1.本发明涉及吡咯并吡啶衍生物化合物用于预防和/或治疗癌症的新用途。
背景技术:
2.表皮生长因子受体(egfr)是一种在表皮细胞表面上表达的跨膜蛋白,并且属于作为细胞周期调节因子的酪氨酸激酶组。
3.当egf或tgf-α与细胞外结构域结合时,egfr被激活并诱导自身磷酸化反应以促进细胞增殖和生长。如果发生影响此类生长因子受体功能或引起受体和配体过表达的基因修饰,则可能诱发癌症。
4.进一步地,egfr是致癌基因erbb或erbb1的蛋白质产物。erbb或erbb1是erbb原癌基因组之一,所述erbb原癌基因组被认为是癌症发生的重要因素。据报告的结果显示,其中在肺癌、头颈癌、乳腺癌、膀胱癌、胃癌等癌症中,egfr表达增加。erbb致癌基因组编码四种结构相关的跨膜受体,即,egfr、her-2/neu(erbb2)、her-3(erbb3)和her-4(erbb4)。
5.为了治疗肺癌、头颈癌、乳腺癌、膀胱癌、胃癌等癌症,已经开发出多种egfr靶向药物,并且代表性药物包含吉非替尼(gefitinib)(英国阿斯利康有限公司(astrazeneca uk ltd.),商标“iressa”)和厄洛替尼(erlotinib)(基因泰克公司(genentech,inc.)和osi制药公司(osi pharmaceuticals,inc.),商标“tarceva”)。吉非替尼和厄洛替尼是喹唑啉化合物,并且通过抑制egfr的酪氨酸激酶活性以抑制磷酸化来抑制细胞生长。
6.尽管这些靶向药物是非常有效的药物,但仍报告了一些问题,如由于患者之间的个体差异而没有显示出可测量的反应,或者在长期使用的情况下对治疗效果表现出抗性。事实上,据报道只有约10%的非小细胞肺癌患者对这些药物表现出反应。因此,正在进行对用于补充egfr靶向药物的问题的伴随疗法的研究,并且虽然可以与egfr伴随使用的各种化合物是已知的,但据报道,所述化合物在伴随使用时也存在如细胞毒性等问题。
7.为了解决靶向抗癌药物的这些局限性,目前正在积极开发癌症免疫治疗药物,所述癌症免疫治疗药物几乎没有不良反应和耐药性问题,并且其中,即使停止施用,免疫细胞也会记住癌细胞并继续攻击癌细胞。癌症免疫治疗药物可以大致分类为免疫检查点抑制剂、免疫细胞治疗剂、治疗性抗体和抗癌疫苗。其中,免疫检查点抑制剂是阻断参与t细胞抑制的免疫检查点蛋白的活性,从而激活t细胞攻击癌细胞的药物。代表性地,这些药物使用识别ctla-4、pd-1和pd-l1的抗体。
8.通过将注意力集中在被报道为作为抑制剂对多种蛋白激酶表现出活性的多种吡咯并吡啶衍生物(韩国专利公开第10-2018,0015142号、第10-2017-0106452号和第10-2017-0058465号)上,本发明人已鉴定出吡咯并吡啶衍生物,当与egfr靶向药物和/或免疫检查点抑制剂伴随使用时,所述吡咯并吡啶衍生物不具有细胞毒性并且可以极大地提高单一药物的抗癌作用,具有将egfr靶向药物和/或免疫检查点抑制剂与吡咯并吡啶衍生物化合物组合的用于预防或治疗癌症的完善药物组合物。
技术实现要素:
9.技术问题
10.本发明的目的是提供一种用于预防和/或治疗癌症的药物组合物,所述药物组合物包括egfr靶向药物和/或免疫检查点抑制剂;以及吡咯并吡啶衍生物化合物、其异构体或其药学上可接受的盐作为活性成分。
11.本发明的另一目的是提供一种用于预防和/或治疗癌症的药物组合物,所述药物组合物包括吡咯并吡啶衍生物化合物、其异构体或其药学上可接受的盐作为活性成分,所述药物组合物用于与egfr靶向药物和/或免疫检查点抑制剂伴随施用。
12.本发明的又另一目的是提供一种用于通过以下来预防和/或治疗癌症的方法:向受试者施用有效剂量的egfr靶向药物和/或免疫检查点抑制剂;以及吡咯并吡啶衍生物化合物、其异构体或其药学上可接受的盐。
13.本发明的又另一目的是提供一种用于预防和/或治疗癌症的试剂盒,所述试剂盒包括egfr靶向药物和/或免疫检查点抑制剂;以及吡咯并吡啶衍生物化合物、其异构体或其药学上可接受的盐。
14.本发明的又另一目的是提供一种化合物、其异构体或其药学上可接受的盐与egfr靶向药物和/或免疫检查点抑制剂伴随使用以用于预防和/或治疗癌症的用途。
15.技术方案
16.本发明提供了一种药物组合物,所述药物组合物包括由化学式1表示的化合物、其异构体或其药学上可接受的盐;以及针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物作为活性成分。
17.[化学式1]
[0018][0019]
(其中在化学式1中,
[0020]
r1是c
1-c3烷氧基;
[0021]
r2和r3各自独立地是氢、直链或支链c
1-c
10
烷基、或c
3-c6环烷基;并且
[0022]
r4是卤代烷基)。
[0023]
本发明提供了一种用于预防和/或治疗癌症的药物组合物,所述药物组合物包括吡咯并吡啶衍生物化合物、其异构体或其药学上可接受的盐作为活性成分,所述药物组合物用于与针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物伴随施用。
[0024]
本发明提供了一种用于通过向受试者施用有效剂量的药物组合物来预防和/或治疗癌症的方法,所述药物组合物包括由化学式1表示的化合物、其异构体或其药学上可接受的盐;以及针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物作为活性成
分。
[0025]
本发明提供了一种用于预防和/或治疗癌症的试剂盒,所述试剂盒包括药物组合物,所述药物组合物包括由化学式1表示的化合物、其异构体或其药学上可接受的盐;以及针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物作为活性成分。
[0026]
本发明提供了一种吡咯并吡啶衍生物化合物、其异构体或其药学上可接受的盐与针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物伴随使用以用于预防和/或治疗癌症的用途。
[0027]
本发明的益处
[0028]
根据本发明的对包含dyrk1a和clk的多种蛋白激酶具有优异的抑制活性并且具有优异的体内稳定性的由化学式1表示的化合物、其异构体或其药学上可接受的盐,当与针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物伴随使用时,显著提高了针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物的治疗效果,并且能够降低癌细胞对此类靶向药物的抗性,从而能够有效地治疗或预防癌症。
附图说明
[0029]
图1示出了伴随使用化合物1和egfr靶向药物(吉非替尼或奥希替尼(osimertinib))处理肺癌细胞系(pc-9和h1975)的肺细胞集落形成抑制效果与用每种物质单独处理的实例的比较结果。
[0030]
图2示出了dyrk1a在非小细胞肺癌细胞系中和在对吉非替尼具有抗性的非小细胞肺癌细胞系中的表达的比较结果。
[0031]
图3示出了对在向具有pc-9肺癌细胞的小鼠模型(balb/c裸小鼠)分别单独施用化合物i和奥希替尼以及伴随施用化合物i和奥希替尼的情况下的实例的抗癌效果的检查结果。
[0032]
图4示出了对在向具有pc-9肺癌细胞的小鼠模型(balb/c裸小鼠)分别单独施用化合物i和吉非替尼以及伴随施用化合物i和吉非替尼的情况下的实例的抗癌效果的检查结果。
[0033]
图5示出了对在向具有nci-h1975肺癌细胞的小鼠模型(balb/c裸小鼠)分别单独施用化合物i和奥希替尼以及伴随施用化合物i和奥希替尼的情况下的实例的抗癌效果的检查结果。
[0034]
图6示出了对当向具有肺癌、结肠癌和乳腺癌的异种移植的小鼠模型单独施用化合物i时的抗癌效果(图6a)以及当化合物1与识别pd-1、pd-l1和ctla-4的抗体伴随施用时对肺癌的抗癌效果(图6b)和结肠癌的抗癌效果(图6c)的检查结果。
[0035]
图7示出了对在用化合物1处理ba/f3 egfr l858r/t790m/c797s、nci-h2228和cal-27细胞系后的egfr表达的测量结果。
[0036]
图8示出了对当向ba/f3 egfr l858r/t790m/c797s细胞伴随施用化合物1和奥希
替尼时的[癌]细胞抑制效果的检查结果。
具体实施方式
[0037]
同时,可以将本发明的实施例修改成各种不同的形式,并且本发明的范围不限于以下描述的实施例。进一步地,提供本发明的实施例是为了向本领域的普通技术人员更全面地解释本发明。进一步地,在整个说明书中,除非有相反的特别说明,否则“包括”某个组成元素并不意味着排除其它组成元素,而是可以进一步包括其它组成元素。
[0038]
在本说明书中,“卤素”可以是f、cl、br或i。
[0039]
在本说明书中,“卤代烷基”可以是具有被如本说明书中所定义的至少一个卤素原子取代的碳原子的直链或支链烷基(烃)。卤代烷基的非限制性实例包含被f、cl、br或i独立地取代的甲基、乙基、丙基、异丙基、异丁基和正丁基。
[0040]
在本说明书中,“烷基”可以指由碳原子构成的直链或支链非环状饱和烃。
–
(c
1-8
烷基)的代表性实例可以包含-甲基、-乙基、-正丙基、-正丁基、-正戊基、-正己基、-正庚基和正辛基;并且支链饱和烷基可以包含-异丙基、-仲丁基、-异丁基、-叔丁基、-异戊基、-2-甲基戊基、3-甲基戊基、4-甲基戊基、2,3-二甲基丁基等。
–
(c
1-8
烷基)可以是经取代的或未经取代的。例如,c
1-8
烷基可以被苯基取代以形成苄基。
[0041]
在本说明书中,“环烷基”可以指非芳香族饱和或不饱和碳环。环烷基的非限制性代表性实例包含环丙基、环丁基、环戊基、环戊二烯基、环己基、环己烯基、1,3-环己二烯基、1,4-环己二烯基、环庚基、1,3-环庚二烯基、1,3,5-环庚三烯基、环辛基和环辛二烯基。环烷基可以是经取代的或未经取代的,在一个实施例中,环烷基可以是c
3-8
环烷基。c7或更高碳数的环烷基可以具有两个或更多个的环结构,并且其具体实例可以是双环烷基。更具体地,双环庚烷可以用于本发明。
[0042]
上述均匀或不均匀取代基中的至少一个可以在相似或不同的位置被取代,并且这些取代基也可以被依次取代。在此,“依次”是指在化学式中一个取代基被取代,接着另一个取代基被依次取代,并且例如,在烷基被取代的情况下,环烷基在烷基处被取代,并且然后环烷基依次被羰基取代,所述化合物可以通过命名化合物羰基环烷基烷基来表示为依次取代。
[0043]
本发明提供了一种药物组合物,所述药物组合物包括由化学式1表示的化合物、其异构体或其药学上可接受的盐;以及针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物作为活性成分。
[0044]
[化学式1]
[0045][0046]
在化学式1中,
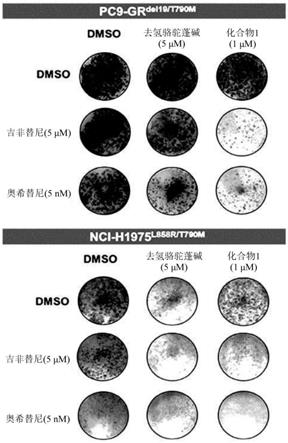
[0047]
r1可以是c
1-c3烷氧基;
412)、纳扎替尼(nazartinib)(egf816)和吡罗替尼(pyrotinib)。其它egfr靶向药物可以是egfr抗体,具体地西妥昔单抗(cetuximab)和帕尼单抗(panitumumab)
[0056]
pd-1靶向药物的实例包含抗pd-1抗体派姆单抗(pembrolizumab)和纳武单抗(nivolumab),并且pd-l1靶向药物的非限制性实例包含阿特珠单抗(atezolizumab)、阿维鲁单抗(avelumab)和度伐利尤单抗(duvalumab)。ctla-4靶向药物的实例可以是抗ctla-4抗体伊匹单抗(ipilimumab)。
[0057]
根据本发明的化合物、其异构体或其药学上可接受的盐可以充当蛋白激酶的抑制剂。
[0058]
蛋白激酶可以是以下中的至少一种:alk、alk(c1156y)、alk(l1196m)、clk1、clk2、clk3、clk4、csnk1d、dyrk1a、dyrk1b、dyrk2、gak、jnk1、lrrk2(g2019s)、ltk、mylk、pak2、phkg1、phkg2、stk33、abl1-非磷酸化、camk2d、camkk2、chek2、csnk1a1、csnk1e、erk5、hunk、insr、jak1(jh2结构域-假激酶)、jnk2、jnk3、lrrk2、mapkapk2、plk4和stk39。
[0059]
进一步地,本发明提供了一种用于预防和/或治疗癌症的药物组合物,所述药物组合物包括吡咯并吡啶衍生物化合物、其异构体或其药学上可接受的盐作为活性成分,并且所述药物组合物的特征在于,所述药物组合物与针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物伴随施用。
[0060]
在癌症的治疗中,根据各种以往治疗方法,伴随或组合药物疗法可能会产生改善的结果,如提高生存率、减轻严重程度、延迟或消除复发,或减少对主要疗法(即,egfr靶向药物)的不良反应。进一步地,在此伴随疗法中,药物的施用剂量可以小于单一药物疗法,和/或药物的施用时间段更短。即,即使在低剂量和/或缩短施用时间段的情况下也可以将治疗效果最大化。
[0061]
在本发明的一个具体实施例中,在将根据本发明的化合物、其异构体或其药学上可接受的盐与针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物伴随施用于多种癌细胞的情况下,据发现,与单独施用针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物相比,癌细胞系的生长在更短的时间内得到了有效抑制,并且还降低了细胞对药物的抗性。
[0062]
在本说明书中,“癌症”可以是例如白血病、淋巴瘤、肉瘤、脑癌、脑肿瘤、良性星形细胞瘤、恶性星形细胞瘤、垂体cyanoma、脑膜瘤、脑淋巴瘤、少突胶质细胞瘤、颅咽管瘤、室管膜瘤、脑干肿瘤、头颈癌、喉癌、口咽癌、鼻腔/pns肿瘤、鼻咽肿瘤、唾液腺肿瘤、下咽癌、甲状腺癌、口腔肿瘤、胸部肿瘤、小细胞肺癌、非小细胞肺癌、胸腺瘤、甲状腺癌、纵隔肿瘤、食管肿瘤、乳腺癌、男性乳腺癌、腹盆腔肿瘤、胃癌、肝癌、胆囊癌、胆道肿瘤、胰腺癌、小肠肿瘤、大肠肿瘤、结肠直肠癌、肛门癌、膀胱癌、肾细胞癌、男性生殖器癌、阴茎癌、前列腺癌、女性生殖器癌、子宫癌、宫颈癌、子宫内膜癌、子宫肉瘤、阴道癌、外阴癌、尿道癌和皮肤癌。在本发明的具体实施例中,癌症可以是肺癌、非小细胞肺癌、胰腺癌和头颈癌。
[0063]
在本发明中,术语“治疗(treatment或therapeutic)”包含遏制、延迟、鉴定、减轻、
削弱、限制、减少、抑制、避免或治愈疾患、病状、残疾、损害或健康问题,或此类状况和/或此类状况的症状的发生或进展。
[0064]
术语“预防”是指避免或减少感染、经历、遭受或患有疾患、病状、残疾、损害或健康问题的风险,或避免或减少此类状况和/或此类状况的症状的发生或进展。
[0065]
疾病、病状、残疾、损害或健康问题的治疗或预防可以是完全的或部分的。
[0066]
通过进一步包括赋形剂、崩解剂、甜味剂、润滑剂和调味剂等,本发明的药物组合物可以使用常规方法调配成片剂、胶囊剂、粉剂、颗粒剂、悬浮剂、乳剂、糖浆剂或其它液体调配物。
[0067]
例如,因为本发明的药物组合物可以全身和/或局部作用,并且可以口服或非口服,即,通过多种途径,如肺部途径施用、鼻内施用、舌下施用、舌施用、颊舌施用、直肠施用、皮肤施用、透皮施用或结膜施用而施用于受试者,所以[药物组合物]可以被调配成适合施用途径的形式。
[0068]
例如,适合口服施用的剂型是包括结晶和/或无定形和/或溶解形式的本发明化合物的调配物,并且可以是例如片剂(包衣或非包衣片剂,例如使用抗胃液、延迟溶解或不溶性包衣)、在口腔中迅速崩解的片剂或薄膜/扁片、薄膜/冻干制剂、胶囊剂(例如,硬或软明胶胶囊)、糖包衣片剂、咀嚼片(例如,软咀嚼片)、颗粒剂、丸剂、粉剂、乳剂、悬浮剂、气雾剂或溶液剂。
[0069]
非口服施用可通过避免吸收阶段(例如,通过静脉内、动脉内、心脏内、鞘内或腰椎内施用)或包含吸收(例如,通过肌内、皮肤、皮内、皮下、经皮或腹膜内途径)来实现。
[0070]
适用于非口服施用的剂型可以包含溶液剂、悬浮剂、乳剂、冻干制剂或注射用灭菌粉剂形式的制剂。
[0071]
进一步地,本发明提供了一种用于预防和/或治疗癌症的试剂盒,所述试剂盒包括药物组合物,所述药物组合物包括由化学式1表示的化合物、其异构体或其药学上可接受的盐;以及针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物作为活性成分。
[0072]
进一步地,本发明提供了一种用于治疗和/或预防癌症的方法,所述方法包括向需要治疗和/或预防癌症的受试者施用药学有效剂量的上述化合物的步骤。
[0073]
在本说明书中,术语“施用”是指使用合适的方法将本发明的药物组合物引入疑似患有炎性疾病的受试者,并且施用可以通过多种途径进行,只要能够到达靶组织即可。在本说明书中,“药学有效剂量”是指足以以适用于医学治疗的合理的收益/风险比治疗疾病的剂量,并且有效剂量的水平可根据包含受试者的类型、疾病的严重程度、年龄、性别、疾病类型、药物活性、药物敏感性、施用持续时间、施用途径和排泄速率、治疗持续时间和伴随使用的药物以及医学领域熟知的其它因素在内的因素决定。本发明的组合物可以作为单一药物或与其它药物伴随施用,并且可以与市售治疗剂依次或同时施用。进一步地,[所述组合物]可以以单剂量或多剂量形式施用。考虑到上述所有因素,重要的是施用能够以最小量达到最大效果且没有副作用的剂量,并且所述剂量可以很容易由phosita决定。本发明的药物组合物的施用剂量可以由专家根据如患者状况、年龄、性别和并发症等多种因素决定。由于本发明的药物组合物的活性成分具有优异的安全性,因此可以在超过规定的施用剂量的情况下使用。
[0074]
进一步地,本发明提供了一种吡咯并吡啶衍生物化合物、其异构体或其药学上可接受的盐与针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物伴随使用以用于预防和/或治疗癌症的用途。具体地,本发明提供了一种由化学式1表示的化合物、其异构体或其药学上可接受的盐与针对egfr(表皮生长因子受体)、pd-1(程序性细胞死亡蛋白1)、pd-l1(程序性死亡配体1)和ctla-4(细胞毒性t淋巴细胞相关蛋白4)中的至少一种的靶向药物伴随使用以用于预防和/或治疗癌症的用途。
[0075]
下面参考实施例和实验实例对本发明进行进一步详细描述。
[0076]
但是,以下实施例和实验实例仅用于例示本发明,并且本发明的范围不限于以下实施例和实验实例。
[0077]
《实施例1》根据本发明的化合物的制备
[0078]
本发明的化合物根据韩国注册专利公报第10-1896568号中所述化合物的制备方法来制备。本发明的化合物(1到5)的化学结构、名称和h1 nmr数据在下表1中示出。
[0079]
[表1]
[0080]
[0081][0082]
《实验实例1》根据本发明的化合物对各种激酶的抑制活性的评估
[0083]
对选自本发明的示例化合物中的化合物1的酶(激酶)选择性和抑制活性的测量委托给了discoverx,并使用scanmaxtm激酶分析面板进行实验。在此,用于处理酶的药物在dmso中的浓度为1μm。对照百分比(对照%)使用以下方法确定,并且结果在表2中示出。
[0084]
[(示例化合物
–
阳性对照)/(阴性对照
–
阳性对照)
×
100]
[0085]
在此,阳性对照是指表现出0%对照百分比的化合物,而阴性对照表示在dmso的情况下100%的对照百分比。进一步地,对于本发明的酶选择性,如果每种酶的对照百分比《41%(即,小于41%),则判断[化合物]对此酶具有活性。
[0086]
[表2]
[0087][0088]
如上表2所示,化合物1表现出对多种蛋白激酶的抑制活性。
[0089]
《实验实例2》在使用本发明的化合物和egfr靶向药物进行的伴随处理的情况下对肺癌细胞集落形成抑制的评估
[0090]
为了评估在使用根据本发明的化合物1和egfr靶向药物进行的伴随处理下对肺癌细胞集落形成的抑制,使用两种肺癌细胞系进行以下实验。
[0091]
具体地,pc-9细胞系购自ecacc(欧洲认证细胞培养物收藏中心(european collection of authenticated cell cultures)),并且使用含10%fbs和1%青霉素链霉素的rpmi-1640。将在缓慢和持续暴露于吉非替尼(由赛力克化学公司(selleckchem)制造)的情况下培养的pc-9gr细胞用1μmol/l吉非替尼进行连续培养。
[0092]
具体地,h1975细胞系购自atcc(美国典型培养物保藏所(american type culture collection)),并且使用含10%fbs和1%青霉素链霉素的rpmi-1640。
[0093]
在用本发明的化合物1、去氢骆驼蓬碱(harmine)、吉非替尼、奥希替尼或其组合处理前的16到24小时,将5000个细胞放置于12孔板的每个孔中。每3天更换一次培养基,区分含有和不含化合物的孔,并从在用化合物处理后10天开始观察孔中的集落形成细胞。剩余的集落形成细胞用甲醇(1%)和甲醛(1%)固定,然后在对每个孔拍摄之前用0.5%结晶紫进行染色。
[0094]
图1示出了所拍摄的照片,并表示了实验化合物伴随处理egfr双突变肺癌细胞的显色抑制效果的评估结果。如图1所示,据发现,与egfr tki吉非替尼或奥希替尼伴随处理时,本发明的化合物1即使与用相应化合物或参考化合物去氢骆驼蓬碱的单一处理相比,也能显著抑制肺癌细胞集落的形成。
[0095]
《实验实例3》非小细胞肺癌细胞系和对egfr靶向药物具有抗性的非小细胞肺癌细胞系中的蛋白激酶表达的比较
[0096]
为了比较dyrk1a在非小细胞肺癌细胞系和具有吉非替尼抗性的非小细胞肺癌细胞系中的表达,进行了蛋白质印迹测试。用添加有蛋白酶抑制剂和磷酸酶抑制剂的1x ripa缓冲液处理细胞,然后恢复,随后在冰中裂解30分钟,并在14000rpm和4℃下离心15分钟。分离上清液,然后使用布拉德福德测定(bradford assay)来对蛋白质进行定量。使用相同量的蛋白质进行蛋白质印迹测试。与相应的第一抗体在4℃下反应16小时,然后与第二抗体反应。使用las500检测结果。
[0097]
结果发现,与pc9人源非小细胞肺癌细胞系(图2)相比,具有吉非替尼抗性的细胞系中dyrk1a/b(y321、273)和akt(s473)的激活程度更高。通过所述结果,可以预期活性增加的蛋白激酶与非小细胞肺癌细胞系对egfr靶向药物(吉非替尼)的抗性相关。
[0098]
《实验实例4》在用根据本发明的化合物和egfr靶向药物进行伴随处理的小鼠模型
institutes for biological sciences,cas))。将细胞保存于含有10%fbs的rpmi-1640中,并于37℃、5%co2湿化细胞培养温育器中进行培养。所有动物实验均按照上海美迪西生物医药有限公司的动物使用和管理指南进行。在无菌条件下,通过皮下施用将2
×
106个pc-9肿瘤细胞(0.1ml,细胞:=1:1)施用于每只动物的右腰部。当肿瘤达到合适的大小(即,250mm3)时,将小鼠随机分组并如下表3所示进行处理。每周两次测量肿瘤大小和动物体重,并且每天记录临床症状。将根据最新的体重对小鼠进行单独施用。使用两个测量值(长度(a)和宽度(b))利用卡尺测量肿瘤。根据肿瘤的两个测得的直径分别计算肿瘤体积,如下所示:肿瘤体积(mm3)=(a
×
b2)/2。
[0107]
[表4]
[0108][0109]
结果发现,如图5所示,与单一施用egfr靶向药物(奥希替尼)的情况相比,[所述药物]与本发明的化合物1伴随使用可显著减少肺癌(nci-h1975)细胞,并且经证实,降低了癌细胞再生长率,从而治疗得以持续。也就是说,虽然在用egfr靶向药物进行单一处理的情况下,在处理期间观察到癌细胞的早期再生,但在用本发明的化合物进行处理的情况下,发现癌细胞的增加以浓度依赖的方式持续受到抑制。这表明本发明的化合物的伴随施用对癌细胞对egfr靶向药物的抗性(耐受性)也有影响。进一步地,虽然用本发明的化合物1进行单一处理未观察到对肺癌细胞的抗癌作用,但观察到与egfr靶向药物的伴随使用显著提高了egfr靶向药物的作用。《实验实例6》在肺癌、结肠癌和乳腺癌异种移植小鼠模型中,对用根据本发明的化合物进行的单一处理和与pd-1、pd-l1和ctla-4抗体进行的伴随处理的抗癌效果的评估
[0110]
在3ll肺癌、mc38结肠癌和emt6乳腺癌异种移植雌性c57bl/6小鼠模型中,评估单一使用化合物1以及将其与pd-1、pd-l1和ctla-4抗体伴随使用的功效。
[0111]
将3ll细胞在hams f10:l15=3:7培养基中培养,将emt-6细胞在waymouth的mb 752/1培养基中培养,并且将mc38细胞在含10%fbs和1%青霉素链霉素的dmem培养基中在37℃下于5%co2湿化细胞培养温育器中培养。
[0112]
小鼠pd-1抗体(be-0146)、pd-l1抗体(be-0101)和ctla-4抗体(be-0131)购自bioxcell。
[0113]
所有动物试验均通过药明康德新药开发股份有限公司(wuxi apptec)进行。在所有动物测试中,化合物1通过qd和bid以45、60、75mg/kg进行处理,如下表5所示,并且用于实现伴随效果的pd-1、pd-l1和ctla-4抗体通过ip和biw以10mg/kg进行处理。
[0114]
在这些结果中,虽然用化合物1进行单一处理具有不显著的肿瘤抑制作用,但观察到与pd-1、pd-l1和ctla-4抗体的伴随作用得到了改善(图6a-6c)。
[0115]
[表5]
[0116][0117]
《实验实例7》证实根据本发明的化合物在egfr突变细胞系和各种癌细胞系中对egfr表达的抑制
[0118]
作为用化合物1处理后检查egfr表达的实验,使用ba/f3 egfr l858r/t790m/c797s、nci-h2228和cal-27细胞系以及蛋白质印迹或磷酸化阵列进行测试。
[0119]
对于ba/f3 egfr l858r/t790m/c797s细胞系,将购自dsmz的ba/f3原初细胞使用阳离子脂质体(lipofectamine)用egfr l858r/t790m/c797s血浆dna转染,并使用利用1μg/ml嘌呤霉素选择2周的细胞系。在此,所使用的培养基是含有10%fbs和1%青霉素链霉素的rpmi-1640。nci-h2228和cal-27细胞系购自atcc,并且对于培养,含有10%fbs和1%青霉素链霉素的rpmi-1640用于nci-h2228,而对于cal-27,使用含有10%fbs和1%青霉素链霉素的dmem。
[0120]
添加化合物1到最终浓度为0.5、1.2和5μm,然后培养4或24小时。根据需要,用30μg/ml浓度的环己酰亚胺(cyclohexamine)进行培养1小时,然后以100ng/ml的浓度进行egf
处理15分钟。对于磷酸阵列实验,将dyrk1a sirna以30nm的浓度与hek293t细胞反应48小时,证实了在细胞中对dyrk1a表达的抑制。这些被用作主要实验的对照。将cal-27细胞用30nm dyrk1a sirna和2μm化合物1处理48小时,然后从细胞中提取蛋白质进行实验。
[0121]
在结果中,如图7所示,在ba/f3 egfr l858r/t790m/c797s、nci-h2228和cal-27细胞中证实了在用化合物1进行处理的情况下降低了egfr表达,并且p-akt(s473)和p-erk 1/2(t202/y204)的降低在nci-h2228细胞中得到了证实。在cal-27细胞中也证实了sidyrk1a和p-egfr(y-1086)的表达降低。
[0122]
《实验实例8》根据本发明的化合物和egfr靶向药物伴随使用对egfr突变细胞系的效果
[0123]
为了证实化合物1和奥希替尼的伴随使用对ba/f3 egfr l858r/t790m/c797s细胞的效果,在样品处理前的16到24小时,将细胞在96孔板中培养到大约2000个细胞。在此,作为化合物1的对照,使用了被称为dyrk1a抑制剂的去氢骆驼蓬碱。使用连续稀释的化合物处理细胞72小时。使用celltiterglo测量化合物的细胞活性抑制结果。
[0124]
在结果中,如图8所示,与用相同量的去氢骆驼蓬碱进行的处理相比,用化合物1进行的处理表现出改善的细胞生长抑制效果。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。