1.本技术大体上涉及植入式医疗装置,并且更具体地涉及利用具有压电尖端的植入式导管的系统和方法,用于增加药物分散到患者的脑脊液中。
背景技术:
2.植入式医疗装置,如植入式进入端口或医疗泵,适用于处方治疗剂、营养物、药物、药剂如抗生素、凝血剂、镇痛剂和其它流体和/或流体类物质(统称为“药剂”或“输注液”)以体积和时间控制的剂量向患者递送和分配。这类植入式装置特别适用于治疗需要定期或慢性(即长期)药理学干预的疾病和病症,包括震颤、痉挛、多发性硬化、阿尔茨海默病(alzheimer's disease)、帕金森病(parkinson's disease)、肌萎缩侧索硬化症(als)、亨廷顿病(huntington's disease)、癌症、癫痫、慢性疼痛、尿失禁或大便失禁、性功能障碍、肥胖和胃轻瘫,仅举几例。根据其特定设计和预期用途,植入式装置非常适合将输液给药到中枢神经系统内的特定区域,包括蛛网膜下、硬膜外、鞘内和颅内空间。
3.输注液直接给药到患者脑脊液中具有优于其它形式的药剂给药的多个重要优点。举例来说,口服给药通常是不可行的,因为在目标部位达到治疗剂量所需的物质的系统剂量可能太大,以至于患者无法忍受而没有不良副作用。此外,一些物质根本无法在肠道中充分吸收,以至于无法使治疗剂量到达目标部位。此外,如果大脑需要,非脂溶性物质可能无法充分穿过血脑屏障。此外,从体外输注物质需要经皮导管,这会导致其它风险,如感染或导管移位。
4.通常,这类植入式医疗装置包括与植入式进入端口或植入式泵流体连通的植入式导管。植入式进入端口通常向颅侧放置或放置在肋骨上方,并连接到导管,所述导管以手术方式放置在大脑的脑室内空间或脊髓的脊椎内区域。当期望给药药剂时,针穿过患者的皮肤,穿过与导管流体连接的端口的隔膜插入。然后将药剂注射到端口中,穿过导管的端口并进入患者的脑脊液中。
5.植入式泵通常被植入患者体内的某个位置(通常是下腹部的皮下区域),并连接到导管,所述导管被配置成将药剂递送到患者体内的选定递送部位。这类植入式医疗泵通常包括可扩展的流体贮存器,所述流体贮存器可通过进入端口进入以进行再填充等。根据编程参数,药剂从贮存器通过导管流入患者的脑脊液。
6.导管通常被配置为具有腔的柔性管,所述腔沿导管的长度延伸到身体中选定的递送部位,如蛛网膜下腔。离开导管腔的药物分子流入蛛网膜下腔,并开始与脑脊液混合。通常,药物缓慢地离开导管(例如,以每小时1ml或更少的流速),其中药物倾向于停滞在紧邻导管周围的缓慢移动的脑脊液中。这种缓慢移动的流体被受过流体力学科学教育的人称为边界层,这是粘性流体和表面(即导管)之间摩擦的结果。药物与脑脊液的缓慢或延迟混合可降低药物的功效和由此产生的治疗效果。尽管已经进行了各种尝试来改善药剂在脑脊液中的分散,但是希望进一步提高药物递送到患者脑脊液中的效率。本公开的申请人已经开发了一种系统和方法来解决此问题。
技术实现要素:
7.本公开的技术大体上涉及植入式系统和方法,所述系统和方法通过使用具有压电元件的植入式导管改善患者脑脊液流内的药剂分散,所述压电元件被配置成在药剂给药期间选择性地振荡以在植入式导管周围的脑脊液和药剂中赋予流体运动,以促进药剂分散在紧邻植入式导管周围的边界层内较慢移动的脑脊液流周围。因此,本公开的实施例通过药剂与脑脊液的主动混合来促进更快速的分散来优化当前的治疗技术。尽管本公开的应用可用于递送任何类型的药剂,但据相信,本公开在靶向特定蛋白质或病毒作为特别疾病或病症的根本原因方面可能特别有用,而不仅仅是解决不良症状。
8.本公开的一个实施例提供了一种被配置成改善药剂分散的医疗装置。医疗装置可包括植入式导管,所述植入式导管具有被配置成定位在患者的脑脊液流内的远侧末端、近侧末端和限定沿植入式导管纵向延伸的腔的主体,所述腔被配置成使得药剂能够从近侧末端流动到靠近远侧末端的输注端口,植入式导管进一步包括被定位成靠近输注端口的压电元件,所述压电元件被配置成在药剂给药期间选择性地振荡以改善药剂在脑脊液内的分散。
9.在一个实施例中,压电元件可包括振荡表面,所述振荡表面被配置成在药剂的给药期间将流体运动赋予植入式导管周围的脑脊液和药剂。在一个实施例中,压电元件被配置成促进药剂在紧邻植入式导管周围的边界层内的脑脊液的较慢移动流外分散。在一个实施例中,压电元件被配置成在与药剂的给药相关的预定时间段内振荡。在一个实施例中,预定时间段在约15秒和约30秒之间的范围内。
10.在一个实施例中,医疗装置进一步包括一个或多个生理传感器,所述生理传感器被配置成监测患者的一种或多种生理状况以对压电元件的振荡进行定时以对应于增强的脑脊液振荡的推断。在一个实施例中,一个或多个生理传感器被配置成监测患者的心率或呼吸频率中的至少一种。
11.在一个实施例中,植入式导管的近侧末端可操作地联接到被配置成皮下接收药剂的植入式端口。在一个实施例中,医疗装置进一步包含针检测传感器,所述针检测传感器被配置成检测针插入到植入式端口中以对压电元件的振荡进行定时。在一个实施例中,植入式导管的近侧末端可操作地联接到具有药剂贮存器的植入式泵。在一个实施例中,医疗装置进一步包含药剂流量传感器,所述药剂流量传感器被配置成检测药剂流量以对压电元件的振荡进行定时。
12.在一个实施例中,医疗装置进一步包括被配置成为压电元件供电的植入式电源。在一个实施例中,植入式电源被配置成通过患者的皮肤进行感应充电。在一个实施例中,植入式电源被定位成靠近植入式导管的近侧末端。在一个实施例中,植入式导管包括将植入式电源电联接到压电元件的一个或多个电气管道。在一个实施例中,植入式导管的主体限定一个或多个电气管道腔,所述电气管道腔沿植入式导管纵向延伸,所述电气管道腔被配置成容纳一个或多个电气管道。
13.本公开的另一个实施例提供一种医疗装置,所述医疗装置被配置成改善药剂在患者的脑脊液流内的分散。医疗装置可包括植入式导管和端口。植入式导管可具有:被配置成定位在脑脊液流内的远侧末端;近侧末端;和限定腔的主体,所述腔被配置成使得药剂能够流入被定位成靠近远侧末端的输注端口;和被定位成靠近输注端口的压电元件。植入式端
口可与植入式导管流体连通并且可被配置成从药剂源接收药剂。压电元件可包括振荡表面,所述振荡表面被配置成在植入式导管周围的脑脊液和药剂中赋予流体运动,以促进药剂在紧邻植入式导管周围的边界层内的脑脊液的较慢移动流外分散。
14.本公开的另一个实施例提供一种改善药剂分散的方法,所述方法包括:经由植入式导管将药剂给药到患者的脑脊液流中,所述植入式导管具有:被配置成定位在脑脊液流内的远侧末端;近侧末端;限定腔的主体,所述腔被配置成使得药剂能够流动到被定位成靠近远侧末端的输注端口;和被定位成靠近输注端口的压电元件;和选择性地振荡压电元件的表面,以在植入式导管周围的脑脊液和药剂中赋予流体运动,以促进药剂在紧邻植入式导管周围的边界层内的脑脊液的较慢移动流外分散。
15.应理解,本文传授内容的方法中所使用的个别步骤可以按任何次序执行和/或同时执行,只要传授内容可行。此外,应理解,本文传授内容的设备和方法可包括任何数目或全部的所描述实施例,只要传授内容可行。
16.在下文的附图和描述中阐述本公开的一个或多个方面的细节。本公开中所描述的技术的其它特征、目标和优点将从描述且从权利要求书而显而易见。
附图说明
17.结合附图来考虑本公开的各种实施例的以下详细说明能够更充分地理解本公开,在附图中:
18.图1a描绘根据本公开的实施例的被配置成改善药剂分散的医疗装置,所述医疗装置具有插入到患者大脑的颅内空间中的导管。
19.图1b描绘根据本公开的实施例的被配置成改善药剂分散的医疗装置,所述医疗装置具有插入到患者脊柱的鞘内空间中的导管。
20.图2为描绘根据本公开的实施例的包括导管和植入式端口的医疗装置的透视图。
21.图3为描绘图2的医疗装置的局部横截面视图。
22.图4描绘图3的医疗装置的导管的局部横截面视图。
23.图5a为描绘根据本公开的实施例的插入到患者的蛛网膜下腔中的导管的透视图。
24.图5b描绘在以每小时1ml的速率开始从图5a的导管输注约7.5秒之后药剂在患者的脑脊液内的分散。
25.图5c描绘在以每小时1ml的速率开始从图5a的导管输注约15秒之后药剂在患者的脑脊液内的分散。
26.图6a为描绘根据本公开的实施例的具有插入到患者的蛛网膜下腔中的激活的压电元件的导管的透视图。
27.图6b描绘在以每小时1ml的速率开始从图5a的导管输注约7.5秒之后药剂在患者的脑脊液内的分散。
28.图6c描绘在以每小时1ml的速率开始从图6a的导管输注约15秒之后药剂在患者的脑脊液内的分散。
29.图7为描绘根据本公开的实施例的包括导管和植入式泵的医疗装置的透视分解视图。
30.图8描绘图7的医疗装置的框图。
31.图9描绘根据本公开的实施例可操作地联接到一个或多个外部组件的医疗装置。
32.图10a为描绘根据本公开的实施例的具有弯曲板的导管的局部透视图。
33.图10b为描绘图10a的导管的局部横截面视图。
34.图10c为描绘插入到患者的蛛网膜下腔中的图10a的导管的透视图。
35.虽然本公开的实施例容许各种修改和替代形式,但将详细描述借助于实例在图式中示出的其细节。然而,应理解并不希望将本公开限制于所描述的特定实施例。相反,意图在于涵盖落入如权利要求书所限定的本主题的精神和范围内的所有修改、等效物和替代方案。
具体实施方式
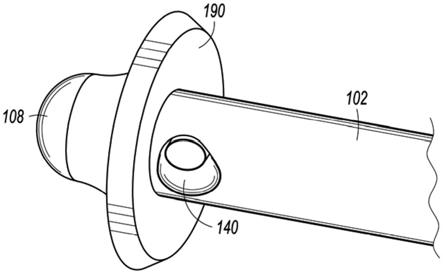
36.参考图1a和1b,描绘了根据本公开的实施例的被配置成改善药剂分散的医疗装置100。医疗装置100可包括植入式导管102,在一些实施例中,其可与植入式端口104(如图1a-b所描绘)或植入式泵106(如图7所描绘)流体连通。如所描绘,医疗装置100可被植入患者的身体b内。在一些实施例中,植入式导管102的远侧尖端108可任选地以手术方式植入患者大脑中的脑室v中(如图1a所描绘)或患者的椎管内空间(如图1b所描绘)。植入式端口104或植入式泵106可向颅侧放置(如图1a中所描绘),或放置在驱干腔内部或靠近患者的肋骨(如图1b中所描绘)。在任一情况下,植入式端口104或植入式泵106通常皮下放置,并且可为通过缝合线或其它固持特征保持在适当位置。
37.另外参考图2和3,描绘了包括可操作地联接到植入式端口104的植入式导管102的医疗装置100的实施例。具体地说,图2描绘了医疗装置100的透视图,而图3描绘了医疗装置100的横截面示意图。植入式端口104可包括大体上圆顶形上壳体110和盘形下壳体112。上和下壳体110、112可由如钛的身体耐受性材料或如硅橡胶的身体相容性塑料构成,并且围绕它们的周边彼此密封。
38.上壳体110可包括居中定位的第一隔膜114。第一隔膜114可限定第一腔室116的上边界。腔室壁118,在一些实施例中大体上为圆柱形,可限定第一腔室116的壁。腔室壁118可由刚性材料,如生物相容性聚合物或钛制成。针筛120可被定位成与第一隔膜114的相对以限定第一腔室116的下边界。在一些实施例中,针筛120可阻止直径大于给定直径的针从其中穿过,同时允许直径小于给定直径的针从其中穿过。在一个实施例中,针筛120为由金属丝构成的网筛,其被配置成使得25号或更小的针能够通过,同时阻止直径大于25号的针通过。
39.第二隔膜122可被定位成紧邻针筛120并且在其下方。第二隔膜122可限定第二腔室124的上边界。在一个实施例中,第一隔膜114和第二隔膜122可由如自密封硅橡胶的弹性柔韧材料构成。腔室壁118可限定第二腔室124的壁。针止动件126可被定位成与第二隔膜122相对以限定第二腔室124的下边界。针止动件126可被配置成阻止针完全穿过第二腔室124。在一个实施例中,针止动件126可以由刚性的生物相容性聚合物材料构成。在一些实施例中,针止动件124搁置在下壳体112上。
40.在一个实施例中,可通过在植入式端口104的导管连接器130上滑动导管102的近侧末端128将植入式导管102连接到植入式端口104。导管连接器130可经由导管132与第二腔室124流体连通。因此,一定量的药剂可从患者体外的注射器穿过植入式端口104到导管
102的远侧末端108。具体地说,为了给药药剂,填充有药剂的注射器的针可穿过患者的皮肤、第一隔膜114、针筛120和第二隔膜122以进入第二腔室124。在药剂从注射器中排出时,药剂填充第二腔室124,穿过导管132并进入通常在导管102的主体138内在近侧末端128和靠近远侧末端108的输注端口140之间纵向延伸的腔136。在一些实施例中,输注端口140可被定位在导管102的远侧末端或尖端108上。替代地,如所描绘,输注端口140可被定位成沿导管102的主体138靠近远侧尖端108。
41.图5a描绘被定位在患者的蛛网膜下腔内的导管102。具体地说,导管102在插入部位i处进入蛛网膜下腔,并且基本上平行于患者脊柱s的纵向轴线a延伸,由此使得能够通过导管102的输注端口140鞘内递送药剂。图5b和5c描绘在药剂200离开输注端口140并流入蛛网膜下腔时的导管102。具体来说,图5b描绘了在开始输注约7.5秒后药剂200的分散,而图5c描绘了在开始输注约15秒后药剂200的分散。
42.在药剂200离开输注端口140并流入蛛网膜下腔时,药剂200开始与脑脊液混合。在药剂200以相对缓慢的速率(例如,每小时1ml的流速)从输注端口140排出的情况下,药剂200通常停滞在紧邻导管102周围的缓慢移动的脑脊髓液中。尽管脑脊液的脉动流最终使药剂200从导管102漂移到更快移动的脑脊液中,但是将药剂200适当地混合到脑脊液中可能需要几分钟。药剂200与脑脊液的缓慢或延迟混合可降低药剂200的功效以及由此产生的治疗效果。
43.继续参考图2和3,为了促进药剂200在紧邻植入式导管周围的边界层内的脑脊液的较慢移动流外更快地分散,本公开的实施例可包括被定位在植入式导管102上的压电元件142。在一些实施例中,压电元件142可被定位在靠近导管102的远侧末端108的输注140附近,并且可包括振荡表面144,所述振荡表面144被配置成通过被称为“稳定流媒体”的现象在药剂的给药期间在植入式导管102周围的脑脊液和药剂中赋予流体运动。
44.在一些实施例中,压电元件142可由电源146供电,所述电源146可并入植入式端口104或可操作地联接到植入式导管102的其它植入式装置,如植入式泵106(如在图7中描绘)。在其它实施例中,电源146通常可靠近植入式导管102的近侧末端皮下、经皮、外皮或皮上定位。在一些实施例中,电源146被配置成经由感应线圈148通过患者的皮肤无线充电。
45.一个或多个沿植入式导管平行于腔136纵向延伸的电气管道150可将压电元件142电联接到电源146。另外参考图4,在一个实施例中,植入式导管102的主体138可进一步限定一个或多个电气管道腔152a/b,一个或多个电气管道150a/b可穿越所述电气管道腔152a/b。因此,在一些实施例中,植入式导管102可具有三腔配置,包括药剂穿过的第一腔136,和被配置成容纳压电元件电缆或电线150a/b的第二和第三腔152a/b。
46.图6a描绘了具有被定位在患者蛛网膜下腔内的压电元件142的导管102,所述压电元件142被配置成在药剂给药期间选择性地振荡。具体地说,导管102在插入部位i处进入蛛网膜下腔,并且基本上平行于患者脊柱s的纵向轴线a延伸,由此使得能够通过导管102的输注端口140鞘内递送药剂。图6b和6c描绘在药剂200离开输注端口140并流入蛛网膜下腔时的导管102。具体来说,图6b描绘了在开始输注约7.5秒后药剂200的分散,而图6c描绘了在开始输注约15秒后药剂200的分散。
47.可使用流体动力学建模方法,如有限体积、有限元或有限差分技术找到偏微分方程系统的近似解来模拟经由导管102递送到蛛网膜下腔(和人体内的其它区域)的药剂200
的分散。在鞘内递送的情况下,对质量和动量守恒进行建模的偏微分方程系统,也称为navier-strokes方程,可模拟脑脊液流动。更准确地说,在体温下性质类似于水的不可压缩流体的层流、振荡流动方程可用于模拟药剂200递送情形。可使用包括欧拉被动定标器方法或拉格朗日粒子方法的各种技术对药剂200分散进行进一步建模。
48.图5a-c和图6a-c表示在理想化的鞘内空间几何形状中的药剂200分散云的相应体积的预测,其中脑脊液根据频率为1hz并且振幅为3ml/s的正弦函数振荡。对于标称导管100(如图5a-c中所描绘),在以1ml/h开始团注输注后30秒的时间,所输注的药剂可占据约25mm3的体积。相比之下,对于其中导管102包括压电元件142的实施例,所述压电元件142被配置成在药剂给药期间振荡以改善药剂200在脑脊液内的分散(如图6a-c中所描绘),其中所有其它模型参数保持不变,输注的药剂200可占据约500mm3的体积。因此,可以看出,如上文所描述,压电元件142可具有使分散的药剂200的体积比没有压电元件的导管增加约二十倍的效果。
49.因此,在一些实施例中,压电元件142被配置成在与药剂200的给药相关的预定时间段内振荡。举例来说,在一个实施例中,压电元件142被配置成在药剂200流动通过腔136并进入脑脊液的整个时间期间以及此后的短时间内振荡,由此使得药剂200能够在紧邻植入式导管102周围的边界层内的脑脊液的较慢移动流外分散。在一些实施例中,压电元件142可被配置成振荡约15秒到约30秒之间的时间;尽管也考虑其它时间段。举例来说,在一些实施例中,团注递送可长于30秒的时间段,并且脑脊液中药剂200的存在可在输注后持续数小时。在此时间期间,压电元件142可连续振荡,或循环打开和关闭以促进混合,同时保持电源146的电池寿命。压电元件142可被配置成在约20khz和约60khz之间的频率范围内振荡;例如,在一个实施例中,压电元件142可被配置成以约41khz振荡。
50.在一些实施例中,压电元件142的振荡可被定时以对应于将针插入到植入式端口104中,由此推断药剂的给药。举例来说,在一些实施例中,植入式端口104可包括针检测传感器154。在一些实施例中,针检测传感器154可为机械开关、声传感器、光学或光电传感器、超声波传感器、压力传感器、电容性传感器、霍尔效应传感器,仅列举一些。针检测传感器154可在检测到针进入第一或第二腔室116/124时向处理器156发送信号。此后,处理器156可激活压电元件142以促进药剂200与脑脊液的混合。在一些实施例中,压电元件142可在针被针检测传感器154检测到的整个时间期间,和任选地在针检测传感器154检测到针移除之后的预定时间被激活。
51.在一些实施例中,压电元件142的振荡可被定时以对应于检测到的药剂200的流动。举例来说,在一些实施例中,植入式端口104和/或导管102可包括被配置成检测药剂流量的流量传感器158。在一些实施例中,流量传感器158可为压力传感器、可变电阻器、应变仪、电感线圈、霍尔效应传感器、谐振电路、电容性传感器、基于声波的传感器、基于光的传感器或被配置成测量相关泵的能量需求的传感器,仅列举一些。流量传感器158可在检测到药剂流动时向处理器156发送信号。此后,处理器156可激活压电元件142以促进药剂与脑脊液的混合。在一些实施例中,压电元件142可在流量传感器158检测到药剂流动的整个时间期间,和任选地在流量传感器158停止检测到药剂流动之后的预定时间被激活。
52.作为植入式端口104的替代方案,在一些实施例中,导管102可以可操作地联接到植入式泵106。参考图7,根据本公开的实施例描绘了包括植入式医疗泵106的医疗装置100。
图7描绘了植入式医疗泵106的分解透视图。图8为植入式医疗泵106的框图。
53.植入式医疗泵106可大体上包括壳体160、电源162、药剂贮存器164、药剂泵166和电子装置168。壳体160可由生物相容且气密密封的材料构成,如钛、钽、不锈钢、塑料、陶瓷等。电源162可为电池,如锂离子电池。电源162可携带在壳体160中,并且可被选择来操作药剂泵166和其它电子装置168,包括导管102的压电元件142。
54.药剂贮存器164可由壳体160承载并且可被配置成含有药剂。在一个实施例中,药剂贮存器164内的药剂可经由进入端口170进入。因此,进入端口170可用于再填充、清空或更换药剂贮存器164内的流体。
55.药剂泵166可由壳体160承载。药剂泵166可与药剂贮存器164流体连通并且可与电子装置168电连通。药剂泵166为足以向患者输注药剂的泵,如活塞泵、蠕动泵、由步进马达驱动的泵、由ac马达驱动的泵、由dc马达驱动的泵、静电膜片、压电马达、螺线管、形状记忆合金等。
56.电子装置168被承载在壳体中,并且可与电源162、药剂泵166和任选地植入式导管102的压电元件142电连通。在一个实施例中,电子装置168可包括处理器172、存储器174、176和收发器电路系统178。在一个实施例中,处理器172可为专用集成电路(asic)状态机、门阵列、控制器等。电子装置168通常可被配置成根据编程参数或指定的治疗方案控制药剂的输注。编程的参数为指定的治疗方案,可存储在存储器174中。收发器电路系统178可被配置成从任选的外部传感器和任选的外部编程器接收信息并将信息传送到所述任选的外部传感器和任选的外部编程器。在一个实施例中,电子装置168可进一步被配置成操作许多其它特征,如患者警报180。
57.在一个实施例中,电子装置168可另外被配置成包括一个或多个传感器182或与其通信,所述传感器182被配置成充当触发机构,用于压电元件142的激活和定时。一个或多个传感器182的实例包括针检测传感器154、流量检测传感器158或生理传感器,其可被配置成与处理器172通信以选择性地激活压电元件142以促进药剂与脑脊液的混合。
58.作为植入式端口104或植入式泵106的替代方案,在又另一个实施例中,导管102可为透皮或经皮导管,被配置成插入穿过患者皮肤并进入患者的蛛网膜下腔、硬膜外、鞘内或颅内空间用于递送药剂,使得导管102的近侧末端128定位在患者身体外部,并且包括输注端口140和压电元件142的远侧末端108定位在患者内部。这类经皮实施例可特别适于临时或一次性使用的应用。
59.在一些实施例中,医疗系统100可包括患者内部和外部的多个组件。举例来说,如图9所描绘,医疗系统100可包括植入式导管102、端口104、一个或多个生理传感器184(如图2中所描绘的嵌入式传感器184,或如图9中所描绘的外部传感器184a和184b),以及任选的服务器186和任选的外部编程器188。
60.生理传感器184可为被配置成监测影响脑脊液循环的一种或多种生理状况的任何传感器。生理传感器184的实例包括心率监测器、脉搏血氧计、呼吸传感器、出汗传感器、姿势定向传感器、运动传感器、加速度计等。在一些实施例中,患者活动的增加(如通过心率、呼吸频率等的增加测量)可推断脑脊液振荡频率的增加,这又可改善药剂与脑脊液的混合。
61.在一个实施例中,一个或多个生理传感器184可并入到端口104或泵106中。在一个实施例中,生理传感器184可由患者佩戴(例如,智能手表、腕带跟踪器、嵌入服装中的传感
器等),由患者携带(例如,智能电话、移动计算装置等),或靠近患者定位(例如,固定监视器等)。在一个实施例中,外部编程器188可包括一个或多个生理传感器184。来自一个或多个生理传感器184的数据可用于确定患者增加的活动率,这可推断脑脊液振荡频率的增加。在一些实施例中,由一个或多个传感器184感测的状况可传送到处理器156、172,其继而可发送信号以选择性地激活压电元件142。
62.在一些实施例中,生理传感器184可被配置成连续监测患者的一种或多种状况。在其它实施例中,生理传感器184限于在要给药指定量的药剂的一个或多个时间段内感测患者状况。由一个或多个生理传感器184收集的数据可用于建立患者特定的基线或阈值;例如,静息状态基线(例如,小于70bpm)和活动状态阈值(例如,大于90bpm)。在一个实施例中,静息状态基线或活动状态阈值可用作触发器来激活压电元件142。在一个实施例中,可利用一个或多个基线或阈值来激活压电元件142;例如,可在一天中的不同时间建立不同的基线或阈值。在一个实施例中,压电元件142的激活可基于活动的变化率来触发(例如,使用感测的或测量的患者生理状况的导数)。在一个实施例中,一个或多个建立基线或阈值可用作初始默认值,并且可由临床医生或患者经由外部编程器188手动调整。例如,在一个实施例中,患者可输入活动时间表信息(例如,锻炼时间等)并相应地调整基线或阈值。
63.图2、3和7描绘了一种医疗装置100,其中压电元件142被定位成靠近输注端口140。还考虑了压电元件142相对于输注端口140的其它配置和放置。举例来说,压电元件142可被定位在输注端口140的远侧、导管102的远侧末端108上,或邻近输注端口140或在其周围。在一些实施例中,可沿导管102的区段利用多个压电元件142。
64.通常,压电元件142可包括被配置成在施加电势(例如,电源146、162)时改变尺寸的基本单元。在一些实施例中,压电元件142可包括薄压电陶瓷层的堆叠,其被配置成在施加电压时延伸。在一些实施例中,压电元件142可并入到双晶片或其它形式的弯曲板190中。
65.图10a-c描绘了包括弯曲板190的导管102的实例实施例。如所描绘,弯曲板190可包括与不同材料的第二层192接触的第一压电元件层142。向压电元件层142施加电势可使弯曲板190快速振荡。根据横截面视图(如图10b所描绘),弯曲板190可被视为在邻近输注端口140侧向弯曲。如图10c中所描绘,利用并入压电元件层142的弯曲板190可进一步增强药剂在药剂给药期间在脑脊液内的快速分散。
66.应理解,本文所公开的各个方面可以不同的组合而非说明书和附图中具体呈现的组合进行组合。还应理解,依据示例,本文所描述的过程或方法中的任一个的某些动作或事件可以以不同顺序执行,可以被添加、合并或完全省略(例如,所有描述的动作或事件对于执行技术可能不是必需的)。另外,尽管出于清楚的目的,将本公开的某些方面描述为由单个模块或单元来执行,但应理解,本公开的技术可以通过与,例如,医疗装置相关联的单元或模块的组合来执行。
67.在一个或多个实例中,所描述的技术可以在硬件、软件、固件或其任何组合中实施。如果以软件实施,则可以将功能以一个或多个指令或代码的形式存储在计算机可读介质上并且可以由基于硬件的处理单元执行。计算机可读介质可以包括非暂时性计算机可读介质,其对应于有形介质,诸如,数据存储介质(例如,ram、rom、eeprom、闪存或可以用于存储呈指令或数据结构形式的期望程序代码并且可以由计算机访问的任何其它介质)。
68.指令可以由一个或多个处理器执行,诸如,一个或多个数字信号处理器(dsp)、通
用微处理器、专用集成电路(asic)、现场可编程逻辑阵列(fpga)或其它等效的集成或离散逻辑电路系统。因此,如本文中所使用的术语“处理器”可以指任何前述结构或适合于实施所描述技术的任何其他物理结构。而且,所述技术可完全实施于一个或多个电路或逻辑元件中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
