功能性c1酯酶抑制剂(fc1-inh)的定量方法
1.相关申请
2.本技术要求2019年4月16日提交的美国临时申请号62/834,461和2019年11月7日提交的美国临时申请号62/932,011根据35 u.s.c.
§
119(e)的权益;每篇的全部内容通过引用并入本文。
背景技术:
3.遗传性血管性水肿(hae)是一种罕见的常染色体显性遗传疾病,其由血浆蛋白c1酯酶抑制剂(简称c1抑制剂,c1-inh)的遗传缺陷或功能障碍引起。hae的特征是血管性水肿的反复发作,通常涉及面部、皮肤、肠道和/或气道。这些症状可出现在其他疾病中,这使得hae的诊断变得复杂。hae可以主要分为两种类型。i型的特征在于c1-inh蛋白水平低,占hae发生率的85%,而ii型的特征在于功能性c1-inh(fc1-inh)低但c1-inh蛋白水平正常或升高,占约15%。在未治疗的i型和ii型患者中,典型的fc1-inh,当以单位/ml测量时是正常水平的5-30%。
4.目前可用于测量fc1-inh的测定是基于血浆的测定。常用的试验是生色测定,它使用合成的c1-酯酶特异性底物间接测量测试样品中c1-inh对c1-酯酶活性的抑制。另一种常用的测定是elisa测定,其测量c1-inh与补体蛋白组分c1s的功能性结合。然而,样品运送到集中测试实验室并储存在集中测试实验室通常不方便进行基于血浆的试验。
5.开发一种可以在中心实验室运行以测量生物样品中fc1-inh的简单且用户友好的方法是受到极大关注的。
技术实现要素:
6.本公开至少部分基于简单、灵敏和选择性测定的开发,其涉及使用含有功能性血浆c1-酯酶抑制剂(fc1-inh)的干血斑进行分析,通过例如,经由液相色谱-质谱法(lc-ms)测量源自c1-酯酶酶促反应的底物产物(c1s底物产物)。
7.因此,本公开的一个方面提供了一种用于确定干血液样品中fcl-inh水平的方法,该方法包括:(i)将来自受试者的血液样品点样在支撑构件上;(ii)在支撑构件上干燥血液样品以形成干血斑;(iii)从(ii)的干血斑中提取蛋白质;(iv)测量(iii)中提取的蛋白质中fc1-inh的水平(如果存在)。这种测量可以针对校准曲线进行或与校准曲线比较。在一些示例中,校准曲线可以通过用不含c1-inh的缓冲液或其他适当的组分对来自正常受试者的全血进行连续稀释来制备。
8.在一些示例中,干燥血斑的步骤(ii)可以在室温下进行3小时。在一些示例中,支撑构件是滤纸。可选地或另外地,从干血斑中提取蛋白质的步骤(iii)可以通过将干血斑与牛血清白蛋白(bsa)/pbs缓冲液孵育至少3小时来进行。
9.在本文公开的任何方法中,测量fc1-inh水平的步骤(iv)可以包括(a)将提取的蛋白质与补体组分1s(c1s)和c1s底物一起孵育以产生反应混合物;(b)测量步骤(a)中产生的c1s底物产物的水平;(c)基于步骤(b)中测量的c1s底物产物的水平,确定干血斑中fc1-inh
的水平。在一些示例中,c1底物产物可通过液相色谱-质谱(lc-ms)或液相色谱-串联质谱(lc-ms/ms)测量。
10.在一些实施方式中,将提取的蛋白质与补体组分1s(c1s)和c1s底物一起孵育的步骤(a)可以通过以下进行:将提取的蛋白质与c1s一起孵育以产生反应混合物,然后将反应混合物与c1s底物一起孵育以产生c1s底物产物。在一些情况下,c1s底物产物的水平可以通过液相色谱-质谱法测量。示例性的c1s底物包括但不限于n
α-苯甲氧甲酰基-lys-硫苄酯,其产生c1s产物n
α-苄氧羰基-l-赖氨酸(cbz-lys)。
11.本文所述的任何方法还可包括从受试者(例如人类受试者)获得血液样品(例如,全血样品)。在一些实施方式中,人类受试者可以是患有或怀疑患有c1-inh缺陷介导的病症例如遗传性血管性水肿(hae),例如i型hae或ii型hae的人类患者。
12.本文所述的方法还可包括确定受试者是否患有hae。与对照相比,fc1-inh水平降低(与c1s底物产物水平提高相关)表明受试者患有血浆激肽释放酶(pkal)和/或c1-inh缺乏介导的病症,例如本文公开的hae。本文所述的任何方法可进一步包括(a)基于功能性c1-inh的水平鉴定对受试者的适当治疗;(b)根据通过本文公开的方法确定的fcl-inh水平,将受试者鉴定为治疗疾病的候选者;或两者。
13.本文所述的任何方法还可包括向通过本文公开的任何方法被鉴定为处于c1-inh缺陷介导的病症的风险中或患有c1-inh缺陷介导的病症的受试者施用治疗剂。在一些实施方式中,治疗剂可以是血浆激肽释放酶(pkal)抑制剂、缓激肽b2受体拮抗剂或c1酯酶抑制剂。示例包括但不限于艾卡拉肽、拉那芦人单抗(lanadelumab)、艾替班特或人血浆来源的c1酯酶抑制剂。
14.本发明的一个或多个实施方式的细节在以下描述中阐述。本发明的其他特征或优势将从以下附图和几个实施方式的详细描述以及从所附权利要求中显而易见。
附图说明
15.图1是说明用于分析c1s产物(cbz-lys)的示例性基于干血斑(dbs)的fcl-inh液相色谱-串联质谱(lc-ms/ms)测定的示意图。
16.图2是示例性离子色谱图,说明了cbz-lys母离子在碰撞诱导解离(cid)下的裂解模式。选择m/z 91处最强的峰作为用于检测的产物离子。
17.图3包括示例性离子色谱图,显示了来自纯(neat)缓冲溶液的cbz-lys和内标物,作为对照(小图(1));来自包括红细胞和bsa溶液以最佳体积比的混合物的替代基质中的dbs提取物的酶反应(小图(2));和来自健康个体的真实全血样品的dbs提取物的酶反应(小图(3))。
18.图4是显示dbs中fc1-inh测量的校准曲线。
19.图5是说明用于测量c1s产物(n
α-苄氧羰基-l-赖氨酸;cbz-lys)的示例性基于干血斑(dbs)的fcl-inh液相色谱-串联质谱(lc-ms/ms)测定的示意图。
20.图6a-6d显示了代表性样品的示例性离子色谱图。图6a显示了作为对照的纯缓冲溶液中的cbz-lys和内标物。图6b显示了空白替代基质中的cbz-lys和内标物。图6c显示了汇合的真实血液中的cbz-lys和内标物。图6d显示了掺有500mu/ml c1-inh的汇合的健康血液中的cbz-lys和内标物。mu/ml是每毫升功能性c1-inh水平的毫单位。
21.图7是一个代表性的校准曲线,显示了dbs中fc1-inh的测量。
22.图8是显示来自健康受试者(n=103)和hae患者(n=24)的样品中fc1-inh水平的图。mu/ml是每毫升功能性c1-inh水平的毫单位。
23.图9是显示具有从不同位置采集的用于分析的冲孔(n=3或=6)的dbs样品(点a-d)的照片。
24.详细描述
25.c1抑制剂蛋白(c1-inh)的遗传缺陷导致遗传性血管性水肿(hae)。hae患者遭受常因未知触发物引起的疼痛性水肿的急性发作。
26.c1酯酶(c1s)抑制剂(c1-inh)是人血浆的正常成分,属于丝氨酸蛋白酶抑制剂(serpins)组,包括抗凝血酶iii、α1-蛋白酶抑制剂、α2-抗纤维蛋白溶酶和肝素辅助因子ii。与该组中的其他抑制剂一样,c1-inh对人体的几个主要级联系统具有重要的抑制潜力,包括补体系统、内在凝血(接触)系统、纤溶系统和凝血级联。c1-inh通常在炎症过程中被激活,通过与反应性位点共价结合使其底物失活。c1-inh是补体组分1(c1r)、c1s、凝血因子xiia和激肽释放酶亚组分的唯一已知的抑制剂。此外,它是内源性凝血级联中凝血因子xia的主要抑制剂。
27.hae可以主要分为两种类型。i型的特征在于c1-inh蛋白水平低,占hae发生率的85%,而ii型的特征在于功能性c1-inh(fc1-inh)低但c1-inh蛋白水平正常或升高,占约15%。在未治疗的i型和ii型患者中,典型的fc1-inh,当以单位/ml测量时是正常水平的5-30%。患者样品中fc1-inh的准确可靠测量是hae诊断的基础。
28.目前,使用两种类型的血浆测试来确定fc1-inh的水平。第一个测定是生色测定,它使用合成的c1s特异性底物间接测量测试样品中c1-inh对目标蛋白酶c1s活性的抑制。第二个测试是基于c1-inh与补体蛋白组分c1s的功能性结合的elisa测定。
29.目前,推荐fc1-inh活性和蛋白质表达的血清或血浆水平连同补体组分4(c4)水平用于hae i/ii型诊断,其中fc1-in活性是最关键的测试(参见,例如,maurer m等人,allergy(2018)73:1575-96)。测量fc1-inh活性的常规方法包括生色法或复合物形成免疫测定。生色法结合合成的c1s底物来测量血浆样品中c1-inh蛋白的抑制活性,其中没有颜色形成证实了c1-inh诱导的抑制。然而,复合物形成免疫测定方法检测c1-inh-c1s复合物形成,而不直接测量c1-inh抑制活性(参见,例如,li hh等人,j allergy clin immunol pract(2015)3:200-5)。
30.c1-inh和c4抗原水平通常通过浊度法测量。这些测定需要在医生诊所立即处理和适当存储血液样品,并且在所有地理区域不都是标准化的、具有成本效益的或容易获得的。迄今为止,诊断率从中国、墨西哥、日本、韩国的5-10%到美国和西欧的75-80%(未公开数据)不等。开发用于在中心实验室测量fc1-inh的简单和标准化的方法受到极大关注。
31.基于干血斑(dbs)的测定已广泛用于新生儿筛选或多种遗传疾病的患者诊断,例如溶酶体贮积病(lsd)(19-23)。多份报告的结果表明,酶活性可以在dbs样品中保留(2,24)。与常规的血浆或血清测定相比,dbs具有独特的优势。首先,dbs取样(例如使用手指采血)的侵入性较小,不需要大量血液和任何实验室器材。其次,dbs样品可以在环境温度下长期运输和存储,而不会显著损失酶活性或遗传信息。这些优势保证dbs样品可以在医生办公室制备并在集中实验室进行测试。
32.本公开描述了用于测量干血斑(dbs)中功能性c1抑制剂(fc1-inh)水平的测定。这种基于dbs的测试与基于血浆的生色或elisa测定相比具有多项优势,例如,血容量小、分析物在滤纸上干燥后的稳定性更高、样品运输和储存方便,和/或允许在集中实验室对患者样品进行检测。
33.i.检测功能性血浆酯酶c1抑制剂(fc1-inh)水平的方法
34.本公开涉及使用从患者的全血样品制备的干血斑(dbs)通过稳健的液相色谱-串联质谱(lc-ms/ms)确定fcl-inh水平的方法。此类方法可用于诊断c1-inh缺陷介导的病症,例如hae。该方法可涉及制备dbs样品、从dbs样品中提取蛋白质、将蛋白质提取物与补体组分1s(c1s)一起孵育,以及与c1s底物反应以产生c1s底物产物,其可以通过例如,液相色谱-串联质谱(lc-ms/ms)测量。
35.(i)样品制备
36.任何可包含或不包含c1-inh(例如,fc1-inh、非功能性c1-inh或两者)的样品都可以通过本文描述的方法进行分析。如本文所用,“样品”是指可包括关注的分析物(在本案中为fc1-inh)的组合物。样品可以包括来自受试者的组织、血液、血浆或血清。术语“样品”可以包括取自受试者的初始未处理样品以及随后处理的样品,例如部分纯化或保存的形式,例如,通过免疫沉淀。示例性样品包括血液、血浆、血清、眼泪或粘液。在其他示例中,样品可以是来自体外测定的组合物。
37.在一些实施方式中,所述样品是体液样品,例如血清或血浆样品。在一些实施方式中,所述样品是从需要分析的受试者获得的生物样品。“患者”、“受试者”或“宿主”(这些术语可互换使用)可以指人类或非人类动物。在一些情况下,受试者是人类患者,其可能患有、怀疑患有与接触系统相关的疾病或处于患有与接触系统相关的疾病的风险中。例如,人类患者可先前发生过hae或可处于hae的风险中。这样的人类患者可在先前接受过治疗,或者可处于用靶向接触系统的组分(例如,c1s、血浆激肽释放酶)的药物的治疗过程中。
38.生物样品可以是体液样品,例如血液样品。在一些示例中,血液样品是全血样品。全血包括红细胞、白细胞、血小板和血浆。在一些实施方式中,血液样品可收集自血管(例如,毛细血管、静脉和动脉)。可使用本领域已知的任何方法收集和处理在本文所述方法中使用的全血样品。在一些实施方式中,样品是通过手指采血(手指针刺)获得的。在一些实施方式下,可以使用抽真空采血管来收集样品。
39.本公开的样品可以具有足以进行如本文描述的至少一种fcl-inh测量测定的任何体积。在一些实施方式中,从受试者获得的样品在25μl-10ml之间。在一些实施方式中,用于本文所述的方法的样品或其等分试样在100μl-2ml之间。在一些实施方式中,样品在50μl-100μl之间。在一些实施方式中,样品在50μl-1ml之间。在一些实施方式中,样品为50μl、100μl、200μl、300μl、400μl、500μl、600μl、700μl、800μl、900μl、1ml、1.1ml、1.2ml、1.3ml、1.4ml、1.5ml、1.6ml、1.7ml、1.8ml、1.9ml、2.0ml、2.5ml、3.0ml、3.5ml、4.5ml、5.0ml、5.5ml、6.0ml、6.5ml、7.0ml、7.5ml、8.5ml、9.0ml、9.5ml或10.0ml。在一些实施方式中,样品是60μl。
40.可以收集本文公开的任何样品,例如全血样品,并且可以取出样品的等分试样并将其点样在支撑构件上。在一些实施方式中,包含样品或样品的等分试样的支撑构件在适当的条件(例如,室温)下保持适当的时间段(例如,至少1小时、至少2小时、至少3小时、至少
4小时或更长时间)以允许在支撑构件上形成样品的干斑(dried spot)。
41.支撑构件可以是膜、薄膜、滤纸或干血斑卡。在一些实施方式中,支撑构件可包括一个或多个样品收集区域,并且可选地,包括环绕盖(wrap-around cover)。支撑构件可装入(fit into)可密封容器中,例如袋,以促进样品传输。在一些实施方式中,支撑构件可以是可折叠的。本文所述的任何支撑构件还可进一步包括一个或多个用于记录样品的另外信息(例如,受试者的人口统计信息)的区域。
42.样品(或其等分试样)可以允许在适当的条件下在适当的时间段内在支撑构件上干燥。在一些实施方式中,允许样品干燥约1-6小时,例如1小时、2小时、3小时、4小时、5小时或6小时。在一些实施方式中,使样品干燥约1-2小时、1-3小时、1-4小时、1-5小时、2-3小时、2-4小时、2-5小时、2-6小时小时、3-4小时、3-5小时、3-6小时、4-5小时、4-6小时或5-6小时。
43.在一些实施方式中,允许样品在适当的温度干燥,例如在10℃-40℃之间的温度或更高的温度。在一些实施方式中,允许样品在10℃、11℃、12℃、13℃、14℃、15℃、16℃、17℃、18℃、19℃、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃或更高的温度干燥。本领域技术人员已知,干燥过程可以在相对较高的温度下进行较短的时间,可选地,在相对较低的温度下进行较长的时间。在一些示例中,可以允许样品在室温(约25℃)干燥至少3小时。
44.(ii)蛋白质提取
45.可以处理如本文所述制备的干斑样品,例如干血液样品,以提取样品中包含的生物材料,例如蛋白质。在一些实施方式中,干斑样品(dried spot sample),例如dbs样品,可以被处理用于蛋白质提取。如本文所用,蛋白质提取是指将在干燥样品中包含的蛋白质或蛋白质的某些部分提取到适当的缓冲液中(例如,目标蛋白质可溶于所述缓冲液中)。在一些情况下,可以通过常规方法(例如,使用打孔器(puncher))将存在于支撑构件的样品收集区域上的干斑样品(例如dbs样品)与支撑构件的其余部分分离。分离的生物材料样品,例如蛋白质样品,可以转移到适当的容器中以进一步提取蛋白质。适当容器的非限制性示例可以是管、盘、小瓶、多孔板。在一些示例中,适当的容器可以是96孔板。可以同时处理一个或多个干斑样品,例如dbs样品。
46.任何适当的缓冲液均可用于本文所述的方法中。优选地,缓冲液与待提取的生物材料相容(例如,能够溶解蛋白质并优选地保留蛋白质功能)。适当缓冲液的非限制性示例包括磷酸盐缓冲盐水(pbs)、dulbecco's磷酸盐缓冲盐水(dpbs)或hanks平衡盐溶液(hbss)。在一些示例中,缓冲液可以是pbs。在一些实施方式中,缓冲液可包含一种或多种组分以促进稳定性和/或防止待提取的生物材料降解。
47.在一些实施方式中,用于提取步骤的缓冲液可以以适当浓度(例如,0.5%)包含一种或多种促进蛋白质提取(例如,牛血清白蛋白)的试剂。在一些实施方式中,可以在允许完全提取样品中关注的生物材料(例如,fcl-inh)的适当条件下在缓冲液中孵育包含干斑样品(例如,dbs样品)的支撑构件或其一部分。在一些实施方式中,可以在适当的温度,例如25-37℃(例如,37℃)下,在缓冲液中将含有干斑样品的支撑构件孵育适当的时间,例如2-5小时(例如,3小时),以允许充分提取关注的生物材料(例如,包括fc1-inh的蛋白质),从而可以测量fc1-inh的水平。
48.在一些实施方式中,缓冲液/样品混合物可以以适当的速度例如800-2000rpm(例
如1250rpm)离心以促进将生物材料提取到溶液中。具体的提取条件,包括温度、提取时间段、缓冲液的使用、离心或不离心、离心速度等的选择,可取决于例如待提取的生物材料和用于形成干斑样品的支撑构件的类型。这样的信息在本领域技术人员的知识范围内。
49.(iii)fc1-inh的测量
50.可以分析如上所公开制备的含有fcl-inh的溶液以确定溶液中fcl-inh的水平。在一些情况下,fc1-inh的水平通过确定fc1-inh的活性来测量,例如,通过本文公开的常规途径或方法。
51.fcl-inh的水平可以使用本领域已知的或如本文所描述的适当的方法来测量。在一些实施方式中,fcl-inh的水平是通过生色测定使用可被c1s裂解的生色底物来测量的。在一些实施方式中,免疫测定用于评估如本文所描述的关注的c1s产物的水平。免疫测定的示例包括但不限于蛋白质印迹、酶联免疫吸附测定(elisa)(例如夹心elisa)、放射免疫测定、基于电化学发光的检测测定和相关技术。测定,例如蛋白质印迹测定,可进一步涉及定量成像系统的使用,例如可商购的licor成像技术(参见例如来自li-cor biosciences的clx红外成像系统)。在一些实施方式中,使用电化学发光检测测定或依赖于电化学发光和图案化阵列技术的组合的测定(例如,来自meso scale discovery(msd)的ecl或multi-array技术测定)。
52.如本文所用,术语“测量”或可选地“检测”是指评估样品中物质的存在、不存在、数量或量(可以是有效量),包括推导此类物质的定性或定量浓度水平,或以其他方式评估受试者的值或分类。
53.在一些实施方式中,从本文公开的任何干斑样品(例如,dbs样品)中提取的含有fcl-inh的样品可以与c1s蛋白酶和c1s底物一起孵育。c1s蛋白酶可以作用于c1s底物以将c1s底物转化为c1s底物产物,其然后可以被分析以确定c1s底物产物的存在和/或水平。可选地,可以分析c1s底物以确定在与c1s蛋白酶和含有fcl-inh的样品孵育后剩余的c1s底物的存在和/或水平。一旦c1s蛋白酶被fc1-inh抑制,c1s底物产物的产生就会减少或消除。如本文所用,“c1s底物产物”是指c1s底物上c1s的蛋白酶反应产生的裂解产物。在一些实施方式中,c1s底物和/或c1s底物产物的量可用作c1s蛋白酶和/或fc1-inh活性的间接量度。
54.在一些实施方式中,从本文公开的任何干斑样品(例如,dbs样品)中提取的含有fcl-inh的样品可以首先在适当的条件下与c1s蛋白酶一起孵育适当的时间。然后可将c1s底物添加至混合物中,所述混合物可在适当的条件下进一步孵育适当的时间段以允许产生c1s底物产物。在一些实施方式中,孵育可以在黑暗中进行。在一些示例中,该方法可以包括淬灭c1s蛋白酶反应的步骤,这可以增加分析的准确性。在一些实施方式中,可以通过在淬灭溶液中稀释(例如,1:5-1:20)c1s反应混合物来淬灭c1s蛋白酶反应。如本文所用,“淬灭溶液”是指用于停止如本文所述的酶促反应(例如,c1s蛋白酶反应)的溶液。在一些实施方式中,淬灭溶液可包含能够使酶变性或失活的试剂。非限制性变性剂包括醇类、去污剂、强酸、强碱、螯合剂等。在一些实施方式中,猝灭溶液可包含去污剂(例如,sds)和/或醇(例如,甲醇)。
55.用于本文公开的方法中的c1s底物可以是可以被c1s蛋白酶裂解以产生可检测的c1s底物产物的任何底物。c1s底物的非限制性示例包括n
α-苯甲氧甲酰基-lys-硫苄酯,其在c1s蛋白酶裂解后生成n
α-苄氧羰基-l-赖氨酸(cbz-lys);和c4,产生c4a和c4b。
56.在一些实施方式中,在酶促反应被淬灭后,可以进一步稀释样品以用于随后的液相色谱-串联质谱(lc-ms/ms)分析。在一些实施方式中,样品可以在适当的溶液中稀释200倍(例如,80%meoh的水溶液(v/v))。
57.由此产生的c1s底物产物可以通过常规方法分析以确定其存在和/或水平。在一些实施方式中,c1s底物产物可以通过液相色谱-质谱(lc-ms)方法进行分析,该方法是一种将液相色谱的物理分离能力与质谱(ms)的质量分析能力相结合的分析技术。可以使用常规方法进行lc-ms/ms测定。
58.在一些情况下,用于分析c1s底物产物的质谱仪可以在选择性反应监测(srm)模式下运行。srm模式是一种用于串联质谱分析的高灵敏度和选择性方法,其中在串联质谱仪的第一阶段中选择特定质量的离子,在第二质谱仪阶段选择前体离子的碎裂反应(fragmentation reaction)的离子产物进行检测。srm模式可用于通过质谱仪进行靶向定量。在电离之后,例如,使用电喷雾源,首先分离前体以获得主要是预期物质(例如,母离子)的大量离子群。然后将该群破碎以产生产物离子,其信号丰度指示样品中关注产物的丰度。在一些实施方式中,cbz-lys母离子可以在m/z281并且选择用于检测的cbz-lys产物离子可以在m/z 91。如示例中所述,合适的仪器,例如absciex 5500或6500qtrap质谱仪,可以使用并且在方法优化后评估不同样品之间的差异。如本文所述,可以制备单独的全血样品用于lc-ms/ms分析。
59.c1s底物产物的水平(例如,浓度)(例如,由auc表示),和因此fc1-inh浓度可以通过常规方法确定。校准或标准曲线(如四参数逻辑校准曲线)可以通过绘制fc1-inh的浓度对分析物(如cbz-lys)与内标物(如nε-苄氧羰基-l-赖氨酸-2,6,6-d3的浓度)的峰面积比来生成。校准曲线可以拟合成一个方程式,例如:
[0060][0061]
其中y指峰面积比;x指样品浓度;并且a、b、c和d为曲线拟合参数。
[0062]
在一些实施方式中,可以通过分析使用本文所述的方法制备的校准标准物来验证lc-ms/ms方法的准确性和再现性。在一些实施方式中,样品中fcl-inh的水平(例如,浓度)可以通过方程式(例如,方程式1)计算。这些结果表明,通过本文所述的方法制备的,由样品中c1s底物产物的水平表示和计算的fc1-inh的水平是hae诊断的可靠生物标志物。
[0063]
在一些情况下,可以用关注的分析物(c1s特征产物)与内标物的峰面积比构建校准曲线。如本文所用,“内标物”是指以恒定量添加到测试样品、质量控制(qc)样品、空白和校准标准物中以校正样品制备期间分析物的损失,因此以提高分析物分析的准确性的化学物质。在一些实施方式中,内标物是nε-苄氧羰基-l-赖氨酸-2,6,6-d3或另一种稳定的同位素标记的c1s底物产物。在一些实施方式中,校准曲线可用于定量分析。
[0064]
另外,还可以制备一系列校准标准物,并用样品进行lc-ms/ms分析,将样品作为测定的校准品并用于质量控制。如本文所用,校准标准物是指包含已知量的关注的分析物或材料(例如,本公开中的fcl-inh)的全血或溶液。校准标准物可用于以与样品相同的方式测试已知浓度的材料,以确保测试系统在整个可报告范围内精确测量样品。可以通过将各种已知量的关注的材料(例如,fcl-inh)添加到最初不包含或耗尽关注的材料的溶液中来制备校准标准物。在一些示例中,可以将关注的材料(例如,fcl-inh)添加到类似于测试样品
(例如,全血样品)的生物样品中以模拟测试样品(例如,替代基质)。在一个示例中,校准标准物可以通过将fc1-inh(例如,纯化的fc1-inh)与fc1-inh耗尽的替代血液混合来制备。如本文所用,fc1-inh耗尽的替代血液可以通过以下制备:(i)通过合适的方法(例如,抽空采血管)从适当的群体获得和/或汇合新鲜的全血,所述群体理想是与受试者相同的物种(例如,健康个体、雄性和/或雌性);(ii)通过使用适当的方法(例如,在室温以800rpm离心10分钟)去除上清血浆来消耗血液样品中关注的内源性物质(例如,fcl-inh);(iii)将适当体积(例如,等体积)的汇合的剩余红细胞与适当的缓冲液(例如,pbs中的~4.3%bsa)混合。关注的材料(例如,fc1-inh)的校准标准物和质量控制(qc)可以通过如本文所述的将各种已知浓度的含有关注的材料(例如,fc1-inh)的溶液掺入到fc1-inh耗尽的替代血液中来制备血液。如本文所述,在lc-ms/ms分析之前,校准标准物可以进行产生c1s底物产物的方法。
[0065]
在一个具体示例中,本文所述的方法可包括:(1)从全血样品制备dbs卡的步骤;(2)从dbs卡中提取c1-inh蛋白质;(3)提取的蛋白质与补体成分c1s孵育;(4)与c1s底物n
α-苯甲氧甲酰基-lys-硫苄酯进行酶反应生成酶产物n
α-苄氧羰基-l-赖氨酸(cbz-lys);(5)随后使用n
ε-苄氧羰基-l-赖氨酸-2,6,6-d3作为用于定量的内标物,通过lc-ms测定测量cbz-lys。
[0066]
ii.干斑测定方法的应用
[0067]
本文所述的用于测量样品中fc1-inh的测定方法可用于临床或非临床目的。
[0068]
(i)疾病诊断和预后
[0069]
c1-inh缺陷介导的病症例如遗传性血管性水肿(hae)的诊断,可以基于从候选受试者获得的样品中的fc1-inh水平。
[0070]
本文所述的测定方法和试剂盒可用于评估疾病,例如疾病的诊断或预后。评估可包括将受试者鉴定为处于患有本文所述疾病的风险中或患有本文所述疾病,例如c1-inh缺陷介导的病症,例如hae(例如i型hae或ii型hae)。评估还可以包括监测疾病的治疗,例如评估治疗对c1-inh缺陷介导的疾病(例如hae)的有效性。此外,评估可包括鉴定可由pkal抑制剂,例如c1s抑制剂(例如,源自人血浆的c1s抑制剂)或血浆激肽释放酶抑制剂治疗的疾病。
[0071]
a.诊断
[0072]
在一些实施方式中,本文所述的测定、方法和试剂盒用于确定从候选受试者(例如,怀疑患有c1-inh缺陷介导的病症(例如,hae)的人类患者)收集的生物样品(例如,全血样品)中的fcl-inh水平。fc1-inh的水平可以基于通过本文描述的方法产生的c1s底物产物的水平来确定(例如,通过4-参数逻辑校准曲线)。可以将这种fc1-inh水平与预定参考值或参考比率进行比较,以确定受试者是否患有c1-inh缺陷介导的病症,例如hae或处于患有c1-inh缺陷介导的病症,例如hae的风险中。例如,如果候选受试者的样品中的fc1-inh是或低于参考值,则该受试者可以被鉴定为患有c1-inh缺陷介导的疾病,例如hae或处于c1-inh缺陷介导的病症,例如hae的风险中。
[0073]
参考样品可以是本文所述的fcl-inh的对照水平。在一些实施方式中,对照水平代表从健康受试者或健康受试者群体获得的对照样品(例如全血样品)中的fcl-inh的量,所述健康受试者或健康受试者群体优选具有与候选受试者相同的物种和年龄。如本文所用,健康受试者是在测量fc1-inh水平时明显没有目标疾病(例如,c1-inh缺陷介导的病症,例如hae)或没有该疾病病史的受试者。
[0074]
可选地,参考值可以是预定值。这种预定的特征fc1-inh可以代表如本文所述的fc1-inh在未患有目标疾病或未处于目标疾病的风险中的受试者群体中的值。
[0075]
预定值可以采用多种形式。例如,它可以是单个截止值,例如中位数或平均值。在一些实施方式中,可以基于比较组来建立预定水平,例如其中一个定义的组已知具有目标疾病而另一个定义的组已知没有目标疾病。可选地,预定水平可以是一个范围,例如在预定百分位数内的对照群体中的fc1-inh范围。
[0076]
如本文所述的对照值可以通过常规技术确定。在一些示例中,可通过对本文也描述的对照样品进行常规方法(例如,用于获得如本文所述的fcl-inh水平的相同测定)来获得对照值。在其他示例中,fc1-inh的水平可以从对照群体的成员中获得并且可以通过例如计算程序分析结果以获得代表对照群体中fc1-inh水平的对照水平(预定水平)。
[0077]
通过将从候选受试者获得的样品中本文所述的fc1-inh浓度与本文所述的参考比率进行比较,可以确定候选受试者是否患有c1-inh缺陷介导的疾病(例如,hae)或处于c1-inh缺陷介导的疾病的风险(例如,hae)中。例如,如果候选受试者的样品中的fcl-inh值偏离参考值或比率(例如,与参考值相比降低),则候选受试者可被鉴定为患有这种疾病或处于这种疾病的风险中。当参考值代表具有目标疾病的受试者群体中如本文所述的fc1-inh的值范围时,落入该范围的候选者样品中的fc1-inh值表明候选受试者具有目标疾病或处于目标疾病的风险中。
[0078]
如本文所使用,“低于参考值的降低值”是指fc1-inh的水平低于参考值,例如对照样品中fc1-inh的预定阈值。对照水平在本文中详细描述。fc1-inh的降低值包括例如比对照样品的参考值低1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、300%、400%、500%或更高的值。
[0079]
在一些实施方式中,候选受试者是具有c1-inh缺陷介导的病症例如hae的一种或多种症状的人类患者。例如,受试者可具有水肿、肿胀,其中所述肿胀完全或主要是外周;荨麻疹;在没有感染迹象的情况下发红、疼痛和肿胀;非组胺介导的水肿、复发性肿胀发作或其组合。在其他实施方式中,受试者在收集样品时没有c1-inh缺乏介导的病症的症状,没有c1-inh缺乏介导的病症的症状的病史,或没有c1-inh介导的病症如hae病史缺陷介导的疾病的病史。在其他实施方式中,受试者对抗组胺疗法、皮质类固醇疗法或两者具有抗性。
[0080]
b.鉴定适当的治疗
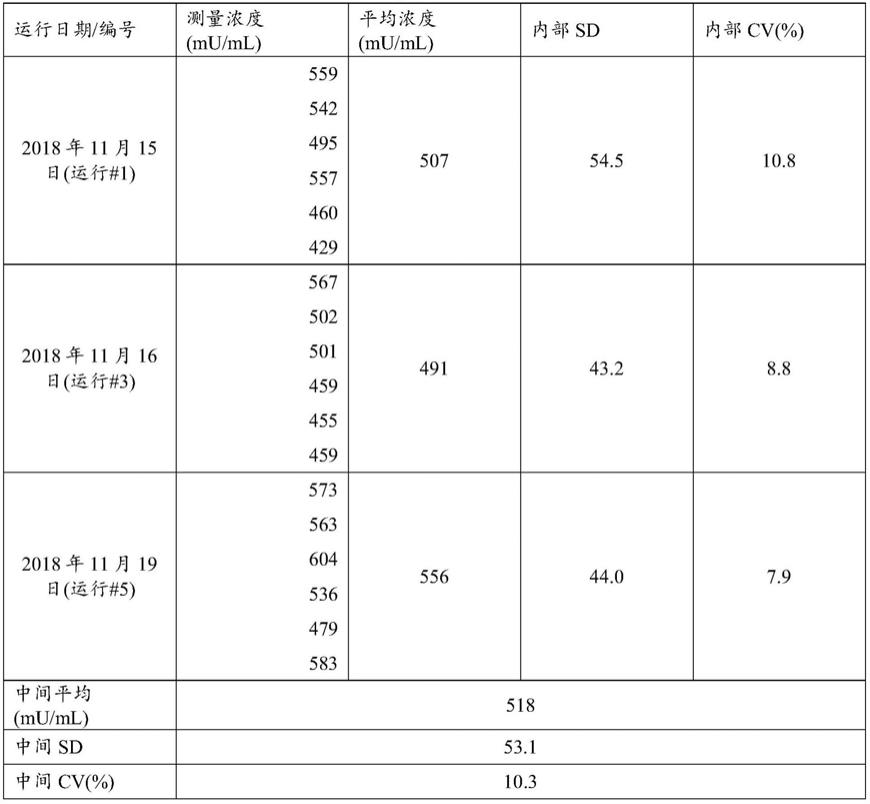
[0081]
在一些实施方式中,本文所述的测定方法和试剂盒还可用于鉴定对患有c1-inh缺陷介导的病症(例如,i型hae或ii型hae)或处于患有c1-inh缺陷介导的病症(例如,i型hae或ii型hae)的风险中的受试者的适当治疗。例如,可以使用本文所述的任何方法测量受试者的fc1-inh水平并与fc1-inh的预定值进行比较。如果受试者的fc1-inh值等于或低于预定值,则可以通过基于fc1-inh的预定值的治疗(例如,重组c1-inh治疗剂或本文所述的其他治疗剂)来治疗受试者。在一些示例中,受试者可以是基于fc1-inh的水平治疗疾病的候选者。
[0082]
在一些实施方式中,本文所述的方法进一步包括向患有c1-inh缺陷介导的病症(例如,hae)或处于患有c1-inh缺陷介导的病症(例如,hae)风险中的受试者施用治疗剂。治疗剂的非限制性示例包括血浆激肽释放酶(pkal)抑制剂(例如,艾卡拉肽、拉那芦人单抗(lanadelumab))、缓激肽b2受体拮抗剂(例如,艾替班特)和c1s抑制剂(例如,人血浆来源的
c1s抑制剂)。
[0083]
(ii)非临床应用
[0084]
进一步,本文所述的测定方法可具有非临床应用,例如,用于研究目的和/或临床前药物开发目的。尽管已经鉴定了许多与c1-inh缺乏相关的疾病,但其他疾病由相似的机制介导或涉及类似的组分也是可能的。在一些实施方式中,本文所述的方法可用于鉴定与c1-inh缺乏相关的疾病。在一些实施方式中,本文所述的方法可用于研究疾病的机制(例如,发现涉及疾病发展的新的生物学途径或过程)或进展。
[0085]
在一些实施方式中,通过如本文所述的测定方法确定的fc1-inh水平可用于开发与c1-inh缺乏相关的疾病的新疗法。例如,如本文所述的fcl-inh水平可以在从已经施用新疗法(例如基因疗法)的受试者获得的样品中或在从体外测定获得的样品中测量。在一些实施方式中,fcl-inh水平可以指示新治疗剂(therapeutic)在体外试验中的活性或新治疗剂在临床试验环境中的功效。
[0086]
iii.用于进行干斑测定方法的试剂盒
[0087]
本公开还提供了用于测量如本文所述的fcl-inh水平的试剂盒。这种试剂盒可以包括用于收集和制备样品、从样品中提取蛋白质的材料、用于测量样品中fc1-inh的组分和/或用于测定样品中fc1-inh水平的说明书。
[0088]
在一些实施方式中,试剂盒包括支撑构件,例如膜、滤纸或干血斑卡。为该方法选择适当的支撑构件将取决于各种因素,例如待被评估的样品数量和从样品中提取蛋白质的方法。
[0089]
在一些实施方式中,支撑构件是多孔板,例如elisa板。在一些实施方式中,本文所述的免疫测定可以在高通量平台上进行。在一些实施方式中,多孔板,例如24-、48-、96-、384-或更多孔的板,可用于高通量免疫测定。可以在每个孔中平行进行单独的免疫测定。因此,通常需要使用读板器仪并行测量多个孔以增加测定通量。在一些实施方式中,能够对多孔(例如,4、16、24、48、96、384或更多的孔)进行并行成像的读板器可用于该平台。
[0090]
该试剂盒还可包含一种或多种如本文所述的缓冲液,但不限于淬灭缓冲液、变性缓冲液和蛋白质提取缓冲液。缓冲液的示例包括但不限于pbs、dpbs、hbss、hepes、tris、tris-hcl、磷酸钠、磷酸钾和氯化钾。
[0091]
在一些实施方式中,试剂盒可包含根据本文所述的任何方法使用的说明书。所包含的说明可以包括如何使用包含在试剂盒中的组分来测量从受试者(例如人类患者)收集的生物样品中的fcl-inh水平的描述。
[0092]
与试剂盒使用相关的说明书通常包括关于每种组分的量和用于执行本文所述方法的适当条件的信息。试剂盒中的组分可以是单位剂量、散装包装(bulk package)(例如多剂量包装)或亚单位剂量。本公开的试剂盒中提供的说明书通常是标签或包装插页(例如,试剂盒中包含的纸页)上的书面说明,但机器可读的说明书(例如,携带在磁盘或光存储盘上的说明书)是也可以接受的。
[0093]
标签或包装插页指示该试剂盒用于评估一个或多个样品中的fc1-inh水平。可提供用于实施本文所述的任何方法的说明书。在一些实施方式中,该试剂盒可包括用于在分析之前运输干燥样品的可密封容器(例如,袋)。
[0094]
本公开的试剂盒采用适当的包装。适当的包装包括但不限于小瓶、瓶子、广口瓶、
软包装(例如密封的聚酯薄膜(mylar)或塑料袋)等。
[0095]
试剂盒可以任选地提供附加组分,例如解释性信息,例如对照和/或标准或参考样品,例如以生成校准曲线。通常,试剂盒包括容器和在容器上或与容器相关联的标签或包装插页。在一些实施方式中,本公开提供包含上述试剂盒的内容物的制品。
[0096]
不再赘述,相信本领域技术人员基于以上描述可以最大限度地利用本发明。因此,以下具体实施方式应被解释为仅是说明性的,而不以任何方式限制本公开的其余部分。出于本文提及的目的或主题,本文引用的所有出版物通过引用并入。
实施例
[0097]
实施例1:基于dbs的lc-ms/ms fc1-inh测定
[0098]
本实施例描述了用于测量血液样品中的功能性c1-抑制剂(fc1-inh)的基于干血斑(dbs)的lc-ms/ms分析。图1阐释了该测定的示例性方案。
[0099]
该方法旨在确定人全血样品中的fc1-inh水平。该方法涉及校准标准物、质量控制(qc)和dbs样品的制备、从dbs样品中提取蛋白质、蛋白质提取物与补体组分1s的(c1s)的孵育、与c1s底物n
α-苯甲氧甲酰基-lys-硫苄酯反应以产生n
α-苄氧羰基-l-赖氨酸(cbz-lys),和随后用液相色谱-串联质谱(lc-ms/ms)测量cbz-lys。ab sciex qtrap 6500质谱仪在选择反应监测(srm)模式下在优化条件下运行,以在正离子模式中检测cbz-lys和内标物(nε-苄氧羰基-l-赖氨酸-2,6,6-d3)。
[0100]
实验步骤:
[0101]
(i)校准标准物和质量控制(qcs)的准备
[0102]
从耗尽了c1-inh蛋白质的替代血液准备校准品(calibrator)和质量控制(qc)。简言之,汇合来自健康个体(男性和女性)的新鲜全血,并在1200
×
g和室温下离心10分钟。丢弃掉上清血浆,所得的红细胞用磷酸盐缓冲盐水(pbs)溶液洗涤一次。通过在pbs中混合等体积的汇合的红细胞和4.3%的牛血清蛋白(bsa)制备不含c1-inh的替代血液。为了准备校准标准物和质量控制(qc),将不同浓度的c1-inh溶液掺入替代血液中。
[0103]
(ii)dbs样品的制备
[0104]
收集全血样本后,将最多60μl等分试样沉积在dbs卡(903蛋白保存卡,whatman)的滤纸点上。将dbs卡弯曲,以便背面不和任何表面接触,避免血液浸透滤纸造成损失。将所述卡干燥至少3小时(h),并在室温下存储。
[0105]
为了准备校准品、qc和测试样品,使用dbs(ge health care life science,whatman)打孔器打出3.0mm的孔,并且dbs样品被转移到500μl 96孔板(eppendorf protein lobind)中。dbs样品通过在1250rpm运行的培养箱中与100μl的0.5%bsa的pbs缓冲液一起在37℃下孵育3小时来提取。将提取样品的等分试样(20μl)转移到另一个96孔板中,并与pbs中的0.5%bsa中新鲜制备的50μl的0.5μg/ml的c1s溶液混合。在800rpm和37℃下孵育1.5小时后,将105μl底物溶液(n
α-苯甲氧甲酰基-lys-硫苄酯)和内标物(nε-苄氧羰基-l-赖氨酸-2,6,6-d3)的混合物加入,并通过在室温下在黑暗中孵育40分钟,使得酶反应得以进行。通过将50μl反应溶液转移至450μl 0.1%的sds的meoh/水(80/20,v/v)中使得反应淬灭。将以上样品用meoh/水(80/20,v/v)进一步稀释200倍,然后进行lc-ms/ms分析。
[0106]
(iii)lc-ms/ms分析
[0107]
未反应的底物、底物产物(分析物、cbz-lys)和内标物的分离是在waters acquity uplc上使用在30℃设置的反相柱(waters xbridge protein beh c4,3.5μm,2.1
×
50mm)实现的。流动相a为水中0.1%甲酸,和流动相b为乙腈。流速为0.3ml/min,并且流动相梯度包括以下时间点(时间,%b)之间的梯度步骤:0分钟,4%;0.5分钟,4%;3.5分钟,12%;3.6分钟,70%;4.6分钟,70%;4.7分钟,4%;5.5分钟,4%。自动进样器温度设置为4℃,以部分-环lc注入模式注入3μl样品。在检测cbz-lys和内标物(nε-苄氧羰基-l-赖氨酸-2,6,6-d3)的优化设置下,在选择反应监测(srm)模式下运行的ab sciex qtrap 6500质谱仪上使用电喷雾电离形成的正离子采集分析物和内标物信号。
[0108]
优化后的ms参数设置如下:气帘,20;碰撞气体,中等;离子喷雾电压,4000;温度,550;离子源气体1,50;离子气源2,50;去簇电压,120;入口电压,10.0;碰撞能量,26.0;碰撞单元退出电压,12.0。分析物和内标物分别使用m/z 281.2至m/z 91.0和m/z 284.2至m/z 91.0的srm离子进行监测。
[0109]
(iv)数据分析
[0110]
分析物和内标物的峰面积由analyst软件确定。使用softmax pro 7.0以分析物与内标物的峰面积比和标准物中掺入的c1-inh浓度构建4参数逻辑校准曲线。基于以下方程式计算样品中的fc1-inh水平。
[0111][0112]
其中y为峰面积比;x是样品浓度;a、b、c和d为曲线拟合参数。此外,使用excel计算准确度和相对标准偏差(rsd)。
[0113]
结果
[0114]
图2显示了cbz-lys前体离子在碰撞诱导的解离(cid)下的碎裂模式。选择m/z 91处最强的峰作为用于检测的产物离子。
[0115]
图3显示了来自以下的cbz-lys和内标物(is)的离子色谱图:(1)作为对照的纯缓冲溶液;(2)来自包括以最佳体积比的红细胞和bsa溶液的混合物的替代基质中的dbs提取物的酶反应产物;(3)来自健康个体的真实全血样品的dbs提取物的酶反应产物。cbz-lys和is显示来自不同样品来源的可重现保留。此外,纯溶液和替代血液基质的cbz-lys峰强度非常相似,这意味着替代血液基质中的残留fc1-inh极少。另一方面,源自fc1-inh正常的健康血液样品的cbz-lys强度明显较低,表明fc1-inh的存在对c1s酶活性的抑制。该图证明了在dbs提取物的酶反应后检测cbz-lys的可行性。
[0116]
图4显示了dbs中fc1-inh测量的校准曲线。
[0117]
为了评估基于dbs的lc-ms/ms fc1-inh测定的运行间再现性,使用基于dbs的lc-ms/ms fc1-inh测定在三个不同的日期收集和分析来自六个个体受试者的汇合的血液样品。测定结果如表1所示。测定的精度(%cv~10.3)非常好。
[0118]
表1.基于dbs的lc-ms/ms fc1-inh测定的运行间再现性汇合的全血(wb)由六组受试者制备
[0119][0120]
为了评估基于dbs的lc-ms/ms fc1-inh测定的日内再现性,将c1-inh掺入到不同浓度的红细胞基质中作为质量控制(定量下限(lloq)、低、中和高)。然后使用基于dbs的lc-ms/ms fc1-inh测定分析样品。结果如表2所示。从该测定中获得的fc1-inh水平对应于掺入样品中的fc1-inh水平,表明该测定在使用dbs测量fc1-inh时的精确度。
[0121]
表2.基于dbs的lc-ms/ms fc1-inh测定的日内再现性
[0122][0123]
实施例2:使用基于dbs的lc-ms/ms fc1-inh测定
[0124]
本文描述了能够测量dbs中fc1-inh活性以诊断hae患者的新型测定的开发和验证。该测定按照监管指南和工业最佳实践进行验证。来自hae患者的dbs样品显示出显著较低的fc1-inh活性,从而可以将hae患者与健康受试者区分开来。
[0125]
实验程序
[0126]
(i)材料
[0127]nα-苯甲氧甲酰基-lys-硫苄酯盐酸盐(z-lys-sbzl
·
hcl,c1s底物)和n
ε-苄氧羰基-l-赖氨酸-2,6,6-d3(nε-cbz-l-赖氨酸-d3,内标物)分别购自bachem(torrance,california,usa)和cdn isotopes(quebec,canada)。重组人补体组分c1s(c1s)购自r&d系统(minneapolis,mn,usa)。重组体c1-inh是内部获得的。牛血清白蛋白(bsa)获自americanbio(natick,ma,usa)。十二烷基硫酸钠(sds)溶液(10%)是sigma(st.louis,mo,usa)的产品。500μl 96孔板(eppendorf protein lobind)购自eppendorf(hamburg,德国)。3毫米打孔器和whatman#903蛋白保存卡购自ge health care life science(little chalfont,buckinghamshire,uk)。干燥剂(1g)和生物危害袋获得自vwr(radnor,pa,us)。研究中使用的所有其他化学品都是最高等级的,并且未经进一步纯化即可使用。
[0128]
(ii)溶液的制备
[0129]
c1s工作溶液(0.5μg/ml)是通过使用pbs缓冲液中制备的0.5%bsa溶液将c1s原料液(367μg/ml)稀释734倍而新鲜制备的。通过将z-lys-sbzl
·
hcl溶解在dmso中至终浓度为10mm来制备底物原料液。内标物(is)原料液(2.5mm)通过将nε-cbz-l-赖氨酸-d3溶解在5mm na2co3的甲醇/水(50/50)溶液中制备。底物、c1s和is原料液在使用前储存在-80℃。在pbs缓冲液中新鲜制备含有0.83mm z-lys-sbzl
·
hcl和33.3μm nε-cbz-l-赖氨酸-d3的底物-is混合物(cocktail)。通过用甲醇/水(80/20,v/v)溶液将10%sds稀释100倍来制备sds溶液(0.1%)。
[0130]
(iii)dbs样品的制备
[0131]
提供了来自24名先前诊断出hae的患者的全血,具有患者的书面知情同意。将血液吸入vacutainer edta管中并储存在4℃。在收集的24小时内,将试管倒置数次以重悬血细胞,并将60μl等分试样点样在滤纸点上。来自103名健康受试者的正常人全血,购自biioivt(westbury,ny,usa)。血斑在室温下干燥至少3小时,并在-20℃下储存在密封的生物危害袋中,每个袋子中装有一种干燥剂。
[0132]
(iv)制备不含c1-inh的血液作为替代基质
[0133]
为了获得用于制备校准曲线和质量控制(qc)的耗尽fcl-inh的替代基质,如实施例1中所述制备了六个不同批次的人全血样品(三名男性三名女性,各10ml)。简而言之,全血在室温下以1200x g离心10分钟。去除上清血浆,并用5ml pbs溶液洗涤红细胞以去除残留血浆和fcl-inh。通过在室温下以1200xg离心10分钟再次分离红细胞。汇合所得的不含fc1-inh的红细胞。通过混合等体积的汇合的红细胞和在pbs缓冲液中制备的4.3%bsa制备替代血液基质。
[0134]
(v)在dbs中制备校准品和qc样品
[0135]
通过将不同浓度的fc1-inh掺入到替代基质中来制备校准标准物(校准品)。标称fc1-inh浓度分别为100、200、300、500、1000和1500mu/ml。质量控制(qc)样
品在替代基质或汇合的人全血中制备。在替代基质中制备定量下限(lloq)qc(100mu/ml)和低qc(150mu/ml)。考虑到内源性c1-inh水平(el),所有其他qc在汇合的全血中制备:低-中qc(el)、中qc(el 200mu/ml)、中-高qc(el 500mu/ml)和高qc(el 800mu/ml)。dbs中校准品和qc的制备遵循与上述相同的程序。
[0136]
(vi)样品提取和酶促反应
[0137]
如实施例1中所述提取样品并进行酶促反应。简而言之,使用3mm打孔器切割dbs盘并转移至500μl 96孔板。通过在thermomixer培养箱中以1250rpm的涡流在37℃的温度下在100μl 0.5%bsa的pbs中孵育3小时来提取盘中的蛋白质。将板以4000rpm离心3分钟,然后将20μl提取物转移到另一个含有50μl c1s工作溶液的96孔板中。然后在800rpm和37℃下孵育1.5小时。随后,将105μl底物-内标物(底物-is)混合物加入上述溶液中,然后在室温下以800rpm在黑暗中孵育40分钟。通过将50μl溶液转移到450μl 0.1%sds的甲醇/水(80/20,v/v)中终止反应。在lc-ms/ms分析之前,将所得样品用meoh/水(80/20,v/v)进一步稀释200倍。
[0138]
(vii)lc-ms/ms分析
[0139]
如实施例1中所述,通过lc-ms/ms分析反应样品。简而言之,在waters acquity uplc系统上实现底物(z-lys-sbzl
·
hcl)、分析物(n
α-苄氧羰基-l-赖氨酸,cbz-lys)和is(n
ε-cbz-l-赖氨酸-d3)的分离,使用反相柱(waters xbridge protein beh c4,3.5μm,2.1
×
50mm),柱温保持在30℃。流动相a为水中0.1%甲酸,和流动相b为乙腈。流速为0.3ml/min,和流动相梯度如下(时间,%b):0分钟,4%;0.5分钟,4%;3.5分钟,12%;3.6分钟,70%;4.6分钟,70%;4.7分钟,4%;5.5分钟,4%。自动进样器设置在4℃,并且使用部分-环lc注入模式注入3.0μl样品。在选择反应监测(srm)模式下使用正离子运行的ab sciex qtrap 6500质谱仪上对分析物和is进行定量。最佳质谱参数如下:气帘,20;碰撞气体,中等;离子喷雾电压,4000;温度,550;离子源气体1,50;离子气源2,50;去簇电压,120;入口电压,10.0;碰撞能量,26.0;碰撞单元退出电压,12.0。分析物和is分别使用m/z 281.2至m/z 91.0和m/z 284.2至m/z 91.0的srm离子对进行监测。
[0140]
(viii)适合目的的测定验证
[0141]
适合目的的测定验证遵循工业对生物标志物和基于dbs的诊断测定的最佳实践(1-6)。该方法在各种条件下的校准曲线、准确度、精度、基质效应、血细胞比容、提取、采样位置和稳定性都得到了验证。
[0142]
准确度(相对误差或%re)和精度(%rsd)是通过每天在每个浓度水平的替代和真实基质二者中分析qc样品的六个重复进行三天来评估的。依次计算日内和日间平均准确度和精度。在运行定量上限(uloq)校准品后,通过注入空白溶液来检查分析物残留(carry-over)。
[0143]
使用来自四名健康受试者的全血评估血细胞比容水平对测定性能的影响。简而言之,通过以1200
×
g离心10分钟将血浆与红细胞分离。然后,混合不同体积的血浆和红细胞,以分别实现25%、45%、60%和75%的血细胞比容水平。来自45%血细胞比容的dbs样品用作在其他血细胞比容水平下c1-inh活性标准化的参考。
[0144]
冲孔位置对dbs斑点和dbs斑点的变化的影响是通过使用来自一个斑点和总共四个不同dbs斑点上额3-6个冲孔位置的低和中-高qc样品来评估(图9,表3)。低qc在替代基质
中制备,并且中-高qc在汇合的全血中制备。
[0145]
表3.dbs同质性测试总结
[0146][0147]
使用在替代基质中以100、600和1000mu/ml制备的qc,通过比较预掺入样品和后掺入样品的结果来评估提取效率。通过将c1-inh掺入到替代基质中来制备预掺入样品,然后制备dbs卡。另一方面,后掺入样品是通过将相同浓度的c1-inh(3.3μl,对应于3.0mm冲孔中的湿血体积)掺入到源自空白替代基质的dbs提取物中制备的。
[0148]
使用来自六名健康受试者(3名男性和3名女性)的等体积汇合的全血测试c1-inh活性的全血稳定性。在添加到whatman#903蛋白保存卡之前,样品在4℃下至多可储存7天。类似地,由汇合的全血制备的dbs样品分别在45℃储存3天和在室温储存134天,以评估运输和储存条件下的稳定性。
[0149]
(ix)数据分析
[0150]
如实施例1中所述进行数据分析。简而言之,分析物与内标物的峰面积比由ab sciex analyst(1.6.3)确定。使用softmax pro 7.0以峰面积比和掺入的c1-inh浓度构建4参数逻辑校准曲线。基于以下方程式计算样品浓度:
[0151][0152]
其中y是峰面积比;x是样品浓度;a、b、c和d为曲线拟合参数。此外,使用excel计算平均值、准确度(%re)、标准偏差和相对标准偏差(%rsd)。
[0153]
结果
[0154]
总体策略
[0155]
如图5所示,开发了lc-ms/ms测定来测量来自干血斑的样品中的酶反应产物cbz-lys。该测定由以下步骤组成:(1)从dbs卡中提取c1-inh;(2)c1-inh与过量c1s结合;(3)未结合的c1s与其底物反应;(4)酶反应产物cbz-lys的lc-ms/ms分析。在预验证运行期间优化了测定条件,例如c1s及其底物的相对浓度、c1s和fc1-inh之间的结合时间和温度、c1s与其
底物之间的酶促反应时间和温度,以及lc-ms/ms条件。
[0156]
校准基质和校准曲线
[0157]
从汇合的人全血制备c1-inh耗尽的血液基质,以测量hae患者的c1-inh活性,其中c1-inh的活性低于正常对照。c1-inh是一种循环蛋白,并且在离心后会留在血浆上清液中以使红细胞降速(spin down)。随后用bsa溶液补充红细胞以模拟真实全血中的血浆蛋白浓度。4.3%的bsa(43mg/ml)与相同体积的红细胞混合,产生与真实全血相似的粘度,如滤纸中相同的斑点大小所示。如图6a和6b所示,来自替代基质和空白对照的相同分析物信号证实了c1-inh完全耗尽,这意味着替代基质中不存在fc1-inh活性。相反,在汇合的健康血液(图6c)和掺有500mu/ml的c1-inh的汇合的健康血液(图6d)中存在c1-inh依赖性信号减弱。
[0158]
图7通过使用四参数逻辑曲线拟合绘制分析物信号与掺入到替代基质中的六种不同c1-inh浓度(mu/ml),显示了典型的校准曲线。曲线显示了100到1500mu/ml的可行范围。测定验证结果表明,六点校准曲线符合预设标准:(1)每个浓度水平至少一半校准品的相对误差(%re)应≤20%,但lloq和uloq校准品除外,它们≤25%;(2)校准曲线中必须包含≥75%的校准品总数;(3)失败的连续验证运行不应超过两次。在14个通过的分析运行中的13个中,所有校准品的平均运行间准确度范围在-1.4%到5.9%之间(表4)。
[0159]
[0160]
qc和低qc通过将fcl-inh掺入替代基质中达到最终浓度分别为100mu/ml和150mu/ml来制备。汇合的全血用作中-低qc,而中、中-高和高qc样品是通过将fc1-inh掺入到汇合的全血中来制备的。它们的标称浓度是平均内源性c1-inh浓度(518mu/ml,n=18)和掺入的fc1-inh浓度的总和。如表5所示,日内精度和准确度范围分布为4.4%至11.6%和-11.1%至-2.1%,并且日间精度和准确度分别为8.1%至13.1%和-10.3%至0.9%。
[0164]
表5.日内和日间精度和准确度汇总
[0165][0166]
血细胞比容水平的影响
[0167]
充分证明全血的血细胞比容水平会影响滤纸中的血液稀释,从而影响dbs斑点大小,从而导致测定偏差(1-3、6、7)。随着血细胞比容水平增加,dbs样品的斑点面积减少。根据性别和年龄,全血中的血细胞比容水平范围为28%至67%(7)。在四个血细胞比容水平(25%、45%、60%和75%)下研究血细胞比容对测定性能的影响,其中45%血细胞比容水平用作对照。fc1-inh活性与干血斑中的血细胞比容水平呈线性相关(表6)。30%-60%之间的血细胞比容水平对fc1-inh活性测量的影响最小(re《20%)。
[0168]
表6.血细胞比容水平对dbs中测量的fc1-inh活性的影响
[0169][0170]
c1-inh活性的冲孔位置
[0171]
基于dbs的测定中的另一个问题是冲孔位置对分析物测量的影响(1、6、8)。为了检查dbs卡上冲孔位置对c1-inh活性的影响,从同一受试者的四个点收集了来自中心和外围孔的总共18个重复样品,并分析了低qc和中-高qc样品。精度和准确度均在15%以内,这意味着冲孔位置不会影响c1-inh活性测量(表4)。
[0172]
提取效率
[0173]
使用在替代基质中制备的qc评估c1-inh的提取效率。在100、600和1000mu/ml的qc浓度下,平均提取效率分别为48.8%、65.9%和58.2%(表7)。在样品测试过程中,每次运行都使用校准曲线,提取效率的变化不会影响测定准确度。
[0174]
表7.dbs样品中c1-inh的提取效率
[0175]
浓度(mu/ml)提取效率
±
s.d.(%,n=4)r.s.d.(%)10048.8
±
4.9210.160065.9
±
3.936.0100058.2
±
3.455.9
[0176]
fc1-inh在全血和dbs中的稳定性
[0177]
在全血中评估fc1-inh的稳定性。之前的报告表明,fc1-inh在室温下在患者和健康受试者中稳定多达三天(9)。在4℃下储存7天后,汇合的健康血液中的fc1-inh活性变化
很小(表8)。为了测试dbs中fc1-inh的稳定性,在室温和45℃下将qc对照放置在带有干燥剂包的密封袋中。c1-inh活性在每张卡的不同冲孔中进行测量,并且在45℃下储存3天和在室温下储存134天后显示出最小的损失(《15%)(表8)。这些结果表明fc1-inh可以在dbs中在环境温度下运输和储存而不会失去活性。
[0178]
表8.在不同温度下储存的全血和dbs中fc1-inh活性的稳定性
[0179][0180][0181]
处理过的样品在4℃下放入自动进样器两天后再注入,以评估再注入的稳定性。结果表明精度和准确度符合预定的验收标准(表9)。此外,未检测到分析物残留(数据未显示)。
[0182]
表9.再注入稳定性测试的总结
[0183][0184]
分析来自健康和hae受试者的dbs样品
[0185]
使用经过验证的测定,在从103名健康受试者和24名hae患者(9名男性和15名女性)收集的dbs样品中测量了fc1-inh活性,结果如图8所示。对于健康受试者组,fc1-inh活性范围为从311到1090mu/ml,平均活性和标准偏差(sd)分别为573和135mu/ml。尽管如此,
所有测试的hae受试者的c1-inh活性都低于lloq(100mu/ml),除了一名受试者的c1-inh为158mu/ml。建立了303mu/ml的临界值(平均值-2xsd),它能够完全区分健康受试者和hae受试者。
[0186]
讨论
[0187]
c1-inh用来调节多种抑制性生物活性,包括补体、接触、凝血和纤溶系统(10-12)。作为激肽释放酶-激肽级联反应中三种酶(因子xiia、因子xiif和血浆激肽释放酶)的关键抑制剂,正常的fc1-inh水平防止缓激肽(一种诱导hae发作的促炎介质)的过度产生。fc1-inh活性缺陷会导致接触系统反复激活,产生过量的血浆激肽释放酶(pkal),这是一种活性蛋白水解酶,其进而裂解高分子量激肽原(hmwk)以释放缓激肽(13-15)。目前,已在整个c1-inh serping1基因中鉴定出超过450个突变,并且许多与hae患者的fc1-inh缺陷有关(16)。
[0188]
尽管存在不同类型的hae,但都以c1-inh功能缺陷为特征。通常,hae患者的fc1-inh水平在正常值的5-30%之间,并且减弱的c1-inh活性被用作hae诊断最重要的实验室参数(9)。fc1-inh活性的常规测定通过c1s与其人工底物z-lys-sbzl
·
hcl之间的反应来间接测量fc1-inh活性,以产生cbz-lys和硫代甲基苯。用5,5'-二硫代双-(2-硝基苯甲酸)(dtnb)衍生化后,通过生色测定测量硫代甲基苯(9)。内源性或掺入c1-inh的存在会抑制酶反应,因此,反应产物的形成与c1-inh活性成反比。虽然常规测定可以有效区分血浆或血清样品中的健康和hae受试者,但由于全血中红细胞的测定干扰,其在dbs中的使用受到限制。lc-ms/ms测定具有优于常规生色测定的独特优势。首先,生色测定基于两个反应步骤,而lc-ms/ms测定测量c1s反应的直接产物,因此测定变化可以更低。其次,在测定中使用内标物(is)也有助于校正样品制备和分析过程中的分析偏差。第三,在每次运行中都包括在不含c1-inh的替代基质中制备的校准曲线和qc,以进一步增强测定的准确度和再现性。考虑到健康受试者中c1-inh活性的广泛范围、hae患者中有限的c1-inh活性变化(正常活性的5-30%)以及酶动力学反应的狭窄范围,最下化测定变化可以是准确测量c1-inh活性的关键因素。
[0189]
在酶活性测定中,分析物的校准曲线通常在纯缓冲溶液中而不是在真实基质中制备,并且测定性能通过qc样品监测。虽然这种方法简单,但它不能容易地应用于c1-inh活性测量,因为酶反应进行得太快,使得反应条件的轻微变化都会影响分析结果,从而影响患者的准确诊断。在这些研究中采用了“替代基质”的概念,该概念已广泛用于生物标志物测定中校准品和qc的制备,因为真实基质包含内源性分析物(15)。替代基质应去除分析物,但在消化效率、电离效果和提取产率方面接近真实基质。使用源自全血的替代基质制备校准曲线和qc对于准确评估c1-inh活性低的患者样品中的酶反应至关重要。通过这种方法,实现了100到1500mu/ml之间范围的测定。此外,由替代基质和真实全血中制备的qc样品都实现了出色的准确度和精度,证明了两种基质在测定条件下的平行性。
[0190]
此处描述的lc-ms/ms测定显示平均日内和日间变化低于15%,样品之间的残留可以忽略不计。此外,c1-inh活性测量与dbs中的冲孔位置无关,而dbs中的其他一些分析物并非如此(1)。但是,测定准确度可能会受到血细胞比容水平的影响,应谨慎解释血细胞比容水平低于30%或高于60%的样品的测试结果。
[0191]
在样品运输和储存过程中,dbs中的分析物水平保持稳定非常重要。全血中的c1-inh在4℃下稳定7天。在dbs中,它在45℃下储存时稳定多达3天,并且在室温下储存时稳定
for lysosomal storage disease.rep biochem mol biol 2019;7:119-28.
[0217]
23.zhang xk、elbin cs、chuang wl、cooper sk、marashio ca、beauregard c、keutzer jm.multiplex enzyme assay screening of dried blood spots for lysosomal storage disorders by using tandem mass spectrometry.clin chem 2008;54:1725-8.
[0218]
24.olivova p、van der veen k、cullen e,rose m、zhang xk、sims kb等人,effect of sample collection on alpha-galactosidase an enzyme activity measurements in dried blood spots on filter paper.clin chim acta 2009;403:159-62.
[0219]
其他实施方式
[0220]
本说明书中公开的所有特征可以以任何组合方式结合。本说明书中公开的每个特征可以被用于相同、等同或类似的目的的替代特征替代。因此,除非另有明确说明,否则所公开的每个特征仅仅是等同或类似特征的通用系列的例子。
[0221]
根据以上描述,本领域技术人员可以容易地确定本发明的基本特征,并且在不脱离其精神和范围的情况下,可以对本发明进行各种改变和变型以使其适应各种用途和条件。因此,其他实施方式也在权利要求的范围内。
[0222]
等同内容
[0223]
虽然本文已经描述和说明了几个创造性的实施方式,但是本领域的普通技术人员将容易想到用于执行功能和/或获得结果和/或一个或多个在此描述的优点的各种其他方式和/或结构,并且这些变化和/或变型中的每一个被认为是在本文描述的发明实施方式的范围内。更一般地,本领域技术人员将容易理解,本文描述的所有参数、尺寸、材料和配置都是示例性的,并且实际参数、尺寸、材料和/或配置将取决于本发明的教导所用于的具体的一个应用或者多个应用。本领域技术人员将认识到,或仅仅使用常规实验就能够确定本文描述的具体发明实施方式的许多等同物。因此,应该理解的是,前述实施方式仅以示例的方式给出,并且在所附权利要求及其等同内容的范围内,可以以与具体描述和要求保护的方式不同的方式实施发明实施方式。本公开的创造性实施方式涉及本文描述的每个单独的特征、系统、物品、材料、试剂盒和/或方法。此外,如果这些特征、系统、物品、材料、试剂盒和/或方法相互一致,则两个或更多个这样的特征、系统、物品、材料、试剂盒和/或方法的任何组合都包括在本公开的发明范围内。
[0224]
如本文所定义和使用的所有定义应理解为控制字典定义、通过引用并入的文献中的定义和/或所定义的术语的普通含义。
[0225]
在此公开的所有参考文献、专利和专利申请都通过引用的方式关于每个被引用的主题并入,在某些情况下可以包含整个文件。
[0226]
除非有明确的相反指示,否则本文在说明书和权利要求书中使用的不定冠词“一种”和“一个”应理解为意指“至少一个/种”。如本文在说明书和权利要求书中使用的短语“和/或”应理解为意指如此结合的要素中的“一个或两个”,即在一些情况下联合存在并且其他情况下是分离地存在的。以“和/或”列出的多个要素应该以相同的方式解释,即如此连接的要素中的“一个或多个”。其他要素可以任选地存在,除了由“和/或”子句明确标识的要素之外,不管与具体标识的那些要素相关还是不相关。因此,作为非限制性示例,当与开放
式语言比如“包含”结合使用时,提及“a和/或b”在一个实施方式中可以仅指代a(任选地包括除b以外的其他要素);在另一实施方式中,仅指代b(任选地包括除a以外的元素);在另一种实施方式中,涉及a和b(任选地包括其他元素)等等。
[0227]
如在本说明书和权利要求书中所使用的,“或”应被理解为具有与如上所定义的“和/或”相同的含义。例如,当分离列表中的项目时,“或”或“和/或”应被解释为包含性的,即包含许多或一列要素的至少一个,但也包括许多或一列要素的多于一个,以及任选的其他未列出的项目。只有明确指出相反的术语,例如“仅一个”或“恰好一个”或者当在权利要求中使用时“由...组成”,将指包含许多或一列要素中的恰好一个。通常,本文使用的术语“或”应当仅被解释为在排他性术语(例如“两者之一”、“其中之一”、“仅一个”或“恰好一个”)之前指示排他性的替代方案(即“一者或另一者,而非两者”)。当在权利要求中使用时,“基本上由......组成”应具有其在专利法领域中使用的普通含义。
[0228]
如本文在说明书和权利要求中所使用的,关于一个或多个要素的列表的短语“至少一个”应该理解为是指从要素列表中的任何一个或多个要素中选择的至少一个要素,但不一定包括要素列表内具体列出的每个要素中的至少一个,并且不排除要素列表中要素的任何组合。除了在短语“至少一个”所指的要素列表内具体标识的要素之外,该定义还允许要素可以任选地存在,不管与具体标识的那些要素相关还是不相关。因此,作为非限制性示例,“a和b中的至少一个”(或者等同地,“a或b中的至少一个”,或者等同地“a和/或b中的至少一个”)可以在一个实施方式中指代至少一个、任选地包括多于一个的a,不存在b(并且任选地包括除了b之外的要素);在另一种实施方式中,指代至少一个、任选地包括多于一个的b,不存在a(并且任选地包括除了a之外的要素);在另一实施方式中,指代至少一个、任选地包括多于一个的a和至少一个、任选地包括多于一个的b(并且任选地包括其他元素)等等。
[0229]
还应该理解的是,除非另有相反的指示,否则在本文所要求的包括多于一个步骤或行为的任何方法中,该方法的步骤或行为的次序不一定限于所记载的该方法的步骤或行为的次序。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。