生产胶原蛋白7组合物的系统和方法
1.相关公开的引用
2.本技术要求2019年3月27日提交的美国临时申请序列号62/824,671的优先权,该申请的内容通过引用全部并入本文。
发明领域
3.本公开涉及生产包含重组人胶原蛋白7和/或其功能变体的胶原蛋白7组合物的生产系统、工程化的宿主细胞和方法。
4.序列表的引用
5.本技术与电子格式的序列表一起提交。序列表以题为seqlst_21181008pct.txt的文件提供,该文件创建于2020年3月27日,大小为215,387字节。电子格式的序列表信息通过引用全部并入本文。
6.发明背景
7.胶原蛋白7(vii型胶原蛋白)是皮肤的重要组成部分,见于表皮基底膜区(bmz)中,bmz是位于皮肤的表皮层和下部真皮层之间的两层的膜。由胶原蛋白7组成的锚定纤维将表皮基底膜与乳突状真皮相连,使皮肤的表皮和真皮层保持在一起,提供结构和稳定性。
8.胶原蛋白7是一种由三个相同的α链多肽组成的同源三聚体。胶原蛋白7的α链多肽是由col7a1基因编码的,并且主要由角质细胞和成纤维细胞表达和合成。胶原蛋白7的改变与一些皮肤病况有关,如大疱性表皮松解症(epidermolysis bullosa,eb)和由针对胶原蛋白7的自身抗体引起的自身免疫性疾病,如获得性大疱性表皮松解症(epidermolysis bullosa acquisita,eba)、大疱性类天疱疮(bullous pemphigoid)、瘢痕性类天疱疮(cicatricial pemphigoid)、副肿瘤性天疱疮(paraneoplastic pemphigus)、寻常型天疱疮(pemphigus vulgaris)、儿童期慢性大疱性疾病(chronic bullous disease of childhood,cbdc)和系统性硬化症。
9.col7a1基因中的突变可导致一种被称为营养不良性大疱性表皮松解症(dystrophic epidermolysis bullosa,deb)的eb形式,这是一种罕见的儿科疾病,表现为极其脆弱且无法治愈的水疱性皮肤、四肢畸形、食道狭窄、许多其他共病以及早期死亡。根据遗传模式,deb可分类为常染色体显性deb(ddeb)或隐性deb(rdeb);后者导致deb的最严重形式。在美国,所有类型的deb的发病率估计为每百万名新生儿中有6.5人,而更严重的常染色体隐性形式的影响则是大约每百万名新生儿中有1人。
10.与胶原蛋白7的缺陷有关的皮肤病况的其他常见症状包括皮肤的荨麻疹性发疹(urticarial eruption)(荨麻疹),皮肤上的水疱(起疱)(包括表皮和表皮下起疱),慢性皮肤伤口,粘膜的严重侵蚀性病变,包括口腔或直肠粘膜、结膜、鼻咽、喉和食道粘膜的严重侵蚀性病变,以及皮肤的疼痛和瘢痕。
11.这些严重的皮肤病况和疾病(如deb)的治疗策略侧重于恢复功能性胶原蛋白7。示例性策略包括胶原蛋白7的外部(topical)和/或局部(local)给药,针对col7a1基因的基因疗法,诸如移植成纤维细胞以表达胶原蛋白7的细胞疗法,以及胶原蛋白7替代疗法,如通过
胶原蛋白7蛋白的全身给药。
12.本公开提供了用于生产胶原蛋白7组合物的生产系统、工程化的宿主细胞和方法,以恢复受试者中功能性胶原蛋白7。在一些实施方案中,胶原蛋白7组合物可用于治疗皮肤病况,例如由胶原蛋白7缺陷和/或皮肤基底膜区(bmz)中的其他缺陷引起的皮肤病况。
技术实现要素:
13.本公开提供了用于生产包含人重组胶原蛋白7(rcol7)和/或其功能变体的胶原蛋白7组合物的生产系统,其中该生产系统包括经修饰以表达人rcol7和/或其功能变体的宿主细胞。优选地,生产系统的工程化的宿主细胞经转化以表达人rcol7或其功能变体,以及至少一种可增加宿主细胞中rcol7和/或其功能变体表达的蛋白,包括氨酰脯氨酸二肽酶(也称为脯氨酸水解酶)、脯氨酰4-羟化酶(由α多肽(亚单位a)和β多肽(亚单位b)组成)、c1galt1特异性伴侣蛋白1(comsc)和/或热休克蛋白(hsp)(例如hsp 47)。优选地,宿主细胞被工程化为仅表达人脯氨酰4-羟化酶(包括α和β多肽(例如hp4ha1和hp4hb)),或组合表达hsp 47,以增加rcol7的表达。
14.在一些实施方案中,生产系统可包括多个均质的工程化的宿主细胞,其来源于表达人rcol7或其功能变体的单一细胞克隆。在其他实施方案中,生产系统可包括多个异质的工程化的宿主细胞,其来源于表达人rcol7和/或其功能变体的一个以上的细胞克隆。
15.在一些实施方案中,工程化的宿主细胞包含至少一个编码人rcol7或其功能变体的第一外源多核苷酸,以及至少一个编码可增加rcol7或其功能变体表达的蛋白的外源多核苷酸,如氨酰脯氨酸二肽酶(pepd)、脯氨酰4-羟化酶(p4h)、c1galt1特异性伴侣蛋白1(comsc)和热休克蛋白47(hsp 47)。在一些实施方案中,工程化的宿主细胞可进一步包含编码rcol7或其功能变体的第二多核苷酸。编码rcol7及其功能变体的第一和第二多核苷酸可以包含相同的核酸序列,或不同的核酸序列。在一些实施方案中,编码rcol7的多核苷酸包含密码子优化的核酸序列。
16.在一个优选的实施方案中,工程化的宿主细胞包含至少一个编码rcol7或其功能变体的第一外源多核苷酸,编码人脯氨酰4-羟化酶(p4ha)的α多肽(亚单位a)的外源多核苷酸,以及编码人脯氨酰4-羟化酶(p4hb)的β多肽(亚单位b)的外源多核苷酸。任选的是,工程化的宿主细胞可进一步包含编码rcol7或其功能变体的第二外源多核苷酸。在一些实例中,第一rcol7编码多核苷酸和第二rcol7编码多核苷酸可以具有相同的核酸序列。在其他实例中,两个rcol7编码多核苷酸具有不同的核酸序列。
17.在一些实施方案中,工程化的宿主细胞包含编码rcol7或其功能变体的一个第一和一个第二外源多核苷酸,编码人脯氨酰4-羟化酶的α多肽(亚单位a)的外源多核苷酸,编码人脯氨酰4-羟化酶的β多肽(亚单位b)的外源多核苷酸,以及编码hsp 47的外源多核苷酸。
18.在一些实施方案中,用包含编码rcol7或其功能变体的多核苷酸的表达载体和至少一个包含编码可增加rcol7或其功能变体表达的蛋白的多核苷酸的表达载体转化工程化的宿主细胞,其中该蛋白可以是氨酰脯氨酸二肽酶(pepd)、脯氨酰4-羟化酶(p4h)、c1galt1特异性伴侣蛋白1(comsc)或热休克蛋白47(hsp 47)。
19.在一个优选的实施方案中,用包含编码人rcol7或其功能变体的第一多核苷酸的
表达载体、包含编码人脯氨酰4-羟化酶的α多肽(亚单位a)的多核苷酸的表达载体和包含编码人脯氨酰4-羟化酶的β多肽(亚单位b)的多核苷酸的表达载体转化工程化的宿主细胞。任选地,工程化的宿主细胞用包含编码人rcol7或其功能变体的第二多核苷酸的表达载体进一步转化。在一些实例中,这种工程化的宿主细胞用表达编码hsp 47的多核苷酸的载体进一步转化。
20.在一些实施方案中,工程化的宿主细胞用包含编码rcol7或其功能变体的多核苷酸的表达载体转化,其中同一表达载体包含编码人脯氨酰4-羟化酶的α多肽(亚单位a)的多核苷酸和编码人脯氨酰4-羟化酶的β多肽(亚单位b)的多核苷酸。
21.在一些实施方案中,工程化的宿主细胞用包含编码rcol7或其功能变体的多核苷酸的表达载体转化,其中同一表达载体包含编码人脯氨酰4-羟化酶的α多肽(亚单位a)的多核苷酸和编码人脯氨酰4-羟化酶的β多肽(亚单位b)的多核苷酸以及编码hsp 47的多核苷酸。
22.在一些实施方案中,工程化的宿主细胞是哺乳动物细胞,例如,人、小鼠、大鼠或中国仓鼠细胞(cho)。在一个优选的实施方案中,细胞是衍生自cho细胞系的哺乳动物细胞。
23.工程化的宿主细胞可以在无血清的蛋白生产条件下培养。该蛋白生产条件可包括一种或多种试剂,如营养剂和/或选择性试剂的添加。
24.在本公开的另一个方面,提供了生产胶原蛋白7组合物的方法,该方法包括(1)向哺乳动物细胞中引入至少一个编码rcol7或其功能变体的外源多核苷酸、编码脯氨酰4-羟化酶的α多肽(亚单位a)的外源多核苷酸和编码脯氨酰4-羟化酶的β多肽(亚单位b)的外源多核苷酸;(2)通过分离那些表达选择性标记物的水平足以使其在选择性试剂存在下生长时存活的转化体,选择所述哺乳动物细胞的稳定的单克隆转化体;(3)在允许表达rcol7或其功能变体和其他多肽的生长条件下培养转化体,以产生蛋白组合物;以及(4)收获细胞培养基并纯化蛋白组合物。
25.在一些实施方案中,该方法进一步包括将编码hsp 47的外源多核苷酸引入步骤(1)的哺乳动物细胞中。
26.在一些实施方案中,生长条件是无血清的,并包括添加一种或多种试剂,如营养剂和/或选择性试剂。
27.本公开的另一个方面涉及包含人rcol7和/或其功能变体的胶原蛋白7组合物,以及包含胶原蛋白7组合物和至少一种药学上可接受的载体的药物组合物或其制剂。在一些实施方案中,药物组合物或制剂适合于对有需要的受试者进行全身给药。受试者可能带有col7a1基因中的缺陷。在一些实例中,受试者可被诊断为rdeb。
28.在一些实施方案中,由本生产系统生产的胶原蛋白7组合物可含有包含seq id no.:1的多肽的天然存在的人胶原蛋白7蛋白,其功能变体,或天然存在的胶原蛋白7蛋白和其功能变体的组合。
29.在一些实施方案中,由本生产系统、宿主细胞和方法生产的胶原蛋白7组合物可用于将有需要的受试者的胶原蛋白7恢复到功能水平。
30.在另一个方面,本公开提供了预防、缓解和抑制受试者皮肤病况进展的方法,该方法包括向受试者施用药物组合物,该药物组合物包含含有rcol7和/或其功能变体的胶原蛋白7组合物。在一些实施方案中,所述病况是与col7a1基因中的突变有关的皮肤病况,如
rdeb。
31.附图简述
32.图1是来自b1stbstb细胞克隆第一轮候选者()培养(在32℃下)第6天的细胞的western印迹的凝胶图像。
33.图2a是32℃下第二轮选择的细胞克隆培养第6天的细胞的western印迹的凝胶图像。
34.图2b是37℃下第二轮选择的细胞克隆培养第6天的细胞的western印迹的凝胶图像。
35.图3是来自b1stbstbsth2cp13和b1stbstbsth2cp15细胞克隆在32℃和37℃下培养第5天的细胞的western印迹的凝胶图像。
36.图4是来自细胞克隆b1stbstbcp03(主细胞库(mcb))的rcol7的southern印迹分析的代表图像,用以确认身份。用hindiii/xbai酶消化来自rcol7 mcb(泳道2)和非转染的cho细胞(泳道3)的基因组dna,并用rcol7编码序列杂交探针进行southern印迹分析。杂交带的预期大小为8.9kb。泳道1:hindiii大小标记。
37.图5是参考胶原蛋白7(泳道2)和mcb衍生的rcol7组合物(泳道3)的western印迹分析的图像。泳道1:分子量梯度。
38.图6显示了层粘连蛋白-332的结合kd与参考胶原蛋白7以及几种mcb衍生的rcol7组合物中y1033的百分比分数的关系图。分析表明,层粘连蛋白332对rcol7y1033含量的结合应答缺乏关联性。
39.图7是使用角质细胞与参考胶原蛋白7和mcb衍生的rcol7组合物进行的伤口愈合试验。分析中还包括一个bsa对照样品。
40.图8证明了在b1stbstbsthcp13-cp01(13-01)和b1stbstbsthcp13-cp03(13-03)两个克隆中均存在完整的转基因转录物。使用对胶原蛋白7的nc1和th3区域特异的探针对转录物进行印迹。
41.图9描述了克隆b1stbstbsthcp13-cp01和b1stbstbsthcp13-cp03中胶原蛋白7的细胞内染色。
42.图10显示了细胞克隆b1stbstbsthcp13-cp01和b1stbstbsthcp13-cp03的hcp定量分析。
43.图11显示了通过sds-page鉴定的来自细胞克隆b1stbstbsthcp13-cp01(泳道8)和b1stbstbsthcp13-cp03(泳道7)的rcol7组合物。泳道1是mw标准,并且泳道2-6是测定对照。
44.发明的详细描述
45.下文阐述了本公开的一个或多个实施方案的细节。尽管在本公开的实践或测试中可以使用与本文描述的材料和方法相似或等同的任何材料和方法,现在描述了优选的材料和方法。本公开的其他特征、目的和优点将从描述中显而易见。在描述中,单数形式也包括复数,除非上下文另有明确规定。除非另有定义,本文使用的所有技术和科学术语的含义与本公开所属领域的普通技术人员通常理解的含义相同。如果发生冲突,则以本文为准。
46.本公开涉及生产胶原蛋白7组合物的生产系统、工程化的宿主细胞和方法。胶原蛋白7组合物可包含人rcol7和/或其功能变体。优选地,生产系统包括用于表达人重组胶原蛋白7(rcol7)和/或其功能变体的基因工程化的宿主细胞。宿主细胞可以通过遗传修饰以包
含编码重组胶原蛋白7和/或其功能变体的多核苷酸。宿主细胞可以用一个或多个表达载体进行转化,所述表达载体包含编码重组胶原蛋白7或其功能变体的多核苷酸。根据本公开,宿主细胞被进一步转化以表达一种或多种可增加宿主细胞中rcol7表达的蛋白。此类蛋白可包括脯氨酰4-羟化酶、氨酰脯氨酸二肽酶、伴侣蛋白和/或热休克蛋白,例如hsp 47。
47.本公开提供了包含rcol7(例如,人rcol7)及其功能变体的胶原蛋白7组合物,其可由本公开的生产系统和宿主细胞生产。此外,还提供了包含本公开的胶原蛋白7组合物的药物组合物和/或制剂。
48.本公开进一步提供了用于产生生产胶原蛋白7组合物的细胞表达系统的载体和方法。在本公开的另一个方面,提供了用包含rcol7及其功能变体的药物组合物和/或制剂来抑制、缓解或预防有需要的受试者的皮肤病况的进展的方法。
49.定义
50.为方便起见,这里提供了说明书、实施例和权利要求中使用的某些术语。除非另有定义,否则本文使用的所有技术和科学术语的含义与相关领域普通技术人员通常理解的含义相同。以下术语和短语的含义如本文所定义。
51.如本文所用,“胶原蛋白7”(也被称为c7、col7、vii型胶原蛋白和胶原蛋白vii)是指由三个相同的由col7a1基因编码的α链多肽组成的胶原蛋白。每个α链多肽由2944个氨基酸组成,包括一个中央胶原蛋白三螺旋段(th)(成熟肽中的残基1254-2783),两侧是一个大的整体氨基端非胶原蛋白nc1结构域(残基17-1253)和一个较小的羧基端非胶原蛋白nc2结构域(残基2784-2944)。人胶原蛋白7的全长α链多肽包含seq id no.:1(ref.no.:np_000085)的氨基酸序列,该序列由seq id no.:2(ref.no.:nm_000094)的核酸序列编码。
52.胶原蛋白7是锚定纤维的主要成分,它在包括皮肤、口腔粘膜和宫颈在内的一些组织的上皮层和间质层之间的界面处充当连接复合物(chung等人,dermatol.clin.,2010,28(1):93-105)。皮肤中的锚定纤维位于基底层下面的真皮-表皮基底膜区(bmz),确保表皮bmz和真皮之间的连接,并有助于皮肤的完整性(varki等,j med genet 2007,44:181-192)。胶原蛋白7形成了二硫键稳定的二聚聚集体的非交错排列(burgenson等人,ann n y acad sci.,1985,460:47-57)。应该注意的是,如本文所用,“胶原蛋白7”包括其功能变体,即使没有明确述及。
53.如本文所用,术语“多肽”是指通过肽键连接在一起的氨基酸序列链。该术语用于指任何长度的氨基酸链,但本领域的普通技术人员将理解该术语不限于长链,并且可以指包含通过肽键连接在一起的两个氨基酸的最小链。如本领域技术人员所知,多肽可以被加工和/或修饰。如本文所用,“蛋白”是指作为一个独立的单元发挥作用的一种或多种多肽。在某些情况下,术语“多肽”和“蛋白”可以互换使用。如本文所用,术语“氨基酸”是指通常用于形成蛋白和多肽的20种天然氨基酸中的任何一种,或这些氨基酸的类似物或衍生物。“重组蛋白”或“重组多肽”是指利用分离的核酸分子或重组核酸分子表达的蛋白或多肽分子。“分离的”蛋白或核酸分子是指从其自然环境中移除的蛋白。如果感兴趣的蛋白或核酸分子按重量计算至少有5%、10%、25%、30%、40%、50%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的纯度,则分离的蛋白或核酸分子可以是“至少”某种程度的纯度。
54.如本文所用,术语“变体”或“功能变体”是指基本上保持野生型胶原蛋白7的生物
功能或活性的野生型胶原蛋白7蛋白的任何衍生物。
55.胶原蛋白7的功能变体可包括保持胶原蛋白7的生物功能(如在人类皮肤的表皮和真皮层之间形成锚定纤维的能力)的多肽。胶原蛋白7变体可以与野生型胶原蛋白7基本同一。胶原蛋白7变体包括但不限于相对于野生型胶原蛋白7进行化学修饰和/或相对于野生型胶原蛋白7含有一个或多个氨基酸序列改变的胶原蛋白7多肽。在一些实施方案中,胶原蛋白7的变体可包括与人胶原蛋白7(野生型)的氨基酸序列具有至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的多肽。作为一个非限制性的实例,胶原蛋白7变体可以包括与seq id no.:1的氨基酸序列具有至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的多肽。
56.胶原蛋白7蛋白的变体还可以包括具有来自野生型胶原蛋白7(例如seq id no.:1)氨基酸序列的氨基酸修饰(例如删除、添加或替换,例如保守性替换),和/或氨基酸残基的其他化学修饰的多肽。在一些实施方案中,胶原蛋白7的变体与人胶原蛋白7相差约1-50个氨基酸残基,或约1-30个氨基酸残基,或约1-20个氨基酸残基,或约1-10个氨基酸残基。胶原蛋白7的变体可以与人胶原蛋白7相差1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45或50个氨基酸残基。作为一个非限制性的实例,变体可以与seq id no.1的氨基酸序列相差1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45或50个氨基酸残基。“保守性氨基酸替换”是指氨基酸残基被具有类似侧链的氨基酸残基替换。本领域已经定义了具有类似侧链的氨基酸残基家族。这些家族包括具有碱性侧链的氨基酸(如赖氨酸、精氨酸、组氨酸)、酸性侧链(如天冬氨酸、谷氨酸)、不带电的极性侧链(如甘氨酸、天冬酰胺、谷氨酸、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸)、β-支链侧链(如苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。氨基酸残基的化学修饰包括但不限于糖基化、磷酸化、酰胺化、豆蔻酰化、羟基化、磷酸泛酰巯基乙胺连接(phosphopantetheine attachment)、甲基化和异戊二烯化。
57.根据本公开,胶原蛋白7的功能变体还可以包括胶原蛋白7的“功能性片段”,其是指人胶原蛋白7多肽的一部分,是比全长蛋白短但保持其生物功能(如在人类皮肤的表皮和真皮层之间形成锚定纤维的能力以及结合胶原蛋白4和层粘连蛋白-332的能力)的多肽。人胶原蛋白7的功能片段可不包括胶原蛋白7的全部2,944个氨基酸残基。例如,一个功能片段可以包括胶原蛋白7的nc1结构域和/或nc2结构域的全部或部分,例如,功能片段可以是没有全部或部分中央胶原蛋白螺旋结构域的胶原蛋白7。
58.如本文所用,术语“胶原蛋白7组合物”是指包含多个重组胶原蛋白7α多肽、多个胶原蛋白7等价多肽或多个其功能变体和片段的组合物。或者,胶原蛋白7组合物可以包括多种重组胶原蛋白7α多肽、多种胶原蛋白7等价多肽以及多种其功能变体和片段的混合物。在一些实例中,胶原蛋白7组合物包含具有seq id no.:1的氨基酸序列的胶原蛋白7α多肽。胶原蛋白7组合物可由本公开的经工程化以表达rcol7和/或其功能变体的表达系统和宿主细胞生产。胶原蛋白7组合物可从宿主细胞的培养基中纯化出来。
59.如本文所用,术语“多核苷酸”和“核酸分子”可互换使用,是指由5
′
和3
′
碳原子之间的磷酸二酯键连接在一起的核苷酸的聚合物。多核苷酸可以包括但不限于rna(核糖核酸
分子)(如mrna)和dna(脱氧核糖核酸分子)(如来自真核生物mrna的cdna,来自真核生物(如哺乳动物)dna的基因组dna序列,甚至是合成的dna序列)。该术语还包括含有任何已知的dna或rna的碱基类似物的序列。这里用来描述核酸分子的术语“重组”是指基因组来源、cdna来源、半合成来源或合成来源的多核苷酸,由于来其源或操作的原因,它(1)与自然界中与之关联的全部或部分多核苷酸不关联;和/或(2)与自然界中与之连接的多核苷酸以外的多核苷酸连接。用于蛋白或多肽的术语“重组”是指通过重组多核苷酸的表达产生的多肽。根据本公开,编码胶原蛋白7的多核苷酸可以包括seq id no.:2的核酸序列。该序列可以是密码子优化的核酸序列,并且在一个实施方案中,这种密码子优化可以增加甘氨酸的含量。
60.术语“基本同一”是指当优化比对时,例如使用下面描述的方法比对时,核酸或氨基酸序列与第二个核酸或氨基酸序列具有至少60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性。“基本上的同一性”可用于指各种类型和长度的序列,如全长序列、功能域、编码和/或调节序列、外显子、内含子、启动子和基因组序列。本领域技术人员能够以各种方式确定两个多肽或核酸序列之间的百分比序列同一性,例如,使用公开可得的计算机软件,如blast(基本局部比对检索工具(basic local alignment search tool)(altschul,s.f.,w.gish等人j mol biol.,1990,215:403-10)、blast-2、blast-p、blast-n、blast-x、wu-blast-2、align、align-2、clustal或megalign(dnastar)。此外,本领域技术人员可以确定测量比对的适当参数,包括在所比较的序列长度上实现最大对齐所需的任何算法。可以理解的是,在比较dna序列和rna序列时,为了确定序列的同一性,胸腺嘧啶核苷酸等同于尿嘧啶核苷酸。保守性替换通常包括在以下组别之一内的替换:甘氨酸、丙氨酸;缬氨酸、异亮氨酸、亮氨酸;天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺;丝氨酸、苏氨酸;赖氨酸、精氨酸;以及苯丙氨酸、酪氨酸。
61.多核苷酸可包括约30至约200,000个核苷酸(例如30至50,30至100,30至250,30至500,30至1000,30至1500,30至3000,30至5000,30至7000,30至10000,30至25000,30至50,000,30至70,000,100至250,100至500,100至1,000,100至1500,100至3,000,100至5,000,100至7,000,100至10,000,100至25,000,100至50,000,100至70,000,100至100,000,500至1,000,500至2,000,500至3,000,500至5,000,500至7,000,500至10,000,500至25,000,500至50,000,500至70,000,500至100,000,1,000至1,500,1,000至2,000,1,000至3,000,1,000至5,000,1,000至7,000,1,000至10,000,1,000至25,000,1,000至50,000,1,000至70,000,1,000至100,000,1,500至3,000,1,500至5,000,1,500至7,000,1,500至10,000,1,500至25,000,1,500至50,000,1,500至70,000,1,500至100,000,2,000至3,000,2,000至5000,2,000至7000,2,000至10,000,2,000至25,000,2,000至50,000,2,000至70,000,2,000至100,000,5,000至15,000,以及5,000至20,000个核苷酸)。
62.编码多肽的多核苷酸可以被化学修饰。如本文所用,术语“修饰”可包括核苷碱基的任何化学修饰。多核苷酸可包含至少一种化学修饰的核苷,胞苷修饰、鸟苷修饰和/或胸苷修饰。多核苷酸可包含2、3、4、5、6、7、8、9、10或更多的化学修饰的核苷。
63.如本文所用,术语“载体”是指病毒或非病毒的、原核或真核的脱氧核糖核酸、核糖核酸或核酸类似物,其能够携带另一种核酸分子,例如,编码重组胶原蛋白7或其功能变体的多核苷酸。载体可以携带核酸分子进入细胞,称为“宿主细胞”,从而使所述核酸分子的全
部或部分被转录或表达。载体通常被组装成来自不同病毒、细菌或哺乳动物基因的元件的组合。载体包含各种编码和非编码序列,包括编码选择性标记的序列(如抗生素抗性基因)、有利于其在细菌中繁殖的序列或一个或多个仅在某些细胞类型中表达的转录单元。例如,哺乳动物表达载体通常既包含有利于载体在细菌中繁殖的原核序列,又包含一个或多个仅在真核细胞中表达的真核转录单元。本领域技术人员可以理解,表达载体的设计可以取决于诸如要转化的宿主细胞的选择、所需蛋白的表达水平等因素。本文使用的合适载体还可以包含选择性标记基因,该基因编码宿主细胞在特定条件下生长和存活所必需的产物,帮助选择向其引入该载体的宿主细胞。典型的选择基因可以包括,但不限于,编码赋予对抗生素、药物或毒素(例如,四环素、氨苄青霉素、新霉素、透明霉素等)的抗性的蛋白的基因。表达载体可以是细菌质粒、噬菌体、酵母质粒、植物病毒或哺乳动物细胞病毒,如腺病毒、逆转录病毒或本领域已知的任何其他载体。合适的载体包括,例如,质粒、噬菌体、黏粒和病毒载体。
64.可使用本领域技术人员已知的标准方法构建含有本文所述核酸序列的重组表达载体。这些方法包括但不限于体外重组技术、合成技术和体内重组/基因重组。方法的选择取决于具体核苷酸片段的性质,并且可由本领域的技术人员确定。
65.如本文所用,术语“转化”和“转染”包括通过本领域已知的一些技术将核酸(如载体)引入细胞中。转化和转染技术包括但不限于磷酸钙或氯化钙共沉淀、deae-葡聚糖介导的转染、脂染剂、电穿孔、显微注射和病毒介导的转染。本领域的技术人员了解基于宿主细胞/载体组合的合适转化和转染方法。对于重组蛋白的长期高产率生产,可能优选重组蛋白的稳定表达。可以对稳定表达重组蛋白的宿主细胞进行工程化。在一些实例中,术语“超级转染”是指用多个外源多核苷酸和载体转染细胞,如2、3、4、5个或更多种外源多核苷酸和载体。
66.如本文所用,术语“宿主细胞”是指能够表达外源蛋白的任何活细胞,如表达载体编码的蛋白。宿主细胞可以是重组的表达载体可以被引入其中的原核细胞或真核细胞。术语“宿主细胞”不仅指特定的目标细胞,还指特定目标细胞的后代或潜在后代。因为突变或环境影响可导致后代中发生某些改变,这种后代事实上可与母细胞不相同,但仍包括在本文所用术语的范围内。示例性的宿主细胞可以来自酵母、真菌、昆虫或哺乳动物系统,但不限于此选择。合适的宿主细胞可包括原代或转化的细胞系,包括但不限于成纤维细胞、角质细胞、cho、hek293、c127、vero、bhk、hela、cos、mdck等。本领域技术人员已知其他合适的宿主细胞。宿主细胞可能调节载体中所包含的包含编码序列的转化的核酸序列的表达,并能够以特定方式修饰和加工载体序列中编码的基因产物。修饰,包括但不限于糖基化、磷酸化和蛋白产物的加工,可能对蛋白的功能很重要。
67.如本文所用,术语“生产系统”或“表达系统”是指可以生产感兴趣的多肽或蛋白的系统。生产系统可以包括可表达感兴趣的多肽或蛋白例如胶原蛋白7的细胞。在本公开的背景下,生产系统包括经工程化以表达rcol7和/或其功能变体的宿主细胞。所述生产系统可进一步包括适合经工程化以表达rcol7和/或其功能变体的宿主细胞生长的反应器。本文所用的生产反应器是指用于生产感兴趣的多肽或蛋白,即rcol7的最终生物反应器。反应器可以是任何尺寸。作为非限制性的实例,反应器可以是至少500ml,至少1升,并且可以是2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、200、250、300、350、400、450、500、600、
700、800、900、1,000、2,500、3,000、4,000、5,000、6,000、7,000、8,000、9,000、10,000升或更多,或两者之间的任何体积。大规模细胞培养生产反应器的体积通常为至少20升、或至少50升、或至少100升、或至少200升、或至少300升、或至少400升、或至少500升,或可以是1000、2500、3000、4000、5000、6000、7000、8000、10000、12000升或更大,或任何介于两者之间的体积。反应器可以由适合在本公开的培养条件下容纳悬浮在培养基中的细胞培养物的任何材料组成,包括玻璃、塑料或金属。生产反应器的条件通常在细胞培养期间是受控制的,以确保细胞密度和活力。这些条件包括但不限于ph、温度、湿度和co2供应。如本文所用,术语“细胞密度”是指在给定体积的培养基中存在的细胞数量。如本文所用,“细胞活力”是指培养中的细胞在给定的培养条件或实验变化设定下的生存能力。本文所使用的术语也指在某一特定时间,相对于当时培养物中的细胞总数(活的和死的)而言,活的细胞的部分。
68.如本文所用,术语“生物反应器"是指用于培养宿主细胞以表达胶原蛋白7组合物的反应器。生物反应器可以是传统的非一次性反应器或一次性的生物反应器。
69.如本文所用,待治疗的“患者”或“受试者”可以指人或非人哺乳动物。在本公开的上下文中,术语“患者”或“受试者”是指患有皮肤病症,例如大疱性表皮松解症(例如营养不良性大疱性表皮松解症)的任何受试者,优选哺乳动物,并且更优选人。
70.如本文所用,术语“疾病”或“病症”是指由各种原因如自身免疫缺陷、遗传缺陷或环境应激引起的生物体的部分、器官或系统的病理状况,并且特征在于一组可鉴别的体征或症状。“皮肤病”或“皮肤病症”是指皮肤的临床状况,例如影响受试者皮肤的病况,例如大疱病、炎性皮肤状况或皮肤癌。大疱(起疱)病症是一组异质性病症,其特征在于主要在皮肤和粘膜上的增加的充满流体的起疱病变(大疱)。大疱的大小可以变化,并且起疱性疾病的具体症状和严重性因人而异,即便在具有相同病症的个体中也是如此。示例性的起疱性病症包括但不限于获得性大疱性表皮松解症(eba)和先天性大疱性表皮松解症(eb),例如营养不良性eb。eb包括一组遗传性结缔组织疾病,其由于遗传缺陷而在皮肤和粘膜上产生水疱。营养不良性大疱性表皮松解症(deb)主要由col7a1基因(其编码胶原蛋白7)内的突变引起。迄今为止,已经报道了col7a1中的约400种突变(van den akker等人,hum mutat.2011,32(10):1100-1107)。deb具有两种遗传模式:常染色体显性(ddeb)和常染色体隐性(rdeb)。ddeb涉及胶原蛋白7表达的降低,这通常是由胶原蛋白α1(vii)链的胶原蛋白结构域内的甘氨酸取代引起的。rdeb通常是严重的,并且由胶原蛋白7表达的缺失或显著降低引起,最主要是由于col7a1基因中的提前终止密码子(ptc)引起的。
71.如本文所用,“治疗”患者或“治疗”或“去治疗”是指向受试者施用药物组合物,使得疾病的至少一种症状被逆转、治愈、减轻或减少。“治疗”受试者的eb,例如deb(ddeb和rreb)或或去治疗eb是指给予eb患者药物组合物,例如包含rcol7及其功能变体的胶原蛋白7组合物,使得eb病的至少一种症状被逆转、治愈、减轻或降低。可作为治疗目标的eb病的症状包括但不限于起疱;病变(lesion)(例如,直肠、肛门、尿道病变和/或粘膜病变和/或鳞状上皮组织病变);胃肠道的病变;挛缩(contractures),例如(例如四肢的)屈曲挛缩(flexion contractures);手或脚的假并指(pseudosyndactyly);癌(carcinoma)(例如,鳞状细胞癌);大疱形成(bulla formation);指甲和/或牙齿畸形;收缩的食道;眼病症、贫血、营养不良;继发性皮肤感染;败血症;声音嘶哑;尿道狭窄(urethral stenosis);包茎(phimosis);角膜瘢痕形成(corneal scarring);吸收不良(malabsorption);和不能茁壮
成长(failure to thrive)。
72.如本文所用,术语“预防”(preventing、prevent或prevention)是指例如在不希望的病况(例如宿主动物的疾病或其它不希望的状态)的临床表现之前施用组合物,以保护宿主免于发展不希望的病况,例如预防疾病的至少一种症状。“预防”疾病也可称为“预防(prophylaxis)”或“预防性治疗(prophylactic treatment)”。在本公开的上下文中,可以预防与eb相关的一种或多种症状,例如瘢痕形成。eb患者的瘢痕形成可导致一种或多种下列症状:挛缩,例如(例如四肢的)屈曲挛缩;手或脚的假并指;癌(例如,鳞状细胞癌);直肠病变;粘膜病变;形成大疱;手外伤后的大疱形成;指甲或牙齿畸形;收缩的食道;眼病症、贫血、营养不良;继发性皮肤感染;败血症;声音嘶哑;尿道狭窄;包茎;角膜瘢痕形成;吸收不良;和不能茁壮成长。
73.如本文所用,术语“治疗有效量“是指在必要剂量和时间段下有效实现所需治疗结果的量。组合物的治疗有效量可根据诸如受试者的疾病状态或年龄、性别和体重的因素而变化。治疗有效量也是组合物的治疗有益效果超过任何毒性或有害效果的量。在本公开的上下文中,当作为任何确定的治疗方案的一部分施用时,rcol7的有效量产生了统计学可测量的结果改善,如由与并发症相关的至少一种临床参数所证明的。
74.本公开的组合物可以与另一种药剂或疗法组合施用。如本文所用,术语“组合”是指使用两种或更多种药剂或疗法来治疗同一患者,其中药剂或疗法的使用或作用在时间上重叠。在本公开的上下文中,包含rcol7或其功能变体的药物组合物可与一种或多种预防和治疗皮肤病症如deb的药剂组合使用。所述药剂或疗法可同时(例如,作为向患者施用的单一制剂或作为同时施用的两种独立制剂)或以任何顺序依次施用。在一些实施方案中,当第二药物或治疗的递送开始时,第一药物或治疗的递送仍然发生,使得在施用方面存在重叠。这在本文中有时称为“同时”或“并行递送”。在其它实施方案中,一种药剂或治疗的递送在另一种药剂或治疗的递送开始之前结束。在任一情况的一些实施方案中,由于组合施用,治疗更有效。例如,第二种治疗更有效,例如,与如果在没有第一种治疗的情况下施用第二种治疗所将看到的相比,用较少的第二种治疗看到等效的效果,或第二种治疗更大程度地减轻症状,或者用第一种治疗看到类似情况。在一些实施方案中,递送使得与病症相关的症状或其他参数的减少大于在不存在另一种治疗的情况下递送一种治疗所观察到的减少。两种治疗的效果可以是部分相加的、完全相加的或大于相加的。递送可以是这样的,即当递送第二治疗时,递送的第一治疗的效果仍然是可检测的。
75.如本文所用,术语“药学上可接受的”是指与制剂的其它成分相容,并且对其接受者无害。
76.用于生产胶原蛋白7组合物的生产系统和细胞
77.在本公开的一个方面,提供了用于制备包含人rcol7和/或其功能变体的胶原蛋白7组合物的生产系统,其中所述生产系统包括用于表达人rcol7和/或其功能变体的宿主细胞。宿主细胞被遗传修饰以表达rcol7,并且在一些实施方案中,被进一步基因工程化以表达至少一种可以增加宿主细胞中rcol7表达的蛋白。所述蛋白可包括但不限于:氨酰脯氨酸二肽酶(也称为肽酶d、脯氨酸二肽酶和l-脯氨酸水解酶、pepd)或其功能变体、脯氨酰4-羟化酶(也称为原胶原蛋白-脯氨酸和2-酮戊二酸4-双加氧酶(2-oxoglutarate 4-dioxygenase),p4h)或其功能变体、c1galt1特异性伴侣蛋白1(也称为核心1β3-半乳糖基转
移酶-特异性伴侣蛋白、β1,3-半乳糖基转移酶2和cosmc)或其功能变体、赖氨酰羟化酶(lh)或其功能变体、糖基转移酶(gtf)或其功能变体,和热休克蛋白或其功能变体(例如hsp47)。优选地,用于增加宿主细胞中rcol7表达的蛋白是人脯氨酰4-羟化酶(hp4h),其包括人脯氨酰4-羟化酶(例如hp4ha1)的α多肽(亚单位a)或其功能变体和人脯氨酰4-羟化酶(即hp4hb)的β多肽(亚单位b)或其功能变体,和hsp 47或其功能变体。
78.在一些实施方案中,转化或转染本公开生产系统的宿主细胞以表达rcol7α链多肽和至少一种可增加宿主细胞中rcol7表达的蛋白,选自氨酰脯氨酸二肽酶(pepd)、脯氨酰4-羟化酶(p4h)、赖氨酰羟化酶(lh)、糖基转移酶(gtf)、c1galt1特异性伴侣蛋白1(cosmc)或热休克蛋白hsp 47或其功能变体。优选地,用包含人脯氨酰4-羟化酶的α多肽(亚单位a)(例如hp4ha1)和人脯氨酰4-羟化酶的β多肽(亚单位b)(即hp4hb)的人p4h和/或hsp 47转化宿主细胞。
79.在一些实施方案中,本公开的生产系统的宿主细胞经基因工程化以产生人rcol7和/或其功能变体。人rcol7可包含由seq id no.:1所示的氨基酸序列。rcol7还可具有与seq id no.:1所示的氨基酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%同一的氨基酸序列。人胶原蛋白7的功能变体可与seq id no.:1所示序列具有至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多氨基酸差异。人胶原蛋白7的功能变体可包含具有seq id no.:1的部分氨基酸序列的片段。
80.在一些实施方案中,rcol7可由包含seq id no.:2所示的核酸序列的多核苷酸编码。在一些实施方案中,编码rcol7或其功能变体的多核苷酸可包含与seq id no.:2的核酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%的核酸序列,或至少约97%,或至少约98%,或至少约99%同一的核酸序列。
81.在一些实施方案中,本公开的生产系统的宿主细胞可以被基因工程化以进一步表达氨酰脯氨酸二肽酶(pepd)。氨酰脯氨酸二肽酶是由pepd基因编码的胞质亚氨基二肽酶,其可水解具有c-末端脯氨酸或羟脯氨酸残基的二肽或三肽。该酶在从主要来源于胶原蛋白降解产物的亚氨基二肽回收脯氨酸用于胶原蛋白和其它含脯氨酸的蛋白的再合成中起重要作用。该酶可以促进一些宿主细胞中重组胶原蛋白的合成。在一些实施方案中,本公开的生产系统的宿主细胞可以被修饰以表达氨酰脯氨酸二肽酶或其功能变体。氨酰脯氨酸二肽酶可以是哺乳动物氨酰脯氨酸二肽酶或其功能变体,例如人氨酰脯氨酸二肽酶、小鼠氨酰脯氨酸二肽酶、大鼠氨酰脯氨酸二肽酶或仓鼠氨酰脯氨酸二肽酶。作为非限制性实例,氨酰脯氨酸二肽酶是人氨酰脯氨酸二肽酶,其包含seq id no.:3的氨基酸序列。氨酰脯氨酸二肽酶的功能变体可以具有与seq id no.:3的氨基酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%的氨基酸序列,或至少约99%同一的氨基酸序列。
82.在一些实施方案中,氨酰脯氨酸二肽酶可以由包含seq id no.:4所示的核酸序列的多核苷酸编码。编码氨酰脯氨酸二肽酶或其功能变体的多核苷酸可包含与seq id no.:4
的核酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%的核酸序列,或至少约97%,或至少约98%,或至少约99%同一的核酸序列。
83.在一些实施方案中,本公开的生产系统的宿主细胞可经基因工程化以进一步表达脯氨酰4-羟化酶(p4h)。脯氨酰4-羟化酶是一种参与前胶原蛋白中脯氨酰残基羟基化(将原胶原蛋白加工成成熟胶原蛋白的重要步骤)的酶。在一些实施方案中,本公开的生产系统的宿主细胞可被修饰以表达脯氨酰4-羟化酶或其功能变体。脯氨酰4-羟化酶可以是哺乳动物脯氨酰4-羟化酶或其功能变体,例如人脯氨酰4-羟化酶、小鼠脯氨酰4-羟化酶、大鼠脯氨酰4-羟化酶或仓鼠脯氨酰4-羟化酶。哺乳动物脯氨酰4-羟化酶是α2β2四聚体,由两个相同的α(alpha)多肽(亚单位a)和两个β(beta)多肽(亚单位b)组成。α多肽(p4hα或p4ha)含有肽-底物结合结构域和酶活性位点。所述α多肽可以是α多肽i(alpha-1、p4hα(i)、亚单位a1或p4ha1)或其同工型、α多肽ii(alpha-2、p4hα(ii)、亚单位a2或p4ha2)或其同工型、或α多肽iii(alpha-3、p4hα(iii)、亚单位a3或p4ha3)或其同工型。
84.在一些实施方案中,本公开的生产系统的宿主细胞被工程化以表达包含两个α多肽(亚单位a)和两个β多肽(亚单位b)的人脯氨酰4-羟化酶或其功能变体。人脯氨酰4-羟化酶的α多肽可以是α多肽1、α多肽2或α多肽3或其同工型或功能变体。α多肽1(alpha-1)可包含选自seq id no.:5、7和9的氨基酸序列。α多肽2(alpha-2)可包含选自seq id no.:11和13的氨基酸序列。α多肽3(α-3)可包含选自seq id no.:15和17的氨基酸序列。所述β多肽可包含seq id no.:19的氨基酸序列。在一些实施方案中,α多肽1可由包含选自seq id no.:6、8和10的核酸序列的多核苷酸编码。α多肽2可由包含选自seq id no.:12和14的核酸序列的多核苷酸编码。α多肽3可由包含选自seq id no.:16和18的核酸序列的多核苷酸编码。所述β多肽可由包含seq id no.:20所示的核酸序列的多核苷酸编码。
85.脯氨酰4-羟化酶的α-1多肽(亚单位a1)的功能变体可具有与seq id no.:5、7和9给出的任何氨基酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%同一的氨基酸序列。脯氨酰4-羟化酶的β多肽(亚单位b)的功能变体可具有与seq id no.:19的氨基酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%的氨基酸序列、或至少约97%、或至少约98%、或至少约99%同一的氨基酸序列。
86.作为非限制性实例,本公开的生产系统的宿主细胞经工程化以表达由两个α-1多肽(亚单位a1,均包含选自seq id no.:5、7和9的氨基酸序列)和两个β多肽(亚单位b,均包含seq id no.:19的氨基酸序列)组成的人脯氨酰4-羟化酶。
87.在一些实施方案中,脯氨酰4-羟化酶的α-1多肽(亚单位a1)可由包含选自seq id no.:6、8和10的核酸序列的多核苷酸编码。在一些实施方案中,编码α-1多肽或其功能变体的多核苷酸可包含与seq id no.:6、8或10给出的任何核酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%同一的核酸序列。在一些实施方案中,脯氨酰4-羟化酶的β多肽(亚单位b)可由包含seq id no.:20
所示的核酸序列的多核苷酸编码。在一些实施方案中,编码β多肽或其功能变体的多核苷酸可包含与seq id no.:20的核酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%的核酸序列、或至少约96%、或至少约97%、或至少约98%、或至少约99%同一的核酸序列。
88.c1galt1特异性伴侣蛋白1(comsc)作为分子伴侣用于胶原蛋白折叠、稳定性和活性。在一些实施方案中,本公开的生产系统的宿主细胞可被修饰以表达c1galt1特异性伴侣蛋白1或其功能变体。c1galt1特异性伴侣蛋白1可以是哺乳动物来源的,例如但不限于人、小鼠、大鼠或仓鼠。作为非限制性实例,宿主细胞经修饰以表达包含seq id no.:21的氨基酸序列的c1galt1特异性伴侣蛋白1。c1galt1特异性伴侣蛋白1的功能变体可具有与seq id no.:21的氨基酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%的氨基酸序列、或至少约98%或至少约99%同一的氨基酸序列。
89.在一些实施方案中,c1galt1特异性伴侣蛋白1多肽可由包含seq id no.:22所示核酸序列的多核苷酸编码。在一些实施方案中,编码c1galt1特异性伴侣蛋白1多肽或其功能变体的多核苷酸可包含与seq id no.:22的核酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%同一的核酸序列。
90.热休克蛋白47(也称为丝酶抑制蛋白()serpin)h1和胶蛋白(colligin))是一种独特的胶原蛋白特异性伴侣蛋白(nagata等人,trends biochem sci,1996,21:22-26综述),其特异性结合胶原蛋白多肽以促进胶原蛋白折叠、装配和胞内转运。在一些实施方案中,本公开的生产系统的宿主细胞可以经修饰以表达hsp 47或其功能变体。hsp 47可以是哺乳动物来源的,例如但不限于人、小鼠、大鼠或仓鼠。作为非限制性实例,宿主细胞经修饰以表达包含seq id no.:23的氨基酸序列的人hsp 47。hsp 47的功能变体可以具有与seq id no.:23的氨基酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%同一的氨基酸序列。
91.在一些实施方案中,hsp 47多肽可以由包含seq id no.:24所示的核酸序列的多核苷酸编码。在一些实施方案中,编码hsp 47或其功能变体的多核苷酸可以包含与seq id no.:24的核酸序列至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%同一的核酸序列。上述序列总结于下表1中。
92.表1:参考序列
93.[0094][0095]
在一些实施方案中,本公开的生产系统的宿主细胞经修饰以表达人rcol7和可以提高rcol7表达的hp4h的α和β多肽,其中α多肽(p4ha)可以是α多肽i、α多肽ii或α多肽iii或其同工型。
[0096]
在一些实施方案中,本公开的生产系统的宿主细胞经修饰以表达人rcol7、hp4h的α和β多肽以及人hsp 47。
[0097]
在一些实施方案中,本公开的生产系统的宿主细胞经基因修饰以包含至少一个编码rcol7的第一外源多核苷酸和至少一个编码能提高宿主细胞中rcol7表达的蛋白的外源多核苷酸,其中所述蛋白可包括但不限于氨酰脯氨酸二肽酶、包含α多肽(亚单位a)和β多肽(亚单位b)的脯氨酰4-羟化酶、赖氨酰羟化酶、糖基转移酶、c1galt1特异性伴侣蛋白1、热休克蛋白例如hsp 47及其功能变体。任选地,宿主细胞可进一步经修饰以包含编码rcol7或其功能变体的第二外源多核苷酸。
[0098]
在一些实施方案中,编码rcol7或其功能变体的外源多核苷酸可包含至少一个修饰,例如密码子优化。在一些实施方案中,编码rcol7的外源多核苷酸可在序列中包含优化的甘氨酸密码子。
[0099]
在一个优选实施方案中,生产系统的宿主细胞经基因工程化以包含至少一个编码人rcol7的第一外源多核苷酸、编码人脯氨酰4-羟化酶的α多肽(亚单位a)的外源多核苷酸和编码人脯氨酰4-羟化酶的β多肽(亚单位b)的外源多核苷酸。α多肽可以是α多肽i(alpha-1/亚单位a1)或其同工型,或α多肽ii(alpha-2/亚单位a2)或其同工型,α多肽iii(alpha-3/
亚单位a3)或其同工型。在一个优选实例中,α多肽是α多肽i(alpha-1/亚单位a1)或其同工型或功能变体。
[0100]
在一些实施方案中,生产系统的宿主细胞经基因工程化以包含至少一个编码人rcol7的第一外源多核苷酸、编码人脯氨酰4-羟化酶的α多肽(亚单位a)的外源多核苷酸和编码人脯氨酰4-羟化酶的β多肽(亚单位b)的外源多核苷酸以及编码hsp 47的外源多核苷酸。
[0101]
任选地,宿主细胞可进一步包含编码rcol7或其功能变体的第二外源多核苷酸。在一些实例中,编码rcol7的第一多核苷酸和编码rcol7的第二多核苷酸可具有相同的核酸序列。在其它实例中,编码rcol7的两个多核苷酸可具有不同的核酸序列。
[0102]
在一些实施方案中,本公开的生产系统的宿主细胞经基因工程化以包含编码人rcol7并具有seq id no.:25的核酸序列的第一外源多核苷酸、编码人脯氨酰4-羟化酶的α多肽1并具有seq id no.:28的核酸序列的外源多核苷酸,和编码脯氨酰4-羟化酶的β多肽并具有seq id no.:30的核酸序列的外源多核苷酸。在一个优选实施方案中,用于表达rcol7的第一外源多核苷酸包含seq id no.:26的核酸序列;编码脯氨酰4-羟化酶的α多肽1的外源多核苷酸包含seq id no.:29的核酸序列;并且编码脯氨酰4-羟化酶的β多肽的外源多核苷酸包含seq id no.:31的核酸序列。
[0103]
在一些实施方案中,生产系统的宿主细胞进一步用编码人rcol7并具有seq id no.:25的核酸序列的第二外源多核苷酸修饰。用于表达rcol7的第二外源多核苷酸可包含与表达rcol7或其功能变体的第一外源多核苷酸相同的核酸序列或不同的核酸序列。在一个实例中,用于表达rcol7的第二外源多核苷酸包含seq id no.:27的核酸序列。
[0104]
在一些实施方案中,用编码rcol7的两个多核苷酸修饰宿主细胞,其中所述两个多核苷酸具有seq id no.:26和seq id no.:27的核酸序列。
[0105]
在一些实施方案中,宿主细胞进一步经基因工程化以包含编码人hsp 47的外源性多核苷酸,其中所述多核苷酸序列包含seq id no.:32的核酸序列。
[0106]
本公开的宿主细胞还可进一步经基因工程化以包含用于表达氨酰脯氨酸二肽酶的外源多核苷酸,或用于表达c1galt1特异性伴侣蛋白1的外源多核苷酸。
[0107]
在其它实施方案中,生产系统的宿主细胞可用一种或多种载体转染,所述载体均包含一个或多个编码rcol7和/或其功能变体的多核苷酸序列。
[0108]
在一些实施方案中,生产系统的宿主细胞经基因修饰以包含含有编码rcol7或其功能变体的多核苷酸的表达载体,和至少一种包含编码可增加宿主细胞中rcol7表达的蛋白的多核苷酸的表达载体,所述蛋白例如氨酰脯氨酸二肽酶、脯氨酰4-羟化酶、赖氨酰羟化酶、糖基转移酶、c1galt1特异性伴侣蛋白1、热休克蛋白(例如hsp 47)或其功能变体。
[0109]
在一个优选实施方案中,宿主细胞经基因工程化以包含含有编码人rcol7或其功能变体的第一多核苷酸的第一表达载体,包含编码人脯氨酰4-羟化酶的α多肽(亚单位a)或其功能变体的多核苷酸的表达载体,和包含编码人脯氨酰4-羟化酶的β多肽(亚单位b)或其功能变体的多核苷酸的表达载体。任选地,进一步修饰宿主细胞以包含含有编码人rcol7或其功能变体的第二多核苷酸的第二表达载体。编码人rcol7或其功能变体的所述两个多核苷酸可包含相同的编码核酸序列。或者,编码人rcol7或其功能变体的所述两个多核苷酸可包含不同的编码核酸序列。第一和第二rcol7表达载体可包含不同的选择标记基因,例如两
种不同的抗生素抗性标记。选择性抗生素可以包括但不限于卡那霉素、壮观霉素、链霉素、氨苄青霉素、羧苄青霉素、博来霉素、红霉素、多粘菌素b、四环素和氯霉素。
[0110]
在其它实施方案中,本公开的生产系统的宿主细胞可经基因修饰以包含表达载体,所述表达载体包含编码人rcol7或其功能变体的第一多核苷酸;和包含编码hp4h的α多肽(亚单位a)的多核苷酸和编码hp4h的β多肽(亚单位b)的多核苷酸或其功能变体的表达载体。
[0111]
在一些实施方案中,本公开生产系统的宿主细胞可经基因修饰以包含含有编码人rcol7或其功能变体的第一多核苷酸的表达载体;和包含编码hp4h的α多肽(亚单位a)或其功能变体的多核苷酸和编码hp4h的β多肽(亚单位b)或其功能变体的多核苷酸的表达载体;和包含编码人hsp 47的多核苷酸的表达载体。
[0112]
作为非限制性实例,本公开的生产系统的宿主细胞可经基因工程化以包含含有编码人rcol7的多核苷酸序列并具有seq id no.:25的核酸序列的第一表达载体,包含编码脯氨酰4-羟化酶的α多肽1(亚单位a1)的多核苷酸序列并具有seq id no.:28核酸序列的表达载体,和包含编码脯氨酰4-羟化酶的β多肽(亚单位b)的多核苷酸序列并具有seq id no.:30的核酸序列的表达载体,和包含编码hsp 47的多核苷酸序列并具有seq id no.:24的核酸序列的表达载体。
[0113]
宿主细胞可进一步包含第二表达载体,其含有编码人rcol7的多核苷酸序列、具有seq id no.:25.的核酸序列的第二表达载体。
[0114]
在一个优选的实施方案中,本公开的生产系统的宿主细胞包含含有seq id no.:26的多核苷酸序列的第一胶原蛋白7表达载体,包含seq id no.:27的多核苷酸序列的第二胶原蛋白7表达载体,用于表达人脯氨酰4-羟化酶的α-1多肽的包含seq id no.:29的多核苷酸序列的表达载体,和用于表达人脯氨酰4-羟化酶的β多肽的包含seq id no.:31的多核苷酸序列的表达载体。所述工程化的细胞可进一步包含用于表达hsp 47的包含seq id no.:32的多核苷酸序列的表达载体。
[0115]
在一些实施方案中,本公开的生产系统的宿主细胞可经工程化以包含含有编码人rcol7或其功能变体的多核苷酸的表达载体,其中同一表达载体进一步包含编码人脯氨酰4-羟化酶的α多肽(亚单位a)或其功能变体的多核苷酸,和编码人脯氨酰4-羟化酶的β多肽(亚单位b)或其功能变体的多核苷酸。在一些实例中,同一表达载体可进一步包含编码人hsp 47的多核苷酸。
[0116]
在一些实施方案中,生产系统可包含多个同质的工程化的宿主细胞,其源自表达人rcol7或其功能变体的单细胞克隆。在其它实施方案中,生产系统可包含多个异质的工程化的宿主细胞,其源自一种以上表达人rcol7和/或其功能变体的细胞克隆。
[0117]
本公开的生产系统的宿主细胞可以是能够表达感兴趣的外源多肽或蛋白例如rcol7的任何细胞。本公开的宿主细胞可以是真核细胞,例如无脊椎动物(昆虫)细胞或脊椎动物细胞,例如非洲爪蟾(xenopus laevis)卵母细胞或哺乳动物细胞。在一些实施方案中,宿主细胞是哺乳动物细胞,包括但不限于成纤维细胞、c127、vero、hela、mdck、cho、cos、bhk、hek293细胞和/或源自这些哺乳动物宿主细胞的任何细胞。宿主细胞可以是原代细胞或转化的细胞系。在一个实施方案中,用于生产胶原蛋白7组合物的表达系统包括哺乳动物cho细胞或来源于cho细胞的细胞。
[0118]
表2:表达构建体
[0119][0120]
宿主细胞可以通过本领域已知的任何方法修饰。在一个实施方案中,宿主细胞通过已知的用于转染哺乳动物细胞的方法修饰,所述方法包括但不限于试剂介导的方法(例如,脂质、磷酸钙、阳离子聚合物、deae-葡聚糖、活化的树状聚合物和磁珠)、电穿孔、显微注射、激光类(laser faction)和病毒介导的方法。转化的宿主细胞可以是通过几轮选择过程所选择的稳定的细胞克隆。
[0121]
在一些实施方案中,本公开的生产系统进一步包括生产反应器,其可以是适于表达rcol7和/或其功能变体的宿主细胞培养物生长的任何容器。
[0122]
在一些实施方案中,本公开的生产系统可以生产重组胶原蛋白7,其用作生物药物。特别地,宿主细胞对于生产包含rcol7和/或其功能变体的胶原蛋白7组合物是稳定的。例如,从工程化的宿主细胞产生的胶原蛋白7组合物的量大于0.5mg/升培养物,或大于1mg/升培养物,或大于5mg/升培养物,或大于10mg/升培养物,或大于20mg/升培养物,或大于50mg/升培养物。本文所用的术语“培养物”、“细胞培养物”和“哺乳动物细胞培养物”是指在适于哺乳动物细胞群存活和/或生长的条件下悬浮于培养基中的所述细胞群。
[0123]
生产反应器可以是任何尺寸。大规模细胞培养生产反应器的体积通常为至少50升,或至少100升,或至少200升,或至少300升,或至少400升,或至少500升,或可为1,000、2,500、3,000、4,000、5,000、6,000、7,000、8,000、9,000、10,000、12,000升或更大,或其间的任何体积。培养体积可以是至少500ml,至少1升,并且可以是2、3、4、5、6、7、8、9、10、100、250、300、400、500、600、700、800、900、1,000、2,500、3,000、4,000、5,000、6,000、7,000、8,000、9,000、10,000升或更大,或其间的任何体积。在细胞培养期间可以控制生产反应器的条件以确保合适的细胞密度和活力。这些条件包括但不限于ph、温度、湿度和co2供应。
[0124]
在一些实施方案中,本公开的生产系统可以生产胶原蛋白7组合物,例如,水平足
够高以使得其可以以每升培养物超过1mg,或每升培养物超过5mg,或每升培养物超过10mg,或每升培养物超过20mg,或每升培养物超过50mg的量纯化。
[0125]
用于生产胶原蛋白7组合物的生产系统的宿主细胞可以使用本领域技术人员已知的标准细胞培养程序和材料进行培养。在一些实施方案中,宿主细胞在无血清培养基中培养。例如,无血清培养基可以是无动物来源的sfm2培养基。在一些实施方案中,培养基可进一步包含至少一种补充物,包括l-谷氨酰胺、胸苷和次黄嘌呤,其它营养物如脂质、氨基酸、维生素和/或生长因子(例如,ge healthcare提供的hyclone cell boost 5补充物)。
[0126]
在一些实施方案中,用于培养本公开的生产系统的宿主细胞的方法可包括用于保持宿主细胞的活力的方法。最大细胞活力是期望的。这些方法可用于使活细胞密度的降低最小化和/或维持高细胞活力。
[0127]
在一些实施方案中,细胞培养方法包括对正表达重组胶原蛋白7和/或其功能变体的细胞进行双重选择。
[0128]
在本公开的另一个方面,提供了一种用于生产胶原蛋白7组合物的方法,所述方法包括:i)提供编码rcol7或其功能变体的多核苷酸;ii)提供编码脯氨酰4-羟化酶的α多肽1或其功能变体的多核苷酸和编码脯氨酰4-羟化酶的β多肽或其功能变体的多核苷酸;iii)提供编码热休克蛋白47的多核苷酸;iv)提供细胞表达系统,其包括用于产生rcol7或其功能变体、脯氨酰4-羟化酶的α多肽1和β多肽或其功能变体和hsp 47的宿主细胞;v)通过在(iv)的细胞表达系统的宿主细胞中共表达(i)、(ii)和(iii)的多核苷酸来生产胶原蛋白7组合物,和vi)收集并纯化产生的胶原蛋白7组合物。
[0129]
在一些实施方案中,用于生产胶原蛋白7组合物的方法可以包括以下步骤:i)提供用于表达rcol7或其功能变体的载体,所述载体包含编码rcol7或其功能变体的多核苷酸;ii)提供用于表达脯氨酰4-羟化酶的α多肽1(亚单位a1)或其功能变体的载体,所述载体包含编码脯氨酰4-羟化酶的α多肽1或其功能变体的多核苷酸;iii)提供用于表达脯氨酰4-羟化酶的β多肽(亚单位b)或其功能变体的载体,所述载体包含编码脯氨酰4-羟化酶的β多肽或其功能变体的多核苷酸;iv)提供用于表达hsp 47的载体,所述载体包含编码hsp 47或其功能变体的多核苷酸;v)提供细胞表达系统,其包括用于产生rcol7或其功能变体、脯氨酰4-羟化酶的α多肽1和β多肽或其功能变体和hsp 47或其功能变体的宿主细胞;vi)通过在(v)的细胞表达系统的宿主细胞中共表达(i)、(ii)、(iii)和(iv)的载体来制备胶原蛋白7组合物,和vii)收集并纯化制备的胶原蛋白7组合物。
[0130]
在一些实施方案中,本公开的制备胶原蛋白7组合物的方法还包括:i)在无血清培养基中培养经基因修饰以表达rcol7或其功能变体的宿主细胞;和ii)从宿主细胞培养物回收rcol7或其功能变体。
[0131]
重组产生的胶原蛋白7组合物可通过本领域已知的任何方法从培养基中回收,所述方法包括但不限于通过离心或过滤从培养基中分离宿主细胞、病毒灭活、通过盐例如硫酸铵沉淀上清液或过滤物的蛋白质组分和除去宿主细胞核酸内容物。任选地,胶原蛋白7组合物可以被进一步纯化。纯化可以使用本领域已知的任何方法实现,包括但不限于亲和层析、hplc、离子交换层析、疏水相互作用层析、尺寸排阻层析、蛋白a层析、蛋白g层析等。
[0132]
在一些实施方案中,下游纯化方法可经设计以提供充分且有效的病毒清除。在一些实例中,所述方法可以包括专用于病毒灭活或去除的多个单元操作。这些单元操作可以
是一致且有效的。同时,这些单元操作对产品质量没有任何不利影响或不引起显著的产量损失。下游纯化可以除去该方法中引入的任何化学品,例如在专用病毒清除单元操作中加入的那些。
[0133]
下游方法还可包括浓缩步骤,其可与最终的超滤和渗滤步骤混合。超滤(uf)是从流体中分离极小的颗粒和溶解的分子的方法。超滤通常用于从用以缓冲液交换、脱盐或浓缩的缓冲液组分中分离蛋白质,并除去糖、非水溶剂和低分子量物质。uf/df步骤可使用高性能膜超滤如聚醚砜超滤膜来进行。
[0134]
在本公开的另一个方面,提供了通过本公开的生产系统、宿主细胞和方法生产的胶原蛋白7组合物。使用本公开的系统制备的胶原蛋白7组合物被正确地修饰并且与天然存在的胶原蛋白7蛋白在功能上不可区分。例如,通过本公开的生产系统制备的胶原蛋白7组合物可以引入至皮肤表皮和真皮之间的基底膜区域(bmz)内的锚定纤维中。通过本公开的生产系统制备的胶原蛋白7组合物可以与层粘连蛋白-332和其它胶原蛋白7结合配偶体结合。胶原蛋白7组合物可保留野生型人胶原蛋白7蛋白的20-100%、50-100%、50-90%或至少20%、30%、40%、50%、60%、65%、70%、85%、80%、90%、95%或100%的功能和/或活性。
[0135]
在一个实施方案中,胶原蛋白7组合物可通过本文其他地方所述的包括用于产生rcol7或功能变体的体外细胞表达系统的方法获得。
[0136]
胶原蛋白7组合物可包含多种重组表达的胶原蛋白7α链多肽,或胶原蛋白7α链多肽的多种功能变体,或多种功能等同的胶原蛋白7α链多肽,或其混合物。作为非限制性实例,通过本公开的细胞表达系统制备的胶原蛋白7组合物可包含多种重组表达的胶原蛋白7α链多肽(包含野生型胶原蛋白7多肽)和多种功能等同的胶原蛋白7α链多肽(例如包含一个或多个氨基酸取代(例如d1033y)的多肽)的混合物。
[0137]
药物组合物和制剂
[0138]
在本公开的一个方面,由本公开的表达系统和宿主细胞产生的包含人rcol7或其功能变体的胶原蛋白7组合物可配制成药物组合物。所述药物组合物可以进一步包含至少一种药学上可接受的载体。所述药物制剂和组合物被解释为向受试者施用治疗有效量的本公开的胶原蛋白7组合物,以预防、减轻和/或减少皮肤病况的症状,例如与deb相关的皮肤症状,例如皮肤伤口。药物组合物可以采取适合预期施用模式和治疗应用的任何可接受的药物制剂的形式。
[0139]
药物组合物可以配制成用于肠胃外、皮内或皮下应用的溶液或悬浮液。
[0140]
药物组合物可经配制以便适于注射。可注射制剂可以是无菌的,包括但不限于无菌水溶液或分散体和用于临时制备无菌可注射溶液或分散体的无菌粉末。药物组合物可以经配制用于口服施用,并且可以是片剂、丸剂、胶囊剂、锭剂、粉末等的形式。药物组合物可以经配制用于外部(topical)施用,例如乳膏、水凝胶等。
[0141]
其它制剂形式包括但不限于液体、半固体或固体给药形式、水凝胶、乳膏、液体溶液(例如,可注射的液体溶液)、分散体或悬浮液、粉末和脂质体。
[0142]
药物制剂在生产和储存条件下是稳定的,并且将被防腐以抵抗微生物如细菌和真菌的污染作用。微生物污染的预防可以通过各种抗细菌剂和抗真菌剂来实现,例如对羟基苯甲酸酯类、氯丁醇、苯酚、抗坏血酸、硫柳汞等。
[0143]
在一些实施方案中,所述药物组合物包含含有浓度范围为0.1mg/ml至200mg/ml、或1mg/ml至200mg/ml、或1mg/ml至10mg/ml、或10mg/ml至200mg/ml、或10mg/ml至100mg/ml、或10mg/ml至50mg/ml的活性药物成分,所述活性药物成分包括重组胶原蛋白7和/或其功能变体和/或其混合物。在一个实施方案中,本公开的制剂中包含的胶原蛋白7组合物具有给定浓度,包括例如至少约0.1mg/ml、至少约1mg/ml、至少约2mg/ml、至少约5mg/ml、至少约10mg/ml、至少约15mg/ml、至少约20mg/ml、至少约25mg/ml、至少约30mg/ml、至少约40mg/ml、至少约50mg/ml、至少约75mg/ml、至少约100mg/ml、至少约125mg/ml、至少约150mg/ml、至少约175mg/ml、至少约200mg/ml或大于约200mg/ml、或大于约300mg/ml、或大于约400mg/ml或大于约500mg/ml的浓度。
[0144]
药物组合物可以包含胶原蛋白7组合物,其在储存时基本上保持了物理和/或化学稳定性和/或生物活性。蛋白的稳定性可以使用本领域可获得的任何分析技术来评估。例如,胶原蛋白7的稳定性可以根据溶液中单体蛋白的百分比确定,降解(例如,片段化)和/或聚集的蛋白的百分比低。例如,包含稳定的胶原蛋白7的药物组合物可以包含约60%至99%的单体蛋白,或约70%至80%的单体蛋白。在一些实例中,包含稳定的胶原蛋白7的药物组合物可以包含至少95%的单体蛋白,或至少90%的单体蛋白,或至少85%的单体蛋白,或至少80%的单体蛋白,或至少75%的单体蛋白,或至少70%的单体蛋白,或至少65%的单体蛋白。或者,本公开的药物组合物可以包含不超过5%的聚集体和/或降解的蛋白。
[0145]
在一些实施方案中,胶原蛋白7组合物包含天然存在的胶原蛋白7和其至少一种功能变体的混合物。在一些实施方案中,使用本公开的生产系统生产和纯化胶原蛋白7组合物,所述生产系统包含经基因工程化以表达重组胶原蛋白7和/或其功能变体的宿主细胞。
[0146]
在一些实施方案中,药物组合物包含至少一种药学上可接受的载体,例如赋形剂、表面活性剂、缓冲系统、稳定胶原蛋白7组合物的稳定剂、张力调节剂、抗氧化剂、冷冻保护剂、填充剂(bulking agent)、冻干保护剂、碱性组分或酸性组分等。
[0147]
如本文所用,术语“赋形剂”是指可以加入到例如药物制剂中以提供所需稠度(consistency)、改善稳定性和溶解性、和/或调节重量克分子渗透浓度、和/或调节适合药物组合物使用目的其它特征的试剂。常用赋形剂的实例包括但不限于糖、多元醇、氨基酸、表面活性剂和聚合物。在一些实例中,赋形剂可以是离子型赋形剂或非离子型赋形剂。离子型赋形剂在某些配制条件如ph下具有净电荷。离子型赋形剂的实例包括但不限于组氨酸、精氨酸和氯化钠。非离子型赋形剂在某些制剂条件如ph下不带电荷。非离子型赋形剂的实例包括但不限于糖(例如蔗糖)、糖醇(例如甘露醇)和非离子表面活性剂(例如聚山梨酯80)。
[0148]
如本文所用,术语“稳定剂”是指改善或以其它方式增强稳定性的赋形剂。稳定剂包括但不限于α-硫辛酸、α-生育酚、抗坏血酸棕榈酸酯、苄醇、生物素、亚硫酸氢盐、硼、丁基化羟基苯甲醚(bha)、丁基化羟基甲苯(bht)、抗坏血酸及其酯、类胡萝卜素、柠檬酸钙、乙酰基-l-肉碱、螯合剂、软骨素、铬、柠檬酸、辅酶q-10、半胱氨酸、盐酸半胱氨酸、3-脱氢莽草酸(dhs)、edta(乙二胺四乙酸,乙二胺四乙酸二钠)、硫酸亚铁、叶酸、富马酸、没食子酸烷基酯、大蒜、葡糖胺、葡萄籽提取物、gugul、镁、苹果酸、焦亚硫酸盐、n-乙酰基半胱氨酸、烟酸、烟酰胺、荨麻根、鸟氨酸、没食子酸丙酯、碧萝芷(pycnogenol)、锯棕榈(saw palmetto)、硒、亚硫酸氢钠、焦亚硫酸钠、亚硫酸钠、亚硫酸钾、酒石酸、硫代硫酸盐(酯)、硫代甘油、硫代山
梨醇、生育酚及其酯(例如生育酚乙酸酯、生育酚琥珀酸酯、生育三烯、d-α-生育酚乙酸酯)、维生素a、b、c、d或e和其酯(例如维生素e乙酸酯)、锌,及其组合。
[0149]
如本文所用,术语“表面活性剂”可以指能够保护胶原蛋白7蛋白免受任何界面诱导的应力的试剂。表面活性剂的实例可以包括但不限于聚山梨醇酯(例如,聚山梨醇酯20、聚山梨醇酯80),聚氧乙烯烷基醚,泊洛沙姆如吐温20、吐温80或泊洛沙姆188、泊洛沙姆407。可保护胶原蛋白7组合物的其它化合物可包括糖,例如蔗糖、葡萄糖、海藻糖、甘露醇、甘露糖和乳糖;聚合物,例如葡聚糖、羟乙基淀粉和聚乙二醇;和氨基酸,如甘氨酸、精氨酸(例如l-精氨酸)、亮氨酸和丝氨酸。
[0150]
在一些实施方案中,药物组合物可以进一步包含缓冲剂系统、酸性组分或碱性组分。缓冲剂可以是,但不限于,磷酸盐缓冲剂(例如pbs)、乙酸盐缓冲剂或tris缓冲剂。酸性组分的实例包括磷酸、盐酸、乙酸、柠檬酸、草酸、琥珀酸、酒石酸、乳酸、苹果酸、乙醇酸和富马酸。碱性组分的实例包括氢氧化钾(koh)和氢氧化钠(naoh)。酸性组分和碱性组分用于调节制剂的ph。
[0151]
如本文所用,术语“抗氧化剂”是指抑制氧化的试剂,因此用于防止由于氧化过程而导致的制剂变质。抗氧化剂的实例可以包括但不限于丙酮、硫酸氢钠、抗坏血酸、抗坏血酸棕榈酸酯、柠檬酸、丁羟茴醚、丁羟甲苯、氢磷酸、一硫代甘油、没食子酸丙酯、甲硫氨酸、抗坏血酸钠、柠檬酸钠、硫化钠、亚硫酸钠、亚硫酸氢钠、甲醛亚砜酸钠、巯基乙酸、偏亚硫酸氢钠、edta(乙二胺四乙酸盐)、喷替酸盐(酯)和本领域普通技术人员已知的其它抗氧化剂。
[0152]
其它药学上可接受的载体、赋形剂或稳定剂,例如remington:the science and practice of pharmacy第20版,gennaro,ed.,lippincott williams&wilkins(2000)中描述的那些也可以包括在本文所述的胶原蛋白7制剂中,前提是它们不会不利地影响制剂的所需特性。
[0153]
在一些实施方案中,药物组合物可以进一步包含一种或多种用于皮肤治疗的活性剂。
[0154]
在一些实施方案中,本公开的药物组合物具有降低的免疫原性。
[0155]
在本公开的一个方面,包含胶原蛋白7组合物的药物组合物可以被配制为液体溶液,例如水性液体溶液。如本文所用,术语“水性”是指基于水的蛋白制剂,但可任选地含有另外的溶剂,例如,少量的水混溶性溶剂。作为非限制性实例,药物组合物是稳定的液体溶液。
[0156]
在一些实施方案中,包含胶原蛋白7组合物的药物制剂是可注射的。如果需要,本方法中的可注射胶原蛋白7组合物可进一步包含稀释剂、增溶剂、ph调节剂、缓冲剂、含硫还原剂、抗氧化剂、防腐剂等。本公开的可注射组合物中使用的缓冲剂可包括通常用作注射剂中缓冲剂的酸及其盐,或具有碱或其盐的混合溶液,例如磷酸、乙酸、盐酸、邻苯二甲酸、硼酸、柠檬酸、碳酸、琥珀酸及其盐,优选磷酸盐缓冲剂(磷酸氢二钠-磷酸二氢钠体系)和/或柠檬酸盐缓冲剂和/或乙酸盐缓冲剂。基于可注射组合物的总量,可注射胶原蛋白7组合物中使用的缓冲剂的浓度可为0-300mm,或0-100mm,或10-200mm,或30-250mm,优选0-100mm。本公开的制剂和可注射组合物的ph可以是6.5-7.4,优选6.8-7.2。
[0157]
在一些实施方案中,本公开的制剂适于任何用途,例如体外和/或体内用途。所述制剂可适于通过任何施用模式施用于受试者,所述施用模式包括但不限于皮下、静脉内、吸
入、皮内、经皮、腹膜内和肌内施用。本公开的制剂可以用于治疗受试者的皮肤疾病(例如,rdeb)。
[0158]
在一些实施方案中,包含胶原蛋白7组合物的药物制剂特别好地适于单剂量制剂或多剂量制剂。多剂量制剂是含有多于一个剂量的治疗性胶原蛋白7组合物的制剂。医疗保健提供者和/或患者可以施用来自多剂量制剂的单一剂量,储存制剂的剩余部分以用于将来施用一个或多个后续剂量。本文公开的多剂量制剂中的剂量数目可以是约2至约50,优选约2至约40,并且更优选约2至约25。还考虑至少5、至少10和至少20的剂量。具体剂量包括2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49和50个制剂剂量。
[0159]
施用和给药
[0160]
根据本公开,包含由本公开的生产系统生产的胶原蛋白7组合物的药物组合物和制剂可以通过本领域已知的任何合适途径施用至有需要的受试者,所述途径包括但不限于口服、肠胃外(包括动脉内、静脉内、皮下、腹膜内和肌内)注射或输注、气道(气溶胶)、鼻、直肠、气管内、肺(例如通过吸入或吹入粉末或气溶胶包括通过喷雾器)、皮下(例如经由植入装置)、颅内(例如实质内)、表皮、外部(包括皮肤、透皮、透粘膜、颊、舌下和眼内)、阴道、透粘膜、支气管和眼施用。本公开的药物组合物和/或制剂可以通过多于一种途径施用,这取决于是需要局部还是全身治疗和/或待治疗的皮肤区域。如果需要,可以同时使用多于一种途径。
[0161]
在一些实施方案中,施用途径可以是局部的,例如至皮肤或眼睛的局部区域。在其它实施方案中,施用途径可以是全身性的,例如注射或输注。
[0162]
根据本公开的药物组合物通常配制成剂量单位形式以便于施用和剂量一致性。然而,应当理解,本公开的组合物的总日用量可以由主治医师在合理的医学判断范围内决定。本领域技术人员将理解,某些因素可影响有效治疗受试者所需的剂量和时间安排,包括但不限于疾病或病症的严重性、先前的治疗、受试者的一般健康状况和/或年龄、以及存在的其它疾病。此外,用治疗有效量的组合物治疗受试者可包括单一治疗或一系列治疗。本公开所涵盖的各药物组合物的有效剂量和体内半衰期的估算可以使用常规方法或基于使用适当动物模型的体内测试来进行。例如,在一些实施方案中,合适的剂量或量是足以使疾病严重性指数得分降低1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100%或更高的剂量或量。
[0163]
本文所述的制剂和剂量经设计以使疾病和病症的治疗中的临床功效最大化,同时使不良副作用降低或最小化。
[0164]
在一些实施方案中,本公开的组合物以治疗有效量和/或根据与特定的期望结果(例如,预防和/或治疗大疱性表皮松解症)相关的给药方案施用。例如,在一些实施方案中,胶原蛋白7组合物的治疗有效剂量可以是范围为每千克受试者体重0.1mg至1,000mg(例如,约1mg至1,000mg,10mg至1,000mg,20mg至1,000mg,30mg至1,000mg,40mg至1,000mg,50mg至1,000mg,60mg至1,000mg,70mg至1,000mg,80mg至1,000mg,90mg至1,000mg,100mg至1,000mg,200mg至1,000mg,10mg至900mg,10mg至800mg,10mg至700mg,10mg至600mg,10mg至500mg,100mg至1,000mg,100mg至900mg,100mg至800mg,100mg至700mg,100mg至600mg,100mg至500mg,100mg至400mg,100mg至300mg,200mg至900mg)的量。在其它实施方案中,治
疗有效剂量可以是,例如,约0.001mg/kg至500mg/kg,例如,约0.001mg/kg至400mg/kg,约0.001mg/kg至300mg/kg,约0.001mg/kg至200mg/kg,约0.001mg/kg至100mg/kg,约0.001mg/kg至90mg/kg,约0.001mg/kg至80mg/kg,约0.001mg/kg至70mg/kg,约0.001mg/kg至60mg/kg,约0.001mg/kg至50mg/kg,约0.001mg/kg至40mg/kg,约0.001mg/kg至30mg/kg,约0.001mg/kg至25mg/kg,约0.001mg/kg至20mg/kg,约0.001mg/kg至15mg/kg,约0.001mg/kg至10mg/kg。
[0165]
总剂量可以以单剂量、多剂量、重复剂量、连续剂量或其组合施用。在一些实施方案中,本公开的药物组合物可以以单一日剂量施用,或总日剂量可以以每日两次、三次或四次的分剂量施用。
[0166]
单一剂量对任何特定表型或症状的作用可以是长期持续的,使得后续剂量的施用不超过3、4或5天的间隔,或不超过1、2、3或4周的间隔,或不超过1、2、3或4个月的间隔。
[0167]
在一些实施方案中,可以将包含由本公开的生产系统生产的胶原蛋白7组合物的药物组合物和制剂施用给有此需要的患者,用于其余生。施用的时间间隔和每次施用的剂量可以根据患者的状况(例如皮肤病况)进行调整。在一个实例中,药物组合物和制剂可以长期施用。长期施用可包括在一段时间内,例如在受试者的生命持续期间,给予多于一个剂量的药剂。胶原蛋白7组合物的浓度可以在整个治疗过程中维持在治疗或预防有效水平。
[0168]
在一些实施方案中,长期施用的时间段可包括但不限于至少1个月、至少2个月、至少3个月、至少6个月、至少1年、至少2年、至少3年、至少4年、至少5年、至少10年、至少15年、至少20年、至少25年,至少30年、至少35年、至少40年、至少45年、至少50年、至少55年、至少60年、至少65年、至少70年、至少75年、至少80年、至少85年、至少90年或至少100年,或1个月到100年之间的任何时间段。
[0169]
例如,给药时间可以包括每天一次、或每周一次、或每隔一周一次、或每月一次、或每隔一月一次、或每三个月一次、或每6个月一次、或每12个月一次、或每18个月一次、或每24个月一次、或每两年一次、或每5年一次。药物组合物可以每周两次、每月两次、或每隔一个月两次、或每三个月两次、或每6个月两次、或每12个月两次、或每18个月两次、或每24个月两次施用。
[0170]
作为非限制性实例,长期施用可包括一系列剂量,其一起提供用于减轻与eb、特别是deb(例如ddeb和rreb)相关的至少一种症状的有效量。长期施用可包括一系列剂量,其组合提供治疗、预防eb特别是deb如ddeb或rdeb,阻止其进展或延迟其发作的有效量。给药时间可以根据几个因素为患者定制,包括eb的类型,如deb、ddeb或rdeb,eb相关症状的存在,患者的年龄、体重、一般健康状况、性别和饮食;所用具体组合物的施用时间、施用途径和排泄速率;治疗的持续时间;与胶原蛋白7组合物组合或同时使用的药物;以及本领域公知的类似因素。
[0171]
rcol7组合物的应用
[0172]
根据本公开,由本公开的生产系统生产的胶原蛋白7组合物及其药物组合物或制剂可以用于替代受试者中,特别是受试者皮肤中的胶原蛋白7物质。所述胶原蛋白7可随后定位于皮肤的bmz并形成锚定纤维。
[0173]
胶原蛋白7水平的恢复
[0174]
在本公开的一个方面,通过将受试者中胶原蛋白7功能恢复到野生型胶原蛋白7正
常功能水平的20%至100%、30%至100%、40%至100%、50%至100%、60%至100%、70%至100%、80%至100%、90%至100%、30%至90%、40%至90%、50-90%、60-90%或70%至90%的范围内,由本公开的宿主细胞和生产系统产生的胶原蛋白7组合物及其药物组合物和制剂可用于在有需要的受试者中将胶原蛋白7恢复到功能水平。
[0175]
在一些实施方案中,胶原蛋白7组合物可恢复皮肤的锚定纤维,从而将皮肤的表皮层和真皮层保持在一起。
[0176]
治疗用途
[0177]
在本公开的一个方面,包含胶原蛋白7组合物的药物组合物和制剂可用于治疗皮肤病况,例如与大疱性表皮松解症(eb)相关的皮肤症状。治疗患有皮肤病症的受试者的方法包括向患有皮肤病症的个体施用包含胶原蛋白7组合物的药物制剂,其中所述组合物全身性施用(例如注射或输注)至所述受试者。胶原蛋白7组合物可以预防、阻止、减轻或抑制病症的皮肤症状的进展,例如皮肤伤口、起疱和结疤等。
[0178]
皮肤病症可以是由基因突变引起的遗传病症,例如大疱性表皮松解症(eb)。大疱性表皮松解症是一组遗传性基因病况,其中皮肤非常脆弱并且由于缺乏将皮肤的表皮层和真皮层保持在一起的锚定蛋白而容易起疱。水疱和皮肤糜烂自发形成,并响应于较小的损伤或摩擦,例如摩搓、抓挠或轻微的创伤。此外,作为慢性皮肤损伤的并发症,eb患者患皮肤恶性肿瘤(癌症)的风险增加。在eb疾病中已经鉴定了超过300种锚定蛋白中的突变。eb疾病可包括但不限于单纯性大疱性表皮松解症、交界型大疱性表皮松解症、营养不良性大疱性表皮松解症、大疱性表皮松解症(致死性棘层松解症)和获得性大疱性表皮松解症。由编码vii型胶原蛋白(胶原蛋白7)的col7a1基因中的突变引起的营养不良性大疱性表皮松解症(deb)(显性或隐性deb),是大疱性表皮松解症的最常见形式之一。这种病况的症状在患病个体中变化很大。在轻度情况下,起疱可主要影响手、脚、膝和肘。这种病况的严重病例包括广泛的起疱和结疤,其可导致视力丧失、外形损伤和其它严重的医学问题。
[0179]
在一些实施方案中,包含胶原蛋白7组合物的药物组合物和制剂可用于预防与deb(包括显性deb(ddeb)和隐性deb(rdeb))有关的一种或多种症状、抑制其进展或延迟其发作。与eb相关的症状可包括,但不限于,皮肤病况,例如皮肤薄且干燥、开放性伤口(例如慢性和非愈合性伤口)、起疱(轻度或重度)、瘢痕形成、由慢性伤口引起的感染(继发性皮肤感染)或皮肤癌(例如鳞状细胞癌);收缩的食道,例如食道的慢性疤痕、结网和阻塞;挛缩,例如(例如,四肢的)屈曲性挛缩;手或脚的假并指;尿道病变(例如,尿道狭窄);粘膜病变;鳞状上皮组织的病变;胃肠道病变,例如直肠或肛门病变;大疱形成,例如手外伤后的大疱形成;指甲或牙齿畸形;眼病,例如睑炎和角膜瘢痕形成;贫血、营养不良;败血症;声音嘶哑;包茎;吸收不良;过敏和免疫缺陷(例如,哮喘、过敏、湿疹或鼻炎症状的频率增加);和不能茁壮成长。
[0180]
在一些实施方案中,与未治疗的患者相比,用本公开的药物组合物治疗可以导致与deb有关的一种或多种症状改善20%至100%、或30%至100%、或35%至100%、或40%至100%、或45%至100%、或50%至100%、或55%至100%、或60%至100%、或65%至100%、或70%至100%、或75%至100%、或80%至100%、或85%至100%、或90%至100%的范围。
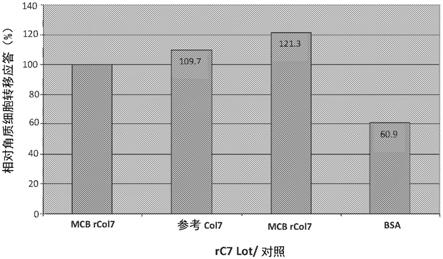
[0181]
在一些实施方案中,本公开的药物组合物和制剂可用于治疗其它皮肤病,包括但不限于未愈合伤口、由皮肤癌引起的皮肤伤口、由糖尿病如ii型糖尿病引起的皮肤伤口、老
年个体中的慢性皮肤伤口、开放性伤口、由过敏反应引起的皮肤伤口、手术伤口、由损伤引起的伤口、由于受试者的受限活动引起的伤口、与器官移植相关的伤口和其它损伤如暴露于阳光、风、热和冷等。
[0182]
皮肤癌可包括但不限于光化性角化病、非典型痣、基底细胞癌、黑素瘤(例如,浅表扩散性黑素瘤(superficial spreading melanoma)、结节性黑素瘤(nodular melanoma)、恶性雀斑样痣黑素瘤(lentigo maligna melanoma)、肢端着色斑黑素瘤(acral lentiginous melanoma))、梅克尔细胞癌(merkel cell carcinoma)、鳞状细胞癌、皮肤纤维肉瘤(dermatofibrosarcoma)、皮肤淋巴瘤(cutaneous lymphoma)和非典型纤维瘤(atypical fibroxanthoma)。
[0183]
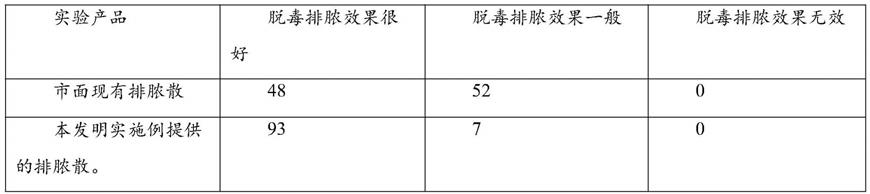
老年个体中的伤口可以是慢性的和不愈合的。年龄相关的病症可以包括皮肤癌、糖尿病和其它。
[0184]
过敏反应可引起显著的皮肤反应,范围从轻度到重度。长期过敏反应的常见症状可包括湿疹。
[0185]
联合疗法
[0186]
在一些实施方案中,本公开包括施用包含胶原蛋白7组合物以及一种或多种另外的药剂的药物组合物,作为联合疗法的一部分。本公开的胶原蛋白7组合物可以在一种或多种另外的疗法之前、同时或之后施用。在一个实施方案中,预期用于治疗大疱性表皮松解症或用于改善与eb相关的临床病症的任何已知的疗法或治疗剂都可以与本公开的胶原蛋白7组合物一起使用。
[0187]
示例性的其它药剂和疗法可包括但不限于抗生素、镇痛药、阿片样物质、抗病毒剂、抗炎剂、口服类固醇、营养补充剂或有助于管理疼痛和瘙痒的外用乳膏。
[0188]
抗生素可以包括但不限于aknilox、两性霉素、阿莫西林、氨苄西林、增强素(augmentin)、莫西沙星(avelox)、阿奇霉素、百多邦、必妥碘、戊酸倍他米松(betnovate)、博来法胺(blephamide)、科赛斯(cancidas)、头孢克洛、头孢氢氨苄、头孢地尼、头孢吡肟、cefix、头孢克肟、头孢西汀、头孢泊肟、头孢罗齐、头孢呋辛、头孢丙烯、头孢氨苄、头孢唑啉、头孢他啶(ceptaz)、氯胺苯醇(chloramphenicol)、氯己定、氯霉素(chloromycetin)、chlorsig、环丙沙星、克拉霉素、clindagel、克林霉素、克林达奇(clindatech)、氯唑西林(cloxacillin)、黏菌素、复方新诺明、地美环素、双氯西林、双氯唑西林、强力霉素、头孢羟氨苄(duricef)、红霉素、弗来格醇(flagyl alcohol)、弗来格剂量(flagyl dosage)、弗来格妊娠(flagyl pregnancy)、弗来格副作用(flagyl side effects)、弗来格治疗(flagyl treatment)、磺胺嘧啶银(flamazine)、菲宁达(floxin)、新霉素b(framycetin)、褐霉酸钠(fucidin)、呋喃旦啶(furadantin)、夫西地酸、加替沙星、吉米沙星、吉米沙星、丙酸红霉素(ilosone)、碘、左氟沙星(levaquin)、左氧氟沙星(levofloxacin)、罗霉乐(loceryl)、洛美沙星、美西肯(maxaquin)、美福仙(mefoxin)、美罗培南(meronem)、米诺环素、莫西沙星、乙胺丁醇(myambutol)、制霉菌素、新孢霉素、萘替米星(netromycin)、硝基呋喃妥因(nitrofurantoin)、诺氟沙星、norilet、氧氟沙星、头孢地尼(omnicef)、ospamox、土霉素、副霉素(paraxin)、青霉素、纽莫法(pneumovax)、多粘菌素b-杆菌肽锌(polyfax)、聚维酮(povidone)、利福定、利福平、利福昔明、卫非宁(rifinah)、(异)利福平(rimactane)、罗氏芬(rocephin)、罗红霉素(roxithromycin)、环丝氨酸、沙弗霉素(soframycin)、司帕沙星、
staphlex、他格适(targocid)、四环素、多西环素、亚甲赖氨酸四环素、妥布霉素(tobramycin)、妥布霉素、乙硫异烟胺(trecator)、替加环素(tygacil)、万古霉素、头孢拉定(velosef)、强力霉素(vibramycin)、昔福申(xifaxan)、司帕沙星(zagam)、zitrotek、zoderm、加替沙星(zymar)和利奈唑胺(zyvox)。
[0189]
抗病毒剂可以包括但不限于阿巴卡韦、阿昔洛韦(aciclovir)、阿昔洛韦(acyclovir)、阿德福韦(adefovir)、金刚烷胺、安普那韦(amprenavir)、安普利根(ampligen)、阿比多尔(arbidol)、阿扎那韦(atazanavir)、阿特普拉(atripla)、博西普韦尔特(boceprevir)、西多福韦(cidofovir)、可比韦(combivir)、地瑞那韦(darunavir)、地拉韦啶(delavirdine)、地达诺新(didanosine)、二十二醇(docosanol)、依度尿苷(edoxudine)、依非韦伦(efavirenz)、恩曲他滨(emtricitabine)、恩夫韦地(enfuvirtide)、恩替卡韦(entecavir)、法昔洛韦(famciclovir)、福米韦生(fomivirsen)、福沙那韦(fosamprenavir)、膦甲酸钠(foscarnet)、膦乙酸钠(fosfonet)、更昔洛韦(ganciclovir)、依巴他滨(ibacitabine)、异丙肌苷(imunovir)、碘苷(idoxuridine)、咪喹莫特(imiquimod)、茚地那韦(indinavir)、肌苷、整合酶抑制剂、iii型干扰素、ii型干扰素、i型干扰素、干扰素、拉米夫定(lamivudine)、洛匹那韦(lopinavir)、洛韦利德(loviride)、马拉韦罗(maraviroc)、吗啉脒胍(moroxydine)、美替沙腙(methisazone)、奈非那韦(nelfinavir)、奈韦拉平(nevirapine)、多吉美(nexavir)、核苷类似物、奥瑟他韦(oseltamivir)、聚乙二醇干扰素α-2a(peginterferon alfa-2a)、喷昔洛韦(penciclovir)、帕拉米韦(peramivir)、普拉康纳利(pleconaril)、鬼臼毒素(podophyllotoxin)、蛋白酶抑制剂、雷特格韦(raltegravir)、逆转录酶抑制剂、利巴韦林(ribavirin)、金刚烷乙胺(rimantadine)、利托那韦(ritonavir)、嘧啶、沙奎那韦(saquinavir)、司他夫定(stavudine)、茶树油、替诺福韦(tenofovir)、替诺福韦二吡呋酯(tenofovir disoproxil)、替普那韦(tipranavir)、三氟尿苷、三协唯(trizivir)、曲金刚胺(tromantadine)、特鲁瓦达(truvada)、伐昔洛韦(valaciclovir)、缬更昔洛韦(valganciclovir)、维立韦罗(vicriviroc)、维达拉滨(vidarabine)、塔利韦林(viramidine)、扎西他滨(zalcitabine)、扎那米韦(zanamivir)和齐多夫定(zidovudine)。
[0190]
抗炎剂可以包括但不限于布洛芬、萘普生、阿司匹林、双氯芬酸、吲哚美辛、酮洛芬、吡罗昔康、美洛昔康、舒林酸和类固醇。
[0191]
营养补充剂可包括但不限于铁、钙、维生素d、硒、肉碱和锌。
[0192]
其它组合疗法可包括但不限于矫正异常运动的手术,例如矫正手指或脚趾的融合或关节中的异常弯曲的手术,食道的手术扩张以改善进食能力,皮肤移植,基因疗法,基于细胞的疗法(例如工程化以表达胶原蛋白7或功能变体的成纤维细胞的移植),骨髓移植,其它蛋白替代疗法,和/或其组合。
[0193]
等同物和范围
[0194]
本领域技术人员仅使用常规实验就会识别或能够确定本文所述的公开内容的具体实施方案的许多等同方案。本公开的范围不旨在被限制于以上描述,而是如所附权利要求中所阐述的。
[0195]
在权利要求中,除非相反指示或从上下文中明显可见,否则诸如“a”、“an”和“the”的冠词可以表示一个或多于一个。如果一个、多于一个或所有的组成员存在于、用于给定的
产品或方法中或以其它方式与之关联,则认为在一个或多个组成员之间包括“或”的权利要求或描述是满足的,除非相反指示或以其它方式从上下文显而易见。本公开包括其中组中的正好一个成员存在于、用于给定产品或方法中或与之关联的实施方案。本公开包括其中多于一个或整个组成员存在于、用于给定产品或方法中或以其他方式与之关联的实施方案。
[0196]
还应注意,术语“包括”旨在是开放的,并且允许但不要求包括额外的元件或步骤。当术语“包含”在本文中使用时,术语“由其组成”也因此被涵盖和公开。
[0197]
在给出范围的情况下,包括端点。此外,应理解,除非另外指明或从上下文和本领域普通技术人员的理解中显而易见,否则表示为范围的值可认为是本公开的不同实施方案中采用所述范围内的任何具体值或子范围,直至范围下限单位的十分之一,除非上下文另外清楚地指明。
[0198]
此外,应当理解,落入现有技术范围内的本公开的任何特定实施方案可以明确地从权利要求中的任何一个或多个中排除。由于这些实施方案被认为是本领域普通技术人员已知的,因此可以将它们排除,即使在本文没有明确地阐述排除。本公开的组合物的任何具体实施方案(例如,任何抗生素、治疗成分或活性成分;任何生产方法;任何使用方法等)可以出于任何原因从任何一个或多个权利要求中排除,无论是否与现有技术的存在相关。
[0199]
应当理解,所使用的词语是描述性的词语而不是限制性的词语,并且可以在所附权利要求的范围内进行改变,而不偏离本公开在其更广泛方面的真实范围和精神。
[0200]
虽然本公开已经利用若干所述实施方案的一些特定性以一定长度进行了描述,但是不意在表示本公开应当限于任何这样的特定情形或实施方案或任何特定的实施方案,而是应当参考所附权利要求来解释,以便鉴于现有技术提供此权利要求的最宽泛的可能解释,并因此有效地涵盖本公开意图保护的范围。
实施例
[0201]
实施例1:多肽表达构建体
[0202]
根据标准分子技术构建用于表达胶原蛋白7-α链多肽和提高胶原蛋白7在细胞中表达的其它多肽的质粒构建体。产生这些表达构建体的详细方法描述如下。
[0203]
胶原蛋白7表达构建体
[0204]
用限制酶hindiii和xbal消化具有嘌呤霉素抗性基因(puro-)(psvpuro-c _ef1alpha(kozak-ext9)egfp_bghpa>x-s*29)或潮霉素抗性基因(hygro-)(psvhygro-c _ef1alpha(kozak-ext9)egfp_bghpa>x_29)的gfp表达质粒。然后通过电泳分离所得的两个dna片段,并从凝胶上切下来自每个构建体的载体片段,转移到1.5ml微量管中,并使用标准技术纯化。分别从puro-构建体和hygro-构建体中回收9114bp的puro-载体条带和9552bp的hygro-载体条带。
[0205]
通过用hindiii和xbal切割质粒,从geneart质粒11aaer3p_collagen7a_pma中切除编码胶原蛋白7α-链(胶原蛋白7a)的多核苷酸。通过电泳分离得到的两个dna片段,并回收对应于胶原蛋白7α链(seq id no.:25)的8870bp条带,并使用标准技术纯化。
[0206]
纯化的8870bp胶原蛋白7a片段与9114bp载体片段装配,产生puro_bt _slx-3631_collagen 7a(seq id no.:26),或与9552bp载体片段装配,产生hygro_bt _slx-3631_
collagen 7a(seq id no.:27)。按照生产商的说明书,使用ligafast rapid dna连接系统(promega,目录号:m8221)将纯化的载体片段(9114bp puro载体片段或9552bp hygro载体片段)与8870bp胶原蛋白7a片段在室温下以10μl的终体积连接5分钟,制备构建体。然后根据制造商的说明书,将连接混合物用于转化50μl感受态dh5α细胞(invitrogen,目录号:18265-017)。
[0207]
通过限制性分析来证实胶原蛋白7a表达质粒的完整性和结构。将一个细菌克隆在含有100μg/ml氨苄青霉素的150ml lb培养基中扩增,并提取蛋白质。用pvui-hf(neb,目录号:r3150l)在37℃过夜线性化胶原蛋白7a构建体,并用限制性酶消化。定量并通过电泳分离消化的dna。针对构建体puro_bt _slx-3631_collagen 7a(seq id no.:26),如所预期一样出现三条带(15426bp、1512bp和1046bp),针对构建体hygro_bt _slx-3631_collagen 7a(seq id no.:27),如所预期一样出现三条带(15864bp、1512bp和1046bp)。
[0208]
脯氨酰4-羟化酶表达构建体
[0209]
为了产生hp4ha1构建体,用hindiii消化gfp表达质粒pbsk_itr_cgapd_egfp_x29_itr以切除gfp序列。如上所述纯化消化的dna。使用dna聚合酶(roche)扩充纯化的dna,并使用标准技术纯化,然后用fsel消化。
[0210]
通过电泳分离来自hindiii/fsel双消化的两条dna条带。回收对应于载体的8584bp条带,并使用标准技术纯化。
[0211]
使用正向引物hp4ha1_fw_hindiiifilled(taccgccaccatgatctggtatatattaattataggaattctgct;seq id no.:33)和反向引物hp4ha1_rv_fsel(tcatggccggccgccccgacttatcattccaattctgacaacgtacaa;seq id no.:34),并以人正常组织的cdna(biochain institute,no.:b110179)作为模板,通过pcr扩增人脯氨酰4-羟化酶的α多肽i(hp4hal_nm_000917)。使用标准技术回收并纯化对应于人p4ha1的1638bp条带。纯化的1638bp pcr产物用fsel消化并进一步纯化。
[0212]
将1632bp的hp4ha1片段(seq id no.:28)与8584bp的载体片段组装,产生pbsk_itr_cgapd_hp4hal_x29_itr(seq id no.:29)。连接纯化的hp4ha1和载体片段。按照生产商的说明书,将整个连接混合物用于转化50μl感受态dh5α细胞。通过如上所述的限制性分析来检查新产生的质粒的完整性和结构。
[0213]
将hp4ha1构建体pbsk_itr_cgapd_hp4hal_x29_itr的样品用pvui-hf线性化,并通过用xbol和xbal消化进一步验证。消化的dna被定量并通过电泳分离。如所预期出现两个片段(8780bp和1440bp)。
[0214]
为了产生hp4hb构建体,用hindiii和xbal消化gfp表达质粒pbsk_itr_cgapd_egfp_x29_itr。如上所述回收并纯化对应于载体的8603bp片段。
[0215]
使用正向引物hp4hb_fw_hindiii(tcccmgcttaccgccaccatgctgcgccgcgctct;seq i dno.:35)、反向引物hp4hb_rv_xbal(ctagtctagattatcacagttcatctttcacagctttctga;seq id no.:36)和作为模板的人正常组织的cdna,通过pcr扩增人脯氨酰4-羟化酶的β多肽(hp 4hb_nm_000918)。纯化1559bp的pcr片段,并用hindiii和xbal消化。
[0216]
将产生的1545bp hp4hb片段(seq id no.:30)与8603bp载体片段装配,产生pbsk_itr_cgapd_hp4hb_x29_itr(seq id no.:31)。将纯化的hp4hb和载体片段连接,并用于转化50μl感受态dh5α细胞。通过如上所述的限制性分析来检查新产生的质粒的完整性和结构。
[0217]
将hp4hb构建体pbsk_itr_cgapd_hp4hb_x29_itr的样品用pvui-hf线性化,并通过用xbal和hindiii-hf消化来验证。定量并通过电泳分离消化的dna。如预期地出现两个片段(8603bp和1545bp)。
[0218]
hsp47、hpepd和comsc表达构建体
[0219]
用类似的方法产生表达hsp 47的构建体。消化gfp表达质粒pbsk_itr_bt _egfp_x29_itr。使用标准技术回收并纯化对应于载体的片段。将编码人hsp 47的核酸序列(seq id no.:32)插入到载体片段中,以产生hsp 47表达构建体((pbsk itr bt shsp47 x29 it)。通过如前所述的限制性分析来检查质粒的完整性和结构,并在最后定量质粒。
[0220]
使用正向引物hpepd_fw_hindiii(tcccaagcttaccgccaccatggcggcggccaccgga;seq id no.:37)、反向引物hpepd_rv_xbal(ctagtctagattatcacttggggccagagaagggggt;seq id no.:38)和作为模板的人正常组织的cdna,通过pcr扩增人氨酰脯氨酸二肽酶编码序列hpepd(nm_000285)。纯化1514bp的pcr产物并用hindiii和xbal消化。将回收的1500bp hpepd片段与8930bp载体片段组装,产生pbsk_itr_bt _hpepd_x29_itr。将纯化的hpepd和载体片段连接在一起,并用于转化50μl感受态dh5α细胞。通过如前所述的限制性分析检查新产生的质粒的完整性和结构,并在最后定量质粒。
[0221]
使用正向引物cosmc_fw_hindiii filled(taccgccaccatgctttctgaaagcagctcctt;seq id no.39)、反向引物cosmc_rv_xbal(ctagtctagattagtcattgtcagaaccatttggaggt;seq id no.:40)和作为模板的人正常组织的cdna,通过pcr扩增人cigalt1特异性伴侣蛋白1编码序列(nm_001011551)。纯化977bp的pcr产物,并用xbal消化。回收的968bp hcosmc片段与8930bp载体片段(用hindiii从pbsk_itr_bt _egfp_x29_itr质粒中切下)组装,产生pbsk_itr_bt _hcosmc_x29_itr。将纯化的hcosmc和载体片段,在10μl终体积中连接,然后用于转化50μl感受态dh5α细胞。如前所述,通过限制性分析检查新产生的质粒的完整性和结构。
[0222]
实施例2:用于生产重组胶原蛋白7的细胞系的产生
[0223]
宿主细胞系和细胞培养
[0224]
在无血清条件下,在补充了8mm l-谷氨酰胺(paa,目录号:m411-004)和lx ht补充物(次黄嘌呤/胸腺嘧啶核苷补充物)(invitrogen,目录号:41065)的sfm4cho培养基(hyclone,目录号:sh30548)中培养和维持源自野生型cho-k1细胞系(atcc,目录号:ccl-61)的无血清培养的细胞库(工作细胞库,wcb)。通过向wcb培养基中添加5%cb5(hyclone
tm
,cell boost
tm
补充物(hyclone,目录号:sh30865),产生用于转染的研究细胞库(rcb)。细胞以2
×
105细胞/ml的密度常规接种。测试并批准转染能力和单细胞铺板能力。这些准备用于转染的无血清的悬浮细胞培养物称为cho-m细胞。
[0225]
cho-m宿主细胞在补充了8mm l-谷氨酰胺、1xht补充物和5%cb5的sfm4cho培养基中常规培养。细胞保持在摇动的(120rpm,25mm冲程)37℃和5%co2的湿润培养箱中。在转染前,通过将2ml接种到6孔板的一个孔中,预热补充了8mm l-谷氨酰胺、1x ht和5%cb5的sfm4cho培养基,并在37℃、5%co2下孵育。
[0226]
表达构建体/质粒制备
[0227]
如实施例1中所详细描述的,制备构建体,定量所有质粒并通过测序进一步验证。
[0228]
转染(池#b1)
[0229]
sge tech 1转染系统用于细胞转染(selexis inc.,usa)。如下将胶原蛋白7表达质粒(携带嘌呤霉素抗性盒)和用于脯氨酰-4-羟化酶亚单位a1和b(p4ha1和p4hb)的两个质粒共转染到cho-m细胞中(表3)。gfp表达质粒用作对照。
[0230]
表3:用于sgetech i转染的质粒
[0231][0232][0233]
在转染程序之前不久制备cho-m细胞,以使细胞活力(96.0%活力)和转染效率最大化。将细胞(每微孔化5.1
×
105个细胞)离心(400xg,5分钟,室温)并在无菌lx pbs中洗涤。将细胞沉淀轻轻重悬于重悬缓冲液r(microporator试剂盒,mpk-1096)中,至浓度为1.7xl07c/ml。将100μl体积的细胞悬浮液(每次微孔化))立即转移至dna管中并小心混合。用microporator移液管(nanoentek inc.,韩国)吸出细胞-dna混合物,并放入移液管台。微孔化(1130v,20ms和3次脉冲)后,将细胞转移至先前制备的6孔板中,并在37℃和5%co2的静态湿润培养箱中孵育过夜。通过平行使用gfp表达载体控制转染效率(第二天进行的显微镜检查显示在50-70%之间的正常转染效率)。
[0234]
sgetech i转染后六(6)天,将细胞转移到离心管中,并在含有抗生素的培养基(含有8mm l-谷氨酰胺、l x ht、5%cb5和5μg/ml嘌呤霉素(sigma,目录号:p-9620)的sfm4cho培养基)中进行选择。将转染的细胞培养并用含8mm l-谷氨酰胺、lx ht、5%cb5和2.5μg/ml嘌呤霉素的sfm4cho培养基传代。将一个转染细胞池(池#b1)用于下一次转染。
[0235]
池#b1的超级转染
[0236]
然后用表4所示的质粒额外转染(作为超级转染)来自sgetech i转染的池#b1细胞。对于超级转染,使用携带潮霉素抗性的载体。将细胞(5.1
×
105细胞/转染)与4.5μg线性化dna样品在无菌反应管中合并。使用相同的转染方案((1130v,20ms和3次脉冲)。转染效率通过使用gfp表达载体控制(正常转染效率在50-70%之间)。
[0237]
表4:用于池#b1的超级转染的质粒
[0238]
[0239][0240]
在超级转染后,将细胞扩增到5ml离心管中。在补充了8mm l-谷氨酰胺、lx ht和5%cb5(包括2.5g/ml嘌呤霉素)的sfm4cho培养基中培养十天后,通过向培养基中添加250μg/ml潮霉素(invivogen,目录号:ant-hm-5)来启动双重选择。在建库(banking)前进行六次连续传代。将转染的细胞的一个池(池#b1stb)用于下一次转染。
[0241]
池#b1stb的超级转染
[0242]
再次用表达脯氨酰4-羟化酶a和b亚单位的载体(表5)和哺乳动物表达载体u5-pb转染池#b1stb的细胞。对于每次微孔化,在无菌反应管中制备3.4
×
105个细胞和3μg线性化的dna,并列进行gfp对照。使用相同的转染方案(1130v;20ms;3次脉冲)。
[0243]
表5:用于池#b1stb的超级转染的质粒
[0244][0245]
超级转染ii后十三天,将细胞扩增到含补充了8mm l-谷氨酰胺、1x ht和5%cb5但无抗生素的sfm4cho培养基的5ml离心管中。在第14天,将250μg/ml潮霉素和2.5μg/ml嘌呤霉素加入到培养基中。
[0246]
在随后传代14次后,将转染的细胞冷冻保存。将所转染的细胞的一个池(池#b1stbstb)在包含250μg/ml潮霉素和2.5μg/ml嘌呤霉素的sfm4cho培养基中进一步培养另外八代,以用于另外的超级转染。
[0247]
池#b1stbstb的超级转染
[0248]
用hhsp47的表达载体(表6)进一步转染池#b1stbstb的细胞。对于每次微孔化,在无菌反应管中制备3.4
×
105个细胞和3μg线性化dna样品,同时进行gfp对照。使用相同的转染方案(1130v;20ms;3次脉冲)。
[0249]
表6:用于池#b1stbstb的超级转染的质粒
[0250][0251]
超级转染iii后九天,进行培养基交换,并将200μg/ml 2-磷酸-l-抗坏血酸(sigma,目录号:49752)加入到已补加8mm l-谷氨酰胺、1x ht和5%cb5但无抗生素的sfm4cho培养基中。五天后,将细胞扩增到含补充了8mm l-谷氨酰胺、lx ht和5%cb5并包含250μg/ml潮霉素和2.5μg/ml嘌呤霉素的sfm4cho培养基的5ml旋转管中。在含有250μg/ml潮霉素和2.5μg/ml嘌呤霉素的培养基中进行随后七次传代,以用于进一步分析。
[0252]
进一步培养和扩增转染细胞的一个池(池#b1stbstbsth2)。
[0253]
实施例3:单克隆细胞系的筛选
[0254]
3.1筛选池#b1stbstb
[0255]
将池#b1stbstb的细胞在半固体培养基(2
×
sfm4cho培养基和甲基纤维素(clonematrix
tm
,genetix,目录号:k8510),其包含8mm l-谷氨酰胺、1x ht和5%cb5)中以100个细胞/ml的浓度培养11天。挑选110个候选物并转移到96孔板的补充了8mm l-谷氨酰胺、1x ht和5%cb5的sfm4cho培养基中。在7天内,通过斑点印迹筛选候选物。进一步挑取18个超级转染的候选物并转移至24孔板。在另外7天内,通过斑点印迹分析24孔上清液,并将12个超级转染的候选物转移至6孔板。
[0256]
7天后,将所有12个最高表达(基于斑点印迹)的超级转染候选物在离心管(5ml工作体积)中扩大到悬浮培养,随后在补充了8mm l-谷氨酰胺、1xht和5%cb5的sfm4cho培养基中传代5次至摇瓶(20ml工作体积)中。所有这些扩增都在不添加用于选择的抗生素的情况下进行。
[0257]
将候选物建库,并在32℃下在分批培养中比较每个候选物的性能。细胞数目和活力显示在表7中。通过western印记测定蛋白表达。图1显示了b1stbstb第一轮候选物的第6天培养物的western印迹的凝胶图像。
[0258]
表7:池b1stbstb候选物在32℃的结果
[0259][0260]
按照相同的方法进一步培养和选择候选克隆b1stbstb-cp03,并选择来自b1stbstb-cp03的5个克隆(表8)。图2a和图2b分别显示了来自第二轮选择的克隆在32℃和37℃的第6天培养物的western印迹的凝胶图像。
[0261]
表8:来自第二轮筛选(32℃和37℃)的候选细胞
[0262][0263][0264]
3.2池#b1stbstbsth2的筛选
[0265]
在半固体培养基(2xsfm4cho培养基和甲基纤维素,包含8mm l-谷氨酰胺、1x ht和5%cb5)中以100个细胞/ml的浓度培养池#b1stbstbsth2的细胞。挑取29个超级转染的候选克隆,并转移至96孔板的补充有8mm l-谷氨酰胺、1x ht和5%cb5而无用于选择的抗生素的sfm4cho培养基中。
[0266]
在3天内,将所有29个生长中的超级转染的候选物转移至6孔板(1ml细胞悬浮液 2ml新鲜生长培养基)。5天后,通过western印迹分析6孔上清液,将显示最高表达的3个超级转染的候选物扩增至离心管(5ml工作体积)中的悬浮培养。在补加了8mm l-谷氨酰胺、1x ht和5%cb5的sfm4cho培养基中连续传代五次而不选择(第四次传代加入200μg/ml 2-磷酸-l-抗坏血酸)后,通过离心管上清液(5ml工作溶液)的western印迹筛选细胞。然后将显示最高表达的两种超级转染的候选物扩增到在补充了8mm l-谷氨酰胺、1x ht和5%cb%的无抗生素的sfm4cho培养基中的摇瓶(20ml工作体积)中的悬浮培养。
[0267]
将两个候选物b1stbstbsth2-cp13和b1stbstbsth2-cp15建库,并在32℃和37℃下分批培养中比较性能。细胞数目和活力示于表8中。图3是在32℃和37℃下b1stbstbsth2cp13和b1stbstbsth2cp15的第5天培养物的western印迹的凝胶图像。
[0268]
表9:b1stbstbsth2第一轮候选结果
[0269][0270]
在半固体培养基(2xsfm4cho培养基和甲基纤维素,包含8mm l-谷氨酰胺、1x ht和5%cb5(无抗生素选择))中进一步培养和筛选候选克隆b1stbstbsth2cp13和b1stbstbsth2cp15。12天后使用clonepix细胞集落挑取系统筛选铺板的集落。挑取来自b1stbstbsth2cp13的32个克隆和来自b1stbstbsth2cp15的30个克隆,并转移到96孔板中,随后是补充了8mm l-谷氨酰胺、1x ht和5%cb5而无选择性抗生素的sfm4cho培养基的6孔板中。三(3)天后将所有挑取的细胞克隆扩增到离心管(5ml工作体积)中。基于通过western印迹对离心管上清液的分析,选择具有最高表达的来自blstbstbsth2cp13的3个克隆和来自blstbstbsth2cp15的4个克隆,并扩增至补充了8mm l-谷氨酰胺、1x ht和5%cb5(而无选择性抗生素)的sfm4cho培养基的摇瓶(20ml工作体积)中。
[0271]
将所有细胞系(列于表10中)建库,并在32℃和37℃的分批培养中比较这些细胞的性能。细胞数和活力示于表10中。图2a和图2b分别显示了来自第二轮选择的克隆在32℃和37℃的第6天培养物的western印迹的凝胶图像。
[0272]
表10:来自第二轮筛选(32℃和37℃)的候选细胞
[0273]
[0274][0275]
所有细胞系使用10%dmso(sigma,目录号:d-2650)、45%条件培养基和补充有8mm l-谷氨酰胺、1x ht和5%cb5的45%的新鲜sfm4cho培养基冷冻保存,以6
×
106细胞/小瓶在-80℃在低温箱(nunc)中储存24小时,然后转移至存取限制的液氮系统。
[0276]
根据制造商的方案(heipha,caso-bouillon tsb,编号:3080r),使用gem支原体检测试剂盒(minerva biolabs,目录号:11-1100),检测并确认冷冻细胞不存在支原体。
[0277]
在指定的时间间隔监测细胞的稳定性,包括解冻时的活力、细胞生长和cdna测序以及解冻后功能性测试。
[0278]
实施例4:验证用于rcol7生产的细胞克隆#b1stbstbcp03(mcb)
[0279]
按照ich(国际人类药物使用技术要求协调委员会(international council for harmonisation of technical requirements for pharmaceuticals for human use))安全性指南,广泛测试了细胞克隆#b1stbstbcp03(也称为mcb细胞)产生的胶原蛋白7。通过southern印迹和rcol7 cdna测序分析来自mcb的rcol7的身份。预期的8.9kb rcol7片段存在于mcb中,但不存在于宿主cho细胞中,这证实了mcb中存在rcol7编码区(图4)。通过测序分析确认从rcol7 mcb分离的cdna的核苷酸序列编码rcol7。
[0280]
测序结果显示了在来自mcb的rcol7的核苷酸位置3097(从atg起始密码子开始计数)处的序列异质性。3097位核苷酸残基是天然g核苷酸(如genbank登录号nm_000094;seq id no.:2)和t核苷酸的混合物,t核苷酸是在该位置观察到的主要核苷酸(20.2%g和79.8%t),这导致在胶原蛋白7多肽的密码子1033处具有氨基酸残基天冬氨酸(d)(由gac编码)和酪氨酸(y)(由tac编码)的异质rcol7多肽。由于证实了两个rcol7表达构建体(puro_bt slx3631_col7a和hygro_bt slx3631_col7a)的核苷酸序列正确编码1033位的天冬氨酸
(d),因此推断在产生mcb的细胞系开发过程中引入了所观察到的异质性。
[0281]
这些结果表明mcb是双克隆的,或者是携带g3097或t3097重组胶原蛋白7序列的两个相关克隆的混合物。g:t序列的比例以及因此两个克隆的比例大约是1:4。由于核酸序列的异质性,由rcol7 mcb产生的重组人胶原蛋白7组合物也是异质的,包含d1033和y1033的混合物,其中y1033变体占该物质的约80%-90%。
[0282]
进行进一步的评价以测试由mcb生产的rcol7物质的功能性。通过分子建模技术的组合评价d1033y异质性对rcol7结构和功能的潜在影响。结果证实了预期的物理化学性质(例如,分子量、脯氨酸羟基化、一级和二级结构)。通过建立的同源性模型(计算机模拟),1033位的异质性不可能影响胶原蛋白vii的iii型纤连蛋白重复9(fniii结构域fniii r9)的β夹心折叠。
[0283]
为了评价1033位的异质性对胶原蛋白7的功能性的影响,测量了mcb来源的rcol7组合物(例如mcb rcol7)的几个重要属性,并将其与参考胶原蛋白7(来自人成纤维细胞)进行比较。这些分析包括在还原条件下通过western印迹进行的同一性评估、通过尺寸排阻-hplc(se-hplc)进行的多聚化状态评估、通过肽作图lc/ms进行的羟脯氨酸占据、通过差示扫描量热法(dsc)进行的结构域完整性的生物物理评估、通过层粘连蛋白-332结合测定法进行的结合配偶体亲和力评估,以及通过incucyte伤口愈合方法进行的伤口愈合评估。
[0284]
使用dsc(差示扫描量热法)评价mcb rcol7的结构域完整性。dsc分析得到参考胶原蛋白7和目前mcb来源的rcol7组合物的可比较的(comparable)结果,观察到非常相似的结构域/亚结构域热转变。胶原蛋白7的胶原蛋白结构域在两种物质中在约45℃均经历了最早的热转变(tm),并且非胶原蛋白结构域(nc1)解链转变发生在约68℃的温度。两种物质内的中间热转变被认为是胶原结构域的亚结构域,两种物质在49℃至50℃具有类似转变。
[0285]
western印迹分析表明,就观察到的主要带型而言,rcol7产物同一性在参考胶原蛋白7和当前的mcb来源的rcol7组合物之间是可比较的(图5)。
[0286]
通过使用碘乙酸使mcb rcol7样品变性、还原并烷基化半胱氨酸,然后用胰蛋白酶在37℃消化14小时。消化的蛋白用pngase f去糖基化。肽混合物用肽作图lc/ms分析。结果表明了rcol7一级序列的完整性。通过在t724指示肽中(vvgapgvpgapger(bulleid等人,the embo journal,1997,vol.16(22):6694-6701)观察到的羟脯氨酸的百分比,来估计mcb rcol7中羟脯氨酸的水平。肽作图lc/ms结果表明了t274指示肽中的羟脯氨酸占据水平相似。
[0287]
残基1033位于胶原蛋白7的iii型第九纤连蛋白样重复序列中,其已在层粘连蛋白-332结合位点内得到定位(chen等人,j invest dermatol.,1999,vol.112(2):177-183)。确定层粘连蛋白-332结合亲和力与mcb来源的rcol7中y1033变体的百分比之间的潜在相关性的评估表明,结合特征(例如,参考胶原蛋白7和mcb rcol7的最大结合水平和解离常数(kd))是相似的(图6)。因此,存在于氨基酸位置1033处的异质性似乎不影响层粘连蛋白-332与mcb来源的rcol7组合物的结合。
[0288]
还用纤连蛋白进行了结合评估,纤连蛋白是胶原蛋白7的另外的结合配偶体,其不存在于bmz中。
[0289]
对参考胶原蛋白7和mcb rcol7进行体外伤口愈合生物测定。这些物质之间的测试结果相似,表明1033位存在的异质性不会不利地影响通过该测定测量的生物学功能(图7)。
[0290]
总之,参考胶原蛋白7和mcb来源的rcol7组合物的物理化学和功能测试证明了许多重要属性的相似性,表明了胶原蛋白7中1033位的酪氨酸而不是天冬氨酸不具有显著影响。
[0291]
实施例5:克隆#b1stbstbsthcp13-01和#b1stbstbsthcp13-03的验证
[0292]
细胞克隆#b1stbstbsthcp13-01和b1stbstbsthcp13-03来源于符合工业标准的两轮克隆,以确保高可能性的单克隆性(即单细胞起源)。对来自两个克隆的分离的基因组dna(gdna)和cdna的dna序列分析证实,存在与野生型胶原蛋白7序列匹配的单个核酸序列。该结果证实,两个细胞克隆都是单克隆的(即,来源于单个细胞祖细胞),并且对于两个克隆,rcol7转基因均编码如参考序列(人胶原蛋白7,genbank登录号nm_000094;seq id no.:2)中定义的天然胶原蛋白7。south印迹分析证实存在rcol7的8.9kb片段,表明rcol7编码序列在两个克隆中都是完整的(图8)。一年后,来自细胞库的培养细胞未显示与参考col7序列的差异。两个克隆中存在完整的转基因序列和转录物(mrna)。
[0293]
来自两个克隆的细胞是稳定的,如通过以下稳定性测试所显示。在选择存在或不存在下培养细胞至少30代。通过针对胶原蛋白7的细胞内染色和elisa试验测试胶原蛋白7的产生(表11和图9)。在没有选择时,生产力下降(表11),而在选择存在时生产力维持至少30代(表11)。针对胶原蛋白7的细胞内染色证实没有观察到另外的亚群,表明两种细胞系都是稳定的(图9)
[0294]
表11:用于细胞生产力的elisa
[0295][0296]
通过测序进一步确定,在来自b1stbstbsthcp13-01和b1stbstbsthcp13-03的rcol7组合物中未发现可检测的突变肽,通过dsc作图,来自b1stbstbsthcp13-01和b1stbstbsthcp13-03的rcol7物质的生物物理特征具有相同的解折叠温度图谱(35℃至55℃)。
[0297]
实施例6:工艺放大的细胞培养条件和生产力
[0298]
成功的工艺放大取决于确定、测量和监测关键的与规模无关的工艺参数,然后适当地设计和操作设备以在大规模时递送那些相同的参数。针对工艺放大,对包括用于细胞扩增的细胞培养基的生物反应器条件进行优化。使用具有细胞加强剂5、100xht和抗坏血酸的基础细胞培养基cd opticho
tm
培养基(thermo fisher)。细胞生长以30e6 vc/ml维持在基于10升cd opticho
tm
培养基的培养物中,并且在25天的培养中克隆b1stbstbsthcp13-01的存活力一致地高于85%。利用elisa的克隆筛选数据表明,克隆b1stbstbsthcp13-01和b1stbstbsthcp13-03的生存力都高于克隆#b1stbstbcp03(表12)。针对克隆b1stbstbsthcp13-01和b1stbstbsthcp13-03的hcp(宿主细胞蛋白)定量也高于mcb克隆(图
10)。
[0299]
表12:胶原蛋白7生产力
[0300][0301]
测试三个候选克隆的可放大性挑战(challenge)。细胞在400sw生物反应器中培养以用于工艺放大。b1stbstbcp03和b1stbstbsthcp13-01的氧更新率(our)分别为1.59e-10(mmol o2/hr*vc和3.09e-10(mmol o2/hr*vc)。b1stbstbsthcp13-03克隆的生物量减少了20%,o2流速增加了20%。在入口处观察到了填充(packing),并且b1stbstbsthcp13-01和b1stbstbsthcp13-03克隆在峰值处具有相似的填充细胞体积(20-25%)。b1stbstbcp03细胞具有均匀的填充分布和大约20%的填充细胞体积(峰值)。初步数据支持优选b1stbstbsthcp13-01用于工艺放大。
[0302]
实施例7:使用用于评价的工艺缩小的下游纯化方法
[0303]
为了提供快速、有效和可靠的生产工艺,使用缩小的实验室模型测试下游纯化处理。在重组的治疗性胶原蛋白7的纯化中,评价和优化下游工艺以提高蛋白质纯度和产率。该工艺包括以下步骤:
[0304]
1.收获细胞培养物质(upb);在本研究中,使用来自每个克隆的混合且汇集的培养物质;
[0305]
2.使用uv-c和化学品(例如triton)灭活细胞培养物质(upb)中的病毒;
[0306]
3.将处理过的upb过滤通过capto
tm
核心流动层析和琼脂糖层析;
[0307]
4.病毒过滤;
[0308]
5.使用膜材料进行最终uf(超滤)和df渗滤)步骤。在该试验研究中,使用两级100kd uf/df(例如100kd c-筛选pes(聚醚砜)膜)。或者,使用单级uf/df(例如,30kd a-筛选pes膜)。
[0309]
6.最终产物过滤通过0.2μm膜。
[0310]
表13:下游纯化产率
[0311][0312][0313]
与eng(88000ng/ml)和gmp相比,来自克隆b1stbstbsthcp13-01和b1stbstbsthcp13-03的upb的效价明显更高(克隆13-01为208,000ng/ml,并且克隆13-03为134,000ng/ml)(表13)。类似的,与eng和gmp相比,来自细胞克隆的hcp显著更高。每个克隆中药物物质中的hcp水平是可比较的且低于规范。
[0314]
使用单级30kd uf/df或两级100kd uf/df工艺,测试的下游纯化产率具有可比性。对所有三个克隆,目前的下游工艺具有可比较的产率,但b1stbstbsthcp13-01和b1stbstbcp03具有更高的最终uf/df产率(表13)。
[0315]
如表14所示,对来自缩小工艺中的药物物质的质量属性进行了评估。来自细胞克
隆的药物物质的如外观、生物负荷、内毒素、渗透压和ph的其他属性与参考标准是可比较的。来自规模轮次和400sw生物反应器的分析结果相似(数据未显示)。
[0316]
表14:来自缩小工艺的药物物质质量属性
[0317]
[0318][0319]
针对两个克隆#b1stbstbsthcp13-01和b1stbstbsthcp13-03,通过elisa检测,来自生物反应器和upb的总hcp较高。通过elisa法,药物物质中的hcp含量在三个细胞克隆的缩小轮次之间是可比较的(表14),尽管通过ms法,针对来自b1stbstbsthcp13-01和b1stbstbsthcp13-03细胞系的药物物质测量的cho c7含量增加(表15)。
[0320]
表15:来自细胞系的药物物质中的cho col7含量
[0321][0322]
这些结果表明,#b1stbstbsthcp13-01的生产力可以是>20mg/l/天。从细胞克隆产生的rcol7含有天然胶原蛋白7(图11)。通过测序重组蛋白,没有发现来自b1stbstbsthcp13-01和b1stbstbsthcp13-03的rcol7的可检测的突变多肽。该细胞系是稳定的,并适于放大细胞培养。总的下游纯化产率和药物物质属性与标准参考物质相当(comparable)。来自b1stbstbsthcp13-01细胞系的药物物质的其它功能(例如,通过incucyte伤口愈合测定和纤连蛋白结合的性能)与参考标准物相当(表14)。详细结果在以下实施例中讨论。
[0323]
实施例8:来自所选单克隆宿主细胞的rcol7序列验证
[0324]
从工程化的重组宿主细胞克隆中提取总rna内容物并按照标准程序定量。还分析了rna提取物的质量。使用rt-pcr(逆转录酶介导的pcr)和race-pcr(cdna末端pcr的快速扩增)富集靶转录物(接受序列验证的序列)。
[0325]
构建扩增产物(扩增子)以产生针对每种扩增子的dna文库。每个dna文库被独特地条形码化,用于采样跟踪和鉴定。在dna文库构建完成后,评估每个dna文库的dna片段长度的平均值(agilent 2100bioanalyzer高灵敏度dna试剂盒)。
[0326]
使用sybr-qpcr(基于sybr green的定量聚合酶链反应)定量最终dna文库,并分析以确定dna浓度。将最终的dna文库变性、稀释、合并在一起,并通过ngs测序(下一代测序)(ngs平台)。
[0327]
通过对rt-pct和race-pcr数据组相对于参考rcol7序列(seq id no.:25;在rcol7构建体中插入胶原蛋白7)作图和比对,来分析序列数据。
[0328]
初步race-pcr作图数据表明,约80%的读段群作图至参考基因组,并且比对以100%相似性产生100%的参考覆盖,没有检测到可报告的变体。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。