1.本发明属于医药技术领域,具体涉及一种向天果中柠檬苦素类化合物swietenine(桃花心木苦素)在治疗糖尿病肾病的组合物中的应用。
背景技术:
2.糖尿病肾病(dn)是糖尿病中一种常见的并发症,由于其高发病率和死亡率,已成为患者终末期肾病的主要原因。高血糖、晚期糖基化终端产物、炎症和氧化应激是糖尿病肾病的主要病因,研究发现,炎症在糖尿病肾病的进展中起核心作用。
3.炎症小体作为炎性反应的中心环节,在各种免疫炎性疾病、代谢性疾病的发生发展中起着重要作用。nod样受体蛋白3(nlrp3)炎症小体是炎性体大家族的典型成员,包括三个成分:nlrp3、凋亡相关斑点样蛋白(asc)、半胱氨酸天冬氨酸蛋白酶1前体(pro-caspase-1)nlrp3的表达上调后,caspase-1的表达也增加,使得炎症因子il-18及il-1β等分泌增加,nlrp3炎性小体的激活以及各种炎性因子的释放能刺激肾小球系膜的肥大和增殖,从而引起系膜外基质的扩张,最终诱发肾小球硬化和肾间质纤维化,导致dn形成。
4.nlrp3炎症小体的激活与多种通路相关,众多研究证实,最主要的介导炎症的转录因子nf-κb信号转导通路参与了糖尿病肾病的发生发展,并在此过程中扮演重要角色。在机体正常条件下,nf-κb是处于失活的状态,iκb是nf-κb的抑制性蛋白,具有两种亚型,分别是iκb-α和iκb-β。当有外界信号刺激时,iκb激酶被激活,导致iκb-α 磷酸化,使iκb-α降解。当其中一种亚型iκb-α被降解后,iκb也会与nf-κb解离而移位于核内,调节靶基因的表达。nf-κb与iκb解离后,nf-κb被激活,从而会上调nlrp3和il-1β的表达,这是nlrp3的初步活化阶段。然后,当机体继续被外界信号或者病原体危险相关分子刺激时,这为nlrp3炎症小体的最终“激活阶段”提供了条件。nlrp3炎症小体被活化后,会与pro-casoase-1相互作用,使 pro-caspase-1成熟,形成caspase-1。caspase-1会使细胞内的il-18前体和il-1β前体转变成成熟的il-18及il-1β,再从细胞内释放至胞外,从而对局部组织或全身造成炎症反应。因此,寻找调控nlrp3炎性小体的有效机制,对筛选dn的防治药物具有非常重要的意义。
技术实现要素:
5.本发明的目的在于提供一种向天果中柠檬苦素类化合物swietenine(桃花心木苦素)在治疗糖尿病肾病的组合物中的应用。
6.本发明的所述的swietenine(桃花心木苦素)的化学结构式如下:
。
7.本发明的所述的swietenine(桃花心木苦素)通过调控nf-κb和nlrp3/caspase-1/il-1β信号通路改善糖尿病肾病的作用。
8.本发明的swietenine(桃花心木苦素)在用于制备改善糖尿病小鼠肾组织的病变、糖尿病肾病小鼠肾脏功能损伤的组合物中的应用。
9.本发明的swietenine(桃花心木苦素)在用于制备抑制2型糖尿病小鼠引起的炎症反应的组合物中的应用。
10.本发明的所述的组合物是以swietenine(桃花心木苦素)作为唯一活性成分,或以包含swietenine(桃花心木苦素)的药物组合物作为活性成分。
11.本发明的有益效果:本发明的swietenine(桃花心木苦素)能够抑制高糖引起的肾小球系膜细胞增殖,同时还能改善糖尿病肾病小鼠肾脏功能损伤,对肾脏具有保护作用。swietenine通过调控nf-κb和nlrp3/caspase-1/il-1β信号通路,减轻炎症,从而改善糖尿病肾病。
附图说明
12.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
13.图1为swietenine对糖尿病小鼠fbg及体重的影响;(a)糖尿病小鼠fbg的影响;(b)糖尿病小鼠体重的影响;图2为swietenine对糖尿病小鼠肾脏功能的影响;(a)尿蛋白;(b)血清肌酐;(c)尿素氮(d)尿酸水平;图3为swietenine对糖尿病小鼠肾脏形态的影响;图4为swietenine对糖尿病小鼠肾组织中nf-κb和nlrp3炎症小体的影响;图5为swietenine对糖尿病小鼠肾组织中炎症因子的影响;(a)il-1β;(b)il-18。
具体实施方式
14.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本发明实施
例的组件可以以各种不同的配置来布置和设计。
15.因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
16.本实施例的目的是探究向天果提取物swietenine(swi)对高糖诱导的人肾小球系膜细胞(hmc)以及糖尿病肾病小鼠(db/db)的作用,并探讨swietenine与核苷酸寡聚化结构域样受体热蛋白结构域相关蛋白3 (nucleotide binding oligomerization domain like receptorpyrin domain containing 3, nlrp3)、半胱天冬氨酸酶-1(caspase-1)以及白介素1β(il-1β)信号通路之间的关系,进一步研究其作用机制。
17.1、化合物分离向天果药材共7 kg,晒干粉碎后,使用无水乙醇冷浸3天后得浸出液,剩余药渣再分别使用100%乙醇和75%乙醇加热回流2次和1次,得两次的浸出液。将3次的浸出液合并,减压浓缩蒸发乙醇后得浸膏。向分液漏斗中加入不同溶剂萃取浸膏,首先使用石油醚和乙酸乙酯萃取得石油醚萃取物和乙酸乙酯萃取物。乙酸乙酯萃取物蒸发溶剂后采用硅胶柱层析法分离纯化,得到10个化合物。分别为:swietenine ;khayasin t ;6-deoxyswietenine ;3-o-tigloylswietenolide ;swietenolide ;3,6-o,o-diacetylswietenolide ;7-deacetoxy-7-oxogedunin ;fissinolide;proceranolide;7-deacetoxy-7α-hydroxygedunin。
18.swietenine的化学结构式如下:。
19.2、动物实验分别购买6周龄的db/m小鼠8只和db/db小鼠18只,适应性喂养2周后,将db/db小鼠随机平均分为3组:模型组,低剂量给药组(25 mg/kg/d)和高剂量给药组(50 mg/kg/d),每组6只。将所有小鼠适应性喂养3天后,db/db小鼠给药组,按照剂量分别给药8周,给药期间每两周测定一次空腹血糖和体重。小鼠成长到16周后,收集尿液,血液和肾脏组织。测定小鼠的各项指标,包括尿蛋白,尿酸,肌酐和尿素氮;western blot 方法检测小鼠肾组织内nf-κb p65、nlrp3、caspase-1、il-1β和il-18的蛋白表达。
20.2.1 swietenine对糖尿病小鼠fbg及体重的影响如图1所示,给药期间内,db/db组小鼠fbg明显高于db/m组小鼠,相对于db/db组,swietenine治疗组小鼠的血糖下降。同时,相比于db/m组,db/db组的小鼠体重增加明显。在
swietenine治疗后,db/db组糖尿病小鼠体重值降低。
21.2.2 swietenine对糖尿病小鼠肾脏功能的影响如图2所示,与db/m组的小鼠相比,db/db组小鼠的尿蛋白、血清肌酐、尿素氮及尿酸水平显著升高(均 p《0.01),给予swietenine低高剂量治疗后,24h尿蛋白、血 清肌酐、尿素氮及尿酸水平显著降低(p《0.05或p《0.01),对糖尿病大鼠的肾脏功能具有良好的改善作用。
22.2.3 swietenine对糖尿病小鼠肾脏形态的影响如图3所示,pas和he染色显示,与对照组db/m小鼠相比,db/db组小鼠肾小球系膜基质增生,基底膜厚度增加,与db/db组相比,swietenine高剂量组的增生明显减少,基底膜厚度降低。masson染色显示,与对照组相比,db/db组小鼠肾组织纤维化严重,与db/db组相比,swietenine低高剂量组能降低肾组织的纤维化程度。因此,可以说明swietenine对糖尿病小鼠肾组织的病变具有一定的改善作用,降低其病变程度。
23.2.4 swietenine对糖尿病小鼠肾组织中nf-κb和nlrp3炎症小体的影响如图4所示,与对照组相比,db/db组小鼠肾皮质中的nf-κb p65、nlrp3及caspase-1蛋白表达明显增多(p《0.05或p《0.01),给予低、高剂量的swietenine后,肾组织中nf-κbp65、nlrp3与caspase-1蛋白表达明显降低(p《0.05或p《0.01)。
24.2.5 swietenine对糖尿病小鼠肾组织中炎症因子的影响如图5所示,与对照组相比,db/db组小鼠肾皮质中的il-1β和il-18蛋白表达明显增多(均p《0.01),给予低、高剂量的swietenine后,肾组织中il-1β和il-18蛋白表达明显降低(p《0.05或p《0.01)。
25.动物实验涉及到的实验方法分组及给药将所有6周龄小鼠适应性喂养2周后,设置一组db/m正常对照组(normal),db/m组8只小鼠,分别于两个笼子饲养;db/db小鼠随机分成3个组,分别为模型组(dn),swietenine低剂量组(dn swietenine 25),swietenine高剂量组(dn swietenine 50),每组6只。在每只小鼠尾部进行编号标记。药物swietenine用1%的羧甲基纤维素钠(cmc-na)制成混悬液。swietenine低、高剂量组给予药物的剂量分别为25 mg/kg/d,50 mg/kg/d,db/m及db/db模型组根据体重给予1 % cmc-na溶液。每天早上八点进行灌胃给药。给药时间为8周。
26.小鼠的生理状况在给药期间观察小鼠的精神状态、垫料的干湿情况、饲养笼内饲料和水的状况。每2周测定小鼠的体重和空腹血糖。
27.小鼠血液和尿液样本的收集小鼠连续灌胃给药8周后,先收集小鼠尿液,在将小鼠处死之前进行眼眶取血,记录尿液和血液的体积。小鼠尿液和血液先放4 ℃保存3小时,3000 r/min离心15min, 吸取上清放入-80 ℃保存。肾脏组织的收集小鼠眼眶取血后,处死小鼠。取出小鼠两侧的肾脏,在分析天平上称量体重。将肾组织装入ep管中,放入-80 ℃冰箱保存。
28.尿蛋白的测定
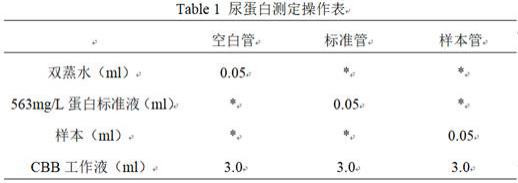
小鼠的尿液使用尿蛋白试剂盒测定,试剂盒所使用的方法是考马斯亮蓝法 (cbb法)。
29.(1)实验原理:在酸性条件下,考马斯亮蓝会和与nh3
基团聚合。使溶液出现颜色变化,溶液颜色由棕色变为蓝色。
30.(2)实验步骤:根据上述表格加入相应的试剂,将溶液充分混合均匀。在室温环境下静置5 min,把上述混合溶液加入到96孔板中,每孔加将200 μl,根据实验需求,每组设置3个复孔。将空白管设为0,在波长595 nm 处测定各组的吸光度值,记录标准品和样本的od 值。
31.(3)根据各组的od值计算对应的值。
32.尿酸的测定(1)实验步骤根据尿酸测定操作表1加入样本和溶液,充分混合均匀。室温环境下静置10 min后,在4 ℃条件下, 3000 g离心5 min。min。
33.离心后,取上清。根据尿酸操作表(2)加入上述溶液,混合均匀。室温环境下静置10 min后,把上述混合溶液加入到96孔板中,每孔加将100 μl,根据实验需求,每组设置3个复孔。将空白管设为0,在波长690 nm 处测定各组的吸光度值,记录标准品和样本的od 值。
34.(2)根据各组的od值计算对应的值。
35.尿素氮的测定(1)基本原理:实验先通过加热后,再加入强酸作用后。尿素氮和二乙酰肟缩合成红色的联吖嗪。根据溶液的颜色和od值计算bun的含量。
36.(2)实验步骤:试剂二应用液在使用前由80 ml蒸馏水配制。试剂二应用液需要现配现用。
37.按照尿素氮操作表加入各种试剂后,混合均匀。将溶液放入水浴锅中加热20 min左右,加热完毕后,用冰水冷却。把上述混合溶液加入到96孔板中,每孔加将200 μl,根据实验需求,每组设置3个复孔。将空白管设为0,在波长520 nm 处测定各组的吸光度值,记录标准品和样本的od 值。
38.(3)根据各组的od值计算对应的值。
39.肌酐含量测定本实验采用的方法为苦味酸比色。
40.(1)从-80 ℃冰箱中取出0.2 ml血清,将血清解冻。血清解冻后,加入蛋白沉淀剂2 ml。把上述溶液混合均匀,4 ℃,3500 r/min,15 min。
41.按照肌酐实验操作表加入各种试剂后,混合均匀。将溶液放入37 ℃恒温烘箱中加热30 min左右,加热完毕后,用冰水冷却。把上述混合溶液加入到96孔板中,每孔加将200 μl,根据实验需求,每组设置3个复孔。将空白管设为0,在波长510 nm 处测定各组的吸光度值,记录标准品和样本的od 值。
42.(3)根据各组的od值计算对应的值。
43.染色(1)将组织切片用蒸馏水清洗几遍后,再放入苏木精染色液中10 min;(2)组织切片先浸泡酸水中10 s,再放入氨水中10 s;(3)蒸馏水浸泡30 min,清洗3遍;(4)切片先放入百分之七十酒精脱水10 min,再放入百分之九十酒精中脱水10 min;(5)用酒精伊红染色液对切片进行染色,染色两分钟到三分钟;(6)染色后的切片经纯酒精脱水,再经二甲苯使切片透明即可;(7)将已透明的切片滴上树胶,盖上盖玻片封固;(8)待树胶略干后,贴上标笺,切片标本即可使用。
44.染色(1)将组织切片脱蜡,用双蒸水清洗3遍,再用百分之七十五的酒精清洗3遍;(2)把组织切片放入高碘酸溶液中,浸泡时间10 min左右;(3)切片用百分之七十五的酒精洗2遍,放入还原液中浸泡1 min左右;(4)再用百分之七十五的酒精洗2遍后,向切片上加无色盐基性品红溶液,需要覆盖整个切片。溶液覆盖切片1小时;(5)双蒸水浸泡15 min,再清洗2遍。切片组织中细胞核使用苏木素染液染色,大约染色5min;(6)蒸馏水冲洗后,脱水,透明,封固。
45.染色(1)将组织切片脱蜡,使用weigert铁苏木素染液染色;(2)在酸性条件下,加入乙醇分化,蒸馏水清洗2遍;(3)切片经masson液返蓝;(4)蒸馏水洗1 min;(5)丽春红品红染色液染色5~10 min;(6)在上述操作过程中按蒸馏水:弱酸溶液=2:1比例配制弱酸工作液,用弱酸工作液洗1 min;(7)磷钼酸溶液洗1~2 min;(8)用配制好的弱酸工作液洗1 min;(9)直接入苯胺蓝染色液中染色1~2 min;(10)用配制好的弱酸工作液洗1 min;(11)95%乙醇快速脱水。无水乙醇脱水3次,每次5~10 s;(12)二甲苯透明3次,每次1~2 min。中性树胶封固。
46.蛋白提取及浓度测定(1)细胞裂解液混合物由裂解液和pmsf配制,配制比例为100:1。提取培养皿中的细胞,向细胞沉淀中加100 μl配制好的裂解液。
47.(2)细胞裂解30 min,每10 min吹打混匀一次。动物组织按加入裂解液体积(μl):组织重量(mg)=8:1加入裂解液混合物,在冰上剪碎匀浆。 细胞和组织裂解全程在冰上进行。
48.(3)裂解完成后在4
ꢀ°
c离心机离心,10000 r/min离心20 min,取上清。
49.(4)每组取上清3 μl,加入96孔板中,每孔1 μl。再向每孔加入9 μl的蒸馏水,稀释样本上清,加入bca工作液100 μl。同时设定空白孔。
50.(5)37 ℃恒温烘箱孵育30 min。565 nm处测定各组的吸光值。
51.(6)根据标准蛋白计算公式,算出各组的蛋白浓度。向上清中加四分之一体积的上样缓冲液,涡旋混匀。
52.(7)将混合后的溶液在100 ℃中煮10 min。
53.(8)(8)收集蛋白溶液,-20 ℃保存。
54.免疫印迹法检测目的蛋白(1)用蒸馏水清洗电泳玻璃板,电泳配胶架,吸取残留的胶。洗干净后组装玻璃板和配胶架,两板间加满蒸馏水,检查是否漏水。5 min后观察液面是否降低,检漏的时候需要将玻璃板向下压紧。如果玻璃板不漏水,倾倒出双蒸水,并用滤纸吸干残留的水分。
55.(2)根据实验需求,按照快速配胶试剂盒(加强版)说明书配制相应体积下层胶。每块胶板需要加入5 ml的下层胶溶液。再加满蒸馏水,排除气泡。室温下静置30 min。等下层胶凝固后,倒去蒸馏水,吸干残留的水分。
56.(3)根据实验需求,按照快速配胶试剂盒(加强版)说明书配制相应体积上层胶。每块胶板需要加入1 ml的上层胶溶液。加完上层胶后,插入梳子,插入过程中尽量减少气泡的产生。如若有气泡,应加入上层胶溶液,以排尽气泡。室温静置20 min。
57.(4)等上层胶凝固后,拔出梳子,将配胶架洗干净。组装胶板和电泳槽,电泳内槽加入新配置的电泳液。
58.(5)将样本从-20
°
c拿出,室温下解冻。待解冻后,涡旋混匀。向胶板内加入计算好的样本溶液,加的过程中速度不要太快,以免样本溢出。加完样本后,胶板两侧加入marker。
59.(6)外槽加入适量的电泳液,外槽液面要低于内槽的液面。盖好电泳槽盖,插上电源,设置电泳程序,60 v电泳30 min,120 v电泳60 min。
60.(7)取半干转液80 ml,加入甲醇20 ml,混合均匀。倒出一部分于另一胶盒中,润湿滤纸。按照实验需求裁剪nc膜,将nc膜放入剩余的半干转混合液中。
61.(8)将电泳完的胶板从电泳槽中取下,用蒸馏水清洗胶板。轻轻取下两块玻璃板中较薄的一块,将剩下的胶板放在裁膜板上。按照marker指示的裁取目的蛋白,其中nf-κbp65、nlrp3、caspase-1、gapdh与actin的蛋白分子量分别为 65kda、85kda、45kda、36kda、
42kda。
62.(9)用抹布把半干转仪擦干净,再把厚滤纸放在半干转仪上。用镊子将nc膜放到厚滤纸上,镊子夹nc膜的时候,不可夹nc膜中间,只能夹两端。加适量的的半干转混合溶液,将裁好的胶转移到nc膜上。再加半干转混合溶液,赶净nc膜和胶之间的气泡。加上最上层的滤纸,擦拭滤纸周围,盖上盖子,插上电源,设置好转膜的程序。一般电压设置为20 v,转膜时间为30 min。
63.(10)称取1.5g脱脂奶粉溶解到30 ml的pbs溶液中。从半干转仪中取出nc膜放入封闭液中,摇床上室温封闭1 h,摇床速度不宜过快。
64.(11)用一抗稀释液将抗体按照说明书的要求稀释,稀释后的抗体放入抗体孵育盒中。把nc膜从封闭液中取出,用蒸馏水吸取残留的封闭液,再用滤纸吸干nc膜上的水分。擦干的条带放入对应的抗体中进行孵育。在4
ꢀ°
c 条件下孵育一夜。
65.(12)从4
ꢀ°
c中取出抗体孵育盒,室温放置5 min。将nc膜从孵育盒中取出,用pbst洗涤3次,每次5 min。用二抗稀释液对二抗进行稀释,稀释比例根据说明书和实验需求来改变。条带放入二抗孵育盒后,室温下条件下孵育一小时。
66.(13)二抗孵育完成后,避光条件下用pbst洗涤3 次,每次5分钟。再用pbs溶液洗涤1次,每次5分钟。将洗好的条带,用干净的滤纸吸干残留水分。避光环境下保存。
67.丙二醛(mda)法实验原理:过氧化脂质经过降解后,会产生丙二醛。而产生的丙二醛会与硫代巴比妥酸(tba)聚合,然后生成红色的沉淀。因底物为硫代巴比妥酸所以此法称tba法。
68.(1)离心管盖上盖,用针在盖上扎一小孔,涡旋混匀器混匀;(2)95℃水浴40min;(3)取出后冷却,3500-4000转/分,离心10min;(4)取上清,532nm处,1cm光径,蒸馏水调零,测各管吸光值。
69.免疫荧光法将盖玻片放到百分之七十五的酒精里,紫外灯下照射半小时。在无菌环境下,先从酒精溶液里把盖玻片取出,挥发掉盖玻片表面的酒精,将盖玻片放入6孔板内。hmc细胞经消化、离心后,加培养基混合均匀,制成混悬液。把混悬液加入6孔板中,使溶液能完全覆盖住盖玻片。hmc细胞固定一天后,使其能贴壁生长。再根据实验要求,设置不同组别,培养48 h。
70.(1)弃去6孔板内的培养基,每孔加入2 ml pbs清洗,如此重复清洗爬片三次,每次洗3 min;(2)洗完后每孔加2 ml甲醇,溶液覆盖整个爬片。再放入-20
ꢀ°
c冰箱内固定15 min,每孔加入2 ml pbs清洗,如此重复清洗爬片三次,每次洗3 min;(3)加入0.1% 曲拉通100进行穿孔,静置10 min后,每孔加入2 ml pbs清洗,如此重复清洗爬片三次,每次洗3 min;(4)称取1g脱脂奶粉,溶于10 ml pbs中,制成封闭液。爬片放入封闭液中封闭半个小时;(5)根据实验要求稀释一抗,覆盖整个爬片,放入湿盒4
°
c 过夜。
71.(6)每孔加入2 ml pbs清洗,如此重复清洗爬片三次,每次洗3 min;(7)根据实验需要配制dylight 594(抗兔)标记的二抗,覆盖整个爬片。
72.(8)室温条件下孵育1h,每孔加入2 ml pbs清洗,如此重复清洗爬片三次,每次洗3 min;(9)将dapi加到细胞爬片上进行染色,染色2 min,每孔加入2 ml pbs清洗,如此重复清洗爬片三次,每次洗3 min;(10)避光条件下加抗荧光猝灭剂,取新的载玻片,将盖玻片正面朝下转移到新的载玻片上。
73.(11)显微镜拍照。
74.法检测il-18和il-1β表达实验原理:在450 nm处测吸光度值(a),il-18与il-1β浓度与a450值之间呈正相关。根据标准品绘制出标准曲线,将实验样本的od值带入到标准曲线中,即可计算出样本中炎症因子的浓度。
75.实验准备:(1)提前半小时从4 ℃冰箱中取出试剂盒置入室温环境下,使试剂盒中孔板平衡至室温。
76.(2)20
×
洗涤缓冲液的配制,由20
×
洗涤液和蒸馏水配制,配制比例为1:20,即1份20
×
洗涤缓冲液加入19份蒸馏水。根据实验需求,现配现用若未用完。
77.(3)标准曲线的制作,实验按照标准品浓度和od值绘制标准曲线。 il-1β标准品的浓度依次为:80,40,20,10,5,2.5 pg/ml,il-18标准品的浓度依次为:320,160,80,40,20,10 pg/ml。
78.(4)样品的处理:测定样本为细胞时,收集造模48小时的培养基,3000 r/min离心20分钟,取上清即可检测。为避免样本反复冻融,可分装保存至-80 ℃。测定样本为组织时,首先用pbs清洗两遍,以去除残留的血液,称重后剪碎组织。剪碎的组织与对应体积的pbs(一般按9:1的体重比)加入离心管中,用匀浆机在冰上研磨。
79.实验步骤如下:(1)从室温平衡半小时后的铝箔袋中取出所需板条,剩余的板条用自封袋密封放回4 ℃冰箱。
80.(2)根据实验需求设置标准孔和样本孔,标准品孔各加入不同浓度的标准品50 μl。
81.(3)样本空中加入待测样本50 μl;同时设置空白孔,空白孔不加试剂。
82.(4)除空白孔外,标准孔和样本孔中每孔加入辣根过氧化物酶(hrp)标记的检测抗体100 μl,立即用封板膜封住反应孔。37
ꢀ°
c水浴锅或恒温烘箱温育一个小时。
83.(5)弃去板孔中的液体,用滤纸吸干水分。每孔加满稀释后的洗涤液(350 μl),室温静置一分钟,甩去洗涤液,滤纸上吸干水分,如此重复洗板5次。
84.(6)吸干水分的板孔加入底物a、b各50 μl,用锡箔纸包上孔板,37
ꢀ°
c水浴锅或恒温烘箱避光温育半小时。
85.(7)板孔中加入终止液50 μl,十五分钟内,在450 nm波长测定各孔的吸光值。
86.(8)将各孔的od值代入标准曲线中,计算出各组的炎症因子浓度。
87.统计学处理用spss 22.0软件对实验数据进行统计分析,结果用平均标准差表示。测量数据通
过单向方差分析(单向方差分析)进行分析。使用独立样本t检验对两个样本的平均值进行多重比较。p 《 0.05表明差异有统计学意义。
88.结论通过本实验可以得到如下结论:高糖促进肾小球系膜细胞的增殖并上调nf-κb、nlrp3、caspase-1及il-1β的表达。糖尿病肾病小鼠各项生理指标升高,肾功能受损;肾组织内nf-κb、nlrp3、caspase-1及il-1β的表达上调。
89.swietenine能够抑制高糖引起的肾小球系膜细胞增殖,同时还能改善糖尿病肾病小鼠肾脏功能损伤,对肾脏具有保护作用。
90.swietenine通过调控nf-κb和nlrp3/caspase-1/il-1β信号通路,减轻炎症,从而改善糖尿病肾病。
91.此外,本实施例中提取的khayasin t ;6-deoxyswietenine ;3-o-tigloylswietenolide ;swietenolide ;3,6-o,o-diacetylswietenolide ;7-deacetoxy-7-oxogedunin ;fissinolide;proceranolide;7-deacetoxy-7α-hydroxygedunin;上述九种衍生物在治疗糖尿病肾病方面也有积极效果。
92.以上所述,仅用以说明本发明的技术方案而非限制,本领域普通技术人员对本发明的技术方案所做的其它修改或者等同替换,只要不脱离本发明技术方案的精神和范围,均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。