1.本发明涉及光遗传学技术领域,尤其涉及一种光控制系统与肿瘤疾病模型动物光控制方法和应用。
背景技术:
2.光遗传学是一项整合了光学、基因操作技术及软件控制等多学科的交叉的生物工程技术,其中包括以下条件:光敏元件的选择、靶基因的定向导入、光信号的时空调控以及结果的输出。相较于传统的研究方法,光遗传学有着无可比拟的优点。以光作为刺激源,对实验动物的创伤也远小于其他方法,同时还可以通过定位光照来局部刺激细胞或组织,便于实施定位控制。
3.但是,相对于光敏元件的快速开发,光照系统的研发则相对滞后,尤其是应用于动物实验的光照系统。在前期的报道中,不少研究中提及的光照方式是将有线或无线的led光源或光纤直接粘在实验动物的皮肤表面,或者是通过整体的在动物活动区域的上方或者下方实施大功率的光源照射,又或者是通过直接连接到光源的、植入式光纤进行光传输。而这些光照方式均存在一定的缺陷,极大地影响了实验结果的准确性。
4.因此,现有技术还有待于改进和发展。
技术实现要素:
5.鉴于上述现有技术的不足,本发明的目的在于提供一种光控制系统与肿瘤疾病模型动物光控制方法和应用,旨在解决现有光遗传学的光照控制设备在肿瘤免疫治疗领域内研究滞后,缺乏能够便于科研人员操作且能够对实验动物进行智能化实时追踪,以及定点控制光照的基础光控设备的问题。
6.本发明的技术方案如下:
7.一种光控制系统,包括光照笼、架设于所述光照笼上方的龙门架、固定在所述龙门架上的云台和相机、固定于所述云台上的激光器、控制所述云台运动的云台pid控制器、与所述云台pid控制器电连接的控制芯片,与所述控制芯片电连接的显示器;
8.其中,所述相机用于捕获所述光照笼内的目标物以得到所述目标物的位置信息;所述云台pid控制器用于将所述位置信息发送给所述云台使所述云台上的激光器实时照射在所述目标物上。
9.所述的光控制系统,其中,所述光照笼由笼底、第一笼壁、第二笼壁、第三笼壁、第四笼壁和笼盖组成;所述第一笼壁和所述第三笼壁对称设置,所述第二笼壁和所述第四笼壁对称设置;所述第一笼壁和所述第三笼壁靠近所述笼盖方向的一端设有凹槽及接线口。
10.所述的光控制系统,其中,所述第四笼壁包括固定笼壁和活动笼壁,所述固定笼壁固定于靠近所述笼底方向的一端,所述活动笼壁的一边活动连接于所述固定笼壁远离所述笼底方向的一边形成活动窗口。
11.所述的光控制系统,其中,所述笼盖设有透气孔;所述笼底的材质为黑色亚克力
板,所述第一笼壁、第二笼壁、第三笼壁、第四笼壁和笼盖的材质为透明亚克力板。
12.所述的光控制系统,其中,所述显示器的界面包括用于实时显示所述光照笼内部的图像窗口、程序日志窗口以及所述光照笼的笼位选择按键窗口。
13.所述的光控制系统,其中,所述笼位选择按键窗口包括四个。
14.所述的光控制系统,其中,所述光控制系统还包括用于控制所述激光器开关及功率的程控电源。
15.一种肿瘤疾病模型动物光控制方法,具体包括步骤:
16.提供一种如上所述的光控制系统和含有肿瘤的模型动物;
17.利用所述相机获取所述模型动物的位置信息,并将所述位置信息发送到云台pid控制器;
18.所述云台pid控制器控制所述云台的移动轨迹,使所述云台搭载的激光器对所述模型动物进行跟踪照射。
19.所述的肿瘤疾病模型动物光控制方法,其中,利用所述相机获取所述模型动物的位置信息,并将所述位置信息发送到云台pid控制器前还包括步骤:
20.使用模型动物专用的动物标记笔在所述模型动物背部圈出肿瘤位置;
21.利用所述相机捕获图像后,通过颜色蒙版识别所述模型动物背部标记笔的标记,然后进行形体学腐蚀处理剔除杂噪、形态学膨胀后生成模型动物标记掩模。
22.一种光控制系统在肿瘤疾病模型中的应用,将所述的光控制系统应用于肿瘤疾病模型中。
23.有益效果:本发明提供一种光控制系统与肿瘤疾病模型动物光控制方法和应用,所述光控制系统包括光照笼、架设于所述光照笼上方的龙门架、固定在所述龙门架上的云台和相机、固定于所述云台上的激光器、控制所述云台运动的云台pid控制器、与所述云台pid控制器电连接的控制芯片,与所述控制芯片电连接的显示器;其中,所述相机用于捕获所述光照笼内的目标物以得到所述目标物的位置信息;所述云台pid控制器用于将所述位置信息发送给所述云台使所述云台上的激光器实时照射在所述目标物上。将所述光控制系统应用于肿瘤疾病模型中时,可以实现激光器对单个目标物进行定点定量的光照控制,能够实现对自由运动的实验动物的特定部位进行实时追踪,保证对动物特定部位持续恒定地施加光照,在不需要对实验动物外加创伤和避免近距离光产生的热对实验结果的影响下,可专一的应用于观察光控表达的基因对实验动物的影响。
附图说明
24.图1为本发明光控制系统的结构示意图;
25.图2为本发明显示器的界面示意图;
26.图3为本发明实施例1的光控细胞因子表达质粒的构建和体外验证数据图;
27.图4为本发明实施例1的光控制系统在正常小鼠肿瘤模型中的应用数据图;
28.图5为本发明实施例1的光控制系统在光控小鼠肿瘤模型中的应用数据图;
29.图6为本发明实施例1光照组和非光照组的分析比较图。
30.附图标记说明:光照笼10、龙门架20、云台30、相机40、激光器50、显示器60、笼底11、第一笼壁12、第二笼壁13、第三笼壁14、第四笼壁15、笼盖16、凹槽17、接线口18、卡扣19、
固定笼壁151、活动笼壁152、透气孔161、通孔162。
具体实施方式
31.本发明提供一种光控制系统与肿瘤疾病模型动物光控制方法和应用,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
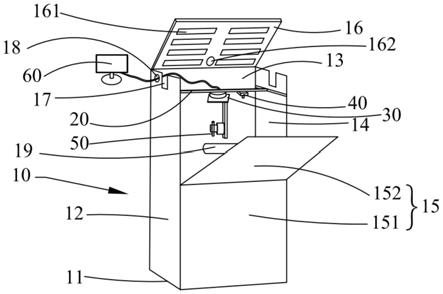
32.本技术的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“长度”、“宽度”、“厚度”、“上”、“下”、“前”、“后”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本技术和简化描述,而不是指示或暗示所指的装置或元件必须具有的特定的方位、以特定的方位构造和操作,因此不能理解为对本技术的限制。此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、”第二”的特征可以明示或隐约地包括一个或者更多个所述特征。
33.本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语),具有与本发明所属领域中的普通技术人员的一般理解相同的意义。还应该理解的是,诸如通用字典中定义的那些术语,应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非像这里一样被特定定义,否则不会用理想化或过于正式的含义来解释。
34.目前,在神经学领域内,特别是探索神经回路和大脑功能之间的关系中,光遗传学的相关技术和方法得到了持续的发展。与此同时,相关光敏蛋白的发现和改造,也使得这项技术的应用逐渐扩展到其他生物医学领域。2012年,一项新的光开关基因表达系统被成功开发,通过光照成功的降低了糖尿病小鼠中的血糖水平。此后,通过改造t细胞的迁移受体,从而实现光对免疫细胞的定向招募及激活杀伤功能,以达到杀伤肿瘤的目的。并将光遗传学的应用推向目前研究热点的肿瘤免疫学方向。随后,针对car-t疗法在实体瘤治疗中的局限性,越来越多的肿瘤免疫疗法中用到了光遗传学的相关技术。
35.但是,相对于以上光敏元件的快速开发,光照系统的研发则相对滞后,尤其是应用于实验动物的光照系统。在现有的光照方式中,有不少是将有线或无线的led光源或光纤直接粘在实验动物皮肤表面,而这种直接粘贴到动物皮肤表面的有线光纤传输的方式,由于阻止了实验动物的自由移动,因而不适用于长时间的光照实验,同时还有可能升高光照区域的皮肤温度,进而影响动物的正常生活环境及最终实验结果。另外,还有通过直接连接到光源的、植入式光纤进行光传输,而这种有创伤的植入式光照方式,由于创伤方式对健康动物自身的损伤,也可能对最终实验结果造成不良影响。尽管有研究者尝试开发了无线的红外光装置来控制动物大脑活动,但仍要通过已预先植入的转换器件进行区域识别,而后再打开光源,由于光源位置固定,所以只能在动物靠近光源时才能够激活,不能够进行自由的智能追踪,也无法保证光照的持续性。对于整体光照动物的方式,也存在对实验动物眼睛造成感光不适、影响动物正常生活环境等问题。
36.因此,现有光照系统均不利于实验人员的便捷操控,且可能因为影响到实验动物自身健康及生存环境而造成实验结果出现偏差。因而,为了可长时间应用于活体实验动物和可控制光照条件(时间及强度),迫切需要开发一套能够实现智能化实时追踪的便携式无
线光照控制系统。
37.基于此,请参照附图1,本发明提供一种光控制系统与肿瘤疾病模型动物光控制方法和应用,其中,所述光控制系统包括:光照笼10、架设于所述光照笼10上方的龙门架20、固定在所述龙门架20上的云台30和相机40、固定于所述云台30上的激光器50、控制所述云台30运动的云台pid控制器、与所述云台pid控制器电连接的控制芯片以及与所述控制芯片电连接的显示器60。
38.在一些实施方式中,所述相机40用于捕获所述光照笼10内的目标物以得到所述目标物的位置信息;所述云台pid控制器用于将所述位置信息发送给所述云台30使所述云台30上的激光器50实时照射在所述目标物上。本实施方式中,所述目标物为小鼠,且在所述光照笼内可自由移动。
39.在一些实施方式中,以小鼠为例,利用所述相机40捕获所述光照笼10内的目标物以获得所述目标物的位置信息具体包括步骤:先采用小鼠专用的动物标记笔在小鼠背部圈出肿瘤的位置(即圈内为肿瘤);然后利用所述相机捕获图像后,应用颜色蒙版识别小鼠背部肿瘤部位的标记圈,使用形态学腐蚀处理剔除杂噪,形态学膨胀操作后生成小鼠标记掩模;随后利用计算机计算掩模轮廓的质心,逐帧计算运动中的小鼠背部肿瘤质心,再通过opencv库对小鼠背部的肿瘤质心进行实时跟踪并获取小鼠的坐标;准确识别并追踪到肿瘤后,将小鼠坐标传输到云台pid控制器,云台pid控制器再将接收的小鼠坐标转换为云台坐标,然后通过云台的移动使所述激光器50发出的光源实时照射在小鼠背部的标记圈处,即小鼠肿瘤位置,从而实现对小鼠的运动进行实时跟踪并局部照射光源。
40.在一些实施方式中,所述云台30由无刷电机提供运动的动力;具体地,所述云台pid控制器与所述云台30进行电连接,所述云台30与所述无刷电机进行电连接,通过云台pid控制器控制的云台30使所述无刷电机在运动过程中保持稳定。
41.在一些实施方式中,所述光照笼10由笼底11、第一笼壁12、第二笼壁13、第三笼壁14、第四笼壁15和笼盖16组成;所述第一笼壁12和所述第三笼壁14对称设置,所述第二笼壁13和所述第四笼壁15对称设置;所述第一笼壁12和所述第三笼壁14靠近所述笼盖16方向的一端设有凹槽17及接线口18。所述光照笼的体积大小可根据实验需要进行设计,可以满足模型动物自由活动即可。
42.具体地,当所述光照笼10的位置固定且不经常搬运时,所述笼底11、第一笼壁12、第二笼壁13、第三笼壁14、第四笼壁15和笼盖16的边缘进行固定连接,使得光照笼更加牢固、耐用。
43.当所述光照笼的使用地点不定,需要到处搬运时,所述笼底11、第一笼壁12、第二笼壁13、第三笼壁14、第四笼壁15和笼盖16的边缘进行可拆卸拼接有利于搬运和在不使用时节省空间。
44.具体地,所述笼盖16的其中一边与所述第二笼壁13远离所述笼底11的一边进行活动连接,便于后期对云台、激光器等设备进行检修。
45.在一些实施方式中,所述第四笼壁15包括固定笼壁151和活动笼壁152,所述固定笼壁151固定于靠近所述笼底11方向的一端,所述活动笼壁152的一边活动连接于所述固定笼壁151远离所述笼底11方向的一边形成活动窗口,以便于模型动物的取放。
46.在本实施方式中,所述第一笼壁12、第二笼壁13、第三笼壁14、第四笼壁15的其中
一个笼壁内侧设有卡扣19,所述卡扣用于安装饮水瓶,为模型动物提供饮用水。
47.在一些实施方式中,所述笼盖16设有透气孔161,使光照笼10与外界相通,为生活在所述光照笼10内的小鼠提供氧气;所述笼底11为黑色不透明材质,所述第一笼壁、第二笼壁、第三笼壁、第四笼壁和笼盖为透明材质;具体地,所述笼底11的材质为黑色亚克力板,所述第一笼壁12、第二笼壁13、第三笼壁14、第四笼壁15和笼盖16的材质为透明亚克力板,当然,选择透明的玻璃也可以,本实施例选用亚克力板,主要是亚克力板质量较轻,可以降低所述光照笼的整体重量,提高便携性。
48.在本实施方式中,所述笼盖16还设有通孔162,所述通孔可用于通入导线等。
49.在一些实施方式中,如图2所示,所述显示器60的界面包括用于实时显示所述光照笼内部的图像窗口、程序日志窗口以及所述光照笼的笼位选择按键窗口。通过所述笼位选择按键窗口,可以选择所要控制的光照笼,并将所选的光照笼的内部情况呈现在图像窗口,方便随时观察及调整光照笼内的光照强度和时间。通过所述程序日志窗口可以获得所述光照笼内的具体时间对应的具体光照强度和时间参数,了解光照强度和时间对小鼠肿瘤的影响。
50.在一些实施方式中,所述控制芯片还与光照时间控制器电连接,所述显示器的界面还包括用于调节光照时间长短的时间调节窗口,通过所述时间调节窗口设置所述激光器50发出光线的时间,即通过所述光照控制器根据所述时间调节窗口设置的时间,对激光器的开关进行控制,进而达到对小鼠进行定时照射的目的。
51.在一些实施方式中,所述笼位选择按键窗口包括但不限于四个,也就是说,通过所述光控制系统,可以对四个光照笼进行控制;具体地,所述笼位的选择按键窗口还可以为2个、3个、5个或者6个等,也就是说,通过所述光控制系统,可以对2个、3个、5个或者6个光照笼进行控制。
52.在一些实施方式中,所述光控制系统还包括用于控制所述激光器开关及功率的程控电源,所述程控电源与所述激光器和所述控制芯片分别进行电连接。
53.本发明提供的光控制系统具有可以保证对单只动物进行定点定量的光照控制,同时也可以保证长时间的实验过程中,实验动物生存所需的水、食物及活动空间;而相机、云台pid控制器、云台等的相互配合,能够实现对自由运动的实验动物的特定部位进行实时追踪,保证对动物特定部位持续恒定的施加光照,不需要对实验动物外加创伤,也避免近距离光产生的热对实验结果的影响,因而可专一的应用于观察光控表达的基因对实验动物的影响。
54.除此之外,本实施方式还提供一种肿瘤疾病模型动物光控制方法,具体包括步骤:
55.步骤s10:提供一种如上所述的光控制系统和含有肿瘤的模型动物;
56.步骤s20:利用所述相机获取所述小鼠的位置信息,并将所述位置信息发送到云台pid控制器;
57.步骤s30:所述云台pid控制器控制所述云台的移动轨迹,使所述云台搭载的激光器对所述模型动物进行跟踪照射。
58.在一些实施方式中,利用所述相机获取所述模型动物的位置信息,并将所述位置信息发送到云台pid控制器前还包括步骤:
59.步骤s11:使用模型动物专用的动物标记笔在所述模型动物背部圈出肿瘤位置;
60.步骤s12:利用所述相机捕获图像后,通过颜色蒙版识别所述模型动物背部标记笔的标记,然后进行形体学腐蚀处理剔除杂噪、形态学膨胀后生成模型动物标记掩模。
61.具体地,使所述云台搭载的激光器对所述模型动物进行跟踪照射具体包括:所述云台搭载的激光器对所述模型动物标记掩模进行跟踪照射。
62.在本实施方式中,选用小鼠作为模型动物。
63.另外,本发明还提供一种光控制系统在肿瘤疾病模型中的应用,将所述的光控制系统应用于肿瘤疾病模型中。
64.简而言之,以小鼠为例,当将所述光控制系统应用在肿瘤疾病模型中时,先采用小鼠专用的动物标记笔在小鼠背部圈出肿瘤的位置(即标记圈内为肿瘤);然后利用所述相机捕获图像后,应用颜色蒙版识别小鼠背部肿瘤部位的标记圈,使用形态学腐蚀处理剔除杂噪,形态学膨胀操作后生成小鼠标记掩模;随后利用计算机计算掩模轮廓的质心,逐帧计算运动中的小鼠背部肿瘤质心,再通过opencv库对小鼠背部的肿瘤质心进行实时跟踪并获取小鼠的坐标;准确识别并追踪到肿瘤后,将小鼠坐标传输所述控制芯片后经过控制芯片的处理再传输给云台pid控制器,云台pid控制器再将接收的小鼠坐标转换为云台坐标,然后通过云台的移动使所述激光器50发出的光源实时照射在小鼠背部的标记圈处,即小鼠肿瘤位置,从而实现对小鼠的运动进行实时跟踪并局部照射光源。
65.需要解释的是,本实施方式的标记笔标记的圈为红色,应用颜色蒙版识别小鼠背部肿瘤部位是识别该红色的圈。当然,圈的颜色可以多选。
66.除此之外,本发明除了使用蓝光光照系统外,还可以利用红光或者其他光源作为照射工具,以及不同的光敏蛋白来改造不同类型的细胞,如t细胞、nk细胞等。进而通过小鼠对特定的疾病进行研究,如关节炎等,而不仅仅局限于肿瘤这一类型的疾病。并且,本发明的光控制系统可以应用到其他的动物实验模型中,如大鼠、兔子等,仅需要改造适配的光照笼。
67.下面进一步举例实施例以详细说明本发明。同样应理解,以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的一些非本质的改进和调整均属于本发明的保护范围。
68.实施例1
69.首先,利用光开关系统,我们构建了一套蓝光激活的细胞因子表达质粒,并选择p815肿瘤细胞系作为底盘细胞进行改造,稳定转染光控质粒的工程化细胞及对照细胞分别注射到dba/2小鼠背部,7天后,用小鼠专用的标记笔(红色)标记出肿瘤位置,而后将动物置于光照笼中进行光控实验。
70.具体地,如附图3所示:a.光控细胞因子表达原理图及质粒构建示意图(包括:细胞因子组及无细胞因子的对照组),细胞在无蓝光照射时,胞内存在的gavpo为单体形式,不结合启动子,也不表达靶基因;而在蓝光照射下,gavpo单体二聚化,形成的二聚体结合到5
×
uas区域,而后启动下游靶基因的表达。
71.b.针对体外细胞水平的光控制系统,包括固定板、水循环的温控系统、可以同时进行24孔板光照的led光源(每个孔的光强都是独立设定的)。
72.c.利用稳转光控质粒的细胞系p815-mruby-ils,检测荧光蛋白mruby在不同光强下的表达曲线(用于探索体外培养时的最佳光照条件:包括光强及光照时间)。
73.d.在选定的光强下,连续光照不同时间后,细胞因子组及对照组表达细胞因子的含量。
74.e.选择12小时开/关及完全关闭光源时,细胞因子的表达量(为动物实验确定光照时间)。
75.在体外细胞水平上,确定了最佳光照强度,并对比了不同光照时间下细胞因子mrna的表达量。同时发现,相比较于连续光照系统,12小时开/关的光照方式可以释放更多的细胞因子,也更符合动物的正常昼夜节律,所以后续的动物实验中采用了12小时开/关的光照方式。
76.需要说明的是,光控制系统里面的细胞因子可以根据不同的疾病而选用不同的疾病因子组合,包括促炎类和抑炎类细胞因子,或者是细胞因子和趋化因子的组合。
77.以稳转肿瘤细胞株p815-mruby-fluc作为对照组(不含光控细胞因子表达系统),观察光照对实验动物正常肿瘤生长及细胞因子表达的影响,如附图4:
78.a.动物实验设计示意图。
79.b.无细胞因子的对照肿瘤组,在连续6天(12h on/off)的蓝光照射下,小鼠体内肿瘤的活体成像图(左一:黑暗组;其余四只为光照组)。
80.c.检测代表肿瘤细胞的萤光素酶的含量。
81.d.光照结束后取小鼠肿瘤,检测其中细胞因子mrna的表达量(光照组与黑暗组对比)。
82.e-g.光照组与黑暗组小鼠血液中几种代表性细胞因子的水平。
83.h-i.光照组及黑暗组的肿瘤小鼠与正常小鼠的wbc及淋巴细胞的对比。
84.结论:如附图4所示,在连续6天(12h开/关)的蓝光定点实时照射下,光照组与未光照组的肿瘤体积没有出现明显差异,也未发现相关细胞因子有明显表达差异,包括:minfγ、mcxcl10、mil-6、m1l-10。同时,未见小鼠wbc及淋巴细胞在蓝光照射下有明显变化。说明对正常的肿瘤小鼠进行蓝光照射没有明显的影响。
85.在确定光控系统及蓝光照射对正常肿瘤小鼠没有影响后,我们在小鼠体内不同位置同时接种光控肿瘤细胞和正常肿瘤细胞,如附图5所示:
86.a.同时接种细胞因子组的肿瘤(left)及对照肿瘤细胞(right)于同一小鼠的后背两侧,而后进行连续6天(12h on/off)的蓝光照射,每隔两天对肿瘤动物进行活体成像(左一:黑暗组;其余四只为光照组)。
87.b.检测代表肿瘤细胞的萤光素酶的含量。
88.c.结束光照后,取小鼠体内肿瘤进行拍照对比。
89.d-e.光照结束后取小鼠肿瘤,检测其中细胞因子mrna的表达量(光照组与黑暗组对比)。
90.f-h.光照组与黑暗组小鼠血液中几种代表性细胞因子的水平。
91.i-j.光照组及黑暗组的肿瘤小鼠与正常小鼠的wbc及淋巴细胞的对比。
92.结论:如附图5所示,和正常的肿瘤组相比,光控肿瘤体积在蓝光照射后明显变小,同时小鼠体内的细胞因子也有较明显的变化,如明显升高mcxcl10,和有下降趋势的m1l-10。另外,小鼠体内的wbc及淋巴细胞也在光照下出现较为明显变化。
93.为了进一步探索肿瘤微环境是否因为光控基因的表达而发生变化,对有无光照的
小鼠肿瘤组织进行rna-seq分析及切片染色观察,如附图6所示,初步的肿瘤rna-seq实验数据表明:蓝光照射后的工程化肿瘤细胞内,有较多的免疫相关分子表达的上调,以及相关信号通路的激活(a-b)。同时,和正常肿瘤及无光照情况下的工程化肿瘤组相比较,工程化改造的肿瘤细胞在光照下,瘤体内免疫细胞数量明显增加,包括dc细胞及cd8 t细胞(c-d)。提示光照后的肿瘤消退与杀伤性免疫细胞的浸润有关。
94.综上所述,本发明提供一种光控制系统与肿瘤疾病模型动物光控制方法和应用,所述光控制系统包括光照笼、架设于所述光照笼上方的龙门架、固定在所述龙门架上的云台和相机、固定于所述云台上的激光器、控制所述云台运动的云台pid控制器、与所述云台pid控制器电连接的控制芯片,与所述控制芯片电连接的显示器;其中,所述相机用于捕获所述光照笼内的目标物以得到所述目标物的位置信息;所述云台pid控制器用于将所述位置信息发送给所述云台使所述云台上的激光器实时照射在所述目标物上。将所述光控制系统应用于肿瘤疾病模型中时,可以实现激光器对单个目标物进行定点定量的光照控制,能够实现对自由运动的实验动物的特定部位进行实时追踪,保证对动物特定部位持续恒定地施加光照,在不需要对实验动物外加创伤和避免近距离光产生的热对实验结果的影响下,可专一的应用于观察光控表达的基因对实验动物的影响。
95.应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。