1.本发明涉及生物药用领域,尤其涉及基于织物的温敏凝胶式医用敷料的制备方法。
背景技术:
2.对于平常可见的疾病如发烧感冒来说,传统的治疗方法主要为静脉注射药物和口服药物。其中皮下静脉注射型给药往往会给病人带来痛苦和恐惧;而以口服的方式给药,药物进入人体后,会迅速溶解到血液中,造成短时间内血液中的药物浓度的迅速增高,一段时间后如果不继续进药,血液中药物的浓度又会迅速降低,达不到治疗的效果。而且很多的药物具有肠胃首过效应,服用过多会对人的身体健康产生影响。
3.目前,最有效的药物传递系统为靶向定向制剂,但靶向制剂成本较高,且技术难度很大,在使用过程中依然存在着很多的限制。在此环境下,介于传统制剂与靶向制剂之间的缓、控释制剂是当前研究和产业化的主流。透皮给药系统(transdermal drug delivery system,tdds)是目前控制给药系统中研究最广泛的课题之一,可以较好的代替口服和注射药物,皮肤作为人体最大的器官,可以提高对药物的利用率和定向性。此外,tdds作为非侵入型的给药方式,还可以设计为持续释放药物延长给药时间等形式,从而减少给药次数,保证了患者的舒适性以及减少了对人体的侵害,相比传统的膏药或喷剂,药物缓释型医用敷料方便穿戴且具有良好的透湿舒适性,可与日常生活中的传统织物有效结合、使用,因此药物缓释型医用敷料的开发具有重要的现实意义及人文关怀精神。
4.药用纺织品作为医用纺织品中的一大分类,具有很高的附加价值。早在古代时期,人们就利用含有中草药的布袋来吸收药物中的活性成分,或让药物中的活性成分直接渗透进入身体中;进入工业革命后,随着自然科学的发展和工业技术的进步,更多的新型纤维被合成,利用天然或人造纤维作为药物载体的医用纺织品也大幅增加,主要以绷带、医疗保健纺织品、伤口敷外、外科用辅料的纺织品或贴剂的形式来治疗皮肤病和一些其他的系统疾病;在二十世纪五六十年代之后,药物控缓释技术越来越多的受到关注,它具有降低药物释放速率,减少药物对人体毒性,延长药物释放时间,提高药物利用率等诸多优点。如今,人们已经使用各种各样的材料用于药物传递系统,例如微/纳米微球,脂质体,胶束,水凝胶和微粒等。在药物传递系统的构造过程中,可通过改变温度和ph值,变化有机溶剂、交联剂、添加剂、乳化剂等方式进行,但可能会对人体产生不良的影响。
5.当下还没有一种高分子聚合物,可在条件较为温和的情况下,对药物进行装载,并且在后期的制备、表征、应用等各方面都有很大的便利性,且其对药物的药理药性影响很小,保留原来的性能。
技术实现要素:
6.本发明克服了现有技术的不足,提供基于织物的温敏凝胶式医用敷料的制备方法。
7.为达到上述目的,本发明采用的技术方案为:基于织物的温敏凝胶式医用敷料的制备方法,包括以下步骤:s1:将壳聚糖溶解于盐酸溶液中,搅拌得到壳聚糖溶液;将甘油磷酸钠溶解于去离子水后,将其加入壳聚糖溶液中,得到壳聚糖/甘油磷酸钠溶液;s2:将京尼平溶解于乙醇溶液中,加入壳聚糖/甘油磷酸钠溶液,得到京尼平改性壳聚糖温敏凝胶溶液;s3:将乙酰氨基酚药物溶解于上述京尼平改性壳聚糖温敏凝胶溶液,将织物浸渍于载药凝胶溶液中直至凝胶溶液均匀分散于织物内外,将浸渍完凝胶溶液的织物通过容器密闭置于目标温度环境中使其凝胶化。
8.本发明一个较佳实施例中,s3中采用的织物为棉,或丝绸,或棉与丝绸的混纺织物。
9.本发明一个较佳实施例中,s1中采用0.05mol/l-0.2mol/l盐酸溶液。
10.本发明一个较佳实施例中,s1中甘油磷酸钠溶液逐滴滴入壳聚糖溶液中,且边滴加边搅拌,用以调节溶液ph值至6-8。
11.本发明一个较佳实施例中,s3中织物表面凝胶溶液的溶-凝胶转变的目标温度为35℃-40℃。
12.本发明一个较佳实施例中,s3中织物在载药的凝胶溶液中反复浸压。
13.本发明一个较佳实施例中,s1中需对盐酸溶液中的壳聚糖搅拌至少2h,直至壳聚糖完全溶解,溶液呈无色透明状微粘稠状态。
14.本发明一个较佳实施例中,s2中京尼平溶解于40%-60%乙醇溶液中。
15.本发明一个较佳实施例中,s2中京尼平质量占总溶液质量的0.005%-0.02%。
16.本发明一个较佳实施例中,s2中京尼平溶液逐滴滴入壳聚糖/甘油磷酸钠溶液中,边滴加边搅拌。
17.本发明一个较佳实施例中,还包括计算总载药量w0,s3中乙酰氨基酚药物浓度与其所在总溶液质量之比为ρ,单位织物原始重量m1,单位织物浸渍完成后重量m2,单位织物的载药量通过式w0=ρ
×
(m
2-m1)得出。
18.本发明一个较佳实施例中,所述目标温度环境采用能够密闭的体箱。
19.本发明解决了背景技术中存在的缺陷,本发明具备以下有益效果:
20.对温敏凝胶进行交联改性,使得其具有药物缓释效应,同时,利用温敏凝胶在人体体温附近受到温度的刺激实现溶-凝胶转变的特性,方便对织物进行快速且均匀的整理,具备规模化制备的潜力。
21.具体的,首先制备了壳聚糖/甘油磷酸钠(cs/gp)温敏凝胶,cs/gp作为一种反向温敏水凝胶,当ph值为中性时可在室温下保持溶液状态,但在温度升至人体体温附近时会发生溶-凝胶转变,变为固体的凝胶状态。利用瓶倒置法和流变仪探究了壳聚糖浓度和ph对温敏响应时间和成胶温度的影响,当壳聚糖浓度为2.22%,ph为7.15时,可达到在37℃最短凝胶时间。甘油磷酸钠在凝胶过程中用于接收壳聚糖上的质子,处于自由扩散的状态,并未参与交联反应。同时,该温敏凝胶内部呈现三维多孔状结构,可用于负载药物实现缓释的效果。
22.然后利用新型天然交联剂京尼平对cs/gp温敏凝胶进行交联改性,京尼平可自发的与壳聚糖上的氨基发生交联反应,并产生特征蓝色,f壳聚糖与京尼平之间的成功交联,京尼平可进一步缩短凝胶对温度的响应时间,经交联后凝胶内部孔隙更为致密,京尼平对
cs/gp凝胶结构稳定性和机械强力也有显著提高。通过将对乙酰氨基酚(aap)药物模型共溶进入凝胶溶液中制备载药温敏凝胶,0.01%的京尼平添加量即可使得药物缓释时长比原来纯的cs/gp延长一倍达到12h之久。
23.最后,采用浸渍法将载药温敏凝胶溶液对真丝织物进行整理,当置于37℃环境中时,附着在织物内外表面的凝胶由液态转变为凝胶固态,凝胶在织物上形成一层致密的多孔结构,该织物凝胶型医用敷料的水蒸气透过率(wvtr)与整理前的织物相差无几,良好的透湿性可以保证患者的舒适体感,对于医用敷料来说具有重要意义。
附图说明
24.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图;
25.图1是本发明的优选实施例的不同cs浓度及ph条件下的凝胶化时间;
26.图2是本发明的优选实施例的cs/gp凝胶水溶液的动态应变扫描图;
27.图3是本发明的优选实施例的不同ph时cs/gp凝胶的g'和g"随温度变化的情况;
28.图4是本发明的优选实施例的不同温度下cs/gp水凝胶的g'和g"随频率变化的情况;
29.图5是本发明的优选实施例的cs/gp温敏凝胶的表面及内部的扫描照片;
30.图6是本发明的优选实施例的cs,gp以及cs/gp凝胶的红外光谱图;
31.图7是本发明的优选实施例的壳聚糖与京尼平反应的红外光谱图;
32.图8是本发明的优选实施例的壳聚糖与京尼平交联前后xps中的c1s和o1s窄谱峰的变化;
33.图9是本发明的优选实施例的添加不同浓度京尼平的凝胶的g'和g"随时间变化的情况;
34.图10是本发明的优选实施例的添加不同浓度京尼平的凝胶的g'和g"随频率变化的情况;
35.图11是本发明的优选实施例的aap的紫外特征吸收光谱图;
36.图12是本发明的优选实施例的aap浓度对应吸光度的标准曲线;
37.图13是本发明的优选实施例的不同浓度京尼平对凝胶释药性能的影响;
38.图14是本发明的优选实施例的0.01%京尼平添加量凝胶内部结构;
39.图15是本发明的优选实施例的0.025%京尼平添加量凝胶内部结构;
40.图16是本发明的优选实施例的0.04%京尼平添加量凝胶内部结构;
41.图17是本发明的优选实施例的cs/gp与cgg凝胶的应力应变曲线;
42.图18是本发明的优选实施例的干燥后的cs/gp与cgg凝胶的热重曲线;
43.图19是本发明的优选实施例的不同的织物类型对释药性能的影响;
44.图20是本发明的优选实施例的不同姆米织物的最终释药量;
45.图21是本发明的优选实施例的不同药物浓度的试样累积释放率;
46.图22是本发明的优选实施例的不同温度下药物的累积释放率;
47.图23是本发明的优选实施例的原真丝织物表面形貌;
48.图24是本发明的优选实施例的原真丝织物截面形貌;
49.图25是本发明的优选实施例的cs/gp整理后表面形貌;
50.图26是本发明的优选实施例的cs/gp整理后截面形貌;
51.图27是本发明的优选实施例的cgg整理后表面形貌;
52.图28是本发明的优选实施例的cgg整理后截面形貌;
53.图29是本发明的优选实施例的不同姆米真丝织物整理前后的厚度变化;
54.图30是本发明的优选实施例的不同姆米真丝织物整理前后的水蒸气透过率变化;
55.图31是本发明的优选实施例的水洗后织物质量损。
具体实施方式
56.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
57.下文包括(1)制备了壳聚糖/甘油磷酸钠温敏凝胶组合,探究了凝胶时间、成胶温度的影响因素以及凝胶机理。(2)利用京尼平对cs/gp温敏凝胶组合进行改性,探究了京尼平的含量对水凝胶凝胶时间、机械性能和内部孔径的影响。(3)以退烧止痛药对乙酰氨基酚(aap)作为药物模型,研究了改性前后的水凝胶对其释放时长的影响。(4)将温敏凝胶与棉或丝绸织物相结合,探究了织物对凝胶释药性能的影响,利用数学模型对该温敏凝胶式医用敷料的缓释机理进行研究。(5)表征了经凝胶整理后织物的厚度变化、吸水透湿性能以及耐水洗性能等实用性能。
58.本发明中织物采用了丝绸作为基底,应当意识到,还可以采用棉或棉与丝绸的混纺织物进行制备,例如脱脂棉,能够具备同样的效果。
59.需要说明的是,壳聚糖(cs)是一种由甲壳质脱乙酰基得到的具有广泛应用价值的天然生物多糖高分子材料。壳聚糖分子链上含有羟基,氨基以及n-乙酰氨基,这些基团之间可以形成分子间及分子内氢键,使得壳聚糖在有机溶剂、水和碱性溶液中难以溶解;在酸性溶液中,其分子结构中的-nh2可以与h 相结合,氨基质子化后破坏了分子内氢键作用,可使得壳聚糖溶解。弱碱盐甘油磷酸钠(gp)可中和壳聚糖酸性溶液中的h ,并且由于甘油磷酸钠的醇组与水分子的氢键作用提高额外的水合作用,使得壳聚糖溶液在中性条件下也能保持溶解状态。不仅如此,当将该溶液放置于人体体温附近环境中时,该溶液可迅速凝胶化。
60.实施例一:
61.称取不同质量(50mg,75mg,100mg,125mg)的壳聚糖粉末溶解于hcl溶液中,利用磁力搅拌器搅拌均匀,得到不同浓度澄清透明的壳聚糖溶液;将甘油磷酸钠溶解于去离子水中,待溶解完全,将其逐滴滴入壳聚糖溶液中,边滴加边搅拌,调节溶液ph至不同值。待用的壳聚糖/甘油磷酸钠溶液可保存至低温环境中,若使其凝胶化将其转移至37℃体箱环境中即可。
62.玻璃瓶倒置法测试cs/gp的凝胶化时间:将样品分装到小玻璃瓶中,放置于37℃恒温孵箱环境里,每隔1min转动一下小玻璃瓶,当玻璃瓶中的流动态凝胶溶液转变为不再流动的凝胶固体时,所需要的时间记为凝胶化时间。
63.流变性能测试:测试温敏凝胶的动态流变性能,将低温下制备的cs/gp凝胶水溶
液,每次测试时依据参照量吸取溶液平铺于帕尔贴温控平台上,保证夹具间填充满样品,吸出多余样品,周围用硅油密封防止蒸发。按照设定程序分别进行动态应变扫描实验,温度扫描实验以及频率扫描实验。
64.扫描电镜(sem)表征:将制得的凝胶固体冷冻,待其冷冻结实后快速转移至冷冻干燥机里干燥48小时去除内部的水分,冷冻干燥可以保证不破坏物质内部原有的结构。将干燥后的样品用刀片沿直线切开,贴于样品台上,经过喷金处理后,利用扫描电子显微镜放大观察并拍照。
65.红外光谱(ft-ir)测试:取壳聚糖,甘油磷酸钠以及经冷冻干燥后的壳聚糖/甘油磷酸钠凝胶粉末分别与kbr粉末以混合研磨,再经压片烘干置于傅立叶红外光谱仪上进行测试,扫描范围为4000cm-1
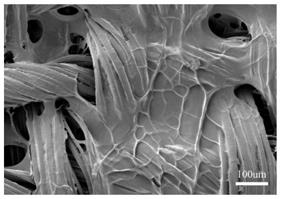
~400cm-1
。
66.元素分布(eds)分析:将制得的温敏凝胶置于去离子水中浸泡然后与未经洗涤的凝胶样品一起放入冷冻干燥机中冻干,置于与eds能谱仪相连接的台式电镜中扫描测定平衡样品中na和p元素含量的变化。
67.上述测试与表征结果:在室温环境中,壳聚糖分子溶于稀盐酸溶液呈现澄清透明的状态。在酸性条件下,cs分子链段上的氨基发生质子化并带正电荷,破坏了分子内氢键和立体规整性,使得cs分子内/间产生静电斥力,故而使得链段充分伸展而溶解;cs/gp在37℃环境中受到温度刺激转变为凝胶状态,该凝胶为白色不可流动状固体。利用cs/gp温敏凝胶的这种特性可以方便后续装载药物以及对织物的浸渍整理等。
68.壳聚糖溶液浓度及ph对凝胶时间的影响:如图1所示,37℃条件下,不同的壳聚糖浓度及ph条件下cs/gp溶液的凝胶化时间测定结果,由图1可以看出cs/gp温敏凝胶的凝胶时间既受到壳聚糖浓度的影响,也与溶液的ph有关。壳聚糖分子溶解于弱酸性条件下,随着甘油磷酸钠的加入溶液的ph会不断升高,gp可以调节壳聚糖溶液至中性环境中而不析出沉淀。推测认为加热可诱导壳聚糖上的质子转移到gp上从而中和cs,使其链间形成了吸引力,从而使得cs链聚集形成凝胶。当溶液ph一定时,cs浓度越大,凝胶化转变所需时间越短,这是因为壳聚糖分子链作为凝胶结构的主体支撑部分,随着浓度的升高其聚集在一起就越容易。此外,当cs浓度一定时,ph值越高,即溶液中的gp含量越大,其所能接受的质子数也就越快越多,使得凝胶化时间减少。当溶液ph=7时,cs浓度小于2.22%时,未形成凝胶,说明当cs比较分散且没有足够的gp来中和其表面的质子时,构不成凝胶形成的条件。当cs浓度大于2.22%时,虽然可在最短的时间内凝胶化,但是在此浓度下壳聚糖在稀盐酸中并不能完全溶解,故确定cs浓度为2.22%。
69.壳聚糖温敏凝胶的流变学性能测试:流变学是研究材料流动及变形的科学,通过测定样品动态的机械学性质,可以研究其成胶机理及内部结构变化。储能模量g'又称弹性模量,是指材料在发生形变时由于弹性(可逆)形变而储存能量的大小,损耗模量g"又称粘性模量,是指材料在发生形变时由于粘性形变(不可逆)而损耗的能量大小。当储能模量g'大于损耗模量g"时,材料发生的是弹性形变,反映了物质主要称固体状态,而当损耗模量大于储能模量时,物质主要发生液态的粘性形变,利用高分子材料的这一流变性质,可以通过储能模量g'和损耗模量g"的变化反映物质的状态变化和内部结构。
70.动态应变扫描实验:线性粘弹区指储能模量g'和耗能模量g"都不随应变频率的变化而变化。只有在线性粘弹区内的测量才可以获得物质的特征常数,因此首先确定物质的
线性粘弹区以选择合适的应变,使得后续的实验在线性粘弹区内进行且产生足够大的响应。设置温度为25℃,角速度为10rad/s,扫描应变范围为0.01%-10%,由图2可以看出当应变增大到1%时,g'和g"均不随应变的变化而变化,故确定本试验所用材料的应变为1%。
71.温度扫描实验:温度扫描实验可以通过g'与g"的变化测定样品的成胶温度,损耗模量g"和储存模量g'之间的关系反映样品不同状态时的流变学行为,当g"大于g'时,此时样品主要呈粘性液体状态,随着温度的升高,储存模量g'不断增大,说明温敏凝胶在温度的刺激下开始由液态向固体凝胶态转变,当g'与g"相等时,此时对应的温度被定义为成胶温度,也称为相转变温度。设定温度扫描范围为10℃-60℃,升温速率为1℃/min,扫描角速度为10rad/s。图3为不同ph时的样品在温度扫描实验下的测试结果。
72.甘油磷酸钠的加入可以调节壳聚糖溶液至ph为中性状态而不沉淀,gp的添加量越多,溶液的ph值越高,凝胶的成胶温度与gp的添加量(ph)有很大的关系。相关研究表明,当温度升高时,加热诱导质子从壳聚糖转移到甘油磷酸钠上,壳聚糖分子极性减弱,甘油磷酸钠的疏水性增强,cs与gp之间的静电作用增强,水分子区域被甘油分子取代,壳聚糖分子间以疏水作用为主,分子逐渐聚积析出,形成凝胶。因此,gp的添加量越多,凝胶转变所需的热量越少,即成胶温度越低。与温度扫描测试结果相符,当溶液ph从7.05升高到7.20时,相转变温度又40.5℃下降到33℃,其中,当ph值为7.15时,相转变温度与人体体温最为接近达到37℃。
73.频率扫描实验:随着扫描频率的增加,样品受到的机械剪切力逐渐变大,储能模量g'的大小反应凝胶网络的强度,图4为当角速度在0.1-100rad
·
s-1范围内,壳聚糖温敏凝胶的g'和g"的变化情况。如图4所示,成胶后的凝胶置于10℃-50℃的温度范围内,随着角频率的变化,储存模量g'始终大于损耗模量g",说明壳聚糖温敏凝胶在各个温度范围内均保持着原有的凝胶态粘弹性,凝胶内部结构稳定,不会再转变为溶液状态,可在常温下保存使用。
74.扫描电镜(sem)表征:如图5为cs/gp温敏凝胶在冷冻干燥后的表面及内部结构的扫描电镜图,其中(a)凝胶表面,(b)凝胶表面放大,(c)凝胶内部,(d)凝胶内部放大,由(a)和(b)中可以看出凝胶的表面形貌为片层多孔结构,孔洞大小不一;由(c)和(d)可以看出凝胶的内部孔洞结构更为明显,为相互连通的不规则超大孔片层结构,最大直径为50um。cs/gp温敏凝胶的这种三维网状多孔结构可为后续药物分子的负载提供空间。
75.红外光谱分析:图6为壳聚糖、甘油磷酸钠以及cs/gp凝胶的红外光谱图,从cs的红外光谱可以看出,在3400-3200cm-1
处为壳聚糖分子内由于氢键的作用,形成-oh伸缩振动吸收峰与-nh的伸缩振动吸收峰缔合的重叠而增宽的多重吸收峰。壳聚糖分子中含有羟基(-oh)、氨基(-nh2)和大量的氢键(-h),2924cm-1
和2875cm-1
分别为c-h的2个伸缩振动吸收峰,1649cm-1
处的吸收峰是-oh的弯曲振动吸峰,1601cm-1
为氨基面内弯曲振动吸收峰,1384cm-1
处的吸收峰为=ch2的变形吸收峰,1091cm-1
处的吸收峰则是醇羟基的变角振动吸收峰,而1154cm-1
处的吸收峰是环上碳-氧(c-o)吸收峰。
76.从cs/gp凝胶的红外光谱可以看出,凝胶后壳聚糖的部分特征吸收峰发生了变化,原位于3400-3200cm-1
附近的氨基及羟基的n-h和o-h重叠峰的伸缩振动吸收峰向低波数段发生红移,表明氨基中n电子的电子云受加入的gp的作用影响发生了迁移,所以n-h吸收峰随着无机粒子的加入向低频方向移动。原位于1601cm-1
处的氨基变形振动吸收峰消失,说明
两组分已形成氢键配合物。从图6中还可以看出,gp与cs/gp的ftir图谱区别不大,没有生成新的特征峰,大部分的峰形变化与消失,基本为叠加与覆盖的后果,经过叠加以后,壳聚糖的吸收峰不明显,基本被gp的特征吸收峰所遮盖。
77.壳聚糖温敏凝胶洗涤前后元素分布分析:与壳聚糖相比,na和p为甘油磷酸钠中的特征元素,通过比较洗涤前后壳聚糖凝胶中na和p元素含量的变化来探究甘油磷酸钠与壳聚糖之间的结合方式。经去离子水洗涤后,na和p元素含量显著减少,说明gp在凝胶中是自由扩散的状态,以及结合红外光谱结果分析,甘油磷酸钠在凝胶转变过程中,与壳聚糖之间的结合并非静电交联剂或起着疏水诱导的作用,它的主要作用是接收壳聚糖表面的质子,使得壳聚糖分子链间的静电斥力减少后,链间吸引作用占主导地位,从而完成由溶液状态像凝胶状态的转变,形成固体水凝胶。
78.综上,实施例一中,利用瓶倒置法以及流变性能表征研究了壳聚糖溶液浓度、甘油磷酸钠添加量(不同ph)时凝胶化时间和成胶温度的变化,利用sem观察了凝胶内部结构,以及结合ftir和eds推测了凝胶化机理,得到了以下结论。
79.(1)cs/gp温敏凝胶在ph为中性时室温下为液态水溶液,当温度升高到人体体温附近时可快速转变为白色不透明的凝胶状,具体的成胶温度与甘油磷酸钠添加量(即调节后的ph值)密切相关,当ph值从7.05升高到7.20时,成胶温度由40.5℃降低到33℃。当固定凝胶转变温度(37℃)时,在一定范围内,cs浓度越高以及ph越大,凝胶化时间越短。
80.(2)该温敏凝胶在成胶后凝胶转变不可逆,从sem图像可以看出凝胶表面及内部均呈现不规则多孔网状结构,水凝胶内部的孔洞结构可为后续药物的负载提供足够的空间。
81.(3)ftir和eds结果显示,cs与gp之间没有形成新的化学键,经水洗后,na和p元素含量极低,壳聚糖温敏凝胶为物理纠缠的结果,甘油磷酸钠分散在凝胶中,影响的是壳聚糖链间的静电力,疏水作用以及与水分子间氢键的相互作用。
82.实施例二
83.取壳聚糖粉末溶解于稀盐酸溶液中,用磁力搅拌器搅拌直至壳聚糖完全溶解,呈无色透明状微粘稠状态。然后称取甘油磷酸钠溶解于去离子水中,逐滴滴入壳聚糖溶液中,边滴边搅拌,调节溶液的ph为7.15。再分别称取总溶液质量0.01%,0.025%,0.04%的京尼平粉末,溶解于50%乙醇溶液中,分别逐滴滴入上述cs/gp水溶液中,边滴加边搅拌,使其混合均匀。将上述各组溶液密闭完全,置于37℃的体箱中,待其凝胶化,即cgg凝胶。
84.需要说明的是,药物标准浓度曲线的测定可根据《中国药典》中对乙酰氨基酚药物紫外分光光度测试方法,称取10mg对乙酰氨基酚溶解于少量去离子水中,加热震摇10分钟,使对乙酰氨基酚完全溶解,置于100ml容量瓶中定容,由此可得100ug/ml药物浓度溶液,再从中分别吸取0.01ml,0.1ml,0.5ml,2.5ml,5ml储备液于10ml容量瓶中定容,便可得到0.1ug/ml,1ug/ml,5ug/ml,25ug/ml和50ug/ml的浓度药物。利用紫外分光光度计扫描出药物的特征吸收峰,再分别对不同浓度的药物溶液在特征吸收峰范围内进行吸光度扫描,依据已知的药物浓度与所对应的吸光度大小即可进行拟合得出相应的线性回归方程。
85.载药温敏凝胶的制备:首先依据上述制备出改性凝胶水溶液,再称取一定量的对乙酰氨基酚药物溶解于50%乙醇溶液中,逐滴滴入改性凝胶水溶液中并不断搅拌使得药物均匀分散于凝胶溶液中。再将载药凝胶溶液置于37℃体箱环境中,待其凝胶化以便后续测试。
86.测试与表征
87.红外光谱(ft-ir)测试:取一定量的壳聚糖、京尼平以及壳聚糖与京尼平的交联产物(经冷冻干燥)粉末,碾碎后与kbr混合,研磨均匀后压片,用红外光谱仪测试,扫描范围为4000cm-1
~400cm-1
。
88.x射线衍射能谱(xps)测试:将cs/gp和cgg凝胶样品冷冻干燥,切成薄片,而后用压片机压实,贴于样品台上,对样品进行扫描,在274ev~297ev对样品进行c1s窄谱扫描,在523ev~541ev处对样品进行o1s窄谱扫描。
89.流变性能测试:测试加入交联剂京尼平后温敏凝胶的动态流变性能的变化,以此探究京尼平对cs/gp温敏凝胶内部结构和性能的影响。将低温下制备的加入不同浓度京尼平的温敏凝胶水溶液,每次测试吸取略多于程序测算量的溶液平铺于帕尔贴温控平台上,保证夹具间填充满样品,吸出多余样品;测定凝胶固体时,先将凝胶在溶液状态时滴于帕尔贴上,再利用其温敏特性设置温度为37℃,待其凝胶完全后再进行测试。最后,按照设定程序分别对样品进行时间扫描实验以及频率扫描实验。
90.凝胶对药物累积释放率的测试:将制备好的载药凝胶(药物含量为药物添加量w0)置于装有去离子水的烧杯中,每隔1h吸取3ml样液,同时补充3ml去离子水进入原液中。利用紫外分光光度计测算出每个时间点的药物浓度,计算出药物的累积释放率。
91.扫描电镜(sem)表征:将冷冻干燥后的壳聚糖凝胶样品切成厚度均匀的薄片状,用导电胶将其粘于样品台上,喷金使样品表面形成一定厚度镀膜层以提高导电性,对水凝胶表面进行放大扫描拍照。
92.力学性能压缩:将两种水凝胶溶液制成圆柱体,利用万能材料试验机进行压缩,将载荷与位移之间的关系转化为应力与应变之间的曲线。
93.热失重(tg)测试:分别称取经冷冻干燥后的cs/gp和cgg样品,将其置于保护气下对其进行热稳定性能分析测试。
94.上述测试与表征的结果:
95.凝胶内部多孔结构作为药物小分子递送的孔道,其孔洞大小与药物扩散的速率息息相关,孔洞越大,药物分子在凝胶中的扩散就越容易,若想达到较长时间的释放时间,可以利用交联反应将凝胶内部的孔洞结构调节的更为致密,密集的孔洞会有效阻碍药物分子的扩散。在此采用生物交联剂京尼平与壳聚糖交联反应,京尼平相对于常用交联剂戊二醛等具有明显更低的细胞毒性,常用于药物递送系统的研究。影响凝胶网络结构大小的因素有凝胶交联度、组成凝胶的单体的化学结构等,cs/gp凝胶的内部结构主要由单一的cs分子链构成,其孔洞大小相对于药物模型来说较为疏松,而经由交联剂京尼平交联后的凝胶(cgg)内部会形成更为致密的孔洞,从而延缓药物的释放时间。京尼平可以自发的与壳聚糖上的氨基发生交联反应,京尼平与壳聚糖之间通过叔胺和酰胺相连。
96.此外,不添加京尼平的纯cs/gp凝胶为白色,结构较为疏松,离开模具后已呈现塌陷状。而添加了京尼平后的凝胶为蓝色,京尼平与氨基交联后会在氧气存在的条件下显现出蓝色,这是一种通常被称为栀子蓝的食品染料,该蓝色色素对热、ph值和光都非常稳定。随着京尼平浓度的增加,蓝色也越来越深,说明其与壳聚糖的交联度越来越大。且交联后的凝胶结构也变得更加坚固,其内部分子在凝胶形成后不会再发生滑移塌陷,可独立支撑起整个凝胶体,但当京尼平添加量达到0.04%后,由于反应的进一步扩大,凝胶内部出现凹
陷,凝胶外围由于与模具连接的比较紧密还未下陷,可能是因为京尼平与壳聚糖交联后,京尼平在壳聚糖分子链之间产生一个“拉力”,使得壳聚糖分子链之间的距离变短,从而出现凹陷现象。因此,京尼平浓度在0.01%~0.025%之间凝胶的整体形貌最好。
97.ft-ir测试结果分析
98.红外光谱图(ft-ir)用来表征壳聚糖与京尼平的交联情况,为避免甘油磷酸钠对测试结果的影响,在制样之前已将gp用去离子水洗去。图7为壳聚糖、京尼平以及壳聚糖与京尼平交联产物的红外光谱图,图7中3423cm-1
,1648cm-1
,1080cm-1
处为壳聚糖的特征吸收峰,分别为n-h伸缩振动峰,n-h(面内)弯曲振动峰,c-n伸缩振动峰,而3397cm-1
,3245cm-1
,1682cm-1
,1620cm-1
分别为京尼平的醇羟基,酚羟基,羧甲基的c=o键和环烯中的c=c键。在酸性和中性条件下,京尼平与壳聚糖之间通过酰胺和叔胺相连。从图7中可以看出,经反应后,在720cm-1
和610cm-1
处出现了仅限于仲酰胺的n-h伸缩振动峰,在
99.1220cm-1
~1020cm-1
处出现了叔胺的c-n伸缩振动峰,说明了壳聚糖与京尼平之间的成功交联。
100.xps测试结果分析
101.通过xps能谱检测交联前后壳聚糖分子链中元素结合能的变化情况,图8为壳聚糖与京尼平交联前后的xps中的c1s和o1s窄谱的变化情况,由图8中可以看出,交联后除了壳聚糖分子中原有的c-c,c-o键的结合能,还出现了酰胺键特征的c=o峰以及叔胺键的c-n峰,c-n峰覆盖了原来的c-h峰,o1s中也新增了c=o峰,交联前后c1s和o1s的变化情况共同说明了酰胺键和叔胺的形成,与ft-ir结果相一致,进一步证明壳聚糖与京尼平的交联成功。
102.流变性能分析
103.时间扫描实验以振荡模式中的步进时间为参考点对凝胶溶液样品进行扫描,设置温度为37℃,角速度为10rad/s,测试时间为1800s,在此条件下对cs/gp溶液,以及添加了0.01%,0.025%,0.04%京尼平的凝胶溶液体系进行流变测量,观察储能模量g'和损耗模量g"随时间的变化情况。所测结果如图9所示,((a)0.00%,(b)0.01%,(c)0.025%,(d)0.04%),从a中可以看出,在37摄氏度条件下,未添加京尼平的cs/gp溶液中g'和g"相交的时间点在450s左右,随着京尼平浓度的逐渐提高,从b、c、d中可以看出,g'和g"相交的时间点越来越靠前,说明凝胶化转变所需的时间越来越短。此外,在c和d中当凝胶成型后储存模量g'曲线出现了少量上下波动的现象,这可能是因为较大浓度的京尼平在成胶过程中会使得壳聚糖分子链快速且更为紧密的聚集在一起,从而造成凝胶在平行板探头和帕尔贴平台之间少量的破碎,造成了曲线的抖动。
104.频率扫描实验利用频率扫描流变性能测试通过凝胶内部的粘弹性可以反映出凝胶的机械性能,设置温度为37℃,角频率扫描范围为0.1-100rad/s,先将凝胶溶液平铺于测试平台上,利用时间扫描监测待其凝胶后再对其进行频率扫描测试。图10为添加不同比例京尼平的壳聚糖温敏凝胶溶液在凝胶后测试的频率扫描流变性能测试结果,如图10所示,储能模量g'均远高于损耗模量g",说明此时凝胶已完全成型,储能模量g'的大小反应凝胶网络的强度。纯的壳聚糖/甘油磷酸钠温敏凝胶的储能模量在1100pa左右,随着京尼平含量的增加,对应的储能模量g'也不断增大,当京尼平浓度在0.04%时,储能模量达到1800pa左右,说明其机械性能越来越好。凝胶内部的网状结构间的连接方式如共价键,氢键以及分子间的纠缠均会影响凝胶的机械性质,在成胶过程中,京尼平与壳聚糖上的氨基相连接,使得
凝胶内部分子间连接的更加致密,故机械性能越来越好。
105.aap标准浓度曲线的绘制
106.图11为药物小分子对乙酰氨基酚的紫外特征吸收光谱图,从图11中可以看出aap在245nm处,吸光度达到最大,因此确定245nm为aap的特征吸收峰。利用不同浓度的aap在245nm处的吸光度大小,以药物浓度为横坐标,浓度对应的吸光度为纵坐标对其进行线性拟合,拟合结果如图12所示,得到线性回归方程为y=0.061x 0.301(r2=0.998),因此,在0.1ug/ml~50ug/ml的浓度范围内,对乙酰氨基酚的浓度与其在245nm处的紫外吸光度有很好的线性关系。
107.凝胶对aap的体外释药性能
108.药物从凝胶聚合物中的扩散行为一方面依赖于凝胶内部的孔洞大小,另一方面依赖于药物与凝胶间的相互作用。图13为不同浓度的京尼平添加量对药物释放时间的影响,可以看出当京尼平浓度从0%增加到0.01~0.025%时,对模型药物对乙酰氨基酚的释放时间从6~8小时延长到10~12小时。这是因为京尼平作为壳聚糖链间的交联剂可以调控凝胶内部孔径结构的大小,当孔径越小时,药物在通道间的扩散遇到的阻碍也就越多,释放时间也就越长。然而,当京尼平的浓度提升到0.04%时,对药物的释放时长骤然降低,可能是因为京尼平与壳聚糖之间的交联作用太过剧烈,使得壳聚糖分子链大块的聚集在一起,释药通道由密而多变得大而少,药物分子扩散几乎遇不到阻碍作用,由此,在1小时处表现明显的突释现象,总释放时长也降低到2~3小时。故优选的选择京尼平的添加量为0.01%。
109.sem形貌分析
110.图14-图16为添加不同比例京尼平的壳聚糖温敏水凝胶冷冻干燥后的内部切面扫描电镜图,从图14可以看出,添加了0.01%京尼平的水凝胶内部为多孔互通的三维网络状结构,孔洞直径在1um左右;当京尼平含量为0.025%时,从图15中可以看出,随着交联反应的进一步进行,部分孔洞被填充,凝胶内部分子链间成片粘连,整体形貌类似于大树的树根状;图16所示,当京尼平含量为0.04%时,原来凝胶内部的小孔洞消失不见,整个凝胶内部结构要么为大块聚集的分子链,要么为链段聚集后形成的超大不规则间隙。由此可见,0.01%京尼平添加量的凝胶内部结构最为理想,也与释药试验结果相一致。
111.凝胶力学压缩性能分析
112.利用万能材料压缩试验机对cs/gp凝胶以及添加了0.01%京尼平的cgg凝胶进行力学压缩试验,图17为力学压缩结果的应力应变曲线,单纯的cs/gp凝胶的机械性能一般,当产生50%应变时需要的应力大约为1kpa,而经过交联之后的凝胶产生在相同的应变条件下所需要的应力为10kpa,展示了更强的机械强力,这是因为京尼平与壳聚糖之间的交联对凝胶内部网络结构起到了一定的增强作用。另外,cgg凝胶在40%应变处产生了明显的破碎现象,可能是因为交联剂的加入使得大分子链间连接的更加牢固和紧密,当受到较大的强力时凝胶的内部结构会直接被破坏,而cs/gp凝胶没有明显的曲线受力断裂现象,这是因为cs/gp凝胶内部分子链间没有互相直接连接在一起,当受到外力作用时会随着力的增大而产生滑移。
113.tg测试结果分析
114.图18为冷冻干燥后的cs/gp与cgg凝胶的热重曲线图,从图18中可以看出,当温度小于100℃时,此时的重量损失主要为水蒸气的蒸发,因为样品已经冷冻干燥过,故重量下
降并不多,存在的少量水分可能是干燥后的凝胶样品暴露于空气中吸湿所致。100℃~200℃处主要为结合水的蒸发,从图18中可以看出cgg水凝胶的失水率比纯的cs/gp更慢,说明其对水分子有更强的结合能力。200℃到300℃处主要为一些易挥发物质的损失,在这个过程中两种凝胶的变化差别并不大。当温度继续升高时,凝胶大分子链间的结构开始被破坏,对比发现经京尼平交联后的凝胶热稳定性能得到了轻微的提高,可能是由于凝胶内部更致密的结构所致。由于壳聚糖的最终分解温度为650-680℃,故在600℃处有近40%左右的粉末残余量。
115.综上,在实施例二中,利用新型交联剂京尼平与壳聚糖/甘油磷酸钠温敏凝胶交联,为了调节其内部结构性能以及达到对药物的一个更好的缓释效果,京尼平的添加量分别为0.01%,0.025%和0.04%。利用ftir和xps对交联结果进行表征,利用流变模量、应力应变、tg和sem表征凝胶内部性能和结构的变化,通过紫外分光光度法测试了其对药物模型的释放效果,得到了以下结论。
116.(1)利用京尼平与壳聚糖上的氨基交联对cs/gp温敏凝胶进行改性,改性后的凝胶显示蓝色,且京尼平的浓度越高,蓝色越深,通过ft-ir和xps对其交联结果进行进一步的表征,新生成的叔胺键和酰胺键代表交联的成功。
117.(2)改性后的凝胶依然表现温敏特性,通过流变扫描测试中g'和g"的变化可以看出京尼平使得凝胶化时间变得更短,且京尼平的添加可以有效的加强凝胶内部的网络结构,使得凝胶的机械性能显著增强。
118.(3)结合sem以及药物释放测试结果确定京尼平的最佳含量为0.01%,此时凝胶内部孔洞结构最为致密,使得药物释放的时间达到12个小时,对比改性前的cs/gp凝胶提升了一倍左右。
119.实施例三
120.凝胶式医用敷料的制备:用浸渍法将温敏凝胶整理到丝绸织物上,首先在低温条件下将适当大小的蚕丝织物浸入凝胶溶液中,待其表面全部浸润且凝胶溶液无法进一步渗入时,挤出多余气泡,再放置于目标温度(37℃)的体箱中,利用温度的刺激实现织物表面凝胶溶液的溶-凝胶转变。
121.载药温敏凝胶医用敷料的制备:称取一定质量的对乙酰氨基酚药物溶解于上述凝胶溶液中,使其分散均匀,药物质量与总溶液质量之比即可得到药物浓度ρ,将素绉缎真丝织物洗净裁剪成适当大小并烘干称重m1,浸渍于载药凝胶溶液中,反复浸压,取出称重m2,记录浸渍前后织物的质量增量,即为负载的凝胶溶液量,根据所配制的凝胶药物浓度,即可算得每块凝胶织物上的总载药量w0=ρ(m
2-m1)。再将浸渍完凝胶溶液的织物密闭好置于37℃的环境中使其凝胶化。
122.测试与表征
123.aap的体外释放性能测试
124.对乙酰氨基酚的体外释放性能测试选用水和pbs为模拟环境,将制备好的载药凝胶织物试样置于溶液中,每隔1小时吸取3ml溶液以待测试,另补充3ml去离子水或pbs溶液于原溶液中。将每小时取得的试样扫描出其特征峰对应的吸光度,利用对应关系从而计算出载药凝胶织物中的对乙酰氨基酚在模拟溶液中的累计释放率。
125.sem表征
126.将制备好的凝胶织物冷冻,再放入冷冻干燥机中使其在干燥时仍保有原来的形貌。然后将表面与横截面样品均贴于样品台上,利用扫描电子显微镜对其进行放大扫描并拍照。
127.厚度变化测试
128.将制备好的水凝胶复合织物冷冻干燥,利用自动织物测试仪根据gb/t3820-1997进行测试。
129.透湿性测试
130.利用透湿杯法对丝绸织物原样及冷冻干燥后的水凝胶织物进行测试,根据gb/t 12604.2-2009,将样品剪成圆,紧密地固定在透湿杯上,放置于全自动透湿仪中。
131.耐水洗性能测试
132.根据iso 105-c06织物耐水洗性能标准,将样品剪成100mmx40mm大小,然后放入水洗性能机器中,加入10个钢珠球增加摩擦力,每隔10分钟取出并擦干表面,称量并计算重量损失率。
133.上述测试与表征的结果
134.不同类型的真丝织物对凝胶释药性能的影响
135.浸渍法相对于其他装载方式具有方便快捷的优势,壳聚糖凝胶溶液极具浸润性,当真丝织物浸渍于凝胶溶液中时,液态的溶液迅速沾满织物表面并沿着经纬纱线之间的孔隙向内部扩散,纱线之间的三维结构为凝胶提供了“巢-栖”空间,同时也是对凝胶整体机械强力的一个有效保障。当织物组织结构不同时,其为凝胶的负载所提供的空间也不相同,在此选择三种常见的丝绸面料,乔其、双绉以及素绉缎作为基底材料,测试其对载药凝胶的释放性能,所得结果如图19所示,以乔其面料为基底的凝胶对药物的缓释时间为3h左右,以双绉面料为基底的凝胶对药物的缓释时间为5h左右,而以素绉缎面料为基底的凝胶的缓释时间达到了10h之久,结合不同类型真丝织物的具体形貌分析其原因可能与织物的紧密度有关。乔其的织物组织结构非常疏松,内部孔径很大,达到了100um左右,这使得凝胶以织物的结构为框架形成薄薄的一层,内部药物的释放只限于单一的凝胶层,并且由于没有密集的纤维对凝胶形成保护,所能负载的凝胶并不多。随着织物组织结构的复杂化,纱线间的三维结构为凝胶提供了“巢-栖”空间,所能负载的凝胶量也越来越多,密集的纱线结构既可为凝胶提供支撑和保护,同时也是药物缓释的路径之一,因此药物缓释的时间越来越长。
136.不同织物厚度对释药情况的影响
137.利用凝胶溶液对相同面积下(48cm2)不同姆米(m/m)的素绉锻织物(12m/m,19m/m,30m/m,40m/m)进行后整理前后的质量变化,姆米作为衡量丝织物品质的一个重要单位,单位面积内姆米数越大说明织物越厚重,织物内部的空间越大,故能吸附的凝胶量也就越多,凝胶作为功能因子缓释载体,其质量也与负载的药物含量成正比,随着织物姆米数的逐渐增大,所负载的凝胶含量也逐渐增多,从12m/m时的1.407g到40m/m时的2.948g,说明凝胶不止停留在织物表面,而是延流进整个真丝织物结构中。从图20中不同姆米织物上的载药凝胶的最终释药量可以看出,织物越厚其所负载的药量确实越多。
138.药物浓度对释放性能的影响
139.配制1mg/ml,3mg/ml,6mg/ml的载药凝胶溶液,将其分别整理到40姆米的素绉锻真丝织物上即可制得含有不同浓度药物的样品,再将其放置于37℃环境中待凝胶化后测试药
物的累积释放性能。由图21的测试结果可以看出,药物浓度越高,相对应的释放时间越长。对于载有1mg/ml的样品来说,因为其浓度较低,故在介质中没有足够的浓度梯度差来加速药物分子的扩散,其初始与最终累积释放率均远低于3mg/ml和6mg/ml的样品。而3mg/ml和6mg/ml的样品相对于1mg/ml样品而言存在一定的突释现象,在1h处释放率在20%左右,这是因为凝胶织物中的药物浓度越高,与释放介质之间的浓度梯度差也就越大,浓度梯度差异越大越会加速药物分子的扩散。另外,6mg/ml样品的最终累积释放率低于3mg/ml的,这可能是因为药物浓度越大意味着初始载药量越多,从而导致相对来说药物的利用率不及3mg/ml的样品。
140.温度对药物释放性能的影响
141.分别在25℃、36℃、38℃和40℃的水温环境中测试了载药医用敷料对aap的累积释放性能,结果如图22所示,载药医用敷料对模型药物aap的释放性能在室温(25℃)时以及人体体温附近(36℃~40℃)之间均能得到有效释放,并且对整体释放时长的影响不大,依然集中在10~12h。温度对药物释放的影响主要体现在1h处药物从温敏凝胶织物中初始释放时的不同,从图22中可以看出在1h处,38℃和40℃存在明显的突释现象,药物的初始释放率达到了30%,这是因为当试样与水分初接触时,凝胶表面的药物首先会产生扩散,水温越高,药物分子的扩散速度也越快,以及可能与不同温度刺激下凝胶内聚合物分子疏松结构的转变有关。
142.在不同介质中药物的释放动力学
143.凝胶内部的药物分子扩散运动是一个非常复杂的过程,在此通过分析凝胶织物中的模型药物在水和pbs中前8小时的释放曲线,以及结合不同释放动力学模型对数据进拟合,来研究其释放机理。目前常用的药物缓释数学模型主要有零级模型,一级模型和korsmeyer-peppas模型。零级模型主要与药物浓度有关,一般能在缓释体系中维持一个相对稳定的释放率。一级模型描述的是体系中药物释放速度与载体中载药量的关系,其主要与载体中剩余的药物含量呈一定的正比关系。korsmeyer-peppas模型的释药机理主要包括两个,一是药物分子在缓释材料中的药物扩散,二是通过基质的降解溶蚀达到药物的释放。二者的相互关系主要取决于特征扩散指数n,n与释放机理的关系。
[0144][0145]
(表一)不同几何形状药物载体的药物释放指数及缓释机理
[0146][0147]
[0148]
(表二)药物在不同释放动力学模型中的特征指数
[0149]
表一中的fickian扩散是指水扩散的速度小于聚合物松弛的速度,当水凝胶采用在药物水溶液中浸泡的形式载药时,润涨的水凝胶就以fickian扩散的方式释放药物;非常规运输指的是水扩散速度等于聚合物的松弛速度,药物释放依赖于这两个同步的过程,是复杂的fickian扩散和骨架溶蚀协同作用的结果;case
‑ⅱ
运输指的是水扩散速度大于高聚物的松弛速度。
[0150]
aap药物在pbs中的释放速度比在水中快,这是因为溶液介质的极性影响药物分子的扩散,在浓度梯度转移过程中药物分子在溶解度更大的介质中转移速度更快。凝胶织物对aap的缓释过程与korsmeyer-peppas模型最相关。其特征扩散指数n列于表二中,药物在水中的特征扩散指数为0.66,在pbs中的为0.68,对比表一中的药物缓释机理,可知其药物扩散方式为非常规运输,是fickian扩散和凝胶溶蚀协同作用的结果。
[0151]
4.5.6sem形貌分析
[0152]
从图23中可以看出,原真丝织物表面光滑未见明显杂质,单根蚕丝由多股单丝并捻而成,结合截面图24可以看出纤维和纱线之间有很多空隙为凝胶的粘附提供了足够的三维空间。经cs/gp凝胶整理后,从图25中可以看出,织物表面被一层多孔结构所覆盖,即为冷冻干燥后的cs/gp凝胶,结合截面图26可以看出,织物内部也分布着多孔的凝胶。从图27中可以看出,经cgg凝胶整理后的织物表面形成一层致密薄膜,该薄膜层紧密的包覆于织物表面,京尼平的加入使得凝胶与织物的结合更为紧密,从横截面图28可以看出凝胶薄膜的厚度非常小。
[0153]
整理前后织物厚度的变化
[0154]
利用织物厚度测试仪测试整理前后不同姆米织物的厚度变化情况如图29所示,随着织物姆米数的增加,织物也越来越厚,不同厚度的真丝织物具有不同的特性,低姆米的丝绸轻薄飘逸,高姆米的丝绸强力好、垂坠感佳,从图29中可以看出,经凝胶整理后的织物厚度变化不大,厚度增量均小于0.04mm,这有利于保持真丝织物的轻薄性和实用性。
[0155]
整理前后织物水蒸气透过率变化
[0156]
水蒸气透过率(wvtr)作为反映水分蒸发能力的直接指标,对于医用敷料来说具有重要意义,良好的透湿性可以保证患者的舒适体感。水蒸气的透过主要通过两个步骤来实现,首先是水蒸气被凝胶织物所吸收,接着再通过复合织物像外界扩散。整个过程与织物材料本身的吸湿性以及纤维间的孔隙等有关,蚕丝织物具有良好的吸湿特性,图30为不同姆米真丝织物整理前后wvtr变化情况。从图30中可以看出,不同姆米的原真丝织物的透湿性随着姆米数的增加而逐渐下降,这是因为织物越厚越密,纤维间孔隙越小,水蒸气越难透过。经水凝胶整理后,由于凝胶在丝绸织物上致密的凝胶层,堵塞了真丝织物纤维之间的孔隙,阻碍了水蒸气的透过,故水蒸气透过率(wvtr)有所下降。但另一方面,由于壳聚糖水凝胶具有超快表面浸润特性,其亲水性可以使得水分子在凝胶内部快速扩散,从而使得wvtr的值依然保持在较高的水平。整理前后水蒸气的透过通道由织物纤维间的空气间隙变为了凝胶内部分子运送,从图30中可以看出整理后的40m/m的试样因为含有较多的凝胶其wvtr值甚至超过了30m/m的试样,因此该织物凝胶型医用敷料可以保证良好的舒适性。
[0157]
负载凝胶的织物耐水洗性能测试
[0158]
利用织物的耐水洗性能评估凝胶对织物的附着稳定性能,将负载凝胶的织物放置
于水洗装置中,加入10个直径为6mm的钢珠球增加摩擦力,每隔10分钟取出试样擦干表面的水分称重,图31为测试结果,经过30min的洗涤后,样品依然保持着80%的凝胶剩余量,凝胶与织物间的结合很牢固,其重量损失可能是因为凝胶易碎,在小钢珠的撞击和摩擦下,凝胶与凝胶之间破碎掉落。
[0159]
综上,实施例三中,采用浸渍法以及温敏凝胶的溶-凝胶转变特性将负载药物的水凝胶与真丝织物相结合制备了一种新型医用敷料,并探究了此种织物凝胶型医用敷料对aap药物的缓释效果以及药物缓释动力学机制,利用sem和织物厚度仪观察了凝胶在织物上的结合状态和浸渍前后的厚度变化,测试了该医用敷料的wvtr和耐水洗性能,所得结果如下。
[0160]
(1)将载药凝胶整理到真丝织物上,所选织物基底的类型对药物的缓释时间有很大影响,织物组织结构越紧密越有利于凝胶的附着以及对凝胶层形成保护,其复杂的内部三维结构通道也有利于延长药物的缓释时间,因而素绉缎织物最适合作为药物缓释的基底。当织物都为素绉缎时,织物的姆米数即厚度决定了单位面积内负载的凝胶含量,织物越厚其内部空间越大所能负载的凝胶量越多,最终可供释放的药物含量也就越多。
[0161]
(2)探究了药物含量和温度环境对药物缓释的影响,当药物含量为3mg/ml时,最终释药率最高;环境温度越高,越容易在最初1h释放时产生突释现象,温度的增高可以加速药物小分子的扩散速度。利用不同数学模型零级、一级以及korsmeyer-peppas模型对药物在水和pbs中的释放速率进行拟合,结果显示其与korsmeyer-peppas模型中的非常规运输最相关,因此药物在介质中的缓释机理是fickian扩散和凝胶溶蚀共同作用的结果。
[0162]
(3)根据sem和织物厚度变化测试结果可知,凝胶在织物上形成了非常薄的一层致密薄膜,使得织物保持了原有的轻薄特性;结合织物的wvtr变化以及耐水洗性能测试结果可知,凝胶与织物之间的结合非常好,并且由于壳聚糖凝胶固有的超快浸润特性,使得该医用敷料能保持原有织物的吸水透湿性能,保证了在使用过程中的舒适性。
[0163]
综合实施例一、实施例二以及实施例三,首先利用壳聚糖和甘油磷酸钠制备了一种温敏水凝胶,探究了壳聚糖浓度和ph值对其凝胶时间和相转变温度的影响,并利用各种表征手段分析了其凝胶机理。然后利用新型生物交联剂京尼平对壳聚糖温敏凝胶组合进行交联改性,通过探测其内部结构、力学性能变化,以及对模型药物对乙酰氨基酚的缓释效果确定了京尼平的最佳添加含量。最后通过浸渍法以及溶-凝胶技术将载药凝胶与真丝织物相结合,探究了织物本身结构、载药量以及环境温度等对药物释放性能的影响,通过与数学模型拟合研究了其缓释机理,并表征了该医用敷料的水蒸气透过率和耐水洗性能。得到以下结论:(1)cs/gp温敏水凝胶在常温下为溶液状态,在人体体温附近即可转变为凝胶态,当溶液ph值一定时,壳聚糖浓度在2.22%时凝胶化时间最短,当壳聚糖溶液浓度一定时,甘油磷酸钠添加的越多凝胶化时间越短。通过流变性能测试可知,当ph从7.05升高到7.20时,溶液的相转变温度可从40.5℃下降到33℃,凝胶的转变由温度和甘油磷酸钠的含量共同决定。通过ftir和eds测试结果可知,甘油磷酸钠在凝胶中为自由扩散的状态,凝胶的主体仅为壳聚糖分子链,因此其内部孔径较大,与sem表征相一致。
[0164]
(2)利用生物交联剂京尼平对壳聚糖温敏凝胶进行交联改性,京尼平可自发的与壳聚糖上的氨基通过叔胺和酰胺相连,并显示出特征蓝色,且京尼平浓度越高,蓝色越深。通过流变扫结果可知,京尼平的加入可缩短凝胶化时间,且浓度越高,储存模量g'越大。
[0165]
(3)利用对乙酰氨基酚作为药物模型,测试凝胶对其缓释时间,结果显示京尼平添加量在0.01%-0.025%时对药物的缓释时间最长,达到了12h。对比cs/gp凝胶和添加了0.01%京尼平的改性后的cgg凝胶,通过sem、应力应变曲线和tg测试结果可以看出,后者的内部结构变得更加致密,导致孔径更小,机械强力和热稳定性更好。
[0166]
(4)利用壳聚糖凝胶溶液的浸润特性以及温敏溶-凝胶转变行为可将载药凝胶快速整理到真丝织物上,织物类型的不同会对凝胶的释药效果产生影响,其中组织结构最为紧密的素绉缎织物最有利于凝胶的负载以及对其形成保护作用,保持了凝胶原有的缓释时间。织物组织结构相同时,织物越厚其可以负载的药物也就越多。药物浓度为3mg/ml时,凝胶的最终释药率最高;释放温度高于37℃时,在初始1h时会有明显的突释现象。通过与数学模型拟合发现,该医用敷料对药物的缓释机理与korsmeyer-peppas模型最相关。
[0167]
(5)这种药物缓释型医用敷料的制备方法简单,取材容易,凝胶与织物间结合紧密且非常轻薄,既保有凝胶亲肤舒适的特点,也保有织物柔软、强力好的性能,还具有良好的水蒸气透过能力,具备规模化生产的潜力。
[0168]
从而优选出本发明方案:基于织物的温敏凝胶式医用敷料的制备方法,包括以下步骤:s1:将壳聚糖粉末溶解于0.1mol/l盐酸溶液中,搅拌得到壳聚糖溶液;将甘油磷酸钠溶解于去离子水后,将其逐滴滴入壳聚糖溶液中,且边滴加边搅拌,用以调节溶液ph值至7.15,得到壳聚糖/甘油磷酸钠溶液;s2:将京尼平粉末溶解于50%乙醇溶液中,将其逐滴滴入壳聚糖/甘油磷酸钠溶液中,边滴加边搅拌,得到京尼平改性壳聚糖温敏凝胶溶液;s3:将乙酰氨基酚药物溶解于上述京尼平改性壳聚糖温敏凝胶溶液,将棉或丝绸织物浸渍于载药凝胶溶液中直至凝胶溶液均匀分散于织物内外,将浸渍完凝胶溶液的织物通过容器密闭置于37℃体箱中使其凝胶化,需要说明的是,棉织物优选的采用脱脂棉,以确保足够的含蓄水率。
[0169]
本发明利用新型生物交联剂对壳聚糖温敏凝胶进行改性,通过将药物与凝胶溶液混合后再浸渍到织物上,可使得药物在织物内外表面均匀分散,利用温敏凝胶在人体体表温度附近迅速凝胶化,达到药物缓释的效果。该种整理方法对织物本身和药物的要求较低,制备过程简单,对环境要求低,生产效率高且适用范围广泛。其不仅具备了织物柔软,机械强力好的特点,而且还兼顾了水凝胶亲肤舒适、保水透湿、药物缓释等功能优势。
[0170]
以上依据本发明的理想实施例为启示,通过上述的说明内容,相关人员完全可以在不偏离本项发明技术思想的范围内,进行多样的变更以及修改。本项发明的技术性范围并不局限于说明书上的内容,必须要根据权利要求范围来确定技术性范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。