1.本发明涉及一种人工智能辅助医学生物信息建立大动脉炎影像学精准评估体系。
背景技术:
2.大动脉炎是一种好发于亚洲青年女性的慢性非特异性的肉芽肿性多血管炎,发病率约为每百万分之三至四十,主要累及主动脉及其主要分支。动脉管壁呈跳跃性的炎症病变,可导致管壁增厚、管腔狭窄或扩张,引起靶器官缺血梗死功能丧失或血管破裂危及生命,预后不佳。及时识别、控制管壁炎症活动,阻断血管的这些重塑性改变,是大动脉炎治疗和评估的关键,而精准地评估血管的状态、判断血管的演化方向是其重要基础。
3.利用mra、cta、血管超声造影、pet-ct和病理等方法观察血管治疗前后的变化,是临床上常用的大动脉炎影像学随访方法。但这些方法具有一定的局限性,进行影像学评估耗用大量的时间,且不能准确地反映血管的炎症和血管重塑状况,亦不能预测血管的转归。此外,单独的影像学评估没有综合考虑患者的医学生物信息,可能也是不能精准评估的重要原因之一。
4.使用人工智能技术辅助识别医学影像是重要的解决方法。目前已有相关技术对血管影像进行三维重建,但尚无研究、发明解决血管影像学的智能评估,并在结合临床信息的基础上给出判断。
技术实现要素:
5.本发明的目的是:使用人工智能技术辅助识别血管影像。
6.为了达到上述目的,本发明技术方案是提供了一种人工智能辅助医学生物信息建立大动脉炎影像学精准评估体系,其特征在于,包括血管图像单元、血管定位人工智能算法模型以及血管识别单元,其中:
7.血管图像单元获取临床血管医学图像后组建图像数据库,随后采用3d建模技术基于图像数据库中图像数据构建高分辨率的血管3d图像,临床血管医学图像包括mri图像以及病理图像,病理图像进一步包括常规he病理图像以及免疫组化病理图像;
8.将血管图像单元输出的血管3d图像以及所对应的免疫组化病理图像输入训练好的血管定位人工智能算法模型后,由血管定位人工智能算法模型对血管3d图像中的血管位置和层次以及病理图像中的细胞类型进行自动识别,对血管定位人工智能算法模型进行训练时采用如下方法构建训练集:
9.获得由血管图像单元输出的血管3d图像以及对应的免疫组化病理图像后,基于特征性的血管解剖学分割点在系统解剖的层面上对血管位置进行标记,在局部解剖的层面上根据三层膜结构的不同,对血管的内膜、中膜和外膜层次进行标记;在免疫组化病理图像中,对细胞类型进行标记;利用训练集对血管定位人工智能算法模型进行反复训练,以优化血管定位人工智能算法模型的识别定位能力;
10.将已完成血管位置和层次定位的血管3d图像输入血管识别单元,血管识别单元依据血管位置和层次按照适当的尺寸,对重建的血管3d图像进行等尺寸切割,获得相邻的连续五节血管段;随后血管识别单元采用影像学方法计算连续五节血管段的管腔直径和管壁厚度平均值,对相邻的连续五节血管段的管腔直径和管壁厚度平均值进行比较,以左心室向升主动脉开口处作为基准值,计算管腔直径和管壁厚度平均值的变化率;为血管狭窄、血管扩张和血管增厚设置不同的变化率阈值,若计算得到的管腔直径和管壁厚度平均值的变化率大于相应的变化率阈值,则判断发生血管狭窄、血管扩张或血管增厚,进而输出发生血管狭窄、血管扩张或血管增厚的血管的病变位置和病变类型;
11.将对应的免疫组化病理图像以及血管定位人工智能算法模型输出的细胞类型输入血管识别单元,血管识别单元采用神经网络算法自动判断内膜、中膜以及外膜的炎症和纤维化水平,并输出结果。
12.优选地,通过血管图像单元构建的所述血管3d图像为高分辨率的mra血管扫描横断面图像。
13.优选地,所述血管定位人工智能算法模型采用神经网络算法。
14.优选地,所述血管识别单元还输出病变程度,病变程度通过实时计算得到的变化率与变化率阈值之间差值体现。
15.优选地,还包括综合评价单元,综合评价单元系统地纳入医学生物信息,根据患者的医学生物信息指标,进行指标筛选,由综合评价单元将筛选获得的指标与血管识别单元输出的影像学表现进行优化组合,对血管影像和血管病理进行自动分析,评估管壁的病变性质。
16.优选地,还包括趋势预测单元,通过趋势预测单元对相同患者治疗前后的数据进行相同的处理,计算相同部位治疗前后的管壁厚度和管腔直径的变化率,设置管腔和管壁变化的阈值,基于阈值评估血管的变化。
17.优选地,所述趋势预测单元结合患者医学生物信息,利用回归模型或决策树模型筛选影响血管预后的因素构建预测模型,对于新病例,预测模型输入纳入分析的数据,即得出该预后的概率,进而精准评估血管预后。
18.本发明在传统人工智能的基础上,对血管图像提取后进行自动化处理,智能评估血管的重塑性改变,并结合医学生物信息,评估血管的炎症状态及变化趋势,自动输出结果。本发明能显著提高医生评估效率,增加评估的全面性和准确性。
附图说明
19.图1为本发明实施的处理方法流程图;
20.图2为根据前期临床随访结果判断血管演化趋势的示例图,图中,event为血管进展。
具体实施方式
21.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定
的范围。
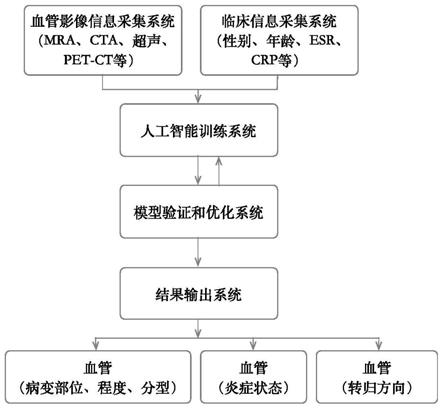
22.本发明公开了一种人工智能辅助医学生物信息建立大动脉炎影像学精准评估体系,包括血管图像单元、血管定位人工智能算法模型、血管识别单元、综合评价单元以及趋势预测单元,其中:
23.血管图像单元获取临床血管医学图像后组建图像数据库,随后采用3d建模技术基于图像数据库中图像数据构建高分辨率的血管3d图像。本实施例中,临床血管医学图像包括mri图像以及病理图像,病理图像进一步包括常规he病理图像以及免疫组化病理图像。通过血管图像单元构建的血管3d图像为高分辨率的mra血管扫描横断面图像。
24.将血管图像单元输出的mra血管扫描横断面图像以及所对应的免疫组化病理图像输入训练好的血管定位人工智能算法模型后,由血管定位人工智能算法模型对mra血管扫描横断面图像中的血管位置和层次以及病理图像中的细胞类型进行自动识别。本实施例中,血管定位人工智能算法模型采用神经网络算法,在对神经网络算法进行训练时采用如下方法构建训练集:
25.获得由血管图像单元输出的mra血管扫描横断面图像以及对应的免疫组化病理图像后,基于特征性的血管解剖学分割点(例如:主动脉弓分叉和髂动脉分叉等)在系统解剖的层面上对血管位置进行标记,在局部解剖(例如:mra横断面图像、病理图像)的层面上根据三层膜结构的不同,对血管的内膜、中膜和外膜层次进行标记。在免疫组化病理图像中,对细胞类型(如浆细胞等)进行标记。利用训练集对血管定位人工智能算法模型进行反复训练,以优化血管定位人工智能算法模型的识别定位能力。
26.将已完成血管位置和层次定位的mra血管扫描横断面图像输入血管识别单元,血管识别单元依据血管位置和层次按照适当的尺寸,对重建的mra血管扫描横断面图像进行等尺寸切割,获得相邻的连续五节血管段。随后血管识别单元采用影像学方法计算连续五节血管段的管腔直径和管壁厚度平均值。对相邻的连续五节血管段的管腔直径和管壁厚度平均值进行比较,以左心室向升主动脉开口处作为基准值,计算管腔直径和管壁厚度平均值的变化率。为血管狭窄、血管扩张和血管增厚设置不同的变化率阈值,若计算得到的管腔直径和管壁厚度平均值的变化率大于相应的变化率阈值,则判断发生血管狭窄、血管扩张或血管增厚,进而输出发生血管狭窄、血管扩张或血管增厚的血管的病变位置、病变程度和类型,其中,病变程度通过实时计算得到的变化率与变化率阈值之间差值体现。
27.将对应的免疫组化病理图像以及血管定位人工智能算法模型输出的细胞类型(包括毛细血管内皮细胞、成纤维细胞、巨噬细胞、浆细胞等)输入血管识别单元,血管识别单元采用神经网络算法自动判断内膜、中膜以及外膜的炎症和纤维化水平,并输出结果。
28.综合评价单元系统地纳入医学生物信息,根据患者性别、年龄、生化和免疫炎症等相关指标,进行指标筛选,由综合评价单元将筛选获得的指标与血管识别单元输出的影像学表现进行优化组合,对血管影像和血管病理进行自动分析,评估管壁的病变性质,如水肿或纤维化等,优化系统。综合评价单元在判断水肿时,可以预先在综合评价单元中设定判断血管水肿的条件,例如同时满足:外膜增厚,毛细血管内皮细胞增多,炎症细胞增多,并判断血管管壁处于炎症活动状态。
29.通过趋势预测单元对相同患者治疗前后的数据进行相同的处理,计算相同部位治疗前后的管壁厚度和管腔直径的变化率,设置管腔和管壁变化的阈值(如管腔直径缩小
25%以上,考虑狭窄进展),评估血管的变化。趋势预测单元再结合患者医学生物信息,利用回归模型、决策树模型等筛选影响血管预后的因素构建预测模型。对于新病例,输入纳入分析的数据,即得出该预后的概率,进而精准评估血管预后。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。