水活化的粘膜粘附性组合物和递送生物活性物质的方法
发明领域
1.本公开涉及在粘膜表面上,例如在胃肠(gi)道内的粘膜表面上形成涂层的组合物,以及在延长的持续时间内将生物活性物质递送至gi道的方法。
背景技术:
2.胃肠道,特别是小肠不仅是营养消化和吸收的主要部位,而且是机体的免疫活性细胞和激素产生细胞的最大储库之一。因此,已经越来越多地认识到肠对于全身性疾病的发病机理是关键的,其中大量的数据突出了小肠作为局部疾病和全身性疾病的治疗靶标的作用。这些观察中最值得注意的是支持小肠在2型糖尿病(t2d)中作为治疗靶标的作用的数据。
3.此外,许多熟知的疾病如炎性肠病(ibd)影响肠的粘膜表面,然而直接的局部药物递送至受影响的粘膜是具有挑战性的。为了将生物制剂局部递送至远端小肠,其通常是患有ibd的患者中的受影响的饮食,主要障碍包括高胃酸度和低ph,以及肠道蛋白水解酶(参见例如zhang et al.,“a ph-responsive supramolecular polymer gel as an enteric elastomer for use in gastric devices,”nat.mater.,14:1065
–
1073(2015)and zelikin et al.,“materials and methods for delivery of biological drugs,”nature chem.,8:997
–
1007(2016))。
4.尽管已经存在克服每个挑战的方法,但是通过口服途径递送的药物(例如蛋白质药物)的生物利用度一直太低(fuhrmann,“sustained gastrointestinal activity of dendronized polymer-enzyme conjugates,”nature publishing group,5:582
–
589(2013)。因此,这些药剂被全身给予,增加了它们的成本以及副作用。能够以最小的全身暴露将药物直接递送至肠道的目标区域的药物递送系统将提供显著的优点,包括延长的药物功效、降低的给药频率和降低的副作用。这些不同的观察结果突出了开发能够提供对小肠粘膜的可靠通路的治疗平台技术的关键需求。
技术实现要素:
5.本公开描述了水活化的粘膜粘附性可水合组合物(本文中也称为肠颗粒的无酸腔涂层,缩写为“af-luci”或“luci”颗粒),其可用于将多种生物活性物质,例如一种或多种这些物质递送至胃肠(gi)道内的多个位置(例如小肠),并持续预定的时间段,例如1至24小时、例如2至6小时、6至12小时、10至15小时、20至24小时或24至48小时。
6.在一个方面,本公开涉及将生物活性物质递送至个体的至少一部分的胃肠(gi)道的方法,该方法包括向个体口服施用组合物,该组合物包括包含一种或多种铝交联的硫酸化试剂的水基液体可水合组合物和至少一种生物活性物质;其中所述生物活性物质在通过个体的胃后在gi道中存在时被保护免受个体的胃中的酸的影响并保持其至少一些生物活性。
7.在这些方法中,组合物可以是丸剂、片剂、胶囊或囊形片的剂型。在一些实施方案
abda、英夫利昔单抗-dyyb、利妥昔单抗和托珠单抗。
18.组合物包括一种或多种铝交联的硫酸化试剂,其在不存在酸的情况下与水性液体接触后可以形成糊剂。在另一个方面,本公开涉及可水合组合物,例如呈干燥形式,其包括颗粒中的生物活性物质,例如生物分子,所述颗粒各自包括一种或多种铝交联的硫酸化试剂,所述铝交联的硫酸化试剂在不存在酸的情况下与水性液体接触后可形成糊剂。在一些实施方案中,用于新方法的组合物包括具有两种或更多种带相反电荷的试剂的复合物(complex)的复合凝聚层,其中一种试剂是硫酸化试剂。生物活性物质与组合物形成物理混合物,并且在生物活性物质和水基、液体可水合组合物之间形成非共价相互作用,例如离子相互作用和氢键。
19.在一些实施方案中,这些组合物可具有以下化学结构:
20.c
12h30
al8s8o
51
·
x[al(oh)i]
·
zh2o
[0021]
其中x小于或等于8;
[0022]
i=1、2或3;和
[0023]
z《x
·
i。
[0024]
这些可水合组合物中的硫酸化试剂可包括以下中的任何一种或多种,基本上由以下组成,或可选自由以下组成的组:硫糖铝、硫酸化葡聚糖、硫酸化糊精、硫酸化支链淀粉、硫酸化直链淀粉、硫酸化纤维素、角叉菜胶、硫酸软骨素、葡萄糖硫酸酯、蔗糖硫酸酯、肝素、硫酸肝素和棉子糖硫酸酯。
[0025]
可水合组合物可以包括非水性液体载体,并且当再水合时,粘稠液体组合物可以具有1至1000帕斯卡-秒(pa.s)的粘度,无关乎液体的ph。可水合组合物可以溶解在足以获得粘度为10pa.s至100pa.s(例如25pa.s至75pa.s)的粘稠液体组合物的量的液体中。在各种实施方案中,颗粒的大小可以为约0.1微米至约500微米。
[0026]
可水合组合物可以通过添加水性溶剂来再水合,并且在水合之后,组合物中的颗粒在剪切应力条件下稳定地粘附到粘蛋白涂覆的表面上。在各种实例中,当水合时,所述组合物形成屏障,当以10mg/ml制备并施加到在franz扩散室中的具有0.45微米孔的1cm2表面积硝酸纤维素过滤器时,所述屏障在添加120g/l葡萄糖溶液至顶室后5分钟表现出小于60%的葡萄糖渗透,并且更优选小于40%的渗透。
[0027]
在水性液体存在下,可水合组合物可释放少于其原始铝含量的约2.0重量/重量%。在一些实施方案中,可水合组合物在水性液体的存在下释放《0.5重量%的铝,并且当施用于个体时在胃肠道中形成有效的营养屏障。当将组合物干燥并在肠道中再水合时,生物活性物质递送性质不会明显改变。
[0028]
生物活性物质包括抗微生物剂,例如碘、银离子和氯,和生物分子,例如酶、受体、神经递质、激素、细胞因子、细胞反应调节剂如生长因子和趋化因子、抗体、疫苗、半抗原、毒素、细菌、小分子、营养素、干扰素、核酶、反义试剂、质粒、dna和rna中的任何一种或多种。在一些实施方案中,可水合组合物(或可水合组合物中的颗粒)与一种或多种生物活性物质交联。在一些实施方案中,可水合组合物负载有一种或多种生物活性物质。在一些实施方案中,生物活性物质包封在可水合组合物中(或包封在可水合组合物的颗粒中)。
[0029]
在各种实施方式中,可水合组合物可以被水合成粘性糊剂,并且该糊剂可以被再次脱水以形成可水合组合物。
[0030]
在另一方面,本公开包括制备包含生物活性物质的稳定的硫酸化试剂的可水合组合物的方法。所述方法包括将硫酸化试剂与酸溶液(例如,0.1-1.0n hcl溶液)混合以形成粘稠(“粘性糊剂”)沉淀物;通过将粘稠沉淀物与足够量(例如至少30v/v%)的水混溶性溶剂混合(例如,通过涡旋、均化或超声处理)足以获得颗粒悬浮液的时间,使沉淀物脱水(例如,快速脱水);从悬浮液中除去颗粒(例如,除去溶剂);以及添加一种或多种生物活性物质以获得包含一种或多种生物活性物质的稳定的硫酸化试剂的可水合组合物。这些方法可还包括进一步干燥稳定的硫酸化试剂的可水合组合物以除去任何残留的溶剂。
[0031]
在一些实施方案中,所述方法包括如下步骤:将硫酸化试剂与酸溶液混合以形成沉淀物;向沉淀物中加入水混溶性常用溶剂;搅拌以形成脆性颗粒形式的悬浮液;真空干燥以蒸发溶剂;以及加入一种或多种生物活性物质。在一些实施方案中,水混溶性常用溶剂是乙醇、甲醇、二甲亚砜(dmso)或丙酮。
[0032]
在各种实施方案中,水溶性溶剂或水混溶性溶剂可包括醇(例如、甲醇、乙醇、异丙醇、正丙醇、试剂醇、2-丁氧基乙醇和糠醇)、丙酮、二甲基硫醚(dmso)、n,n-二甲基甲酰胺(dmf)、乙腈、1,4-二噁烷、四氢呋喃(thf)、乙酸、乙醛、1,2-丁二醇、1,3-丁二醇、1,4-丁二醇、丁酸、二乙醇胺、二亚乙基三胺、二甲氧基乙烷、乙胺、乙二醇、甲酸、甘油、甲基二乙醇胺、甲基异腈、1,3-丙二醇、1,5-戊二醇、丙酸、丙二醇、吡啶和三甘醇。
[0033]
在另一个实施方案中,本公开包括通过将硫酸化试剂与酸溶液(例如,0.1-1.0n hcl溶液)混合以形成粘稠(“粘性糊剂”)沉淀物;以及通过施加微波能量并持续足以获得干燥颗粒的时间使沉淀物快速脱水来制备包含一种或多种生物活性物质的稳定的硫酸化试剂的可水合组合物的其它方法。这些方法中的任何一种方法可以还包括研磨或压碎干燥的可水合组合物以形成粉末。
[0034]
在另一方面,本公开包括将一种或多种生物活性物质递送至需要治疗的患有病症的个体的方法。所述方法包括选择需要一种或多种生物活性物质的患有病症的个体;以及向该个体施用治疗有效量的本文所述的任何可水合组合物,其包括一种或多种适于特定病症的生物活性物质。例如,施用可以通过直接应用组合物来完成,例如通过内窥镜、针、刷或喷雾来应用,或其中组合物为丸剂、片剂、胶囊剂或囊性片(gel-cap)的形式。在这些方法中,所述病症可以是,例如,2型糖尿病(例如,用glp-1治疗)、糖尿病前期、肥胖、克罗恩病(例如,用(阿达木单抗)或(优特克单抗)治疗)、肠易激综合征、胃炎、溃疡性结肠炎、憩室炎、消化性溃疡、十二指肠溃疡、肠溃疡、乳糜泻、菌群失衡、类风湿性关节炎(例如用生物制剂治疗)、甲状腺功能减退症、肢端肥大症、胃肠道感染、亮丙瑞林、肠癌、结肠直肠癌、前列腺癌、子宫内膜异位症、抗利尿激素缺乏等。
[0035]
在一些实施方案中,本文所述的包含一种或多种生物活性物质的可水合组合物涂覆gi道的不同区域以治疗特定疾病。例如,涂覆食道的组合物可用于治疗barrett’s食道。例如,涂覆十二指肠的组合物可用于治疗zollinger-ellison综合征。例如,涂覆胃的组合物可用于胃癌、消化性溃疡、胃炎、酸反流(胃食管反流(ger)和ger病(gerd))、m
éné
trier’s病等。例如,涂覆小肠的组合物可用于治疗克罗恩病(也可以是大肠)、乳糜泻、病毒性胃肠炎(也可以是大肠)、whipple病等。例如,涂覆大肠的组合物可用于治疗肠易激综合征(也可以是小肠)、溃疡性结肠炎、结肠息肉等。例如,涂覆直肠的组合物可用于治疗憩室病、痔疮、
结肠直肠癌(也可以是大肠)、显微镜下结肠炎、直肠炎等。
[0036]
在这些方法中,所述组合物可以被封装在可降解的胶囊、片剂或丸剂中,例如被配置成在gi道的特定区域中降解的胶囊、片剂或丸剂。例如,胶囊可以包括ph敏感材料,例如在碱性或酸性条件下降解的材料。所述方法可包括使用经改变以允许组合物的特定头尾向分布的组合物。例如,组合物的改变是组合物的ph敏感性的变化,组合物的静电荷的变化和/或组合物的大小的变化。在一些实施方案中,其涂覆特定长度的gi道。
[0037]
在一些实施方案中,组合物涂覆整个长度的gi道。在一些实施方案中,组合物通过位点特异性递送来施用,而不是在丸剂、片剂或胶囊中施用。
[0038]
在另一方面,本公开包括脱水的酸预处理的组合物,其包括颗粒,所述颗粒包括铝交联的硫酸化试剂和干的铝交联的硫酸化组合物,所述铝交联的硫酸化试剂在不存在酸的情况下与水接触后可形成糊剂,所述干的铝交联的硫酸化组合物用作铝含量小于15.5%的水性成膜屏障,其在水的存在下形成粘稠的糊剂。当存在胃肠液时,这些组合物可在某些实施方案中释放小于2%wt/wt的铝。
[0039]
在一些实施方案中,本文提供的可水合组合物在水合(例如,再水合)、例如在水性流体中水合或再水合时形成糊,无论该流体的ph如何,所述糊具有例如大于35pa.s(例如,大于40、45、50、55或60pa.s)的粘度。一些实施方案还包括将可水合组合物置于包衣材料(例如明胶或羟丙基甲基纤维素(hpmc),或本文所述的或本领域已知的包衣材料的任何组合)中以在特定组合物中形成围绕可水合组合物的包衣。一些实施方案还包括将可水合组合物添加到食品物质或食品添加剂中。
[0040]
本公开还提供了治疗个体(例如患有粘膜炎、口腔溃疡、溃疡性结肠炎或克罗恩病的个体)中的口腔、胃部、腹部或肠溃疡或伤口的方法,所述方法包括以下步骤(由以下步骤组成或基本上由以下步骤组成):选择患有溃疡或伤口的个体并向所选择的个体施用治疗有效量的本文提供的任何可水合组合物。
[0041]
还提供了在需要这样的治疗的个体(例如,具有需要这样的治疗的病症的个体)中治疗微生物感染或微生物定殖的方法,其包括以下步骤(由以下步骤组成或基本上由以下步骤组成):选择需要这样的治疗的个体(例如,患有需要治疗微生物定殖或微生物感染的病症的个体)并向该个体施用治疗有效量的本文所述的任何可水合组合物。对于这些用途,组合物提供保护和治疗效果。
[0042]
在一些实施方案中,可水合组合物包含抗微生物剂(例如本文所述的或本领域已知的示例性抗微生物剂中的任一种)、与该抗微生物剂交联、与该抗微生物剂连接(例如,物理连接)、或与该抗微生物剂组合。例如,抗微生物剂可以选自碘、银离子和氯,或选自碘、银离子、铋(例如,水杨酸铋)和氯。
[0043]
在一些实施方案中,本文所述的可水合组合物与另外的药剂(例如治疗剂)组合使用或作为对另外的药剂(例如治疗剂)的补充使用,以治疗病症,例如糖尿病、肥胖、糖尿病前期和粘膜炎。例如,所述另外的药剂可以是已知的可用于治疗所述病症的治疗剂。另外的药剂也可以是赋予治疗性组合物有益属性的药剂(例如,影响组合物粘度的药剂)。
[0044]
本文考虑的组合疗法包括,例如,在单一药物制剂中施用一种或多种如本文所述的可水合组合物和一种或多种另外的生物活性物质,以及在分开的药物制剂中施用一种或多种如本文所述的组合物和一种或多种另外的药剂。例如,可以在一段时间内同时或依次
施用另外的药剂。
[0045]
例如,在各种实施方案中,本文所述的可水合组合物与一种或多种以下糖尿病治疗剂(例如,同时或相继或作为组合物的一部分)一起施用:胰岛素、二甲双胍、磺酰脲、α-葡糖苷酶抑制剂、噻唑烷二酮类、糊精类似物、胆汁酸螯合剂、dpp-4抑制剂、多巴胺激动剂、肠降血糖素模拟物、非磺酰脲促分泌素和美格列奈(瑞格列奈/prandin,那格列奈/)。在其它实施方案中,可水合组合物与一种或多种以下肥胖治疗剂一起施用:奥利司他、氯卡色林、西布曲明、利莫那班、二甲双胍、艾塞那肽、普兰林肽和托吡酯/芬特明在一些实施方案中,可水合组合物与一种或多种生物活性物质一起施用,所述生物活性物质在全身施用时通常是毒性的,例如激酶抑制剂。
[0046]
本文所述的药剂和组合物用于示例性说明目的,而不旨在是限制性的。所述组合还可以包括多于一种的另外的药剂,例如,两种或三种另外的药剂,如果所述组合使得所得到的组合物可以执行其预期的功能的话。
[0047]
可以将新的可水合组合物设计成形成临时保护层和载体,以将一种或多种生物活性物质递送至胃肠道(gi)的任何部分,而与gi道的该部分中的流体的ph无关。因此,新组合物可用于暂时递送一种或多种生物物质至gi道的多个部分(例如胃、十二指肠和小肠)的内壁,并释放物质以在gi道中起作用或通过肠道内壁吸收至血流中。因此,可以治疗各种医学病况,例如肥胖、代谢病症(例如ii型糖尿病(t2dm)、糖尿病前期、甲状腺功能减退症和肢端肥大症)、肠道病症(例如克罗恩病、肠易激综合征、胃炎、溃疡性结肠炎、憩室炎、消化性溃疡、十二指肠溃疡、肠溃疡、乳糜泻和菌群失衡)、类风湿性关节炎、胃肠感染、亮丙瑞林、癌症(例如肠癌、结肠直肠癌和前列腺癌)、子宫内膜异位、抗利尿激素缺乏等。
[0048]
本文所用的术语“生物活性物质”是指基因编辑药剂(例如cripsr系统)、修饰的或天然存在的细菌(以改变微生物群系)、病毒、抗生素、细胞(例如干细胞和免疫细胞(例如t细胞和car t细胞))、生物分子、小分子药物(包括免疫调节药物)(例如地塞米松、氢化可的松和曲安西龙)、抗生素(例如,环丙沙星)、抗癌药物(例如,多柔比星和紫杉醇)等。在一些实施方案中,这些生物活性物质能够在作用位点由本文所述的组合物释放。在一些实施方案中,这些生物活性物质在作用位点是生物活性的。在一些实施方案中,这些生物活性物质在远端位点是生物活性的。
[0049]
本文所述的可水合组合物可以含有一种或多种生物活性物质,所述生物活性物质是治疗剂、预防剂和/或诊断剂,例如,从组合物中释放。药剂可以是小分子药剂(例如,分子量小于2000、1500、1000、750或500amu)、大分子或生物分子或它们的组合。药剂也可以是疫苗。
[0050]
在一些实施方案中,含有一种或多种生物活性物质的可水合组合物在作用位点是生物活性的。例如,本文所述的组合物可影响局部治疗的gi道粘膜,例如治疗克罗恩病的生物活性物质,例如氨基水杨酸盐、皮质类固醇、免疫调节剂、抗生素等中的一种或多种。在一些实施方案中,克罗恩病可以用生物制剂形式的生物活性物质治疗,所述生物制剂例如阿达木单抗阿达木单抗-adbm阿达木单抗-atto赛妥珠单抗英夫利昔单抗英夫利昔单抗-abda英夫利昔单抗-dyyb那他珠单抗
优特克单抗和维多珠单抗
[0051]
在另一个实施方案中,新的组合物可以用于用生物制剂形式的生物活性物质治疗类风湿性关节炎,所述生物制剂例如阿巴西普阿达木单抗阿达木单抗-adbm阿达木单抗-atto阿那白滞素(kineret)、赛妥珠单抗依那西普依那西普-szzs戈利木单抗(simponi)、英夫利昔单抗英夫利昔单抗-abda(renflexis)、英夫利昔单抗-dyyb利妥昔单抗和托珠单抗
[0052]
在另一个实施方案中,本文所述的具有局部生物活性的组合物可以含有一种或多种有益细菌菌株以减少细菌失衡的至少一种症状。
[0053]
在一些实施方案中,本文所述的包含一种或多种生物活性物质的组合物将所述一种或多种生物活性物质释放到血流中以用于治疗。在一些实施方案中,这些生物活性物质在远端部位和/或全身具有生物活性。
[0054]
小分子药剂的种类的实例包括但不限于抗炎剂、镇痛剂、抗微生物剂、类固醇、干细胞活化分子、再生治疗剂及其组合。
[0055]
细胞因子和生长因子的实例包括但不限于tnf、tgf-b、酸性成纤维细胞生长因子、碱性成纤维细胞生长因子、趋化因子如sdf-1、表皮生长因子、igf-i和ii、血管内皮衍生生长因子、骨形态发生蛋白、血小板衍生生长因子、肝素结合生长因子、造血生长因子和肽生长因子。细胞外基质组分的实例包括但不限于胶原、纤连蛋白、层粘连蛋白、弹性蛋白及其组合。蛋白聚糖和糖胺聚糖也可以与本文所述的材料共价或非共价结合。
[0056]
本文所用的术语“生物分子”是指通常在细胞和组织中发现的分子(例如蛋白质、氨基酸、肽、多核苷酸、核苷酸、多糖、碳水化合物、脂质、核蛋白、糖蛋白、脂蛋白和类固醇),无论是天然存在的还是人工产生的(例如通过合成或重组方法)。生物分子的具体种类包括但不限于酶、受体、神经递质、激素、营养素、小分子、细胞因子、细胞粘附序列(例如rgd序列和整联蛋白)、细胞外基质组分)、细胞反应调节剂如生长因子和趋化因子、抗体、疫苗、半抗原、毒素、干扰素、核酶、反义试剂、质粒、适体、dna和rna(例如,cdna、shrna、sirna、mrna或modrna)。
[0057]
在一些实施方案中,组合物中每分子的铝离子的平均数小于40、30、20或10。在一些实施方案中,所述组合物在与ph大于6、7、8、9或10的水性液体接触后能够形成糊。
[0058]
术语“多核苷酸”、“核酸”或“寡核苷酸”是指核苷酸的聚合物。术语“多核苷酸”、“核酸”和“寡核苷酸”可以互换使用。通常,多核苷酸包含至少三个核苷酸。dna和rna是多核苷酸。聚合物可以包括天然核苷(即腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞苷)、核苷类似物(例如2-氨基腺苷、2-硫代胸苷、肌苷、吡咯并嘧啶、3-甲基腺苷、c5-丙炔基胞苷、c5-丙炔基尿苷、c5溴尿苷、c5氟尿苷、c5碘尿苷、c5甲基胞苷、7脱氮腺苷、7脱氮鸟苷、8氧代腺苷、8氧代鸟苷、o(6)甲基鸟嘌呤和2-硫代胞苷)、化学修饰的碱、生物修饰的碱(例如甲基化的碱)、插层的碱、修饰的糖(例如,2'-氟核糖、核糖、2'-脱氧核糖、
阿拉伯糖和己糖)、或修饰的磷酸酯基团(例如,硫代磷酸酯连接和5'-n亚磷酰胺连接)。
[0059]
如本文所用,“多肽”、“肽”或“蛋白质”包含一串通过肽键连接在一起的至少三个氨基酸。术语“多肽”、“肽”和“蛋白质”可以互换使用。肽可以指单个肽或肽的集合。本发明的肽优选仅含有天然氨基酸,尽管如本领域已知的非天然氨基酸(即,在自然界中不存在但可掺入多肽链中的化合物;参见,例如,如万维网上在cco.caltech.edu/~dadgrp/unnatstruct.gif所描述的,其显示了已经成功掺入功能性离子通道中的非天然氨基酸的结构)和/或氨基酸类似物可以替代地使用。
[0060]
此外,一个或多个氨基酸可以被修饰,例如,通过添加化学实体、如碳水化合物基团、磷酸酯基团、法呢基基团、异法呢基基团、脂肪酸基团、用于缀合、功能化或其它修饰的连接等来实现。在优选的实施方案中,肽的修饰导致更稳定的肽(例如,体内更长的半衰期)。这些修饰可以包括肽的环化、d-氨基酸的掺入等。修饰不应实质性干扰所需的肽的生物活性。
[0061]
术语“多糖”、“碳水化合物”或“寡糖”是指糖的聚合物。术语“多糖”、“碳水化合物”和“寡糖”可以互换使用。通常,多糖包含至少三个糖。聚合物可以包括天然糖(例如,葡萄糖、果糖、半乳糖、甘露糖、阿拉伯糖、核糖和木糖)和/或改性糖(例如,2
’‑
氟核糖、2
’‑
脱氧核糖和己糖)。
[0062]
术语“润湿剂”是指吸收或帮助另一种物质保持水分的物质,例如吸湿物质。它具有促进物质中的水分保持的性质。当掺入化合物结构中时,亲水性润湿剂分子增加水合的功效。交联润湿剂是连接化合物或组合物的不同组分的有效交联剂或间隔剂。
[0063]
本文所述的可水合组合物也可用作递送细胞和/或转染剂的媒介物。
[0064]
本文所述的可水合组合物可以通过多种形式施用,包括直接应用、内窥镜检查、针、刷、喷雾、塞、丸剂、片剂和囊形片。
[0065]
在一些实施方案中,本文所述的颗粒状(例如,微粒状)可水合组合物不被它们所施用的患者的身体吸收。
[0066]
在一些实施方案中,可水合组合物可配制成粉末、润肤剂、乳膏剂、软膏剂或悬浮液。
[0067]
在一些实施方案中,通过使可水合组合物与含水的液体接触而获得的糊剂可用于涂覆生物表面,例如直肠、阴道、鼻和皮肤。
[0068]
在一些实施方案中,可水合组合物可以作为饮料、溶液或酏剂递送。在一些实施方案中,所述组合物可以以饮用吸管的形式施用。
[0069]
在一些实施方案中,可水合组合物可用于递送传感分子(例如传感器)以及造影剂(例如微泡或放射性对比剂)。
[0070]
在另一个方面,本公开还提供了促进粘膜愈合的方法,所述方法通过鉴定需要这种治疗的个体,并将含有合适的生物活性物质的本文所述的可水合组合物或糊剂施用于需要这种治疗的部位来进行,所述糊剂通过使可水合组合物与含水的液体接触而获得。
[0071]
在一个方面,本公开还提供了治疗皮炎的方法。所述方法包括鉴定需要这种治疗的个体的步骤,和将具有合适的生物活性物质的本文所述的可水合组合物或糊剂施用到皮炎部位的步骤,所述糊剂是通过使可水合组合物与含水的液体接触而获得的。也考虑其它用途,例如治疗痔疮、治疗静脉性溃疡、治疗感染等。
[0072]
在整个说明书中使用术语“个体”来描述“动物”或“人”。术语“动物”包括但不限于鸟类、爬行动物、两栖动物和哺乳动物、例如人、其它灵长类、猪、啮齿类如小鼠和大鼠、兔、豚鼠、仓鼠、牛、马、猫、狗、绵羊和山羊。优选的个体是人、农场动物和家养宠物,例如猫和狗。
[0073]
如本文所用,短语“治疗有效量”是指如本文所述的可水合组合物和一种或多种生物活性物质的量,该量引起所期望的生物学或医学反应,包括以下的一种或多种:(1)抑制正在经历或显示疾病、病况或病症的病理学或症状学的个体中的疾病、病况或病症,或疾病、病况或病症的一种或多种症状,例如在2型糖尿病的情况下,抑制升高的血浆葡萄糖水平;(2)促进体重减轻;(3)在患有糖尿病前期的个体中预防或降低发展成ii型糖尿病的风险;或(4)改善疾病或疾病的症状;例如,在正在经历或显示疾病、病况或病症的病理学或症状学的个体中改善疾病、病况或病症或其症状(即,逆转病理学或症状学),例如改善血浆葡萄糖水平。
[0074]
例如,通过用本文所述的组合物治疗个体,糖尿病的以下症状都可以被改善:改善血浆葡萄糖水平、hba1c水平、血浆胰岛素水平、或活性的或总的葡萄糖样肽(glp)水平,或消除增加的口渴、尿频、增加的饥饿、高血压、高脂血症、体重减轻或增加、肥胖相关的关节问题、高血压、总胆固醇、升高的ldl和甘油三酯、代谢综合征、乏力、视力模糊、缓慢愈合溃疡、频繁感染、神经性疼痛、肾衰竭或皮肤变黑和/或引起以下的一种或多种:血浆中餐后活性glp-1水平升高、血浆中餐后葡萄糖水平降低、血浆中c-肽水平升高、通过视觉模拟评分法(vas)测量的食欲感觉的水平降低、通过动态血糖监测系统(cgms)评估的24小时血浆葡萄糖水平降低或体重减轻。
[0075]
本文所用的短语“药学上可接受的”是指在合理的医学判断范围内适合用于与人类和动物的组织接触而没有过度的毒性、刺激、变态反应或其它问题或并发症,与合理的收益/风险比相称的那些化合物、材料、组合物和/或剂型。
[0076]
术语“试剂盒”是指用于例如治疗或预防糖尿病或肥胖的药物试剂盒,其包括一个或多个含有化合物或药物组合物的容器,所述药物组合物包含治疗有效量的一种或多种本文所述的化合物。如果需要,这样的试剂盒可以还包括各种常规药物试剂盒组分中的一种或多种,例如,具有一种或多种药学上可接受的载体的容器,另外的容器等,这对于本领域技术人员而言是显而易见的。作为插入物或作为标签的表示待施用的组分的量、施用指南和/或混合组分的指南的说明书也可包括在试剂盒中。
[0077]
本文所用的术语“聚合物”是指包含重复结构单元的化合物或化合物的混合物。
[0078]
本文所用的短语“粘膜粘附”是指两种材料之间的粘附形式,其中至少一种是粘膜表面。粘膜粘附通常发生在个体体内。
[0079]
短语“口服葡萄糖耐量试验”是指诊断试验,其中在给予葡萄糖后从个体或患者获得血样,以确定葡萄糖从该个体或患者的系统中清除的时间。该测试通常用于确定个体或患者中糖尿病或胰岛素抵抗的存在。
[0080]
术语“可水合组合物”、“水可水合组合物”或“水基液体可水合组合物”是指在与含水的液体(例如纯水)或具有一种或多种溶质的水溶液接触后可形成糊剂的组合物。液体可以具有任何的ph,例如,它可以是酸性的或非酸性的,例如,它可以具有1至14的ph值。
[0081]
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普
通技术人员通常理解的相同的含义。尽管在本发明的实践或测试中可以使用与本文所述的方法和材料类似或等同的方法和材料,但下文描述了合适的方法和材料。本文提及的所有出版物、专利申请、专利和其它参考文献通过引用以其整体并入。在冲突的情况下,以本说明书(包括定义)为准。此外,材料,方法和实施例仅是说明性的,而不是限制性的。
[0082]
本发明的其它特征和优点将从下面的详细描述和权利要求中显而易见。
附图说明
[0083]
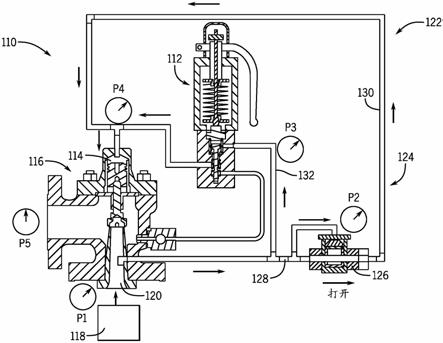
图1是描绘了新的基于硫酸化试剂的可水合组合物(af-luci颗粒)的口服递送的概念的示意图,所述组合物例如在丸剂或胶囊中,其被分散以在胃肠道中例如在胃和/或小肠中形成屏障涂层,并且递送一种或多种生物活性物质。
[0084]
图2是显示了在胃和/或小肠内在液体存在的情况下干颗粒的分散以及在胃和/或肠内壁上立即形成安全的、不可渗透的屏障涂层的示意图,所述屏障涂层可减少和/或延迟葡萄糖和其它营养物的摄取并用于递送一种或多种生物活性物质。
[0085]
图3是显示了如何使用水溶性溶剂可容易地将粘性的酸化的硫糖铝糊重新配制成af-luci的非粘性颗粒的示意图。
[0086]
图4a和4b是在制造期间在硫糖铝和ac-luci中的聚铝配合物(pac)的化学变化的示意性表示。
[0087]
图4c和4d是硫糖铝、酸化的硫糖铝糊和af-luci的化学结构和化学式的表示。离子化的铝原子(配位数=6)通过与羟基的配位键聚合并且也通过配位键被水分子包围。
[0088]
图5是显示硫糖铝的铝含量对比af-luci颗粒的铝含量的柱形图。与天然硫糖铝(其为总重量的15.5-18.5w/w%)相比,af-luci颗粒含有明显更低的铝含量(低于总重量的15w/w%)。
[0089]
图6是显示在模拟胃液(模拟胃液(sgf),ph 1.0)中铝组分从硫糖铝中释放对比铝组分从af-luci中释放的柱形图。
[0090]
图7a至7d是显示从20℃至800℃测量的硫糖铝(图7a中的热曲线和图7c中的一阶导数曲线)和af-luci(图7b中的热曲线和图7d中的一阶导数曲线)的热重分析(tga)的一系列图。
[0091]
图8是硫糖铝和af-luci的ft-ir光谱的表示。af-luci的光谱在3174cm-1
处具有关于-oh伸缩的宽峰,而硫糖铝在3312cm-1
处具有关于-oh伸缩的宽峰,这表明-oh处于较低的能态,这表示与在硫糖铝中以氢氧化铝(al(oh)3)结合的-oh相比,在聚铝配合物中-oh更强地与铝离子结合。
[0092]
图9是一对显示酸化的硫糖铝糊(左图)和水合的af-luci(右图)的粘度的柱形图。由不同浓度的hcl溶液(0.3-0.5n)制备硫糖铝糊,并用乙醇处理以制备af-luci。af-luci颗粒可以在可在gi道中发现的所有ph(即ph 1-7)下形成粘稠的粘性糊剂。
[0093]
图10是显示由水合的af-luci糊形成的层的厚度的柱形图。af-luci可以在与包括胃(ph 1-3)和肠(ph高于6)在内的gi道中的粘液表面接触时形成糊剂层。
[0094]
图11是显示水合的af-luci糊对剪切应力的抗性的柱形图。在粘液表面上形成的层保持稳定至少2小时。
[0095]
图12是显示水合的af-luci糊剂的溶胀的图。水合的af-luci糊在sgf(ph 1.0)和
模拟肠液(sif)(ph 6.5)中显示出显著低的溶胀,溶胀小于5w/w%持续至少2小时。
[0096]
图13是显示af-luci颗粒的屏障性能的一系列柱形图。af-luci颗粒在sgf(ph 1.0)、模拟十二指肠液(sdf)(ph 3.5)和sif(ph 6.5)中对粘液基质显示出优异的屏障性能。
[0097]
图14a是显示用水合的af-luci(水合前180mg)灌胃的大鼠和用相同量的盐水灌胃的大鼠的口服葡萄糖耐量试验(ogtt)曲线的图。
[0098]
图14b是显示图14a中的ogtt曲线的曲线下面积(auc)的柱形图。
[0099]
图14c是显示用含有180mg干af-luci的未包衣明胶胶囊灌胃的大鼠、用含有180mg干af-luci的肠溶衣明胶胶囊灌胃的大鼠和用空的未包衣明胶胶囊灌胃的大鼠的ogtt曲线的图。
[0100]
图14d是显示图14c中的ogtt曲线的auc的柱形图。
[0101]
图15是显示使用计算每个铝的羟基(hydroxo)连接的数目的滴定方法测量的在硫糖铝和af-luci中pac的聚合度的图。
[0102]
图16是显示在不同的模拟胃肠液中再水合的干燥af-luci粉末的流变性质的变化的图。
[0103]
图17是显示在具有不同离子强度的nacl溶液中再水合的af-luci的粘度变化的图。
[0104]
图18a、18b和18c是来自微型计算机断层摄影(microct)的图像,其显示被灌胃到大鼠胃中的af-luci的行为。
[0105]
图19a是显示用不同粘度和不同剂量的af-luci糊灌胃的sprague dawley(sd)大鼠的曲线下面积增值(iauc)中的血糖应答降低的图。
[0106]
图19b是显示两个不同剂量(450mg/kg和2,700mg/kg)的af-luci粘度与iauc之间的相关性的图。
[0107]
图19c是显示使用不同的af-luci给药方案的口服葡萄糖耐量试验(ogtt)中iauc的降低百分比的图。
[0108]
图19d是显示af-luci在采用口服施用的葡萄糖的ogtt中的局部屏障效应的示意图。
[0109]
图19e是显示用af-luci糊灌胃的大鼠的ogtt曲线的图。将用0.9w/v%生理盐水灌胃的大鼠用作对照。
[0110]
图19f是显示图19e中的ogtt曲线的iauc的图(在单因素方差分析(anova)中*《0.05和**《0.001)。
[0111]
图19g是显示在采用全身施用的葡萄糖的腹膜内注射(ipgtt)中af-luci没有全身作用的代表性示意图。
[0112]
图19h是显示用af-luci糊剂灌胃的大鼠的ipgtt曲线的图。将用0.9w/v%生理盐水灌胃的大鼠用作对照。
[0113]
图19i是显示(h)中ogtt曲线的iauc的图。(*《0.05和**《0.001,单因素anova)。
[0114]
图20a是证实了使用luci进行生物活性物质(例如治疗剂)的口服施用和粘膜粘附递送的示意图。
[0115]
图20b是显示在模拟胃液(ph 1.0)中1小时处理之前和之后由luci组合物保护的
辣根过氧化物酶(hrp)活性的柱形图,用剩余量的hrp活性归一化。student t-检验(双尾)。
[0116]
图20c是显示在模拟胃液(ph 1.0)中1小时孵育之前和之后的hrp活性(没有任何luci或其它载体)的柱形图。student t-检验(双尾,***p《0.0001)。
[0117]
图20d是显示使用不同制剂从luci中释放hrp的图。制剂a:混合在干燥hrp粉末中的干燥luci粉末。制剂b:干燥luci粉末 在pbs(ph 7.4)中的hrp溶液。制剂c:在pbs(ph 7.4)中的水合的luci糊 在pbs(ph 7.4)中的hrp溶液。
[0118]
图21a-21c是显示ivis分析的结果的一系列荧光图像,所述ivis分析跟踪当其通过大鼠中的gi道时luci中封装的荧光示踪的模型蛋白(fitc-清蛋白)。
[0119]
图22是显示在施用luci封装的fitc-bsa后24小时的相对荧光强度的柱形图。
[0120]
图23a是显示对于不同的二甲双胍与luci的比率,二甲双胍随时间释放的图。
[0121]
图23b是显示对于不同的二甲双胍与luci的比率,二甲双胍随时间释放的图的特写(显示图23a的前6分钟)。
[0122]
详细说明
[0123]
本公开描述了递送生物活性物质的方法,其通过将所述物质与一种或多种水基、液体可水合组合物混合,并用口服施用的粘膜粘附可水合组合物、例如微粒、制剂或液体制剂涂覆gi道(例如,近端gi道)的部分(包括十二指肠、空肠、髂骨(ilium)、近端肠、整个小肠、大肠和结肠)的腔表面来进行(参见,例如图1)。这些可水合组合物由包含铝交联的硫酸化试剂(例如硫糖铝)的颗粒制成,所述硫糖铝是蔗糖八硫酸酯-铝配合物,其是fda批准的口服施用的药物,用于治疗活跃的胃溃疡和十二指肠溃疡。硫糖铝的粘度是其屏障和递送/载体性能的关键决定因素。当暴露于水性液体(即,胃酸或肠液)时,可水合组合物形成粘性糊,其物理地涂覆口、咽喉、胃、十二指肠和/或小肠的腔表面,以通过与胃和十二指肠粘液的强粘膜粘附相互作用来增厚保护性粘膜层(s.higo et al;pharm.res.21,413-419(2004);tasman-jones and morrison,am.j.med.,86,5-9(1989);slomiany et al.,am.j.of med.,91,30-36,1991)。
[0124]
然而,当硫糖铝单独使用并与胃酸反应形成粘性糊时,它释放大量的铝。因此,使用硫糖铝治疗t2dm的一个障碍是潜在的过度铝吸收,特别是因为t2dm治疗所需的长期的、重复的给药,导致长期的铝暴露。此外,25-40%的糖尿病患者患有慢性肾损害,因此,由于从硫糖铝中释放铝,可能会日益增加潜在的副作用。与具有正常肾功能的患者(其可以充分地排泄铝并因此仅保留有限量)不同,患有cri的患者可具有受损的铝排泄,这可能限制硫糖铝对t2dm患者的长期应用(j.p.new et al.,diabetic medicine,24,364
–
369;eberhard,ritz et al.,new engl.j.med.,341,1127-1133(1999))。因此,必须确保将在长时间段内施用的瞬时营养物屏障涂层几乎没有释放毒性成分,例如铝。减少铝对t2dm患者的暴露将增加这种疗法的安全性,以便将硫糖铝在临床中转变为患者中的肠屏障。
[0125]
硫糖铝也已经用于制备硫糖铝组合物,例如,如pct wo2014/151565中所述,其通过引用并入本文。虽然现有的硫糖铝组合物在酸性液体中再水合时表现出对葡萄糖吸收的有效屏障性能,但是在再水合后在胶凝过程中释放了大量的硫糖铝,因此不能将全部量的组合物用于随后的涂层。此外,在初始的再水合过程中,组合物释放铝。随着时间的推移且重复的暴露,这种释放的铝可能潜在地在组织中蓄积,这可能是非常不希望的,并且在患有肾功能不全的患者中是特别禁忌的。
[0126]
用于肠涂层的理想的粘膜粘附制剂应该1)在与具有不同ph(即胃ph~1,十二指肠ph 3-5,肠ph》6)的gi道的不同区段上的水性粘液接触时,能够在腔上的粘液层上形成层,2)具有良好的屏障性能,3)在水性环境下剪切应力中稳定(即抗剪切,低溶胀),4)能够被封装到肠溶衣胶囊中,因此应该在干燥制剂中,5)使用安全,6)与生物活性物质有效地组合,7)保护生物活性物质免受胃环境影响,8)成功地将生物活性物质递送至gi道的各个部分(包括但不限于,髂骨、空肠和十二指肠)。
[0127]
通常使用的凝胶状的粘膜粘附聚合物不适合于此目的,只要它们吸收水并迅速溶胀,这会损害粘膜粘附、抗剪切性和屏障性能。在我们早期研究的筛选结果中,硫糖铝已经被鉴定为具有最佳的屏障性能。在胃酸中,硫糖铝形成可与胃溃疡结合以形成保护层的粘性糊剂。然而,考虑到硫糖铝需要酸(ph低于~2)来形成粘性糊并且结合对溃疡是特异性的,其不期望在具有较高ph环境的十二指肠或肠上形成层。
[0128]
因此,如本文所述,基于硫糖铝和其它硫酸化试剂开发了与至少一种生物活性物质组合的新的粘膜粘附颗粒组合物,所述其它硫酸化试剂可形成粘膜粘附粘性糊剂,其保护并递送生物活性物质且同时通过减少释放到体内的铝含量的量而最小化潜在的副作用。
[0129]
对于新的可水合组合物实现的令人惊讶的益处是它们可以在任何ph下在液体中再水合并且与生物活性物质混合。因此,本文所述的组合物可用于形成粘稠涂层并且不仅在胃中而且在gi道的其它部分中递送生物活性物质,例如在胃(ph 1)、十二指肠(ph 3-5)、肠(ph 6-7)和结肠(ph 5.5-7)中。本文所述的新方法可以将含水量显著降低到现有的硫糖铝组合物中所发现的水平以下,这使得新的可水合组合物能够用水性液体(例如水)再水合,而不管ph如何,并且不改变pac化学性质或不使用任何添加剂(凝胶保护剂,润湿剂等)。因此,在给定的丸剂、片剂或胶囊中每单位体积可递送更多的可水合组合物,而在具有较高含水量的现有硫糖铝组合物中可能会递送更多的可水合组合物。
[0130]
在一些实施方案中,新的可水合组合物可以在与具有任何ph的液体接触后形成糊剂,所述ph例如ph 1、ph 2、ph 3、ph 4、ph 5、ph 6、ph 7、ph 8、ph 9、ph 10、ph 11、ph 12、ph 13或ph 14。在一些实施方案中,液体可具有1至14、2至13、3至12、4至11、5至10、6至9、6至10、6至11、6至12、6至13或6至14的ph;或具有大于6、7、8、9、10、11、12或13的ph。在一些实施方案中,新的组合物可以与生物活性物质以约1:1、约1:10、约2:10、约3:10、约4:10、约5:10、约6:10、约7:10、约8:10、约9:10、约10:1、约10:2、约10:3、约10:4、约10:5、约10:6、约10:7、约10:8或约10:9的生物活性物质与luci之比率混合。
[0131]
通用方法学
[0132]
新的基于铝交联的硫酸化试剂的(例如,基于硫糖铝的)可水合组合物是干燥颗粒或悬浮液形式的惰性的不可吸收的组合物,其可以暂时涂覆消化道的管腔内壁并减少摄取的营养物通过肠内壁的吸收,并因此阻止那些被阻断的营养物进入血流或具有其它全身作用。
[0133]
下面的实施例表明,施用本文所述的新颗粒状(例如微粒状)组合物在gi道中的任何地方提供了对葡萄糖吸收的有效屏障,从而例如降低餐后血糖浓度。因此,新的组合物和方法可用于治疗人们希望减少一种或多种营养物吸收到体内的病症。
[0134]
例如,通常除了基于药物或胰岛素的治疗之外,ii型糖尿病的管理还需要改变饮食。类似地,控制各种形式的肥胖需要一起调节食物摄取,通常采用药物治疗或包括减肥手
术在内的外科手术方法。如图2中示意性所示,本文所述的基于硫酸化试剂的可水合组合物减少了营养物通过肠内壁从肠腔到血流的通道。例如,抑制或延迟抑制营养物吸收可以意味着抑制葡萄糖吸收。因此,新的可水合组合物可用于治疗ii型糖尿病。例如,新的组合物可以包括与已经批准用于治疗肥胖或糖尿病的生物活性物质混合的luci制剂。这种生物活性物质的非限制性实例是胰岛素、二甲双胍、磺酰脲、α-葡糖苷酶抑制剂、噻唑烷二酮类、糊精类似物、胆汁酸螯合剂、dpp-4抑制剂、多巴胺激动剂、肠降血糖素模拟物、非磺酰脲促分泌素、美格列奈(瑞格列奈/prandin,那格列奈/)、奥利司他、氯卡色林、西布曲明、利莫那班、二甲双胍、艾塞那肽、普兰林肽和托吡酯/芬特明
[0135]
本文所述的可水合组合物以如下方式制备,该方式减少组合物中金属离子(即,铝离子)的存在从而减少在酸(即,胃酸)的存在下从基于硫糖铝的可水合组合物中释放的铝,进而减少血流中来自过量铝的潜在的副作用。此外,将本文所述的可水合组合物与生物活性物质混合,并以保护生物活性物质免受胃的酸性环境影响并将生物活性物质递送至gi道的所需区域的方式制备。
[0136]
可水合组合物和制备该组合物的方法
[0137]
基于铝交联的硫酸化试剂的(例如,基于硫糖铝的)可水合组合物(在本文中也称为“af-luci”颗粒)包括离子化的铝离子的聚合物或由离子化的铝离子的聚合物组成。硫糖铝由与蔗糖八硫酸酯连接的氢氧化铝组成。其它的硫酸化试剂包括硫酸化葡聚糖、硫酸化糊精、硫酸化支链淀粉、硫酸化直链淀粉、硫酸化纤维素、角叉菜胶、硫酸软骨素、葡萄糖硫酸酯、蔗糖硫酸酯、肝素、硫酸肝素和棉子糖硫酸酯。一旦形成luci颗粒,就可以加入一种或多种生物活性物质。如果生物活性物质在酸或醇中是稳定的,则可以就在最终的酸或醇处理之前加入该物质,如下所述。
[0138]
硫糖铝包括形成水不溶性盐的两个带相反电荷的聚离子:阴离子的蔗糖八硫酸酯和阳离子的聚铝配合物(pac)(图4a)。pac是具有铝离子作为骨架的阳离子无机聚合物,其通过与羟基连接(-oh-)的配位键连接在一起。当其暴露于酸时,一部分的羟基连接可逆地质子化以形成水(-oh2),并且在较强的酸中,另外的质子化(h
)和进一步的水合(h2o)不可逆地破坏键以缩短聚合物链,与天然硫糖铝中的pac相比该聚合物链被更多的水分子包围(图4b)。
[0139]
当硫酸化试剂如硫糖铝与酸反应时,一部分铝组分被释放,另一部分铝交联在一起形成“聚铝配合物”。离子化的铝原子(配位数=6)被认为是通过与羟基的配位键聚合并且也通过配位键被水分子包围。如图4c所示,当氢氧化铝基团与酸反应时,它们形成部分水合的阳离子聚铝配合物。水合的聚铝配合物具有总的正电荷,并且通过静电相互作用与带负电荷的蔗糖八硫酸酯强烈结合以形成水不溶性粘性糊。由于羟基连接通过可逆的质子化负责流变性质的ph依赖性变化,具有较少羟基连接和较多结合水(-oh2)的较短的pac聚合物将最小化ph依赖性并且可以容易地脱水/再水合而不需要酸。此外,通过控制静电荷,较短的且更水合的pac聚合物将经历与阴离子蔗糖八硫酸酯的复合凝聚,其中两个聚离子静电缠结以形成具有受控粘度的水不混溶性液体。
[0140]
基于如以下实施例中所述的热重分析(tga)和傅里叶变换红外光谱(ft-ir),并且不受以下理论的束缚,在使用硫糖铝的实例中,如图3和4d中所示,似乎当酸化的硫糖铝粘性糊与水溶性(水混溶性)溶剂如醇混合(然后除去溶剂)时,发生快速脱水反应,并且硫糖
铝的x个氢氧化铝基团(al(oh)3)中的数目“n”离开结构(留下“x-n”),并且数目“m”个氢氧化铝基团似乎形成聚铝配合物,其通过铝离子之间的1个或2个或3个羟基(-(oh)i)(其中i=1或2或3)交联以形成-[al-(oh)i]m。因此,硫糖铝、酸化的硫糖铝糊和af-luci的预测的化学结构是:
[0141]c12h30
al8s8·
xal(oh)3·
yh2o(硫糖铝)
[0142]c12h30
al8s8·
(x-n)al(oh)3·-[al-(oh)i]
m-·
ah2o(酸化的硫糖铝糊)
[0143]c12h30
al8s8o
51
·
x[al(oh)i]
·
zh2o(af-luci)
[0144]
其中x小于或等于8(对于硫糖铝x为8,并且等于铝原子的数目),0《n《x,m大于或等于2(并且可以小于n),i=1或2或3,并且z《x
·
i。
[0145]
yh2o中的变量y是被吸收并潜在地与al配合的水分。因此,y《(6-3)x=3x,其中3x表示可结合al(oh)3的水分子的最大数目。变量z也是af-luci中吸收的水分。因此,z《3(x-n) (6-i)m,其中(3(x-n)是能够结合al(oh)3的水分子的最大数目,(6-i)m是聚铝配合物的最大数目。注意,硫糖铝中的“y”和“z”“h2o”值可以在5.0-40.0w/w%的范围内,例如,可以小于20w/w%。
[0146]
通常,为了使用基于溶剂的脱水来制造干燥的af-luci颗粒,首先用酸溶液(例如,0.1-1.0nhcl溶液)处理硫酸化试剂,例如硫糖铝,以形成粘稠沉淀物(“粘性糊”)(如图3中示意性示出的)。然后将沉淀物快速脱水,例如通过与足够量的、例如至少30v/v%的水溶性(水混溶性)溶剂(但不是水不混溶性溶剂)混合来实现,并混合以施加剪切应力一段足以获得颗粒悬浮液的时间,例如从几秒至几分钟,然后除去溶剂。在一些实施方案中,这些颗粒可以是白色的。
[0147]
在一些实施方案中,粘稠的粘性糊进一步与水溶性溶剂(例如,醇、丙酮、dmso和dmf)混合并涡旋,得到白色颗粒悬浮液。然后将悬浮液干燥以除去溶剂,并将干燥的颗粒进一步研磨以形成白色粉末。可以将生物活性物质添加到干燥的luci组合物中以形成物理混合物,或者如果在酸中稳定的话,则可以就在酸处理之前将所述物质添加到组合物中,并且如果在水溶性溶剂中稳定的话,则可以就在用水溶性溶剂如醇处理之前将所述物质添加到粘性糊中。
[0148]
在一些实施方案中,酸溶液是盐酸(hcl)、氢碘酸(hi)、氢溴酸(hbr)、高氯酸(hclo4)、硝酸(hno3)或硫酸(h2so4)。在一些实施方案中,酸溶液是0.1nhcl、0.2nhcl、0.3nhcl、0.4nhcl、0.5nhcl、0.6nhcl、0.7nhcl、0.8nhcl、0.9nhcl或1.0nhcl。在一些实施方案中,盐酸(hcl)具有大于0.1n、0.2n、0.3n、0.4n、0.5n、0.6n、0.7n、0.8n、0.9n或1.0n的浓度。
[0149]
可用的水溶性溶剂包括醇(例如、甲醇、乙醇、异丙醇、正丙醇、试剂醇、2-丁氧基乙醇和糠醇)、丙酮、二甲基硫醚(dmso)、n,n-二甲基甲酰胺(dmf)、乙腈、1,4-二噁烷、四氢呋喃(thf)、乙酸、乙醛、1,2-丁二醇、1,3-丁二醇、1,4-丁二醇、丁酸、二乙醇胺、二亚乙基三胺、二甲氧基乙烷、乙胺、乙二醇、甲酸、甘油、甲基二乙醇胺、甲基异腈、1,3-丙二醇、1,5-戊二醇、丙酸、丙二醇、吡啶和三甘醇。
[0150]
在另一个实施方案中,不是使用水溶性(水可混溶性)溶剂使酸化的硫糖铝糊快速脱水,而是还可以使用其它快速脱水方法,例如用微波炉快速加热并干燥组合物,以制备af-luci颗粒。例如,可以将一定量的硫酸化试剂(例如硫糖铝)添加到容器(例如玻璃小瓶)
中,然后与酸性溶液(例如,一定量的、例如10ml的0.1-1.0n hcl水溶液)混合,并立即以3000rpm涡旋10秒以形成粘稠沉淀物。例如,可以用微波炉(功率:800w)实施微波干燥方法30秒。
[0151]
除去溶剂的颗粒可进一步被干燥以除去任何残留的水溶性溶剂。可以将干燥的颗粒研磨或粉碎以形成甚至更小的颗粒以形成af-luci粉末。
[0152]
在加入生物活性物质后,然后可以将干燥的颗粒或粉末根据需要在任何水性液体中再水合,而不管ph如何。所得的粘稠的粘性糊或颗粒或粉末可以与各种试剂混合以稳定糊或颗粒,并控制水合水平和控制总粘度。例如,那些试剂可以包括润湿剂或交联润湿剂。这些试剂可以包括以下试剂(由以下试剂组成或基本上由以下试剂组成):例如角叉菜胶、丙二醇、1,2,6-己三醇、丁二醇、二丙二醇、己二醇、甘油、三甘醇、赤藓糖醇辛二醇(erythritol capryl glycol)、植烷三醇、己二醇蜂蜡、己三醇蜂蜡、泛醇、吡咯烷酮羧酸钠、透明质酸、肌醇、糖原、山梨醇、聚甘油基山梨醇、葡萄糖、果糖、木糖醇、弹性蛋白、胶原、丝、角蛋白、异鲸蜡醇聚醚、异月桂醇聚醚、羊毛脂醇聚醚、月桂醇聚醚、硬脂醇聚醚、聚乙二醇、硅共聚物、乳酸铵、甘油三乙酸酯、水解胶原、水解弹性蛋白、水解角蛋白、水解丝、乳酸、甘露醇、泛醇、聚右旋糖、丙二醇、quilaia、尿素或甜菜碱。
[0153]
颗粒稳定剂可选自,例如且不限于,磷酸根离子、果胶、角叉菜胶、壳聚糖、纤维素衍生物、结冷胶、藻酸盐、刺梧桐树胶、葡聚糖、普鲁兰糖、聚乙二醇(peg)、聚乙烯醇(pva)蜂蜡、硼酸钠、硬脂酸、卡波姆、鲸蜡醇、丙二醇、聚山梨酸酯、卵磷脂、单硬脂酸甘油酯、脂肪酸的乙酸酯、脂肪酸的乳酸酯、脂肪酸的柠檬酸酯、脂肪酸的酒石酸酯、脂肪酸的乙酰酒石酸酯、蔗糖甘油酯、脂肪酸的聚甘油酯、脂肪酸的丙烷-2,3-二醇酯、硬脂酰-2-乳酸钠、硬脂酰-2-乳酸钙、硬脂酰酒石酸酯和蓖麻油衍生物。
[0154]
因为在酸处理时一部分铝含量从硫糖铝中释放出来,所以af-luci颗粒具有的铝含量(低于总重量的15.5w/w%,约10.0至约15.5w/w%)显著低于天然的硫糖铝(对硫糖铝的铝含量,usp规定为总重量的15.5-18.5w/w%)(图5)。因此,与硫糖铝和现有的硫糖铝组合物相比,新的可水合组合物再水合时释放出显著更低水平的铝。例如,当使用硫糖铝并将其暴露于酸性流体例如胃液时,其释放其初始铝含量的约15.0w/w%。另一方面,暴露于相同的酸性流体(或任何水性液体,无论ph如何)的新的af-luci可水合组合物释放小于约2.0w/w%的市售硫糖铝的初始铝含量。
[0155]
在一些实施方案中,af-luci中的聚铝配合物(pac)聚合物比硫糖铝中的pac聚合物短,例如,af-luci的每分子的铝离子的平均数可以小于50、40、30、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6或5。在一些实施方案中,每分子af-luci的铝离子的数目可以小于40或30。在一些实施方案中,每分子af-luci的铝离子的平均数可以是约20、19、18、17、16、15、14、13、12、11、10、9、8、7、6或5。
[0156]
虽然已经测试了硫糖铝,但是在本文所述的方法中也可以使用其它硫酸化试剂。例如,硫酸化试剂包括但不限于硫酸化葡聚糖、硫酸化糊精、硫酸化支链淀粉、硫酸化直链淀粉、硫酸化纤维素、角叉菜胶、硫酸软骨素、葡萄糖硫酸酯、蔗糖硫酸酯和棉子糖硫酸酯,可用于产生本文所述的组合物。此外,本文所述的所有可水合组合物可通过本文所述的方法使用可容易从商业来源获得的试剂来制备。例如,硫糖铝可以从商业来源获得,例如sigma-aldrich(st.louis,mi)。
[0157]
可将本文所述的干颗粒(例如微粒)包装成丸剂、片剂或胶囊形式。例如,本文所述的任何组合物中的颗粒可以被肠溶衣包封。例如,包衣可以包含明胶、羟丙基甲基纤维素(hpmc)、和中的一种或多种。在一些实施方案中,所述组合物是含有本文所述颗粒的胶囊。此外,本文所述的任何可水合组合物可以混合到食品(例如棒或奶昔)中或与其它添加剂(例如盐)混合。食品或添加剂的其它实例在本领域中是已知的。
[0158]
例如,可以将含有生物活性物质的组合物填装到明胶胶囊中。对于肠溶衣,可以在增塑剂(例如,柠檬酸三乙酯)和抗粘剂(例如,滑石粉)的存在下将分散在水中,并用常规搅拌器轻轻搅拌。悬浮液可以通过0.5mm筛过滤,然后可以使用喷雾涂布机将其涂覆在制备的明胶胶囊上。对于gi道中的每个区段,e100、e12,5或e po可用于靶向胃(非肠溶衣),l30d-55或l100-55可用于靶向十二指肠,以及l100或l12,5可用于靶向空肠。此外,s100、s12,5或fs30d可用于靶向回肠。
[0159]
使用可水合组合物的方法
[0160]
基于铝交联的硫酸化试剂的(例如,基于硫糖铝的)可水合组合物与生物活性物质组合并用作用于任何患者的疗法,或者可用作用于患有需要减少摄入的营养物的病症的患者的附加疗法。例如,可水合组合物可以与生物活性物质混合,所述生物活性物质例如胰岛素、二甲双胍、磺酰脲、α-葡糖苷酶抑制剂、噻唑烷二酮类、糊精类似物、胆汁酸螯合剂、dpp-4抑制剂、多巴胺激动剂、肠降血糖素模拟物、非磺酰脲促分泌素、美格列奈(瑞格列奈/prandin,那格列奈/)、奥利司他、氯卡色林、西布曲明、利莫那班、二甲双胍、艾塞那肽、普兰林肽和托吡酯/芬特明
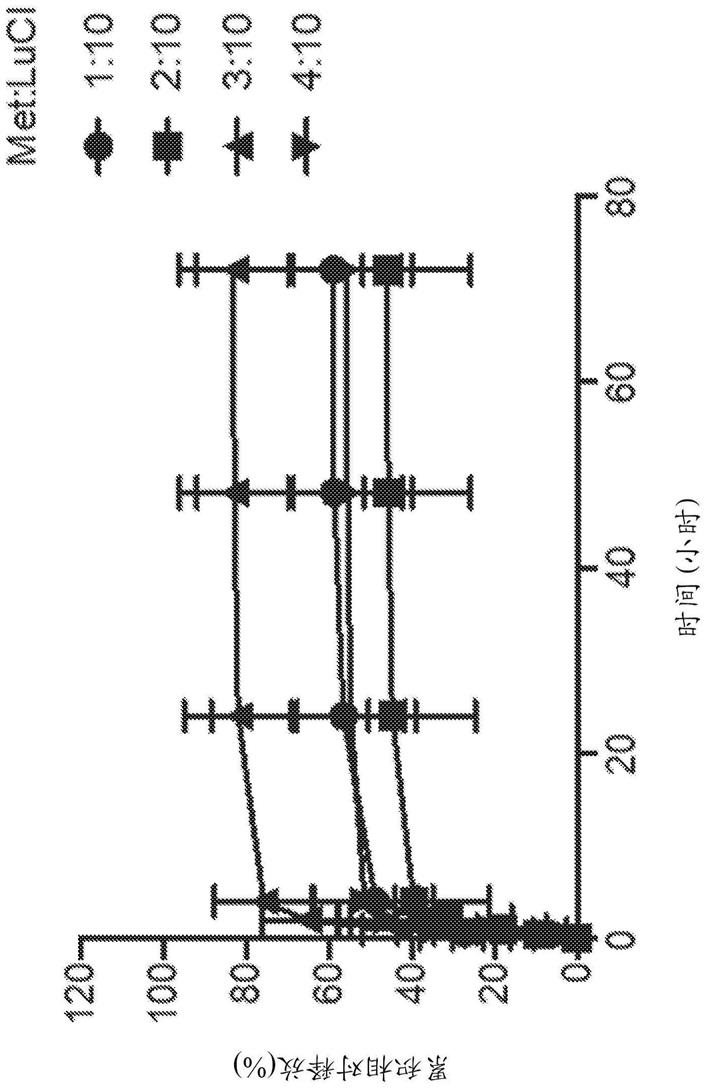
[0161]
例如,t2dm患者在通过常规食物摄入摄取葡萄糖后由于胰岛素抵抗而表现出血糖升高。升高的血糖水平导致多尿症、多饮症和多食症的典型症状。然而,如果不进行治疗,则t2dm可导致严重的并发症,包括酮症酸中毒、高渗性昏迷、心血管疾病、慢性肾衰竭和视网膜病变。作为t2dm患者维持健康体重是避免糖尿病严重程度增加、并发症增加或甚至死亡的重要生活方式因素。因此,t2dm患者使用硫糖铝交联润湿剂微粒将具有双重益处:降低葡萄糖吸收,以及降低导致体重减轻的其它营养物(例如脂肪和碳水化合物)的吸收,和体重减轻。
[0162]
例如葡萄糖的摄取降低或在一些情况下摄取延迟可以治疗ii型糖尿病。实际上,它可以减少糖尿病治疗所需的剂量,包括胰岛素、二甲双胍或磺酰脲类。由沿着胃肠道形成内衬的新制剂产生的屏障颗粒的存在也可以在消化的营养物移动通过肠时调节(例如,降低)营养物的吸收。屏障颗粒的存在产生了可用于与消化的营养物接触的肠内壁的表面积减小,并因此导致这种营养物的吸收减小或延迟。本文所述的基于硫糖铝的可水合组合物是肥胖、体重控制、胰岛素抵抗、高脂血症、高血压和t2dm的潜在疗法或附加疗法。
[0163]
由新的可水合组合物在gi道中形成的粘性糊的持续时间为约2-6小时,随后降解和排泄。然而,基于具体组合物的粘度和电荷,可以将持续时间调整为更短或更长。
[0164]
所述新组合物可用于携带和递送生物活性物质和其它材料。可以控制物质和材料从屏障层的释放,并且可以在延长的时间段内发生,但是是临时的。在另一个实例中,可以
将碘离子、银离子和/或含氯物质与新组合物组合以用于附着和缓慢释放以抑制表面(例如在gi道中的)上的各种微生物的生长和/或增殖。
[0165]
在本文所述的任何方法中,向个体施用一定剂量的本文所述的任何组合物。例如,在本文所述的任何方法中,在进食之前(例如,进餐之前),向个体施用一定剂量的本文所述的任何可水合组合物。可以在进食之前(例如,在进餐之前)约5小时至约1分钟(例如,4小时、3小时、2小时、1.8小时至5分钟、1.5小时至10分钟、1.3小时至15分钟、1.0小时至20分钟、50分钟至25分钟、40分钟至25分钟、5小时至3小时、4小时至2小时、3小时至1小时或2.5小时至1小时),向个体施用本文所述的任何组合物。在其它实施方案中,在基本上与进食相同的时间(例如,在进食的同时),向个体施用本文所述的任何可水合组合物。可以一天(例如,在至少1个月、至少6周、至少2个月、至少10周或至少3个月的总时间段内)向个体施用例如一次、两次、三次、四次、五次、六次或七次剂量的本文所述的任何组合物。本文提供的方法的一些实例还包括监测个体的血糖水平和/或体重(例如,在施用(例如,重复施用)本文提供的任何组合物之前和之后)。
[0166]
在一些实施方案中,本文所述的可水合组合物也可用作递送细胞和/或转染剂的媒介物。本文所述的可水合组合物可以通过多种方式应用,包括直接应用、内窥镜检查、针、刷、喷雾、塞、丸剂、片剂、胶囊和囊形片。在一些实施方案中,本文所述的颗粒状(例如,微粒状)可水合组合物不被向其施用的患者的身体吸收。在一些实施方案中,可水合组合物可配制成粉末、润肤剂、乳膏剂、软膏剂或悬浮液。
[0167]
在一些实施方案中,通过使可水合组合物与含水的液体(例如,至少45%w/w,或至少50%、60%、70%、80%、90%、95%或100%)接触获得的糊剂可用于涂覆生物表面,例如直肠、阴道、鼻和皮肤。在一些实施方案中,可水合组合物可以作为饮料、溶液或酏剂递送。在一些实施方案中,所述组合物可以以饮用吸管的形式施用。参见,例如,万维网在pharmaceuticalonline.com/doc/pediatric-drug-delivery-systems-drinking-straw-xstraw-0001。
[0168]
在一些实施方案中,可水合组合物可用于递送传感分子(例如传感器)以及造影剂(例如微泡或放射性对比剂)。
[0169]
本公开还提供了治疗局部创伤和烧伤的方法。所述方法包括鉴定需要这种治疗的个体,以及将可水合组合物或糊剂施用于局部创伤和烧伤部位,所述糊剂通过将可水合组合物与含水的液体接触而获得。在一些实施方案中,所述组合物为乳膏剂形式。在beheshti,akram,et al.“comparison of topical sucralfate and silver sulfadiazine cream in second degree burns in rats,”adv.clin.exp.med.,22(4):481
–
487(2013)中描述了使用硫糖铝治疗局部创伤和烧伤的方法,将其通过引用的方式以其整体并入本文中。在一些实施方案中,所述组合物包括磺胺嘧啶银。
[0170]
在另一方面,本公开还提供了促进粘膜愈合的方法。所述方法包括鉴定需要这种治疗的个体的步骤,以及将可水合组合物或糊剂施用于需要这种治疗的部位的步骤,所述糊剂通过使可水合组合物与含水的液体接触而获得。在gupta,pravin j.,et al.“topical sucralfate treatment of anal fistulotomy wounds:a randomized placebo-controlled trial,”diseases of the colon&rectum,54(6):699-704(2011)中描述了使用硫糖铝促进粘膜愈合的方法,将其通过引用的方式以其整体并入本文中。
[0171]
在一个方面,本公开还提供了治疗皮炎的方法。所述方法包括鉴定需要这种治疗的个体的步骤,以及将可水合组合物或糊剂施用于皮炎部位的步骤,所述糊剂通过使可水合组合物与含水的液体接触而获得。在markham,trevor,fionnuala kennedy,and paul collins.“topical sucralfate for erosive irritant diaper dermatitis,”archives of dermatology,136:10(2000)中描述了使用硫糖铝治疗皮炎的方法,将其通过引用的方式以其整体并入本文中。
[0172]
也考虑其它用途,例如治疗痔疮、治疗静脉性溃疡,治疗感染等。这些用途中的一些用途以及除本文所述组合物之外的组合物描述于例如wo1989005645a1中,将其通过引用的方式以其整体并入本文中。
[0173]
药物制剂和剂型
[0174]
含有本文所述的与生物活性物质混合的至少一种可水合组合物的药物组合物也在本公开内容的范围内,其具有或不具有另外的药学上可接受的载体。此外,本公开内容涵盖向患有t2db或肥胖的患者(例如,如本文所述的患者)施用有效量的本文所述的化合物(例如,在药物组合物中)的方法。“有效的量”或“有效量”是指化合物和一种或多种生物活性物质的量,该量被要求能在gi道的一个或多个部分的内壁上形成屏障以递送一种或多种生物活性物质和/或赋予所治疗的患者治疗效果。如本领域技术人员所认识到的,有效剂量将根据所治疗的疾病的类型、给药途径、赋形剂的使用以及与其它治疗性治疗共同使用的可能性而变化。在一些实施方案中,可水合组合物可以与生物活性物质以约1:1、约1:10、约2:10、约3:10、约4:10、约5:10、约6:10、约7:10、约8:10、约9:10、约10:1、约10:2、约10:3、约10:4、约10:5、约10:6、约10:7、约10:8或约10:9的生物活性物质与luci之比率混合。
[0175]
治疗性化合物的剂量、毒性和治疗功效可以通过在细胞培养物或实验动物中进行的标准药学程序来测定,例如,用于测定ld50(群体的50%的致死剂量)和ed50(群体的50%的治疗有效剂量)。毒性和治疗效果之间的剂量比是治疗指数,并且其可以表示为ld50/ed50之比。显示高治疗指数的化合物是优选的。虽然可以使用表现毒副作用的化合物,但是应该小心设计将这种化合物靶向受感染组织部位的递送系统,以最小化对未感染细胞的潜在损害,从而减少副作用。
[0176]
从细胞培养测定和动物研究中获得的数据可用于配制用于人的剂量范围。这种化合物的剂量优选在包括ed50的循环浓度范围内,而几乎没有或没有毒性。剂量可以在该范围内变化,这取决于所使用的剂型和所使用的给药途径。对于本发明方法中所用的任何化合物,治疗有效剂量可最初由细胞培养测定来估计。可以在动物模型中配制剂量以实现包括在细胞培养中测定的ic50(即,实现症状的半数最大抑制的测试化合物的浓度)在内的循环血浆浓度范围。这种信息可用于更准确地确定人类中的有用剂量。血浆中的水平可以例如通过高效液相色谱法来测量。
[0177]
示例性剂量可在用于成人的约4g/天至用于成人的约8g/天的最大硫糖铝剂量(对于70kg成人,~114mg/kg)的范围内。对于新的可水合组合物,剂量可以更高,约20g/天至约50g/天,具有以液体形式施用的潜力,因为与单独的硫糖铝相比,新组合物中的铝水平显著更低。在其它实例中,剂量可以为约1g/天至约8g/天(例如,2g/天至约7g/天)。
[0178]
用于口服给药的组合物可以是任何口服可接受的剂型,包括胶囊、片剂、乳剂和水性悬浮液、分散体和溶液。在片剂的情况下,通常使用的载体包括乳糖和玉米淀粉。通常也
加入润滑剂,例如硬脂酸镁。对于胶囊形式的口服施用,有用的稀释剂包括乳糖和干燥的玉米淀粉。当口服施用水性悬浮液或乳剂时,活性成分可悬浮或溶解于与乳化剂或助悬剂组合的油相中。如果需要,可以加入某些甜味剂、矫味剂或着色剂。
[0179]
药物组合物中的载体必须是“可接受的”,即其与组合物的活性成分相容(并且优选地,能够稳定活性成分)并且对待治疗的个体无害。一种或多种增溶剂可用作药物赋形剂以递送上述活性化合物。其它载体的实例包括胶体氧化硅、硬脂酸镁、纤维素、十二烷基硫酸钠和d&c黄#10。
[0180]
治疗性化合物也可以与载体一起制备,所述载体将保护治疗性化合物免于从身体中快速消除,例如控释制剂。可以使用生物可降解的、生物相容的聚合物,例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。可以将新的组合物掺入控释制剂中以调节头尾向分布和保留时间。使用这种制剂的实例包括在下文中(实施例6和7)。此外,这些制剂可用于控制所需效果的持续时间,例如通过改变整体制剂的电荷和/或粘度。此外,新组合物可以与另外的药物混合(例如“掺杂”),然后可以用作药物递送系统。
[0181]
这样的制剂可以使用标准技术制备,或例如从alza corporation and nova pharmaceuticals,inc商购获得。脂质体悬浮液也可用作药学上可接受的载体。这些可以根据本领域技术人员已知的方法来制备,例如,如美国专利号4,522,811中所述。
[0182]
一些组合物和药物组合物可以包括干酸式盐或液体酸式盐(例如本文所述的或本领域已知的任何示例性的干酸式盐或液体酸式盐)。这样的组合物和药物组合物可以在施用于个体或患者(例如施用于个体的小肠)之前用水溶液润湿。
[0183]
药物组合物可以与给药说明书一起包括在容器、包装或分配器中。
[0184]
配制合适的药物组合物的方法是本领域已知的,参见,例如,这个系列drugs and the pharmaceutical sciences:a series of textbooks and monographs(dekker,ny)的书。
[0185]
本文所述的组合物可以通过本文所述的全有机体筛选方法初步筛选其在治疗上述疾病中的功效,然后通过另外的动物实验和临床试验进行证实。其它筛选方法对于本领域普通技术人员也是显而易见的。
实施例
[0186]
本文所述的发明是新的聚合物制剂,其可以在肠壁上形成粘膜粘附性层,并因此用作对经消化的营养物经过消化道吸收的屏障。在以下实施例中进一步描述本发明,这些实施例不限制权利要求中描述的本发明的范围。
[0187]
实施例1-用于制备可水合组合物的方法
[0188]
使用以下方法制造af-luci颗粒组合物,其在水中形成粘稠的粘性糊剂而不需要酸。
[0189]
将1克硫糖铝(heisen pharmaceutical,中国)加入到20ml玻璃小瓶中,加入10ml的0.1-1.0n hcl的水溶液,立即以3000rpm涡旋10秒,形成粘稠沉淀物。
[0190]
除去上清液并加入10ml甲醇、乙醇、异丙醇或粗试剂醇。将小瓶以3000rpm涡旋30秒以获得白色颗粒悬浮液。使用离心(1000rpm,1分钟)或重力沉淀将颗粒沉淀并除去上清液。
[0191]
在另一个测试中,不是使用溶剂使酸化的硫糖铝糊脱水,而是使用微波辅助干燥来制备af-luci颗粒。将1克硫糖铝(heisen pharmaceutical,中国)加入到20ml玻璃小瓶中,加入10ml的0.1-1.0n hcl水溶液,立即以3000rpm涡旋10秒,形成粘稠沉淀物。用微波炉(功率:800w)实施微波干燥方法30秒。
[0192]
使用空气干燥进一步干燥白色颗粒超过12小时或在真空下干燥至少1小时。使用研钵和研杵研磨干燥的颗粒以配制成白色粉末。在使用前将粉末在室温下储存在密闭的玻璃小瓶中。使用ft-ir(bruker,以波数从500cm-1至4000cm-1测量)和tga(perkin elmer,从20℃至800
°
测量)评价硫糖铝和af-luci颗粒的化学状态。现有的硫糖铝组合物(本文称为luci-x)和新的af-luci颗粒制造方法中的关键差异描述于下表1中。
[0193]
表1
[0194][0195][0196]
在一个测试中,在基于溶剂的脱水中,将过量的水混溶性常用溶剂(例如,乙醇、甲醇、二甲亚砜(dmso)、丙酮等)加入到酸化的硫糖铝糊中,并搅拌以形成脆性颗粒形式的悬浮液,将其进一步真空干燥以蒸发溶剂。在微波辅助脱水中,将酸化的硫糖铝糊放置在微波炉中,暴露于1200w微波30秒,并使用研钵和研杵研磨成白色粉末。简言之,为了使用基于溶剂的脱水来制造干颗粒,首先用酸(0.3-0.8n hcl溶液)处理硫糖铝以形成粘稠的粘性糊,将其进一步与水溶性溶剂(例如,醇、丙酮、dmso、dmf等)合并并涡旋,得到白色颗粒悬浮液。然后将悬浮液干燥以除去溶剂,并将干燥的颗粒进一步研磨以形成白色粉末。
[0197]
实施例2-铝含量和从可水合组合物中的释放
[0198]
使用usp推荐的比色法测量硫糖铝和af-luci颗粒的铝含量。简言之,将约1.0g的硫糖铝或af-luci颗粒转移到250ml容量瓶中,加入10ml的6.0n盐酸,混合,并在70℃下水浴中连续搅拌加热5分钟。将溶液冷却至室温,用水稀释至体积,并混合。将溶液过滤,弃去滤液的第一部分。将25毫升滤液转移到250ml烧杯中,加入25ml的0.05m乙二胺四乙酸二钠,加入20ml的乙酸-乙酸铵缓冲液,并混合。将溶液在70℃下水浴中加热5分钟。将所得溶液冷却至室温,加入50ml醇和2ml二硫腙,并混合。然后用0.05m硫酸锌滴定溶液,直到它们形成鲜艳的玫瑰粉红色。消耗的每ml的0.05m乙二胺四乙酸二钠相当于1.349mg的铝。
[0199]
因为在酸处理时铝含量的一部分被释放,所以与天然的硫糖铝相比,af-luci含有显著更低的铝含量(对硫糖铝的铝含量,usp规定是总重量的15.5-18.5w/w%)。图5显示了
硫糖铝和af-luci的铝含量。与天然的硫糖铝(对硫糖铝的铝含量,usp规定是总重量的15.5-18.5w/w%)相比,af-luci颗粒含有显著更低的铝含量(低于总重量的15w/w%)。
[0200]
如图6所示,当暴露于模拟胃液(sgf,ph 1.0)时,与硫糖铝(15w/w%的硫糖铝的总铝含量)相比,从af-luci中释放的铝显著更低(小于2w/w%的af-luci颗粒的总铝含量)。此外,当暴露于模拟十二指肠液(sdf,ph 3.5)或模拟肠液(sif,ph 6.5)时,使用比色法不能检测到从af-luci中释放的铝,这表明长期使用的安全性增强。
[0201]
实施例3-热重分析(tga)和傅里叶变换-红外(ft-ir)
[0202]
使用热重分析(tga)和傅里叶变换红外(ft-ir)进一步详细评价化学组成。如图7a-d所示,af-luci的tga热曲线在340-400℃下显示出独特的重量损失,这在硫糖铝的热曲线中未发现,表明af-luci具有不存在于硫糖铝中的组分(即聚铝配合物)。特别地,图7示出了从20℃至800℃测量的(7a)硫糖铝和(7b)af-luci的热重分析(tga)热曲线。(c-d)。图(7a)硫糖铝的一阶导数曲线(7c)和图(7b)af-luci的一阶导数曲线(7d)也被示出,以更清楚地区分每个段。af-luci的tga热曲线在340-400℃下显示出独特的重量损失,这在硫糖铝的热曲线中未发现,表明af-luci具有不存在于硫糖铝中的组分(即聚铝配合物)。
[0203]
与硫糖铝中的氢氧化铝(al(oh)3)的热氧化相比,af-luci的重量损失的相对高温度(340-400℃)表明af-luci中的新组分需要较高的能量以被氧化,支持了聚铝配合物的存在。此外,如图8中所示,af-luci的ft-ir光谱显示在3174cm-1
处的关于-oh伸缩的宽峰,而硫糖铝在3312cm-1
处具有关于-oh伸缩的宽峰,表明-oh处于较低能态,表示与硫糖铝中的以氢氧化铝(al(oh)3)结合的-oh相比,-oh更强烈地结合聚铝配合物中的铝离子。有趣的是,通过af-luci的水合形成的糊的ft-ir光谱和酸化的硫糖铝糊的ft-ir光谱非常相似,表明当它们在gi道中水合形成糊时,它们具有相似的化学结构。
[0204]
实施例4-af-luci可水合组合物的粘度测量
[0205]
使用流变仪(ar-g2,ta instruments)分析在模拟胃液(sgf)中的1w/v%材料溶液的机械性能。使用具有200μm间隙的20mm板测量每种材料溶液的动态粘度(剪切速率:在对数尺度中0.01-100 1/s,选择1 1/s的剪切速率以比较材料的粘度)。
[0206]
当制造的干af-luci颗粒暴露于水时,它们迅速形成粘稠的粘性糊,其具有与酸处理的硫糖铝糊剂相似的粘度。这种糊剂形成方法具有与硫糖铝的糊形成方法非常不同的几个方面,并且明显有利于与湿表面(即肠腔表面)接触时形成涂层。af-luci颗粒可以在可在gi道中发现的所有ph(即ph 1-7)下形成粘稠的粘性糊剂。
[0207]
具体地,图9显示了酸化的硫糖铝糊和水合的af-luci的粘度。左图显示了从不同浓度的hcl溶液(0.3-0.5n)制造的硫糖铝糊剂的结果,其用乙醇处理以制造af-luci。右图显示了af-luci颗粒的结果,其可以在可在gi道中发现的所有ph(即ph 1-7)下形成粘稠的粘性糊剂。
[0208]
当af-luci颗粒暴露于模拟胃液(sgf,ph 1.0)、模拟十二指肠液(sdf,ph 3.5)、模拟肠液(sif,ph 6.5)和磷酸盐缓冲盐水(pbs,ph 7.4)时,它们都产生类似的粘稠的粘性糊剂。例如,当使用粘度为80pa.s的酸化的硫糖铝糊剂制造af-luci时,所得的af-luci颗粒可分别在蒸馏水(ph 5.5)、sgf、sif和pbs中形成粘度为77pa.s、41pa.s、105pa.s和70pa.s的糊剂。来自af-luci水合的糊的粘度可使用具有不同粘度的酸化的硫糖铝糊来调节。当用醇处理粘度为80、22和12pa.s的酸化的硫糖铝糊以制造af-luci时,所得的af-luci颗粒可在
蒸馏水中形成粘度为77、36和20pa.s的粘稠糊。
[0209]
此外,假定其是再水合过程,并且制成af-luci的原始糊中的水含量为约5-20w/w%,则仅需要最少量的水来产生粘稠的粘性糊料,而硫糖铝需要至少0.6-0.8当量的酸来进行反应以产生类似的糊料。这显然有利于在与湿的肠腔表面接触后立即形成涂层。
[0210]
实施例5-水合的af-luci可水合组合物的膜厚度
[0211]
将500毫克af-luci(过量)加入到粘液涂布的硝酸纤维素膜(直径为2cm的盘形)上,立即加入ddw(ph 5.5)、sgf(ph 1.0)或sif(ph 6.5)。在af-luci变成糊剂并流动以形成层(3-5分钟)之后,除去上清液并将糊剂涂覆的膜在-80℃冷冻器中快速冷冻以测量厚度。分别测量不含af-luci的粘液涂布的硝酸纤维素膜的厚度作为基线。
[0212]
af-luci在与包括胃(ph 1-3)和肠(ph高于6)在内的gi道中的粘液表面接触时可以形成一层的糊。当将af-luci粉末加入到粘液涂布的硝酸纤维素膜上并添加蒸馏水(ph 5.5)、sgf(ph 1.0)或sif(ph 6.5)时,它们可以形成缓慢流过粘膜的糊剂,以形成厚度为100-300μm的连续层(图10)。硫糖铝仅在sgf(ph 1.0)中在粘液涂布的硝酸纤维素膜上形成约250μm的层,而它在蒸馏水和sif中不形成任何层。
[0213]
实施例6-水合的af-luci可水合组合物的稳定性
[0214]
将500毫克af-luci(过量)加入到粘液涂布的硝酸纤维素膜(直径为2cm的盘形)上,立即加入sif(ph 6.5)。在af-luci变成糊剂并流动以形成层(3-5分钟)之后,将af-luci涂布的膜置于具有5ml的sif(ph 6.5)的10cm陪替氏培养皿上。将陪替氏培养皿置于37℃的振荡培养箱中,以500rpm振荡1或2小时,以施加剪切作为随时间的稳定性测试。在选定的时间段结束时,将af-luci涂布的膜在-80℃冷冻器中快速冷冻以测量厚度作为稳定性的量度。分别测量不含af-luci的粘液涂布的硝酸纤维素膜的厚度作为基线。
[0215]
如图11所示,在粘液表面上形成的层保持稳定(厚度没有变化)至少2小时。这些结果表明,af-luci颗粒可以在肠上形成连续层,并且在肠腔粘液表面上形成的层在用餐期间(即,30-60分钟并且至多2小时)应该停留在初始粘附位点上,并且在用餐期间具有最小的屏障性能变化。
[0216]
实施例7-水合的af-luci可水合组合物糊的溶胀
[0217]
将500毫克的af-luci 0.4(过量)加入到粘液涂布的硝酸纤维素膜(直径为2cm的盘形)上,并立即加入sif(ph 6.5)。在af-luci变成糊剂并流动以形成层(3-5分钟)之后,将af-luci涂布的膜置于具有10ml的sgf(ph 1.0)或10ml的sif(ph 6.5)的10cm陪替氏培养皿上。将陪替氏培养皿在不振荡的情况下置于37℃的培养箱中30、60和120分钟。测量所得的af-luci涂布的膜的湿重以计算af-luci糊的溶胀。分别测量不含af-luci的粘液涂布的硝酸纤维素膜的重量作为基线。
[0218]
如图12所示,在sgf(ph 1.0)和sif(ph 6.5)中,在粘液表面上形成的层显示出显著低的溶胀,小于5w/w%并持续至少2小时。这些结果进一步表明,af-luci颗粒可以在肠上形成连续层,并且在肠腔粘液表面上形成的层在用餐期间(即,30-60分钟)应该停留在初始粘附位点上,并且在用餐期间具有最小的屏障性能变化。
[0219]
实施例8-使用粘蛋白涂覆的膜的综合屏障性能测试
[0220]
为了在体外检查由新的可水合组合物形成的糊剂的屏障性能,制备粘蛋白涂布的膜以模拟肠的粘液表面。具体地,将硝酸纤维素膜(孔径:0.2μm,whatman,germany)在pbs
(ph 7.4)中在3%w/v猪胃粘蛋白(sigmaaldrich,usa)溶液中孵育并在室温下轻轻振荡2小时。用蒸馏去离子水(ddw,ph5.5)洗涤膜以除去过量的粘蛋白溶液。制备后1小时内使用粘蛋白涂布的膜。
[0221]
为了测量粘蛋白层的厚度,将粘蛋白涂覆的膜冻干并使用扫描电子显微镜(sem)成像,并检查随机选择的位置的厚度(平均粘蛋白层厚度:~100μm)。为了测试营养屏障性能,将10mg硫糖铝或af-luci均匀地加入到粘蛋白涂布的膜中并垂直倾斜1分钟。将附着于粘蛋白涂布的膜的材料安装在franz-cell系统中,加入3毫升葡萄糖溶液(120g/l),5分钟后从系统的接受部分处收集样品。
[0222]
对每种材料进行一式三份的渗透测试。使用高效液相色谱法(hplc,agilent,usa)用分析型c18柱(zorbax eclipse xdb-c18,agilent)测量葡萄糖浓度。流速为1ml/min,洗脱剂为ddw,uv检测器的波长为195nm。将所有结果归一化为不施加测试材料的粘蛋白涂布的膜(0%阻断)。
[0223]
如图13所示,af-luci颗粒在sgf(ph 1.0)、sdf(ph 3.5)和sif(ph 6.5)中对粘液基质显示出优异的屏障性能。在sgf中,af-lucis可以阻断40-70%的葡萄糖渗透,而在使用sdf和sif的较高ph的环境中,af-lucis显示出更强的屏障功能(65-90%葡萄糖被阻断),高于sgf中硫糖铝的屏障功能(~60%)。这种增强的屏障功能是由于在新采集的肠粘膜上形成强的层,并且似乎与af-luci的粘膜粘附性密切相关。
[0224]
因此,当水合时,该组合物形成屏障,当以10mg/ml制备并施加到在franz扩散室中的具有0.45微米孔的1cm2表面积的硝酸纤维素过滤器上时,在将120g/l葡萄糖溶液添加到顶室后5分钟,该屏障表现出小于60%的葡萄糖渗透,更优选小于40%的渗透。
[0225]
实施例9-体内评价af-luci对葡萄糖耐量的影响
[0226]
从口服葡萄糖耐量试验前的晚上7点起,将330克至350克的雄性sprague dawley(sd)大鼠禁食过夜(15小时)。测试两种不同的制剂(封装在胶囊中的水合的糊和干颗粒)。对于水合的糊剂,在每次灌胃前使用0.9%生理盐水水合180mg的af-luci颗粒。使用灌胃针将水合的糊剂灌胃到胃中。
[0227]
在口服灌胃后,允许动物随意饮水。用0.9%生理盐水灌胃的大鼠用作对照。在施用胶囊后3小时,所有动物进行口服葡萄糖耐量试验(ogtt)。简言之,所有大鼠都用2g/kg的葡萄糖溶液灌胃。在施用葡萄糖溶液之前和之后15、30、60、90和120分钟收集血样。用30号针从尾静脉收集血液以使用血糖仪(onetouchlifescan inc.,usa)测量血糖水平。
[0228]
对于干颗粒制剂,将af-luci颗粒封装在硬明胶胶囊中以经由口服灌胃递送化合物。每个胶囊含有30mg的af-luci颗粒。在没有肠溶衣的情况下,100%可溶性胶囊在胃中快速且完全溶解。使用6个胶囊(总剂量:180mg)而无需进一步包衣,并且用肠溶衣((15w/v%eudragit l100-55,0.1w/v%柠檬酸三乙酯(增塑剂),0.5w/v%滑石粉(抗粘剂),在9.5ml甲醇和0.5ml水中)手动覆盖6个胶囊以确保靶向递送至下胃肠道。对胶囊进行灌胃需要适当的药丸灌胃针,并在氧气中用异氟烷短暂麻醉大鼠。在口服灌胃后,使动物恢复并随意饮水。用相同数量的未包衣的空胶囊灌胃的大鼠用作对照。在施用胶囊后3小时,将所有动物都进行如上所述的ogtt。
[0229]
以预水合的制剂和胶囊中的干制剂形式进行口服施用的af-luci颗粒均能够抑制sd大鼠中的血糖反应(图14a-d)。用水合制剂灌胃的大鼠显示出18.7%的血糖反应降低(曲线下面积,auc),并且在未包衣胶囊中用干胶囊灌胃的大鼠显示出19.2%的降低。还测试了防止af-luci在胃中释放和颗粒在十二指肠中释放的肠溶衣胶囊。通过在3小时内施用肠溶衣胶囊,大鼠显示出17.8%的血糖反应降低,这表明在十二指肠中形成的糊剂也可以阻断营养物的传感和吸收。
[0230]
具体地说,图14a显示了用水合的af-luci(水合前180mg)灌胃的大鼠的ogtt曲线和用相同量的盐水灌胃的大鼠的ogtt曲线。图14b显示了图14a中ogtt曲线的曲线下面积(auc)。图14c显示了用含有180mg的干af-luci的未包衣明胶胶囊灌胃的大鼠、用含有180mg的干af-luci的肠溶衣明胶胶囊灌胃的大鼠和用空的未包衣明胶胶囊灌胃的大鼠的ogtt曲线。图14d显示图14c中ogtt曲线的auc。用不同制剂中的af-luci灌胃的大鼠的ogtt曲线显示出显著的血糖反应降低。
[0231]
这些体内结果表明,胶囊中的af-luci的口服施用可以通过在gi道(即胃和肠)的目标区域中可能形成粘膜粘附性屏障来确保葡萄糖耐量的成功降低。
[0232]
实施例10-在af-luci中的pac的聚合
[0233]
通过使用在nail,s.l.,white,j.l.&hem,s.l.structure of aluminum hydroxide gel i:initial precipitate.journal of pharmaceutical sciences 65,1188
–
1191(1976);and hem,j.d.&roberson,c.e.form and stability of aluminum hydroxide complexes in dilute solution.geol surv water-supply pap(us);(united states)(1967)中所述的基于滴定的方法进行实验以确定af-luci中的聚合度。使用基于pac骨架中羟基(hydroxo)连接的可逆质子化的滴定方法测定af-luci和硫糖铝分子中的pac的聚合度。在不同试管中用0.1n、0.2n、0.3n、0.4n和0.5n hcl溶液处理约10mg的af-luci。将样品涡旋5秒,然后孵育1小时。然后收集每个样品的上清液,并使用ph计测量ph。用硫糖铝进行相同的操作程序。测量hcl溶液的ph作为对照组,并计算对照组和处理组之间的差异。ph的差异对应于质子消耗和羟基连接的量,然后使用它们来计算每分子的铝的数量。
[0234]
分析af-luci和天然硫糖铝中pac的聚合度(即,每pac分子的铝离子数)。af-lucis的每分子的铝离子数(对于使用0.4n、0.5n和0.6nhcl溶液制造的af-lucis,分别为18.6
±
8.4、9.4
±
0.9和6.9
±
0.8)显著低于硫糖铝(每分子56.1
±
3.0铝)(图15)。图15显示af-luci中的pac聚合物显著短于硫糖铝中的pac聚合物,这表明该聚合物具有较低的ph依赖性并且能够与阴离子的蔗糖八硫酸酯形成液体复合凝聚层(***《0.0001,单因素anova)。
[0235]
实施例11-再水合糊剂的性质
[0236]
还进行实验以进一步确定再水合糊剂的性质。当向模拟胃液(sgf,ph 1.0)中水合的af-luci糊添加ph 3.5sdf和ph 6.5sif时,所得糊的相位角高于80
°
,这表明所得糊呈液态,其在形成连续层的表面上是适形的,而在添加有sdf或sif的ph 1.0sgf中的硫糖铝糊显示出相位角的显著降低或形成弱的脆性固体颗粒(图16)。这表明相位角没有显著变化,表明af-luci以ph非依赖性方式形成液体。在sdf(ph 3.5)中,酸化的硫糖铝糊的相位角显著降低,形成弱的固体聚集体。因此,af-luci可以水合成与gi道中的位置无关的适形的粘稠糊剂,这与在胃中形成颗粒聚集体并且不附着在十二指肠和肠上的天然硫糖铝不同。这种ph非依赖性水合行为是由于af-luci中较短的pac更容易溶解在水中,因此与具有较高聚合
度的天然硫糖铝的水不溶性pac相比,其更容易与阴离子形成复合凝聚层(complex coacervate)。
[0237]
当向af-luci粉末中加入不同浓度的nacl溶液时,随着nacl浓度的增加,它们逐渐溶胀以形成较低粘度的液体,这是由于用单价离子部分掩蔽带电荷的聚合物,并且完全溶解在高于某一临界水平的较高浓度的nacl溶液中(图17)。图17显示,随着离子强度的增加,由于af-luci的pac和蔗糖八硫酸酯中带电基团的部分掩蔽,再水合的af-luci糊的粘度降低,并完全溶解在离子强度高于某一临界点的nacl溶液中。这是复合凝聚层系统的特征行为。这是液体复合凝聚层系统的特征行为(参见wang,q.&schlenoff,j.b.the polyelectrolyte complex/coacervate continuum.macromolecules 47,3108
–
3116(2014);de kruif,c.g.,weinbreck,f.&de vries,r.complex coacervation of proteins and anionic polysaccharides.current opinion in colloid&interface science 9,340
–
349(2004);veis,a.&aranyi,c.phase separation in polyelectrolyte systems.i.complex coacervates of gelatin.j.phys.chem.64,1203
–
1210(1960))。这表明,较短的和更多的水合pac可以与阴离子的蔗糖八硫酸酯形成更多的柔性连接,形成粘稠液体。在较高浓度hcl中制造的af-luci需要较低浓度的nacl溶液以完全溶解af-luci(即,完全解离pac和蔗糖八硫酸酯),这表明较短的pac具有较低的离子结合能,这有助于其较低的粘度。甚至在饱和nacl溶液(约0.35g/ml,在水中)中溶解少于5w/w%的天然硫糖铝,并且剩余的硫糖铝保持悬浮,这表明在天然硫糖铝中两种聚离子太强烈地结合在一起,并且仅用大量胃酸变成液体糊相,胃酸大量破坏pac。
[0238]
实施例12
–
af-luci涂层可以降低大鼠中的血糖响应
[0239]
进行实验以评估af-luci如何在体内形成涂层。
[0240]
将水合的af-luci糊剂灌胃到sprague-dawley(sd)大鼠的胃中并使用微型计算机断层扫描(microct)成像。由于铝的存在,在没有另外的造影剂的情况下,af-luci糊剂可以在胃肠道组织上可视化。对于这些实验,将大鼠禁食过夜,并用在0.9w/v%生理盐水溶液中水合的af-luci糊剂以450mg/kg大鼠直接灌胃到胃中。在1小时和5小时后,使用异氟烷麻醉大鼠并使用microct成像。图像显示,在灌胃1小时后,af-luci糊剂在胃和十二指肠中形成层,并且该层对于研究的程度(5小时)是稳定的(图18a-18c)。图18a是在成像前1小时用af-luci灌胃的sd大鼠的冠状平面视图。af-luci在胃、十二指肠和近端肠中形成层。图18b和18c是在microct成像前1小时(图18b)和5小时(图18c)用af-luci灌胃的sd大鼠的三维视图。af-luci在灌胃后附着在胃、十二指肠和近端肠上至少5小时,而硫糖铝仅在健康粘膜上形成稀疏分散的聚集体。
[0241]
当向sd大鼠灌胃硫糖铝时,microct图像仅在胃和肠区显示出小的聚集体,表明硫糖铝没有形成层。这些数据表明af-luci可以在gi道的腔侧(luminal side)上形成具有瞬时稳定性的涂层。
[0242]
然后进行实验以评估af-luci涂层是否可以降低血糖反应。为了评价来自af-luci的屏障涂层对餐后血糖反应的体内作用,用af-luci糊剂预先灌胃sd大鼠,并进行标准的ogtt。不同剂量但不同粘度的af-luci。据推测,低粘度产品可能导致在较大面积和较早的十二指肠涂层(起效)中形成屏障。对于这些研究,将大鼠禁食过夜并用af-luci糊剂灌胃(剂量:450-2,700mg/kg大鼠;粘度:高和低),或灌胃盐水作为对照。1小时或3小时后,灌胃
葡萄糖溶液(2g/kg大鼠),并在随后的120分钟内每30分钟测量血清葡萄糖水平的变化(n=4/臂)。尾静脉血液用于使用血糖仪测量血糖水平。af-luci糊的粘度对降低血糖反应具有显著影响(图19a和19b)。形成较低粘度的糊(粘度:5pa.s,用450mg/kg大鼠剂量降低15%)的af-luci制剂与较高粘度的糊(粘度:36pa.s,用450mg/kg大鼠剂量降低3%)相比显示出明显更高的血糖反应降低。较高粘度的糊剂(36pa.s)表现出与通过与sgf反应由天然硫糖铝形成的糊剂类似的粘度。af-luci给药和葡萄糖灌胃之间的时间间断还根据af-luci制剂而不同地影响血糖反应的降低(图19c)。用较低粘度的af-luci(即5pa.s)以450mg/kg大鼠处理后3小时,血糖反应的降低降至7%。在图19中,使用0.4n、0.5n和0.6n hcl溶液制造并在0.9w/v%生理盐水中再水合的af-luci分别表示为“高粘度”、“中粘度”和“低粘度”。
[0243]
这些结果表明af-luci的口服施用可以有效地降低血糖反应,并且血糖反应的降低可以通过改变af-luci的物理性质(例如,粘度)来最大化,所述物理性质潜在地调节涂层性质(例如,涂层的持续时间和位置)。
[0244]
相反,硫糖铝选择性地结合溃疡性粘膜,其中碳酸氢盐分泌被破坏(即酸性),而在碳酸氢盐中和的健康粘膜上,硫糖铝形成附着在表面上的松散结合的离散固体聚集体,而不是形成连续层。用硫糖铝灌胃的大鼠的计算机断层扫描(ct)图像和荧光显微镜图像显示,硫糖铝在胃和肠中以低密度稀疏分散,并在几个小时内洗出。由于流变性质的改变,粘液表面上中和的ph也损害了硫糖铝的屏障功能。当酸化的硫糖铝糊加入ph高于1.0的溶液时,振荡流变分析中的相位角(δ)逐渐增加,表明弱的固体聚集体的形成。此外,当在ph 1.0下将硫糖铝施加到粘液涂布的膜上并添加具有较高ph(》2.0)的溶液时,屏障功能急剧降低(在ph 4.0下16.5%葡萄糖阻断)。因此,当使用正常的sprague-dawley(sd)大鼠在口服葡萄糖耐量测试(ogtt)中测试硫糖铝时,除了5分钟时的一个时间点之外,所有其它时间点的峰值葡萄糖值相似,并且在硫糖铝处理组和盐水处理组之间曲线下面积(auc)没有显著差异。这些结果表明af-luci在降低血糖反应方面比硫糖铝更有效。
[0245]
实施例13
–
af-luci涂层通过物理屏障效应降低血糖反应
[0246]
还进行了实验以确定af-luci涂层是否仅通过物理屏障效应而不是通过全身效应对血糖反应具有影响。以具有最大效果的剂量(低粘度,450mg/kg大鼠)用af-luci灌胃大鼠,并且在1小时后通过口服灌胃(对于ogtt)或通过腹膜内注射(对于ipgtt)施用高剂量葡萄糖(2g/g大鼠)。在ogtt中(图19d),血糖反应显著降低(图19e)并且iauc降低47.3%(图19f)。在ipgtt中(图19g),ipgtt曲线(图19h)中和iauc(图19i)中的血糖反应没有差异,表明血糖反应的降低是通过局部屏障涂层,但不是通过全身作用。
[0247]
实施例14-用于制备包含生物活性物质的可水合组合物的方法
[0248]
使用以下方法制造包含生物活性物质的af-luci颗粒组合物,其在不需要酸的情况下仍在水中形成粘稠的粘性糊。
[0249]
将1克硫糖铝(heisen pharmaceutical,中国)加入到20ml玻璃小瓶中,加入10ml的0.1-1.0n hcl的水溶液,立即以3000rpm涡旋10秒,形成粘稠沉淀物。
[0250]
除去上清液并加入10ml的甲醇、乙醇、异丙醇或粗试剂醇。将小瓶以3000rpm涡旋30秒以获得白色颗粒悬浮液。使用离心(1000rpm,1分钟)或重力沉淀将颗粒沉淀并除去上清液。
[0251]
在另一个测试中,不是使用溶剂使酸化的硫糖铝糊脱水,而是使用微波辅助干燥
来制备af-luci颗粒。将1克硫糖铝(heisen pharmaceutical,中国)加入到20ml玻璃小瓶中,加入10ml的0.1-1.0n hcl水溶液,立即以3000rpm涡旋10秒,形成粘稠沉淀物。用微波炉(功率:800w)实施微波干燥方法30秒。
[0252]
使用空气干燥进一步干燥白色颗粒超过12小时或在真空下干燥至少1小时。使用研钵和研杵研磨干燥的颗粒以配制成白色粉末。在与生物活性剂混合之前,将粉末在室温下储存在密闭的玻璃小瓶中。使用ft-ir(bruker,以波数从500cm-1至4000cm-1测量)和tga(perkin elmer,从20℃至800
°
测量)评价硫糖铝和af-luci颗粒的化学状态。
[0253]
在2ml eppendorf管中,将1毫克的干hrp粉末与50mg的af-luci(制剂a,目标载量2%w/w)均匀混合,并使用1ml的pbs(ph 7.4)水合。除去上清液并用pbs洗涤三次。为了计算载药率(loading efficiency),使用mbca测量上清液和各洗涤缓冲液中的hrp浓度(载药率,~84%)。在第二制剂(制剂b)中,将hrp溶液(1ml的pbs中的1mg的hrp)加入到水合的luci(干重,50mg)中,涡旋1分钟并用pbs洗涤三次(载药率,~80%)。在第三制剂(制剂c)中,将hrp溶液(1ml的pbs中的1mg的hrp)加入到干燥的luci粉末(50mg)中,涡旋1分钟,并用pbs洗涤三次(载药率,~99%)。
[0254]
实施例15
–
luci涂层保护生物活性物质免受酸环境的影响
[0255]
还进行了实验以显示使用luci递送生物分子和luci制剂保护蛋白质免受胃酸降解的能力(图20a)。在该试验中,使用辣根过氧化物酶(hrp)-特异性底物3,3',5,5'-四甲基联苯胺(tmb)来测量在用模拟胃液(ssf)进行酸处理之前和之后封装在luci中的hrp的活性,所述模拟胃液具有1.0的ph。
[0256]
将干燥的hrp粉末(1mg)与2g干燥的luci粉末均匀混合,并使用hank's平衡盐溶液(hbss)水合。将载有hrp的luci(20μl)转移至96孔板(hrp的总量,8μg,使用每干重的luci的水合体积来计算)。将ssf(50μl,ph 1.0)加入到载有hrp的luci中,并在37℃下孵育1小时。除去ssf,用hbss洗涤luci糊三次。按照制造商的手册,tmb底物(液体底物,对elisa(sigma-aldrich)超灵敏)用于测试hrp的活性。简言之,将50μl的tmb底物加入到luci中,在振荡培养箱(37℃)中孵育5分钟,并使用50μl的2.0n hcl水溶液(其也完全溶解luci)终止反应。使用420nm的波长在读板器中测量所得溶液的颜色变化。使用hbss、hrp溶液或未载有hrp的luci作为对照。使用micro-bca(mbca)测量在ssf处理之前和之后luci中剩余的hrp的量。
[0257]
该实施例的结果表明luci制剂能够保护负载的蛋白质不被胃酸降解。在酸处理之前和之后,保持装载在luci中的hrp显示出类似的活性(图20b),而暴露于酸的裸露的hrp显示完全丧失活性(图20c)。
[0258]
该实施例有效地显示了luci保护生物分子免受胃的苛刻微环境影响并维持生物活性的能力。
[0259]
实施例16-生物活性物质从不同的luci制剂中的释放
[0260]
采用不同的luci制剂进行进一步的实验以显示luci释放生物活性物质的能力。对于该释放研究,在2ml eppendorf管中将1mg的干hrp粉末与50mg的luci均匀混合(制剂a,目标载量2%w/w),并使用1ml的pbs(ph 7.4)水合。除去上清液并用pbs洗涤三次。为了计算载药率,使用mbca测量上清液和各洗涤缓冲液中的hrp浓度(载药率,~84%)。在第二制剂(制剂b)中,将hrp溶液(1ml的pbs中的1mg的hrp)加入到水合的luci(干重,50mg)中,涡旋1分钟并用pbs洗涤三次(载药率,~80%)。在第三制剂(制剂c)中,将hrp溶液(1ml的pbs中的1mg
的hrp)加入到干luci粉末(50mg)中,涡旋1分钟,并用pbs洗涤三次(载药率,~99%)。
[0261]
将洗涤的luci与1ml的pbs合并,并在振荡培养箱(37℃)中孵育预定的时间点。采集释放缓冲液并用1ml的pbs替换。时间点为5分钟、30分钟、1小时、2小时、4小时、8小时和24小时。使用mbca测量各释放缓冲液的hrp浓度。使用与上述相同的方法和时间点测试制剂b和制剂c的hrp释放。
[0262]
对于制剂a,当干hrp粉末直接与干luci粉末混合时(装载量,2%w/w于luci中;载药率,84%),~62%的装载的hrp在前4小时期间从luci逐渐释放,并且另外的~10%的hrp在24小时期间释放(参见图20d)。然而,如图20d中进一步所示,对于制剂b(其为干luci粉末与pbs(ph 7.4)中的hrp溶液混合),~18%的装载的hrp在前4小时期间从luci逐渐释放,并且在24小时期间几乎没有另外的hrp释放。对于制剂c,其为在pbs(ph 7.4)中水合的luci糊加上在pbs(ph 7.4)中的hrp溶液,基本上没有装载的hrp在前4小时期间从luci释放,然后在24小时期间内仅1%或2%的hrp被释放。这些结果可以通过在制剂a的luci中预期形成较大的孔来解释。
[0263]
实施例17
–
luci制剂涂覆整个gi道24小时
[0264]
当将载有荧光示踪的模型蛋白(异硫氰酸荧光素(fitc)-白蛋白)的luci的干混制剂灌胃至大鼠时,在施用后的第一小时内开始将蛋白货物递送至十二指肠和小肠,并且蛋白在gi道中保留24小时。
[0265]
特别地,将用fitc-bsa封装的luci(2w/w%,于luci粉末中)灌胃给sd大鼠(剂量:450mg/kg大鼠),在1小时或24小时后收集胃至盲肠的gi道。使用ivis spectrum体内成像系统(perkin elmer)对获得的gi道进行成像。将没有luc灌胃的大鼠用作对照,并使用对照将所有图像归一化。
[0266]
在1小时后主要在胃和十二指肠中检测到来自模型蛋白的荧光信号(图21b),该信号甚至在24小时后在十二指肠和小肠中检测到(图21c)。对照显示没有信号(图21a)。如图22的柱形图所示,从1至24小时,肠中的总荧光强度保持在相似的水平,而胃中的总荧光强度从1小时至24小时显著降低。总之,与1小时后发现的总荧光相比,46.8
±
24.1%的荧光信号保留在肠中。
[0267]
这些实验表明,luci保护生物分子并将生物分子递送通过胃到达肠中,并在小肠中维持蛋白质长达24小时。
[0268]
实施例18
–
用于递送另一种生物活性物质的luci涂层
[0269]
进行二甲双胍释放研究以进一步研究luci制剂递送生物活性物质至小肠的能力。
[0270]
在该实施例中,在2ml eppendorf管中将10、20、30或40mg盐酸二甲双胍(sigma aldrich)粉末与100mg的luci(目标载药量分别为1:10、2:10、3:10、4:40w/w)均匀混合,并使用1ml的pbs(ph 7.4)水合。除去上清液并用pbs洗涤3次。为了计算载药率,使用高效液相色谱法(hplc)测量上清液和各洗涤缓冲液中的二甲双胍浓度。将洗涤的luci与1ml的pbs合并,并在振荡培养箱(37℃)中孵育预定的时间点。采集释放缓冲液并用1ml的pbs替换。时间点为5分钟、30分钟、1小时、2小时、4小时、24小时、48小时和72小时。使用hplc测量各释放缓冲液的二甲双胍浓度。基于初始载药量计算释放百分比。
[0271]
如图23a和23b所示,所用的所有比例导致二甲双胍从luci释放。在二甲双胍装载入luci后至少72小时内二甲双胍释放是一致的。如图23a所示,其显示了前6小时的结果,大
部分二甲双胍在该时间段内释放。如图23b所示,在余下的小时至72小时的时间点内没有太多的另外的二甲双胍释放。
[0272]
其它实施方案
[0273]
应当理解,虽然已经结合其详细描述描述了本发明,但是上述描述旨在示例性说明而不是限制发明的范围,其由所附的权利要求书的范围限定。其它的方面、优点和修改在所附权利要求书的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。