1.本发明涉及生物医药领域,具体而言,涉及一种融合蛋白及其应用。
背景技术:
2.cd19是一种跨膜糖蛋白,对b淋巴细胞的活化与增殖过程起着重要的调节 作用,其广泛存在于超过95%的b细胞恶性肿瘤表面,主要包括急性b淋巴细 胞白血病、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤及b细胞非霍奇金淋巴瘤(弥 漫性大b细胞淋巴瘤dlbcl、原发性纵隔b细胞淋巴瘤pmbcl以及滤泡性淋 巴瘤fl)等,而其在正常组织中的表达仅仅局限于b淋巴细胞谱系。
3.以cd19为靶点的car-t细胞疗法凭借卓越的治疗效果开启了治疗难治复 发b细胞恶性肿瘤的新模式,公开资料显示,抗cd19 car-t细胞治疗难治复 发b-all的完全缓解率可高达70%-90%。
4.近年来,抗cd19 car-t治疗范围已逐渐由急、慢性b淋巴细胞白血病扩 展到具有较低侵袭性或偏惰性的b细胞淋巴瘤疾病治疗领域,如b-nhl、边缘 区b淋巴瘤mzbl等。然而,类似的疗效未能在这些患者中成功复制,比如抗 cd19 car-t治疗b-nhl的完全缓解率目前仅有43%-59%,抗cd19 car-t药 物在治疗b细胞淋巴瘤时效果未及预期,亟需开发更有效的针对b细胞淋巴瘤 的car-t治疗产品。
5.b细胞淋巴瘤是一类在组织形态、免疫表型、遗传生物学、临床治疗及预后 等各方面具有高度异质性的淋巴系统恶性肿瘤。不同于血液白血病,b细胞淋巴 瘤通常会在原位或转移灶处形成肿状物并在周围形成类似于实体瘤的肿瘤微环 境,抑制和阻挡car-t细胞向肿瘤部位的迁移。因此,将car-t细胞成功转 移到淋巴瘤部位使其更好发挥药物疗效成为car-t治疗b细胞淋巴瘤时需要首 先解决的问题。
技术实现要素:
6.基于此,有必要提供一种融合蛋白及其应用,其能够将car-t细胞高效转 移到b细胞淋巴瘤部位,使其更好发挥药物疗效。
7.本发明的第一目的在于提供一种融合蛋白,包括自n端至c端顺次连接的 靶向cd19的嵌合抗原受体、连接子元件和cxcr5蛋白;
8.所述嵌合抗原受体包括自n端至c端顺次连接的cd19抗体、跨膜结构域、 共刺激结构域和胞内信号传导结构域。
9.本发明的第二目的在于提供一种分离的核酸,其表达得到所述的融合蛋白。
10.本发明的第三目的在于提供一种含有所述核酸的载体。
11.本发明的第四目的在于提供一种细胞,含有所述的核酸或所述的载体,或 细胞膜表面表达有所述的融合蛋白中的所述嵌合抗原受体和所述cxcr5蛋白。
12.本发明的第五目的在于提供药用组合物,包含所述的细胞。
13.本发明的第六目的在于提供所述的细胞在制备用于治疗b细胞淋巴瘤的药 物中
的应用。
14.本发明将cd19抗体特异性靶向b细胞和cxcr5专一趋向肿瘤分泌 cxcl13因子的特点结合起来,获得了高表达趋化因子受体cxcr5的抗cd19car-t细胞,其可引导改造后的t细胞往趋化因子cxcl13高表达的b细胞淋 巴瘤区域定向迁移富集并杀伤肿瘤细胞,从而有望解决现有抗cd19 car-t疗 法治疗b细胞淋巴瘤效果较差的问题,彻底杀灭肿瘤,提高cr率。
附图说明
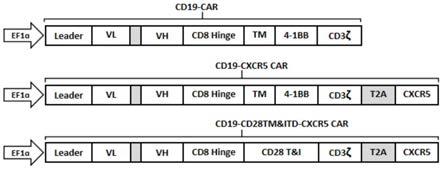
15.图1为本发明一实施例的融合蛋白结果图;
16.图2为本发明一实施例的抗cd19-car质粒示意图;
17.图3为本发明一实施例的抗cd19-cxcr5 car质粒示意图;
18.图4为本发明一实施例的抗cd19-cd28t&i-cxcr5 car质粒示意图;
19.图5为本发明实施例1的elisa检测anti cd19-scfv同cd19抗原结合情 况,a和b图分别为线形图和柱形图;
20.图6为本发明实施例2的膜蛋白阵列验证抗体的非靶点结合的相互作用结 果图;
21.图7为本发明实施例3的anti-cd19 scfv能特异性识别cd19阳性细胞系 结果图;
22.图8a为本发明实施例4的细胞迁移实验示意图;
23.图8b为本发明实施例4的car ts细胞在不同浓度的重组人cxcl13趋 化作用下随时间变化迁移情况图;
24.图9a为本发明实施例5的抗cd19-cxcr5-car t(bg-t19c)杀伤人正常细 胞ifn-γ分泌情况图;
25.图9b为本发明实施例5的抗cd19-cxcr5-car t(bg-t19c)杀伤人正常细 胞il-2分泌情况图;
26.图10a为本发明实施例6的elisa检测抗cd19-cxcr5-car t细胞体外 杀伤肿瘤靶细胞k562-cd19细胞能力图;
27.图10b为本发明实施例6的elisa检测抗cd19-cxcr5-car t细胞体外 杀伤肿瘤靶细胞raji细胞能力图;
28.图10c为本发明实施例6的elisa检测抗cd19-cxcr5-car t细胞体外 杀伤肿瘤靶细胞cd19阴性细胞k562细胞能力图;
29.图11为本发明实施例7的动物实验设计示意图;
30.图12为本发明实施例7的活体成像显示荷瘤小鼠经car-t治疗后体内肿 瘤生长情况图。
具体实施方式
31.为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。 附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实 现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本 发明的公开内容的理解更加透彻全面。
32.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术 领域
的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术 语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的 术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
33.本发明中所使用的术语“含有”、“包含”和“包括”是同义词,其是包容性或开 放式的,不排除额外的、未被引述的成员、元素或方法步骤。
34.本发明模拟人体内天然趋化因子-受体系统,使得car-t细胞带上肿瘤来源 趋化因子的受体,进而驱使car-t细胞往淋巴瘤区域定向聚集。
35.cxcr5,伯基特淋巴瘤受体1(burkitt's lymphoma re-ceptor 1,blr-1), 是趋化因子cxc受体家族成员,主要分布在外周成熟的b细胞。cxcr5是 使b淋巴细胞回巢至淋巴结滤泡以及促进淋巴滤泡集结和淋巴结发育的重要 分子。cxcl13又称b细胞趋化因子1(lymphocyte che-moattractant,blc1), 作为cxcr5的配体,是趋化因子cxc家族的一员,主要分布在胃、肝脏和 淋巴结中。正常情况下cxcl13由次级淋巴组织b细胞区域的基质细胞分泌, 也可表达于滤泡树突状细胞膜。cxcl13/cxcr5共同作用发挥生物学效应,参 与体液循环中幼稚b淋巴细胞归巢至淋巴结的过程,促进淋巴结及次级淋巴组 织发育构建,并促进次级淋巴结中b细胞与抗原接触分化为功能性b细胞, 进而协调体液免疫。
36.同时,cxcl13和受体cxcr5也常高表达于肝癌、前列腺癌、胃癌、胰腺 癌、乳腺癌、淋巴瘤等肿瘤组织。谭卫国等检测了cxcr5及cxcl13在5例原 发中枢神经系统淋巴瘤组织和10例正常脑组织中的表达,结果显示,cxcr5 和cxcl13在肿瘤标本中阳性表达率均为100%(5/5),而在正常脑组织中阳 性表达率均为0(0/10)。widney等和hussain等在非霍奇金淋巴瘤的实验研 究中证明,血清中趋化因子cxcl13的表达与非霍奇金淋巴瘤显著相关,并在 非霍奇金淋巴瘤的细胞系中证实趋化因子受体与其配体cxcl13均有表达, cxcr5/cxcl13在非霍奇金淋巴瘤中有潜在的生物学意义,cxcl13可以作为 诊断非霍奇金淋巴瘤的潜在生物学标志物。唐家宏研究发现在临床治疗弥漫大b 细胞淋巴瘤时,与cxcr5阴性cd8 t细胞相比,cxcr5阳性cd8 t与自体 肿瘤细胞接触和相互作用更紧密,cxcr5 cd8 t细胞与自体肿瘤细胞作用时 细胞毒颗粒的表达上调也更显著,具有更好的弥漫大b细胞淋巴瘤杀伤效果。
37.本发明将抗cd19抗体特异性靶向b细胞和cxcr5专一趋向肿瘤分泌 cxcl13因子的特点结合起来,获得了高表达cxcr5的抗cd19 car-t细胞, 经改造后的t细胞可往cxcl13高表达的b细胞淋巴瘤区域定向迁移聚集,更 好杀灭肿瘤,从而有望解决现有抗cd19 car-t疗法治疗b细胞淋巴瘤效果较 差的问题,提高cr率。
38.第一方面,本发明实施例提供一种融合蛋白,包括自n端至c端顺次连接 的靶向cd19的嵌合抗原受体、连接子元件和cxcr5蛋白。
39.所述嵌合抗原受体包括自n端至c端顺次连接的cd19抗体、跨膜结构域、 共刺激结构域和胞内信号传导结构域。
40.在本技术中,“嵌合抗原受体(chimeric antigen receptor,car)”通常是指 包含能够结合抗原的胞外结构域和至少一个胞内结构域的融合蛋白。car是嵌 合抗原受体t细胞(car-t)的核心部件,其可包括抗原(例如,肿瘤特异性抗原 和/或肿瘤相关抗原)结合结构域、跨膜结构域、共刺激结构域和胞内信号结构域。 car是工程化的受体,可将任意特异性受体植入到免疫效应细胞上,尤其是t 细胞上。在car中,可以将特异识别肿瘤抗原的单
克隆抗体的scfv片段或 vhh片段植入t细胞或nk细胞上。可以使用例如逆转录病毒载体将编码 car的核酸导入t细胞、nk细胞或nkt细胞中。以这种方式,可以生成大 量的癌症特异性t细胞、nk细胞或nkt细胞用于过继性细胞转移。在本申 请中,所述car可以基于抗体的抗原(例如cd19)特异性与t细胞受体活化 胞内结构域组合在一起。经遗传修饰表达car的t细胞可以特异地识别和消 除表达靶抗原的恶性细胞。
41.如本文所用,所述嵌合抗原受体中所包含的“区”或者“域”是指多肽中的一个 区,其可以独立于其它区而折叠成为特定结构。这些“区”或者“域”可以是鼠源或 其他动物源性的序列,如人源序列。
42.在本技术中,“抗体”通常是指一种能够特异性识别和/或中和特定抗原的 多肽分子。例如,抗体可包含通过二硫键相互连接的至少两条重(h)链和两条 轻(l)链组成的免疫球蛋白,并且包括任何包含其抗原结合部分的分子。术语“抗 体”包括单克隆抗体、抗体片段或抗体衍生物,包括但不限于人抗体、人源化 抗体、嵌合抗体、单域抗体(例如,dab),单链抗体(例如,scfv),以及与抗原 结合的抗体片段(例如,fab、fab'和(fab)2片段)。术语“抗体”还包括抗体 的所有重组体形式,例如在原核细胞中表达的抗体、未糖基化的抗体以及本申 请所述的任何与抗原结合的抗体片段及其衍生物。每条重链可由重链可变区(vh) 和重链恒定区构成。每条轻链可由轻链可变区(vl)和轻链恒定区构成。vh和 vl区可进一步被区分为称为互补决定区(cdr)的高变区,它们散布在称为构 架区(fr)的更保守的区域中。每个vh和vl可由三个cdr和四个fr区构成, 它们从氨基端至竣基端可按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、 cdr3和fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。
43.在一些实施方式中,所述cd19抗体的氨基酸序列为seq id no:2所示。
44.在一些实施方式中,所述cxcr5蛋白的氨基酸序列为seq id no:8所示。
[0045]“连接子”或称为“蛋白切割元件”,主要功能是一个载体上表达2个或 多个蛋白,不想让多个蛋白之间连接起来形成融合蛋白,而是各个分离开来发 挥各自功能,故在两个蛋白中间插入上述元件,当核糖体翻译的时候会在此暂 时中止,当跨过这段序列后又重新翻译下游蛋白,相当于类似“剪刀”的作用。
[0046]
可选地,所述连接子元件选自t2a、p2a、e2a、f2a和ires中的一种, 或t2a、p2a、e2a、f2a和iresz至少两者的任何组合中的任一种。优选t2a, 且氨基酸序列为seq id no:7所示。
[0047]
在本技术中,术语"跨膜结构域"通常是指细胞表面蛋白中一段跨越细胞膜的 序列。跨膜域可以与细胞内信号转导结构域直接或间接相连接,起着传递信号 的作用。
[0048]
可选地,所述跨膜结构域包含源自下组中的一种或多种蛋白的跨膜域:cd8、 cd28、4-1bb、cd4、cd27、cd7、pd-l、trac、trbc、cd3ε、cd3ζ、ctla-4、 lag-3、cd5、icos、ox40、nkg2d、2b4、cd244、fcεriγ、btla、cd30、 gitr、hvem、dapi0、cd2、nkg2c、light、dapi2、cd40l、timl、cd226、 dr3、cd45、cd80、cd86、cd9、cd16、cd22、cd33、cd37、cd64、cd134、 cd137、cd154和slam。
[0049]
优选源自cd8蛋白的跨膜域,且氨基酸序列为seq id no:4所示。
[0050]
在本技术中,“共刺激结构域”通常是指可以提供免疫共刺激分子的胞内 结构域,所述共刺激分子为淋巴细胞对抗原的有效应答所需要的细胞表面分子。
[0051]
可选地,所述共刺激结构域包含源自下组中的一种或多种蛋白的共刺激结 构域:cd28、4-1bb、cd27、cd2、cd7、cd8、ox40、cd226、dr3、slam、 cds、icam-1、nkg2d、nkg2c、b7-h3、2b4、fc r riγ、btla、gitr、 hvem、dap10、dap12、cd30、cd40、cd40l、tim1、pd-1、lfa-1、light、 jaml、cd244、cd100、icos、cd83的配体、cd40和myd88;
[0052]
优选4-1bb,且氨基酸序列为seq id no:5所示。
[0053]
在本技术中,“信号传导结构域”通常是指位于细胞内部能够转导信号的 结构域。在本技术中,所述胞内信号传导结构域可以将信号传导至细胞内。通 常,信号传导结构域为用于指导蛋白质找寻靶点的任何一段连续的氨基酸序列。
[0054]
可选地,所述胞内信号传导结构域包含源自下组中的一种或多种蛋白的胞 内信号传导结构域:cd3ζ、cd3γ、cd3e、cd79a、cd79b、fcεriγ、fcεriβ和 fcγriia;
[0055]
优选源自cd3ζ蛋白的胞内信号传导结构域。cd3ζ可以与t细胞受体亚基 和cd3-gamma,-delta,和l-epsilon形成t细胞受体-cd3复合体。cd3ζ含有 三个itam基序,itam序列介导tcr的胞内信号激活。ζ链是一种受体激活 的蛋白酪氨酸激酶底物,当tcr受体与多肽mhc复合物结合后,ζ链可以很 快发生酪氨酸磷酸化,参与淋巴细胞活化信号的转导。
[0056]
在一些实施方式中,cd3ζ蛋白的胞内信号传导结构域氨基酸序列为seq idno:6所示。
[0057]
在本技术中,“铰链区”通常是指胞外域(例如,cd19靶向部分)和跨膜区 之间的连接区。
[0058]
在一些实施方式中,所述嵌合抗原受体还包括连接于所述cd19抗体和所述 跨膜结构域之间的铰链区。铰链区包含一个或多个。
[0059]
优选的,所述铰链区的氨基酸序列为seq id no:3所示。
[0060]
在一些实施方式中,所述cd19抗体的n端还设置有信号肽;
[0061]
优选的,所述信号肽的氨基酸序列为seq id no:1所示。
[0062]
应当理解,本发明所涉及的“区”或者“域”或“功能片段”,或其他的 多肽(例如连接肽和信号肽),可以选自与它们各自所对应的示例序列,例如seq id no:1~9中的任一项的氨基酸序列,或与之具有至少约80%同一性、 至少约90%同一性、至少约95%同一性、至少约96%同一性、至少约97%同 一性、至少约98%同一性或至少约99%同一性的序列,且保留相应所需功能的 实质上相似的序列。
[0063]
实质上相似的序列亦保留多肽的所需活性。通常视为保守置换的置换是在 脂肪族氨基酸ala、val、leu和ile中的彼此置换、羟基残基ser和thr的互换、 酸性残基asp和glu的交换、酰胺残基asn和gln之间的置换、碱性残基lys 和arg的交换以及芳香残基phe、tyr间的置换。进一步的,实质上相似的序列 还包括与所需功能差异不大的经过修饰的序列,这些修饰例如磷酸化、糖基化、 泛素化等。
[0064]
第二方面,本发明实施例提供一种分离的核酸,其表达得到上述任一实施 例所述的融合蛋白。
[0065]
第三方面,本发明实施例提供一种含有上述任一实施例所述的核酸的载体。
[0066]
术语“载体(vector)”是指,可将多聚核苷酸插入其中的一种核酸运载工具。 当载体能使插入的多核苷酸编码的蛋白获得表达时,载体称为表达载体。载体 可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主 细胞中获得表达。载体是本
领域技术人员公知的,包括但不限于:质粒;噬菌 粒;柯斯质粒;人工染色体,例如酵母人工染色体(yac)、细菌人工染色体(bac) 或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。 可用作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺 相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头 多瘤空泡病毒(如sv40)。在一些实施方式中,本发明所述载体中包含基因工程 中常用的调控元件,例如增强子、启动子、内部核糖体进入位点(ires)和其 他表达控制元件(例如转录终止信号,或者多腺苷酸化信号和多聚u序列等)。
[0067]
载体也可以为组合物,例如,可以将不同区段的不同核酸位于不同载体上。
[0068]
在本公开的一些具体的实施方式中,所述载体选自逆转录病毒载体、慢病 毒载体、腺病毒载体、腺病毒相关病毒载体或crispr/cas质粒。
[0069]
第四方面,本发明实施例提供一种细胞,含有上述任一实施例所述的核酸 或上述任一实施例所述的载体,或细胞膜表面表达有上述任一实施例所述的融 合蛋白中的所述嵌合抗原受体和所述cxcr5蛋白。
[0070]
可选地,融合蛋白的基因转入细胞的方式为:慢病毒、逆转录病毒、普通 质粒载体、附加体载体、纳米递送系统、电转导、转座子中的任意一种,或其 它递送系统。
[0071]
在一些实施方式中,所述细胞为免疫细胞。
[0072]
所述免疫细胞可选自辅助t细胞、细胞毒性t细胞、记忆t细胞、调节 性t细胞、mait细胞、γδt细胞、nk细胞、cik细胞中的任一种。
[0073]
免疫细胞可制成制剂,制剂为药学上可接受的载体、稀释剂或赋形剂。本 发明的制剂的施用可以以任何方便的方式进行,包括通过喷雾法、注射、吞咽、 输液、植入或移植。
[0074]
第五方面,本发明实施例提供一种药用组合物,包含上述任一实施例所述 的细胞。
[0075]
所述药物组合物还可以包括药学上可接受的载剂。如本文所用,“药学上可 接受的载剂”包括当与活性组分组合时允许所述组分保持生物学活性并且与受 试者的免疫系统不发生反应的任何材料。实例包括但不限于标准药物载剂(诸如 磷酸盐缓冲盐水溶液、水、乳液(诸如油/水乳液))和各种类型的润湿剂中的任一 者。用于气雾剂或肠胃外施用的示例性稀释剂是磷酸盐缓冲盐水(pbs)或生理 (0.9%)盐水。包含此类载剂的组合物通过熟知的常规方法来配制(参见例如, remington's pharmaceutical sciences,第18版,a.gennaro编,mackpublishingco.,easton,pa,1990;和remington,the science and practice of pharmacy, 第21版,mack publishing,2005)。
[0076]
第六方面,本发明实施例提供上述任一实施例所述的细胞在制备用于治疗b 细胞淋巴瘤的药物中的应用。
[0077]
在一些实施方式中,b细胞淋巴瘤源自成熟的b细胞淋巴细胞,b细胞淋 巴瘤是非霍奇金氏淋巴瘤,或非霍奇金氏淋巴瘤选自小淋巴细胞淋巴瘤(sll), 套细胞淋巴瘤,伯基特淋巴瘤,伯基特-样淋巴瘤,滤泡中心细胞淋巴瘤,滤泡 性淋巴瘤,边缘区b-细胞淋巴瘤,节边缘区b细胞淋巴瘤,节外边缘区b细胞 淋巴瘤,脾边缘区b细胞淋巴瘤,淋巴浆细胞性淋巴瘤,成淋巴细胞b细胞淋 巴瘤,弥漫性大b细胞淋巴瘤,纵隔大b细胞淋巴瘤和瓦尔登斯特伦巨球蛋白 血症。
[0078]
在一些实施方式中,b细胞淋巴瘤是b细胞白血病,或b细胞白血病选自 b细胞急性
淋巴细胞白血病(b-all),前体b细胞急性淋巴细胞白血病,b细胞 慢性淋巴细胞白血病(b-cll),前体b-成淋巴细胞白血病,b细胞前淋巴细胞白 血病,毛细胞白血病和伯基特细胞白血病。
[0079]
在一些实施方式中,b细胞淋巴瘤选自浆细胞骨髓瘤,浆细胞瘤,primaryeffusive淋巴瘤,弥漫性混合b细胞淋巴瘤和未分化的b细胞淋巴瘤。
[0080]
根据本发明的再一方面,还涉及一种治疗有需要的患者的肿瘤的方法,该 方法包括向该患者施用治疗有效量的如上所述的细胞或药用组合物。
[0081]“患者”是指动物。优选地,动物是哺乳动物。患者还指例如灵长类动物(例 如,人)、牛、绵羊、山羊、马、狗、猫、兔、鱼、鸟、啮齿动物(包括小鼠、大 鼠、豚鼠)等。
[0082]
下面将结合实施例对本发明的实施方案进行详细描述。
[0083]
以下各实施例采用的car t的制备:
[0084]
首先,根据图1所示的连接顺序构建各融合蛋白结构。图1中包括3种融 合蛋白结构:cd19-car、cd19-cxcr5-car、cd19-cd28t&i-cxcr5-car。 cd19-car、cd19-cxcr5-car采用cd8跨膜区和4-1bb共刺激结构域。 cd19-cd28t&i-cxcr5-car采用cd28跨膜区和共刺激结构域。
[0085]
将各融合蛋白结构构建在相同的载体质粒中,如图2~4所示。然后通过慢 病毒将载体转染入t细胞,得到cd19-car t、cd19-cxcr5-car t、 cd19-cd28t&i-cxcr5-car t。
[0086]
其中信号肽(leader)氨基酸序列为seq id no:1所示。cd19抗体(vl~vh) 氨基酸序列为seq id no:2所示。铰链区(cd8hinge)氨基酸序列为seq idno:3所示。tm氨基酸序列为seq id no:4所示。4-1bb共刺激结构域氨基 酸序列为seq id no:5所示。cd3ζ胞内信号传导结构域氨基酸序列为seq idno:6所示。t2a连接子元件氨基酸序列为seq id no:7所示。cxcr5氨基 酸序列为seq id no:8所示。cd28t&i氨基酸序列为seq id no:9所示。
[0087]
实施例1:elisa检测anti cd19-scfv(cd19抗体)同cd19抗原结合情况
[0088]
用10μg/ml重组链霉亲和素100μl/孔预包被96孔nunc-immunotm酶 标板过夜。再将购自北京百普赛斯生物科技有限公司的生物素标记重组人cd19 (rhcd19)、重组人bcma(rhbcma)、重组人cd27(rhcd27)以及重组人cd40 (rhcd40)蛋白,用pbs稀释至5μg/ml的工作溶液。经处理后的酶标板,先用 pbst洗涤,在相应的孔中加入50μl/孔上述重组人蛋白的工作溶液,密封后 室温孵育过夜。孵育后的酶标板先用pbst洗涤,再用5%bsa在37℃培养箱 封闭1小时、洗涤、甩干后备用。用1%bsa连续稀释小鼠抗人anti cd19-scfv 抗体成梯度溶液。在相应的孔中加入100μl/孔上述anti-cd19 scfv梯度溶液, 每个梯度设置4个复孔。另外使用兔抗人bcma、兔抗人cd27和兔抗人cd40 抗体作为rhbcma、rhcd27和rhcd40蛋白的阳性对照。在37℃共孵育1小时 后洗涤、甩干。在与anti-cd19 scfv共孵育的样品中每孔加100μl 0.25μg/ml 的hrp-小鼠抗his二抗;与兔抗人抗体共孵育的样品中每孔加入100μl 0.081 μg/ml的hrp-山羊抗兔igg二抗(polyclonal,genetex),37℃孵育1小时。 洗涤、甩干后每孔加入100μl tmb底物显色液,37℃避光反应20分钟,加 入100μl/孔终止液终止反应后马上用infinite f50酶标仪(tecan,)读取450nm 波长的od值。如图5,结果显示,anti-cd19 scfv有良好的靶点特异性,可特 异性结合重组人cd19蛋白,最小剂量的anti-cd19 scfv(40pg/ml)与重组人 cd19蛋白结合的od450值也显著高于重组人bcma、cd27、cd40蛋白实验 组,因此说明anti-cd19 scfv对重组人cd19蛋白有较高亲和力,不结合其它
蛋 白。
[0089]
实施例2:膜蛋白阵列(membrane proteome array)验证抗体的非靶点结合的 相互作用
[0090]
膜蛋白质组阵列(mpa)分析。mpa是分析抗体和其他人膜蛋白配体是否靶 向的平台,可用于确定抗体靶点的特异性。将含有约6000个膜蛋白克隆(占人膜 蛋白组的94%以上)的质粒分别转染到hek-293t细胞(atcc,crl-3216;或qt6 细胞(atcc,crl-1708;384孔细胞培养板(corning,3764),18000个细胞/孔)。孵 育36小时后,试验抗体以预先确定的浓度加入膜蛋白组阵列基质板,使用流式 细胞仪直接检测目标抗体anti cd19-scfv-hfc与约6000种膜蛋白表达细胞的结 合。其中,所有的靶蛋白都具有天然构象和适当的翻译后修饰。
[0091]
如图6所示,膜蛋白阵列结果显示:anti cd19-scfv-hfc能特异性结合人 cd19,而不与其他非靶蛋白结合。
[0092]
实施例3:流式检测anti cd19-scfv同靶细胞结合
[0093]
用pe-抗cd19抗体(hib19,biolegend)对k562、k562-cd19和raji细胞 染色,用pe-抗bcma抗体(19f2,biolegend)对k562-bcma染色。证实 k562-cd19和raji细胞是cd19阳性,k562-bcma细胞是bcma阳性,而 k562细胞是cd19、bcma阴性。接下来,根据上述细胞的特征,检测了anticd19-scfv对cd19阳性、阴性细胞的特异性结合能力。
[0094]
如图7所示,数据显示,anti-cd19 scfv可与cd19阳性细胞系结合,其中 包括k562-cd19和raji,荧光强度随anti-cd19 scfv的剂量增大而增强,有明 显的剂量依赖性。与此相比,经anti-cd19 scfv孵育后的cd19阴性细胞 (k562-bcma、k562)荧光强度均维持在背景值水平,说明anti-cd19 scfv可 特异性识别cd19阳性细胞,而基本不与cd19阴性细胞结合。综上所述, anti-cd19 scfv有良好的靶点特异性,可特异性结合重组人cd19蛋白和cd19 阳性细胞。
[0095]
图7中,a,4个肿瘤细胞系(k562-cd19,k562-bcma,k562,raji)和 0.2-20000pg/ml的anti-cd19 scfv共孵育1小时后,再用pe标签的anti-his来 标记结合到细胞表面的anti-cd19 scfv。b,流式分析仪检测k562,k562-cd19, raji细胞分别用pe-抗cd19抗体(hib19)染色后cd19表达。c,流式分析仪 检测k562,k562-bcma分别用pe-抗bcma抗体(19f2)染色后,用bcma 表达。
[0096]
实施例4:car-t细胞迁移能力检测
[0097]
转染的cd19-car-t和cd19-cxcr5-car-t细胞趋化性试验前在无血清 培养基中饥饿过夜。将1x105个细胞/孔放置在24孔含直径6.5-mm聚碳酸酯孔 膜迁移小室的上腔(5mm孔径;costar transwell,美国纽约州康宁市),下腔 含有600ml无血清培养基,分别含有0、1、5ug/ml浓度的cxcl13因子。不添 加血清的无趋化因子培养基作为阴性对照。car-t细胞在37℃和5%co2条件 培养箱中迁移,分别在迁移4h、8h及16h后从下室收集迁移的细胞。添加计数 磁珠(invitrogen),然后将细胞重新悬浮在100ul体积中,流式上机检测细胞 数。结果如图8a和8b所示。
[0098]
实施例5:elisa检测car-t细胞对正常人体细胞杀伤作用
[0099]
抗cd19-cxcr5-car t细胞用无血清培养液(rpmi-1640,2mm glutamax, 10mm hepes,100u/ml青霉素,100μg/ml链霉素)稀释后,按10:1、3:1、 1:1的效:靶比例,分别与
1x105阳性对照靶细胞(raji)、人肺微血管内皮细 胞(hpmec)、人肺动脉内皮细胞(hpaec)、人肺动脉平滑肌细胞(hpasmc), 共培养在96-孔圆底板中,复孔3个,在37℃和5%co2培养箱孵育16小时,每 孔取50μl上清液酶联免疫法检测ifn-γ和il-2。如图9a~9b所示,结果显示, 抗cd19-cxcr5-car t对cd19阳性肿瘤细胞具有强杀伤功能,对cd19阴性 的人原代细胞无杀伤作用。
[0100]
实施例6:elisa检测car-t细胞杀伤肿瘤靶细胞时分泌ifnγ和il2的情况
[0101]
抗cd19-car t、抗cd19-cxcr5-car t、抗cd19-cd28tm-cxcr5-cart及t mock细胞用无血清培养液(rpmi-1640,2mm glutamax,10mm hepes, 100u/ml青霉素,100μg/ml链霉素)稀释后,按30:1的效:靶比例,分别 与1x106阳性对照靶细胞(raji)、k562-cd19细胞和cd19阴性细胞k562, 共培养在96-孔圆底板中,复孔3个,在37℃,5%co2培养箱孵育16小时,每 孔取50μl上清液酶联免疫法检测ifn-γ和il-2。如图10a、10b、10c结果 显示,抗cd19-cxcr5-car t对cd19阳性肿瘤细胞分泌更多ifn-γ和il-2, 提示其具有更强杀伤能力。各图中,a为raji和t细胞效靶比30:1共孵育后ifn
‑ꢀ
γ和il-2分泌情况;b为k562-cd19和t细胞效靶比30:1共孵育后ifn-γ和 il-2分泌情况;c为k562和t细胞效靶比30:1共孵育后ifn-γ和il-2分泌情 况。
[0102]
实施例7:抗cd19-cxcr5-car t细胞对人burkitt淋巴瘤(raji)荷瘤小鼠 模型的药效实验。
[0103]
如图11,制备获得raji-luc(荧光素酶标记的人burkitt淋巴瘤raji细胞) 细胞后,采用雌性b-ndg小鼠,根据给药前1天(d-1)测定的体重,使用计 算机系统将动物按体重区段随机分为3组,分别尾静脉接种1
×
106个raji-luc 肿瘤细胞。在肿瘤细胞接种第10天后,经尾静脉注射对应的car-t细胞(抗 cd19-car t细胞、抗cd19-cxcr5-car t细胞)和未转导的t细胞(mockcontrol),3
×
106个总细胞/小鼠。在接受治疗后的第1,4,7,14天,经腹 腔注射发光底物d-luciferin,进行活体成像并测量肿瘤大小。
[0104]
如图12所示,结果表明:接受抗cd19-car t或抗cd19-cxcr5-car t 细胞治疗后,小鼠体内的raji-luc肿瘤生长被明显抑制。
[0105]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对 上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技 术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0106]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解 本发明的技术方案,但并不能因此而理解为对发明专利保护专利范围的限制。 应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提 下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发 明专利的保护范围应以所附权利要求为准,说明书可以用于解释权利要求的内 容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。