1.本发明属于药物信息技术领域,涉及一种脂肪乳对药物体内动力学影响的预测模型建立方法。
背景技术:
2.随着我国社会经济的发展,新化合物、新材料、新药品的不断涌现,毒物的种类和数量亦不断增加,我国中毒疾病的毒物谱也因此逐渐演变。根据国内多项流行病学研究数据表明,药物过量(中毒)所占比例逐年增多,已成为我国急性中毒的主要原因,在多个省份的急性中毒毒物谱上居前三位。且很多种类的药物过量时存在危及生命的风险,如2018年度美国中毒控制中心国家中毒数据系统登记,镇静/安眠/抗精神病类药物过量占中毒死因第一位,死亡率达9.71%;江苏省多中心流调数据亦提示:药物过量的总死亡率达8.82%,占中毒死因第二位。
3.鉴于目前药物过量通常无特效药剂,临床干预手段仍以清除未吸收毒物、促进已吸收毒物排出及对症处理。在治疗上寻求突破,使患者获得良好预后一直是中毒领域的热点与难点。而脂肪乳制剂作为一种新型的药剂逐渐吸引着学者们的兴趣。目前提出的脂肪乳生效机制中,“脂肪池(lipid sink)”理论被广泛接受,即短时间内大量脂肪乳进入血液中,会在血浆中形成一个“脂肪池”,使亲脂性的药物更倾向于分布于“脂肪池”内,从而减少细胞或靶器官中药物含量,进而降低其损害。而关于脂肪乳用于药物过量的研究,设计上多拘泥于观察脂肪乳干预后动物的血流动力学、血药浓度等其他指标的变化来反映脂肪乳的作用,存在不同程度的局限性。
技术实现要素:
4.为解决上述问题,本发明提供一种脂肪乳对药物体内动力学影响的预测模型建立方法,通过建立脂肪乳结合药物能力的模型,并深入探究脂肪乳结合药物的速度与程度,进而建立药物参数与脂肪乳应用后改变药物药代动力学参数的相关性。
5.为了达到上述目的,本发明提供如下技术方案:
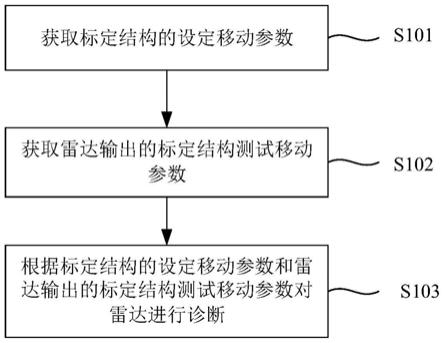
6.一种脂肪乳对药物体内动力学影响的预测模型建立方法,包括如下步骤:
7.步骤1,体外构建长链脂肪乳结合药物能力的定量模型;
8.步骤2,体外构建药物分配至脂肪乳的动力学定量模型;
9.步骤3,定量药物过量后使用脂肪乳对于药物代谢动力学的影响;
10.步骤4,通过体外定量实验构建体内药代动力学行为的预测模型。
11.进一步的,所述步骤1包括如下子步骤:
12.步骤1-1,采集不同质量浓度脂肪乳下的微粒浓度,获得脂肪乳结合药物的热力学参数;
13.步骤1-2,根据微粒浓度与脂肪乳浓度的相关性对热力学参数进行处理得到长链脂肪乳结合药物能力的定量模型。
14.进一步的,所述步骤1-1中,使用动态光散射技术采集不同浓度脂肪乳微粒浓度,使用等温滴定量热法采集脂肪乳与不同药物分子结合热力学过程的化学计量比n。
15.进一步的,所述步骤1-2包括如下过程:
16.对微粒浓度与脂肪乳浓度建立相关性:
17.y=kρ
18.其中,y为脂肪乳微粒浓度,k为脂肪乳浓度和微粒浓度之间的转换系数,ρ是脂肪乳的质量/体积浓度;
19.根据n值计算得单个脂肪乳乳滴内结合药物分子数量n:
[0020][0021]
其中,na是阿伏伽德罗常数,k是脂肪乳浓度和微粒浓度之间的转换系数,ρ是脂肪乳的质量/体积浓度,mw是大豆油的平均分子量;
[0022]
将获得的n与药物logp按如下公式建立相关性:
[0023][0024]
其中,n
initial
和n
final
分别为单个脂肪乳乳滴结合的最少和最多的药物分子数,logp为药物的logp值,logp
center
为药物的中心脂水分配系数,dx为一级表观结合常数。
[0025]
进一步的,所述步骤2如下子步骤:
[0026]
步骤2-1,采集不同药物浓度及油相体积下药物由水相至油相扩散过程水相中药物浓度随时间变化数据;
[0027]
步骤2-2,建立药物在脂肪乳与水相间的扩散动力学的数学模型,根据药物浓度随时间变化数据与扩散动力学的数学模型构建药物分配至脂肪乳的动力学定量模型。
[0028]
进一步的,所述步骤2-1包括如下过程:通过紫外-可见光分光光度计实时在线监测不同药物浓度及油相体积下药物由水相至油相扩散过程水相中药物浓度随时间的变化数据。
[0029]
进一步的,所述步骤2-2包括如下过程:
[0030]
设药物在水相与油相之间的分配符合一级速率过程,得到以下微分公式:
[0031][0032][0033]
其中,c0是水相的药物浓度,cw是油相的药物浓度,k
ow
是药物油相到水相的扩散速率常数,k
wo
是药物水相至油相的扩散速率常数,t表示时间;
[0034]
求解c0和cw:
[0035]
[0036][0037]
将药物由水相至油相扩散过程水相中药物浓度随时间变化的数据用cw的表达式进行拟合得到k
ow
和k
wo
,定义k
cap
为药物由水相至油相的扩散速率特征:
[0038][0039]
通过计算出的k
cap
值与油相体积v
oil
建立相关性:
[0040]kcap
~k
oilvolume
*v
oil
[0041]
其中,k
oilvolume
为油相体积与k
cap
的关系系数;
[0042]
获得油水界面面积s
area
与k
cap
值之间的相关性:
[0043]kcap
~k
area
*s
area
[0044]
其中,k
area
为油水界面面积与k
cap
的关系系数;
[0045]
建立k
cap
与logp之间的相关性:
[0046]kcap
=4πr2kρk
area
*k
oilvolumevoil
*e
δlogp
[0047]
其中,r为脂肪乳的粒径,δ为常数。
[0048]
进一步的,所述步骤3包括:建立动物药物过量中毒模型定量药物过量后使用脂肪乳对于药物代谢动力学的影响,同时设立生理盐水空白对照组,按连续时间点取血获得脂肪乳/生理盐水应用后的血浆药物浓度-时间曲线,建立二室模型,获得关键药代动力学参数:t(半衰期),auc(曲线下面积)。
[0049]
进一步的,所述步骤4包括:将步骤3中获得药代动力学参数中的auc和t与步骤1中的logn和步骤2中的k
cap
分别按以下公式建立相关性:
[0050][0051][0052]
其中,auc
le
、t
le
分别为脂肪乳处理组的auc、t,auc
ns
、t
ns
分别为对照组的auc、t,α为常数项,γ、δ为系数;
[0053]
与现有技术相比,本发明具有如下优点和有益效果:
[0054]
1.本发明基于脂溶性药物分子会发生向脂肪乳扩散这一现象,利用等温滴定量热法和高效液相色谱分析仪分析药物的扩散现象并建立可靠的体外预测脂肪乳结合药物能力的预测模型,利用紫外-可见光分光光度计深度定量分析脂肪乳结合药物分子的过程,并建立动物模型分析分析脂肪乳对药物药代动力学的影响,进而建立脂肪乳在体外热力学及动力学过程与在体内影响药物药代动力学过程的相关性模型。
[0055]
2.本发明提供的方法可以实现体外预测脂肪乳结合药物的能力,以及通过体外药物定量实验预测体内脂肪乳能够改变药物药代动力学的能力,与现有研究方法相比,本方法从体外微观角度出发,与药物体内的代谢动力学过程深度结合分析,有助于更直观、方便、可靠地建立脂肪乳对药物体内动力学影响的预测模型,对解毒剂的开发研究方面具有重要意义。
附图说明
[0056]
图1本发明方法流程示意图。
[0057]
图2为本发明采用等温滴定量热法实验结果示意图。
[0058]
图3为本发明采用紫外-可见光分光光度计实验结果示意图。
[0059]
图4为本发明建立动物模型实验药代动力学结果示意图。
[0060]
图5为对药代动力学参数中的auc和t与logn和k
cap
采用origin软件拟合结果示意图。
具体实施方式
[0061]
以下将结合具体实施例对本发明提供的技术方案进行详细说明,应理解下述具体实施方式仅用于说明本发明而不用于限制本发明的范围。
[0062]
本发明提供一种脂肪乳对药物体内动力学影响的预测模型建立方法,如图1所示,包括如下步骤:
[0063]
步骤1,体外构建长链脂肪乳结合药物能力的定量模型。
[0064]
我们选择了不同的药物(如表1)并分别使用等温滴定量热法和高效液相色谱分析法去量化脂肪乳结合药物的能力;
[0065][0066]
表1药物信息
[0067]
步骤1-1,采集不同质量浓度脂肪乳下的微粒浓度,获得脂肪乳结合药物的热力学参数。
[0068]
我们将30%长链脂肪乳使用超纯水稀释成不同浓度,借助动态光散射技术(zetasizer ultra,malvern instruments,u.k.)在173
°
散射光角分别测量了0.001
‰
、0.0025
‰
、0.005
‰
、0.001%、0.0025%、0.005%、0.010%和0.025%脂肪乳的微粒浓度。所有实验重复三遍。结果如图2。
[0069]
使用超纯水分别将30%脂肪乳(frenius kabi,germany)稀释成浓度为5%、10%和15%的脂肪乳,在4℃ 22000g下离心40分钟,取下层水相在25℃ 80000g下离心20分钟,分别获得5、10和15%脂肪乳对应水相,使用脂肪乳水相制备100~1000μg/ml的药物溶液。取以上稀释后脂肪乳和脂肪乳水相经脱气站脱气处理后,将药物溶液作为样品池,脂肪乳水相作为对照组,将5、10和15%脂肪乳作为滴定剂对样品池进行滴定(每次2或2.5μl,滴定20或25次),在37℃下使用等温滴定量热仪(nano itc,waters,u.s)记录反应过程热力学信息,使用内置软件获得热力学过程的化学计量比(n),结果如图2。
[0070]
步骤1-2,根据微粒浓度与脂肪乳浓度的相关性对热力学参数进行处理得到长链脂肪乳结合药物能力的定量模型。
[0071]
对微粒浓度与脂肪乳浓度使用origin软件建立相关性:
[0072]
y=kρ
[0073]
其中,y为脂肪乳微粒浓度,k为脂肪乳浓度和微粒浓度之间的转换系数,ρ是脂肪乳的质量/体积(w/v)浓度,求得k=1.38e11(其中,决定系数:r2=0.9995)。
[0074]
对脂肪乳与药物分子结合热力学过程的化学计量比(n)进一步根据公式获得单个脂肪乳乳滴内结合药物分子数量(n),公式如下:
[0075][0076]
其中,na是阿伏伽德罗常数,k是脂肪乳浓度和微粒浓度之间的转换系数,ρ是脂肪乳的质量/体积(w/v)浓度,mw是大豆油的平均分子量,n是脂肪乳和药物之间的摩尔比。
[0077]
将获得的n与药物logp使用origin软件按如下公式建立相关性:
[0078][0079]
其中,n
initial
和n
final
分别为单个脂肪乳乳滴结合的最少和最多的药物分子数,logp为药物的logp值,logp
center
为药物的中心脂水分配系数,dx为一级表观结合常数。输出模型如下:
[0080][0081]
其中,决定系数:r2=0.9886。
[0082]
步骤2,体外构建药物分配至脂肪乳的动力学定量模型。
[0083]
步骤2-1,使用紫外-可见光分光光度计采集不同药物浓度及油相体积下药物由水相至油相扩散过程水相中药物浓度随时间变化数据。
[0084]
向10mm*10mm比色皿中加入2.5ml水相即药物溶液,于水相顶部加入不同体积油相即大豆油(考虑脂肪乳会在水相中分散,此处使用脂肪乳主要成分大豆油代替),环境温度为37℃,400rpm进行搅拌,设立不同药物浓度-油相组:40μg/ml-90μl油、5μg/ml-180μl油、40μg/ml-180μl油、100μg/ml-180μl油和40μg/ml-360μl油,同时设立2.5ml的pbs对照组,使用紫外-可见光分光光度计(cary 3500uv-vis,agilent technologies inc.,u.s.)的kinetics模块实时在线监测水相中药物浓度的变化。所有实验重复三次。结果如图3。
[0085]
步骤2-2,建立药物在脂肪乳与水相间的扩散动力学的数学模型,根据药物浓度随时间变化数据与扩散动力学的数学模型构建药物分配至脂肪乳的动力学定量模型。
[0086]
通过使用紫外-可见光分光光度计初步采集不同药物浓度及油相体积下药物由水相至油相扩散过程水相中药物浓度随时间变化数据,分析油水界面面积对扩散动力学变化的影响,进一步构建在体外脂肪乳结合药物的动力学模型。具体分析时,设这一扩散过程符合一级速率过程,得到以下微分公式:
[0087][0088][0089]
其中,c0是水相的药物浓度,cw是油相的药物浓度,k
ow
是药物油相到水相的扩散速率常数,k
wo
是药物水相至油相的扩散速率常数,t表示时间。
[0090]
使用matlab软件dsolve函数求解c0和cw:
[0091][0092][0093]
将药物由水相至油相扩散过程水相中药物浓度随时间变化的数据用cw的表达式进行拟合得到k
ow
和k
wo
,定义k
cap
为药物由水相至油相的扩散速率特征:
[0094][0095]
从结果中图3(a)可以看到,药物浓度对k
cap
影响不明显,因此在只考虑40μg/ml下,油相体积对k
cap
的影响;
[0096]
通过计算出的k
cap
值与油相体积v
oil
建立相关性:
[0097]kcap
~k
oilvolume
*v
oil
[0098]
其中,k
oilvolume
为油相体积与k
cap
的关系系数,根据图3(b)求得k
oilvolume
=5.0e-4。kcap与油相体积和logp之间关系如图3(c)所示。
[0099]
进一步的,选取变化趋势最明显的舍曲林药物,评估界面面积对速率的影响。分别向10mm*10mm、5mm*10mm、2mm*10mm的比色皿中加入2.5、1.25、0.5ml的40μg/ml的舍曲林,顶部分别加入300、150、60μl大豆油,同时设立pbs对照组,37℃下监测水相中药物浓度的变化。所有实验重复三次。
[0100]
获得油水界面面积s
area
与k
cap
值之间的相关性:
[0101]kcap
~k
area
*s
area
[0102]
其中,k
area
为油水界面面积与k
cap
的关系系数,根据图3(d)求得k
area
=0.122。
[0103]
建立kcap与logp之间建立相关性:
[0104]kcap
=4πr2kρk
area
*k
oilvolumevoil
*e
δlogp
[0105]
其中,r为脂肪乳的粒径,δ为常数。
[0106]
步骤3,定量药物过量后使用脂肪乳对于药物代谢动力学的影响。
[0107]
初步建立药物过量后脂肪乳解毒的动物模型,同时设立生理盐水空白对照组,按连续时间点取血获得脂肪乳/生理盐水应用后的血浆药物浓度-时间曲线,建立二室模型,获得关键药代动力学参数:t,auc。实验操作中,我们首先取8周龄雄性sprague-dawley大鼠分为实验组和对照组各6只,实验组与对照组经尾静脉推注等量药物溶液,随后立即给予5ml/kg 30%长链脂肪乳(实验组)或5ml/kg生理盐水(对照组)。在处理完后于0、3、5、10、15、30、60、120、240和360分钟经眼眶静脉丛取血约1ml,每次取血后灌胃补充等量生理盐
水。将取得全血于室温3200g离心5分钟,取上清22000g离心15分钟,取下清血浆75μl,加入150μl乙腈涡旋混匀,于14000g离心5分钟,取上清使用高效液相色谱分析仪检测药物浓度。使用pk solver插件的二室模型计算药代动力学参数。结果如图4:t,半衰期;auc,曲线下面积;vss,稳态分布容积;cl,清除率;mrt,平均驻留时间。(n=6每组,mean
±
sd)
[0108]
步骤4,通过体外定量实验构建体内药代动力学行为的预测模型
[0109]
将步骤3中获得药代动力学参数中的auc和t与步骤1中的logn和步骤2中的k
cap
按以下公式建立相关性得根据药物体外定量实验预测体内动力学行为的模型模型:
[0110][0111][0112]
本例将步骤3中获得药代动力学参数中的auc和t与步骤1中的logn和步骤2中的k
cap
分别使用origin软件进行拟合,结果如图5,得:
[0113]
(决定系数:r2=0.9801)
[0114]
(决定系数:r2=0.9772)
[0115]
本发明方案所公开的技术手段不仅限于上述实施方式所公开的技术手段,还包括由以上技术特征任意组合所组成的技术方案。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。