抗体制剂
1.本技术是中国专利申请200980149644.4(其分案申请的申请号 201410730219.7)的分案申请,原申请的申请日是2009年12月9日,发 明名称是“抗体制剂”。
2.本发明涉及新的药物制剂,特别是其中的活性成分包含针对人白细胞 介素iβ(il-1β)的人抗体的新药物制剂,其中所述的人抗体特别是描述 于wo 2002/016436的抗体。
3.抗体,与其他蛋白质治疗剂一样都是复杂的分子,并且由于其在哺乳 动物特别是人类中的治疗有效剂量,通常不得不在药物制剂中使用大量的 抗体。蛋白质治疗剂的液体制剂应当保留了蛋白质治疗剂的完整生物学活 性并保护蛋白质治疗剂的官能团在生产和贮存期限免于降解。蛋白质的降 解途径可以涉及化学不稳定性或物理不稳定性。有关如何解决蛋白质治疗 剂制剂的不稳定性问题的早期建议包括,冷冻干燥药物产品,然后在施用 前即刻或施用前的短时间内重构。然而,为了获得具有有效治疗结果的安 全制剂,需要可再现的、稳定的且具有生理活性的重构制剂(reconstitutedformulation)。
4.方便地,蛋白质治疗剂即抗体的液体药物制剂应当是长期稳定的、含 有安全且有效量的药物化合物。对于蛋白质治疗剂的液体制剂,长期意识 到的问题是聚集,其中蛋白质分子物理上粘连在一起,例如,导致不透明 的不溶性物质或沉淀的形成,其可能显示出不期望的免疫反应。此外,由 聚集形成引起的主要问题是在施用期间制剂可能堵塞注射器或泵,并使得 其对患者是不安全的。
5.因此,对于包含蛋白质治疗剂,特别是包含长期稳定的、在高抗体浓 度时无聚集的抗体的制剂存在需求。本发明通过提供包含抗体、无蛋白质 聚集物、稳定且具有足够的低黏度,并因此适用于给哺乳动物特别是人类 受试者施用的新制剂满足了上述需求。
6.人白细胞介素-1β(il-1beta或il-1β或者白介素-1β在本文中具有相 同的含义)是介导大范围免疫和炎症应答的有效免疫调节物。il-1β的不 适当或者过量产生与多种疾病和病症,例如败血病、败血性休克或内毒素 性休克、过敏症、哮喘、骨流失、局部缺血、中风、类风湿性关节炎和其 他炎性疾病的病理学有关。已经建议将针对il-1β的抗体用于治疗il-1介 导的疾病和病症;参见例如,wo 95/01997及在其介绍部分中的讨论和 wo 02/16436,所述文献的内容在此引用作为参考。
7.用于本发明制剂的特别优选的针对il-1β的抗体是如在下文seq.id. no.1和seq.id.no.2中所述的acz885抗体,或者是其保留了对抗原的 亲和力的功能性片段,例如f(ab)2、fab、scfv、vh结构域、cdr。
8.本发明的一个目的是提供贮藏和递送时稳定的抗体制剂。根据本发 明,稳定的制剂是贮藏时,在其中的抗体基本上保留了其物理和化学稳定 性和完整性的制剂。例如,在液体制剂的情况下,冷冻干燥和贮藏或贮藏 后产物相关物质和杂质的范围是约2-5%,优选地2-3%。可以使用生物活 性测定法测量抗体制剂的稳定性,并且其中贮藏时的生物活性是初始活性 的约80-125%。使用在下文实施例部分中所述的遗传修饰细胞系,在报告 基因测定法中测量贮藏时本发明制剂中抗体的生物活性。
9.另外的目的是提供适用于皮下施用的稳定的液体抗体制剂。优选地, 该液体制剂
也适用于冷冻干燥和随后的重构。提供至少将在施用给哺乳动 物,特别是人类受试者的时间期间稳定的制剂也是本发明的目的。
10.一般而言,优选地是使用小体积的药物制剂用于皮下注射(最大量通 常为1.0ml-1.2ml)。在包含抗体的制剂,例如高剂量的抗体疗法的情 况下,皮下施用需要高浓度抗体制剂(例如,50mg/ml-150mg/ml或者更 多)。由于需要高的抗体浓度,所以给包含抗体的制剂提出了与抗体的物 理和化学稳定性、聚集物的形成相关的挑战,以及在抗体制剂的生产、贮 藏和递送方面的困难。
11.蛋白质制剂增加的黏度具有来自加工的负面影响,例如液体通过药物 递送例如以高黏度递送给患者的可处理性,液体制剂不再能轻易地通过针 管,这造成了患者的不适;注射持续时间;自动注射器的可利用性。此外, 作为易于生产、贮藏和施用的前提,希望得到具有适当的低黏度的相对高 浓度的抗体制剂。如本文中所用,术语“黏度”可以是“动力黏度”或者“绝对 黏度”。通常,动力黏度表示为厘斯(centistokes;cst)。动力黏度的si 单位是mm 2/s,其是1cst。绝对黏度表示为单位厘泊(centipoise;cp)。 绝对黏度的si单位是毫帕-秒(mpa-s),其中1cp=1mpa-s。
12.因此,本发明提供了包含il-1β抗体的并且稳定的且在高抗体浓度无 聚集的,而且具有足够的低黏度的制剂。
13.液体药物抗体制剂应当显示出多种预先定义的特征。由于在生产和贮 藏期间,蛋白质倾向于形成可溶性和不可溶性聚集物,因此液体药物产品 中最关心的问题之一是稳定性。此外,在溶液中可以发生多种化学反应(脱 酰胺化基、氧化、剪切(clipping)、异构化等),导致降解产物水平和/ 或生物活性丧失的增加。优选地,液体抗体制剂应当显示出多于18个月的 贮存期限。最优选地,液体acz885制剂应当显示出多于24个月的贮存 期限。il-1β抗体的贮存期限和活性定义于实施例部分的生物活性测定法 中,其中活性应当保留初始活性的80%至125%之间。
14.抗体制剂,特别是acz885抗体制剂在2-8℃应当显示出约36至60 个月的贮存期限。优选地,acz885液体制剂在2-8℃应当显示出约24至 36个月的贮存期限。优选地,acz885冷冻干燥制剂在2-8℃应当显示出 约优选地多达60个月的贮存期限。
15.决定贮存期限的主要因素通常是副产物和降解产物的形成以及生物 活性的丧失。本发明的制剂实现了这些需要的稳定性水平。
16.除足够的物理和化学稳定性之外,制剂还应当具有用于皮下应用的可 接受的ph值和重量摩尔渗透压浓度(250至500mosm/kg)。然而,文 献中报道,具有高重量摩尔渗透压浓度(多达1100mosm/kg)的制备物 可以皮下地施用,而且在注射后不会具有显著增加的疼痛感或灼烧持续时 间。也已知,高浓度的抗体会增加制剂的黏度以及聚集。根据本发明的合 适的药物制剂具有约小于16mpas,优选地3-16mpas和优选的3-10mpas 的黏度。
17.根据本发明,现在已经令人惊奇的发现,特别稳定的抗体制剂是可以 获得的,所述抗体制剂在保留长期贮藏期间的抗体活性,在高抗体浓度下 避免聚集并具有合适的黏度方面具有有利特性。本发明在其最广泛的方面 提供了包含作为活性成分的抗体和缓冲系统、稳定剂以及表面活性剂的药 物制剂(本发明的制剂)。本发明的制剂是液体的,但是也适合于冷冻干 燥并随后重构成具有低的、相同的或更高的抗体浓度的液体制剂。重构制 剂是制备自冷冻干燥物的制剂,以使制剂的抗体分散在重构的制剂中。
18.本发明涉及包含针对il-1β的抗体作为活性成分和缓冲系统的新制 剂,其中ph值是5.5至7.5,优选地5.5至7,优选的6.2至6.8。更具体 地,本发明涉及包含acz885抗体作为活性成分和缓冲系统的新药物制剂, 其中ph值是5.5至7.5,优选地5.5至7,优选的6.2至6.8。
19.我们现在已经发现,可以使用缓冲系统制备稳定的制剂,使得制剂具 有5.5至7.5,优选地5.5至7,优选的6.2至6.8的ph。在具体的方面, ph是在如上列举的那些ph值范围内的任一ph值;例如6.2、6.3、6.4、 6.5、6.6、6.7、6.8。
20.本发明的优选的缓冲系统包括柠檬酸盐、组氨酸、琥珀酸钠和磷酸钠 和/磷酸钾缓冲系统,以及其他有机酸或无机酸,更优选地,组氨酸或柠檬 酸,并且最好的结果是使用组氨酸获得的。
21.用于根据本发明的制剂的合适的缓冲系统的浓度是约10mm至约50 mm,或者约10mm至约40mm,取决于,例如缓冲液和制剂需要的稳 定性。在优选的实施方案中,缓冲系统是组氨酸;并且将组氨酸优选地以 10至50mm,优选地15至40mm,优选的20至30mm的浓度使用。
22.本发明的制剂可以优选地进一步包含稳定剂。根据本发明的稳定剂包 括蔗糖、海藻糖、甘露糖醇、山梨糖醇和盐酸精氨酸。当使用蔗糖和甘露 糖醇时,获得了最好的结果。用于根据本发明的制剂的合适稳定剂的浓度 是约50至300mm,优选地180至300mm,最优选的约270mm的蔗糖 或甘露糖醇。在特定的方面,冷冻干燥和重构的液体制剂包含作为稳定剂 的蔗糖和甘露糖醇。在另一特定的方面,液体制剂包含作为稳定剂的甘露 糖醇。
23.本发明的制剂可以任选地进一步包含一种或多种选自填充剂、盐、表 面活性剂和防腐剂的赋形剂。
24.填充剂是增加质量至药物制剂并且有助于冷冻干燥形式的制剂的物 理结构的化合物。根据本发明的合适的填充剂包括甘露糖醇、甘氨酸、聚 乙二醇和山梨糖醇。用于根据本发明的制剂的填充剂的浓度是20-90mm。
25.使用表面活性剂可以降低重构制剂中重构蛋白质的聚集和/或降低颗 粒的形成。添加的表面活性剂的量是使得其可以在重构后降低重构蛋白质 的聚集并最小化颗粒形成的量。
26.根据本发明的合适的表面活性剂包括聚山梨醇酯(polysorbates)(例 如聚山梨醇酯20或80);泊洛沙姆(例如泊洛沙姆188);triton;十二 烷硫酸钠(sds);月桂硫酸钠(sodium laurel sulfate);辛基配糖物钠 盐(sodium octyl glycoside);月桂基磺基甜菜碱、肉豆蔻基磺基甜菜碱、 亚油烯基磺基甜菜碱(linoleyl sulfobetaine)或硬脂基磺基甜菜碱;月桂基 肌氨酸、肉豆蔻基肌氨酸、亚油烯基肌氨酸或硬脂基肌氨酸 (stearyl-sarcosine);亚油烯基甜菜碱、肉豆蔻基甜菜碱或鲸蜡基甜菜碱; 月桂酰胺基丙基(lauroamidopropyl)甜菜碱、椰油酰胺基丙基 (cocamidopropyl)甜菜碱、亚油酰胺基丙基(linoleamidopropyl)甜菜 碱、肉豆蔻酰胺基丙基甜菜碱、棕榈酰胺基丙基甜菜碱或异硬脂酰胺基丙 基甜菜碱(例如月桂酰胺基丙基);肉豆蔻酰胺基丙基二甲胺、棕榈酰胺 基丙基二甲胺或者异硬脂酰胺基丙基二甲胺;甲基椰油酰基牛磺酸钠或甲 基油基牛磺酸二钠(disodium methyl oleyl-taurate);以及系列(mona industries公司,paterson,new jersey)、聚乙二醇、聚丙 二醇以及乙二醇和丙二醇的共聚物(例如普朗
尼克(pluronics)、pf68 等)。在一个优选的实施方案中,表面活性剂选自聚山梨醇酯20和聚山梨 醇酯80。
27.用于根据本发明的制剂的表面活性剂的浓度是约0.001-0.5%,或者约0.005-0.10%,优选地0.01至0.10%,最优选地约0.04至0.06%重量比制 剂的体积。可以根据需要将表面活性剂加入冷冻干燥前的制剂、已冷冻干 燥的制剂和/或重构的制剂中,但优选的是加入到冷冻干燥前的制剂中。
28.任选地,可以在本发明的制剂中使用防腐剂。用于在本发明的制剂中 使用的合适的防腐剂包括十八烷基二甲基苄基氯化铵、氯化己烷双胺、苯 扎氯铵(benzalkonium chloride)(苄基烷基二甲基氯化铵的混合物,其 中烷基是长链化合物)和苄索氯铵(benzethonium chloride)。其他类型 的防腐剂包括芳香醇例如苯酚醇、丁醇和苯甲醇、对羟基苯甲酸烷基酯例 如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯、邻苯二酚、间苯二酚、环己醇、 3-戊醇和间甲酚。
29.其他可药用载体、赋形剂或稳定剂例如那些在remington's scienceand practice of pharmacy第21版,(2005)或者art,science andtechnology of pharmaceutical compounding,第3版(2008)中所述的载 体、赋形剂或稳定剂,只要它们不会负面影响制剂的所需特性,那么可以 包含于本发明的制剂中。可接受的载体、赋形剂或者稳定剂在使用的剂量 和浓度下对接受者是无毒的,并且包括其他的缓冲剂;防腐剂;共溶剂; 抗氧化剂包括抗坏血酸和甲硫氨酸;螯合剂例如edta;金属复合物(例 如锌-蛋白质复合物);可生物降解聚合物例如聚酯;和/或成盐反荷离子 (salt-forming counterion)例如钠。
30.本发明在一个方面提供了包含抗体,优选地针对il-1β的抗体,更优 选的acz885和缓冲系统的稳定的液体、冷冻干燥或重构的制剂,其中液 体或重构制剂的ph是5.5至7.5,优选地5.5至7,优选的6.2至6.8,以 达到足够的稳定性、最小的聚集和可接受的低黏度。根据本发明的制剂适 用于冷冻干燥并在可接受的时间期间,一般少于10分钟内实现用水的重 构。本发明提供了包含针对il-1β的抗体,最优选的acz885抗体和缓冲 系统的稳定重构制剂,该重构制剂制备自抗体的冷冻干燥混合物和缓冲系 统,其中重构制剂的ph是5.5至7.5,优选地5.5至7,优选的6.2至6.8, 并且重构时间低于10分钟。稳定的重构制剂是在重构到使用期间(一般为 几个小时至多达几天)贮藏时,在其中的抗体基本上保留了其物理和化学 稳定性和完整性的制剂。
31.在一个另外的实施方案中,本发明提供了制备制剂的方法,包括步骤: (a)冷冻干燥包含针对il-1β的抗体,最优选的acz885抗体,和缓冲系 统的制剂;和(b)在重构介质中重构步骤(a)的冷冻干燥混合物,以使该重构 制剂是稳定的。
32.步骤(a)的制剂可以进一步包含如上文所述的稳定剂和选自填充剂、 盐、表面活性剂和防腐剂的一种或多种赋形剂。
33.作为重构介质,可以使用几种稀释的有机酸或水即无菌水、用于注射 的抑菌水(bwfi)。重构介质可以选自水即无菌水、用于注射的抑菌水 (bwfi)或者选自约50至约100mm的量的乙酸、丙酸、琥珀酸、氯化 钠、氯化镁、氯化钠的酸性溶液、氯化镁的酸性溶液和精氨酸的酸性溶液。
34.因此,本发明提供了药物制剂,其包含:
35.a)以约10至150mg/ml的浓度使用的针对il-1β的抗体,优选地 acz885抗体;和
36.b)缓冲系统,优选地柠檬酸盐、组氨酸、琥珀酸钠、或者磷酸钠和/ 或磷酸钾缓冲系统,最优选的组氨酸缓冲系统,并且缓冲系统可以以约10 至50mm的浓度使用;并且其中缓冲系统的ph是5.5至7.5,优选地6.2 至6.8内的任一ph值;和任选地:
37.c)稳定剂,优选地蔗糖、海藻糖、甘露糖醇、山梨糖醇和盐酸精氨酸, 最优选的以约50至300mm浓度的蔗糖或甘露糖醇;和任选地
38.d)选自填充剂、盐、表面活性剂和防腐剂的另外的赋形剂。
39.在本发明的某些实施方案中,将填充剂(例如甘露糖醇或甘氨酸)用 于制备冷冻干燥前的制剂。填充剂可以允许产生均一的冷冻干燥饼(cake) 且其中没有过多的孔洞。
40.本发明优选的液体制剂提供了包含10-150mg/ml浓度的acz885、 270mm甘露糖醇、20mm组氨酸和0.04%聚山梨醇酯80的制剂,其中制 剂的ph是6.5。
41.本发明优选的重构制剂提供了冷冻干燥物,其在重构形式中产生了包 含10-150mg/ml浓度的acz885、270mm蔗糖、30mm组氨酸和0.06% 聚山梨醇酯80的重构制剂,其中制剂的ph是6.5。
42.本发明进一步提供了治疗哺乳动物,特别是人类受试者的方法,包括 将本文中公开的重构制剂的治疗有效量施用给哺乳动物,特别是人类受试 者,其中哺乳动物,特别是人类受试者具有需要用针对il-1β的抗体,最 优选的acz885治疗的病症。例如,可以皮下地施用该制剂。
43.本发明的制剂可以用于预防和治疗il-1介导的疾病或医学疾病,例如 炎性疾病、过敏症和过敏疾病、超敏性反应、自身免疫病、严重感染和器 官或组织移植排斥。
44.本发明的一个目的是提供本发明制剂的用途,用于治疗il-1介导的疾 病或医学疾病。
45.例如,本发明的制剂可以用于治疗心、肺、组合的心-肺、肝、肾、胰 脏、皮肤或角膜移植的接受者,包括同种异体移植排斥或异种移植排斥, 和用于预防移植物抗宿主病,例如骨髓移植后的移植物抗宿主病,以及与 器官移植相关的动脉硬化。
46.本发明的制剂特别地用于治疗、预防或者缓解自身免疫病和炎性疾 病,特别是具有包括自身免疫组分的病原学的炎性疾病,例如关节炎(例 如类风湿性关节炎、慢性进育型关节炎(arthritis chronica progrediente) 和变形性关节炎)和风湿病,包括涉及骨流失的炎性疾病和风湿病,炎性 痛、超敏性(包括呼吸道超敏性和皮肤超敏性)和过敏症。可以使用本发 明的制剂的具体自身免疫疾病包括自身免疫血液疾病(包括例如,溶血性 贫血、再生障碍性贫血、纯红细胞性贫血和特发性血小板减少症)、全身 性红斑狼疮、多软骨炎、硬皮病、韦格纳氏肉芽肿(wegenergranulomatosis)、皮肌炎、慢性活动型肝炎、重症肌无力、银屑病、史 蒂芬强森综合征(steven-johnson syndrome)、特发性口炎性腹泻、自身 免疫炎性肠病(包括例如,溃疡性结肠炎、节段性回肠炎和过敏性肠综合 征)、内分泌眼病(endocrine ophthalmopathy)、突眼性甲状腺肿(gravesdisease)、肉样瘤病、多发性硬化、夏科氏肝硬变、青少年糖尿病(i型 糖尿病)、葡萄膜炎(前葡萄膜炎和后葡萄膜炎)、干性角膜结膜炎和春 季角膜结膜炎、肺间质纤维化、牛皮癣关节炎和肾小球肾炎(具有和不具 有肾病综合征,例如包括特发性肾病综合征或微小病变型肾病)。
47.本发明的制剂也可以用于治疗、预防或缓解哮喘、支气管炎、肺尘埃 沉着病、肺气
肿和呼吸道的其他梗阻性疾病或炎性疾病。
48.本发明的制剂可以用于治疗由il-1特别是il-1β,或者由il-1促进的 tnf释放介导的或者涉及il-1特别是il-1β产生,或者由il-1促进的tnf 释放产生的不希望有的急性炎性反应和超急性炎性反应,例如急性感染, 例如败血性休克(例如,内毒素性休克和成人呼吸窘迫综合征)、脑膜炎、 肺炎和重度烧伤;以及用于治疗与病态tnf释放相关的恶病质或者消耗综 合征,用于治疗作为感染的结果发生的疾病、癌症或者器官功能异常,特 别是aids相关的恶病质,例如与hiv感染相关的恶病质或者hiv感染 后的恶病质。
49.本发明的制剂可以特别地用于治疗骨代谢疾病,包括骨关节炎、骨质 疏松症和其他炎性关节炎性皮疹,和一般性骨流失,包括年龄相关的骨流 失,和特别是牙周病。
50.本发明的制剂可以用于预防和治疗患者例如哺乳动物,特别是人类的 自身炎性综合征(auto-inflammatory syndrome)。根据本发明的自身炎 性综合征是例如,但不限于,与自身免疫疾病相反的缺乏高滴度的自身抗 体或抗原特异性t细胞的,以炎症的复发为特征的一组遗传性疾病。此外, 根据本发明的自身炎性综合征显示出增加的il-1β分泌(丧失了热蛋白的 负调控作用,其在所述疾病中是突变的)、nfκb活化和受损的白细胞凋 亡。根据本发明的自身炎性综合征是穆克尔-韦尔斯综合征(muckle-wellssyndrome)(mws)、lada(成人迟发性自身免疫糖尿病)、家族性 冷自发炎症综合症(familial cold autoinflammmatory syndrome;fcas)、 cryopyrin相关的周期性综合征(caps)、新生儿多系统炎性病 (neonatal-onset multisystem inflammatory syndrome;nomid)、慢性 婴儿神经性皮肤关节(cinca)综合征、家族性地中海热(fmf)和/或 幼年型关节炎例如全身型幼年特发性关节炎(sjia)的某些形式、幼年型 类风湿性关节炎例如全身型幼年特发性类风湿性关节炎的某些形式和/或 成人类风湿性关节炎的某些形式。
51.优选地,本发明制剂可以用于预防和治疗幼年型类风湿性关节炎和成 人型类风湿性关节炎和/或穆克尔-韦尔斯综合征。
52.本发明的制剂也可以用于治疗2型糖尿病,其中临床和临床前研究显 示出通过il-1阻断而改善的胰岛功能。本发明制剂也可以用于治疗多种糖 尿病相关的病理例如视网膜病、伤口愈合、血管疾病,(包括支架术和血 管成形术后的动脉再狭窄)、肾功能障碍、慢性肾脏疾病和代谢综合征以 及肥胖。本发明的制剂也可以用于治疗偏头痛、关节膜炎、痛风、假性痛 风/痛风性关节炎或者软骨钙质沉着病、慢性阻塞性肺病(copd)、换气 诱导的肺损伤(ventilation induced lung damage)、多种疼痛疾病,例如 吗啡抗性疼痛、神经性疼痛、早产疼痛、椎间盘源性疼痛、炎性痛、头痛 或者偏头痛。il-1β参与疼痛感知和放大神经原性信号。此外,本发明的 制剂可以用于治疗动脉粥样硬化、急性肾绞痛、胆石绞痛和与这些疾病相 关的疼痛。
53.本发明的制剂可以用于治疗周期性发热综合征(periodic feversyndrome):家族性地中海热(fmf)、肿瘤坏死因子受体相关的周期 性综合征(traps)、超免疫球蛋白d综合征(hids),也称为甲羟戊 酸激酶相关的周期热综合征(mevalonate kinase associated periodic feversyndrome)、家族性冷自发炎症综合症和周期性发热、阿弗他口炎、咽炎、 腺炎(pfapa)综合征,其中il-1β是主要的细胞因子。il-1β是主要的 细胞因子且可以用根据本发明的本发明制剂治疗的其他疾病包括抗合成 酶综合征、巨噬细胞激活综合征mas、贝赫切特综合征、blau’s综合征、 papa综合征、schnizler’s综合征、sweet’s综合征。il-1β
配体-受体阻断 和本发明的il-1β化合物也可以用于治疗血管炎:巨细胞性动脉炎(gca)、 舍-亨二氏紫癜(henoch-schoenlein purpura)、原发性系统性小血管炎、 川崎氏病(皮肤粘膜淋巴结综合征)、大动脉炎、多发性结节性动脉炎、 原发性冷球蛋白血症性血管炎、显微多血管炎(mpa)和变应性肉芽肿性 血管炎(churg
–
strauss syndrome)(css)、荨麻疹性血管炎。此外, 本发明的制剂可以用于治疗自身免疫性疾病,如结节病、天疱疮 (pemphygus)、关节强硬性脊椎柱炎、阿尔茨海默病、淀粉样变性病、 继发性淀粉样变性病和成年型斯蒂尔病(adult onset still disease) (aosd)。
54.本发明的制剂可以用于治疗hla-b27相关的疾病例如但不限于银屑 病、强直性脊柱炎(spondylitis ankylosans)、morbus reiter和肠病性关 节炎。根据本发明的il-1β化合物可以用于治疗风湿热、风湿性多肌痛和 巨细胞动脉炎(giant cell artheriitis)。最后,本发明的制剂可以用于治疗 感染,特别是细菌感染和病毒感染,更具体的是与关节炎症状或检查有关 的细菌感染,例如但不限于血源性骨髓炎、感染性关节炎、结核性关节炎 (tuberculotic arthritis)。
55.对于上述适应症,合适的剂量将依照例如,使用的针对il-1β的特定 抗体、宿主、施用的模式和所治疗的疾病的性质和严重程度变化。用于预 防性用途的剂量的频率通常是约1周1次至每3月1次,更通常的是约每 2周1次至每10周1次,例如每4至8周1次。
56.本发明的制剂合适地以一次或者在一系列的治疗期间施用给患者,并 且可以从诊断起在任何时间施用给患者;可以将其作为单一的治疗或者与 其他在治疗本文前述的疾病中有用的药物或治疗结合施用。
57.预防性治疗一般包括每月1次至每2至3月一次,或者更低频率地施 用本发明的制剂。
58.包含acz885的本发明的制剂优选地通过静脉内途径施用,但是也通 过皮下或肌内注射途径施用。对于该目的,可以使用注射器注射制剂。例 如,使用自动注射器、预装了的常规注射器,任选地在无菌包装中,任选 地具有安全设备的注射器,施用包含acz885的制剂。也可以考虑将显微 针和具有储库的包衣贴片(coated patches with reservoirs)作为合适的施 用设备。
59.依照已知的方法,例如静脉内施用如大丸剂(bolus)或者通过一段时 间的连续输注,通过肌肉内、腹膜内、脑脊髓膜内(intracerobrospinal)、 皮下、关节内、滑膜内、鞘内、口服、局部的或吸入途径,将本发明的制 剂施用给哺乳动物,优选地需要用针对il-1β的抗体,即acz885治疗的 人类。
60.用于体内施用的制剂必须是无菌的。这可以在冷冻干燥和重构前或 后,通过经无菌的滤过膜过滤来容易地达到。备选地,全部混合物的无菌 可以通过在例如,约120℃高压灭菌除抗体外的成分约30分钟实现。
61.在治疗成人类风湿性关节炎(ra)、幼年类风湿性关节炎(sjia、 pjia)、慢性阻塞性肺病(copd)、caps、穆克尔-韦尔斯综合征(mws)、 骨关节炎(oa)和潜在的2型糖尿病(potentially type 2diabete)以及痛 风中,优选地通过皮下注射施用包含acz885的本发明制剂。
62.本发明进一步提供了等渗的液体制剂,其通过用输注液稀释重构制剂 获得。
63.术语治疗指治疗性治疗和预防性或者防治性措施二者。
64.对治疗目的而言,术语哺乳动物指分类为哺乳动物的任一动物,包括 人类、家畜和耕畜和动物园动物、竞技动物或宠物动物,例如狗、马、猫、 奶牛等。优选地,哺乳动物是人类。
65.病症可以是从用针对il-1β的抗体治疗中受益的任一疾病。这包括慢 性和急性疾病,包括那些会诱发哺乳动物患所讨论的病症的病理疾病。本 文中待治疗的病症的非限制性示例包括以上提及的疾病和病症。
66.治疗有效量是实现可测量的改善或者预防特定的病症所需要的至少 最小浓度。
附图说明
67.图1a显示在40℃贮藏4周后,通过rp-hplc对acz885制剂获得 的结果的总结。图1b显示在40℃贮藏4周后,通过sec对acz885制剂获得的结果 的总结。
68.图2显示在40℃贮藏4周后,对acz885制剂的相对效力获得的结果 的总结。
实施例
69.制备液体制剂及其冷冻干燥物
70.研发了acz885制剂,其允许在重构和随后的稀释后静脉内施用和在 重构后皮下施用二者。
71.选择了4种不同的缓冲系统(柠檬酸盐、组氨酸、琥珀酸钠和磷酸钠/ 磷酸钾缓冲系统,每一浓度为40mm)以测试它们对acz885制剂的合适 性。
72.将振荡和冻融循环用作为应力测试以就蛋白质聚集而言对缓冲系统 的适合性排序。
73.在ph5.0至7的范围,使用组氨酸或柠檬酸盐缓冲液可以最有效地避 免蛋白质聚集,如表1中所示。
74.表1缓冲系统筛选的分析结果
[0075][0076][0077]
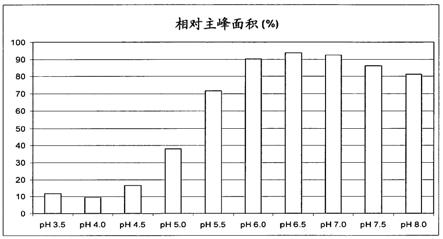
观察了0.5个单位增加的3.5至8.0的ph范围。在40℃贮藏4周后,基于使用的不同分析技术所得结果总结了6.2至6.8的不同ph最佳值,如图1a和图1b中所示。
[0078]
表2冷冻干燥的分析结果
[0079][0080]
组氨酸和柠檬酸盐缓冲的样品的结果类似。由于在使用后增加的疼痛 感,因此柠檬酸盐缓冲液在皮下制剂中是受批判的(critical);因此,相 对于柠檬酸盐,可优选组氨酸用于皮下应用。
[0081]
在选择了合适的缓冲体系后,观察了稳定剂对蛋白质聚集的影响。在 5℃和40℃贮藏6和16周后,分析了含有蔗糖、甘氨酸、甘露糖醇、山梨 糖醇或海藻糖的制剂。对于储存在40℃的含有蔗糖的制剂,观察到了黄色 显色,可能是由于蛋白质或组氨酸的氨基与还原
糖之间的美拉德反应 (maillard reaction)。选择含有蔗糖或甘露糖醇的制剂用于冷冻干燥和重 构制剂。选择含有甘露糖醇的制剂用于液体制剂。
[0082]
进行了进一步的研究以评估表面活性剂浓度对本发明制剂的物理-化 学稳定性的影响。以下的颗粒物质数据显示了无表面活性剂制剂的最高 值,表明吐温有利于样品的物理稳定性。在0.10%吐温的浓度时,与更低 水平的比较,颗粒物质数据倾向于更高。
[0083]
表3 10个月后通过不透光度(light obscuration)(颗粒物质)对 吐温:亚可见颗粒(subvisible particle)的分析结果
[0084][0085]
将含有150mg/ml acz885、20mm组氨酸、270mm甘露糖醇、0.04% (m/v)吐温80、具有ph 6.5的液体制剂的样品储存于5℃、25℃和40℃ 直到24个月。在5℃,没有检测到大量(major amount)的可溶性和不可 溶性聚集二者。使用下文所述的报告基因测定法测定的生物活性在 70-125%内。这些数据(参见表4至6)表明,测试的制剂在贮藏24个月 时是稳定的。
[0086]
表4 5℃,筛选的分析数据
[0087]
[0088][0089]
apx至dp3:从较高至较低的分子量;ap1:二聚体,dpx:p100, dp3:p50
[0090]
表5 25℃,筛选的分析数据
[0091]
[0092][0093]
apx至dp3:从较高至较低的分子量;ap1:二聚体,dpx:p100, dp3:p50
[0094]
表6 40℃,筛选的分析数据
[0095]
[0096][0097]
apx至dp3:从较高至较低的分子量;ap1:二聚体,dpx:p100, dp3:p50
[0098]
冷冻干燥制剂的重构
[0099]
根据本发明的acz885的液体制剂适用于冷冻干燥。冷冻干燥可以在 药学领域熟知的常规条件下进行。可以包括填充剂例如甘氨酸,增加冷冻 干燥物的重量和可见性。在将抗体、10至40mm量的缓冲剂、稳定剂和 表面活性剂混合在一起后,冷冻干燥该制剂。
[0100]
表7制剂的技术稳定性(冷冻干燥前)
[0101][0102]
重构一般在15-25℃的温度进行,以确保完全水合。用无菌水重构冷 冻干燥物。
[0103]
每一经冷冻干燥并用水重构的制剂,重构后的靶浓度是150mg/ml。
[0104]
稳定性
[0105]
在2-8℃、25℃和40℃储存不同的制剂3个月。
[0106]
将冷冻干燥和贮藏后的聚集用作为蛋白质稳定性的指示物。
[0107]
报告基因测定法
[0108]
使用遗传修饰的细胞系,在报告基因测定法中测量acz885的生物学 活性。这种细胞系来源于人胚肾细胞,并用报告构建体稳定转染,其中将 启动子nf-κb(一种il-1β应答
型启动子)融合在萤光素酶基因的上游。
[0109]
通过共导入新霉素抗性基因进行转染。在这种细胞系中,暴露于il-1β 将以剂量依赖的方式刺激萤光素酶的表达。在温育直到18个小时期间,将 分级的acz885量加入到固定的、亚最大剂量的il-1β中造成了萤光素酶 表达的降低。在温育期间的最后,萤光素酶的量基于其在细胞裂解物中的 酶活性定量。萤光素酶将底物萤光素催化转变成氧化萤光素,一种化学发 光产物。然后用合适的光度计测定所得的辉光型化学发光。
[0110]
通过将acz885测试样品抑制il-1β依赖的萤光素酶活性诱导的能力 与acz885参考标准品的能力比较,测定acz885测试样品的生物学效力。 基于蛋白质含量归一化样品和标准品。然后使用根据欧洲药典(europeanpharmacopoeia)的平行线测定法计算相对效力。最终结果表示为与参考 标准品比较的样品的相对效力(以百分数表示)。
[0111]
试剂和缓冲液
[0112]-用于细胞培养的基础培养基mem earle’s l-谷氨酰胺;
[0113]-热灭活的、筛过支原体的胎牛血清(fcs);
[0114]-遗传霉素;
[0115]-无酶的、基于pbs的细胞解离缓冲液;
[0116]-用于测定的基础培养基optimem-i glutamax-i;
[0117]-用于辉光型化学发光的萤光素酶底物;
[0118]-重组白细胞介素-1β(il-1β)。
[0119]
测定方法的步骤:
[0120]
(1)通过从400ng/ml的acz885起始溶液进行几次1:2稀释制备参考 标准品和测试样品的多种浓度;
[0121]
(2)将2
×
104个重悬在测定培养基中的细胞加入到96孔微量滴定板的 每一孔中;
[0122]
(3)通过添加il-1β溶液开始测定。在加湿的co2培养箱温育直到18 个小时;
[0123]
(4)温育后,将萤光素酶底物溶液加入所有孔中。将平板进一步避光 温育10分钟,并通过合适的微量滴定板荧光读数器测定每孔的荧光;
[0124]
(6)根据来自至少两次独立实验的ep的平行线评价计算样品的未加 权平均相对效力。
[0125]
表8技术稳定性的分析结果:
[0126][0127][0128]
*粘附于底部的饼的小块
[0129]
制剂3显示出最低量的聚集。在贮藏时,制剂1和3显示出约90-105% 初始活性的生物活性。
[0130]
制剂的施用
[0131]
acz885的合适剂量(即治疗有效量)取决于,例如待治疗的疾病、 疾病的严重程度和病程、acz885是用于预防性还是治疗性目的的施用、 以前的治疗、患者的临床史和对
acz885的反应,以及主治医师的判断。
[0132]
acz885重链可变区seq.id.no.1
[0133][0134]
acz885轻链可变区seq.id.no.2
[0135]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。