1.本发明涉及基因工程,特别是转基因的插入位点、在该插入位点处包含转基因或其它修饰的细胞、用于靶向该插入位点的载体,以及通过在该位点处插入或其它修饰来产生转基因细胞的方法。
背景技术:
2.转基因细胞和动物的产生已被广泛接受。然而,传统转基因技术的缺点是转基因的整合是随机事件,因此转基因不可被导向特异性染色体位置。随机插入基因组可导致包括插入突变和基因沉默的问题。
3.使用位点特异性重组酶诸如噬菌体p1重组酶cre的较新技术,以及使用工程化内切核酸酶诸如crispr、锌指核酸酶和talen的基因编辑和染色体工程技术,允许将位点特异性转基因整合到基因组中。然而,虽然位点特异性插入现在是可能的,但许多转基因株系仍在使用常规的随机插入方法产生。这些相对较新的位点特异性插入技术的新挑战中的一个是具体在哪里插入转基因的问题。除了需要稳定的整合之外,主要的挑战是整合位点处的基因组环境对转基因的表达有显著影响,并且还可导致相邻基因表达的下游变化,这也可导致不希望的影响。染色体插入位置对转基因表达水平的影响仍相对未知。此外,具有治疗目的的细胞也必须是安全的且具有可预测的作用。
4.人类基因组中的少数位点被认为是基因组安全港,可在其中插入并表达转基因,而不导致其它基因元件表达的显著变化(lombardo等人,2011年)。然而,还没有足够的已知和验证的
‘
安全港’基因组基因座可靶向引入的重组基因(一种或多种)。正如papapetrou和schambach(分子治疗《mol ther.》2016年4月;24(4):678
–
684)所指出的,人类基因组中不存在完全验证的gsh。
5.因此,仍然需要提供稳定的并提供可接受的转基因表达的转基因细胞和动物。对于具有治疗效用的转基因细胞,转基因细胞还必须是安全的、一致的和可重复的,例如跨批次的。
技术实现要素:
6.本发明基于对基因组基因座的令人惊讶的鉴定,该基因座特别有利于基因修饰,诸如转基因的插入。这是基于这样的认识,即ctx0e03细胞系中c-mycer
tam
转基因的插入位点是安全的、稳定的并且以有效水平表达。将转基因整合到神经干细胞中以产生ctx0e03细胞系是随机事件,然而发明人现在已经认识到整合的特异性位点是有利的,并且允许将任何转基因安全和稳定地插入细胞。这在产生用于治疗的细胞方面特别有用。
7.所鉴定的插入位点是有益的,因为随机插入常常不能有效地工作和/或需要多次重复尝试才能达到稳定的插入。因此,本发明提供更可预测的基因修饰技术,特别是编码序列的插入。
8.本发明的转基因细胞可用于许多应用,包括作为研究工具、作为筛选、作为细胞疗
法、作为生物技术过程的一部分生产生物制品,以及从细胞中收获微粒诸如外泌体。
9.插入物还可用于为工程细胞提供一种手段,以生产外源引入的蛋白或核酸药物,或增强细胞的特征以使其更适合用于任何上述应用,例如生物技术过程。例如,工程可提供扩大细胞培养扩增和增加细胞在体外培养中可稳定扩增的传代次数,或者含有促进细胞追踪/标记或纯化的特性的能力。
10.本发明的基因座为工程提供所谓的“安全港”,即安全和可预测的。发明人在ctx0e03神经干细胞系中对其进行鉴定。因此,通过向ctx0e03细胞中的该基因座中提供不同的或另外的插入,或者通过靶向其它(非ctx0e03)细胞类型中的相同基因座,提供该技术的新应用。
11.本发明的第一方面提供一种细胞,其包含spata13基因内的基因修饰,其中:
12.(i)细胞不是ctx0e03细胞;和/或
13.(ii)基因修饰不是插入cmyc-er转基因。
14.在某些实施方案中,基因修饰是插入。在一些实施方案中,基因修饰是整合转基因,典型地是稳定的整合转基因。
15.在各种实施方案中,插入位点可:
16.a.在spata13基因的内含子内;
17.b.在spata13基因的第三内含子内;
18.c.在基因库登记号为bx648244的cdna克隆的第三内含子内;
19.d.在染色体13q12.12上距p端的核苷酸24,083,250-400bp之间的任何位置;
20.e.在染色体13q12.12上距p端的核苷酸24,083,300-350bp之间的任何位置;
21.f.在染色体13q12.12上距p端的核苷酸24,083,325-335bp之间的任何位置;
22.或
23.g.在染色体13q12.12上距p端的核苷酸-24,083,331-24,083,332bp之间。
24.细胞典型地是哺乳动物,更典型地是人类。当细胞是人类时,spata13基因插入位点在染色体13q12.12上。
25.在某些实施方案中,细胞是干细胞或终末分化细胞。细胞可以是或可不是神经干细胞、来自胎儿皮质组织或来自神经干细胞系的神经干细胞。在其它实施方案中,细胞可不是神经细胞和/或不是干细胞。
26.在第一方面的一个实施方案中,细胞是被工程化以用不同的转基因替换cmycer-转基因的ctx0e03细胞。cmycer转基因可被全部或部分替换,或者新的转基因可简单地插入现有的cmycer转基因中(典型地使得cmycer转基因被破坏,并且新的转基因功能性地替换它)。在一些实施方案中,转基因在cmyc-er转基因之前或之后,例如紧接在cmyc-er转基因之前或之后,或者在该转基因开始或结束的约100bp内插入。
27.根据第二方面,提供第一方面的细胞用于治疗。
28.根据第三方面,提供根据第一方面的细胞用于生物技术过程,任选地,其中该过程是干细胞、蛋白或微粒诸如外泌体的生产。
29.根据第四方面,提供包含根据第一方面的细胞的药物组合物。
30.本发明的第五方面提供一种生产包含稳定的整合转基因的转基因细胞的方法,其包含在spata13基因内的位点处整合转基因的步骤。典型地,spata13基因在染色体
13q12.12上。典型地,转基因细胞是人类。转基因可为或包含人类或非人类序列。该方法可应用于体外或体内细胞。这一方面在基因治疗中特别有用,特别是在体内使用时。
31.第五方面的方法可任选地包含crispr、talen或其它位点特异性基因修饰技术的一种或多种元件。在第五方面的某些实施方案中,使用构建体,例如基因治疗构建体来靶向插入位点,该构建体能够并适于在施用于人类或动物后引导外源转基因插入到插入位点。
32.第六方面提供从第五方面的方法获得或可获得的细胞。
33.在另外的方面,本发明提供一种核酸分子,其能够并适于在施用于人类或动物后引导转基因插入到典型地在spata13基因内且任选地在染色体13q12.12上的插入位点。该核酸可用于治疗,例如基因治疗。
附图说明
34.图1:两个侧翼序列的blast同源性(如图a和图b所示)。最上面一行示出供应的序列,而最下面一行示出13号染色体上的基因组位置。由于原始测序中缺失碱基调用,侧翼序列a明显存在一个错配。序列b中明显存在两个错配。这很可能是由于测序错误。图a中的最上面一行(供应的序列)为seq id no.1。图a中的最下面一行(基因组序列)为seq id no.2。图b中的最上面一行(供应的序列)为seq id no.3。图b中的最下面一行(基因组序列)为seq id no.4。
35.图2:(a)示出整合位点两侧1mb区域的图。顶部示出与13号染色体p端粒的距离。示出如由ucsc基因组浏览器指示的已知基因(原始格式为蓝色)。竖直线/框代表外显子,中间带有箭头的细线代表内含子。那些带有半高框的外显子代表未翻译的外显子。示出超家族,即可鉴定的结构域/基序(在原始颜色格式中为ref)。底部示出各种重复序列的分布。(b)位于bx648244的内含子3内的整合位点的特写图。cpg岛也显示在该图中(原始图中为绿色),外显子也显示在该图中(红色)。ucsc基因组浏览器鉴定的基因ak092754和mgc48915以及bx648244均是spata13基因的同种型。对整合位点特别感兴趣的是,大多数5’外显子是未翻译的,即前信使(在图上指示为半高框)。
36.图3:示出人类染色体13q12.12(grch38:13:24083331-24083332)中转基因c-myc-ertam的整合位点的周围区域的示意图。下图是1m碱基对的放大图,指示基因座spata13处的插入位点周围最近的基因。
37.图4:示出使用crispr/cas9允许在13号染色体中整合dna的方案。(a)在13号染色体上诱导cas9依赖性同源重组所必需的元件的表示。(b)示出doi在位置(grch38)chr13:24,083,331和chr13:24,083,332之间同源整合的图。
具体实施方式
38.本发明人已经强调有利的染色体插入位点。该位点在人类染色体13q12.12上的spata13基因内。在来自其它动物物种的细胞基因组中存在相同基因座位的等价插入位点。
39.在某些实施方案中,插入位点提供靶基因座,诸如用于基因治疗,以使得能够插入基因、基因部分或其它遗传元件。在一些实施方案中,插入物的表达可组成型表达,或者可通过使用本领域已知的条件激活启动子进行条件激活。一种此类条件激活启动子是下面实施例中使用的tam条件激活启动子。
40.在某些实施方案中,可使用与本文鉴定的靶基因座序列互补的序列将一个或多个治疗基因或基因部分靶向基因座。例如,可提供与本发明基因座的有义或反义链互补的核酸作为基因编辑技术诸如crispr的引导链。
41.在一些实施方案中,基因座允许细胞系的工程化,该细胞系可用作生产生物制剂或治疗剂的gmp生产源。生物制剂或治疗剂可包含抗体或其片段、蛋白、糖蛋白、肽、脂蛋白等。在一些方法中,本发明的细胞用于生产干细胞或微粒。微粒典型地是从细胞中释放的直径为30至1000nm的细胞外囊泡。它典型地受到包围生物分子的脂质双层的限制。术语“微粒”在本领域中是已知的,并且涵盖许多不同物种的微粒,包括膜颗粒、膜囊泡、微囊泡、外泌体样囊泡、外泌体、核外颗粒体样囊泡、核外颗粒体或外囊泡。典型地,由本发明的细胞生产的微粒是外泌体。
42.新的细胞来源可提供优于现有细胞系诸如cho和perc6的优势。因此,提供被工程化以在插入基因座处包括外源编码序列的细胞系,其具有稳定的基因组和对细胞生长、健康或毒性产生不利影响的低风险。
43.在一个实施方案中,通过在插入位点处插入条件致癌基因,使施万细胞永生化。然后,这些细胞典型地通过支持轴突生长和髓鞘形成而可在神经修复和/或再生中具有效用。例如,条件致癌基因可为c-mycer或l-mycer。
44.本发明的修饰细胞可用于人类或动物的细胞治疗。在一个实施方案中,提供第一方面的细胞用于治疗需要此类治疗的人类或动物的疾病或遗传病状。还提供治疗有此需要的患者的方法,包含向患者施用治疗有效量的(i)本发明的转基因细胞或(ii)能够引导转基因插入到插入位点的核酸载体。患者也可通过施用靶向插入位点的引导rna(例如sgrna)来治疗,任选地与cas内切酶诸如cas9一起施用。病人典型地是人类。
45.位点特异性整合的方法典型地可涉及以下步骤:1)将含有目的基因的靶向载体引入哺乳动物细胞,和2)筛选和选择在特异性基因组基因座处整合目的基因的转染细胞。位点特异性基因插入在本领域是已知的,例如在《自然方法(nature methods)》第10卷第13页(2013年)中所描述的。
46.本发明还提供用于靶向插入位点的核酸、载体和基因治疗构建体。这些典型地为人类或动物中更安全和更有效的基因治疗提供改进的靶向性。
47.修饰位点
48.本发明鉴定人类基因组中可用于基因修饰的特别有用的位点。该位点典型地将用于插入编码感兴趣蛋白的核酸,如在鉴定该位点的ctx0e03细胞中的情况,但是该位点的其它基因修饰也是可能的。该基因座在本文中一般被称为插入位点。
49.插入位点在人类染色体13q12.12上的spata13基因内鉴定。在黑猩猩(黑猩猩属(pan troglodytes))中,spata13基因也位于13号染色体上,而在其它动物中其染色体位置有所不同:小鼠(小家鼠(mus musculus))中的14号染色体、大鼠(褐家鼠(rattus norvegicus))中的15号染色体、恒河猴(猕猴(macaca mulatta))中的17号染色体、斑马鱼(鲱鱼)中的24号染色体和非洲爪蛙(非洲爪蟾(xenopus laevis))中的2号染色体。在一些实施方案中,如本文所描述的任何动物细胞中的spata13基因被靶向修饰,例如在spata13基因的第三内含子内。典型的动物细胞是哺乳动物细胞,更典型的是大型类人猿,诸如黑猩猩或大猩猩。更典型地,插入位点在人类细胞中。
50.ctx0e03细胞中插入的确切位置在(grch38)染色体13q12.12上距p端的核苷酸24,083,331-332bp之间。然而,如果根据本发明以该一般区域中的位点为靶,例如在该特异性位点的10kb内、或5kb内、2.5kb内,例如1000bp内或500bp内,则预期可获得等同的结果。在某些实施方案中,靶向修饰的基因座可在spata13基因的内含子内。在另外的实施方案中,基因座在spata13基因的第三内含子内。典型地,基因座在基因库登记号为bx648244的cdna克隆的第三内含子内。更具体地说,基因座可在染色体13q12.12上距p端的核苷酸24,083,250-400bp之间的任何位置、距p端的核苷酸24,083,300-350bp之间的任何位置,或距p端的核苷酸24,083,325-335bp之间的任何位置。
51.插入位点称为“grch38:13:24083331-24083332”。grch38指的是由ucsc浏览器目前使用的人类基因组参考版本,这对本领域技术人员来说是显而易见的。
52.插入位点在由再生神经元公司(reneuron limited)保藏在英国波顿当(porton down,uk)的欧洲认证细胞培养物收藏中心(european collection of authenticated cell cultures)(ecacc)且ecacc登记号为04091601的称为“ctx0e03”的神经干细胞中鉴定。
53.ctx0e03细胞系的细胞是最初衍生自12周人类胎儿皮质的多潜能细胞。sinden等人详细描述ctx0e03细胞系的分离、制造和方案(美国专利7,416,888和ep1645626b1)。ctx0e03细胞不是“胚胎干细胞”,即它们不是衍生自胚泡的内细胞团的多能细胞;原始细胞的分离不导致胚胎的破坏。在生长培养基中,ctx0e03细胞为巢蛋白阳性,gfap阳性细胞百分比低(即gfap的群体为阴性)。
54.ctx0e03是克隆细胞系,其含有由逆转录病毒感染传递的c-mycer转基因的单一拷贝,并且受4-oht(4-羟基他莫昔芬)的条件调整。将c-mycer转基因掺入本文鉴定的插入位点并表达融合蛋白,该融合蛋白在4-oht存在下刺激细胞增殖,并且因此当在4-oht存在下培养时允许受控的扩增。该细胞系是克隆的,在培养中快速扩增(倍增时间50-60小时),并且具有正常的人类核型(46xy)。它基因稳定,并且可大量生长。细胞是安全和无致癌性的。在没有生长因子和4-oht的情况下,细胞经历生长停滞并分化为神经元和星形胶质细胞。一旦植入缺血损伤的大脑,这些细胞就只能迁移到组织损伤的区域。
55.ctx0e03细胞系的细胞可在以下培养条件下培养:
56.·
人类血清白蛋白0.03%
57.·
转铁蛋白,人类5μg/ml
58.·
腐胺盐酸盐16.2μg/ml
59.·
人类重组胰岛素5μ/ml
60.·
孕酮60ng/ml
61.·
左旋谷氨酰胺2mm
62.·
亚硒酸钠(硒)40ng/ml
63.加上碱性成纤维细胞生长因子(10ng/ml)、表皮生长因子(20ng/ml)和4-羟基他莫昔芬100mm用于细胞扩增。通过去除4-羟基他莫昔芬可分化细胞。典型地,细胞可在5%co2/37℃或5%、4%、3%、2%或1%o2的低氧条件下培养。这些细胞系不需要血清就能成功培养。许多细胞系的成功培养需要血清,但血清含有许多污染物。ctx0e03神经干细胞系或不需要血清的任何其它细胞系的优点是避免血清的污染。
64.基因修饰
65.本发明提供在本文所描述的基因座(“插入位点”)处对细胞的修饰。
66.典型地修饰是核酸的插入。插入到插入位点的核酸对细胞来说可为外源性的。另选地,待插入的核酸可在细胞内的不同基因座处天然发现。典型地,插入的核酸将是dna,但也可为rna、dna或rna的杂交体或包含另一种核酸、非标准核酸或其聚合物。
67.插入的核酸可为编码或非编码序列。在典型的实施方案中,核酸序列是导致目的蛋白表达的dna编码序列。插入的核酸可来自与待修饰细胞相同的物种(同种异体插入)或者不是(异种插入)。插入的序列可包含一个或多个控制序列,诸如启动子,这对于确保插入的序列具有功能是必要的。对于编码序列,功能序列是可成功转录的序列。
68.在一些实施方案中,插入的核酸是转基因。例如,在某些实施方案中,插入的转基因可改进细胞中重组蛋白的表达。此类转基因的示例包括但不限于ebna-1、gs、xbp1或ero-la(hunter m等人,2018.《蛋白科学实验指南(current protocols in protein science)》)。在其它实施方案中,插入的转基因赋予细胞永生或条件永生。其它实施方案在细胞上插入新的或增强的功能,例如新的细胞表面受体或新的酶或结构功能。一种此类工程化细胞类型是工程化到免疫细胞诸如t细胞或自然杀伤细胞中的嵌合抗原受体。因此,可通过将嵌合抗原受体插入到t细胞(例如cd8 细胞毒性t淋巴细胞)或nk细胞中的本发明的插入位点来生产car-t和car-nk细胞。众所周知,car-t和car-nk细胞可用于治疗,例如治疗癌症诸如血癌的方法。
69.插入的结果将是产生天然不存在的序列(且因此是细胞),即具有插入到未修饰染色体中不存在的基因座中的序列。
70.插入的序列本身可为天然不存在的人工序列,例如重组产生的序列。示例是两个序列的融合构建体,例如编码融合蛋白的融合构建体。融合蛋白的示例是嵌合抗体。其它非天然存在的蛋白包括人源化抗体和嵌合抗原受体,该人源化抗体包含非人类cdr和人类恒定区和可变框架序列的混合物,该嵌合抗原受体典型地包含抗体衍生的抗原结合胞外部分和t细胞受体跨膜和胞内部分。使用crispr将car编码序列靶向到本发明的插入位点而生产的car-t细胞是示例性实施方案。
71.在本发明的一个方面,被修饰的细胞是哺乳动物细胞。在一些实施方案中,哺乳动物细胞是人类细胞或动物细胞。细胞可来自肌肉、上皮、结缔组织或神经系统。哺乳动物或人类细胞的示例包括但不限于体细胞、神经细胞、肌肉细胞、红细胞、白细胞、免疫细胞、t细胞、cd4 t细胞、cd8 t细胞、b细胞、骨细胞、脂肪细胞、皮肤细胞、心脏细胞、胰腺细胞和肝细胞。在一些实施方案中,细胞是干细胞、祖细胞、多潜能细胞、多能细胞、诱导多能干(ips)细胞或非干(终末分化)细胞。
72.当用于治疗时,细胞对于患者可为同种异体的或自体的。自体细胞疗法正在成熟,例如自体car-t细胞疗法。
73.在一些实施方案中,基因座允许细胞系的工程化,该细胞系可用作生产生物制剂或治疗剂的gmp生产源。人类细胞系的示例包括但不限于hela、hek293细胞、u2os、hct 116、mda-mb-231、mda-mb-435、u87、u251、raji细胞、jurkat细胞、pc3、mcf-7、saos-2、hl-60和lncap细胞。动物(哺乳动物)细胞系的示例包括但不限于cho、bhk、ns0、sp2/0、yb2/0、cos、mdck、msc-1、cad、p19、nih 3t3、l929、n2a和j558l细胞。cho细胞通常地用于生产生物药物,
并且是那些实施方案的典型细胞。
74.永生和条件永生
75.在某些实施方案中,插入位点处待插入的核酸是赋予细胞永生的序列。例如,待插入的核酸可编码永生化因子。永生化因子是本领域众所周知的并包括一种或多种病毒致癌基因和htert(人类端粒酶逆转录酶),或其组合。病毒致癌基因包括腺病毒e1a/e1b基因、猿猴病毒40大t抗原(sv40标签)和人类乳头瘤病毒16(hpv16)e6/e7基因。
76.在其它实施方案中,插入的序列赋予细胞条件永生,其中永生化因子的表达可被调整。条件永生化因子是本领域已知的并包括对温度敏感的sv40标签、c-mycer或l-mycer。
77.在条件永生化细胞中,可调整永生化因子的表达,而不对治疗有效干细胞的生产产生不利影响。这可通过引入无活性的永生化因子来实现,除非向细胞供应激活剂。此类永生化因子可为一种基因,诸如c-mycer。c-mycer基因产物是包含与突变雌激素受体的配体结合结构域融合的c-myc变体的融合蛋白。c-mycer仅在合成类固醇4-羟基他莫昔芬(4-oht)存在下驱动细胞增殖(littlewood等人,1995年)。这种方法允许体外控制神经干细胞的扩增,同时避免由于神经干细胞系中存在c-myc或编码它的基因而对宿主细胞增殖(例如肿瘤形成)产生不期望的体内影响。
78.ctx0e03是条件永生化干细胞系的示例。示例性条件永生化细胞系包括ctx0e03、str0c05和hpc0a07神经干细胞系,其由本专利申请的申请人在威尔特郡索尔兹伯里波顿当(porton down,salisbury,wiltshire)sp4 0jg的再生神经元公司以登记号04091601(ctx0e03)保藏在欧洲动物培养物收藏中心(ecacc);以登记号04110301(str0c05)保藏在疫苗研究和生产实验室(vaccine research and production laboratories);并且以登记号04092302(hpc0a07)保藏在公共卫生实验室服务(public health laboratory services)。这些细胞的来源和出处描述于ep1645626b1和美国专利第7416888号中。
79.在一个实施方案中,本发明提供的细胞不是ctx0e03,而是包含在相同位点(即本文所描述的插入基因座)处插入的相同条件永生化转基因。这可为干细胞诸如神经干细胞、间充质干细胞或造血干细胞,或非干细胞诸如分化细胞。本文别处描述其它细胞。
80.分化细胞的示例是施万细胞,它可被修饰以在插入基因座处含有c-mycer转基因。为了避免疑问,本发明的一个方面因此提供在插入位点处插入c-mycer(或另选地l-myc-er)的施万细胞,以制造条件永生化施万细胞。
81.整合位点的靶向
82.核酸的位点特异性插入基因组可通过基因组编辑工具诸如大范围核酸酶、锌指核酸酶(zfn)、转录激活因子样效应物核酸酶(talen)和簇状调整间隔短回文重复序列(crispr)相关(cas)rna引导核酸酶来实现(gaj t等人,2013年.《生物技术趋势(trends in biotechnology)》)。这些均是基因组编辑领域众所周知的方法。在工程化核酸酶诱导的位点特异性dna双链断裂(dsb)或单链断裂(ssb)时,靶基因座典型地将被两种主要的dna损伤修复途径中的一个修复:非同源末端连接(nhej)或同源介导的修复(hdr)。熟练的读者将理解如何使用这些技术来靶向已鉴定的基因组基因座。
83.大范围核酸酶、zfn和talen已被广泛用于基因组编辑。大范围核酸酶是天然存在的限制性酶的工程版本。这些酶典型地具有延伸的dna识别序列(例如14-40bp)。zfn和talen是人工融合蛋白,其由与非特异性核酸酶结构域融合的工程dna结合结构域构成。具
有定制特异性的锌指和tale重复结构域可一起连接成与延伸的dna序列结合的阵列(sander jd和joung k.2014年.《自然生物技术(nature biotechnology)》)。
84.crispr-cas9系统还允许对dna进行靶向编辑。系统经由与引导rna(grna)分子相关联而靶向dna,该引导rna通过碱基互补与靶向dna结合并使得能够精确切割dna。grna的长度约为100nt。crispr-cas9系统的靶向特异性由grna的5’端处的17-21个核苷酸序列确定,该序列与靶位点互补。在化脓性链球菌(s.pyogenes)crispr-cas9系统中,所期望的靶序列必须紧接在5’pam基序之前(ngg)。
85.hdr是将核酸插入到细胞基因组所期望的修复途径。野生型cas9酶可用于在dna中引入双链断裂,并且已经生成引入单链断裂的突变cas9酶。在一些方法中,为了鼓励hdr(发生的频率比nhej低),可使用突变cas9酶,其仅产生单链断裂。这些突变cas9酶可与靶向插入位点的dna的有义链和反义链的grna配对,以引入靶向双链断裂,其在待插入的外源核酸存在下由hdr修复(ran fa等人,2013年《细胞(cell)》;koch b等人,2018年.《自然实验手册(nature protocols)》)。
86.将核酸插入到靶整合位点可通过设计作为本发明的插入位点的携带短同源臂的供体质粒来实现。同源臂的长度典型地在100至2000bp之间(koch b等人,2018年.《自然实验手册》)。
87.在一些实施方案中,本发明提供grna,典型地是分离的grna,其被设计成与本文鉴定的插入位点杂交。crispr引导rna的设计是本领域众所周知的。与靶位点互补的grna的5’端的17-21nt序列典型地与本文鉴定的插入位点的17-21nt部分至少70%相同、至少80%相同、至少90%相同、至少95%相同、至少99%相同或完全互补。在一些实施方案中,grna的靶互补区与spata13内含子中的区互补,典型地是spata13的第三内含子。
88.在一些实施方案中,关键grna区与染色体13q12.12上的序列互补。
89.在某些实施方案中,grna的5’端的17-21nt序列与跨越人类染色体13q12.12上的p端的核苷酸24,083,331-24,083,332bp的17、18、19、20或21nt序列至少70%相同、至少80%相同、至少90%相同、至少95%相同、至少99%相同或完全互补。在某些实施方案中,互补区的长度是20nt。
90.在一些实施方案中,本发明提供一种组合物或试剂盒,其包含编码化脓性链球菌cas9内切核酸酶的dna载体和如上所论述的单一引导rna。
91.在人类细胞中鉴定插入位点。在一些实施方案中,非人类细胞中的插入基因座可通过杂交crispr-cas9基因组编辑系统所使用的grna来鉴定,该系统被设计成靶向如上所论述的ctx细胞中的插入位点。不受理论的束缚,预期被设计成与ctx0e03细胞中的插入位点杂交的grna将与不同哺乳动物细胞中类似的插入位点杂交。因此,哺乳动物细胞中潜在的插入位点可通过与本文鉴定的dna插入位点杂交的grna来鉴定。
92.杂交通常在本领域技术人员已知的严格条件下进行,选择该条件是为了降低非互补杂交的可能性。合适的杂交条件的示例公开于《核酸杂交:实用方法(nucleic acid hybridisation:a practical approach)》(b.d.hames和s.j.higgins,irl出版社编辑,1985年)中。严格杂交条件的示例是在包含以下的溶液中于42℃下孵育过夜:50%甲酰胺、5x ssc(150mm nacl、15mm柠檬酸三钠)、50mm磷酸钠(ph7.6)、5x denhardt溶液、10%硫酸葡聚糖和20μg/ml变性剪切鲑鱼精子dna,随后在约65℃下的0.1x ssc中洗涤。
93.药物组合物
94.本发明的工程细胞以及载体和核酸可用于治疗,并且因此可被配制成药物组合物。除了本发明的产品之外,药学上可接受的组合物典型地包括至少一种药学上可接受的载体、稀释剂、载剂和/或赋形剂。合适载体的示例是乳酸林格氏溶液。对此类组分的全面论述提供于gennaro(2000)《雷明顿:制药科学与实践(remington:the science and practice of pharmacy)》,第20版,isbn:0683306472中。
95.短语“药学上可接受的”在本文中用来指那些化合物、材料、组合物和/或剂型,这些化合物、材料、组合物和/或剂型在合理的医学判断范围内,适于与人类和动物的组织接触使用,而没有过度的毒性、刺激、过敏反应或其它问题或并发症,与合理的益处/风险比相称。
96.如果期望,则组合物还可含有少量的ph缓冲剂。组合物可包含存储介质,诸如可商购自美国biolife solutions公司(biolife solutions inc.,usa)的合适的药物载体的示例描述于e w martin的《雷明顿药学科学(remington's pharmaceutical sciences)》中。此类组合物将含有预防或治疗有效量的预防或治疗干细胞,优选纯化形式的干细胞,以及合适量的载体,以便为受试者提供合适的施用形式。制剂应该适合施用方式。在优选的实施方案中,药物组合物是无菌的,并且以合适的形式施用于受试者,优选动物受试者,更优选哺乳动物受试者,并且最优选人类受试者。
97.本发明的药物组合物可为多种形式。这些包括例如半固体和液体剂型,诸如冻干制剂、冷冻制剂、液体溶液或悬浮液、可注射和不可输注的溶液。药物组合物优选是可注射的。
98.药物组合物一般为水性形式。组合物可包括防腐剂和/或抗氧化剂。
99.为了控制张力,药物组合物可包含生理盐,诸如钠盐。氯化钠(nacl)是优选的,其可在1和20mg/ml之间存在。可存在的其它盐包括氯化钾、磷酸二氢钾、无水磷酸二钠、氯化镁和氯化钙。
100.组合物可包括一种或多种缓冲液。典型的缓冲液包括:磷酸盐缓冲液;tris缓冲区;硼酸盐缓冲液;琥珀酸盐缓冲液;组氨酸缓冲液;或者柠檬酸盐缓冲液。包括的缓冲液的浓度典型地在5-20mm范围内。组合物的ph通常在5和8之间,并且更典型地在6和8之间,例如在6.5和7.5之间,或在7.0和7.8之间。
101.组合物优选是无菌的。组合物优选是非热解的。
102.在典型的实施方案中,细胞悬浮在包含1、2、3、4、5、6、7、8、9、10或更多赋形剂的组合物中,该赋形剂选自6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸na 、k 、ca2 、mg2 、cl-、h2p04-、hepes、乳糖酸盐、蔗糖、甘露醇、葡萄糖、右旋糖酐-40、腺苷和谷胱甘肽。在一个实施方案中,组合物包含这些赋形剂中的所有。典型地,组合物将不包括偶极非质子溶剂,例如dmso。合适的组合物可商购,例如此类组合物是有利的,因为它们允许细胞在4℃至25℃下储存较长时间(数小时至数天)或保存在低温下,即低于-20℃的温度。然后干细胞可在解冻后以这种组合物施用。
103.参考以下非限制性实施例另外描述本发明。
104.实施例
105.a)基因表达的安全港基因座
106.引言
107.在人类细胞中插入基因过度表达的转基因需要使用不影响靶细胞的基因表达模式的安全港基因座(shl)。
108.到目前为止,在人类细胞中仅鉴定出3个shl,aavs1在19号染色体中,ccr5和rosa26均在3号染色体中。ccr5和aavs1均位于含有多个基因的区域,包括可被整合的转基因失调的癌症相关基因。rosa26也位于基因附近,并且没有附加的研究证实该基因座在人类细胞中的效用或安全性。
109.因此,新shl的发现将高度有益于用于治疗目的的转基因的安全过度表达。
110.在13q12.12(grch38:13:24,083,331-24,083,332)处鉴定shl
111.治疗性人类细胞系ctx0e03的生成包括其通过重组基因c-myc-er
tam
的过度表达而永生化。这是通过使用逆转录病毒来实现的,该病毒在13号染色体的特异性位置随机插入基因的一个单一拷贝。我们已经绘制这个区(grch38:13:24,083,331-24,083,332)的图谱,并且将其定位在基因spata13的内含子中。我们没有观察到任何邻近的基因(《180kb)(图1和3和表2),并且因此任何基因均不太可能被这种插入或由于这种插入引起的任何染色质重塑事件而改变。由于c-myc-er在我们的ctx0e03细胞系中仍然是活性的,这清楚地指示染色质的构象处于开放阶段,允许转基因的连续表达。在插入区域周围的1m碱基对区中鉴定的基因没有一个被鉴定为癌症相关基因。
112.因此,我们认为13号染色体上的这个特异性位点具有shl的基本特性,并且可在任何人类细胞中靶向插入任何基因,以使用重组技术诸如非蛋白依赖性同源重组、talen核酸酶或crispr/cas9核酸酶进行基因治疗。
113.shl的cas靶向
114.例如,将cas9和一小段互补的rna(称为引导rna(sgrna))一起使用可用来切割dna中的任何特异性位置,并且插入任何期望的dna序列。
115.为了触发这种特异性重组,我们将使用与grch38:13:24,083,331-24,083,332上的位置附近的区互补的一个/多个sgrna。通过转染、转导、电穿孔或递送dna、rna和/或蛋白的任何其它方式,将sgrna作为表达载体或核糖核蛋白复合物(rnp)与cas9一起递送至细胞。感兴趣的dna(doi)也将与cas9和一个/多个sgrna一起递送,其两侧将有与位置chr13:24,083,331互补的5’臂和与位置chr13:24,083,332互补的3’臂(图4a)。
116.一旦进入细胞核,rnp复合物将切除sgrna靶向位置的染色体dna,这将触发dna修复机制。具有与13号染色体互补的臂的doi的存在将被细胞的重组机制识别并插入互补区(图4b)。
117.这将允许在任何人类细胞系中的位置chr13:24,083,331和chr13:24,083,332之间插入doi。
118.b)ctx0e03中转基因插入位点的分析
119.1引言
120.ctx0e03是神经干细胞系,其衍生自原代胎儿神经干细胞,随后经条件永生化基因cmycer
tam
转导。转基因被工程化为逆转录病毒载体,plnc-x(克隆技术(clontech))和使用利用包装细胞系tefly-a生成的逆转录病毒转导的细胞。对于ctx0e03细胞系,我们已经鉴
定出mycer
tam
的基因组整合位点在13号染色体内。本报告的目的是评估转基因整合导致插入突变的可能性。
121.概要
122.对插入位点和周围基因组的生物信息分析指示在ctx0e03细胞系中由于插入突变导致致癌激活的风险非常低。
123.ctx0e03插入位点
124.对ctx0e03神经干细胞系的逆转录病毒插入位点进行调查。该调查涉及生物信息学分析,以便评估逆转录病毒插入可导致细胞系由于插入突变而导致致肿瘤的可能性。
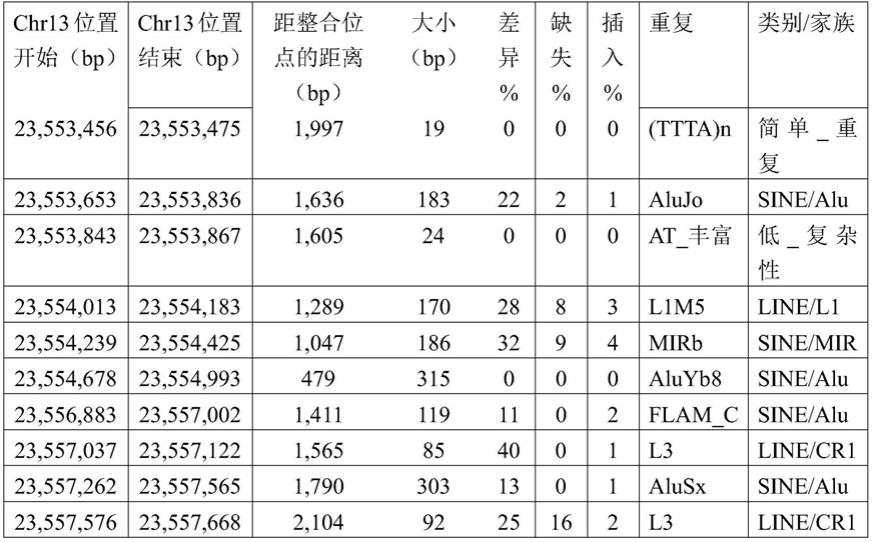
125.插入突变是有据可查的现象。逆转录病毒显然是随机插入染色体dna序列的。因此,它们破坏现有的dna序列。因此,它们具有使它们可插入的任何基因突变的潜力。这种现象引起关注的示例是在法国进行的利用逆转录病毒载体的x-scid基因治疗试验中三名儿童的白血病发病率(参见:《科学(science)》.2005年3月11日;307:1544-5)。由于ctx0e03细胞系是使用逆转录病毒载体生成的,因此重要的是考虑插入突变和致癌激活可发生的可能性。
126.本研究调查三个假设:
127.1.原病毒已经以可能激活此致癌潜力的方式插入具有致癌潜力的基因;
128.2.原病毒已经插入或接近内源性逆转录病毒,从而引起激活或重组;和
129.3.病毒已经插入足够接近已知致癌基因的位置,可导致致癌基因的激活。
130.2.插入位点的位置-spata13
131.为c-myc-er
tam
供应的侧翼序列允许将插入物定位到染色体13q12.12的(距p端的)核苷酸-24,083,331-24,083,332(grch38)bp之间-参见图1。
132.逆转录病毒被认为优先插入到内含子序列,并且在此就是这种情况。整合位点位于登记号为bx648244的cdna克隆的第三内含子内。此克隆代表基因spata13或精子发生相关基因13的剪接变体。前16个外显子,其包括整合位点两侧的两个外显子,是
‘
前信使’序列,即它们是非编码序列。
133.通过生物信息学分析调查spata13的结构和功能。
134.2.1结构
135.spata13在大量组织中表达。替代剪接产生18种不同的转录物。该基因含有37个内含子以及8个可能的替代启动子。它具有非常长的3’utr。前信使具有多达16个外显子并覆盖342kb。
136.2.2同源性
137.经由blast(www.ncbi.nlm.nih.gov/blast)进行的氨基酸同源性搜索示出与用作rhoa和rac1gtpase的鸟嘌呤核苷酸交换因子(gef)的arhg4(rho鸟嘌呤核苷酸交换因子4[apc刺激的鸟嘌呤核苷酸交换因子])有62%的同源性。apc的结合可激活rac1gef活性。apc-arhg4复合物似乎参与细胞迁移以及e-钙粘蛋白介导的细胞-细胞粘附。
[0138]
2.3基序(说明编辑自interpro)
[0139]
补体c1q蛋白基序存在于该基因的3种同种型中。c1q是激活血清补体系统的c1酶复合物的亚单位。
[0140]
胶原三螺旋重复基序存在于该基因的6种同种型中。该序列主要是g-x-y的重复序
列,并且多肽链形成三螺旋。重复序列的第一位置是甘氨酸,第二和第三位置可为任何残基,但经常是脯氨酸和羟脯氨酸。
[0141]
普列克底物蛋白样基序存在于该基因的4种同种型中。
‘
普列克底物蛋白同源性’(ph)结构域是约100个残基的结构域,存在于参与细胞内信号传导或作为细胞骨架成分的广泛蛋白中。这个结构域的功能尚不清楚,已经提出几个假定的功能:-结合异源三聚体g蛋白的β/γ亚单位,-结合脂质,例如磷脂酰肌醇-4,5-二磷酸,-结合磷酸化的ser/thr残基,-通过未知的机制附着在膜上。不同的ph结构域可能具有完全不同的配体要求。
[0142]
oh基序存在于该基因的4种同种型中。rho家族gtpase rho、rae和cdc42调整各种各样的细胞过程。像ras超家族的所有成员一样,rho蛋白在活性gtp结合构象态和非活性gdp结合构象态之间循环。通过释放结合的gdp和后续的gtp结合激活rho蛋白,由dbl家族中的鸟嘌呤核苷酸交换因子(gef)催化。dbl家族成员编码的蛋白共享约200个残基的公共结构域(称为dbl同源性或dh结构域),该结构域已被证明编码对许多rho家族成员特异的gef活性。此外,所有家族成员均拥有第二共享结构域,称为普列克底物蛋白同源性(ph)结构域。ph结构域总是直接位于dh结构域的c端,并且这种不变的拓扑表明这两个结构模块之间的功能相互依赖。生化数据已经确定保守dh结构域在rho gtpase相互作用和激活中的作用,以及串联的ph结构域在细胞内靶向和/或调整dh结构域功能中的作用。dbl的dh结构域已被证明介导本质上大多数是同嗜性的寡聚化。除了串联的dh/ph结构域之外,dbl家族的gef还含有不同的结构基序,如丝氨酸/苏氨酸激酶、rbd、pdz、rgs、iq、rem、cdc25rasgef、ch、sh2、sh3、ef、血影蛋白或lg。dh结构域由通过更多的可变区分开的三个结构上保守的区构成。它与其它亚型的小g蛋白gef基序(诸如分别与ras和arf家族小gtpase特异性相互作用的cdc25结构域和sec7结构域)没有共享显著的序列同源性,也与其它rho蛋白相互作用基序没有共享显著的序列同源性,指示dbl家族蛋白在进化上是独特的。
[0143]
sh3基序(src同源性-3)存在于该基因的6种同种型中。sh3结构域是含有大约50个氨基酸残基的小蛋白模块。它们存在于多种细胞内或膜相关蛋白中,例如,在多种具有酶活性的蛋白中,在缺乏催化序列的衔接蛋白中,以及在细胞骨架蛋白中。sh3结构域的功能尚不清楚,但它们可介导许多不同的过程,诸如增加蛋白的局部浓度、改变其亚细胞位置和介导大的多蛋白复合物的组装。
[0144]
变体sh3基序存在于该基因的5种同种型中。sh3(src同源性3)结构域常常指示参与细胞骨架组织相关信号转导的蛋白。
[0145]
2.4细胞位置
[0146]
ncbi locuslink提出磷酸盐转运、细胞粘附和蛋白结合的功能。locuslink预测细胞质定位,而psort预测细胞核定位。不同的定位可适用于不同的同种型。
[0147]
2.5结论
[0148]
spata13是功能未知的基因。它的结构初步表明它可为鸟嘌呤交换因子,但仅基于生物信息学,这是非常初步的结论。这不会先验地表明spata13可能是致癌基因,或具有任何致肿瘤功能的基因。
[0149]
我们可得出结论,逆转录病毒插入不会破坏任何蛋白编码序列,或任何非编码非翻译序列。也没有任何剪接供体或受体位点被破坏。因此,我们得出结论,任何突变的蛋白均极不可能从该基因座生产,或不太可能出现任何被破坏或截短的转录物。有可能rna加工
可受到影响。可想象增强子序列受到插入的影响,因为它们有时位于内含子序列中。尽管如此,由于发生插入的基因部分是非编码外显子之间分散的5’区,因此此类效应似乎不太可能。
[0150]
我们得出结论,由于这种插入事件导致spata13的致癌激活是非常不可能的。
[0151]
3重复序列
[0152][0153]
表1-整合位点两侧 /-2,5kb序列的repeatmaster结果。示出13号染色体上的位置以及距整合位点的距离。还示出元件的大小和序列差异百分比以及核苷酸缺失和插入的百分比。
[0154]
对插入位点和染色体上下游区进行分析,以发现存在重复序列-即可携带内源性逆转录病毒或转座因子的序列。
[0155]
在整合位点的
±
2.5kb区内仅发现两种类型的转座因子:长散布重复元件(line)和短散布重复元件(sine)。
[0156]
line是6kb长的转座子,其携带内部聚合酶ii启动子并编码两个开放阅读框(orf)。在line中,只有line1在人类中是活性的。翻译后,line rna与自己编码的蛋白组装并移动到细胞核,在细胞核中,内切核酸酶的活性产生单链缺口,并且逆转录酶使用缺口的dna从line rna的3’端启动逆转录。逆转录常常无法进行到5’端,导致大部分截短的、无功能的插入。因此,大多数line衍生的重复序列很短,所有line1拷贝的平均大小为900bp(ihgsc,2001年)。接近c-mycer
tam
整合位点的所有line重复序列均是截短形式(最大大小=170bp),并且通过进化积累序列突变。因此,它们并不是活性的。
[0157]
sine是携带内部聚合酶iii启动子的短(100-400bp)元件,但不编码蛋白。这个区中的主要sine元件是alu,随后是mir元件(非活性)和flam_c元件(化石alu单体-非活性)。超过10%的人类基因组由alu重复序列构成,这些重复序列倾向于在基因丰富的区域相互关联(ihgsc,2001年)。唯一活性sine是alu元件。由于它们不编码任何蛋白,因此它们依赖于l1机制进行逆转录转座。许多sine被定位为共享line元件的3’端(okada等人,1997),可
能是为了帮助或作为逆转录转座的结果。
[0158]
检查区中的sine元件没有一个与line重复序列的功能活性3’端相关联。
[0159]
我们得出结论,整合的前病毒附近没有内源性逆转录病毒。因此,由于整合导致的内源性逆转录病毒激活似乎是极不可能的结果。
[0160]
international human genome sequencing consortium(2001).initial sequencing and analysis of the human genome.nature 409:860-921。
[0161]
okada,n.,hamada,m.,ogiwara,i.&ohshima,k.sines and lines share common 39 sequences:a review.gene 205,229
±
243(1997)。
[0162]
4相邻基因
[0163]
分析整合的基因座以发现整合的原病毒附近还有哪些其它基因。除了spat a 13之外,整合位点的
±
1mb区内还有10个已知基因(参见表2和图2)。对其中的每一项进行了分析。
[0164]
4.1 sgcg(距离=758,167bp)
[0165]
sgcg或γ-肌聚糖仅编码在骨骼肌和心肌组织中表达的一个转录物。它是肌营养不良蛋白-糖蛋白复合物(dgc)的组成蛋白,这是跨越肌膜并将肌动蛋白结合到肌肉细胞的细胞外基质的一组蛋白(noguchi等人,1995年)。sgcg的缺乏是导致特异性形式的肢带肌营养不良或肌聚糖病的原因,主要涉及肩部和腰部肌肉的消耗以及小腿肌肉的肥大(crosbie等人,2000年)。类似地,γ-肌聚糖在小鼠中的过度表达产生严重的肌营养不良,肌肉质量和早期致死率大大降低(zhu等人,2001年)。
[0166]
crosbie,r.h.;lim,l.e.;moore,s.a.;hirano,m.;hays,a.p.;maybaum,s.w.;collin,h.;device,s.a.;stolle,c.a.;fardeau,m.;
[0167]
tome,f.m.s.;campbell,k.p(2000)molecular and genetic characterization of sarcospan:insights into sarcoglycan-sarcospan interactions.hum.malec.genet.9:2019-2027。
[0168]
noguchi,s.;mcnally,e.m.;ben othmane,k.;hagiwara,y.;mizuno,y.;yoshida,m.;yamamoto,h.;bonnemann,c.g.;gussoni,e.;
[0169]
denton,p.h.;kyriakides,t.;middleton,l.;hentati,f.;ben hamida,m.;nonaka,i.;vance,j.m.;kunkel,l.m.;ozawa.e.(1995)mutations in the dystrophin-associated protein gamma-sarcoglycan in chromosome 13muscular dystrophy.science 270:819-821。
[0170]
zhu x,hadhazy m,groh me,wheeler mt,wellmann r,mcnally em.(2001)overexpression of gamma-sarcoglycan induces severe muscular dystrophy.implications for the regulation of sarcoglycan assembly.j biol chem.2001jun 15;276(24):21785-90.epub 2001 apr 3。
[0171][0172]
表2
–
整合位点 /-1mb区内已知基因的概要。还提供染色体位置、链和距整合位点的计算距离。
[0173]
4.2 sacs(距离=649,642bp)
[0174]
sacs(或sacsin)基因通过交替剪接编码7种不同的转录物。sacsin蛋白在中枢神经系统、骨骼肌中高度表达,并且在胰腺中以低水平表达。热休克结构域的存在表明sacsin在伴侣介导的蛋白折叠中起作用(engert等人,2000年)。sacs的缺陷是charlevoix-saguenay的常染色体隐性痉挛性共济失调(arsacs)的原因。arsacs是早发性神经退行性疾病,在魁北克省(quebec)的charlevoix-圣约翰湖(saguenay lac-saint-jean)区发病率很高。其特征在于感觉神经传导缺失、运动神经速度降低和视网膜神经纤维过度髓鞘化。
[0175]
engert,j.c.;berube,p.;mercier,j.;dore,c.;lepage,p.;ge,b.;bouchard,j.-p.;mathieu,j.;melancon,s.b.;schalling,m.;lander,e.s.;morgan,k.;hudson,t.j.;richter,a(2000)arsacs,a spastic ataxia common in northeastern quebec,is caused by mutations in a new gene encoding an 11.5-kb orf.nature genet.24:120-125,2000。
[0176]
4.3 tnfrsf19(距离=407,228bp)
[0177]
tnfrsf19通过交替剪接编码5种不同的同种型。该基因编码的蛋白是tnf-受体超家族的成员。这种受体在胚胎发育期间高度表达。已经证明它与traf家族成员相互作用,并且在细胞中过表达时激活jnk信号传导和nf-kb途径(eby等人,2000年;kojima等人,2000年)。虽然它缺乏死亡结构域,但这种受体能够通过胱天蛋白酶非依赖性机制进行程序性细
胞死亡(wang等人,2003)。tnfrsf19还在轴突再生中发挥作用。
[0178]
髓鞘相关抑制因子(maif)是损伤后cns轴突再生的抑制剂。nogo受体复合物其由nogo-66受体1(ngr1)、神经营养蛋白p75受体(p75)和ling0-1构成,在与这些髓鞘组分结合时抑制轴突再生。p75仅在某些类型的神经元中表达,并且其在发育期间的时间表达表明ngr1复合物中涉及其它受体。tnfrsf19在出生后和成年神经元中广泛表达,能够与ngr1结合,并且可替换p75/ngr1/ling0-1复合物中的p75,以激活gtpase rhoa,后者在髓鞘抑制剂存在下使肌动蛋白细胞骨架硬化,导致生长锥塌陷(park等人,2005年;shao等人,2005年)。
[0179]
eby mt,jasmin a,kumar a,sharma k,chaudhary pm.(2000)taj,a novel member of the tumor necrosis factor receptor family,activates the c-jun n-terminal kinase pathway and mediates caspase-independent cell death.j biol chem.2000 may 19;275(20):15336-42。
[0180]
kojima,t.,morikawa,y.,copeland,n.g.,gilbert,d.j.,jenkins.n.a.,senba,e.and kitamura,t.(2000).troy,a newly identified member of the tumor necrosis factor receptor superfamily,exhibits a homology with edar and is expressed in embryonic skin and hair follicles.j.biol.chem.275,20742-20747
[0181]
park jb,yiu g,kaneko s,wang j,chang j,he xl,garcia kc,he z.(2005)a tnf receptor family member,troy,is a coreceptor with nogo receptor in mediating the inhibitory activity of myelin inhibitors.neuron.2005 feb 3;45(3):345-51
[0182]
shao z,browning jl,lee x,scott ml,shulga-morskaya s,allaire n,thill g,levesque m,sah d,mccoy jm,murray b,jung v,pepinsky rb,mi s.(2005)tajftroy,an orphan tnf receptor family member,binds nogo-66receptor 1and regulates axonal regeneration.neuron.2005 feb 3;45(3):353-9。
[0183]
wang y,li x,wang l,ding p,zhang y,han w,dalong m.(2004)an alternative form of paraptosis-like cell death,triggered by tajftroy and enhanced by pdcd5 overexpression j cell sci.2004 mar 15;117(pt 8):1525-32。
[0184]
4.4 pcoth(距离=186,070bp)
[0185]
pcoth或前列腺胶原三螺旋编码3种不同的转录物和假定的2种不同的蛋白产物。pcoth的表达仅限于睾丸和前列腺,在前列腺癌细胞以及其前体前列腺上皮内瘤变中的表达显著升高(ashida等人,2004年)。pcoth在健康细胞中的过度表达导致细胞生长/分裂速率增加(anazawa等人,2005年)。相反,前列腺肿瘤细胞中的pcoth sirna减弱细胞生长。发现前列腺癌细胞中pcoth的表达与taf-1β磷酸化的升高相关联。taf-1β(或set)最初被鉴定为急性未分化白血病中融合基因的伴侣,称为set-can基因,并且被证明是多任务蛋白,诸如蛋白磷酸酶2a的有效抑制剂、颗粒酶a的靶标、组蛋白乙酰转移酶的抑制剂,并且也是细胞周期转化的调整剂,指示taf-1β是细胞生长和增殖的调节剂(参见anazawa等人,2005年引用的参考文献22-29)。pcoth可按某种方式调整taf-1β的磷酸化/激活。尽管taf-1β在各种组织中广泛表达,但pcoth表达仅在睾丸、前列腺和前列腺肿瘤中观察到。因此,pcoth可作为前列腺癌、睾丸癌或前列腺癌特异性调节剂调整taf-1β的磷酸化,pcoth的过度表达导致taf-1β的过度磷酸化,并且从而促进细胞存活。
[0186]
anazawa y,nakagawa h,furihara m,ashida s,tamura k,yoshioka h,shuin t,fujioka t,katagiri t,nakamura y.(2005)pcoth,a novel gene overexpressed in prostate cancers,promotes prostate cancer cell growth through phosphorylation of oncoprotein taf-lbeta/set.cancer res.jun 1;65(11):4578-86。
[0187]
ashida s,nakagawa h,katagiri t,et al.molecular features of the transition from prostatic intraepithelial neoplasia(pin)to prostate cancer:genome-wide geneexpression profiles of prostate cancers and pins.cancer res 2004;64:5963-72。
[0188]
4.5 mipep(距离=193,884bp)
[0189]
mipep或线粒体中间肽酶基因编码6种不同的同种型。这种蛋白在靶向线粒体基质或内膜的特异性类别的核编码蛋白的切割中执行最后一步(lsaya等人,1991年)。这些蛋白包括(i)吡啶和黄素连接的脱氢酶的亚单位;(ii)含有铁-硫簇的蛋白和呼吸链复合物的其它核编码亚单位;(iii)线粒体dna复制和表达所需的蛋白;和(iv)亚铁血红素合成酶,在血红素合成的最后一步催化铁附着的酶(branda和lsaya 1995年,chew 1997年)。这表明mipep对氧化代谢很重要。在神经退行性病症弗里德里希共济失调(branda 1999年)中,mipep也被认为在线粒体铁稳态中起作用,并且可能对临床严重程度具有调节作用。
[0190]
branda ss,lsaya g.(1995)prediction and identification of new natural substrates of the yeast mitochondrial intermediate peptidase.j.biol.chem.270 27366-27373。
[0191]
branda.ss,yang z,chew a,lsaya g.(1999)mitochondrial intermediate peptidase and the yeast frataxin homolog together maintain mitochondrial iron homeostasis in saccharomyces cerevisiae.hum.molec.genet.8:i 099-1110。
[0192]
chew a.buck ea,peretz s,sirugo g.rinaldo p,lsaya g.(l 997)cloning,expression,and chromosomal assignment of the human mitochondrial intermediate peptidase gene(mipep).genomics 40:493-496。
[0193]
lsaya g,kalousek f,fenton wa,rosenberg le.(1991)cleavage of precursors by the mitochondrial processing peptidase requires a compatible mature protein or an intermediate octapeptide.j.cell biol.113 65-76。
[0194]
4.6 flj46358(距离=129,175bp)
[0195]
假设的蛋白flj46358仅覆盖基因组的47kb。没有发现关于假设的蛋白flj46358的文献。它由7个cdnnest克隆(来自合并的胰腺和脾脏、星形细胞瘤细胞系、睾丸和海马)定义。它不含蛋白结构域或特征性psort基序。psort预测它定位在细胞质中。序列同源性未能揭示任何更多信息。
[0196]
4.7 parp4(距离=337,591bp)
[0197]
聚(adp-核糖)聚合酶-4(parp4)催化衍生自nao 的adp-核糖部分转移到各种受体蛋白,包括parp4本身。蛋白的这种聚(adp-核糖基)化在parp4dna结合结构域(dbd)与dna的单链或双链断裂结合时受到强烈刺激,人们普遍认为parp在细胞从dna损伤中恢复方面起着积极作用(lindahl等人,1995年)。此外,已经描述
[0198]
parp4在fas配体或dna损伤诱导的凋亡期间被胱天蛋白酶-3定量切割(tewari等
complex.mo/cell biol.2000oct;20(20):7813-25
[0220]
koyanagi m,hijikata m,watashi k,masui 0,shimotohno k.(2005)centrosomal p4.1-associated protein is a new member of transcriptional coactivators for nuclear factor-kappab.j biol chem.2005 apr 1;280(13):12430-7.epub 2005 jan 31
[0221]
peng b,sutherland kd,sum ey,olayioye m,wittlin s.tang tk,lindeman gj,visvader je.(2002)cpap is a novel stat5-interacting cofactor that augments stat5-mediated transcriptional activity.mol endocrinol.2002 sep;16(9):2019-33。
[0222]
4.11结论
[0223]
在1mb的插入位点内存在十个基因,但最近的flj46358已经有129kb的距离。在如此远的距离处的基因表达不太可能被逆转录病毒插入破坏。十个基因中没有一个是已知的致癌基因,尽管其中两个在文献中与癌症相关联(pcoth和parp4)。尽管如此,这两个基因分别距插入点186和337kb。它们的表达极不可能在如此远的距离处被逆转录病毒插入所破坏并且也是前所未有的。在文献中,其它十个基因中有许多与疾病相关联,但没有明确的方法表明它们可带来风险。
[0224]
5.论述
[0225]
插入的前病毒可通过插入突变过程诱导致癌激活。问题是ctx0e03细胞中是否可能存在此类激活。从这个分析中得出的结论是这是极不可能的。
[0226]
首先,重要的是要注意在ctx0e03细胞的生成和致癌激活已经出现的场景(诸如法国x-scid基因治疗试验)之间的显著方法差异。在这些应用中,逆转录病毒载体本身就是治疗剂,大量血液祖细胞被逆转录病毒感染。每一个均将构成独立的插入事件。所以每个病人均暴露于许多潜在的突变事件。接下来是一个选择性过程,受感染的祖细胞的子集将在患者体内扩增。因此,在试验开始时,存在许多未被鉴定的基因的致癌激活机会,以及增加致癌性被揭示的可能性的选择压力。相比之下,ctx0e03的生成涉及单一的插入事件进入单一的鉴定基因座,没有后续的选择。因此,与基因治疗研究相比,插入突变的先验概率大大降低,并且可提前量化。
[0227]
在对致癌激活可能性的这种评估中,观察到以下情况:
[0228]
·
ctx0e03细胞系将逆转录病毒插入到没有已知致癌功能的基因中。插入的性质不太可能引起基因破坏或激活。
[0229]
·
插入没有落在任何内源性逆转录病毒附近,可想象其激活诱导致癌激活。
[0230]
·
除了插入点所在的基因之外,没有其它基因足够接近或具有足够的致癌潜力来引起对致癌激活的关注。
[0231]
由于插入突变导致致癌激活的风险永远不可被认为是零,因为必须仍有致癌基因和机制有待发现。尽管如此,鉴于目前的知识状况,似乎有理由得出结论,由于ctx0e03细胞系中插入突变导致致癌激活的风险非常低。
[0232]
除非本文中另外指示或与上下文明显矛盾,否则在描述本发明的上下文中(尤其是在以下权利要求的上下文中),术语“一”和“一个”和“所述”以及类似术语的使用应被解释为涵盖单数和复数。除非另外说明,否则术语“包含”、“具有”、“包括”和“含有”应被解释
为开放式术语(即,意指“包括但不限于”)。除非本文中另外指示,否则本文中数值范围的叙述仅旨在用作单独提及落入该范围内的每个单独数值的速记方法,并且每个单独数值被并入说明书中,就好像其在本文中被单独叙述一样。除非本文中另外指示或另外与上下文明显矛盾,否则本文所描述的所有方法可按任何合适的顺序执行。除非另外声明,否则本文中提供的任何和所有示例或示例性语言(例如“诸如”)的使用仅仅是为了更好地说明本发明,而不是对本发明的范围进行限制。说明书中的语言均不应被解释为指示任何未要求保护的元件对于本发明的实践是必要的。
[0233]
本文描述本发明的实施方案,包括发明人已知的实施本发明的最佳模式。在阅读前面的描述后,那些实施方案的变化对于本领域普通技术人员来说可变得显而易见。发明人期望熟练的技术人员适当地采用此类变化,并且发明人希望本发明以不同于本文具体描述的方式实践。因此,本发明包括适用法律允许的所附权利要求中列举的主题的所有修改和等同物。此外,除非本文中另外指示或另外与上下文明显矛盾,否则本发明涵盖上述元件在其所有可能变化中的任何组合。
[0234]
所有引用和参考文献均以全文引用的方式并入,就好像每个单独的公开内容均被单独且明确地并入一样。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。