1.本技术涉及医药技术领域,尤其涉及一种硫酸氢氯吡格雷阿司匹林微片胶囊及其制备方法。
背景技术:
2.阿司匹林能抑制血小板的释放反应、抑制血小板的聚集,从而减少血栓素a2(txa2)生成,主要用于预防和治疗缺血性心脏病、心绞痛、心肺梗塞、脑血栓形成。
3.硫酸氢氯吡格雷能选择性地抑制二磷酸腺苷(adenosine diphosphate,adp)与血小板受体的结合,随后抑制激活adp与糖蛋白gpⅱb/ⅲα复合物,从而抑制血小板的聚集,主要用于中风、心肌梗死和外周动脉疾病患者的治疗。
4.研究表明,将阿司匹林和硫酸氢氯吡格雷合用,抗血小板活性显著增强,可用于治疗血小板聚集引起的疾病,包括稳定或不稳定的心绞痛、心血管和脑血管系统的疾病,疗效确切。
5.目前市售的硫酸氢氯吡格雷阿司匹林片为双层片,因为阿司匹林和硫酸氢氯吡格雷相容性较差,两个原料药直接混合压片,将大大增加其接触,进而导致性状改变,有关物质增加。制成双层片可有效改善其稳定性,但双层片的工艺对设备及辅料均有较高的要求,在制备过程中仍然无法避免局部原料药混合的现象,因此无法将两种原料药完全隔绝。
技术实现要素:
6.本技术提供了一种硫酸氢氯吡格雷阿司匹林微片胶囊及其制备方法,以解决现有的硫酸氢氯吡格雷阿司匹林双层片制备过程中仍然无法避免局部原料药接触的现象,因此无法将两种原料药完全隔绝问题。
7.一方面,本技术提供一种硫酸氢氯吡格雷阿司匹林微片胶囊,所述硫酸氢氯吡格雷阿司匹林微片胶囊由硫酸氢氯吡格雷微片、阿司匹林微片和胶囊壳组成,其中活性成分为硫酸氢氯吡格雷、阿司匹林;辅料为填充剂、崩解剂、助流剂和/或润滑剂。
8.可选的,活性成分占比为30-60%、填充剂25-40%、崩解剂4-20%、助流剂和/或润滑剂0.8-2.5%;活性成分中,阿司匹林占比12-42%;硫酸氢氯吡格雷占比18-48%。
9.可选的,所述填充剂为微晶纤维素、乳糖、玉米淀粉、硅化微晶纤维素、甘露醇中的一种或多种;所述崩解剂为微晶纤维素、低取代羟丙纤维素中的一种或多种。
10.可选的,所述助流剂为二氧化硅、滑石粉中的一种或多种;所述润滑剂为硬脂酸、硬脂酸锌、硬脂酸镁、聚乙二醇、山嵛酸甘油酯中的一种或多种。
11.可选的,所述胶囊包括硫酸氢氯吡格雷微片、阿司匹林微片以及胶囊壳;其中,硫酸氢氯吡格雷微片数量10-20片、阿司匹林微片数量8-20片、胶囊壳为1号、0号及00号的肠溶性胶囊壳。
12.可选的,硫酸氢氯吡格雷微片规格为5-10mg,片重为10-25mg、直径为2-3mm。
13.可选的,阿司匹林微片规格为5-10mg,片重为10-25mg、直径为2-3mm。
14.第二方面,本技术提供一种硫酸氢氯吡格雷阿司匹林微片胶囊的制备方法,包括以下步骤:
15.将阿司匹林过80目筛,与第一填充剂、第一崩解剂和第一助流剂混合,得到第一混合物;向第一混合物中加入第一润滑剂混合,得到阿司匹林微片;
16.将硫酸氢氯吡格雷过80目筛,与第二填充剂、第二崩解剂和第二助流剂混合,得到第二混合物;向第二混合物中加入第二润滑剂混合,得到硫酸氢氯吡格雷微片;
17.将阿司匹林微片、硫酸氢氯吡格雷微片填充至胶囊壳中制成微片胶囊。
18.可选的,所述阿司匹林微片中,阿司匹林的重量份数为36-52%、第一填充剂的重量份数为24-44%、第一崩解剂的重量份数为6-20%、第一助流剂的重量份数为0.8-2.5%、第一润滑剂的重量份数为0.8-2.5%。
19.可选的,所述硫酸氢氯吡格雷微片中,硫酸氢氯吡格雷重量分数为38-66%、填充剂的重量份数为24-45%、崩解剂的重量份数为4-8%、第二助流剂的重量份数为0.8-2.5%、第二润滑剂的重量份数为0.8-2.5%。
20.由以上技术方案可知,本技术提供一种硫酸氢氯吡格雷阿司匹林微片胶囊及其制备方法,本技术提供的硫酸氢氯吡格雷阿司匹林微片胶囊,所述硫酸氢氯吡格雷阿司匹林微片胶囊由硫酸氢氯吡格雷微片、阿司匹林微片和胶囊壳组成,其中活性成分为硫酸氢氯吡格雷、阿司匹林;辅料为填充剂、崩解剂、助流剂和/或润滑剂。通过将阿司匹林和硫酸氢氯吡格雷分别压制成两种微片,然后按规格需求将两种微片装入同一胶囊中,这种方式可将阿司匹林和硫酸氢氯吡格雷进行物理上的绝对隔绝,可杜绝阿司匹林和硫酸氢氯吡格雷的相互作用,大大提高其稳定性,并且工艺相比于双层片更可控。并且硫酸氢氯吡格雷阿司匹林微片胶囊的胶囊体选择为肠溶胶囊,即能避免阿司匹林对胃黏膜刺激引起的不良反应,又能避免工艺难度较大的肠溶包衣工序。
附图说明
21.为了更清楚地说明本技术的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
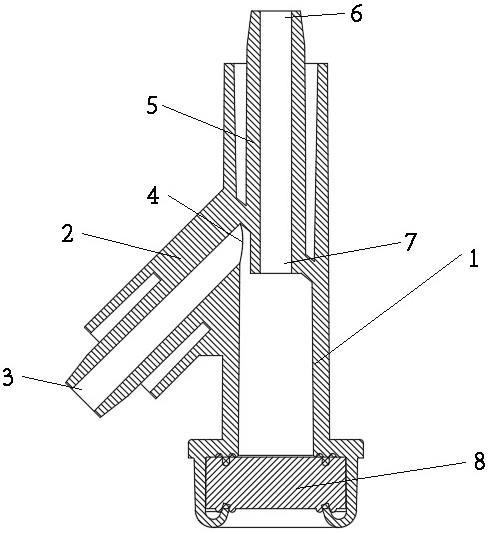
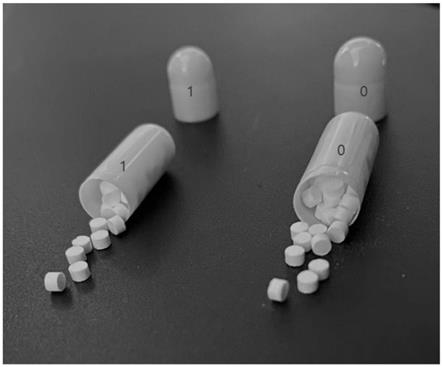
22.图1为本技术提供硫酸氢氯吡格雷阿司匹林微片胶囊示意图。
具体实施方式
23.下面将详细地对实施例进行说明,其示例表示在附图中。下面的描述涉及附图时,除非另有表示,不同附图中的相同数字表示相同或相似的要素。以下实施例中描述的实施方式并不代表与本技术相一致的所有实施方式。仅是与权利要求书中所详述的、本技术的一些方面相一致的系统和方法的示例。
24.目前,硫酸氢氯吡格雷阿司匹林片由赛诺菲安万特公司研制开发,商品名为duoplavin,该产品2009年12月17日获得欧洲药品管理局(ema)的人用医药产品委员会(chmp)的上市许可,该复方片包括2个剂量组合,即氯吡格雷75mg/阿司匹林75mg和氯吡格雷75mg/阿司匹林100mg。
25.目前市售的硫酸氢氯吡格雷阿司匹林片为双层片,因为阿司匹林和硫酸氢氯吡格
雷相容性较差,两个原料药直接混合压片,将大大增加其接触,进而导致性状改变,有关物质增加。制成双层片可有效改善其稳定性。但双层片的工艺对设备及辅料均有较高的要求,在制备过程中仍然无法避免局部接触的现象。口服阿司匹林可直接影响刺激胃黏膜而引起恶心、呕吐,长期使用会导致胃炎膜损伤引起胃溃疡及胃出血等症状。
26.为解决上述技术问题,本技术提供的一种硫酸氢氯吡格雷阿司匹林微片胶囊及其制备方法。
27.一方面,本技术提供一种硫酸氢氯吡格雷阿司匹林微片胶囊,所述硫酸氢氯吡格雷阿司匹林微片胶囊由硫酸氢氯吡格雷微片、阿司匹林微片和胶囊壳组成,其中活性成分为硫酸氢氯吡格雷、阿司匹林;辅料为填充剂、崩解剂、助流剂和/或润滑剂。
28.具体地,活性成分占比为30-60%、填充剂25-40%、崩解剂4-20%、助流剂和/或润滑剂0.8-2.5%;活性成分中,阿司匹林占比12-42%;硫酸氢氯吡格雷占比18-48%。
29.具体地,所述填充剂为微晶纤维素、乳糖、玉米淀粉、硅化微晶纤维素、甘露醇中的一种或多种;所述崩解剂为微晶纤维素、低取代羟丙纤维素中的一种或多种。
30.具体地,所述助流剂为二氧化硅、滑石粉中的一种或多种;所述润滑剂为硬脂酸、硬脂酸锌、硬脂酸镁、聚乙二醇、山嵛酸甘油酯中的一种或多种。
31.具体地,所述胶囊包括硫酸氢氯吡格雷微片、阿司匹林微片以及胶囊壳;其中,硫酸氢氯吡格雷微片数量10-20片、阿司匹林微片数量8-20片、胶囊壳为1号、0号及00号的肠溶性胶囊壳。
32.具体地,硫酸氢氯吡格雷微片规格为5-10mg,片重为10-25mg、直径为2-3mm。
33.具体地,阿司匹林微片规格为5-10mg,片重为10-25mg、直径为2-3mm。
34.第二方面,本技术提供一种硫酸氢氯吡格雷阿司匹林微片胶囊的制备方法,包括以下步骤:
35.将阿司匹林过80目筛,与第一填充剂、第一崩解剂和第一助流剂混合,得到第一混合物;向第一混合物中加入第一润滑剂混合,得到阿司匹林微片;
36.将硫酸氢氯吡格雷过80目筛,与第二填充剂、第二崩解剂和第二助流剂混合,得到第二混合物;向第二混合物中加入第二润滑剂混合,得到硫酸氢氯吡格雷微片;
37.将阿司匹林微片、硫酸氢氯吡格雷微片填充至胶囊壳中制成微片胶囊。
38.具体地,所述阿司匹林微片中,阿司匹林的重量份数为36-52%、第一填充剂的重量份数为24-44%、第一崩解剂的重量份数为6-20%、第一助流剂的重量份数为0.8-2.5%、第一润滑剂的重量份数为0.8-2.5%。
39.具体地,所述硫酸氢氯吡格雷微片中,硫酸氢氯吡格雷重量分数为38-66%、填充剂的重量份数为24-45%、崩解剂的重量份数为4-8%、助流剂的重量份数为0.8-2.5%、润滑剂的重量份数为0.8-2.5%。
40.图1为本技术提供硫酸氢氯吡格雷阿司匹林微片胶囊示意图,小的为1号胶囊,大的为0号胶囊。
41.下面给出具体实施例进行详细说明。
42.实施例1
43.表1
[0044][0045][0046]
其中,表1为实施例1的各组分组成以及比例。
[0047]
工艺:
[0048]
阿司匹林微片制备:
[0049]
将阿司匹林过80目筛,与乳糖、微晶纤维素和二氧化硅过40目筛混合,加入硬脂酸过40目混合。制成微片,直径2mm,片重10mg,每片含阿司匹林5mg。
[0050]
硫酸氢氯吡格雷微片制备:
[0051]
将硫酸氢氯吡格雷过80目筛,与甘露醇、低取代羟丙纤维素、二氧化硅过40目筛混合,加入硬脂酸锌过40目混合。制成微片,直径2mm,片重10mg,每片含氯吡格雷5mg。
[0052]
制成复方胶囊:
[0053]
取上述阿司匹林微片15片,硫酸氢氯吡格雷微片15片,装至1号肠溶胶囊,制得75mg:75mg规格的硫酸氢氯吡格雷阿司匹林微片胶囊。
[0054]
实施例2
[0055]
表2
[0056]
[0057][0058]
其中,表2为实施例2的各组分组成以及比例。
[0059]
工艺:
[0060]
阿司匹林微片制备:
[0061]
将阿司匹林过60目筛,与玉米淀粉、微晶纤维素和二氧化硅过40目筛混合,加入硬脂酸过40目混合。制成微片,直径2mm,片重10mg,每片含阿司匹林5mg。
[0062]
硫酸氢氯吡格雷微片制备:
[0063]
将硫酸氢氯吡格雷过60目筛,与硅化微晶纤维素、低取代羟丙纤维素、滑石粉过40目筛混合,加入聚乙二醇6000过40目混合。制成微片,直径2mm,片重10mg,每片含氯吡格雷5mg。
[0064]
制成复方胶囊:
[0065]
取上述阿司匹林微片15片,硫酸氢氯吡格雷微片20片,装至0号肠溶胶囊,制得75mg:100mg规格的硫酸氢氯吡格雷阿司匹林微片肠溶胶囊。
[0066]
实施例3
[0067]
表3
[0068][0069]
其中,表3为实施例3的各组分组成以及比例。
[0070]
工艺:
[0071]
阿司匹林微片制备:
[0072]
将阿司匹林过60目筛,与微晶纤维素、聚维酮k30和二氧化硅过40目筛混合,加入硬脂酸过40目混合。制成微片,直径2mm,片重10mg,每片含阿司匹林5mg。
[0073]
硫酸氢氯吡格雷微片制备:
[0074]
将硫酸氢氯吡格雷过60目筛,与硅化微晶纤维素、羧甲基淀粉钠、滑石粉过40目筛混合,加入山嵛酸甘油酯过40目混合。制成微片,直径2mm,片重10mg,每片含氯吡格雷5mg。
[0075]
制成复方胶囊:
[0076]
取上述阿司匹林微片15片,硫酸氢氯吡格雷微片15片,装至1号肠溶胶囊,制得75mg;75mg规格的硫酸氢氯吡格雷阿司匹林微片胶囊。
[0077]
实施例4
[0078]
将实施例3中阿司匹林微片和硫酸氢氯吡格雷微片进行包衣,使用不同颜色的欧巴代薄膜包衣预混剂进行隔离包衣,进一步将阿司匹林微片和硫酸氢氯吡格雷微片完全隔开。包衣参数:包衣液固含量12%,物料温度30-40℃,主机转速6-15rpm,包衣增重为2-3%。得到浅蓝色阿司匹林薄膜包衣微片,包衣增重2.6%;黄色硫酸氢氯吡格雷薄膜包衣微片,包衣增重2.4%。分别取上述浅蓝色阿司匹林薄膜包衣微片15片,黄色硫酸氢氯吡格雷薄膜包衣微片15片,装至1号肠溶胶囊,制得75mg:75mg规格的硫酸氢氯吡格雷阿司匹林微片胶囊。
[0079]
对比例1
[0080]
表4
[0081]
处方组成作用比例阿司匹林活性成分20%(5mg)硫酸氢氯吡格雷活性成分26.1%(6.52mg)乳糖填充剂34%微晶纤维素崩解剂18%二氧化硅助流剂1.1%硬脂酸润滑剂0.8%
[0082]
其中,表4为对比例1的各组分组成以及比例。
[0083]
区别在于阿司匹林和硫酸氢氯吡格雷直接混合压片。
[0084]
工艺:
[0085]
将阿司匹林、硫酸氢氯吡格雷过60目筛,与乳糖、微晶纤维素和二氧化硅过40目筛混合,最后加入硬脂酸过40目混合。
[0086]
制成微片,直径3mm,片重25mg,每片含阿司匹林5mg,含氯吡格雷5mg。
[0087]
取上述硫酸氢氯吡格雷阿司匹林微片15片,装至0号明胶胶囊,制得75mg;75mg规格的硫酸氢氯吡格雷阿司匹林微片胶囊。
[0088]
对比例2
[0089]
表5
[0090][0091]
其中,表5为对比例2的各组分组成以及比例.
[0092]
区别在于阿司匹林和硫酸氢氯吡格雷压制双层片。
[0093]
工艺:
[0094]
将阿司匹林过60目筛,与微晶纤维素、二氧化硅过40目筛混合,加入硬脂酸过40目混合,备用。
[0095]
将硫酸氢氯吡格雷过60目筛,与甘露醇、低取代羟丙纤维素、二氧化硅过40目筛混合,加入硬脂酸锌过40目混合,备用。
[0096]
使用压片机进行压制双层片,先填充阿司匹林混粉,进行预压成片,再填充硫酸氢氯吡格雷混粉,进行压制成片。直径10mm,片重500mg,每片含阿司匹林75mg,含氯吡格雷75mg。
[0097]
对比例3
[0098]
区别仅在于使用对比例2的片剂进行肠溶包衣。
[0099]
使用欧巴代肠溶包衣预混剂进行包衣,包衣参数:包衣液固含量7%,物料温度30-40℃,主机转速6-15rpm,包衣增重为6-8%。得到肠溶包衣片的包衣增重为6.9%。
[0100]
其中,上述实施例1-4所用的胶囊壳型号及参数如表6所示。
[0101]
表6
[0102]
项目00
#0#1#
冒长度(mm)11.6
±
0.410.8
±
0.49.8
±
0.4体长度(mm)19.8
±
0.418.4
±
0.416.4
±
0.4冒壁厚(mm)0.110
±
0.0150.110
±
0.0150.110
±
0.015体壁厚(mm)0.110
±
0.0150.110
±
0.0150.110
±
0.015冒口部外径(mm)8.48
±
0.037.58
±
0.036.83
±
0.03体口部外径(mm)8.15
±
0.037.34
±
0.036.61
±
0.03锁和后总长(mm)23.3
±
0.0321.2
±
0.0319.0
±
0.03
平均重量(mg)122
±
1097
±
877
±
6容积(ml)0.950.680.5
[0103]
下面结合具体效果评价数据来进行分析。
[0104]
效果评价数据:
[0105]
1、崩解时限
[0106]
肠溶胶囊:取供试品6粒,先在盐酸溶液(9
→
1000)中不加挡板检查2小时,每粒的囊壳均不得有裂缝或崩解现象;继将吊篮取出,用少量水洗涤后,每管加入挡板,再按上述方法,改在人工肠液中进行检查,1小时内应全部崩解。如有1粒不能完全崩解,应另取6粒复试,均应符合规定。
[0107]
肠溶片:取供试品6片,先在盐酸溶液(9
→
1000)中检查2小时,每片均不得有裂缝、崩解或软化现象;然后将吊篮取出,用少量水洗涤后,再按上述方法,改在人工肠液中进行检查,1小时内应全部崩解。如有1片不能完全崩解,应另取6片复试,均应符合规定。崩解试验数据如表7-8。
[0108]
表7盐酸溶液中崩解试验
[0109][0110][0111]
表8人工肠液中崩解试验
[0112]
试验组崩解时限实施例110min实施例213min实施例314min实施例413min对比例1/对比例2/对比例330min
[0113]
结论:从上述数据可知,实施例所用的肠溶胶囊在盐酸溶液中无裂缝和崩解现象,在磷酸盐缓冲液中又能较快的崩解释放,而对比例中肠溶包衣虽然在盐酸溶液中无裂缝和崩解现象,但在磷酸盐缓冲液中崩解释放较慢。
[0114]
2、溶出
[0115]
溶出方法:转速75rpm,溶出介质为ph6.8磷酸盐缓冲液。
[0116]
色谱柱:ultimate xb-c18柱(250mm
×
4.6mm,5μm);流动相:乙腈-水-磷酸(体积比40:60:2);检测波长:235nm;流速:1.0ml
·
min-1
;进样量:10μl。在此色谱条件下理论塔板数按相对保留时间计算应不小于2000。表9-15分别为实施例1-4以及对比例1-3的溶出数据。
[0117]
表9实施例1溶出结果
[0118][0119][0120]
表10实施例2溶出结果
[0121][0122]
表11实施例3溶出结果
[0123][0124]
表12实施例4溶出结果
[0125][0126][0127]
表13对比例1溶出结果
[0128][0129]
表14对比例2溶出结果
[0130][0131]
表15对比例3溶出结果
[0132][0133][0134]
结论:从上述数据可知,本发明的实施例在ph=6.8磷酸盐缓冲液中溶出均快于对比例,并且实施例的批内均一性优于对比例。
[0135]
3、有关物质
[0136]
阿司匹林有关物质方法:
[0137]
色谱条件:用十八烷基硅烷键合硅胶为填充剂;以乙腈-四氢呋喃-冰醋酸-水(20:5:5:70)为流动相a,乙腈为流动相b,按下表进行梯度洗脱;检测波长为276nm;进样体积10μl。
[0138]
限度:供试品溶液色谱图中如有杂质峰,除水杨酸峰外,其他各杂质峰面积的和不得大于对照溶液主峰面积(0.5%),小于灵敏度溶液主峰面积的色谱峰忽略不计。水杨酸限度0.3%。
[0139]
硫酸氢氯吡格雷有关物质方法:
[0140]
色谱条件:以卵粘蛋白键合硅胶为填充剂的手性色谱柱(ultrones-ovm);以乙腈-0.01mol/l的磷酸二氢钾溶液(20:80)为流动相;检测波长为220nm;进样体积10μl。
[0141]
限度:供试品溶液色谱图中如有杂质峰,按外标法以峰面积计算,氯吡格雷杂质i不得过氯吡格雷标示量的0.5%,氯吡格雷杂质iii不得过氯吡格雷标示量的1.0%;其他单个杂质按主成分外标法以峰面积计算,并将结果乘以0.766,不得过氯吡格雷标示量的0.2%;杂质总和不得过氯吡格雷标示量的1.5%(均除氯吡格雷杂质ii外)。具体数据见表16-17。
[0142]
表16阿司匹林有关物质结果
[0143][0144]
表17硫酸氢氯吡格雷有关物质结果
[0145][0146]
结论:从上述数据可知,本发明的实施例稳定性优于对比例。
[0147]
数据效果分析:
[0148]
实施例1-3均使用未包衣的两种微片装肠溶胶囊,实施例4先对两种微片包薄膜衣,后装胶囊。对比例1直接将阿司匹林和硫酸氢氯吡格雷混合压片,对比例2将阿司匹林和硫酸氢氯吡格雷压制双层片,对比例3对双层片直接进行肠溶包衣。
[0149]
稳定性(有关物质):实施例1-4基本一致,为最稳定产品;对比例1最差;对比例2-3较稳定,和1-4相比仍有较大差距。
[0150]
溶出:双层片及包衣片溶出均一性较差,装至肠溶胶囊的微片溶出均一性更好。
[0151]
生产工艺对比:
[0152]
阿司匹林和硫酸氢氯吡格雷混合压片:工艺最简单,但稳定性最差;
[0153]
双层片:压片工艺难度较大,肠溶包衣难度大时间长,肠溶性能控制难度大,稳定性较好;
[0154]
微片胶囊:压片工艺难度较小,直接装胶囊工艺简单可控,肠溶性能容易控制,稳定性最好。
[0155]
综上所述,本技术提供一种硫酸氢氯吡格雷阿司匹林微片胶囊及其制备方法,本技术提供的硫酸氢氯吡格雷阿司匹林微片胶囊,所述硫酸氢氯吡格雷阿司匹林微片胶囊由
硫酸氢氯吡格雷微片、阿司匹林微片和胶囊壳组成,其中活性成分为硫酸氢氯吡格雷、阿司匹林;辅料为填充剂、崩解剂、助流剂和或润滑剂。通过将阿司匹林和硫酸氢氯吡格雷分别压制成两种微片,然后按规格需求将两种微片装入同一胶囊中,这种方式可将阿司匹林和硫酸氢氯吡格雷进行物理上的绝对隔绝,可杜绝阿司匹林和硫酸氢氯吡格雷的相互作用,大大提高其稳定性,并且工艺相比于双层片更可控。并且硫酸氢氯吡格雷阿司匹林微片胶囊的胶囊壳选择为肠溶胶囊,即能避免阿司匹林对胃黏膜刺激引起的不良反应,又能避免工艺难度较大的肠溶包衣工序。
[0156]
本技术提供的实施例之间的相似部分相互参见即可,以上提供的具体实施方式只是本技术总的构思下的几个示例,并不构成本技术保护范围的限定。对于本领域的技术人员而言,在不付出创造性劳动的前提下依据本技术方案所扩展出的任何其他实施方式都属于本技术的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。