1.本发明涉及植物组织培养技术领域,具体涉及一种木本花卉植物快繁培养基与培养方法。
背景技术:
2.木本花卉是以观花、观叶、观果为主的木本植物,具有木质化程度较高的茎干,寿命较长,木本花卉主要包括乔木、灌木、藤本三种类型。在花卉分类中常单独列出,在园林景观上的应用极为广泛,花开时节,繁花满树,姹紫嫣红,美不胜收,为造园的优良树木。很多木本花卉植物的花、叶、果、树皮可做药材、可提取香精香料等,具有较高的经济价值。
3.木本花卉植物的繁育方式,根据植物种类不同通常有播种、嫁接、扦插、分株,高压等。在苗木供不应求的当今,扦插、嫁接,分析、高压育苗量少,难以形成规模,不能满足市场需求,且容易造成病毒泛滥,引起品种退化。植物组织培养育苗作为一种高新的育苗手段,多应用在草本花卉上。到目前为止,木本花卉植物的组培快繁技术还不成熟稳定,尤其是针对木本植物特性进行组培的基本培养基成分种类、浓度配比还有很多值得探索。
4.草本植物的植物形态和内部细胞组织结构与木本植物不同,且草本花卉的组培成活率比木本植物尤其是是木本花卉植物成活率较高,因此适合于草本植物的培养基并不适于木本植物。我们曾使用专利cn108401905b中非洲菊的快繁培养基培养木本植物,但分化、增殖率一直很低,浪费人力、物力,增加木本植物的生产成本。
技术实现要素:
5.为解决上述问题,发明人经过长期的探索研究,最终研究出一种新的木本花卉植物快繁培养基,能够使木本植物丛生芽萌发时间早,诱导率高达到100%,增殖系数最多可达8.1,组培苗生根率高达95%以上。
6.为了实现上述目的,本发明采用以下技术方案:
7.本发明提供了一种木本花卉植物快繁培养基,包括诱导培养基、增殖培养基、生根培养基,所述诱导培养基成分为基本培养基 氯吡脲1~2mg/l 多氯苯甲酸0.5~2mg/l 吲哚乙酸0.05~0.5mg/l 萘乙酸naa0.05~0.2mg/l;所述增殖培养基成分为基本培养基 氯吡脲0.2~1mg/l 多氯苯甲酸0.1~0.4mg/l 吲哚乙酸0.05~0.2mg/l 萘乙酸naa0.05~0.2mg/l;所述生根培养基成分为1/2基本培养基 吲哚乙酸0.1~0.5mg/l 萘乙酸naa0.05~0.2mg/l;
8.其中,基本培养基中包含:
9.大量元素:硝酸钾2450~2600mg/l、磷酸铵280~320mg/l、二水氯化钙180~220mg/l、七水硫酸镁380~420mg/l、磷酸二氢铵280~320mg/l;
10.微量元素:碘化钾0.5~1.5mg/l、硼酸2~4mg/l、七水硫酸锌0.5~1.5mg/l、二水钼酸钠0.07~0.15mg/l、五水硫酸铜0.4~0.6mg/l、六水二氯化钴0.2~0.4mg/l、硫酸猛8~12mg/l;
11.铁盐:乙二胺四乙酸二钠25~35mg/l、七水硫酸亚铁10~18mg/l;
12.有机物:肌醇800~1200mg/l、烟酸2~4mg/l、盐酸硫胺素4~6mg/l、盐酸吡哆醇0.4~0.7mg/l;
13.蔗糖2~5%、琼脂5~10g/l。
14.诱导培养基、增殖培养基、生根培养基中,是将基本培养基组分以及对应培养基中其他组分称量好后,配制成1l溶液。
15.进一步地,所述基本培养基的ph值为5.5~6.5,进一步为5.8~6.0。
16.进一步地,所述诱导培养基成分为基本培养基 氯吡脲0.5mg/l 多氯苯甲酸1.0.mg/l 吲哚乙酸0.2mg/l 萘乙酸naa0.1mg/l;
17.所述增殖培养基成分为基本培养基 氯吡脲0.5mg/l 多氯苯甲酸0.2.mg/l 吲哚乙酸0.1mg/l 萘乙酸naa0.1mg/l;
18.所述生根培养基成分为1/2基本培养基 吲哚乙酸0.2mg/l 萘乙酸naa0.1mg/l。
19.氯吡脲、多氯苯甲酸均属于细胞分裂素类物质,具有促进细胞分裂、分化,促进侧芽生长,延缓植物体内蛋白质降解,延长细胞寿命。
20.吲哚乙酸和萘乙酸属于植物生长促进剂,具有促进细胞分裂、扩大、诱导愈伤组织和不定根形成,两种配合使用产生比单独使用效果更好的复合效应。
21.在本发明的具体实施方式中,所述基本培养基的成分为:
22.大量元素:硝酸钾2500mg/l、磷酸铵300mg/l、二水氯化钙200mg/l、七水硫酸镁400mg/l、磷酸二氢铵300mg/l;
23.微量元素:碘化钾1mg/l、硼酸3mg/l、七水硫酸锌1mg/l、二水钼酸钠0.1mg/l、五水硫酸铜0.5mg/l、六水二氯化钴0.3mg/l、硫酸猛10mg/l;
24.铁盐:乙二胺四乙酸二钠30mg/l、七水硫酸亚铁15mg/l;
25.有机物:肌醇1000mg/l、烟酸3mg/l、盐酸硫胺素5mg/l、盐酸吡哆醇0.5mg/l;
26.蔗糖3%、琼脂7g/l。
[0027]“蔗糖3%”是指1l溶液中,蔗糖用量为30g。
[0028]
本发明还提供了一种木本花卉植物快繁培养方法,包括如下步骤:
[0029]
(1)初代培养:将外植体材料接种在灭菌后的诱导培养基;
[0030]
(2)增殖培养:丛生芽苗生长到1~2.5cm时,将芽切割后转接在增殖培养基上培养;
[0031]
(3)生根培养:将经过继代增殖的无根苗转入生根培养基中培养。
[0032]
进一步地,初代培养的温度为23~28℃,光照强度800~1800lx,光照时间8~15小时;
[0033]
在本发明的具体实施方式中,初代培养的温度为25~28℃,光照强度1000~1500lx,光照时间10~12小时。
[0034]
进一步地,增殖培养的温度23~28℃,光照强度2400~3200lx,光照时间10~18小时;
[0035]
在本发明的具体实施方式中,增殖培养的温度25~28℃,光照强度2500~3000lx,光照时间12~15小时。
[0036]
进一步地,增殖培养的数量为初代苗的3~8倍后进行生根培养。
[0037]
进一步地,生根培养温度23~28℃,光照2800~3800lx,光照时间10~18小时。
[0038]
在本发明的具体实施方式中,生根培养温度25~28℃,光照3000~3500lx,光照时间12~15小时。
[0039]
进一步地,将木本花卉的枝条剪成带1~2叶的小段,用洗洁剂加水振荡洗涤后用流水冲洗50~80分钟后,用75%酒精摇动5~15秒,用无菌水洗净后,加入1~3%次氯酸钠浸泡10~20分钟,用无菌水洗涤。
[0040]
本发明的有益效果是:
[0041]
本发明在植物组织培养过程中利用诱导培养基、增殖培养基、生根培养基培育,能够使木本植物丛生芽萌发时间早,诱导率高达到100%,增殖系数最多可达8.1,组培苗生根率高达95%以上,具有较好的市场前景。
具体实施方式
[0042]
下面对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0043]
实施例中的数据若出现范围值,可理解为可选取两端的任一端点值或两端中间的任意数值。
[0044]
实施例1
[0045]
实验材料:月季
[0046]
1、基本培养基成分
[0047]
大量元素:硝酸钾2500mg/l、磷酸铵300mg/l,二水氯化钙200mg/l、七水硫酸镁400mg/l、磷酸二氢铵300mg/l。
[0048]
微量元素:碘化钾1mg/l、硼酸3mg/l、七水硫酸锌1mg/l、二水钼酸钠0.1mg/l、五水硫酸铜0.5mg/l、六水二氯化钴0.3mg/l、硫酸猛10mg/l。
[0049]
铁盐:乙二胺四乙酸二钠30mg/l、七水硫酸亚铁15mg/l。
[0050]
有机物:肌醇1000mg/l、烟酸3mg/l、盐酸硫胺素5mg/l、盐酸吡哆醇0.5mg/l。
[0051]
蔗糖3%、琼脂7.0g/l、ph 5.8~6.0。
[0052]
2、培养基配方
[0053]
诱导培养基:基本培养基 氯吡脲0.5mg/l 多氯苯甲酸1.0.mg/l 吲哚乙酸0.2mg/l 萘乙酸naa0.1mg/l
[0054]
将基本培养基组分以及氯吡脲、多氯苯甲酸、吲哚乙酸、萘乙酸称量好后,倒进容量瓶,加水配制成1l溶液,增殖培养基、生根培养基均依此方法配制。
[0055]
增殖培养基:基本培养基 氯吡脲0.5mg/l 多氯苯甲酸0.2mg/l 吲哚乙酸0.1mg/l 萘乙酸naa0.1mg/l
[0056]
生根培养基:1/2基本培养基 吲哚乙酸0.2mg/l 萘乙酸naa0.1mg/l
[0057]
3、培养方法
[0058]
材料处理与初代培养:将月季枝条剪成带1~2叶节的小段,放进烧杯中,用少许洗衣粉加水振荡洗涤3分钟,流水冲洗60分钟。取出材料转入小瓶口的玻璃瓶,倒入75%酒精摇动10秒,倒入无菌水摇晃几下立即倒掉,加入2%次氯酸钠振荡浸泡15分钟,无菌水振荡
洗涤5次,每次5分钟,取出材料接种在灭菌诱导培养基上。设置培养室温度25~28℃,光照强度1000~1500lx,光照时间10~12小时。培养7天腋芽萌发生长,15~20天后,分化出5~7个丛生芽,分化率达100%。
[0059]
增殖培养:丛生芽苗生长到1.5~2.0公分,将芽分切成单苗,转接在增殖培养基上培养,15~20天,小苗生长到5~7公分,再将其剪成带1~2片叶的茎段,转入新鲜增殖培养基,在温度25~28℃,光照强度2500~3000lx,光照时间12~15小时条件下继代增殖培养,3~4周继代一次,增殖5~7倍。
[0060]
生根培养:将继代增殖的无根苗切成2公分长的茎段,转入生根培养基中,设置培养室温度25~28℃,光照3000~3500lx,光照时间12~15小时进行培养。10天长出2~5条不定根,生根率达98%。
[0061]
实施例2
[0062]
实验材料:山茶花
[0063]
1、基本培养基成分
[0064]
大量元素:硝酸钾3000mg/l、磷酸铵400mg/l、二水氯化钙250mg/l、七水硫酸镁450mg/l、磷酸二氢铵350mg/l。
[0065]
微量元素:碘化钾0.5mg/l、硼酸5mg/l、七水硫酸锌1.2mg/l、二水钼酸钠0.2mg/l、五水硫酸铜0.8mg/l、六水二氯化钴0.5mg/l、硫酸猛12mg/l。
[0066]
铁盐:乙二胺四乙酸二钠35mg/l、七水硫酸亚铁10mg/l。
[0067]
有机物:肌醇1500mg/l、烟酸5mg/l、盐酸硫胺素6mg/l、盐酸吡哆醇1.0mg/l。
[0068]
蔗糖3%、琼脂7.0g/l、ph 5.8~6.0。
[0069]
2、培养基配方
[0070]
诱导培养基:基本培养基 氯吡脲1.0mg/l 多氯苯甲酸0.5.mg/l 吲哚乙酸0.1mg/l 萘乙酸naa0.2mg/l
[0071]
将基本培养基组分以及氯吡脲、多氯苯甲酸、吲哚乙酸、萘乙酸称量好后,倒进容量瓶,加水配制成1l溶液,增殖培养基、生根培养基均依此方法配制。
[0072]
增殖培养基:基本培养基 氯吡脲0.5mg/l 多氯苯甲酸1.0.mg/l 吲哚乙酸0.1mg/l 萘乙酸naa0.1mg/l
[0073]
生根培养基:1/2基本培养基 吲哚乙酸0.3mg/l 萘乙酸naa0.2mg/l
[0074]
3、培养方法
[0075]
材料处理与初代培养:将山茶花枝条剪成带1~2叶节的小段,放进烧杯中,用少许洗衣粉加水振荡洗涤3分钟,流水冲洗60分钟。取出材料转入小瓶口玻璃瓶,倒入75%酒精摇动10秒,倒入无菌水摇晃几下立即倒掉水分,加入2%次氯酸钠振荡浸泡15分钟,无菌水振荡洗涤5次,每次5分钟,取出材料接种在灭菌诱导培养基上,在相同培养条件下培养,7天后腋芽陆续萌发生长,20天后,腋芽周围分化出3~7个丛生芽,分化率90%。
[0076]
增殖培养:丛生芽苗生长到1.5~2.0公分,将芽分切成单苗,转接在增殖培养基上培养,20~25天,无根小苗生长到5~7片叶,再将其切成带1~2片叶的茎段,转入新鲜培值培养基,在相同培养条件下继代增殖培养,4~5周继代一次,每次增殖3~6倍。
[0077]
生根培养:将继代增殖的无根苗切成2公分长的茎段,转入生根培养基中在相同培养条件下培养,10天长出2~5条不定根,生根率92%。
[0078]
实施例3
[0079]
实验材料:玫瑰
[0080]
1、基本培养基成分
[0081]
大量元素:硝酸钾2500mg/l、磷酸铵500mg/l二水氯化钙200mg/l、七水硫酸镁400mg/l、磷酸二氢铵300mg/l。
[0082]
微量元素:碘化钾1mg/l、硼酸3mg/l、七水硫酸锌1mg/l、二水钼酸钠0.1mg/l、五水硫酸铜0.5mg/l、六水二氯化钴0.3mg/l、硫酸猛10mg/l。
[0083]
铁盐:乙二胺四乙酸二钠30mg/l、七水硫酸亚铁15mg/l。
[0084]
有机物:肌醇1000mg/l、烟酸3mg/l、盐酸硫胺素5mg/l、盐酸吡哆醇0.5mg/l。
[0085]
蔗糖3%、琼脂7.0g/l、ph 5.8~6.0。
[0086]
2、培养基配方
[0087]
细胞分裂素:氯吡脲0.5mg/l、多氯苯甲酸0.1.mg/l。
[0088]
植物生长素:吲哚乙酸0.1mg/l、萘乙酸0.1mg/l
[0089]
诱导培养基:基本培养基 氯吡脲0.5mg/l 多氯苯甲酸1.0.mg/l 吲哚乙酸0.2mg/l 萘乙酸naa0.1mg/l
[0090]
将基本培养基组分以及氯吡脲、多氯苯甲酸、吲哚乙酸、萘乙酸称量好后,倒进容量瓶,加水配制成1l溶液,增殖培养基、生根培养基均依此方法配制。
[0091]
增殖培养基:基本培养基 氯吡脲0.5mg/l 多氯苯甲酸0.2.mg/l 吲哚乙酸0.1mg/l 萘乙酸0.1mg/l
[0092]
生根培养基:1/2基本培养基 吲哚乙酸0.2mg/l 萘乙酸naa0.1mg/l
[0093]
3、培养方法
[0094]
材料处理与初代培养:将玫瑰枝条剪成带1~2叶节的小段,放进烧杯中,用少许洗衣粉加水振荡洗涤3分钟,流水冲洗60分钟。取出材料转入瓶口小的玻璃瓶,倒入75%酒精浸泡10秒,无菌水洗后,倒入无菌水摇晃几下立即倒掉水分,加入2%次氯酸钠振荡浸泡15分钟,无菌水振荡洗涤5次,每次5分钟,取出材料接种在灭菌诱导培养基上。培养7天腋芽萌发生长,15~20天后,腋芽周围分化出5~7个丛生芽。分化率96%。
[0095]
增殖培养:丛生芽苗生长到1.5~2.0公分,将芽分切成单苗,转接在增殖培养基上培养,15~20天,小苗生长到5~7左右,再将其切成带1~2片叶的茎段,转入新鲜培值培养基中继代增殖培养,3~4周继代一次,增殖3~6倍。
[0096]
生根培养:将继代增殖的无根苗切成2公分长的茎段,转入生根培养基中10天长出2~5条不定根,生根率97%。
[0097]
对比例1
[0098]
实验材料:月季
[0099]
一、配制培养基
[0100]
以应用最多最广的ms为基本培养基和非洲菊培养基,6-ba和iba作为细胞分裂素和生长素与实施例1培养基进行对比试验。
[0101]
诱导培养,按相同的方法对材料进行表面消毒处理后,将月季茎段接种在ms 6-ba2.0
㎎
/l iba0.1
㎎
/l诱导培养基上,在相同的培养条件下培养,20天腋芽才开始萌发生长,25天以后才有1~3个丛生芽长出来,分化率80%。
[0102]
增殖培养:将芽分切成单苗,转接在增殖培养基上培养ms 6-ba2.5
㎎
/l iba0.2
㎎
/l,在相同的培养条件下培养,20~25天小苗才生长到3~5公分,再将其切成带1~2片叶的茎段,转入新鲜培值培养基中继代增殖培养,5~6周才能继代一次,增殖倍数2~3倍。
[0103]
生根培养:将继代增殖的无根苗切成2公分长的茎段,转入生根培养基1/2ms iba0.5
㎎
/l中,在相同的培养条件下培养,25天长出1~3条不定根,生根率85%。
[0104]
对比例2
[0105]
实验材料:山茶花
[0106]
以应用最多最广的ms为基本培养基和非洲菊培养基,6-ba和iba作为细胞分裂素和生长素与实施例2培养基进行对比试验。
[0107]
诱导培养,将山茶花茎段接种在ms 6-ba2.0
㎎
/l iba0.1
㎎
/l诱导培养基上,在相同培养条件下培养,20天腋芽开始萌发生长,25天以后有1~3个丛生芽长出来。分化率52%。
[0108]
增殖培养基:将芽分切成单苗,转接在增殖培养基上培养ms 6-ba2.5
㎎
/l iba0.2
㎎
/l,20~25天小苗生长到3~5公分,再将其切成带1~2片叶的茎段,转入新鲜培值培养基中继代增殖培养,6~7周才能继代一次,增殖2~4倍。
[0109]
生根培养基:将继代增殖的无根苗切成2公分长的茎段,转入生根培养基1/2ms iba0.5
㎎
/l中,25天长出1~3条不定根,生根率72%。
[0110]
对比例3
[0111]
实验材料:玫瑰
[0112]
以应用最多最广的ms为基本培养基和非洲菊培养基作对照:
[0113]
诱导培养,将玫瑰茎段接种在ms 6-ba2.0
㎎
/l iba0.1
㎎
/l诱导培养基上培养20天腋芽才开始萌发生长,25天以后1~3个丛生芽长出来,分化率56%。
[0114]
增殖培养基:将芽分切成单苗,转接在增殖培养基上培养ms 6-ba2.5
㎎
/l iba0.2
㎎
/l,20~25天小苗才生长到3~5公分左右,再将其切成带1~2片叶的茎段,转入新鲜培值培养基中继代增殖培养,6~7周继代一次,增殖2~4倍。
[0115]
生根培养基:将继代增殖的无根苗切成2公分长的茎段,转入生根培养基1/2ms iba0.5
㎎
/l中,25天长出1~3条不定根,生根率75%。
[0116]
对比例1~3中非洲菊培养基的配方为:
[0117]
初代培养基成分为a培养基、6-糠基氨基嘌呤、腺嘌呤、吲哚丁酸,加入后6-糠基氨基嘌呤5
㎎
/l,腺嘌呤2
㎎
/l,吲哚丁酸2
㎎
/l;
[0118]
继代培养基成分为a培养基、6-糠基氨基嘌呤、腺嘌呤、吲哚丁酸,加入后6-糠基氨基嘌呤3-5
㎎
/l、腺嘌呤1-2
㎎
/l、吲哚丁酸1.5-2
㎎
/l;所述生根培养基成分为b培养基、吲哚丁酸,加入后吲哚丁酸5
㎎
/l;
[0119]
a培养基成分为:硝酸钾100
㎎
/l、氯化钾50
㎎
/l、四水硝酸钙300
㎎
/l、七水硫酸镁750
㎎
/l、硫酸钠200
㎎
/l、磷酸二氢钠20
㎎
/l、四水硫酸锰7
㎎
/l、硫酸亚铁2.5
㎎
/l、七水硫酸锌3
㎎
/l、硼酸1.5
㎎
/l、碘化钾0.7
㎎
/l、烟酸0.5
㎎
/l、盐酸吡哆醇0.3
㎎
/l、盐酸硫胺素0.1
㎎
/l、甘氨酸10
㎎
/l、葡萄糖50g/l、琼脂粉10g/l;
[0120]
所述的b培养基各组分与a培养基一致,但各组分浓度为a培养基的1/2。
[0121]
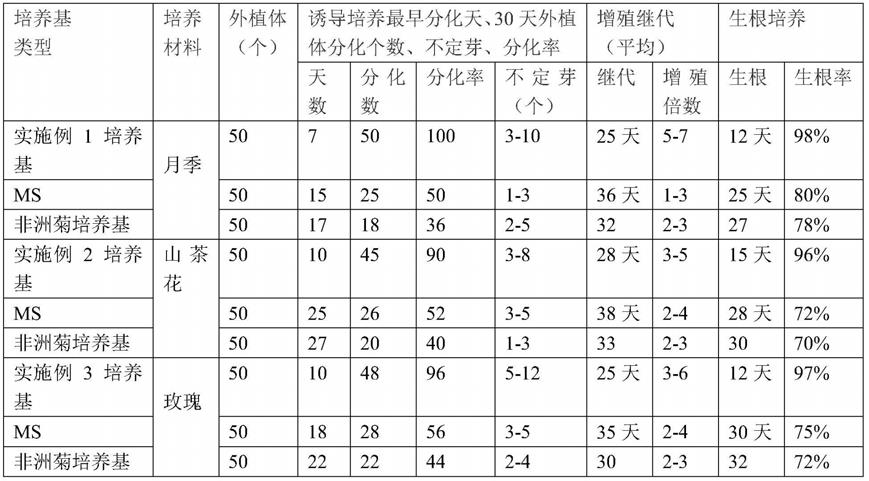
实施例1~3、对比例1~3中木本植物的生长情况如下表:
[0122]
本培养基实施例与ms培养基对比例试验结果统计
[0123][0124]
由上表可以看出,几种木本花卉植物的对比试验结果表明,本培养基在诱导、继代增殖、生根培养的效果均优于ms培养基。
[0125]
本基本培养基在月季的诱导分化100%、增殖5~7倍、生根为98%,均优于ms的诱导分化50%、增殖1~3倍、生根80%,优于非洲菊培养基的40%、增殖2~3倍、生根78%。
[0126]
山茶花的诱导分化96%、增殖3~5倍、生根96%,均优于ms的诱导分化52%、增殖2~3倍、生根72%,优于非洲菊培养基的36%、增殖1~3倍、生根70%。
[0127]
玫瑰的诱导分化96%、增殖3~6倍、生根97%,均优于ms的诱导分化56%、增殖2~4倍、生根75%,优于非洲菊培养基的44%、增殖2~4倍、生根72%。
[0128]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。