用于产生肝细胞的方法和组合物
1.相关申请的交叉引用
2.本技术要求于2019年7月26日提交的美国临时申请第62/879,142号和于2020年3月26日提交的美国临时申请第63/000,169号的权益,所述美国临时申请的公开内容通过引用以其整体并入本文。
技术领域
3.本公开属于人肝细胞领域,包含产生肝细胞并且使用这些肝细胞以用于临床用途的方法。
背景技术:
4.人肝细胞在临床前药物开发期间被制药行业广泛使用。事实上,其用途是由fda规定的,作为药物开发的一部分。对于药物代谢和其它研究,通常从尸体器官供体中分离肝细胞,然后将所述肝细胞运送到将进行测试的位置。来自尸体来源的肝细胞的状况(活力和分化状态)变化很大,并且许多细胞制剂质量较差。高质量人肝细胞的可获得性由于其无法在组织培养中扩增的事实而进一步受到阻碍(runge等人(2000)《生物化学与生物物理研究通讯(biochem.biophys.res.commun.)》274:1-3;cascio等人(2001)《器官(organs)》25:529-538)。铺板之后,细胞存活但不分裂,并迅速丧失代谢功能。来自如小鼠等容易获得的哺乳动物物种的肝细胞不适合于药物测试,因为其不同程度地补充代谢酶,并且在诱导研究中的反应也不同。永生的人肝脏细胞(肝癌)或胎儿成肝细胞也不能充分替代完全分化的成体细胞。人肝细胞对于微生物学领域的研究也是必要的。许多人类病毒,如引起肝炎的病毒,不能在任何其它细胞类型中复制。
5.目前,原位肝移植仍然是针对肝脏疾病的唯一可用的根治治疗。然而,此治疗由于难以获得高质量肝脏而受到严重限制。人肝细胞在培养中不能显著扩增。衍生自培养中的干细胞的肝细胞是不成熟的,并且通常缺乏完整的功能。因此,当今使用的所有肝细胞都衍生自人类供体,或是尸体样本或是外科手术标本,这显著限制了肝细胞的可获得性。最近,已经描述了使用动物来扩增肝细胞(动物作为体内生物反应器),包含缺乏fah、rag-1或rag-2以及il-2rγ(fah-/-、rag1-/-或rag2-/-、il2rg-/-[frg])的遗传性酪氨酸血症1型的动物模型。参见,例如,美国专利第8,569,573号(小鼠);美国专利第9,000,257号(猪)和美国专利公开第20160249591号(大鼠)。然而,目前移植到这些动物生物反应器中的肝细胞中的仅大约至多15%能够在移植后存活和植入(在宿主肝脏中再殖)。此外,这些fah缺乏的动物需要用ntbc(2-硝基-4-三氟-甲基-苯甲酰基)-1,3环己二酮,也被称为尼替西酮(nitisinone))进行治疗,以阻断酪氨酸分解代谢通路,以防止富马酰乙酰乙酸盐累积。由于充分表征的功能性肝细胞的产率低,迄今为止,尚未报道使用生物反应器扩增的人肝细胞进行的人类移植。
技术实现要素:
[0006]
本文公开了用于增强移植到体内生物反应器中的人肝细胞的再殖、植入、存活和/或扩增的方法和组合物。本文还描述了用于各种用途的所分离的这些经扩增的肝细胞的群体,包含但不限于用于治疗和/或预防人类受试者的肝脏疾病。
[0007]
在一个方面,本文描述了一种产生肝细胞的方法,所述方法包括:向活的动物施用产生肝细胞的离体操纵的细胞(例如,干细胞、肝细胞祖细胞、肝细胞样细胞、成熟或幼年肝细胞等),使得产生肝细胞的细胞在动物体内扩增;以及从动物中分离扩增的肝细胞。在某些实施例中,所述离体操纵包括:用促进肝细胞的健康、生长、再生、存活和/或植入的至少一种药剂对所分离的产生肝细胞的细胞(例如,人肝细胞)进行处理(温育);以及将经处理的细胞移植(通过注射到脾脏或肝脏中)到任何合适的动物生物反应器中(例如,经基因修饰的动物,包含但不限于fah缺乏的动物,如猪或啮齿动物)。在某些实施例中,对细胞进行处理的至少一种药剂包括抗体,例如至少一种c-met(也被称为酪氨酸-蛋白激酶met或肝细胞生长因子受体)和/或表皮生长因子(egfr)抗体,所述抗体可能对人类细胞具有特异性,或者可以与两种或更多种物种交叉反应。在某些实施例中,在动物生物反应器中实现了大于10%、大于15%、40%或更大、50%或更大、70%或更大、75%或更大、80%或更大、85%或更大以及90%或更大的再殖率。在某些实施例中,衍生自经移植的细胞的肝脏细胞与内源性肝脏细胞的比率为1:1、2:1、3:1或更大,包含但不限于例如1:1或更大、2:1或更大、3:1或更大、4:1或更大、5:1或更大、6:1或更大、7:1或更大、8:1或更大、9:1或更大10:1或更大等。在某些实施例中,在将经处理的细胞移植到动物生物反应器中之后获得的再殖的细胞比衍生自未经处理的细胞的移植的细胞更健康(如通过任何合适的定性或定量测定测量的)。在某些实施例中,再殖是在数周(例如,2-16周、2-14周或2-12周或其间的任何时间)、数月(1到12个月或其间的任何时间)或数年(1到5年或更多)内实现的。在某些实施例中,再殖率是在实现在移植之前(和/或之后)未用促进肝细胞生长、再生、存活和/或植入的至少一种药剂(例如,一种或多种c-met和/或egfr抗体)对产生肝细胞的细胞进行处理的速率之前数周(例如,2-16周、2-14周或2-12周或其间的任何时间)实现的。
[0008]
在离体操纵的方法中的任何方法中,可以从商业来源获得或从活的受试者或尸体中分离产生肝细胞的细胞(例如,干细胞、肝细胞祖细胞、肝细胞样细胞、成熟或幼年肝细胞)。另外,可以在任何培养基中培养产生肝细胞的细胞,在一些实施例中,所述培养基包括1:1混合完成的hbm肝细胞基础培养基和hcm single
tm quots
tm 试剂盒(龙沙公司(lonza))、5%fbs和10um rock抑制剂。
[0009]
在某些方面,如本文所述的产生肝细胞的细胞的离体操纵包括:向所培养的肝细胞添加促进肝细胞生长、再生、存活和/或植入的至少一种药剂(例如,一种或多种c-met抗体);以及将肝细胞与药剂的混合物一起温育一定时间段,所述时间段包含,例如,1分钟到2天(或其间的任何时间)、1到24小时(或其间的任何时间)、1到4小时(或其间的任何时间)等。在某些实施例中,细胞(例如,肝细胞)和药剂(例如,c-met和/或egfr抗体)一起温育1小时,任选地在温育期间在摇动的情况下温育,这可以帮助最大化肝细胞对药剂的暴露。
[0010]
在本文所述的方法中的任何方法中,收集离体操纵的产生肝细胞的细胞并向合适的动物生物反应器施用所述细胞以进行扩增。在某些实施例中,所述动物生物反应器包括经基因修饰的动物,例如一个或多个基因靶标被重组修饰,包含,例如,一个或多个基因靶
标被敲除和/或敲低的动物。在某些实施例中,动物生物反应器中的多个基因被修饰(例如,敲低和/或激活)。在某些实施例中,动物生物反应器包括导致延胡索酰乙酰乙酸水解酶(fah)的产生或功能缺乏的基因修饰。这种动物可以被称为fah缺乏的动物(包含但不限于,例如frg动物,如大鼠、小鼠或猪)。fah缺乏症不一定需要对fah基因座进行基因修饰。例如,在一些实施例中,动物生物反应器包括修饰fah基因表达的基因被修饰的经基因修饰的动物,其中所述经修饰的基因不是fah基因,例如fah上游的修饰fah表达的基因。可以使用任何合适的方式将产生肝细胞的细胞引入(移植、注射、植入等)到生物反应器中,任选地通过脾内注射、门静脉内注射或直接注射到动物生物反应器的肝脏中。在某些实施例中,将产生肝细胞的细胞移植到frg猪、大鼠或小鼠体内。在一些情况下,包括经处理的细胞的动物可以在扩增时间段期间循环接通/断开ntbc。用至少一种药剂(例如,抗体)处理的所移植的产生肝细胞的细胞可以表现出,与移植有未经处理的肝细胞(即,未进行如本文所述的离体操纵的肝细胞)的动物相比,在动物生物反应器中的存活和/或植入增加(例如,10%、20%、30%、40%、50%、60%、70%、80%、90%或更多),或与未进行移植的动物相比再殖率增加。与未经处理的肝细胞的移植相比,植入和存活的增加减少了所植入的细胞在动物生物反应器中达到给定再殖百分比所需的细胞周期/细胞分裂的次数。不受理论的束缚,在经历较少细胞周期/细胞分裂的一些肝细胞中可以是或可以产生更健康、更稳定和/或更持久的肝细胞的后代,例如在遗传上更稳定和/或更持久。可以采用细胞健康、稳定性和/或持久性的各种量度来定量或定性地显示这种增加的稳定性和/或持久性(例如,经扩增的肝细胞表现出更长的端粒长度、细胞增殖测定等)。
[0011]
在某些实施例中,使离体操纵的产生肝细胞的细胞在动物生物反应器中扩增14-112天或28-112天的时间段(2周或4周到16周)或其间的任何时间,任选地14-56天或28-56天(2周或4周到8周),并且在此之后收获(收集)所述细胞。在某些实施例中,在移植到动物生物反应器中8周时收获在动物生物反应器中产生的肝细胞,所述肝细胞在动物体内扩增(再殖)到动物的总肝细胞群体的多于50%、多于60%、多于70%或介于80%与100%之间。在一些情况下,在8周时收获消除了可能会使动物有显著压力的另外的ntbc循环和长ntbc断开周期(14或21天)的需要。不受理论的束缚,在一些情况下,通过省略长ntbc断开周期,可以改善动物生物反应器的健康以及因此产生的肝细胞(例如,人肝细胞)的健康、数量、质量、稳定性和/或持久性。
[0012]
在某些实施例中,将原代人肝细胞施用于(移植到)动物(例如,大鼠、小鼠、猪、兔等)生物反应器,并且实现了动物的肝脏的至少40%再殖(例如,利用ntbc循环),任选地到施用后4-16周得以实现。由frg动物肝脏纯化的再殖的人肝细胞表现出在体外成熟的肝功能和强大的体内效力,包含在移植到frg动物(例如,小鼠、大鼠、猪、兔等)体内之后在体内的高效植入和扩增。因此,本文所述的frg动物生物反应器产生适合于移植到患者体内的高质量原代人肝细胞,由此为患有肝脏疾病的受试者提供治疗益处(以及肝移植的替代方案)。
[0013]
在另一方面,本文所述的方法中的任何方法可以进一步包括对从动物生物反应器收集的经扩增的肝细胞进行离体操纵,例如用促进肝细胞生长、再生、存活和/或植入的至少一种药剂,任选地一种或多种c-met抗体培养(温育)经扩增的肝细胞。另外的离体操纵还可以包括使用已知技术将一种或多种基因修饰引入到肝细胞。
[0014]
在又另一方面,本文所述的方法中的任何方法可以进一步包括重复所述步骤一次或多次,例如以通过引入从动物生物反应器收集的肝细胞来进行连续移植并经受进一步离体操纵进入同一动物生物反应器或不同的动物生物反应器中以供进一步扩增。所述方法的步骤可以重复1次、2次、3次、4次或更多次。
[0015]
在另一方面,本文描述了一种治疗和/或预防有需要的受试者的一种或多种肝脏疾病或病症的方法,所述方法包括向有需要的受试者施用经扩增的肝细胞(从动物收集并且进行或不进行另外的离体操纵)。在某些实施例中,将使用表示总肝脏肝细胞的细胞质量的大约1%到25%的1
×
107到5
×
108个细胞/kg以供在临床进行移植以用于多种人类肝脏疾病,所述人类肝脏疾病包含但不限于慢性肝脏疾病,如肝硬化、酒精性肝炎、肝性脑病、急性加慢性肝脏衰竭(aclf)、药物或中毒诱导的肝脏衰竭和/或一种或多种先天性代谢性肝脏疾病。
[0016]
在另一方面,本文描述了一种动物生物反应器,其包括如本文所述的离体操纵的肝细胞。在某些实施例中,所述动物生物反应器是fah缺乏的动物(例如大鼠、小鼠或猪)。在某些实施例中,包括肝细胞的动物生物反应器经受用ntbc进行的处理(例如,ntbc循环)。ntbc断开周期提供了fah缺乏的动物体内的选择压力,并且有利于所植入的人肝细胞的再殖(植入、存活和/或扩增)。在某些实施例中,通过在所述动物生物反应器中植入、存活和/或扩增的离体操纵的肝细胞在动物生物反应器中实现了多于50%、多于60%、多于70%或介于80%与100%之间的人肝细胞再殖率。在某些实施例中,到8-16周(或其间的任何值)时实现了多于50-70%的人肝细胞再殖,例如到8-12周(或其间的任何值)时实现了70%再殖。参见例如图3b。
[0017]
在另一方面,本文描述了一种使用本文描述的方法产生的肝细胞的群体。在某些实施例中,经扩增的肝细胞的所述群体包括从施用了如本文所述的离体处理(例如,用本文所述的至少一种药剂)的肝细胞的动物生物反应器中分离的肝细胞(例如,人肝细胞)。所分离的包括如本文所述的经扩增的肝细胞的群体可以用于离体治疗受试者的肝脏疾病和/或可以在用作离体处理之前被进一步离体操纵(例如,通过本文描述的另外轮的方法)。可以任选地用一种或多种药剂(例如,本文所述的一种或多种药剂)对包括肝细胞的群体的生物反应器和/或受试者进行进一步处理以进一步增强细胞在生物反应器和/或受试者体内的植入和/或扩增。在某些实施例中,任选地将一种或多种c-met抗体(激动剂)与本文处理的肝细胞依序(以任何次序)和/或同时施用于生物反应器和/或受试者。
[0018]
在仍另外的方面,本文提供了一种使肝细胞在人类受试者体内扩增的方法,所述方法包括向所述受试者施用在如本文所述的动物生物反应器中产生的人肝细胞。在某些实施例中,所述肝细胞(包含包括如本文所述的肝细胞的组合物)是通过门静脉输注施用的。在一些情况下,肝细胞可以通过脐部静脉输注、直接脾被膜注射、脾动脉输注或腹膜内注射施用。如本文所述获得的肝细胞在施用于所述受试者之前可以包封或可以不包封。在本文所述的方法中的任何方法中,本文所述的肝细胞比通过其它方法产生的肝细胞更高效地在受试者体内植入、存活和/或扩增,其中至多10%到15%的肝细胞体内移植植入。在某些实施例中,移植到患者体内的多于5%-50%(或其之间的任何值)、多于60%、多于70%或介于80%与100%之间的肝细胞随着时间的推移在患者体内植入、存活和/或扩增。在一些情况下,本文所述的肝细胞在受试者体内更高效地植入、存活和/或扩增,例如比其它方法多至
少1.1倍,包含例如多至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2倍或至少2.5倍。在一些情况下,本文所述的肝细胞在受试者体内更高效地植入、存活和/或扩增,例如比其它方法高效至少10%,包含例如高效至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%或至少150%。在本文所述的方法中的任何方法中,在施用于受试者后,在任何时间段(包含但不限于2-16周、2-14周、2-12周、1-12个月或一年以上),如本文所述的肝细胞包括受试者的肝脏中的细胞的总数的至少5%、至少10%或更多。
[0019]
在又另一方面,本文提供了一种治疗和/或预防有需要的人类受试者的肝脏疾病的方法,所述方法包括向所述受试者施用如所述的经扩增的人肝细胞的群体。因此,本文所述的方法可以用于临床中的通过提供健康的肝细胞且作为独立疗法的肝细胞疗法,与使用新鲜或冷冻保存的肝细胞的当前方法相比,所述肝细胞疗法由于增强的植入和/或再殖特征而产生了更高效的疾病治疗和/或预防。施用可以通过任何合适的方式进行,包含但不限于静脉内(例如,门静脉)、腹膜内、到网膜囊中、移植和/或植入到一个或多个器官或组织(例如,肝脏、脾脏、淋巴结等)。
[0020]
在涉及受试者的本文所述的方法中的任何方法中,所述方法可以进一步包括施用促进肝细胞在受试者体内生长、再生、存活和/或植入的一种或多种药剂(例如,抗体、小分子、核酸(dna和/或rna)等)。在某些实施例中,至少一种药剂包括c-met抗体,任选地人特定的抗体。一种或多种药剂可以施用一次、两次或更多次并且可以与肝细胞一起施用和/或在与肝细胞不同的时间施用。
[0021]
此外,涉及向受试者施用经扩增的肝细胞的离体方法中的任何离体方法可以进一步包括重复所述方法的一个或多个步骤,包含例如以任何时间间隔重复施用(2次、3次、4次、5次、6次、7次或更多次施用)如本文所述的经扩增的肝细胞。
[0022]
可以通过本文所述的方法和组合物治疗的疾病和病症包含但不限于:克里格勒-纳贾尔综合征(crigler
–
najjar syndrome)1型;家族性高胆固醇血症;因子vii缺乏症;因子viii缺乏症(a型血友病);苯丙酮尿症(pku);糖原贮积病i型;小儿雷弗素姆氏病(infantile refsum'sdisease);进行性家族性肝内胆汁淤积症2型;遗传性酪氨酸血症1型;以及各种尿素循环缺陷;急性肝脏衰竭,包含患有急性药物诱导的肝脏衰竭的幼年和成人患者;病毒诱导的急性肝脏衰竭;特发性急性肝脏衰竭;蘑菇中毒诱导的急性肝脏衰竭;外科手术后急性肝脏衰竭;由妊娠期急性脂肪肝诱导的急性肝脏衰竭;慢性肝脏疾病,包含肝硬化;由以下急性事件之一引起的急性加慢性肝脏疾病:酒精消耗、药物摄入和/或乙型肝炎发作。可以使用本文所述的方法和组合物治疗和/或预防的肝脏疾病因此包含在移植到内源性肝细胞受损/患病的肝脏中之后所移植的(所操纵的)细胞未受损伤或预期未受损伤的肝脏疾病(也被称为“内源性肝脏疾病”)以及所移植的(所操纵的)细胞和内源性肝细胞可能经受例如由外在因素引起的损伤/疾病或受损伤/疾病影响的肝脏疾病(也被称为“外源性肝脏疾病”)两者。
[0023]
本文描述了产生肝细胞的方法,所述方法包括:通过使产生肝细胞的细胞离体与促进生长、再生、存活和/或植入的至少一种药剂(例如,与如c-met和/或egfr等生长因子受体特异性结合的激动剂,任选地小分子或抗体)接触来操纵产生肝细胞的细胞(例如,原代人肝细胞);在适合于植入的条件下将离体操纵的细胞移植到体内生物反应器中;将体内生
物反应器维持在适合于使所植入的细胞在生物反应器中扩增到经扩增的肝细胞群体的条件下,任选地与缺乏离体操纵的对应方法相比,将经扩增的细胞的植入和/或再殖效率增加至少10%。在某些实施例中,产生肝细胞的细胞和至少一种药剂被容纳在器皿内并且温育包括搅动所述器皿,任选地其中所述搅动包括摇动。本文所述的方法中的任何方法可以进一步包括在移植之前从离体操纵的细胞中分离至少一种药剂,例如通过去除至少一种药剂和/或分离离体操纵的细胞,任选地通过离心和/或抽吸。本文所述的方法中的任何方法可以进一步包括分离经扩增的肝细胞(例如,从生物反应器中)。在本文所述的方法中的任何方法中,所植入的细胞被扩增约2周到16周的任何时间段。在本文所述的方法中的任何方法中,经扩增的肝细胞占体内生物反应器的总肝细胞群体的至少50%。体内生物反应器可以是哺乳动物并且任选地可以患有内源性肝脏损伤和/或可以是免疫抑制的,任选地是包括fah缺乏症、il-2rγ缺乏症、rag1缺乏症、rag2缺乏症或其任何组合的小鼠、大鼠或猪生物反应器(例如,包括fah、rag1和/或rag2以及il-2rγ缺乏症(frg)的啮齿动物或猪)。
[0024]
在又另一方面,本文描述了治疗受试者的肝脏疾病的方法,所述方法包括:以有效在体内植入和扩增的量向所述受试者施用产生肝细胞的离体操纵的细胞,由此治疗受试者的所述肝脏疾病。所述离体操纵的细胞是通过本文所述的任何方法或系统产生的,例如通过将产生肝细胞的细胞与促进生长、再生、存活和/或植入的至少一种药剂一起温育并且在施用于所述受试者之前使所述离体操纵的细胞在体内生物反应器中扩增。可以治疗的肝脏疾病包含但不必限于遗传性病症、肝脏衰竭、由酶缺乏症引起的肝脏疾病,其包含但不限于:肝硬化;急性加慢性肝脏衰竭(aclf);药物或中毒诱导的肝脏衰竭;先天性代谢性肝脏疾病;克里格勒-纳贾尔综合征1型;家族性高胆固醇血症;因子vii缺乏症;因子viii缺乏症(a型血友病);苯丙酮尿症(pku);糖原贮积病i型;小儿雷弗素姆氏病;进行性家族性肝内胆汁淤积症2型;遗传性酪氨酸血症1型;尿素循环缺陷;急性肝脏衰竭;急性药物诱导的肝脏衰竭;病毒诱导的急性肝脏衰竭;特发性急性肝脏衰竭;蘑菇中毒诱导的急性肝脏衰竭;外科手术后急性肝脏衰竭;由妊娠期急性脂肪肝诱导的急性肝脏衰竭;慢性肝脏疾病,包含酒精性肝炎、肝性脑病、肝硬化;和/或由酒精消耗、药物摄入引起的急性加慢性肝脏疾病和/或乙型肝炎发作。本文所述的方法中的任何方法可以使受试者的存活期延长,任选与未施用离体操纵的细胞,任选地未如本文所述进行离体操纵的所施用的细胞的相当的受试者的存活期相比。
[0025]
还提供了如本文所述的细胞(例如,细胞的群体和包括这些细胞的组合物),包含通过如本文所述的用于治疗肝脏疾病的方法中的任何方法,包含在用于治疗一种或多种肝脏疾病的药物的制备中产生的细胞(以及含有这些细胞的组合物)的用途,所述一种或多种肝脏疾病包含但不限于遗传性病症、肝脏衰竭、由酶缺乏症引起的肝脏疾病,如:肝硬化;急性加慢性肝脏衰竭(aclf);药物或中毒诱导的肝脏衰竭;先天性代谢性肝脏疾病;克里格勒-纳贾尔综合征1型;家族性高胆固醇血症;因子vii缺乏症;因子viii缺乏症(a型血友病);苯丙酮尿症(pku);糖原贮积病i型;小儿雷弗素姆氏病;进行性家族性肝内胆汁淤积症2型;遗传性酪氨酸血症1型;尿素循环缺陷;急性肝脏衰竭;急性药物诱导的肝脏衰竭;病毒诱导的急性肝脏衰竭;特发性急性肝脏衰竭;蘑菇中毒诱导的急性肝脏衰竭;外科手术后急性肝脏衰竭;由妊娠期急性脂肪肝诱导的急性肝脏衰竭;慢性肝脏疾病,包含酒精性肝炎、肝性脑病、肝硬化;和/或由酒精消耗、药物摄入引起的急性加慢性肝脏疾病和/或乙型肝炎
发作。
[0026]
在又另一方面,本文提供了一种试剂盒,其包括产生肝细胞的细胞(例如,人肝细胞)和/或促进肝细胞生长、再生、存活和/或植入的至少一种药剂,所述试剂盒任选地包括说明书,所述说明书用于执行本公开的方法并且产生本文所述的组合物。在某些实施例中,肝细胞是如本文所述的经扩增的肝细胞。
[0027]
根据公开作为整体,这些和其它方面对于本领域技术人员来说将是显而易见的。
附图说明
[0028]
图1是根据lee等人(2015)《免疫靶标和疗法(immunotargets ther.)》4:35-44调整的示意图,其描绘了hgf/c-met信号传导通路。附图中使用的缩写如下:“akt”是指ak品系转化;蛋白激酶b;“c-met”是指间充质-上皮转变因子;肝细胞生长因子受体;“grb2”是指生长因子受体结合蛋白2;“gab1”是指grb2相关结合蛋白1;“hgf”是指肝细胞生长因子;“mtor”是指雷帕霉素(rapamycin)的哺乳动物靶标;“mapk”是指丝裂原活化蛋白激酶;“pi3k”是指磷脂酰肌醇-4,5-二磷酸3-激酶;“stat3”是指信号转导子和转录激活因子3。
[0029]
图2a到图2f描绘了用c-met激动剂抗体对原代人肝细胞(phh)进行离体操纵,从而使在frg小鼠体内植入和扩增的水平增加。图2a显示了在进行(空心圆圈)或不进行(阴影圆圈)c-met抗体操纵的情况下移植原代人肝细胞之后1周frg小鼠肝脏中fah阳性(fah )人肝细胞的百分比。每个数据点表示单个动物。图2b显示了移植后1周指定条件的frg小鼠肝脏的fah免疫组织化学成像的实例。在2周时仅在移植有经c-met抗体处理的肝细胞的肝脏中观察到fah 人肝细胞的双峰。左边的图像显示了移植了未用c-met抗体处理的细胞(“无ab对照”)后的结果,右边的图像显示了移植了用c-met抗体处理的细胞(“c-met ab”)后的结果。图2c显示了在用(空心圆圈)或不用(阴影圆圈)c-met抗体处理的细胞的移植后2周frg小鼠体内的fah阳性人肝细胞(上图)和在血液中测得的人白蛋白水平(下图)的百分比。每个数据点表示单个动物。图2d显示了移植后2周指定条件的frg小鼠肝脏的fah免疫组织化学的实例。图2e显示了移植后4周frg小鼠体内的fah阳性人肝细胞(上图)和在血液中测得的人白蛋白水平(下图)的百分比。每个数据点表示单个动物(阴影圆圈描绘了接受未用c-met抗体处理的细胞的对照动物,并且空心方块描绘了接受用c-met抗体处理的细胞的动物)。图2f显示了移植后4周施用了指定条件的细胞的frg小鼠肝脏的fah免疫组织化学的实例。顶部图像显示了移植了未用c-met抗体处理的细胞(“无ab对照”)后的结果,并且底部图像显示了移植了用c-met抗体处理的细胞(“c-met ab”)后的结果。
[0030]
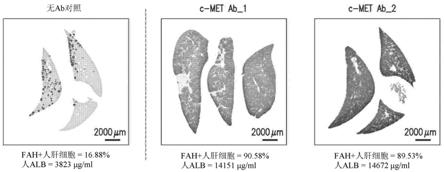
图3描绘了用c-met激动剂抗体对原代人肝细胞进行离体操纵,这使在frg小鼠体内再殖的水平增加。frg小鼠体内的肝细胞产生的当前方法涉及移植后的细胞植入的水平,这对应于小于约1%的肝脏再殖(例如,移植后4周约20-50μg/ml的人白蛋白(halb)以及约8周之后约1-5%肝脏再殖(例如,200-500μg/ml halb)。已观察到frg小鼠达到约20-95%的肝脏再殖(例如,2000-5000 μg/ml halb);然而,此范围通常是在约12 周之后才能获得。图3通过取自施用了如所指示的进行处理的细胞的小鼠的肝脏切片的示例性fah免疫组织化学显示了在移植后8周时frg小鼠肝脏中的fah 人肝细胞再殖。为了进行比较,左图(“无ab对照”)显示了移植有在移植前使用当前方法处理(即,未进行如本文所述的离体操纵)的人肝细胞的frg小鼠肝脏。中间图(“c-met ab_1”)和右侧(“c-met ab_2”)图显示了移植有在
如本文所述的移植前离体操纵的人肝细胞的frg小鼠肝脏的结果。具体地,用所指示的两种不同的c-met激动剂抗体之一(即,“ab_1”或“ab_2”)对肝细胞进行处理。下面的每个图还显示了在小鼠肝脏中再殖的fah 人肝细胞的百分比(通过ihc评估)和在血液中测得的人白蛋白水平(通过elisa)。如所示出的,与接受未进行本文所述的离体操纵的肝细胞的动物体内的小于约17%的再殖相比,如本文所述的肝细胞的离体操纵在移植了肝细胞的情况下产生了约90%的再殖。还显示了与接受未用c-met抗体处理的肝细胞的对照动物相比,接受离体操纵的肝细胞的动物体内的人白蛋白水平显著增加。
[0031]
图4显示了描绘了用egfr激动剂抗体对原代人肝细胞进行的离体操纵使在frg小鼠体内植入和扩增的水平增加的图。经受或未经受(如所指示的)用如本文所述的egfr激动剂抗体进行的离体操纵的人肝细胞的移植后4周(左图)和8周(右图)frg小鼠体内的从血液中测得的人白蛋白水平。每个图显示了移植了未用egfr抗体处理的细胞(“无ab对照”)后的结果以及移植了用egfr抗体处理的细胞(“egfr ab”)后的结果。每个数据点表示单个动物。
[0032]
图5显示了用c-met和egfr激动剂抗体两者对原代人肝细胞进行的离体操纵使在frg小鼠体内植入和扩增的水平增加。提供了移植后2周:在移植有未用抗体处理的人肝细胞的frg小鼠(标记为“无ab对照”的阴影圆圈)中,fah阳性人肝细胞(左图)和在血液中测得的人白蛋白水平(右图)的百分比;仅用单独的c-met抗体离体操纵的人肝细胞(标记为“c-met ab”的空心圆圈);或c-met和egfr抗体(带有标记为“c-met egfr ab”的虚线边框的空心圆圈)。每个数据点表示单个动物。各组之间的t测试:*p《0.05;**p《0.01。
[0033]
图6是描绘了在啮齿动物(例如,小鼠或大鼠)生物反应器中对如本文所述的肝细胞进行的示例性离体操纵的示意图。如所示出的,可以在移植到啮齿动物生物反应器之前和/或之后对人肝细胞进行离体操纵。在生物反应器中扩增后,在一些情况下,可以向受试者,包含例如成人和/或儿科受试者,施用使用经扩增的肝细胞。如所示出的,肝细胞可能会或可能不会连续移植到动物生物反应器中以供进一步扩增(有或没有额外的离体操纵的情况下)。还描绘了可以在向有需要的受试者,如所示出的人类受试者,施用经扩增的肝细胞之前执行或可以不在所述施用之前执行以针对例如肝脏疾病等病状对所述受试者进行治疗的离体操纵。
具体实施方式
[0034]
原位肝脏移植仍然是针对肝脏疾病的唯一根治治疗。肝细胞移植是针对急性和慢性肝脏疾病的潜在替代疗法;然而,获得功能性肝细胞由于难以获得高质量肝脏并且从肝脏中获得的产率低而变得困难。
[0035]
本文公开了出于各种目的产生肝细胞,包含使肝细胞扩增的方法。在一些情况下,本方法提供了适合于移植到有需要的受试者体内的人肝细胞,包含适合于原位肝移植的人肝细胞,的产生和/或扩增。根据本文所述的方法产生的肝细胞,包含人肝细胞,可以在输注之前纯化、冷冻保存和/或广泛表征。在其它用途中,根据本文所述方法产生的肝细胞可以提供针对患有一种或多种严重肝脏疾病的患者的按需疗法。
[0036]
本文还提供了包括根据本文所述的方法产生和/或扩增的肝细胞的组合物。在一些实施例中,本文所述的组合物含有适合于移植到患有一种或多种肝脏病症的患者体内的人肝细胞并且本文所述的方法产生所述人肝细胞。在一些情况下,如本文所述的施用于受
试者的组合物将包含已经离体操纵以增强此类细胞在受试者体内的植入和/或扩增的产生肝细胞的细胞。在一些情况下,如本文所述的施用于受试者的组合物将包含在离体操纵之后已在体内生物反应器中扩增以增强此类细胞在生物反应器内的植入和/或扩增的肝细胞的群体。因此,用于增强植入和/或扩增的离体操纵可以在本文所述的过程中的各个点使用,包含例如在生物反应器中扩增之前、移植到受试者体内之前、在生物反应器中扩增之前和移植到受试者体内之前两者。
[0037]
在一些情况下,本文所述的方法涉及外源性肝细胞在体内生物反应器中扩增,包含其中外源性肝细胞使宿主肝脏再殖,从而实现大于40%、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多或95%或更多的再殖率。在一些情况下,再殖的肝脏(例如,fgr啮齿动物肝脏)可以包括大于80%再殖的肝细胞(包含例如,85%或更大、90%或更大、95%或更多大),而100%再殖将表示具有完全衍生自外源性、所移植的产生肝细胞的细胞的肝细胞群体(即,不含宿主来源的肝细胞)的肝脏。进一步地,在一些实施例中,本文所述的方法比当前方法更快地产生大量的这些人肝细胞,包含到8周时实现40%、60%、80%或更多的再殖率,例如,相比于植入后8周达到低于20%的再殖率的当前方法。因此,本公开提供了一种用于治疗患有肝脏疾病的患者的充分表征的成熟功能性人肝细胞的来源。
[0038]
在一方面,本文公开了用于产生肝细胞的组合物和方法,具体地是在将产生肝细胞的细胞移植到动物生物反应器中之后使人肝细胞扩增的组合物和方法。
[0039]
与目前使用的方案和组合物相比,本公开提供了显著且出乎意料的优点,包含但不限于:(1)显著增强了肝细胞在动物生物反应器(例如,frg动物)中的存活、植入和/或再殖;(2)减少了在动物体内实现最优(70-90%)再殖所需的时间(由此减少与动物设施和/或施用于动物的药剂相关联的成本);(3)减少了移植所需的肝细胞的数量(降低了与获得肝细胞相关联的成本);(4)减少了对动物生物反应器中的ntbc循环的需要(由此改善动物生物反应器的健康和获得的肝细胞的质量);(5)通过减少克隆扩增期间细胞分裂的次数,保留了在生物反应器中扩增的肝细胞的增殖潜力;(6)减少了动物生物反应器所需的细胞纯化的量(例如,通过增加收获时生物反应器中存在的所期望的细胞的百分比);(7)提高了从动物生物反应器中纯化的肝细胞的质量(例如,通过细胞的白蛋白产生水平、测定经纯化的细胞的细胞活力和/或可镀性确定的);和/或(8)通过在反复施用抗体以促进肝脏再生的情况下直接对受试者进行治疗提供了作为针对肝脏疾病的独立抗体疗法的潜力;(9)提供将药剂的离体操纵和体内施用组合以进一步改善生物反应器和临床中人类肝细胞再殖的潜力;和/或(10)改进针对肝脏疾病的其特征在于增加在接受离体操纵的产生肝细胞的细胞的受试者体内的再殖的细胞疗法,从而产生增强的治疗结果。
[0040]
因此,本文描述为离体操纵的方法和组合物可以改进在动物(例如,啮齿动物或猪)生物反应器中的人肝细胞再殖。另外,在从生物反应器中分离后,通过本文所述方法产生的肝细胞表现出增加的功能性和再殖效率,从而在施用于人类受试者以对肝脏疾病进行治疗和/或预防时提供一致的改进。
[0041]
总述
[0042]
除非另有说明,否则本文公开的方法的实践以及组合物的制备和用途采用分子生物学、生物化学、染色质结构和分析、计算化学、细胞培养、重组dna的常规技术,并且相关领
域在本领域的技术人员的范围内。这些技术在文献中进行了充分解释。参见例如sambrook等人《分子克隆:实验手册(molecular cloning:a laboratory manual)》,第二版,冷泉港实验室出版社(cold spring harbor laboratory press),1989以及第三版,2001;ausubel等人,《当代分子生物学实验指南(current protocols in molecular biology)》,(纽约的约翰
·
威利父子出版公司(john wiley&sons,new york),1987以及定期更新);《酶学方法(methods in enzymology)》系列,圣地亚哥的学术出版社(academic press,san diego);以及《分子生物学方法(methods in molecular biology)》,第119卷,“染色质方案(chromatin protocols)”(p.b.becker编辑)托托瓦的胡玛纳出版社(humana press,totowa),1999。
[0043]
定义
[0044]
如本文所用,术语“生物反应器”、“动物生物反应器”和“体内生物反应器”总体上是指引入外源性细胞,如产生肝细胞的细胞以供植入和扩增,从而产生经扩增的细胞的群体和/或其后代,如由所引入的细胞产生的经扩增的肝细胞的群体的活的非人动物。将如产生肝细胞的细胞等外源性细胞引入到生物反应器中总体上将涉及异种移植,因此,所移植的外源性细胞在一些情况下可以被称为异种移植物,例如人对啮齿动物的异种移植物、人对小鼠的异种移植物、人对大鼠的异种移植物、人对猪的异种移植物、小鼠对大鼠的异种移植物、大鼠对小鼠的异种移植物、啮齿动物对猪的异种移植物等。在一些情况下,可以执行到生物反应器中的同种异体移植,例如,啮齿动物对啮齿动物、猪对猪等的同种异体移植。在本文中更详细地讨论的,生物反应器可以被配置成例如在遗传和/或药理学上赋予如所引入的外源性产生肝细胞的细胞等所引入的外源性细胞选择性优势,以促进其植入和/或扩增。在一些情况下,生物反应器可以被配置成防止对所引入的外源性细胞的排斥,包含但不限于例如通过如本文更详细描述的遗传和/或药理学免疫抑制。
[0045]
术语“离体”用于指代在从生物体获得的样品(例如,组织或细胞等)中或上进行的处理、实验和/或测量,所述处理、实验和/或测量是在生物体的外部环境中进行的。因此,如应用于细胞的术语“离体操纵”是指在生物体之外对细胞(例如肝细胞)进行的任何处理,所述处理包含但不限于培养细胞、对细胞进行一种或多种基因修饰和/或在将细胞放回到生物体(例如,动物生物反应器或人类受试者)中时将细胞暴露于促进生长、再生、存活和/或植入的一种或多种试剂。因此,离体操纵在本文中可以用于指代在动物之外执行的对细胞的处理,例如,在从动物或其器官(例如,肝脏)中获得此类细胞之后并且在将此类细胞移植到动物体内,如动物生物反应器或有需要的受试者体内之前。与“离体”相反,由于在受试者体内产生细胞和/或将细胞移植到受试者体内,术语“体内”如本文所用,可以指代动物或其器官内的细胞,例如,受试者或其肝脏内的细胞(例如,肝细胞)。
[0046]
术语“多肽”、“肽”以及“蛋白质”可互换使用以指代氨基酸残基的聚合物。所述术语也适用于其中一个或多个氨基酸是对应天然存在的氨基酸的化学类似物或经修饰的衍生物的氨基酸聚合物。
[0047]
术语“抗体”是指包含基本上由免疫球蛋白基因或免疫球蛋白基因的片段编码的多肽的一种或多种蛋白质(或蛋白质复合物)。所识别的免疫球蛋白基因包含κ、λ、α、γ、δ、ε和μ恒定区基因,以及无数免疫球蛋白可变区基因。轻链被分类为κ或λ。重链被分类为γ、μ、α、δ或ε,这进而分别限定免疫球蛋白类别igg、igm、iga、igd和ige。
[0048]
基本的免疫球蛋白(抗体)结构单元通常是四聚体。每个四聚体由两对相同的多肽链构成,每对具有一个“轻”链(约25kda)和一个“重”链(约50-70kda)。每条链的n末端限定了约100个到110个或更多个氨基酸的主要负责抗原识别的可变区。术语可变轻链(v
l
)和可变重链(vh)分别指代这些轻链和重链。
[0049]
如本文所用,术语“抗体”包含完整的免疫球蛋白以及许多充分表征的片段。例如,与靶蛋白(或蛋白质或融合蛋白内的表位)结合的fab、fv和单链fv(scfv)也将是所述蛋白质(或表位)的特异性结合剂。这些抗体片段定义如下:(1)fab,含有通过用酶木瓜蛋白酶消化整个抗体以得到完整的轻链和一条重链的一部分而产生的抗体分子的单价抗原结合片段的片段;(2)fab',通过用胃蛋白酶对整个抗体进行处理,然后还原以得到完整的轻链和重链的一部分而获得的抗体分子的片段;每抗体分子获得了两个fab'片段;(3)(fab')2,通过用酶胃蛋白酶对整个抗体进行处理随后不进行还原而获得的抗体的片段;(4)f(ab')2,通过两个二硫键结合保持在一起的两个fab'片段的二聚体;(5)fv,含有表示为两条链的轻链的可变区和重链的可变区的经基因工程化的片段;以及(6)单链抗体,含有轻链的可变区和重链的可变区的通过合适的多肽接头连接为经基因融合的单链分子的经基因工程化的分子。制成这些片段的方法是常规的(参见,例如,harlow和lane,《使用抗体:实验室手册(using antibodies:a laboratory manual)》,纽约的cshl,1999)。
[0050]
抗体可以是单克隆的或多克隆的。仅通过举例来说,单克隆抗体可以根据kohler和milstein的经典方法(《自然(nature)》256:495-97,1975)或其衍生方法由鼠杂交瘤制备。用于单克隆抗体产生的详细程序在harlow和lane,《使用抗体:实验室手册》,纽约的cshl,1999中进行了描述。抗体还可以是“仅重链”抗体或其衍生物,如但不限于例如骆驼科仅重链抗体、纳米抗体等。如本文所用,术语“纳米抗体”是指最小的抗原结合片段或单个可变结构域(v
hh
),例如衍生自可以含有v
hh
和恒定结构域(例如,ch2和ch3)的天然存在的重链抗体的杨园结合片段或可变结构域。纳米抗体可以衍生自仅重链抗体,见于其中存在缺乏多肽轻链的免疫球蛋白的骆驼科(参见例如hamers-casterman等人,1993;desmyter等人,1996)。“骆驼科”包括旧世界骆驼科(双峰驼(camelus bactrianus)和单峰驼(camelus dromedarius))和新世界骆驼科(例如小羊驼(llama paccos)、大羊驼(llama glama)、原驼(llama guanicoe)和骆马(llama vicugna))。重链抗体也可以从软骨鱼类抗体,例如,ignar抗体和其片段,如v
nar
片段获得或可以衍生自软骨鱼类抗体。单结构域抗体(sdab)可以被称为纳米体或v
hh
抗体,并且此类抗体可通过各种方式得到,包含例如衍生自重链抗体、衍生自多链抗体(例如、小鼠、兔或人抗体)的工程化、衍生自对vh结构域文库进行筛选等。
[0051]
术语“样品”和“生物样品”是指从受试者的细胞、组织或体液中获得的材料,如外周血、血清、血浆、脑脊液、骨髓、尿液、唾液、组织活检、外科手术样本和尸检材料。样品还可以指代组织样品,如但不限于肝脏组织样品。组织样品可以以多种状态保存和/或利用,包含例如以完整组织的形式、以组织切片的形式、以均质组织的形式、以从组织中获得的解离和/或经纯化的细胞的形式等,其可以根据多种技术制备,所述技术包含但不限于例如外科手术切除、切片、均质化、解离、纯化等。
[0052]
如本文所用,术语“收集”,例如因为其涉及经扩增的人肝细胞,而是指从已注入或移植有所分离的人肝细胞或其它产生肝细胞的细胞的动物(例如,小鼠,大鼠或猪生物反应器)体内除去经扩增的肝细胞的过程,如本文所述。在一些情况下,接受细胞,例如离体操纵
的细胞,的移植的非人动物也可以被称为接受者动物。在一些情况下,接受例如经扩增的肝细胞的移植的人类受试者可以被称为经治疗的受试者、接受者等。收集任选地包含将肝细胞与其它细胞类型分离,其它细胞类型包含但不限于例如非肝细胞类型(例如,血细胞、肝外免疫细胞、血管细胞等)、非肝细胞性肝细胞(例如,肝星状细胞、库普弗细胞(kupffer cell)和肝窦内皮细胞)。
[0053]
如本文所用,“冷冻保存的”是指通过冷却到低于零的温度,如77k或-196℃(液氮的沸点),而保存或维持的细胞(例如肝细胞)或组织。在这些低温下,任何生物活动,包含会导致细胞死亡的生化反应,都会有效地停止。冷冻保存并且对冷冻保存的细胞解冻的有用方法,以及与其相关的过程和试剂,包含但不限于,例如以下美国专利中所述的那些:第10370638号;第10159244号;第9078430号;第7604929号;第6136525号;以及第5795711号,所述美国专利的公开内容通过引用以其整体并入本文。相比之下,如本文所用的关于细胞的术语“新鲜”可以指尚未冷冻保存的细胞,并且例如可以在从受试者或受试者的器官中收集之后直接获得和/或使用(例如,移植、培养等)。
[0054]
术语“存活”用于指代在移植到动物体内后继续活着的细胞,通常包含在将细胞施用于(例如,注射到)动物体内后植入的细胞。细胞存活期可以使用多种方法来评估,包含直接评估(例如对含有或预期含有所关注的细胞的样品中的细胞活力的定性或定量测量)和间接评估(例如对动物和人类受试者体内的活细胞的存在的一个或多个功能结果的定性或定量测量)。细胞(例如,肝细胞)存活期的有用的直接和间接读数可以包含但不限于细胞计数(例如,通过血细胞计、免疫组织化学、流式细胞术等)、测量分泌因子或生物标志物(例如,通过蛋白质(例如,白蛋白)elisa、蛋白质印迹(western blot)等)、评估接受者的健康(例如通过测量生命体征、功能测试(例如肝功能测试)等)等。术语“存活”在本文中也用于指代受试者,例如患有肝脏疾病的受试者或其动物模型,在一些治疗、干预和/或攻击,例如,向受试者施用或移植细胞(例如,肝细胞),向受试者施用引起疾病(例如,肝脏疾病)的药剂,撤回抑制、延迟、避免或预防疾病(例如,肝脏疾病)的发展的药剂之后继续活着的时间长度。存活,因为其涉及受试者,也可以以一些治疗、干预和/或攻击之后存活给定时间段的群体(例如,对照组或治疗组)的一部分(例如,百分比)来表示。生物医学领域的技术人员将很容易看出存活在本文中涉及细胞或受试者。
[0055]
术语“植入(engraft)”是指将细胞或组织植入(implantation)在动物体内。如本文所用,将人肝细胞植入在接受者动物体内是指在施用(例如,注射)后人肝细胞植入(例如,在肝脏中)在接受者动物体内的过程。在某些条件下,所植入的人肝细胞能够在接受者动物体内扩增。如本文所用,术语使人肝细胞“扩增”是指允许细胞分裂发生使得人肝细胞的数量增加的过程。术语“体内扩增”是指允许外源性细胞的细胞分裂在活宿主(例如,非人动物生物反应器,例如啮齿动物(例如,小鼠或大鼠)生物反应器、猪生物反应器、大鼠生物反应器等)内发生,使得活宿主内的外源性细胞的数量增加的过程。例如,移植到非人动物生物反应器中的人肝细胞可以在生物反应器内经历体内扩增,使得生物反应器内的人肝细胞的数量增加。
[0056]
术语“再殖”总体上是指在引入到动物(例如,生物反应器和/或受试者)体内后植入、存活和扩增的细胞。因此,所述术语涵盖在动物体内扩增和增殖的所植入的细胞,包含在动物的肝脏中扩增和增殖的人肝细胞。再殖和其增强可以在效率方面进行描述,包含例
如,据称再殖动力学增强的细胞的再殖效率可以增加,这可能是由植入、细胞存活、增殖或某种组合的一种或多种改进产生的。再殖可以被称为比率,例如施用于动物后占总肝脏细胞或其亚群的百分比(例如,总肝细胞的百分比)和/或总肝脏体积的百分比。具体地,关于所移植的肝细胞,除非另有说明,否则再殖的水平总体上将是指衍生自移植物的宿主肝脏中存在的肝细胞(即,存活且所植入的所移植的细胞加上其任何后代)与宿主肝脏细胞或其亚群(例如,宿主肝细胞)的比率。此比率可以表示为百分比,例如,其中50%的再殖将表示包含为一半移植物来源且一半宿主来源的细胞的宿主肝脏,而100%再殖将表示具有仅移植物来源的肝细胞的宿主肝脏。可替代地,此比率可以被称为衍生自所移植的细胞的细胞与衍生自内源性细胞的细胞的比例(例如,1:1、2:1、3:1等)。再殖通常是在足以使细胞在动物体内植入和扩增的时间段之后确定的,所述时间段包含但不限于2-16周、2-14周或2-12周(或其间的任何时间)、1-12个月(或其间的任何时间)或一年或更长时间。在一些情况下,再殖是在移植后2-6周、6-12周、4-8周、6-10周、8-12周、10-14周、12-16周、14-18周、2-4周、2-6周、6-8周、8-10周、10-12周、12-14周、14-16周、16-18周、18-20周、1-2周、2-3周、3-4周、4-5周、5-6周、6-7周、7-8周、8-9周、9-10周、10-11周、11-12周、12-13周、13-14周、14-15周、15-16周、17-18周、18-19周、19-20周、约1周、约2周、约3周、约4周、约5周、约6周、约7周、约8周、约9周、约10周、约11周、约12周、约13周、约14周、约15周、约16周、约17周、约18周、约19周或约20周时测量的。在一些情况下,在将例如第一组(例如,接受离体操纵的细胞的组)的再殖与第二组(例如,接受未离体操纵的细胞的组)进行比较的情况下,再殖可以被表示为到某个时间点时已达到特定水平,包含例如到移植后1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周或20周或更多时已达到至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%或至少90%或更多。
[0057]
再殖可以使用多种方法评估,包含直接评估和间接评估。有用的直接评估可以包含,例如,对含有或预期含有此类细胞的样品中的外源衍生的细胞的存在的定性或定量测量。如本文使用的关于细胞以及具体地在一些情况下肝细胞的术语“外源衍生的”统称为移植到宿主生物体中的细胞以及此类所移植的细胞的任何后代。因此,外源衍生的细胞可以指代移植到宿主中的初始产生肝细胞的细胞以及在此类细胞扩增期间产生的任何肝细胞。外源衍生的细胞可以通过多种方法进行标识,包含但不限于例如对在外源衍生的细胞中特异性存在或表达的基因或基因产物(例如,fah基因、fah mrna或在移植到fah缺乏的(例如,fah-/-)宿主中的细胞中表达的fah蛋白)进行染色或标记。例如,在一些实施例中,再殖的水平可以通过计算肝脏或其样品中的移植物衍生的肝细胞的量(例如,通过人fah 免疫组织化学(ihc)确定的)与肝脏或其样品中的细胞或肝细胞的总量(例如,通过反染色、核和/或细胞质标记/计数等确定的)的比率来确定,所述比率任选地表示为百分比或比率。
[0058]
对再殖的有用间接评估可以包含,例如,对动物或人类受试者体内的再殖细胞类型的存在的一个或多个功能结果的定性或定量测量,所述定性或定量测量包含但不限于细胞计数(例如,通过血细胞计、ihc、流式细胞术等)、测量分泌因子或生物标志物(例如,通过蛋白质(例如,白蛋白)elisa、蛋白质印迹等)、评估所移植的细胞的健康(例如,通过如酶学测定等细胞增殖测定,如mtt,成像方法或能够定量地测量细胞健康的实时基于板的测定),和/或评估动物生物反应器和/或接受者的健康(例如,测量生命体征、功能测试(例如,肝功
能测试)等)等。
[0059]
再殖(例如,肝细胞再殖)的直接和间接读数可以利用各种测定或其组合,包含但不限于例如细胞计数(例如,通过血细胞计、ihc、流式细胞术等)、细胞染色(例如,利用比色或荧光染料,包含例如,核染料、细胞质染料、组织学染色等),细胞标记(例如,通过使用可检测到的特异性结合剂,例如,可检测到的抗体等)、测量一种或多种分泌因子或生物标志物(例如,通过蛋白质(例如,白蛋白)elisa、蛋白质印迹等)、检测核酸和/或对核酸定量(例如,dna或rna,例如,通过原位杂交、qpcr、测序等)、评估接受者的健康(例如,测量生命体征、功能测试(例如,肝脏功能测试)等)、存活期测定等。
[0060]
术语“肝细胞”是指通常占肝脏的细胞质质量的70-80%的细胞的类型。肝细胞参与蛋白质合成、蛋白质储存和碳水化合物的转化,胆固醇、胆汁盐和磷脂的合成以及外源性和内源性物质的解毒、修饰和分泌。肝细胞还发起胆汁的形成和分泌。肝细胞制造血清白蛋白、纤维蛋白原和凝血因子的凝血酶原组,并且是脂蛋白、铜蓝蛋白、转铁蛋白、补体和糖蛋白合成的主要部位。另外,肝细胞能够代谢、解毒和灭活如药物和杀虫剂等外源性化合物以及如类固醇等内源性化合物。
[0061]
术语“一个受试者”和“多个受试者”可互换使用,并且是指如人类受试者和非人灵长类等哺乳动物以及实验动物,如兔、狗、猫、大鼠、小鼠、猪和其它动物。因此,如本文所用,术语“一个受试者”或“多个受试者”是指任何哺乳动物受试者或可以向其施用本文所述细胞的受试者。本公开的受试者包含患有肝脏疾病或病症的那些,包含患有此类疾病或病症的成人或幼年人类受试者。
[0062]
如本文所用,术语“治疗(treating)”和“治疗(treatment)”是指症状的严重度和/或频率的降低、症状和/或基本病因的消除、对症状和/或其基本病因的发生的预防和/或对损伤的改善或修复。任何肝脏病症或疾病可以使用本文所述的组合物和方法治疗。因此,“治疗”和“治疗”包含:
[0063]
(i)预防疾病或病状在哺乳动物体内发生,具体地在此类哺乳动物易患病状但尚未诊断患有所述病症时;
[0064]
(ii)抑制疾病或病状,即阻止其发展;
[0065]
(iii)缓解疾病或病状,即使疾病或病状消退;和/或
[0066]
(iv)缓解或消除由疾病或病状引起的症状,即在解决或不解决潜在疾病或病状的情况下缓解疼痛。
[0067]
如本文所用,术语“疾病”和“病状”可以互换使用或可以不同,因为特定弊病或病症可能没有已知的致病媒介(因此病因学尚未确定),并且因此所述特定弊病或病症尚未被识别为疾病,而仅被识别为其中临床医生或多或少已经鉴定了一组特定的症状的不期望的病状或综合征。
[0068]“药物组合物”是指本公开的化合物和/或细胞与如本领域普遍公认用于向哺乳动物,例如,人,递送生物活性化合物和/或细胞的培养基的调配物。此类培养基包含所有药学上可接受的载体、稀释剂或赋形剂。
[0069]“有效量”或“对...有效的量”是指当施用(例如,施用于哺乳动物,例如人,或哺乳动物细胞,例如,人细胞)时,足以影响所指示的结果(例如,植入、扩增、治疗等)的化合物和/或细胞的量。例如,“有效量”,如“治疗有效量”,是指本公开的化合物和/或细胞在施用
于哺乳动物,例如人,时足以实现对哺乳动物,例如,人的治疗的量。本公开的组合物的构成“治疗有效量”的量将根据化合物和/或细胞、病状和其严重度、施用的方式以及要治疗的哺乳动物的年龄而变化,但可以由本领域的普通技术人员根据其自己的知识和本公开来常规地进行确定。
[0070]
对产生肝细胞的细胞的离体操纵
[0071]
能够产生肝细胞的任何细胞都可以经受如本文所述的离体操纵(暴露于促进生长、再生、存活和/或植入的一种或多种药剂)。产生肝细胞的细胞的实例包含但不限于诱导型多能干细胞(ipsc)、例如由ipsc产生的肝细胞样细胞(hlc)、干细胞、肝细胞祖细胞和/或成熟或幼年肝细胞。
[0072]
在某些实施例中,产生肝细胞的细胞包括使用标准技术分离的任何来源的肝细胞,例如来自人类供体的肝细胞。在某些实施例中,肝细胞是从经筛选的尸体供体中分离的原代人肝细胞(phh),包含新鲜的phh或冷冻保存的phh。
[0073]
如果冷冻,则将产生肝细胞的细胞解冻,并放置在任何合适的器皿或培养容器中。可以使用任何合适的培养基。在某些实施例中,培养基包括肝细胞基础培养基、fbs和/或rock抑制剂,例如肝细胞基础培养基和lonza hcm
tm single quots
tm
的1:1混合物、5%fbs和10μm rho激酶(rock)抑制剂。可使用多种肝细胞相容性培养基,包含但不限于,例如liebovitz l-15、最低必需培养基(mem)、dmem/f-12、rpmi 1640、waymouth's mb 752/1williams培养基e、h 1777、肝细胞解冻培养基(htm)、冷冻保存的肝细胞恢复培养基人肝细胞培养基(密理博西格玛公司(millipore sigma))、人肝细胞铺板培养基(密理博西格玛公司)、人肝细胞解冻培养基(密理博西格玛公司)、lonza hcm
tm
、lonza hbm
tm
、hepatozyme-sfm(赛默飞世尔科学公司(thermo fisher scientific))、cellartis power初级hep培养基(cellartis)等。各种培养补充剂和/或基质可以包含或排除期望的培养基,所述期望的培养基包含但不限于例如lonza single quots
tm
补充剂、hepextend
tm
补充剂、胎牛血清、rock抑制剂、地塞米松(dexamethasone)、胰岛素、hegf、氢化可的松(hydrocortisone)、l-谷氨酰胺、glutamax
tm
、缓冲液(例如,hepes、碳酸氢钠缓冲液等)、转铁蛋白、硒复合物、bsa、亚油酸、胶原蛋白、胶原酶、geltrex
tm
、甲基纤维素、二甲基亚砜、透明质酸酶、抗坏血酸、抗生素等。肝细胞相容性培养基可以是通用的或者可以是专门针对初级、次级或永生化肝细胞调配的,并且此类培养基可以含有血清或生长因子,或可以被配置成无血清、无生长因子或具有最少/减少的生长因子。
[0074]
新鲜解冻的产生肝细胞的细胞(例如,人肝细胞)然后通过在促进肝细胞的存活、再生和/或植入的一种或多种药剂存在的情况下轻轻摇动来简单地进行离体操纵。可以靶向参与肝细胞再生的任何分子,有用的试剂包含但不限于抗体和/或核酸(dna和/或rna,如mrna)和/或调节信号传导通路的小分子,包含但不限于不限于hgf/c-met、egf/egfr、wnt、tgfβ、hippo、端粒伸长等。此外,可以使用任何合适的药剂以进行如本文所述的对肝细胞的离体操纵,所述任何合适的药剂包含但不限于靶向参与肝细胞再生的任何分子的一种或多种抗体或小分子,包含但不限于例如,靶向一种或多种组分的一种或多种抗体或小分子、hgf/c-met信号传导通路、egf/egfr信号传导通路、wnt信号传导通路、tgfβ信号传导通路、hippo信号传导通路、端粒伸长等。
[0075]
在某些实施例中,所述药剂包括一种或多种抗体,例如与未如本文所述进行处理
的细胞/动物相比刺激细胞(例如,肝细胞)的肝细胞存活、生长、再生和/或植入的激动剂抗体。在一些情况下,例如与受体的天然配体相比,通过靶向受体刺激肝细胞存活、生长、再生和/或植入的激动剂抗体试剂可以具有延长的激动剂活性。在一些情况下,在肝细胞或产生肝细胞的细胞分离含有激动剂抗体的培养基之后,包含例如将肝细胞或产生肝细胞的细胞移植到例如体内生物反应器或受试者体内之后,激动剂抗体激活可能持续显著的时间段。例如,在一些情况下,由于激动剂抗体的施用而引起的通路激活在去除含有抗体的培养基之后可以持续1小时或更多小时,包含例如在去除含有抗体的培养基之后可以持续2小时或更多小时、3小时或更多小时、4小时或更多小时、5小时或更多小时、6小时或更多小时、7小时或更多小时、8小时或更多小时、9小时或更多小时、10小时或更多小时、11小时或更多小时或12小时或更多小时、或1天或更多天。相比之下,由于肝细胞或产生肝细胞的细胞与受体的天然配体接触而引起的通路激活可能持续仅1小时或更短时间。因此,在一些情况下,相比于由受体配体引起的通路激活,由激动剂抗体引起的通路激活可以持续2倍长或多,包含但不限于例如相比于在施用并去除对应配体之后观察到的通路激活,可以持续至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少12倍、至少14倍、至少16倍、至少18倍或至少20倍长或多。通路激活可以通过多种方式来进行检测和/或测量,包含但不限于例如下游基因/效应基因的上调/表达、一种或多种通路组分的翻译后修饰(例如,磷酸化)、多聚化(例如,二聚化)、一种或多种通路组分的易位等。例如,在一些情况下,hgf/c-met通路激活可以通过对一种或多种hgf/c-met下游效应子的表达进行分析或对由于c-met激活(例如,gab1的酪氨酸磷酸化(py gab1)引起的翻译后修饰进行分析来进行检测和/或测量。在一些情况下,egfr通路激活可以通过对一种或多种egfr下游效应子的表达进行分析或对由于egfr激活(例如,egfr c端尾部中的酪氨酸磷酸化)引起的翻译后修饰进行分析来进行检测和/或测量。
[0076]
在某些方面,所述一种或多种抗体是hgf/c-met(c-met抗体)的激动剂。如图1所示,hgf/c-met信号传导是肝细胞再生的关键调节剂,并且肝细胞中的c-met信号传导的激活在下游诱导促存活和促增殖效应两者。hgf/c-met信号传导的激活涉及配体结合和受体的二聚化。已显示针对c-met的双价单克隆抗体可激活此信号传导并充当激动剂(参见例如ohashi等人(2000)《自然医学(nat med.)》6(3):327-31;yuan等人(2019)《治疗诊断学(theranostics)》9(7):2115-2128)。此外,尽管研究已经显示,c-met抗体的体内反复注射可以改善所移植的人肝细胞在小鼠体内的再殖(参见,例如ohashi等人(2000)《自然医学》6(3):327-31;yuan等人(2019)《治疗诊断学(theranostics)》9(7):2115-2128),但令人惊讶且出乎意料的是,如本文所述的离体操纵在将细胞施用于动物后可增强动物生物反应器中的肝细胞再殖。此外,令人惊讶且出乎意料的是,观察到的再殖的增强即使在动物生物反应器本身中不存在c-met抗体的情况下也持续(即,观察到的再殖的增强不需要向动物生物反应器施用激动剂)。此外,令人惊讶且出乎意料的是,相比于尚未进行如所描述的离体操纵的肝细胞的移植,如本文所述的离体操纵的肝细胞的移植可增强对患有肝脏疾病的受试者的治疗。
[0077]
在其它实施例中,激动剂抗体靶向egfr。egfr是配体的跨膜酪氨酸激酶受体,包含egf、tgfα等。egfr在成人肝脏的肝细胞中表达最高,在维持肝脏功能中起重要作用,并且是肝脏修复和再生必不可少的。针对egfr的双价单克隆抗体可以起到激动剂的作用并且可以
激活细胞存活和增殖的下游信号传导。egfr抗体可商购获得。
[0078]
在其它实施例中,激动剂抗体靶向wnt/β连环蛋白信号传导。wnt/β连环蛋白信号传导通过调节细胞增殖、分化、迁移和凋亡参与多种发育过程和组织再生。wnt/β连环蛋白信号传导在wnt配体与卷曲受体的胞外结构域结合并与脂蛋白受体相关蛋白(lrp)-5/6的共受体相互作用时进行激活。针对使受体稳定的卷曲或lrp-5/6的抗体可以起到激动剂抗体的作用并且激活信号传导。
[0079]
可以使用抗体的组合。可以使用可商购获得的抗体。
[0080]
可以在本文所述的离体操纵方法中使用一种或多种不同类型的药剂(例如,抗体)。在某些实施例中,使用针对同一靶标的1种、2种、3种、4种、5种、6种、7种、8种、9种或10种不同的抗体(例如,不同的c-met抗体)。在其它实施例中,针对一种靶标(例如,c-met)的一种或多种抗体与针对一种或多种额外靶标(例如,egfr)的一种或多种抗体组合使用。
[0081]
所述一种或多种抗体和/或小分子(例如激动剂抗体、小分子激动剂)对一种物种(例如人)可以具有特异性,或者可替代地,可以与其它物种(例如,小鼠、大鼠、猪等)交叉反应。在一些实施例中,激动剂抗体(例如,c-met和/或egfr抗体)对人c-met具有特异性并且不具有跨物种活性(例如,不与小鼠c-met或egfr交叉反应,不与大鼠c-met或egfr交叉反应,不与啮齿动物c-met或egfr交叉反应,不与猪c-met或egfr交叉反应,不与其它非人哺乳动物c-met或egfr交叉反应等以及其组合)。如本文所用,“人c-met特异性激动剂”和“对人c-met具有特异性的”激动剂是指与人c-met特异性结合并且特异性激活或增强人hgf/c-met信号传导(例如,通过c-met和/或gab1的磷酸化或通路活性的其它读数测量的)而基本上不与非人(例如啮齿动物、猪等)c-met结合和/或基本上激活或增强非人hgf/c-met信号传导的药剂。如本文所用,“人egfr特异性激动剂”和“对人egfr具有特异性的”激动剂是指与人egfr特异性结合并且特异性激活或增强人egf/egfr信号传导(例如,通过egfr的磷酸化和/或下游效应子激活或通路活性的其它读数测量的)而基本上不与非人(例如啮齿动物、猪等)c-met结合和/或基本上激活或增强非人hgf/c-met信号传导的药剂。
[0082]
所述一种或多种抗体、核酸和/或小分子可以以任何方式添加到产生肝细胞的细胞中,包含但不限于通过添加到培养基中。另外,可以使用任何浓度的抗体、核酸和/或小分子。在一些实施例中,抗体以范围为10ng/ml或更小到1mg/ml或更大的浓度使用,包含但不限于例如10ng/ml-1mg/ml、25ng/ml-1mg/ml、50ng/ml-1mg/ml、75ng/ml-1mg/ml、100ng/ml-1mg/ml、250ng/ml-1mg/ml、500ng/ml-1mg/ml、750ng/ml-1mg/ml、1μg/ml-1mg/ml、5μg/ml-1mg/ml、10μg/ml-1mg/ml、25μg/ml-1mg/ml、50μg/ml-1mg/ml、75μg/ml-1mg/ml、10ng/ml-750μg/ml、25ng/ml-750μg/ml、50ng/ml-750μg/ml、75ng/ml-750μg/ml、100ng/ml-750μg/ml、250ng/ml-750μg/ml、500ng/ml-750μg/ml、750ng/ml-750μg/ml、1μg/ml-750μg/ml、5μg/ml-750μg/ml、10μg/ml-750μg/ml、25μg/ml-750μg/ml、50μg/ml-750μg/ml、75μg/ml-750μg/ml、10ng/ml-500μg/ml、25ng/ml-500μg/ml、50ng/ml-500μg/ml、75ng/ml-500μg/ml、100ng/ml-500μg/ml、250ng/ml-500μg/ml、500ng/ml-500μg/ml、750ng/ml-500μg/ml、1μg/ml-500μg/ml、5μg/ml-500μg/ml、10μg/ml-500μg/ml、25μg/ml-500μg/ml、50μg/ml-500μg/ml、75μg/ml-500μg/ml、10ng/ml-250μg/ml、25ng/ml-250μg/ml、50ng/ml-250μg/ml、75ng/ml-250μg/ml、100ng/ml-250μg/ml、250ng/ml-250μg/ml、500ng/ml-250μg/ml、750ng/ml-250μg/ml、1μg/ml-250μg/ml、5μg/ml-250μg/ml、10μg/ml-250μg/ml、25μg/ml-250μg/ml、50μg/ml-250μ
g/ml、75μg/ml-250μg/ml、10ng/ml-100μg/ml、25ng/ml-100μg/ml、50ng/ml-100μg/ml、75ng/ml-100μg/ml、100ng/ml-100μg/ml、250ng/ml-100μg/ml、500ng/ml-100μg/ml、750ng/ml-100μg/ml、1μg/ml-100μg/ml、5μg/ml-100μg/ml、10μg/ml-100μg/ml、25μg/ml-100μg/ml、50μg/ml-100μg/ml、75μg/ml-100μg/ml、10ng/ml-75μg/ml、10ng/ml-50μg/ml、10ng/ml-25μg/ml、10ng/ml-10μg/ml、10ng/ml-5μg/ml、10ng/ml-1μg/ml、10ng/ml-750ng/ml、10ng/ml-500ng/ml、10ng/ml-250ng/ml、10ng/ml-100ng/ml、10ng/ml-75ng/ml、10ng/ml-50ng/ml、10ng/ml-25ng/ml、50ng/ml-50μg/ml、50ng/ml-10μg/ml、50ng/ml-5μg/ml、50ng/ml-1μg/ml、100ng/ml-50μg/ml、100ng/ml-10μg/ml、100ng/ml-5μg/ml、100ng/ml-1μg/ml、500ng/ml-50μg/ml、500ng/ml-10μg/ml、500ng/ml-5μg/ml、500ng/ml-1μg/ml、1μg/ml-50μg/ml、1μg/ml-40μg/ml、1μg/ml-30μg/ml、1μg/ml-20μg/ml、1μg/ml-10μg/ml、5μg/ml-50μg/ml、5μg/ml-40μg/ml、5μg/ml-30μg/ml、5μg/ml-20μg/ml等。
[0083]
在某些实施例中,将肝细胞(例如,新鲜解冻的)与一种或多种抗体(例如,c-met和/或egfr抗体)一起温育,所述抗体/抗体处于任何有效浓度下。在某些实施例中,将产生肝细胞的细胞(例如,新鲜解冻的人肝细胞)与一种或多种c-met抗体一起温育,所述一种抗体/多种抗体的浓度为或约10ng/ml或更低到1mg/ml或更高,或其间的任何值,包含例如本文公开的那些单独的值和范围,包含例如10μg/ml。在某些实施例中,将产生肝细胞的细胞(例如,新鲜解冻的人肝细胞)与一种或多种egfr抗体一起温育,所述一种抗体/多种抗体的浓度为或约10ng/ml或更低到1mg/ml或更高,或其间的任何值,包含例如本文公开的那些单独的值和范围,包含例如10μg/ml。在其它实施例中,将产生肝细胞的细胞(例如,新鲜解冻的人肝细胞)与一种或多种c-met和一种或多种egfr抗体一起温育,所述一种抗体/多种抗体处于相同或不同的浓度下,包含本文所述的那些浓度,并且其中对于每种抗体类型,每种抗体的浓度为或者为约10μg/ml。
[0084]
如本文所述的离体调节中采用的激动性抗体在效力方面可能有所变化,并且在一些情况下,离体调节中采用的抗体的浓度可以相应地进行调整。本方法中采用的有用的激动性抗体的半最大有效浓度(ec
50
)的范围可以为例如0.001μg/ml或更低到1μg/ml或更高,包含但不限于例如0.001μg/ml到1μg/ml、0.001μg/ml到0.75μg/ml、0.001μg/ml到0.5μg/ml、0.001μg/ml到0.25μg/ml、0.001μg/ml到0.1μg/ml、0.001μg/ml到0.075μg/ml、0.001μg/ml到0.05μg/ml、0.001μg/ml到0.025μg/ml、0.005μg/ml到1μg/ml、0.005μg/ml到0.75μg/ml、0.005μg/ml到0.5μg/ml、0.005μg/ml到0.25μg/ml、0.005μg/ml到0.1μg/ml、0.005μg/ml到0.075μg/ml、0.005μg/ml到0.05μg/ml、0.005μg/ml到0.025μg/ml、0.01μg/ml到1μg/ml、0.01μg/ml到0.75μg/ml、0.01μg/ml到0.5μg/ml、0.01μg/ml到0.25μg/ml、0.01μg/ml到0.1μg/ml、0.01μg/ml到0.075μg/ml、0.01μg/ml到0.05μg/ml或0.01μg/ml到0.025μg/ml。受试者激动性抗体的ec
50
可以通过任何方便的方式确定,包含但不限于例如在流式细胞术结合测定中用表达相关抗原(例如,c-met和/或egfr)的细胞进行滴定等。
[0085]
产生肝细胞的细胞和一种或多种抗体/小分子可以在任何合适的条件下一起温育持续任何时间段(包含几分钟、几小时或几天)。温育时间和条件会有所变化,其中有用的温育时间通常将足以激活所靶向的通路,其中例如,通路激活的充分性可以通过使用通路激活的各个读数中的任何读数,包含但不限于例如,本文所述的任何此类测定来评估。在某些实施例中,将培养物温育1分钟到180分钟或240分钟或更长,包含例如温育15分钟、30分钟、
45分钟、1小时、2小时、3小时、15分钟到4小时、30分钟到4小时、45分钟到4小时、1到4小时、15分钟到3小时、30分钟到3小时、45分钟到3小时、1到3小时、15分钟到2.5小时、30分钟到2.5小时、45分钟到2.5小时、1小时到2.5小时、15分钟到2小时、30分钟到2小时、45分钟到2小时、1到2小时等。温育可以包含搅动温育培养物,在此情况下此类搅动的方式可以变化。例如,产生肝细胞的细胞和一种或多种药剂可以容纳在器皿(例如,细胞培养器皿、管、小瓶等)内,并且所述温育可以包含器皿的各种搅拌,包含但不限于例如,其中摇动、晃动、旋转、章动等。
[0086]
肝细胞扩增/再殖
[0087]
在对如本文所述的产生肝细胞的细胞进行离体操纵之后,在一些情况下,然后向动物(例如,小鼠、大鼠、猪等)施用所述细胞以用于使肝细胞在体内生物反应器中扩增。
[0088]
用于如本文所述的使肝细胞扩增的合适的动物生物反应器是本领域已知的。在某些实施例中,在一个或多个基因座处对动物进行基因修饰。基因修饰可以包含用于产生在一个或多个基因座处缺乏的动物的敲除或敲低或对一个或多个靶基因的激活。基因修饰可以在多个基因座处以任何组合(一个或多个抑制性修饰和/或一个或多个激活性修饰)进行。体内生物反应器中有用的基因修饰可以包含各种基因中的修饰,包含免疫基因(例如,导致免疫缺陷)、肝功能基因(例如,导致肝脏功能缺乏症)、代谢基因(例如,导致代谢缺乏症)、氨基酸分解代谢基因(例如,导致氨基酸分解代谢不足)等。
[0089]
在某些方面,经基因修饰的动物是延胡索酰乙酰乙酸水解酶(fah)缺乏的动物,例如美国专利第8,569,573号、第9,000,257号和美国专利公开第20160249591号中所述,所述美国专利的公开内容通过引用以其整体并入本文。fah是催化酪氨酸分解代谢的最后步骤的代谢酶。具有fah基因的纯合缺失的动物表现出肝脏mrna表达改变和严重的肝脏功能障碍。fah基因中的点突变也已被证明会导致肝脏衰竭和产后致死。缺乏fah的人类会患有肝脏疾病遗传性酪氨酸血症1型(ht1)并患有肝脏衰竭。fah缺乏症导致延胡索酰乙酰乙酸盐(一种强效氧化剂)的积累,并且这最终导致缺乏fah的肝细胞的细胞死亡。因此,fah缺乏的动物可以用来自包含人类的其它物种的含有功能性fah基因的肝细胞再殖。许多不同物种的fah基因组、mrna和蛋白质序列是可公开获得的,如在genbank数据库中(参见,例如,基因id 29383(大鼠fah);基因id 14085(小鼠fah);基因id 610140(狗fah);基因id 415482(鸡fah);基因id 100049804(马fah);基因id 712716(恒河猴fah);基因id 100408895(狨猴fah);基因id 100589446(长臂猿fah);基因id 467738(黑猩猩fah);以及基因id 508721(牛fah)。此类动物可以包含经基因修饰的fah基因座,并且可以包含或可以不包含在另一基因座处的另外的基因修饰,包含例如在此动物(例如,小鼠、猪或大鼠)缺乏fah、rag-1或rag-2和il-2rγ(在一些情况下被称为“frg”动物,如frg小鼠、frg猪或frg大鼠)的情况下。
[0090]
有用的基因修饰还包含导致免疫缺陷的那些,例如,由于缺乏免疫系统的特定分子或细胞组分、免疫系统的特定分子或细胞组分的功能等。在一些情况下,有用的基因改变包含重组激活基因1(rag1)基因的基因改变。rag1是参与激活免疫球蛋白v(d)j重组的基因。rag1蛋白参与dna基质的识别,但稳定的结合和切割活性也需要rag2。rag-1缺乏的动物已显示出不具有成熟的b和t淋巴细胞。在一些情况下,有用的基因改变包含重组激活基因2(rag2)基因的基因改变。rag2是参与免疫球蛋白和t细胞受体基因座的重组的基因。缺乏rag2基因的动物不能够进行v(d)j重组,从而导致功能性t细胞和b细胞完全丧失(参见例如
shinkai等人,《细胞(cell)》68:855-867,1992)。在一些情况下,有用的基因改变包含白介素受体(il2rg)的共同γ链的基因改变。il2rg是对白介素受体的共同γ链进行编码的基因。il2rg是许多白介素的受体的组分,所述受体包含il-2、il-4、il-7和il-15(参见例如di santo等人,《美国国家科学院院刊(proc.natl.acad.sci.u.s.a.)》92:377-381,1995)。缺乏il2rg的动物表现出b细胞和t细胞减少并且缺乏天然杀伤细胞。il2rg也被称为白介素2受体γ链。
[0091]
在一些情况下,动物可以是免疫抑制的,包括例如,在免疫抑制是在通过施用一种或多种免疫抑制剂实现的情况下。可以使用任何合适的免疫抑制剂或对于实现对动物的免疫抑制有效的药剂。免疫抑制剂的实例包含但不限于fk506、环孢菌素a、氟达拉滨(fludarabine)、霉酚酸酯、泼尼松(prednisone)、雷帕霉素和硫唑嘌呤(azathioprine)。还可以施用免疫抑制剂的组合。在一些情况下,采用免疫抑制剂来代替遗传免疫缺陷。在一些情况下,采用免疫抑制剂与遗传免疫缺陷的组合。
[0092]
如本文所概述的,经基因修饰的动物可以包含一种或多种(即,组合)基因修饰。例如,此动物可以包含rag1基因修饰、rag2基因修饰、il2rg基因修饰,或者此动物可以包含rag1或rag2基因修饰以及il2rg基因的基因改变,使得基因改变对应地使功能性rag1蛋白、rag2蛋白、il-2rg蛋白或rag-1/rag-2蛋白和il-2rg蛋白的表达丧失。在一个实例中,所述一个或多个基因改变包含rag2基因的基因改变和il2rg基因的基因改变。在一个实例中,所述一个或多个基因改变包含rag1基因的基因改变和il2rg基因的基因改变。在一些情况下,有用的基因改变包含例如scid、nod、sirpα、穿孔素或裸。所改变的基因座可以是遗传无效(即,敲除)或导致对应基因座处缺乏基因产物的其它修饰。免疫系统的特定细胞(如巨噬细胞或nk细胞)也可以被耗尽。可以采用使特定细胞类型耗尽的任何方便的方法。
[0093]
应当理解,可以在动物生物反应器(例如,大鼠、小鼠、兔、猪)中使用为肝细胞异种移植物创造了选择性生长优势的肝脏损伤的各种模型以促进肝细胞植入和扩增,所述模型包含但不限于,诱导型损伤、选择性栓塞、短暂性缺血、倒千里光碱(retrorsine)、野百合碱(monocrotoline)、硫代乙酰胺、利用γ射线进行的照射、四氯化碳、和/或基因修饰(例如,fah破坏、upa、tk-nog(washburn等人,《胃肠病学(gastroenterology)》,140(4):1334-44,2011)、白蛋白afc8、白蛋白白喉毒素、威尔逊氏病(wilson's disease)等)。也可以使用肝脏损伤技术的组合。
[0094]
在一些实施例中,在注射异源性肝细胞之前,向动物施用对尿激酶基因(例如,尿激酶纤溶酶原激活物(upa))进行编码的载体(例如,ad载体)。upa在肝细胞中的表达会导致肝损伤,并由此允许肝细胞异种移植物在移植后选择性扩增。在一个实施例中,尿激酶基因是人尿激酶并且可以是分泌的或非分泌的。参见例如美国专利第8,569,573号;第9,000,257号和美国专利公开第20160249591号。
[0095]
在一些情况下,可以使用tk-nog肝脏损伤模型(即,白蛋白胸苷激酶转基因-nod-scid-白介素共同γ链敲除)作为如本文所述的动物生物反应器。tk-nog动物包含可以通过施用更昔洛韦(ganciclovir)而有条件地激活的单纯疱疹病毒胸苷激酶肝毒性转基因。在施用更昔洛韦期间由转基因激活引起的肝损伤为肝细胞异种移植物提供了选择性优势,这促进了将此类动物用作用于使如本文所述的所移植的肝细胞扩增的体内生物反应器。
[0096]
在一些情况下,可以使用afc8肝脏损伤模型(特征在于具有由白蛋白启动子驱动
的fkbp胱天蛋白酶8基因)作为如本文所述的动物生物反应器。afc8动物包含可以通过施用ap20187有条件地激活的fk508胱天蛋白酶8融合肝毒性转基因。在施用ap20187期间由转基因激活引起的肝损伤为肝细胞异种移植物提供了选择性优势,这促进了将此类动物用作用于使如本文所述的所移植的肝细胞扩增的体内生物反应器。
[0097]
在一些情况下可以使用nsg-piz肝脏损伤模型(特征在于具有α-1抗胰蛋白酶(aat)缺乏症与免疫缺陷(ngs)组合)作为如本文所述的动物生物反应器。nsg-piz动物的aat分泌受损,这导致错误折叠的piz突变aat蛋白的积累,从而引发肝细胞损伤。此类肝损伤为肝细胞异种移植物提供了选择性优势,这促进了将此类动物用作用于使如本文所述的所移植的肝细胞扩增的体内生物反应器。免疫缺陷使动物能够在没有显著排斥的情况下容纳异种移植物。
[0098]
在一些情况下,动物可以在接受产生肝细胞的细胞移植之前进行预调节,以提高接受者肝脏支持所移植的细胞的能力。可以采用各种预调节方案,包含但不限于例如照射预调节(例如部分肝脏照射)、栓塞预调节、缺血预调节、化学/病毒预调节(使用例如,upa、环磷酰胺、多柔比星(doxorubicin)、一氧化氮、倒千里光碱、野百合碱、毒性胆汁盐、四氯化碳、硫代乙酰胺等)、肝切除预调节等。在一些情况下,产生肝细胞的细胞可以在预调节不存在的情况下引入和/或程序将特别排除预调节方案或特定试剂的一种、全部或某种组合,包含例如本文所述的那些中的一种或多种。在一些情况下,可以使用通过停止ntbc或施用更昔洛韦或ap20187诱导肝脏损来进行预调节。在采用的情况下,预调节可以在某个时间执行,包含产生肝细胞的细胞移植之前几小时、几天或几周或更多,包含至少移植前例如至少6小时、至少12小时、至少24小时、至少36小时、至少48小时、至少60小时、至少72小时、至少4天、至少5天、至少6天、至少一周或至少两周。
[0099]
在对动物进行任选的预调节(例如,用upa)之后(例如,预调节后24小时),可以通过任何合适的方式向动物递送异源性肝细胞。在某些实施例中,将本文所述的肝细胞直接施用于肝脏(例如,通过门静脉注射)和/或通过脾内注射,在这种情况下肝细胞将穿过脉管系统行进以到达肝脏。在某些实施例中,在介于1
×
105与1
×
109(例如,5
×
105/小鼠、5-10
×
106/大鼠等)之间的任何地方,将肝细胞引入到frg动物体内,任选地用腺病毒upa(例如,1.25
×
109pfu/25克的小鼠体重)进行预调节(例如,施用前24小时)。引入到生物反应器中的产生肝细胞的细胞的数量会有所不同,并且,其范围例如,由于各种因素,包含接受细胞的动物的物种和大小,可以为1
×
105或更少到1
×
109或更多,包含但不限于例如1
×
105到1
×
109、1
×
106到1
×
109、1
×
107到1
×
109、1
×
108到1
×
109、1
×
105到1
×
106、1
×
105到1
×
107、1
×
105到1
×
108、1
×
106到1
×
107、1
×
107到1
×
108、1
×
106到1
×
108个等。在一些情况下,所施用的细胞的数量可以为1
×
109或更少,包含例如0.5
×
109或更少、1
×
108或更少、0.5
×
108或更少、1
×
107或更少、0.5
×
107或更少、1
×
106或更少、0.5
×
106或更少、1
×
105或更少等。
[0100]
另外,免疫抑制药物可以任选地在移植之前、期间和/或之后给予动物以从异种移植的异源性肝细胞中消除动物(例如,小鼠、猪或大鼠)体内的宿主对移植物的应答。在一些情况下,通过在限定时间段内循环使动物断开免疫抑制剂,肝脏细胞变得静止,并且所植入的细胞将具有增殖优势,从而使内源性肝细胞(例如,小鼠、猪或大鼠肝细胞)被异源性肝细胞(例如,人肝细胞)代替。在人肝细胞的情况下,这会产生具有高水平的人源化肝脏的动
物。异源性肝细胞再殖水平可以通过各种量度来确定,包含但不限于例如对人血清白蛋白水平的定量,所述定量任选地与来自所移植的动物的肝脏切片的免疫组织化学相关。
[0101]
在一些实施例中,在所施用的肝细胞扩增期间向动物生物反应器施用抑制、延迟、避免或预防肝脏疾病的发展的药剂。这种药剂的施用避免了(或防止了)在具有健康(例如,fah表达)异源性肝细胞的动物生物反应器(例如,小鼠、大鼠或猪生物反应器)再殖之前动物生物反应器(例如,小鼠、大鼠或猪生物反应器)的肝脏功能障碍和/或死亡。药剂可以是抑制与生物反应器相关的疾病模型中的肝脏疾病的任何化合物或组合物。一种此药剂是2-(2-硝基-4-三氟-甲基-苯甲酰基)-1,3环己二酮(ntbc),但也可以使用苯丙酮酸双加氧酶的其它药理学抑制剂,如甲基ntbc。施用ntbc以调节fah缺乏的动物的肝脏疾病的发展。在fah缺乏的动物生物反应器中,剂量、给药时间表和施用的方法可以根据需要进行调整和/或循环,以避免灾难性肝脏功能障碍,同时促进肝细胞异种移植物的扩增。在一些实施例中,在如本文所述的肝细胞移植后,向fah缺乏的动物施用ntbc持续至少两天、至少三天、至少四天、至少五天或至少六天。在一些实施例中,向fah缺乏的动物进一步施用ntbc持续至少约一周、至少约两周、至少约三周、至少约四周、至少约一个月、至少约两个月、至少约三个月、至少约四个月、至少约五个月或至少约六个月。在一些实施例中,在肝细胞移植后约两天、约三天、约四天、约五天、约六天或约七天撤回ntbc(或具有肝脏保护作用的另一种化合物)。
[0102]
施用于fah缺乏的动物的ntbc的剂量可能会有所变化。在一些实施例中,所述剂量为约0.5mg/kg到约30mg/kg每天,例如约1mg/kg到约25mg/kg、约10mg/kg每天到约20mg/kg每天或约20mg/kg每天。ntbc可以通过任何合适的方式施用,如但不限于以饮用水的形式、以食物的形式或通过注射。在一个实施例中,以饮用水的形式施用的ntbc的浓度为约1到约30mg/l,例如约10mg/l到约25mg/l、约15mg/l到约20mg/l或约20mg/l。在某些实施例中,ntbc施用是从移植前到移植后4到8周或更多周循环。此外,由于使用本文所述的方法到约8周时产生动物生物反应器中的人肝细胞的70-90%的人源化(再殖)率,因此消除了对另外潜在有害的长期(例如,14天或更长)ntbc撤回(即ntbc断开)的需要。
[0103]
也可以在施用经离体修饰的肝细胞之前、期间和/或之后用如本文所述的一种或多种药剂(例如,c-met激动剂(例如,c-met抗体、小分子、hgf多肽或其衍生物)、egfr激动剂(例如,egfr抗体、小分子、egf多肽或其衍生物)等)对动物生物反应器或下文更详细描述的受试者进行治疗。参见例如ohashi等人(2000)《自然医学》6(3):327-31;yuan等人(2019)《治疗诊断学》9(7):2115-2128。在一些情况下,本文所述的方法可以具体地排除在施用经离体修饰的肝细胞之前、期间和/或之后向动物生物反应器或受试者施用如本文所述的一种或多种药剂(例如,c-met激动剂(例如,c-met抗体、小分子、hgf多肽或其衍生物)、egfr激动剂(例如,egfr抗体、小分子、egf多肽或其衍生物)等),使得在施用经离体修饰的肝细胞之前、期间和/或之后生物反应器或受试者中不存在所述药剂。
[0104]
在任何时间段之后,包含但不限于移植之后7天到180天(或其间的任何一天)或更多天,可以从动物生物反应器收集衍生自如本文所述操纵的所移植的产生肝细胞的细胞的经扩增肝细胞。在某些实施例中,经扩增的肝细胞在移植后28天到56天(或其间的任何一天)收集。在一些情况下,肝细胞在1周时、在2周或更早时、在3周或更早时、在4周之前、在4周或更早时、在5周或更早时、在6周或更早时、在7周或更早时、在8周之前、在8周或更早时、
在9周或更早时、在10周或更早时、在11周或更早时、在12周之前、在12周或更早时、在13周或更早时、在14之前或在14周或更早时收集。
[0105]
此外,经扩增的肝细胞可以使用多种技术中的任何一种技术从动物中收集。例如,肝细胞可以通过对动物的肝脏进行酶消化,然后轻轻切碎、过滤和离心来收集。此外,肝细胞可以使用各种方法与其它细胞类型、组织和/或碎屑分离,如通过使用特异性识别所植入的肝细胞物种的细胞类型的抗体。此类抗体包含但不限于与i类主要组织相容性抗原特异性结合的抗体,如抗人hla-a、b、c(markus等人(1997)《细胞移植(cell transplantation)》6:455-462)。然后可以通过淘选(利用粘附到固体基质的单克隆抗体)、荧光激活的细胞分选(facs)、磁珠分离等来分离抗体结合的肝细胞。也可以采用收集肝细胞的替代方法。
[0106]
在一些情况下,可以将所收集的肝细胞连续一次或多次移植到额外的动物生物反应器中。参见例如图6。连续移植可以在同一物种或不同物种的动物体内进行两次、三次、四次或更多次,例如使用大鼠、猪、小鼠或兔以进行所有连续移植,或者可替代地使用合适的动物生物反应器的任何组合以进行连续移植(大鼠中进行一次或多次,猪中进行一次或多次等)。
[0107]
此外,在从动物生物反应器收集肝细胞后,肝细胞可以在施用于受试者之前经受如本文所述的另外的离体操纵(例如,与一种或多种激动剂,如激动剂抗体、小分子、多肽等一起温育)。所收集且任选地所分离的经扩增的肝细胞可以新鲜使用或者可以在使用前冷冻保存。
[0108]
组合物
[0109]
本文还描述了包括如本文所述操纵的产生肝细胞的细胞以及由这些细胞产生的肝细胞的组合物。
[0110]
因此,本文提供了一种活的非人动物(例如,非人哺乳动物、啮齿动物、小鼠、大鼠、猪等),所述活的非人动物包括衍生自如本文所述的离体处理的产生肝细胞的细胞(或从所述细胞中扩增)的肝细胞(例如,人高细胞)的群体,使得在任何时间段内(例如,8-16周或更长)在动物生物反应器中通过在动物体内植入、存活和扩增的离体操纵的肝细胞实现了多于40%、多于50%、多于60%、多于70%、多于80%或80%与100%之间的肝细胞(例如,人肝细胞)再殖率。在某些实施例中,与在相同时间段内实现了总体上至多30%的再殖的当前方法相比,到8周时实现了多于70%的再殖。这通过消除数周的ntbc循环极大改善了动物生物反应器的健康。另外,与未经处理的所移植的细胞相比,衍生自如本文所述进行处理的所移植的细胞的经再殖的细胞的健康、存活率、持久性和/或植入也得到改善。
[0111]
在一些情况下,本文提供了一种非人体内生物反应器(如非人哺乳动物或啮齿动物,例如小鼠或大鼠或猪)或其肝脏,其具有肝细胞群体,所述肝细胞群体在移植后14周之前,包含例如,13周或更短时、12周或更短时、11周或更短时、10周或更短时、9周或更短时或8周或更短时为或已再殖到至少50%、至少55%、至少60%、至少65%、至少70%或更多的外源性(即,异种移植物衍生的)肝细胞(例如,人肝细胞)。还提供了一种非人体内生物反应器(如非人哺乳动物或啮齿动物,例如,小鼠或大鼠或猪)或其肝脏,其在移植后14周之前,包含例如,13周或更短时、12周或更短时、11周或更短时、10周或更短时、9周或更短时或8周或更短时包含至少1
×
109个外源性(即,异种移植物衍生的)所植入且经扩增的肝细胞(例如,人肝细胞)。还提供了一种猪体内生物反应器或其肝脏,其包含至少30-50
×
109外源性(即,
异种移植物衍生的)所植入且经扩增的肝细胞(例如,人肝细胞)。
[0112]
在一些情况下,本文提供了一种非人体内生物反应器(如非人哺乳动物或啮齿动物,例如,小鼠或大鼠或猪)或其肝脏,其具有外源衍生的(即异种移植物)离体操纵的肝细胞群体(例如,人肝细胞群体),所述外源衍生的离体操纵的肝细胞群体在移植后的某一时间点时大于移植后同一时间点时对应生物反应器中存在的外源衍生的非离体操纵的肝细胞群体。在一些情况下,离体操纵的外源衍生的肝细胞群体比对应非离体操纵的外源衍生的肝细胞群体大至少1.1倍,包含例如大至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2倍或至少2.5倍。在一些情况下,离体操纵的外源衍生的肝细胞群体比对应非离体操纵的外源衍生的肝细胞群体大至少10%倍,包含例如大至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%或至少150%。与对应外源衍生的非离体操纵的肝细胞群体相比,离体操纵的肝细胞群体的大小的此增强可以在任何方便的时间点进行评价,包含例如移植后2周或更短或更长,包含但不限于移植后2周时、3周时、4周时、5周时、6周时、7周时、8周时、10周时、12周时、14周时或16周时或者其间或之前或之后的任何时间段时。
[0113]
如以上所详述的,可以使用任何合适的动物生物反应器以用于肝细胞的体内产生。非人哺乳动物生物反应器适合于使用。在某些实施例中,动物为如小鼠或大鼠等啮齿动物。在其它实施例中,动物为猪。活的动物生物反应器可以是免疫抑制/免疫受损的、已经历肝脏损伤和/或用ntbc进行了治疗(例如循环ntbc治疗),如上所述。
[0114]
在某些实施例中,如本文所述的包括肝细胞的组合物包括爆包封的肝细胞。所分离的经扩增的肝细胞可以使用任何方法包封,通常在施用于受试者之前包封。参见例如jitraruch等人(2014)《公共科学图书馆
·
综合(plos one)》9:10;dhawan等人(2019)《肝脏病学杂志(j hepatol.)》doi:10.1016/j.jhep.2019.12.002;bochenek等人(2018)《自然生物医学工程(nature biomedical engineering)》2:810-821。半渗透性水凝胶内的细胞包封表示基于细胞的疗法的无需全身免疫抑制的局部免疫分离策略。水凝胶球在排除会排斥同种异体细胞的免疫细胞的同时,促进细胞功能所需的基质、营养物和蛋白质的扩散。藻酸盐球是研究最广泛的细胞包封材料之一,因为此阴离子多糖在细胞友好条件下在二价阳离子的存在下形成水凝胶。
[0115]
本文还提供了一种脱细胞的肝脏或其它无细胞的支架(包含天然支架和合成支架),其接种和/或再殖有通过如本文所述的方法产生的肝细胞的群体。例如,可以将如本文所述的离体操纵的产生肝细胞的细胞的群体引入(有或没有其它支持细胞类型的情况下)到脱细胞的肝脏或其部分或其它无细胞的支架中,随后将所述群体维持在足以使脱细胞的肝脏或其部分通过由离体操纵的产生肝细胞的细胞产生的肝细胞再殖的条件下。
[0116]
可以获得如人肝脏等肝脏或如猪等非人哺乳动物或其部分,并且任选地对所述肝脏或非人哺乳动物进行外科手术处理(例如,以分离肝脏的一个或多个部分或叶)。然后通过任何方便且适当的方式使肝脏或其部分脱细胞,包含例如机械细胞损伤、冷冻/解冻、插管和逆行灌注一种或多种脱细胞试剂(例如,一种或多种蛋白酶(例如胰蛋白酶)、一种或多种核酸酶(例如,dna酶)、一种或多种表面活性剂(例如十二烷基硫酸钠、triton x-100等)、一种或多种低渗试剂、一种或多种高渗试剂、其组合等。可以将脱细胞的肝脏或其一部分储存和/或预浸在肝细胞相容性培养基中。然后可以通过任何方便的机制,例如,注射、灌注、
局部施用(例如,逐滴)或其组合向脱细胞的肝脏或其部分应用含有如本文所述的离体操纵的产生肝细胞的细胞的细胞悬浮液。在一些情况下,离体操纵的产生肝细胞的细胞可以存在于细胞悬浮液中,以用于以任何方便且适当的浓度接种到所制备的支架中,所述浓度包含例如1
×
105个或更少个到1
×
107或更多个细胞每50μl的浓度,包含但不限于例如1-2
×
106个细胞每50μl。可以将接种的脱细胞的肝脏、其部分和/或其它无细胞的支架维持在合适的条件下,以用于植入/粘附和/或扩增所引入的细胞,其中此类条件可以包含合适的湿度、温度、气体交换、营养物等。在一些情况下,可以在为或约37℃下在5%co2的情况下将接种的肝脏、其部分和/或其它无细胞的支架维持在合适的培养基中,潮湿的环境下。在将所接种的和/或所产生的肝细胞粘附和/或扩增到脱细胞的肝脏、其部分或其它无细胞的支架上或内之后,所述材料可以用于各种用途,包含例如移植到有需要的受试者,如肝脏功能降低和/或具有肝脏疾病的人类受试者体内。与肝脏,包含人肝脏的脱细胞以及肝细胞接受性无细胞支架的产生相关的方法和试剂在以下中进行了描述:例如mazza等人《科学报告(sci rep)》5,13079(2015);mango等人《先进功能材料(adv.funct.mater.)》2000097(2020);shimoda等人《科学报告》9,1543(2019);croce等人《生物分子(biomolecules)》2019,9(12):813;以及美国专利第10,688,221号,所述文献的公开内容通过引用以其整体并入本文。
[0117]
本公开还提供了一种通过如本文所述的方法产生的肝细胞的群体(例如,包括如本文所述产生的经扩增的肝细胞的药物组合物)。在某些实施例中,所分离的肝细胞的群体是以来自啮齿动物生物反应器(小鼠或大鼠)的每只动物1000万-20亿个人肝细胞,包含例如每只啮齿动物至少5亿个,每只啮齿动物至少7.5亿个,每只啮齿动物至少10亿个等从动物生物反应器收集的。在某些实施例中,所分离的肝细胞的群体是以来自猪生物反应器的每只动物100亿-500亿个人肝细胞,包含例如每只猪至少100亿,每只猪至少200亿,每只猪至少300亿等从动物生物反应器收集的。如本文中所述的所分离的经扩增的肝细胞的群体可以用于离体治疗受试者的肝脏疾病和/或可以在用作对一种或多种肝脏病状的离体治疗之前进一步离体操纵(例如,通过本文描述的更多轮的方法)。
[0118]
通过如本文所述的方法产生的肝细胞的群体以及其药物组合物可以存在于任何合适的容器(例如,培养器皿、管、烧瓶、小瓶、冷冻小瓶、冷冻袋等)中并且可以使用任何合适的递送方法和/或装置而被利用(例如,施用于受试者)。这种肝细胞的群体和药物组合物可以新鲜制备和/或使用或可以冷冻保存。在一些情况下,肝细胞的群体和其药物组合物可以以“即用型”形式制备,包含例如,其中细胞以合适的稀释剂的形式和/或以所期望的递送浓度(例如,以单位剂型)或可以容易稀释到所期望的递送浓度的浓度存在(例如,在合适的稀释剂或培养基的情况下)。肝细胞的群体和其药物组合物可以在递送装置或与所期望的递送机制或所期望递送途径相容的装置中制备,如但不限于例如注射器、输注袋。
[0119]
应用
[0120]
如本文所述的肝细胞可用于治疗和/或预防任何肝脏疾病或病症。例如,通过引入肝细胞在患者体内重组肝脏组织是针对患有任何肝脏病状(例如急性肝脏衰竭、慢性肝脏疾病和/或代谢性或单基因疾病)的患者的潜在治疗选项,包含作为针对这些病状的通过用野生型细胞再殖受试者的肝脏的永久治疗。肝细胞重组可用于,例如,引入用于基因疗法的经基因修饰的肝细胞或替代由于疾病、物理或化学损伤或恶性肿瘤而丧失的肝细胞。此外,
经扩增的人肝细胞可以用于再殖人工肝脏辅助装置。本文提供了将异源性肝细胞移植在动物(例如大鼠、小鼠、兔等)体内并使所述异源性肝细胞在动物体内扩增的具体方法,以及经扩增的异源性肝细胞的医疗用途。可以在事先在体内生物反应器中扩增或不扩增的情况下向有需要的受试者施用离体操纵的肝细胞。
[0121]
本文所述的方法和组合物也可以用于在将肝细胞移植到人类受试者体内之后使肝细胞扩增。例如,可以使用已知方法(例如,静脉内)向人类受试者施用如本文所述的从动物生物反应器获得的离体操纵的经扩增的肝细胞。参见例如dhawan等人,《自然评论:胃肠病学与肝脏病学(nat rev gastroenterol hepatol)》,7:288-98,2010;forbes等人,《肝脏病学(hepatology)》,62:s157-s169,2015。所移植的肝细胞比通过其它方法产生的肝细胞更有效地在受试者体内再殖。在某些实施例中,在受试者体内实现了5-10%或更高的再殖率,这足以在治疗上有效。
[0122]
相比之下,在一些情况下,本文所述的方法可以具体地排除在施用经离体修饰的肝细胞之前、期间和/或之后(无论此类肝细胞是否首先在体内生物反应器中扩增)向受试者施用如本文所述的一种或多种药剂(例如,c-met激动剂(例如,c-met抗体、c-met激动剂小分子、hgf多肽或其衍生物)、egfr激动剂(例如,egfr抗体、egfr激动剂小分子、egf多肽或其衍生物)等,使得在施用经离体修饰的肝细胞之前、期间和/或之后受试者中不存在所述药剂。因此,本文所述的方法包含在治疗期间的任何时间点不向受试者施用在肝细胞的离体操纵期间使用的试剂的治疗。
[0123]
本文所述的组合物和方法提供了治疗和/或预防人类受试者的肝脏疾病的新方法,因为本文提供的经离体扩增的肝细胞是在动物生物反应器中产生的可以直接用于疗法的第一肝细胞。这种令人惊讶且出乎意料的独立使用是动物生物反应器中的离体操纵的肝细胞的扩增和/或植入显著增加和/或移植到患者体内后其扩增和/或植入潜力增加的结果。因此,本文所述的方法可以用于临床中的通过提供健康的肝细胞的肝细胞疗法,包含独立疗法,与当前方法相比,所述肝细胞疗法由于增强的植入特征而产生了更高效的疾病治疗和/或预防。
[0124]
如本文所述的肝细胞和包括如本文所述的肝细胞的组合物可以通过任何合适的方式施用于受试者并施用于任何部分、器官、组织或受试者。施用方式的非限制性实例包含门静脉输注、脐静脉输注、直接脾被膜注射、脾动脉输注、输注到网膜囊中和/或腹膜内注射(输注、移植)。在某些实施例中,所述组合物包括通过输注到腹膜内空间和/或网膜囊中而移植的包封的肝细胞。在某些实施例中,所述组合物包括如本文所述用肝细胞接种和/或再殖并以外科手术方式移植到有需要的受试者体内的无细胞/脱细胞的支架,包括例如合成支架、脱细胞的肝脏等。
[0125]
在施用如本文所述的肝细胞之前和/或之后,还可以用促进肝细胞在受试者体内生长、再生、存活和/或植入的一种或多种药剂(例如,抗体、小分子、rna等)对患者进行治疗。在某些实施例中,可以用至少一种c-met抗体、任选地人特异性的一种抗体对患者进行治疗。一种或多种药剂可以向患者施用1次、2次、3次、4次、5次或更多次并且可以与肝细胞一起施用和/或在与肝细胞不同的时间施用。在一些情况下,在施用如本文所述的肝细胞之前和/或之后,可以不用促进肝细胞在受试者体内生长、再生、存活和/或植入的一种或多种或任何额外的药剂(例如,抗体、小分子、rna等)对患者进行治疗。因此,在一些情况下,所使
用的肝细胞可以是施用于受试者以治疗受试者的病状的唯一活性剂。
[0126]
除了向受试者(患者)施用(移植)或作为所述施用的替代方案,如本文所述的肝细胞还可用于向用于治疗患有肝脏疾病的受试者的装置或组合物供应肝细胞。可以使用本公开的肝细胞的此类装置或组合物的非限制性实例包含生物人工肝脏(bal)(用于患有急性肝脏衰竭的受试者的体外支持装置)和/或脱细胞的肝脏(使器官支架再细胞化以在受试者体内提供肝脏功能)。参见例如shaheen等人(2019)《自然生物医学工程(nat biomed eng.)》doi:10.1038/s41551-019-0460-x;glorioso等人(2015)《肝脏病学杂志》63(2):388-98。
[0127]
此外,涉及向受试者施用肝细胞的离体方法中的任何离体方法可以进一步包括重复所述方法的一个或多个步骤,包含例如在任何时间重复施用如本文所述的肝细胞和/或药剂。
[0128]
可以通过本文所述的方法和组合物治疗的疾病和病症包含但不限于:克里格勒-纳贾尔综合征1型;家族性高胆固醇血症;因子vii缺乏症;糖原贮积病i型;小儿雷弗素姆氏病;进行性家族性肝内胆汁淤积症2型;遗传性酪氨酸血症1型;以及各种尿素循环缺陷;急性肝脏衰竭,包含患有急性药物诱导的肝脏衰竭的幼年和成人患者;病毒诱导的急性肝脏衰竭;特发性急性肝脏衰竭;蘑菇中毒诱导的急性肝脏衰竭;外科手术后急性肝脏衰竭;由妊娠期急性脂肪肝诱导的急性肝脏衰竭;慢性肝脏疾病,包含肝硬化;由以下急性事件之一引起的急性加慢性肝脏疾病:酒精消耗、药物摄入和/或乙型肝炎发作。因此,患者可能患有这些或其它肝脏疾病中的一种或多种肝脏疾病。
[0129]
在一些情况下,根据本文所述方法治疗的疾病和病症可以包含肝细胞特异性(肝细胞内在的)功能障碍。例如,功能障碍以及疾病和/或病症的病因可能是由于或主要归因于受试者体内存在的内源性肝细胞的功能障碍引起的。在一些情况下,肝细胞特异性功能障碍可以是受试者遗传的或遗传性的。在一些情况下,疾病或病症的病因基本上不涉及除肝细胞之外的细胞类型。在一些情况下,疾病或病症导致肝功能降低、肝脏疾病(急性或慢性)或衍生自内源性肝细胞的其它不利病状。因此,在一些情况下,例如,在疾病是内源性肝细胞群体内在的时,有效的治疗可以包含用如本文所述的肝细胞替代、补充、移植或再殖。不受理论的束缚,在肝细胞内在的疾病/病症中,内源性肝细胞的替代和/或补充可以引起显著临床改善,而疾病/病症不会负面地影响所移植的肝细胞。例如,当受试者具有影响肝细胞功能的遗传性病症时(例如,肝细胞内的氨基酸代谢,例如,高酪氨酸血症),同种异体所移植的肝细胞可以基本上不受受试者体内的疾病/病症的存在的影响。因此,所移植的肝细胞可以在受试者体内大量植入、存活、扩增和/或再殖,从而产生显著的阳性临床结果。
[0130]
特征在于肝细胞特异性(肝细胞内在的)功能障碍的疾病和病症可以与病因不是肝细胞特异性的并且涉及肝细胞外在的因素的疾病和病症形成对比。因素和/或病因是肝细胞外在的疾病的实例包含但不限于例如酒精性脂肪性肝炎、酒精性肝脏疾病(ald)、肝脂肪变性/非酒精性脂肪性肝脏疾病(nafld)等。肝细胞外在的疾病涉及内源性肝细胞外部或源自内源性肝细胞外部的肝脏损伤,如酒精、饮食、感染等。
[0131]
肝细胞内在的疾病和肝细胞相关的疾病的实例包含肝相关酶缺乏症、肝细胞相关运送疾病等。这种肝脏相关的缺乏可以是获得性或遗传性疾病,并且可以包含代谢性疾病(如例如,肝脏类代谢障碍)。遗传性肝脏类代谢障碍可以被称为“遗传性代谢性肝脏疾病”,
如但不限于,例如ishak,《临床肝病(clin liver dis)》(2002)6:455-479中描述的那些疾病。在一些情况下,肝脏相关的缺乏可能导致急性和/或慢性肝脏疾病,包含例如,在急性和/或慢性肝脏疾病是尚未治疗或治疗不足时的缺乏症的结果。遗传性肝脏相关酶缺乏症、肝细胞相关运送疾病等的非限制性实例包含克里格勒-纳贾尔综合征1型;家族性高胆固醇血症、因子vii缺乏症、糖原贮积病i型、小儿雷弗素姆氏病、进行性家族性肝内胆汁淤积症2型、遗传性酪氨酸血症(例如,遗传性酪氨酸血症1型)、遗传性尿素循环缺陷、苯丙酮尿症(pku)、遗传性血色素沉着症、α-i抗胰蛋白酶缺乏症(aatd)、威尔逊病等。肝脏的遗传代谢病,包含具有至少一些肝脏表型、病理学和/或肝脏相关症状的代谢疾病的非限制性实例包含5-β还原酶缺乏症、aact缺乏症、阿斯科格综合征(aarskog syndrome)、无β脂蛋白血症、肾上腺脑白质营养不良、阿尔珀斯病(alpers disease)、阿尔珀斯综合征、α-1-抗胰蛋白酶缺乏症、抗凝血酶iii缺乏症、精氨酸酶缺乏症、精氨琥珀酸尿症、肝动脉发育不良症、自身免疫性淋巴增生综合征、良性复发性胆汁淤积、β-地中海贫血、布卢姆综合征(bloom syndrome)、巴德-吉亚利综合征(budd-chiari syndrome)、碳水化合物缺乏的糖蛋白综合征、神经酰胺酶缺乏症、蜡样脂褐质沉积症、胆固醇脂贮积病、胆固醇酯贮积病、慢性肉芽肿、慢性丙型肝炎、克里格勒-纳贾二氏综合征、囊性纤维化、胱氨酸病、糖尿病、杜宾-约翰逊综合征(dubin-johnson syndrome)、地方性蒂罗尔肝硬化(endemic tyrolean cirrhosis)、红细胞生成性原卟啉症、法布里病(fabry disease)、家族性高胆固醇血症、家族性脂肪性肝炎、纤维蛋白原贮积病、半乳糖血症、神经节苷脂沉积症、高雪氏(gaucher disease)、遗传性血色素沉着症、糖原病1a型、糖原病2型、糖原病3型、糖原病4型、肉芽肿病、肝家族性淀粉样变性、遗传性果糖病综合征、遗传性球形红细胞症、赫曼斯基-普德拉克综合征(hermansky-pudlak syndrome)、高胱氨酸尿症、高草酸尿症、低β脂蛋白血症、低纤维蛋白原血症、妊娠期肝内胆汁淤积症、(lafora disease)、脂酰胺脱氢酶缺乏症、脂蛋白病症、莫里阿克综合征(mauriac syndrome)、异染性脑白质营养不良、线粒体细胞病、纳瓦霍神经肝病(navajo neurohepatopathy)、尼曼-匹克病(niemann-pick disease)、无综合征性胆管缺乏症、北美印第安印度儿童肝硬化(north american indian childhood cirrhosis)、鸟氨酸氨甲酰基转移酶缺乏症、部分脂肪营养不良、皮尔森综合征(pearson syndrome)、迟发性皮肤卟啉症、进行性家族性肝内胆汁淤积症、进行性家族性肝内胆汁淤积症1型、进行性家族性肝内胆汁淤积症2型、蛋白c缺乏症、舒氏综合征(shwachman syndrome)、丹吉尔病(tangier disease)、血小板减少性紫癜、总脂肪代谢障碍、1型糖原病、蒂罗尔肝硬化(tyrolean cirrhosis)、酪氨酸血症、尿素循环障碍、静脉闭塞病、威尔逊病(wilson disease)、沃尔曼病(wolman disease)、x-连锁高igm综合征和齐薇格综合征(zellweger syndrome)。
[0132]
根据本文所述的方法治疗受试者可以产生各种临床益处和/或可测量的结果,包含但不限于例如存活期延长、疾病进展延迟(例如,肝脏衰竭延迟)、肝脏衰竭得到预防、肝脏功能得到改善和/或正常化、氨基酸水平得到改善和/或正常化、氨水平得到改善和/或正常化、白蛋白水平得到改善和/或正常化、胆红素得到改善和/或正常化、从无法茁壮成长的表型中恢复、嗜睡减少、迟钝减少、癫痫减少、黄疸减少、血清葡萄糖得到改善和/或正常化、inr得到改善和/或正常化、尿液检测结果得到改善和/或正常化等。例如,在一些情况下,相比于例如根据护理标准治疗和/或施用了尚未如本文所述进行离体操纵的产生肝细胞的细
胞的受试者,如肝细胞等已经如本文所述进行离体操纵的产生肝细胞的细胞例的施用使患有肝脏疾病和/或导致肝脏衰竭的病状的受试者的存活期增加了至少5%。此类受试者体内的观察到的增强的存活水平可以变化并且范围可以为增加至少5%到60%或更多,包含但不限于例如存活期增加至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%或更多。在一些情况下,施用了已如本文所述进行离体操纵的产生肝细胞的细胞的受试者可能经历疾病进展的延迟和/或一种或多种疾病症状的发作,如但不限于例如肝脏衰竭和/或可归因于肝脏衰竭的任何症状。这种疾病进展和/或症状发作的延迟可以持续数天、数周、数月或数年,包含但不限于例如至少一周、至少一个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少一年或更多。施用于患者的本文所述的肝细胞随着时间的推移在患者体内产生有益治疗反应。
[0133]
以下实例涉及本公开的示例性实施例。应当理解,这仅出于例示的目的,并且也可以使用其它抗体、核酸(例如,dna和/或rna)或小分子(除c-met外)。
[0134]
实例
[0135]
实例1:c-met抗体的表征
[0136]
针对hepg2和原代人肝细胞(phh)的信号传导激活在体外对商业获得的c-met抗体进行了评价。具体地,在标准条件下将细胞与商业获得的抗体一起温育2小时,并且通过facs分析和蛋白质印记进行评价。通过facs识别天然人c-met受体并激活人肝脏细胞中的hgf/c-met信号传导通路的抗体被表征为c-met激动剂抗体。
[0137]
另外,通过洗出测定如下对抗体动力学进行评价。在有或没有c-met抗体(10μg/ml)(或hgf对照(100ng/ml))的情况下激动hepg2细胞持续1小时。将抗体保留在样品中或洗出,并在以下时间点提取样品:处理后1小时、2.5小时、5小时、1天、2天和5天。
[0138]
结果显示,用c-met激动剂抗体或hgf(100ng/ml)处理1小时可高度激活c-met/gab1信号传导通路。此外,出乎意料地发现,在激动剂保留的条件和激动剂洗出的条件两者下,相比于用hgf处理的样品中看到的信号传导激活,由用c-met抗体处理引起的信号传导激活随着时间的推移显著更加持久(例如,对于保留的样品至多5天并且对于洗出的样品为2天)。
[0139]
这些结果表明,在相应激动剂与细胞一起保留在培养物中时并且在初始温育时间之后的洗出/去除时,c-met激动剂抗体治疗可以提供更持久的通路激活(例如,相比于hgf诱导的通路激活)。
[0140]
实例2:肝细胞的离体操纵
[0141]
在移植到frg动物体内之前对原代人肝细胞进行离体操纵,并且对c-met抗体离体操纵对所移植的肝细胞的扩增和植入的影响进行评价如下。
[0142]
从碧迪公司(bd)获得原代肝细胞并将其储存在-80℃下。肝细胞培养基制备如下:肝细胞基础培养基(龙沙公司)和hcm single
tm quots
tm
的1:1混合物、5%fbs和10um rock抑制剂。对于这些实验,从义翘神州科技有限公司(sino biological)(c-met ab#1)和r&d系统公司(r&d systems)(c-met ab#2)商购获得c-met抗体。从义翘神州科技有限公司商购获得egfr抗体。
[0143]
在移植当天(第0天),根据以下方案解冻和制备冷冻保存的原代人肝细胞:
[0144]
(1)将1
×
50ml肝细胞解冻培养基(赛默飞世尔公司)温热到37℃。在37℃水浴中快速解冻冷冻保存的人肝细胞并且将肝细胞转移到肝细胞解冻培养基(赛默飞世尔公司)。
[0145]
(2)在室温下以100g将细胞悬浮液离心10分钟以形成细胞团块,并且然后丢弃上清液。
[0146]
(3)轻轻地通过打旋使细胞团块重悬,并且然后添加47ml肝细胞培养基。
[0147]
(4)在室温下以80g将细胞悬浮液离心4分钟以形成细胞团块,并且然后丢弃上清液。
[0148]
(5)轻轻地通过在少量肝细胞培养基中打旋使细胞团块重悬(因细胞批次而异,重悬到估计细胞密度1.0-2.0
×
106个细胞/ml)。
[0149]
(6)用台盼蓝染色在血细胞计上执行手动细胞计数,以确定活的和死的肝细胞的数量。
[0150]
(7)在肝细胞培养基中将活肝细胞的浓度调整为1.0
×
106个细胞/ml。
[0151]
(8)针对每个组将细胞与期望浓度的抗体混合,并且以2ml/孔将细胞铺板到6孔超低连接板(细胞密度1.0
×
106个细胞/ml)。将板放置在培养箱内的摇动平台上并摇动1-2小时。
[0152]
(9)在摇动过程期间每30分钟手动轻轻晃动/混合以进行混合。
[0153]
(10)摇动之后,将细胞转移到15ml管中。
[0154]
(11)以80g自旋向下持续4分钟。
[0155]
(12)抽吸上清液(去除未结合的抗体)。
[0156]
(13)以每次动物移植100ul等分试样轻轻地将肝细胞重悬在具有dna酶(2ug/ml)的肝细胞培养基中,从而将每个等分试样放置到单独的管中以进行每次移植。在移植之前将细胞保持在冰上。
[0157]
实例3:体内生物反应器中的肝细胞的产生
[0158]
按照标准移植方案,通过脾内注射将如上文实例2中所述制备的人肝细胞移植到frg小鼠中。根据美国专利第8,569,573号中所述的ntbc循环方案,对小鼠循环接通/断开ntbc,所述专利的公开内容通过引用以其整体并入本文。
[0159]
在移植后1周、4周和8周时收获肝脏,并且如美国专利8,569,573中所述通过fah ihc和人白蛋白elisa对所移植的人肝细胞的再殖进行评价,所述美国专利的公开内容通过引用以其整体并入本文。
[0160]
如图2a到图5所示,对肝细胞的离体操纵引起frg动物的植入和扩增水平增加。具体地,相比于使用当前程序(即,缺乏本文所述的离体操纵的程序)获得的5-30%的再殖范围,用c-met激动剂抗体进行的离体操纵通过在8周内达到70-90%的再殖而显着改善了所移植的人肝细胞的体内再殖动力学。
[0161]
图2a和2b表明,相比于接受未经受离体操纵的肝细胞的动物(“无ab对照”),使用通过fah ihc进行的定性(图2b)和定量(图2a)评估,在接受了通过应用激动性c-met抗体(“c-met ab”)离体操纵的肝细胞的动物体内,在移植后1周植入和扩增增加。图2c和图2d类似地表明,相比于接受未进行离体操纵的肝细胞的动物,在接受离体操纵的肝细胞的动物体内在移植后2周肝细胞再殖增加。具体地,这些结果显示,通过fah ihc,c-met ab组中的肝细胞的数量增加(图2c,上图和图2d),而且相比于对照,c-met ab组中的如通过更高的人
白蛋白水平所测量的功能性再殖也得到增强(图2c,下图)。图2e和图2f进一步表明,相比于对照如通过fah ihc(图2e,上图和图2f)和人白蛋白elisa(图2e,下图)测量的,在接受用c-met激动剂抗体离体操纵的肝细胞的动物体内,在移植后4周时再殖的增强持续。在移植后4周和6周时通过人白蛋白elisa量化的额外研究进一步表明,如相比于接受未经处理的对照(即,非离体操纵的)肝细胞的动物,在接受用c-met激动剂抗体离体操纵的经处理的肝细胞的小鼠体内,平均而言,再殖率增加了约2倍或更大。例如,此类另外的研究显示,在移植后4周,接受c-met激动剂抗体离体操纵的肝细胞的小鼠的平均人白蛋白水平为388μg/ml,相比之下接受未经受离体操纵的肝细胞的对照的58μg/ml,差异在统计学上显著(p=0.0076)。
[0162]
图3中显示的示例性结果表明,在移植后8周时,接受未经处理的人肝细胞移植的对照动物生物反应器的fah 人肝细胞再殖率低于17%,并且此动物的人白蛋白水平低于4000μg/ml(左图,“无ab对照”)。相比之下,在移植有用c-met激动剂抗体(中图(“c-met ab_1”)和右图(“c-met ab_2”))处理的人肝细胞的动物体内实现了fah 人肝细胞再殖水平的约90%。另外,在这些离体操纵的动物体内观察到人白蛋白水平高于14,000μg/ml。在另外的研究中,在移植后8周时通过fah肝脏ihc和血液人白蛋白elisa进行的定量显示,在接受了c-met激动剂处理的肝细胞的多只动物体内,再殖水平高于70%并且人白蛋白水平高于4000μg/ml。平均而言,相比于接受未用c-met激动剂抗体离体操纵的肝细胞的动物,再殖(例如,通过fah肝脏ihc和/或血液人白蛋白elisa测量的)在移植后8周时在接受了c-met激动剂抗体离体操纵的肝细胞的动物体内增强了约两倍或更多。
[0163]
如图4所示,在移植后4周和8周两者时,相比于未经处理的细胞,用egfr抗体对细胞进行的离体操纵也改善了再殖。在单独研究中,相比于接受未进行离体操纵的人肝细胞的对照小鼠,在接受egfr抗体离体操纵的人肝细胞的小鼠体内早在移植后2周时就观察到再殖水平增强。具体地,在egfr抗体离体操纵的组中在2周时检测到小鼠的人白蛋白水平高于100μg/ml,并且此组的平均值比未离体操纵的组高》2倍,其中所有动物的人白蛋白水平低于50μg/ml。
[0164]
如图5所示,如通过2周时的白蛋白产生水平和fah ihc确定的,相比于未经处理的细胞,在移植前用c-met egfr抗体处理的细胞也使动物生物反应器中的人肝细胞的植入和扩增显著增加。另外,通过用c-met和egfr抗体两者离体处理的细胞进行的再殖的最大值和平均值两者在2周时均大于在接受单独用c-met抗体离体处理的细胞的动物体内观察到的对应再殖水平。
[0165]
还使用了大鼠frg动物作为体内生物反应器,以用于肝细胞(例如,人肝细胞)的产生(即扩增)。在此类方法中,如以上在实例2中描述的对人肝细胞进行处理,并将其施用于循环接通/断开ntbc的大鼠(例如,类似于上针对小鼠所述的ntbc循环)。可以通过与促进肝细胞生长、再生、存活和/或植入的至少一种药剂,包含例如c-met激动剂(如c-met激动剂抗体)、egfr激动剂(如egfr激动剂抗体),接触并移植等来对包含原代人肝细胞的人肝细胞进行离体操纵。在移植后2周、4周、8周、12周和/或16周收获大鼠肝脏并针对通过所移植的肝细胞的再殖进行评价。例如,可以针对如人fah表达等人蛋白质表达对所收获的大鼠肝脏进行评价,如上所述。在一些情况下,可以从活的大鼠获得血液样品以用于再殖的研究中评价,例如,通过使用人白蛋白定量作为通过所移植的细胞再殖的水平的替代量度。任选地,在移植之前、期间和/或之后用c-met和/或egfr抗体一次或多次对大鼠进行治疗。
[0166]
离体操纵,包含暴露于c-met抗体,增加了frg大鼠的植入和扩增的水平,从而到移植后8-16周实现了至少50-70%或更多的再殖。
[0167]
如下执行如本文所述的frg啮齿动物模型中的人肝细胞再殖的fah ihc定量。通过pannoramic midi ii载玻片扫描仪对针对fah阳性细胞(通过fah特异性抗体)染色的ihc载玻片进行扫描。然后使用caseviewer软件cellquant模块对所扫描的载玻片进行分析。在模块特性和测量参数下构建标准场景。由细胞质的宽度和细胞质的染色强度定义细胞。通过细胞质中的颜色解卷积、指示色原的阳性和指示复染的阴性来完成细胞检测。由染色强度(0、 1、 2或 3)定义fah阳性细胞,其中0为未检测到阳性强度,并且 3为检测到强阳性强度。必要时调整评分。再殖率被确定为细胞 3(强fah阳性)对检测到的总细胞的百分比(基于上述细胞检测标准)。
[0168]
实例4:通过移植离体操纵的人肝细胞增强对肝脏疾病的拯救
[0169]
在此研究中,使用了frg大鼠作为肝脏疾病的临床相关模型,因为在ntbc不存在的情况下,此类大鼠会重现肝脏衰竭,所述肝脏衰竭据观察是由人类患者的1型遗传性酪氨酸血症未得到治疗引起的。对应地,对人类疾病进行建模,在替代性干预不存在的情况下,frg大鼠会患上肝脏衰竭并最终死于肝功能衰竭。为了对如本文所述的离体操纵的人肝细胞在此模型中体内治疗肝脏衰竭的能力进行测试,向frg大鼠施用细胞疗法剂量的(1)用c-met抗体激动剂离体操纵的原代人肝细胞或(2)未用c-met抗体激动剂离体操纵的对照原代人肝细胞。在本文所述的整个观察过程中,在没有ntbc补充的情况下维持所移植的动物,并且将动物存活期作为疾病进展的标志物进行测定。到移植后7天,相比于在用未离体操纵的肝细胞治疗的组中的25%存活期,在接受c-met激动剂抗体离体操纵的肝细胞的大鼠组中观察到91.7%的存活期。此研究表明,本文所述的离体操纵的人肝细胞的施用可有效治疗人类疾病的啮齿动物模型中的肝脏衰竭。这些数据显示,相比于包含未经受如本文所述的离体操纵的肝细胞的匹配的对照治疗,离体操纵的人肝细胞的施用增加了存活期并延迟了疾病进展。
[0170]
实例5:离体疗法
[0171]
使用标准方案将包括在如本文所述,例如实例3中所述,的动物生物反应器中制备的人肝细胞的药物组合物移植到患有一种或多种肝脏疾病或病症的人类受试者体内。
[0172]
在一些情况下,在移植之前,可以使用标准技术对从动物生物反应器中分离的肝细胞进行包封,例如以下。基本上如下所述产生空微珠和肝细胞微珠(emb和hmb):dhawan等人(2019)《肝脏病学杂志》72(5):p877-884以及jitraruch等人(2014)《公共科学图书馆
·
综合》9:10。简而言之,使用ie-50r包封器(瑞士多蒂孔的创新技术包封公司(inotech encapsulation ag,dottikon,switzerland))利用250-μm喷嘴和无菌临床级试剂产生肝细胞微珠。将具有低粘度和高葡萄糖醛酸(挪威桑维卡novamatrix公司(novamatrix,sandvika,norway)的pronova
tm slg20)的超纯海藻酸钠溶解在0.9%nacl中,以给出1.5%海藻酸钠溶液的最终浓度(w/v),并以2.5
×
106个细胞/ml藻酸盐的密度与细胞混合。使微珠在1.2%cacl2溶液中交联持续10分钟,并且用0.9%nacl洗涤两次以去除过量ca
2
离子。微珠平均直径为500sd 100μm。
[0173]
向受试者施用肝细胞组合物(包含藻酸盐hmb)。施用可以通过输注到腹腔内腔中进行,包含在连续心肺监测下的重症监护室中。作为急性肝脏衰竭管理的一部分,可以在输
注时使受试者(成人和幼年)通气。治疗前,将国际标准化比值(inr)校正为《2并且将血小板校正为》50,000/微升。将16号插管放置在超声引导下穿过前腹壁并且位于5-20ml/kg/次肝细胞之间(例如,在超声引导下在20-45分钟内输注细胞培养基中的藻酸盐hmb)。剂量可以被计算为每ml藻酸盐大约2500万个细胞。通常监测患者的生命体征、腹胀、肠梗阻、腹部出血、尿排出量和/或过敏症或感染的迹象。
[0174]
所移植的肝细胞植入在人类受试者体内并扩增并通过降低症状的严重度和/或频率、消除症状和/或基本病因、防止症状和/或其基本病因的发生和/或改善或补救由疾病造成的损伤来治疗一种或多种肝脏疾病。
[0175]
本文提到的所有专利、专利申请和出版物出于所有目的通过引用以其整体在此并入。
[0176]
虽然出于清楚和理解的目的,已经通过说明以及实例相当详细地提供了本公开,但是本领域的技术人员应当清楚的是,可以实践不同的变化和修改而不背离本公开的精神或范围。因此,前述描述和实例不应被解释为限制。
[0177]
实施例
[0178]
因此,本文所述的本发明主题的实施例单独或与一个或多个其它方面或实施例组合可以是有利的。在不限制本描述的情况下,以下提供了连续编号的本公开的某些非限制性实施例。本领域的技术人员在阅读本公开时将显而易见的是,每个单独编号的实施例可以与任何前述或以下单独编号的实施例一起使用或组合。这旨在为所有这些实施例的组合提供支持,并且不限于下文明确提供的实施例的组合:
[0179]
1.一种产生肝细胞的方法,所述方法包括:
[0180]
向动物生物反应器施用产生肝细胞的离体操纵的细胞,使得肝细胞在所述动物的肝脏中扩增,任选地其中在施用之后8-16周内,经扩增的肝细胞占所述动物的总肝细胞群体的至少70%;以及
[0181]
从所述动物中分离所述经扩增的肝细胞。
[0182]
2.根据实施例1所述的方法,其中所述离体操纵包括将所述产生肝细胞的细胞与促进所述肝细胞在所述动物生物反应器中生长、再生、存活和/或植入的至少一种药剂一起培养。
[0183]
3.根据实施例2所述的方法,其中至少一种或多种药剂包括一种或多种抗体、一种或多种小分子和/或一种或多种核酸,任选地c-met和/或表皮生长因子(egfr)抗体。
[0184]
4.根据前述实施例中任一项所述的方法,其中所述经扩增的肝细胞是人肝细胞。
[0185]
5.根据前述实施例中任一项所述的方法,其中所述动物生物反应器包括经基因修饰的动物。
[0186]
6.根据前述实施例中任一项所述的方法,其中所述动物生物反应器是fah缺乏的。
[0187]
7.根据前述实施例中任一项所述的方法,其中所述动物生物反应器包括小鼠、大鼠或猪。
[0188]
8.根据前述实施例中任一项所述的方法,其中将所述离体操纵的产生肝细胞的细胞注射到所述动物生物反应器中。
[0189]
9.根据前述实施例中任一项所述的方法,其中将所述离体操纵的产生肝细胞的细胞静脉内注射到所述动物生物反应器中。
[0190]
10.根据前述实施例中任一项所述的方法,其中向所述动物生物反应器的器官施用所述离体操纵的产生肝细胞的细胞,任选地通过脾内注射、门内注射或直接注射到所述动物生物反应器的肝脏中。
[0191]
11.根据前述实施例中任一项所述的方法,其中在所述动物生物反应器中实现了大于10%的肝细胞再殖率。
[0192]
12.根据前述实施例中任一项所述的方法,其中在所述动物生物反应器中实现了大于40%的肝细胞再殖率。
[0193]
13.根据前述实施例中任一项所述的方法,其中所述产生肝细胞的细胞是从商业来源获得的或者是从活的受试者或尸体中分离的,或者是体外预扩增的原代人肝细胞,并且然后经受离体操纵。
[0194]
14.根据前述实施例中任一项所述的方法,其中所述离体操纵包括在施用于所述动物生物反应器之前将所述产生肝细胞的细胞与所述至少一种药剂一起培养持续1分钟到2天。
[0195]
15.根据前述实施例中任一项所述的方法,其中所述离体操纵进一步包括摇动与所述至少一种药剂一起温育的所述产生肝细胞的细胞的步骤。
[0196]
16.根据前述实施例中任一项所述的方法,其进一步包括在施用离体操纵的产生肝细胞的细胞之前和/或之后向所述动物生物反应器施用ntbc的步骤。
[0197]
17.根据前述实施例中任一项所述的方法,其中使所述离体操纵的产生肝细胞的细胞在所述动物生物反应器中扩增持续4周到16周,任选地6周到10周,任选地少于8周。
[0198]
18.根据前述实施例中任一项所述的方法,其中所述经扩增的肝细胞占所述动物生物反应器的总肝细胞群体的至少40%。
[0199]
19.根据前述实施例中任一项所述的方法,其进一步包括分离所述经扩增的肝细胞并且使所分离的经扩增的肝细胞经受另外的离体操纵,任选地其中所述离体操纵包括将所述所分离的经扩增的肝细胞与促进肝细胞生长、再生、存活和/或植入的至少一种药剂一起培养。
[0200]
20.一种通过根据前述实施例中任一项所述的方法产生的经扩增的肝细胞的群体。
[0201]
21.根据实施例20所述的经扩增的肝细胞的群体,其中相比于由未与所述至少一种药剂一起培养的产生肝细胞的细胞产生的肝细胞,所述肝细胞更健康、更好地植入和/或更具增殖性。
[0202]
22.一种动物生物反应器或其肝脏,其包括经扩增的离体操纵的人肝细胞,其中所述人肝细胞占所述动物生物反应器的肝脏细胞体积的多于40%和/或所述动物生物反应器的肝脏肝细胞的多于40%。
[0203]
23.一种治疗和/或预防有需要的受试者的一种或多种肝脏疾病或病症的方法,所述方法包括向所述受试者施用通过根据前述实施例中任一项所述的方法产生的经扩增的肝细胞或从根据实施例22所述的动物生物反应器中分离的人肝细胞。
[0204]
24.根据实施例23所述的方法,其中所述肝脏疾病是慢性肝脏疾病或急性肝脏疾病。
[0205]
25.根据实施例23或24所述的方法,其中所述肝脏疾病为:肝硬化;急性加慢性肝
脏衰竭(aclf);药物或中毒诱导的肝脏衰竭;先天性代谢性肝脏疾病;克里格勒-纳贾尔综合征1型;家族性高胆固醇血症;因子vii缺乏症;因子viii缺乏症(a型血友病);苯丙酮尿症(pku);糖原贮积病i型;小儿雷弗素姆氏病;进行性家族性肝内胆汁淤积症2型;遗传性酪氨酸血症1型;尿素循环缺陷;急性肝脏衰竭;急性药物诱导的肝脏衰竭;病毒诱导的急性肝脏衰竭;特发性急性肝脏衰竭;蘑菇中毒诱导的急性肝脏衰竭;外科手术后急性肝脏衰竭;由妊娠期急性脂肪肝诱导的急性肝脏衰竭;慢性肝脏疾病,包含酒精性肝炎、肝性脑病、肝硬化;和/或由酒精消耗、药物摄入引起的急性加慢性肝脏疾病和/或乙型肝炎发作。
[0206]
26.根据实施例23到25中任一项所述的方法,其中所述肝细胞是通过门静脉输注、脐静脉输注、直接脾被膜注射、脾动脉输注、腹腔注射、淋巴结注射施用的,任选地其中所述肝细胞包括包封的肝细胞。
[0207]
27.根据实施例23到26中任一项所述的方法,其进一步包括向所述受试者施用促进肝细胞在所述受试者体内生长、再生、存活和/或植入的一种或多种药剂的步骤。
[0208]
28.根据实施例27所述的方法,其中所述一种或多种药剂包括一种或多种抗体、一种或多种小分子和/或一种或多种核酸。
[0209]
29.根据实施例27或28所述的方法,其中至少一种药剂包括c-met抗体,任选地其中所述c-met抗体是人特异性的。
[0210]
30.根据实施例27到29中任一项所述的方法,其中向所述受试者施用所述一种或多种药剂一次、两次或更多次,任选地与所述肝细胞一起施用和/或在与所述肝细胞不同的时间施用。
[0211]
31.一种试剂盒,其包括产生肝细胞的细胞(例如,人肝细胞)和/或促进肝细胞生长、再生、存活和/或植入的至少一种药剂,所述试剂盒任选地包括用于执行前述方法中的任何方法的说明书。
[0212]
32.一种产生肝细胞的方法,所述方法包括:
[0213]
通过使所述细胞与促进生长、再生、存活和/或植入的至少一种药剂离体接触来操纵产生肝细胞的细胞;
[0214]
在适合于植入的条件下将离体操纵的细胞移植到体内生物反应器中;以及
[0215]
将所述体内生物反应器维持在适合于使所植入的细胞扩增并产生肝细胞的条件下,任选地与缺乏所述离体操纵的对应方法相比,将植入和/或再殖效率增加至少10%。
[0216]
33.根据实施例32所述的方法,其中所述操纵包括搅动含有所述产生肝细胞的细胞和所述至少一种药剂的器皿,任选地其中所述搅动包括摇动。
[0217]
34.根据实施例33所述的方法,其中所述方法进一步包括在所述移植之前将所述至少一种药剂与所述离体操纵的细胞分离。
[0218]
35.根据实施例34所述的方法,其中所述分离包括去除所述至少一种药剂和/或分离所述离体操纵的细胞,任选地其中所述分离包括离心和/或抽吸。
[0219]
35.根据实施例32到35中任一项所述的方法,其进一步包括分离所述经扩增的肝细胞。
[0220]
36.根据实施例32到25中任一项所述的方法,其中所产生的肝细胞是人肝细胞,任选地其中所述产生肝细胞的细胞包括原代人肝细胞。
[0221]
37.根据实施例32到36中任一项所述的方法,其中所述至少一种药剂包括与生长
因子受体特异性结合的激动剂。
[0222]
38.根据实施例37所述的方法,其中所述激动剂包括小分子或抗体。
[0223]
39.根据实施例37或38所述的方法,其中所述生长因子受体为c-met和/或egfr。
[0224]
40.根据实施例32到39中任一项所述的方法,其中所述至少一种药剂包括c-met激动剂抗体和/或egfr激动剂抗体。
[0225]
41.根据实施例32到40中任一项所述的方法,其中所植入的细胞扩增持续2周到16周的时间段。
[0226]
42.根据实施例32到41中任一项所述的方法,其中所述经扩增的肝细胞占所述体内生物反应器的总肝细胞群体的至少50%。
[0227]
43.根据实施例32到42中任一项所述的方法,其中所述体内生物反应器包括内源性肝脏损伤,任选地其中所述体内生物反应器被基因修饰为包括所述内源性肝脏损伤。
[0228]
44.根据实施例32到43中任一项所述的方法,其中所述体内生物反应器是免疫抑制的,任选地其中所述体内生物反应器被基因修饰为免疫抑制的。
[0229]
45.根据实施例32到44中任一项所述的方法,其中所述体内生物反应器是包括fah缺乏症、il-2rγ缺乏症、rag1缺乏症、rag2缺乏症或其任何组合的小鼠、大鼠或猪。
[0230]
46.根据实施例45所述的方法,其中所述体内生物反应器是包括fah、rag1和/或rag2以及il-2rγ缺乏症(frg)的啮齿动物或猪。
[0231]
47.根据实施例32到46中任一项所述的方法,其进一步包括在施用离体操纵的产生肝细胞的细胞之前和/或之后向所述生物反应器施用ntbc。
[0232]
48.根据实施例32到47中任一项所述的方法,其中向所述体内生物反应器的器官施用所述离体操纵的产生肝细胞的细胞,任选地通过脾内注射、门内注射或直接注射到所述体内生物反应器的肝脏中。
[0233]
49.根据实施例32到48中任一项所述的方法,其中所述产生肝细胞的细胞是从商业来源获得的或者是从活的受试者或尸体中分离的,或者是体外预扩增的原代人肝细胞,并且然后经受离体操纵。
[0234]
50.根据实施例32到49中任一项所述的方法,其中所述离体操纵包括在施用于所述体内生物反应器之前将所述产生肝细胞的细胞与所述至少一种药剂一起培养持续1分钟到2天。
[0235]
51.一种治疗受试者的肝脏疾病的方法,所述方法包括:
[0236]
以有效在体内植入和扩增的量向所述受试者施用产生肝细胞的离体操纵的细胞,由此治疗受试者的所述肝脏疾病。
[0237]
52.根据实施例51所述的方法,其进一步包括使产生肝细胞的细胞与促进生长、再生、存活和/或植入的至少一种药剂接触以产生所述离体操纵的细胞。
[0238]
53.根据实施例51或52所述的方法,其进一步包括在施用于所述受试者之前使所述离体操纵的细胞在体内生物反应器中扩增。
[0239]
54.根据实施例51到53中任一项所述的方法,其中所述肝脏疾病为:肝硬化;急性加慢性肝脏衰竭(aclf);药物或中毒诱导的肝脏衰竭;先天性代谢性肝脏疾病;克里格勒-纳贾尔综合征1型;家族性高胆固醇血症;因子vii缺乏症;因子viii缺乏症(a型血友病);苯丙酮尿症(pku);糖原贮积病i型;小儿雷弗素姆氏病;进行性家族性肝内胆汁淤积症2型;遗
传性酪氨酸血症1型;尿素循环缺陷;急性肝脏衰竭;急性药物诱导的肝脏衰竭;病毒诱导的急性肝脏衰竭;特发性急性肝脏衰竭;蘑菇中毒诱导的急性肝脏衰竭;外科手术后急性肝脏衰竭;由妊娠期急性脂肪肝诱导的急性肝脏衰竭;慢性肝脏疾病,包含酒精性肝炎、肝性脑病、肝硬化;和/或由酒精消耗、药物摄入引起的急性加慢性肝脏疾病和/或乙型肝炎发作。
[0240]
55.根据实施例51到54中任一项所述的方法,其中所述肝脏疾病为遗传性病症。
[0241]
56.根据实施例51到55中任一项所述的方法,其中所述肝脏疾病包括肝脏衰竭。
[0242]
57.根据实施例51到56中任一项所述的方法,其中所述肝脏疾病包括肝脏相关的酶缺乏症。
[0243]
58.根据实施例51到57中任一项所述的方法,其中所述肝脏疾病为遗传性酪氨酸血症。
[0244]
59.根据实施例51到58中任一项所述的方法,其中所述治疗至少使所述受试者的存活期延长,任选地与未施用所述离体操纵的细胞的相当的受试者的存活期相比。
[0245]
60.一种细胞的用途,所述细胞是通过根据前述实施例所述的方法或系统中的任何方法或系统产生的,其用于治疗肝脏疾病。
[0246]
61.一种根据实施例20或21所述的细胞的群体在治疗肝脏疾病中的用途。
[0247]
62.根据实施例56或57所述的用途,其中所述肝脏疾病为:肝硬化;急性加慢性肝脏衰竭(aclf);药物或中毒诱导的肝脏衰竭;先天性代谢性肝脏疾病;克里格勒-纳贾尔综合征1型;家族性高胆固醇血症;因子vii缺乏症;因子viii缺乏症(a型血友病);苯丙酮尿症(pku);糖原贮积病i型;小儿雷弗素姆氏病;进行性家族性肝内胆汁淤积症2型;遗传性酪氨酸血症1型;尿素循环缺陷;急性肝脏衰竭;急性药物诱导的肝脏衰竭;病毒诱导的急性肝脏衰竭;特发性急性肝脏衰竭;蘑菇中毒诱导的急性肝脏衰竭;外科手术后急性肝脏衰竭;由妊娠期急性脂肪肝诱导的急性肝脏衰竭;慢性肝脏疾病,包含酒精性肝炎、肝性脑病、肝硬化;和/或由酒精消耗、药物摄入引起的急性加慢性肝脏疾病和/或乙型肝炎发作。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。