新型抗肌钙蛋白t抗体
技术领域
1.本发明涉及与人心肌肌钙蛋白t(seq id no:1)特异性结合的新型单克隆抗体,该抗体的特征在于cdr包含以下氨基酸序列或最多有一个氨基酸的取代的其变体:(i)在轻链可变结构域中包含seq id no:2的氨基酸序列的cdr1、包含seq id no:3的氨基酸序列的cdr2、以及包含seq id no:4的氨基酸序列的cdr3,和(ii)在重链可变结构域中包含seq id no:5的氨基酸序列的cdr1、包含seq id no:6的氨基酸序列的cdr2和包含seq id no:7的氨基酸序列的cdr3。
背景技术:
2.在本说明书中,引用了大量文件,包括专利申请书和制造商手册。所述文件的公开内容,被认为与本发明的专利性无关,而是以全文引用的方式并入本文。更具体而言,所有参考文件的引用程度如同将每个单独的文件具体且单独地以引用方式并入本文。
3.心肌肌钙蛋白是反映心肌损伤的敏感和特异性生物标志物。特别地,心肌肌钙蛋白t(ctnt)具有高度的心脏特异性,并且在非心肌或其他组织损伤后,它不存在于血清中。此外,与其他用于诊断心肌梗塞的生物标志物相比,ctnt已被证明是一种更持久、更敏感的生物标志物。因此,心肌肌钙蛋白通常可用于诊断急性心肌缺血,而ctnt尤其有用。
4.心肌肌钙蛋白t是心脏病患者广泛使用的生物标志物。westermann等人最近综述了它在心脏病患者中的效用(自然评论/心脏病学(nature reviews/cardiology),第14卷(2017)473-483。ctnt的使用在疑似急性心肌梗死(ami)患者中已得到广泛应用,但肌钙蛋白的测量也被应用于其他急性和非急性情况。对于疑似ami患者,早期决策对于快速治疗和进一步诊断评估至关重要。
5.较新的、高灵敏度的肌钙蛋白测定法可以检测明显较低的浓度。已报道一些利用这些测定法和非常低的截止浓度的快速诊断策略,以改善急性心脏护理的诊断。此外,肌钙蛋白测定的非冠状动脉和非急性应用——例如作为心力衰竭、肺栓塞或稳定性冠状动脉疾病患者的生物标志物——即将出现,并可能会改善个体的风险分层。
6.心肌肌钙蛋白t通常在夹心型免疫测定中测量,其中至少一种抗体用于捕获ctnt,并且至少第二种(标记的)抗体用于检测样品中的ctnt。德国罗氏诊断公司出售的第五代ctnt测定法也是如此。单克隆抗体12.1a11.11-7由杂交瘤克隆抗体7.1a 12.2-22(ecacc 89060901)产生,保藏在英国的欧洲动物细胞培养物保藏中心(european collection of animal cell cultures,gb),近30年来一直被用作检测ctnt中的最佳检测抗体。自从1989年这种抗体产生以来,没有出现过更好的用于检测ctnt的单克隆抗体。
7.在过去的几年中,已经开发了用于测量各种肌钙蛋白的更灵敏的测定法,例如基于对此类检测中使用的检测抗体进行标记的复杂技术。
8.许多研究评估了各种高灵敏度的肌钙蛋白测定法,认为它们既可以改善疑似ami患者的分流,也可以在其他临床诊断领域中发挥作用。
9.即使是最敏感的肌钙蛋白测定法,也有报告称在一定比例的健康个体中无法测出
肌钙蛋白(参见上文westermann等人的综述)。显然,测定法灵敏度是最重要的,例如在检测ctnt时,为此目的进行改进将是非常理想的。
技术实现要素:
10.本发明通过提供如权利要求中定义的实施方案来解决这种需要。
11.现已令人非常惊讶地发现,某些突变可以被引入抗体12.1a11.11-7的互补决定区(cdr)中,其一方面不会对抗体与ctnt的复合物形成产生负面影响,但对于ctnt和这些突变抗体之间形成的复合物的稳定性方面却有明显的改善。通过这些令人惊讶的特性,对ctnt的测定法具有更高的灵敏度是可行的。
12.因此,本发明涉及与人心肌肌钙蛋白t(seq id no:1)特异性结合的新型单克隆抗体,该抗体的特征在于cdr包含以下氨基酸序列或其变体,该变体最多有一个氨基酸的取代
13.(i)在轻链可变结构域中的包含seq id no:2的氨基酸序列的cdr1、包含seq id no:3的氨基酸序列的cdr2以及包含seq id no:4的氨基酸序列的cdr3,和
14.(ii)在重链可变结构域中的包含seq id no:5的氨基酸序列的cdr1、包含seq id no:6的氨基酸序列的cdr2以及包含seq id no:7的氨基酸序列的cdr3。
附图说明
15.图1:编码一个或多个重链cdr内的氨基酸取代的dna文库的构建
16.图1a:构建突变体文库所需的重链片段的产生(步骤1)。在第一轮(pcr 1)中,分别对应于片段1、3和4的三个不同的重链片段通过借助相应的引物组来生成。浅灰色段表示cdr。主链序列以黑色给出。水平箭头表示使用的引物。垂直箭头指向pcr的结果。图中打叉的42bp短寡核苷酸(片段2)不是通过pcr获得的,而是单独化学合成的。
17.图1b:通过cdr单氨基酸随机化的hc文库合成。在第二步pcr 2中,如图1a中所述获得的四个片段用作模板(黑线)。带叉的水平箭头表示多核苷酸文库,每个文库包含每个cdr密码子位置的简并nnk密码子。这些多核苷酸文库还包含能够根据需要和指示与步骤1的一个或两个片段杂交的序列段。分别使用正向引物和反向引物(小箭头)进行各自的pcr。
18.图1c:文库合成的最后一步:需要能够与步骤1中的一个或两个片段杂交的额外序列段来执行hc文库产生的最后一步,即使用pcr 2的所有四种产物进行重叠pcr。使用末端引物(f1a;r1a),并且片段本身在该重叠pcr中充当大型引物。
19.图2:周质fab表达的载体图:所给出的图中的描述被认为是不言自明的,并且所有元件都是技术人员已知的。
20.图3:用于筛选ctnt结合fab片段的elisa设置:包被有链霉亲和素的微量滴定板(sa板)用于将生物素化的心肌肌钙蛋白t(bi-ctnt)与固相结合。包含重组抗ctnt重链(<ctnt>-fab)的fab片段与tnt结合,并通过过氧化物酶(pod)标记的抗鼠fab抗体(抗mufab-pod)进行检测。
21.图4:biacore传感图:在37℃下对fab片段mab<tnt>rm-11-7中位置a102的单个氨基酸突变的影响进行动力学分析。相对响应单位(ru,rel.resp.units)表示实时spr测量的信号水平,以秒(s)为单位进行监控。显示的是针对mab<tnt>rm-11-7fab a102(野生型)、a102w、a102f、a102y、a102h、a102e、a102r、a102l、a102n、a102d、a102r和a102k的
biocore测量结果。
22.图5:归一化biacore传感图:fab/肌钙蛋白t复合物解离动力学的叠加。突变a102w最能稳定复合物,其次是a102f。a102y显示出类似野生型(a102)的解离特性。与亲本a102 fab片段相比,所有其他突变都显示出更快的复合物解离。
23.图6:夹心测定法:描绘了显示测定设置的方案。(突变体)生物素化(bi)捕获抗体附接在链霉亲和素(sa)包被的珠子上。将抗ctnt检测抗体进行钌化(ru),并通过ecl分析来研究提高亲和力的效果。
24.图7:使用亲本抗体和突变抗体测量ctnt:显示的是使用未成熟的商业标准免疫试剂(左,亲本)和其中生物素化的标准抗体缀合物被成熟的生物素化mab<tnt>rm-11-7(a102w)-fab替代的试剂(右,a102w)的ctnt测定的任意光单位(计数)。白色柱:稀释剂通用空白值。浅灰色柱:含有18pg/ml重组tnt(rectnt,roche)的校准品cal1。深灰色柱:含有4200pg/ml rectnt的校准品cal2。
具体实施方式
25.抗体的整体结构在本领域中是众所周知的,并且包含通过二硫键连接的两条重链和两条轻链。重链和轻链各由一个恒定结构域和一个可变结构域组成。与抗原的特异性结合由形成抗体的轻链和重链的可变结构域提供的。更具体地说,抗体中决定其特异性和与特定配体接触的部分被称为互补决定区(cdr)。cdr是分子中最易变的部分,有助于这些分子的多样性。每个可变结构域中有三个cdr区cdr1、cdr2和cdr3,嵌入四个框架区(fw)。如本文所述,cdr-hc(或cdr(hc))描述可变重链的cdr区,而cdr-lc(或cdr(lc))可变轻链的cdr区有关。同样,fw-hc(或fw(hc))描述了可变重链的框架区,fw-lc(或fw(lc))与可变轻链的框架区有关。
26.根据本发明使用的术语“包含”表示除了具体列举的序列和/或成分之外,还可以包括其他序列/成分。然而,该术语还涵盖了所要求保护的主题完全由所列举的序列和/或成分组成。
27.在本发明的抗体包含多于所述氨基酸序列的那些实施例中,额外的氨基酸可存在于n末端,或c末端,或两者都有。额外的序列可以包含例如用于纯化或检测而引入的序列,如下文详细讨论。此外,当单个序列“包含”所述序列时,它们还可以包含在n末端或c末端或两者的额外的氨基酸。
28.根据本发明,该抗体与seq id no:1的人心肌肌钙蛋白t(ctnt)特异性结合。可以理解的是,在本发明的抗体包含额外氨基酸的情况下,如上文详述,所述抗体必须特异性结合ctnt。
29.根据本发明,术语“特异性结合”(本文中也称为“特异性相互作用”),是指该抗体仅特异性地结合ctnt,而不与或基本上不与不同的蛋白质,特别是具有类似结构的不同蛋白质,如肌钙蛋白i(seq id no:29)交叉反应。
30.用于分析抗体特异性的相应方法在例如以下文献中有描述:harlow&lane(1988)antibodies:a laboratory manual,cold spring harbor laboratory press以及harlow&lane(1999)using antibodies:a laboratory manual,cold spring harbor laboratory press。适用研究的非限制性实例是,例如采用结构上和/或功能上密切相关的分子进行的
结合研究、阻断和竞争研究。这些研究可采用以下方法进行,例如荧光激活细胞分选术(facs)分析、流式细胞术滴定(facs滴定)分析、表面等离子体共振技术(spr,例如使用)、等温滴定量热法(itc)、荧光滴定法或放射性标记的配体结合测定法。更多的方法包括,例如免疫印迹法(western blot)、elisa(包括竞争elisa)测试、ria测试、ecl测试和irma测试。
31.在本发明范围内,术语“抗体”涉及完整的免疫球蛋白分子并涉及结合其片段的抗原,如fab、fab
′
、f(ab
′
)2、fv。此外,该术语还涉及修饰的和/或改变的抗体分子,并涉及以重组或合成的方式生成/合成的抗体。术语“抗体”还包括双官能抗体、三官能抗体、完全人抗体(fully-human antibodies)、嵌合抗体和抗体构建体,如单链fv(scfv)或抗体融合蛋白。
32.如本文中所用的“fab片段”由一条轻链以及一条重链的ch1(恒定区)和可变区组成。fab分子的重链无法与另一个重链分子形成二硫键。“fab’片段”包含一条轻链及一条重链的一部分,该重链包含vh结构域和ch1结构域以及ch1与ch2结构域之间的区域,这样就可以在两个fab’片段的两条重链之间形成链间二硫键,从而形成f(ab
′
)2分子。“f(ab
′
)2片段”包含两条轻链和两条重链,该重链包含ch1与ch2结构域之间的一部分恒定区,如此,在两条重链之间形成链间二硫键。因此,f(ab
′
)2片段由两个fab’片段组成,这两个fab
′
片段通过两条重链之间的二硫键结合在一起。
33.fab/c片段同时包含fc和fab决定簇,其中“fc”区包含两个重链片段,其包括抗体的ch2和ch3结构域。所述两个重链片段通过两个或多个二硫键以及通过ch3结构域的疏水相互作用结合在一起。
[0034]“fv区”包括重链和轻链的可变区,但缺少恒定区。在本发明范围内,“单链fv”(也缩写为“scfv”)是具有抗体的vh和v
l
结构域的抗体片段,其中所述结构域存在于单个多肽链。通常,scfv多肽进一步在vh和v
l
结构域之间包括多肽连接基,使得scfv能形成所需的抗原结合结构。所描述的用于产生单链抗体的技术,例如pl
üꢀ
ckthun在the pharmacology of monoclonal antibodies(rosenburg and moore eds,springer-verlag,n.y.113(1994),269-315)中的描述。
[0035]
在本文中,术语“全人源抗体”是指仅包含人免疫球蛋白序列的抗体。尽管如此,如果在小鼠、小鼠细胞或源自小鼠细胞的杂交瘤中产生,则全人源抗体可能含有鼠糖链,或者如果在大鼠、大鼠细胞或源自大鼠细胞的杂交瘤中产生,则它可能含有大鼠糖链。同样地,如果在仓鼠、仓鼠细胞(如cho细胞)或源自仓鼠细胞的杂交瘤中产生,则全人源抗体可能含有仓鼠糖链。另一方面,“小鼠抗体(mouse antibody)”或“鼠抗体(murine antibody)”是仅包含小鼠(鼠)(mouse(murine))免疫球蛋白序列的抗体,而“大鼠抗体”或“兔抗体”是指分别仅包含大鼠或兔免疫球蛋白序列的抗体。与全人源抗体一样,如果在此类动物或此类动物的细胞中产生,此类鼠、大鼠或兔抗体可能包含源自其他物种的糖链。例如,如果在仓鼠细胞,如cho细胞,或从仓鼠中细胞提取的杂交瘤细胞中产生的抗体可能含有仓鼠糖链。例如,全人源抗体可以通过噬菌体展示法产生,这是一种广泛使用的筛选技术,能够生产和筛选全人源抗体。在本发明的背景下中也可以使用噬菌体抗体。噬菌体展示方法例如在us 5,403,484,us 5,969,108和us 5,885,793中描述。另一种能够制备全人源抗体的技术涉及对小鼠杂交瘤技术的改进。小鼠被制成含有人类免疫球蛋白基因座的转基因来替换它们自己
的小鼠基因(参见例如us 5,877,397)。
[0036]
术语“嵌合抗体”指包括融合或嵌合化到另一个(人类或非人类,例加,小鼠、马、兔、狗、牛、鸡)物种的抗体区(例加,恒定区)的人类或非人类物种的可变区的抗体。
[0037]
如上文所述,术语“抗体”还包含抗体构建体,诸如抗体融合蛋白,其中该抗体包括(一个)额外的结构域(除了本文中按特定氨基酸序列定义的结构域以外),例如用于分离和/或制备重组地产生的构建体。
[0038]
可以制备本发明的抗体,使其成为重组抗体,例如重组人抗体,或异源杂合抗体,还包括如本发明所公开和定义的互补决定区(cdr)。
[0039]
术语“重组抗体”是例如通过重组手段制备、表达、创造或分离的抗体,如从人免疫球蛋白基因转基因的动物(如小鼠)中分离的抗体,使用重组表达载体转染到宿主细胞中表达的抗体,从重组、组合人抗体库中分离的抗体,或通过任何其他涉及人免疫球蛋白基因序列与其他dna序列拼接的手段制备、表达、创造或分离的抗体。重组的人抗体具有来自人类生殖细胞系免疫球蛋白序列(human germline immunoglobulin sequences)的可变区和恒定区(如有)。然而,此类抗体可以进行体外诱变(或者,当使用人ig序列的转基因动物时,可以进行体内体细胞诱变),因此重组抗体的vh和v
l
区的氨基酸序列是虽然来源于人类生殖细胞系vh和v
l
序列并与其相关,但可能不会天然存在于体内人抗体生殖细胞系库中。
[0040]
术语“异源杂合抗体”是指具有源自不同生物体的轻链和重链的抗体。例如,具有人类重链和小鼠轻链的抗体就是一个异源杂合抗体。异源杂合抗体的实例包括嵌合抗体和人源化抗体。
[0041]
根据本发明的抗体包括所述的轻链crd和重链crd的组合。技术人员可以毫不费力地选择纳入了cdr的各个可变结构域的周围框架序列。例如,可以使用下文进一步描述的框架序列或在所附实施例中采用的特定框架序列。
[0042]
根据本发明,cdr可以包含具体列举的序列或者可以与之最多相差一个氨基酸取代。因此,每个cdr中的一个氨基酸可以被不同的氨基酸替换。可以理解的是,还包括在一条链或一个抗体的部分,但不是所有的cdr中存在氨基酸取代。
[0043]
根据本发明,术语“取代”,指某一个氨基酸被另一个氨基酸替换。因此,氨基酸的总数保持不变。术语“取代”显然不包含删除某个位置的氨基酸并在另一个位置引入一个(或多个)氨基酸的情况。取代,如本发明所述,可以是保守性氨基酸取代或非保守性氨基酸取代。术语“保守性氨基酸取代”是本领域所公知的,指一个氨基酸被另一个具有相似结构和/或化学特性的氨基酸替换。所述相似性包括,例如在有关残基的极性、带电性、可溶性、疏水性、亲水性和/或两亲性方面的相似性。所述氨基酸取代是保守性氨基酸取代,若以下一个基团的一个氨基酸被同一基团的另一个氨基酸取代:非极性(疏水)氨基酸,包括丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、酪氨酸、色氨酸和甲硫氨酸;极性中性氨基酸,包括甘氨酸、丝氨酸、苏氨酸、半胱氨酸、天冬酰胺和谷氨酰胺;带正电(碱性)氨基酸,包括精氨酸、赖氨酸和组氨酸;以及带负电(酸性)氨基酸,包括天冬氨酸和谷氨酸。在一个实施例中,任何(或所有)的cdr中的取代是保守氨基酸取代。应当理解,在一个或多个cdr中具有此类取代的氨基酸的抗体也必定是与seq id no:1的ctnt特异性结合的抗体。
[0044]
在一个实施例中,与人心肌肌钙蛋白t(seq id no:1)特异性结合的抗体是这样的抗体,其中轻链可变结构域包含seq id no:2的氨基酸序列的cdr1、seq id no:3的氨基酸
序列的cdr2、以及seq id no:4的氨基酸序列的cdr3,或这些cdr中的一个或多个的变体,该变体每个cdr相差至多一个氨基酸取代,并且其中重链可变结构域包括包含seq id no:5的氨基酸序列的cdr1、包含seq id no:6的氨基酸序列的cdr2、以及包含seq id no:7的氨基酸序列的cdr3。
[0045]
在一个实施例中,本发明公开了一种
[0046]
一种与人心肌肌钙蛋白t(seq id no:1)特异性结合的抗体,该抗体的特征在于,cdr包含以下氨基酸序列:(i)在轻链可变结构域中的包含seq id no:2的氨基酸序列的cdr1、包含seq id no:3的氨基酸序列的cdr2、以及包含seq id no:4的氨基酸序列的cdr3,和(ii)在重链可变结构域中的包含seq id no:5的氨基酸序列的cdr1、包含seq id no:6的氨基酸序列的cdr2、以及包含seq id no:7的氨基酸序列的cdr3。
[0047]
此外,本发明还涉及与人心肌肌钙蛋白t(seq id no:1)特异性结合的抗体.
[0048]
其中抗体包含轻链可变结构域,该轻链可变结构域由如式i所示的框架区(fw)和cdr组成:
[0049]
fw(lc)1-cdr(lc)1-fw(lc)2-cdr(lc)2-fw(lc)3-cdr(lc)3-fw(lc)4(式i)
[0050]
和重链可变结构域,该重链可变结构域由如式ii所示的fw和cdr组成:
[0051]
fw(hc)1-cdr(hc)1-fw(hc)2-cdr(hc)2-fw(hc)3-cdr(hc)3-fw(hc)4(式ii),
[0052]
其中fw包含以下氨基酸序列或与该氨基酸序列至少85%相同的其变体:
[0053]
在轻链中
[0054][0055]
和在重链中
[0056][0057][0058]
并且其中cdr包含以下氨基酸序列:(i)在轻链可变结构域中的包含seq id no:2的氨基酸序列的cdr1、包含seq id no:3的氨基酸序列的cdr2、以及包含seq id no:4的氨基酸序列的cdr3,和(ii)在重链可变结构域中的包含seq id no:5的氨基酸序列的cdr1、包含seq id no:6的氨基酸序列的cdr2、以及包含seq id no:7的氨基酸序列的cdr3,或这些cdr的变体,该变体每个cdr相差至多一个氨基酸取代。
[0059]
此外,本发明公开了抗ctnt抗体,其包含轻链可变结构域,该轻链可变结构域由如式i所示的框架区(fw)和cdr组成:
[0060]
fw(lc)1-cdr(lc)1-fw(lc)2-cdr(lc)2-fw(lc)3-cdr(lc)3-fw(lc)4(式i)
[0061]
和重链可变结构域,该重链可变结构域由如式ii所示的fw和cdr组成:
[0062]
fw(hc)1-cdr(hc)1-fw(hc)2-cdr(hc)2-fw(hc)3-cdr(hc)3-fw(hc)4(式ii),
[0063]
其中fw包含以下氨基酸序列或与该氨基酸序列至少85%相同的其变体:
[0064]
在轻链中
[0065][0066]
和在重链中
[0067][0068]
并且其中cdr包含以下氨基酸序列:(i)在轻链可变结构域中的包含seq id no:2的氨基酸序列的cdr1、包含seq id no:3的氨基酸序列的cdr2、以及包含seq id no:4的氨基酸序列的cdr3,和(ii)在重链可变结构域中的包含seq id no:5的氨基酸序列的cdr1、包含seq id no:6的氨基酸序列的cdr2、以及包含seq id no:7的氨基酸序列的cdr3。
[0069]
式i所示的一级结构代表本发明抗体的轻链可变结构域的组分从n端到c端的顺序。式ii所示的一级结构代表本发明抗体的重链可变结构域的组分从n端到c端的顺序。在每种情况下,框架区(fw)1代表各自可变链结构域的最n端部分,而fw 4代表各自可变链结构域的最c端部分。
[0070]
如上文所定义,各自的fw和cdr序列“包含”所列的氨基酸序列。在一个实施例中,各自的fw和cdr序列由所述氨基酸序列组成,即本发明的抗肌钙蛋白t抗体的轻链可变结构域和重链可变结构域由分别如式i和式ii所示的fw和cdr组成,其中各自的fw和cdr序列由所列的氨基酸序列组成。
[0071]
关于cdr及其变体,上文提供的定义和具体示例的实施例在细节上作适当修改后适用。
[0072]
关于框架区,本文还设想了一定程度的可变性,即单个fw可以包含具体列举的氨基酸序列或与其至少85%相同的氨基酸序列,或由其组成。优选地,同一性为至少90%,更优选至少92.5%,更优选至少95%,甚至更优选地同一性为至少98%,例如至少99%,并且最优选地,同一性为至少99.5%。应当理解,对于不同的fw,可能允许不同程度的序列同一性,这取决于实际序列和例如各自fw序列的长度,以及其在各自可变链结构域内的位置。
[0073]
根据本发明,术语“%序列同一性”描述了与构成氨基酸序列(或其整体比较部分)的总长度的氨基酸残基数量相比,两个或更多个比对的氨基酸序列的相同氨基酸的匹配(“命中”)数量。同一性百分比是通过将相同残基的数量除以残基总数并将商乘以100来确定的。换句话说,使用比对,当比较和比对两个或更多个序列或子序列以获得在比较窗口上或在使用本领域已知的序列比较算法测量的指定区域上的最大对应性时,或当手动比对和目视检查时,可以确定两个或更多个序列或子序列的相同氨基酸残基的百分比(例如,85%
同一性)。
[0074]
本领域技术人员知道如何使用例如算法来确定序列之间的百分比序列同一性,该算法是例如基于ncbi blast算法(altschul,s.f.等人[1997]nucleic acids res.25:3389-3402)、clustalw计算机程序(tompson,j.d.等人[1994]nucleic acids res.22:4673-4680)或fasta(pearson,w.r.&lipman,d.j.[1988]proc.natl.acad.sci.u.s.a.85:2444-2448)的那些算法。在一个实施例中,根据本发明采用ncbi blast算法。对于氨基酸序列,blastp程序默认使用字长(w)3和期望值(e)10。blosum62评分矩阵(henikoff,s.&henikoff,j.g.[1992]proc.natl.acad.sci.u.s.a.89:10915-10919)使用比对(b)50、期望值(e)10、m=5、n=4并且比较两条链。因此,在指出%序列同一性的那些实施例中,如用ncbi blast程序确定的具有至少85%的序列同一性的所有氨基酸序列都落入所述实施例的范围内。
[0075]
与各自具体列举的氨基酸序列相比在框架区的上述变化程度可能是由于氨基酸的取代、插入、添加或缺失。
[0076]
术语“取代”已在上文中定义。在这些情况下,当多于一个氨基酸被取代时,每个氨基酸独立地被另一个氨基酸替换,即对于每个被去除的氨基酸,在相同位置引入不同的氨基酸。
[0077]
根据本发明,术语“插入”是指将一个或多个氨基酸添加到具体列举的氨基酸序列,其中添加不是添加到多肽的n-端或c-端。
[0078]
根据本发明,术语“添加”是指将一个或多个氨基酸添加到具体列举的氨基酸序列,该添加是添加到多肽的n-端或c-端或两者。
[0079]
根据本发明使用的术语“缺失”是指从具体列举的氨基酸序列中丢失一个或多个氨基酸。
[0080]
在一个实施例中,框架区的氨基酸序列的变化是由于氨基酸的取代。如上文定义的取代可以是保守性氨基酸取代或非保守性氨基酸取代。上文提供的关于术语“取代”的定义和具体示例的实施例在细节上作适当修改后适用。在一个实施例中,框架区中的取代是保守氨基酸取代。
[0081]
在进一步的实施例中,cdr由以上列举的特定序列(即,没有任何变化)组成,并且以上列举的框架区(fw)在以上列举的特定序列内包含至多以下量的氨基酸变化:
[0082][0083]
在进一步的实施例中,fw中的氨基酸变化是取代。
[0084]
在进一步的实施例中,轻链或重链可变结构域框架区中存在的变化总量为至多9个氨基酸取代,例如至多8个氨基酸取代,例如至多6个氨基酸取代,例如至多4个氨基酸取代,例如至多3个氨基酸取代,例如至多2个氨基酸取代。在进一步的实施例中,在轻链可变结构域的框架区1至4中或者重链可变结构域的框架区1至4中总共仅存在1个氨基酸取代。
[0085]
由于在本文中定义为fw的式i和式ii的部分是形成可变链区的框架或支架的部分的氨基酸序列,因此在所述序列内的取代(特别是以保守氨基酸取代的形式)在许多情况下将不会影响抗ctnt抗体的结合能力。这是因为这些氨基酸通常不直接参与与ctnt的结合,并且它们的取代可以设计取代为合适的替代氨基酸,从而不会发生蛋白质的三维结构和折叠的改变。另一方面,这样的取代可以提供许多有益效果,例如改善某些宿主中的表达或通过引入例如额外的二硫键来稳定蛋白质。
[0086]
根据以下方程式,抗体的“结合亲和力”可测量靶抗原上的表位与抗体的结合位点之间的相互作用强度:
[0087]
kd(或kd)=kd/ka
[0088]
其中:
[0089]
kd=平衡解离常数[m]
[0090]
kd=解离速率常数[s-1
]
[0091]
ka=缔合速率常数[m-1
s-1
]
[0092]
抗体的结合亲和力的进一步相关参数如下:
[0093]
t/2=复合物解离半衰期=ln2/kd/60[min]
[0094]
rmax=分析物最大响应值[ru]
[0095]
mr:摩尔比=分析物最大响应值(rmax)比率
[0096]
在一个实施例中,如上文公开的针对ctnt的单克隆抗体在37℃以10分钟或更长时间的t/2-diss结合至ctnt。
[0097]
本发明进一步涉及一种抗体,其包含:
[0098]
(i)由氨基酸序列组成的轻链可变结构域,所述氨基酸序列与由seq id no:27的氨基酸序列组成的轻链可变结构域至少85%相同,和
[0099]
(ii)由氨基酸序列组成的重链可变结构域,该氨基酸序列与seq id no:28的重链可变结构域至少85%相同,
[0100]
其中该抗体与人心肌肌钙蛋白t特异性结合并且在37℃具有10分钟或更长时间的t/2-diss。
[0101]
本发明还公开了一种抗体,其包含:
[0102]
(i)由氨基酸序列组成的轻链可变结构域,所述氨基酸序列与由seq id no:27的氨基酸序列组成的轻链可变结构域至少85%相同,和
[0103]
(ii)seq id no:28的氨基酸序列的重链可变结构域,
[0104]
其中cdr包含以下氨基酸序列:(i)在轻链可变结构域中的包含seq id no:2的氨基酸序列的cdr1、包含seq id no:3的氨基酸序列的cdr2、以及包含seq id no:4的氨基酸序列的cdr3,和(ii)在重链可变结构域中的包含seq id no:5的氨基酸序列的cdr1;包含seq id no:6的氨基酸序列的cdr2;以及包含seq id no:7的氨基酸序列的cdr3,
[0105]
并且其中该抗体与人心肌肌钙蛋白t特异性结合并且在37℃具有10分钟或更长时
间的t/2-diss。
[0106]
在一个实施例中,本公开涉及一种抗体,其包含:
[0107]
(i)由seq id no:22的氨基酸序列组成的轻链可变结构域,和
[0108]
(ii)由seq id no:28的氨基酸序列组成的重链可变结构域。
[0109]
上文提供的关于本发明的抗ctnt抗体的所有定义和具体例示的实施例,特别是所引用的变化程度和类型,在细节上作适当修改后都适用。
[0110]
根据本发明,提供了新型抗ctnt抗体,其具有改善的与ctnt的结合特性(更好的kd值),因此与以前的测定法相比,能够以更高的灵敏度检测ctnt。
[0111]
术语“k
d”是指平衡解离常数(平衡结合常数的倒数)并且根据本领域提供的定义在本文中使用。测定kd值的手段和方法如下简要给出并在给出的示例中详细描述。
[0112]
抗体的结合特性,例如,抗ctnt抗体的结合特性最好通过基于生物传感器的实时分子相互作用测量来测定,如表面等离子体共振光谱法,其同义词是biacore技术。实验细节在示例5中给出并且动力学数据显示在表2中。例如,表2中标记为a192w的抗体具有改善的与ctnt的结合特性,即缔合常数(ka)为1.1e 06<0.011/ms;解离常数(kd)<1e-05(转换为解离半衰期》1155分钟,因此总亲和常数(kd)<0.01nm。
[0113]
本发明所公开和要求保护的突变抗体令人惊讶地一方面不会负面影响抗体与ctnt的复合物形成,所有抗体的ka都在与亲本抗体相同的范围内。另一方面,在转换为更好的kd值的ctnt之间形成的复合物的稳定性方面可以获得显著改善。
[0114]
在一个实施例中,如上文公开的根据本发明的单克隆抗体在37℃以10分钟或更长时间的t/2-diss结合至ctnt。
[0115]
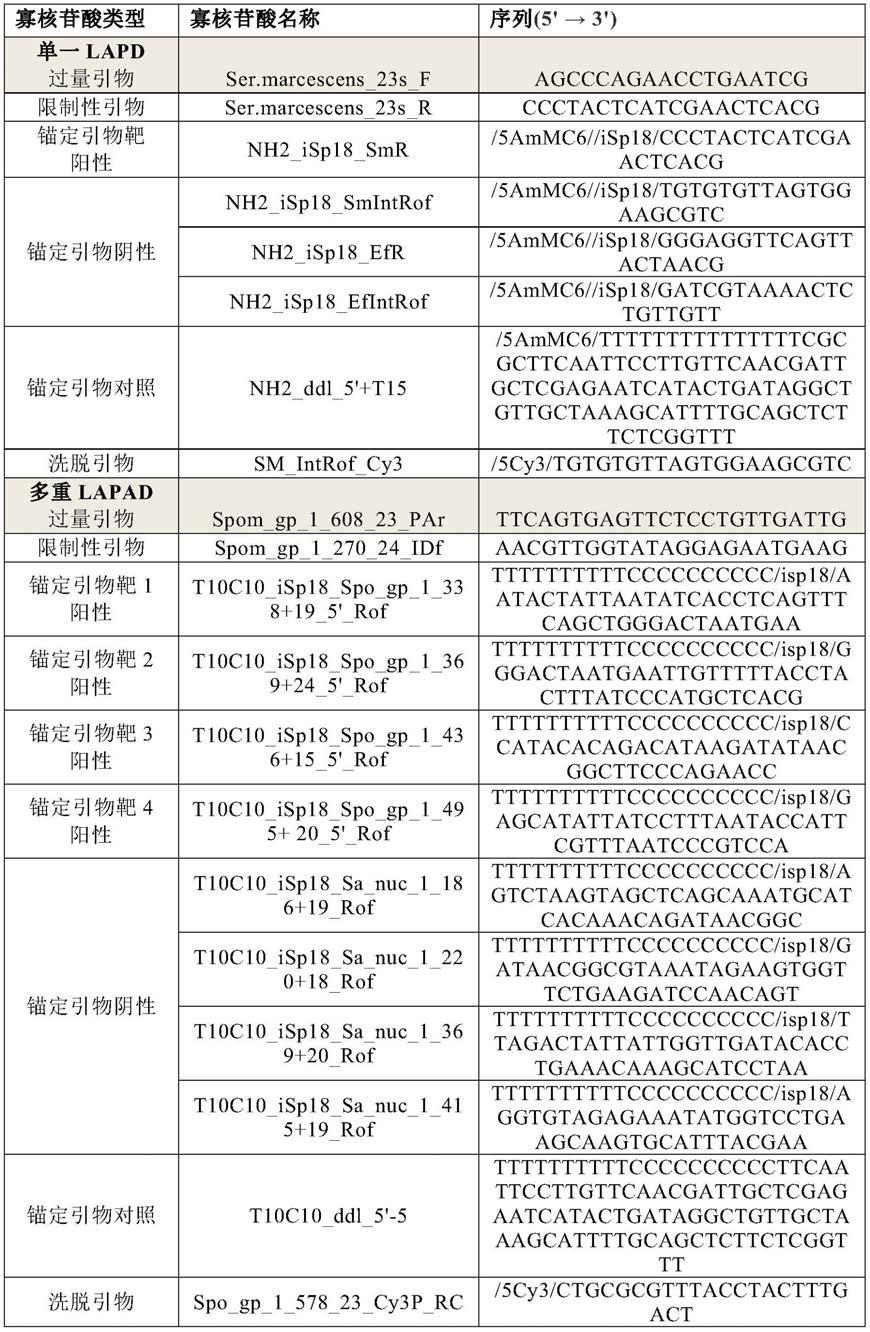
如本领域公知的,较低的kd值通常对应于较高或改善的亲和力。在一个实施例中,突变型抗ctnt抗体的结合亲和力等于或低于具有3nm kd的亲本抗体的kd。
[0116]
以上列举的针对可变轻链区和可变重链区的序列是在所附示例中使用的氨基酸序列。
[0117]
本发明进一步涉及编码上文定义的任一种本发明抗体的轻链可变区的核酸分子。该核酸分子在本文中被称为本发明的第一核酸分子。此外,本发明还涉及编码上文定义的任一种本发明抗体的重链可变区的核酸分子。该核酸分子在本文中被称为本发明的第二核酸分子。
[0118]
根据本发明,术语“核酸分子”,在本文中也称为核酸序列或多核苷酸,包括dna,例如cdna或基因组dna。
[0119]
本发明的核酸分子可以例如通过标准化学合成方法和/或重组方法合成,或以半合成的方式产生,例如通过将化学合成方法和重组方法组合。编码序列与转录调控元件和/或其他氨基酸编码序列的连接可以使用已建立的方法(例如限制性消化、连接和分子克隆)来执行。
[0120]
根据本发明,本发明的第一核酸分子编码轻链可变区:
[0121]
(i)包括包含seq id no:2的氨基酸序列的cdr1、包含seq id no:3的氨基酸序列的cdr2、以及包含seq id no:4的氨基酸序列的cdr3;
[0122]
(ii)由如上文定义的式i的氨基酸序列组成;或者
[0123]
(iii)由氨基酸序列组成,该氨基酸序列与由seq id no:27的氨基酸序列组成的
轻链可变结构域至少85%相同。
[0124]
类似地,本发明的第二核酸分子编码重链可变区:
[0125]
(i)包括包含seq id no:5的氨基酸序列的cdr1或相差至多一个氨基酸取代的其变体、包含seq id no:6的氨基酸序列的cdr2或相差至多一个氨基酸取代的其变体、以及包含seq id no:7的氨基酸序列的cdr3或相差至多一个氨基酸取代的其变体;
[0126]
(ii)由如上文定义的式ii的氨基酸序列组成;
[0127]
(iii)由氨基酸序列组成,该氨基酸序列与由seq id no:28的氨基酸序列组成的重链可变结构域至少85%相同。
[0128]
本发明进一步涉及一种载体,其包含本发明的第一核酸分子,即编码上文定义的任一种本发明抗体的轻链可变区的核酸分子。本发明进一步涉及一种载体,其包含本发明的第二核酸分子,即编码上文定义的任一种本发明抗体的重链可变区的核酸分子。此类载体在本文中也称为“本发明的个体载体”。
[0129]
许多合适的载体是分子生物学技术人员已知的,其选择取决于所需的功能。载体的非限制性实例包括质粒、粘粒、病毒、噬菌体和其他常规用于例如基因工程中的载体。本领域技术人员公知的方法可以用于构建各种质粒和载体;参见,例如,sambrook等人(引自上文)和ausubel,current protocols in molecular biology,green publishing associates and wiley interscience,n.y.(1989),(1994)中描述的技术。
[0130]
在一个实施例中,载体是表达载体。根据本发明的表达载体能够指导本发明的核酸分子在宿主中的复制和表达,并因此提供由此在选定的宿主中编码的本发明抗肌钙蛋白t抗体的可变链结构域的表达。在进一步的实施例中,载体包含另外的序列以确保不仅表达本发明的所述可变链结构域,而且还表达包含本发明的所述可变链结构域的全长igg抗体。
[0131]
表达载体可以是例如克隆载体、二进制载体或整合载体。表达包括例如将核酸分子转录成可翻译的mrna。在一个实施例中,载体是用于瞬时重组表达单克隆兔抗体的重链和/或轻链的真核表达质粒。此类载体已专门开发用于抗体表达,但也可用于抗体生产,例如通过真核细胞(例如hek 293)或其衍生物或cho细胞的瞬时转染。
[0132]
载体的非限制实例包括pqe-12、puc-系列、pbluescript(stratagene)、pet-系列表达载体(novagen)或pcrtopo(invitrogen)、lambda gt11、pjoe、pbbr1-mcs系列、pjb861、pbsmul、pbc2、pucpks、ptact1、ptre、pcal-n-ek、pesp-1、pop13cat、e-027pcag kosak-cherry(l45a)载体系统、prep(invitrogen)、pcep4(invitrogen)、pmc1neo(stratagene)、pxt1(stratagene)、psg5(stratagene)、ebo-psv2neo、pbpv-1、pdbpvmmtneo、prsvgpt、prsvneo、psv2-dhfr、pizd35、okayama-berg cdna表达载体pcdv1(pharmacia)、prc/cmv、pcdna1、pcdna3(invitrogen)、pcdna3.1、psport1(gibco brl)、pgemhe(promega)、plxin、psir(clontech)、pires-egfp(clontech)、peak-10(edge biosystems)ptriex-hygro(novagen)和pcineo(promega)。适用于毕赤酵母的质粒载体的非限制性实例包括例如质粒pao815、ppic9k和ppic3.5k(均来自invitrogen)。另一种适用于在非洲爪蟾胚胎、斑马鱼胚胎以及多种哺乳动物和鸟类细胞中表达蛋白质的载体是多用途表达载体pcs2 。
[0133]
通常,载体可以含有一个或多个复制起点(ori)和用于克隆或表达的遗传系统、一个或多个用于在宿主中的选择的标志物(例如抗生素抗性),以及一个或多个表达盒。此外,载体中包含的编码序列可以使用已建立的方法与转录调控元件和/或其他氨基酸编码序列
连接。此类调控序列是本领域技术人员熟知的,并且包括但不限于确保转录起始的调控序列、内部核糖体进入位点(ires)(owens,g.c.等人[2001]proc.natl.acad.sci.u.s.a.98:1471-1476)和确保转录终止和转录物稳定的任选调控元件。此类确保转录起始的调控元件的非限制性实例包括启动子、翻译起始密码子、增强子、绝缘子和/或确保转录终止的调控元件,它们将被包含在本发明的核酸分子的下游。进一步的实例包括kozak序列和侧翼为用于rna剪接的供体和受体位点的插入序列、编码分泌信号的核苷酸序列,或根据所使用的表达系统,能够将表达的蛋白质引导至细胞区室或培养基的信号序列。载体还可以含有编码一种或多种分子伴侣的另外的可表达多核苷酸,以促进正确的蛋白质折叠。
[0134]
合适的复制起点的其他实例包括例如全长cole1、截短的colei、sv40病毒和m13复制起点,而合适的启动子的其他实例包括但不限于巨细胞病毒(cmv)启动子、sv40-启动子、rsv-启动子(rous肉瘤病毒)、lacz启动子、四环素启动子/操作子(tet
p/o
)、鸡β-肌动蛋白启动子、cag-启动子(鸡β-肌动蛋白启动子和巨细胞病毒立即早期增强子的组合)、gai10启动子、人延伸因子1α-启动子、aox1启动子、gal1启动子、cam-激酶启动子、lac、trp或tac启动子、t7或t5启动子、lacuv5启动子、苜蓿银纹夜蛾多核多角体病毒(acmnpv)多面体启动子,或哺乳动物和其他动物细胞中的球蛋白内含子。增强子的一个实例是例如sv40增强子。确保转录终止的调控元件的其他非限制性实例包括sv40-poly-a位点、tk-poly-a位点、rho非依赖性lpp终止子或acmnpv多面体多腺苷酸化信号。可选择的标志物的进一步非限制性实例包括dhfr,其赋予对甲氨蝶呤的抗性(reiss,plant physiol.(life sci.adv.)13(1994),143-149);npt,其赋予对氨基糖苷类新霉素、卡那霉素和巴龙霉素的抗性(herrera-estrella,embo j.2(1983),987-995);和hygro,其赋予对潮霉素的抗性(marsh,gene 32(1984),481-485)。已描述了其他可选择基因,即允许细胞利用吲哚代替色氨酸的trpb;允许细胞利用组氨醇(histinol)代替组氨酸的hisd(hartman,proc.natl.acad.sci.usa 85(1988),8047);甘露糖-6-磷酸异构酶,其允许细胞利用甘露糖(wo 94/20627)和odc(鸟氨酸脱羧酶),其将阻力赋予鸟氨酸脱羧酶抑制剂、2-(二氟甲基)-dl-鸟氨酸、dfmo(mcconlogue,1987,in:current communications in molecular biology,cold spring harbor laboratory ed.)或来自土曲霉的脱氨酶,其赋予对杀稻瘟菌素s的抗性(tamura,biosci.biotechnol.biochem.59(1995),2336-2338)。
[0135]
在进一步的实施例中,载体是含有表达盒的真核表达质粒,该表达盒由包含内含子a的5
′
cmv启动子和3
′
bgh多腺苷酸化序列组成。除了表达盒之外,质粒还含有源于puc18的复制起点和赋予氨苄青霉素抗性的β-内酰胺酶基因,以用于在大肠杆菌中进行质粒扩增。为了分泌抗体,可以在抗体基因的5
′
侧克隆真核前导序列。
[0136]
合适的细菌表达宿主包括例如衍生自jm83、w3110、ks272、tg1、k12、bl21(例如bl21(de3)、bl21(de3)plyss、bl21(de3)ril、bl21(de3)prare)或rosetta的菌株。对于载体修饰、pcr扩增和连接技术,参见sambrook&russel[2001](cold spring harbor laboratory,ny)。
[0137]
本发明的核酸分子和/或载体可以被设计用于引入细胞中,这是通过例如基于化学的方法(聚乙烯亚胺、磷酸钙、脂质体、deae-葡聚糖、核转染)、非化学方法(电穿孔、声穿孔、光转染、基因电转移、流体动力学递送或在使细胞与本发明的核酸分子接触后自然出现的转化)、基于颗粒的方法(基因枪、磁转染、穿刺感染)、基于噬菌体载体的方法和病毒方
法。例如,衍生自病毒(例如逆转录病毒、牛痘病毒、腺相关病毒、疱疹病毒、semliki森林病毒或牛乳头状瘤病毒)的表达载体可用于将核酸分子递送至目标细胞群中。此外,杆状病毒系统也可在针对本发明核酸分子的真核表达系统中用作载体。在一个实施例中,本发明的核酸分子和/或载体被设计用于通过磷酸钙来转化化学感受态大肠杆菌和/或用于通过聚乙烯亚胺转染或lipofectamine转染来瞬时转染hek293和cho。
[0138]
本发明进一步涉及一种载体,该载体包含:
[0139]
(i)编码根据上文定义的选项(i)的轻链可变结构域和根据上文定义的选项(i)的重链可变结构域的核酸分子;
[0140]
(ii)编码根据上文定义的选项(ii)的轻链可变结构域和根据上文定义的选项(ii)的重链可变结构域的核酸分子;或
[0141]
(iii)编码根据上文定义的选项(iii)的轻链可变结构域和根据上文定义的选项(iii)的重链可变结构域的核酸分子。
[0142]
在一个实施例中,载体是表达载体。
[0143]
上文提供的关于本发明的载体的所有定义和具体例示的实施例,特别是载体类型或调控序列,在细节上作适当修改后都适用。这种第二类型的载体涉及包含至少两种核酸分子(即一种编码轻链可变结构域,一种编码重链可变结构域)的载体。从上述组合可以看出,轻链可变结构域和重链可变结构域在载体中组合,使得能够表达本发明的功能性抗ctnt抗体。这种第二类型的载体在本文中也称为“本发明的组合载体”。
[0144]
本发明进一步涉及一种宿主细胞或非人类宿主,其包含:
[0145]
(i)本发明的组合载体;或
[0146]
(ii)包含本发明的第一核酸分子(即编码根据本发明的轻链可变区的核酸分子)的本发明的个体载体,以及包含本发明的第二核酸分子(即编码本发明的重链可变区的核酸分子)的本发明的个体载体,其中这两种载体包含编码如上文选项(i)至(iii)中定义的匹配的轻链可变区和重链可变区的核酸分子。
[0147]
宿主细胞可以是任何原核或真核细胞。术语“原核生物”意在包括可以用dna或dna或rna分子转化、转导或转染以表达本发明的蛋白质的所有细菌。原核宿主可以包括革兰氏阴性细菌和革兰氏阳性细菌,例如大肠杆菌、鼠伤寒沙雷氏菌、粘质沙雷氏菌、棒状杆菌属(谷氨酸棒状杆菌)、假单胞菌属(荧光假单胞菌)、乳杆菌属、链霉菌属、沙门氏菌属和枯草杆菌。
[0148]
术语“真核的”是指包括酵母、高等植物、昆虫和哺乳动物细胞。典型的哺乳动物宿主细胞包括hela、hek293、h9、per.c6和jurkat细胞、小鼠nih3t3、ns/0、sp2/0和c127细胞、cos细胞(例如cos 1或cos 7)、cv1、鹌鹑qc1-3细胞、小鼠l细胞、小鼠肉瘤细胞、bowes黑色素瘤细胞和中国仓鼠卵巢(cho)细胞。根据本发明的示例性哺乳动物宿主细胞是cho细胞。其他合适的真核宿主细胞包括但不限于鸡细胞,例如dt40细胞,或酵母,例如酿酒酵母、毕赤酵母、粟酒裂殖酵母和乳酸克鲁维酵母。适合用于表达的昆虫细胞是例如果蝇s2、果蝇kc、灰翅夜蛾sf9和sf21或粉纹夜蛾hi5细胞。合适的斑马鱼细胞系包括但不限于zfl、sjd或zf4。
[0149]
所描述的载体可以整合到宿主的基因组中,也可以在染色体外维持。一旦将载体掺入合适的宿主中,就将宿主维持在适合于核酸分子高水平表达的条件下,并且根据需要,
可以随后收集和纯化本发明的抗体。上述宿主细胞的适当培养基和条件是本领域已知的。
[0150]
在一个实施例中,所述宿主是哺乳动物细胞,例如人类细胞或人类细胞系。在进一步的实施例中,用本发明的载体转化的宿主细胞是hek293或cho。在又一个实施例中,用本发明的载体转化的宿主细胞是cho。这些宿主细胞以及合适的培养基和细胞培养条件已在本领域中描述,参见例如baldi l.等人,biotechnol prog.2005 jan-feb;21(1):148-53、girard p.等人,cytotechnology.2002 jan;38(1-3):15-21和stettler m.等人,biotechnol prog.2007 nov-dec;23(6):1340-6。
[0151]
关于根据本发明的术语“载体包含”,应理解在载体中存在对于宿主细胞产生本发明的抗ctnt抗体而言是必需和/或足够的另外的核酸序列。这样的另外的核酸序列是例如编码轻链的剩余部分的核酸序列以及编码重链的剩余部分的核酸序列。
[0152]
根据本发明的宿主细胞或非人类宿主包含编码如上文定义的轻链可变区和重链可变区两者的一种载体,或者包含两种单独的载体,其中一种载体携带编码根据本发明的轻链可变区的核酸分子并且第二种载体携带编码根据本发明的匹配的重链可变区的核酸分子。因此,如果第一载体携带编码根据上文选项(i)的轻链可变区的核酸分子,则第二载体携带编码同样根据上文选项(i)的重链可变区的核酸分子。在细节上作适当修改后,这同样适用于选项(ii)和(iii)。
[0153]
因此,在每种情况下,需要存在于一个抗体分子内的那些核酸分子的表达相互连接,以确保产生由上文所述的结合能力组成的本发明的抗ctnt抗体。
[0154]
根据该实施例的宿主细胞可以例如用于产生大量本发明的抗ctnt抗体。通过将上述载体引入宿主中来产生所述宿主细胞。所述载体在宿主中的存在随后会介导编码本发明的抗ctnt抗体的上述轻链可变结构域和重链可变结构域的核酸分子的表达。如上文所述,本发明的载体可以进一步包含能够表达全长igg抗体的序列,从而导致宿主细胞产生全长igg抗体,其中所述抗体的特征在于存在根据本发明的可变轻链结构域和/或可变重链结构域。
[0155]
本发明进一步涉及一种产生与seq id no:1的ctnt特异性结合的抗体的方法,该方法包括在合适的条件下培养本发明的宿主细胞以及分离产生的抗体。
[0156]
根据该实施例,存在于本发明宿主中的载体是表达载体,或者该载体以确保其表达的方式介导本发明的核酸分子稳定整合到宿主细胞的基因组中。用于选择其中已成功引入编码本发明的抗ctnt抗体的相应轻链和重链结构域的核酸分子从而确保抗体表达的宿主细胞的手段和方法是本领域中熟知且已被描述的(browne,s.m.&al-rubeai,m.[2007]trends biotechnol.25:425-432;matasci,m等人[2008]drug discov.today:technol.5:e37-e42;wurm,f.m.[2004]nat.biotechnol.22:1393-1398)。
[0157]
培养原核或真核宿主细胞的合适条件是本领域技术人员熟知的。例如,细菌(例如大肠杆菌)可以在luria bertani(lb)培养基中通气培养,通常培养温度为4℃至约37℃。为了增加表达产物的产量和溶解度,可以用已知增强或促进产量和溶解度的合适添加剂来缓冲或补充培养基。在诱导型启动子控制宿主细胞中存在的载体中的本发明核酸分子的那些情况下,可以通过添加合适的诱导剂(例如无水四环素)来诱导多肽的表达。合适的表达方案和策略在本领域中已有描述(例如,在dyson,m.r.,等人(2004).bmc biotechnol.4,32-49和baldi,l.等人(2007).biotechnol.lett.29,677-684中)并且可以根据需要来适应特
定宿主细胞的需要和要表达的蛋白质的要求。
[0158]
根据细胞类型及其特定要求,哺乳动物细胞培养可以例如在含有10%(v/v)fcs、2mm l-谷氨酰胺和100u/ml青霉素/链霉素的rpmi、williams
′
e或dmem培养基中进行。对于dt40鸡细胞,细胞可以例如在37℃或41℃被保存在5%co2、水饱和的气氛中。
[0159]
适合于昆虫细胞培养的培养基是例如tnm 10%fcs、sf900或hyclone sfx-insect培养基。昆虫细胞通常在27℃作为粘附或悬浮培养物生长。
[0160]
用于真核或脊椎动物细胞的合适表达方案是技术人员熟知的并且可以例如从sambrook,j&russel,d.w.[2001](cold spring harbor laboratory,ny)检索到。
[0161]
在一个实施例中,该方法是使用哺乳动物细胞(例如cho或hek293细胞)进行的。在进一步的实施例中,该方法使用cho细胞进行。
[0162]
取决于重组生产过程中使用的宿主,所表达的抗体可以是糖基化的或可以是非糖基化的。在一个实施例中,使用了质粒或病毒,其含有本发明抗体的编码序列以及与其基因融合的n-端flag-标签和/或c-端his-标签。在进一步的实施例中,所述flag-标签的长度为约4至8个氨基酸,例如正好8个氨基酸。可以使用本领域普通技术人员通常已知的任何技术,将上述载体用于转化或转染宿主。此外,制备融合的、可操作连接的基因并在例如哺乳动物细胞和细菌中表达它们的方法是在本领域中熟知的(sambrook,loc cit.)。
[0163]
转化的宿主可以在生物反应器中生长并根据本领域已知的技术进行培养以实现最佳细胞生长。然后可以从生长培养基中分离本发明的抗体。本发明的例如微生物表达的抗体的分离和纯化可以通过任何常规方法进行,例如,亲和层析(例如使用融合标签,如strep-标签ii或his6标签)、凝胶过滤(尺寸排阻色谱)、阴离子交换色谱、阳离子交换色谱、疏水相互作用色谱、高压液相色谱(hplc)、反相hplc或免疫沉淀。这些方法是本领域中熟知的并且通常描述于例如sambrook,j&russel,d.w.[2001](cold spring harbor laboratory,ny)。
[0164]
应当理解,根据本发明,术语“分离所产生的抗体”是指分离本发明的抗ctnt抗体。
[0165]
本发明进一步涉及一种组合物,其包含以下至少一种:
[0166]
(i)本发明的抗体,
[0167]
(ii)本发明的核酸分子,
[0168]
(iii)本发明的载体,
[0169]
(iv)本发明的宿主细胞,和/或
[0170]
(v)通过本发明的方法产生的抗体。
[0171]
根据本发明使用的术语“组合物”涉及包含至少一种所述化合物的组合物。组合物可以任选地包含能够改变本发明化合物的特征从而例如稳定、调节和/或增强化合物的功能的其他分子。该组合物可以是固体或液体形式并且尤其可以是粉末、片剂或溶液的形式。
[0172]
可以将组合物的组分作为水溶液或作为用于重构的冻干制剂包装在一个容器或多个容器中,例如密封的安瓿或小瓶中。作为冻干制剂的一个实例,10-ml小瓶被装有5ml 1%(w/v)或10%(w/v)的水溶液,并将所得混合物冻干。供使用的溶液通过使用例如用于治疗用途的注射用水或用于诊断目的的另一所需溶剂(例如缓冲液)重构冻干的化合物来制备。还可以存在防腐剂和其他添加剂,例如抗微生物剂、抗氧化剂、螯合剂和惰性气体等。
[0173]
可以将组合物的各种组分包装成带有使用说明的试剂盒。
[0174]
在一个实施例中,本发明的组合物是使得技术人员能够进行本领域熟知的体外或离体方法(例如免疫测定法等方法)的组合物。
[0175]
可以利用本发明抗体的免疫测定法的实例是直接形式或间接形式的免疫测定。此类免疫测定法的实例是酶联免疫吸附测定法(elisa)、酶免疫测定法(eia)、放射免疫测定法(ria)或基于发光、荧光、化学发光或电化学发光的免疫测定法。
[0176]
心肌肌钙蛋白t(ctnt)最好通过夹心免疫测定法检测,例如分别在us 6,333,397和us 6,376,206中公开的,并且其在基本上所有后续代的ctnt测量测定法中得到证实。在第五代ctnt测定法中,采用了由roche diagnostics,germany销售的高灵敏度ctnt测定法(hs-ctnt),其仍然采用夹心免疫测定法的原理。该测定法是一种高灵敏度测定法,因为它检测ctnt的检测下限(lod)可以为5ng/ml。测定时间取决于所使用的测定方案,尽管总体孵育时间分别为非常短的9分钟或18分钟,但仍可达到良好的lod。在该测定法中,形成了包含生物素化捕获抗体和钌化检测抗体的夹心。使该复合物与链霉亲和素包被的磁珠结合,未结合的物质被洗掉。对于技术人员来说,这是非常关键的,如果kd不突出,则会因为发生一些解离并导致信号降低,而直接转化为降低的lod。
[0177]
对技术人员显而易见的是,在检测ctnt的方法中使用根据本发明的抗体将是有利的。在一个实施例中,本公开涉及一种测定人心肌肌钙蛋白t(seq id no:1)的方法,该方法包括检测如本文以上公开的抗体与人心肌肌钙蛋白t的结合。
[0178]
在一个实施例中,本公开涉及一种检测样品中ctnt的方法,该方法包括以下步骤:a)在足以形成抗ctnt抗体/ctnt复合物的时间和条件下使样品与根据本公开的抗ctnt抗体接触;和b)测量抗ctnt抗体/ctnt复合物,其中该复合物的量指示样品中ctnt的浓度。例如在“抗ctnt抗体/ctnt复合物”中的术语“/”被用于指示在一方面的抗ctnt抗体和在另一方面的ctnt之间形成了非共价复合物。
[0179]
在一个实施例中,本发明涉及一种检测样品中ctnt的方法,包括以下步骤:a)在足以形成第一抗ctnt抗体/ctnt/第二抗ctnt抗体复合物的时间和条件下使样品与针对ctnt的第一抗体和针对ctnt的第二抗体接触,其中第二抗体被可检测地标记;和b)测量(a)中形成的复合物,其中该复合物的量指示样品中ctnt的浓度,并且其中第一抗体或第二抗体中的一个是根据本发明的抗体。
[0180]
如对技术人员显而易见的那样,可按任意需要的顺序在足以形成第一抗ctnt抗体/ctnt/第二抗ctnt抗体复合物的时间和条件下使样品接触第一和第二抗体,该顺序即首先接触第一抗体,然后接触第二抗体;首先接触第二抗体,然后接触第一抗体;或同时接触第一和第二抗体。
[0181]
如技术人员所容易理解的是,仅需要常规实验来确立形成以下复合物的适合或充分的时间和条件:特异性抗ctnt抗体和ctnt抗原/分析物之间的复合物(=抗ctnt抗体/ctnt复合物),或包含针对ctnt的第一抗体、ctnt(分析物)和第二抗ctnt抗体复合物的二级复合物或夹心复合物(=第一抗ctnt抗体/ctnt/第二抗ctnt抗体复合物)。
[0182]
抗ctnt抗体/ctnt复合物或第一抗ctnt抗体/ctnt/第二抗ctnt抗体复合物的各自检测可以通过任何合适的手段进行。本领域的技术人员充分熟悉所述方式/方法。
[0183]
在一个实施例中,本发明涉及与人心肌肌钙蛋白t(seq id no:1)特异性结合的抗体的用途,该抗体的特征在于,cdr包含以下氨基酸序列或相差至多一个氨基酸取代的其变
体:(i)在轻链可变结构域中的包含seq id no:2的氨基酸序列的cdr1、包含seq id no:3的氨基酸序列的cdr2、以及包含seq id no:4的氨基酸序列的cdr3,和(ii)在重链可变结构域中的包含seq id no:5的氨基酸序列的cdr1、包含seq id no:6的氨基酸序列的cdr2、以及包含seq id no:7的氨基酸序列的cdr3,或者涉及上文公开的任何其他抗体的用途,用于体外诊断方法。
[0184]
术语“样品”或“目标样品”或“测试样品”在本文中可互换使用。样品为体外样品,其将在体外进行分析并且不会被移回体内。样品的实例包括但不限于液体样品,诸如血液、血清、血浆、滑液、尿液、唾液和淋巴液;或固体样品,诸如组织提取物、软骨、骨头、滑膜和结缔组织。在一个实施例中,样品选自血液、血清、血浆、滑液和尿液。在一个实施例中,样品选自血液、血清和血浆。在一个实施例中,样品是血清或血浆。
[0185]
本文中使用的术语“参考样品”是指以与目标样品大致相同的方式进行分析且其信息与目标样品的信息进行比较的样品。因此,参考样品提供一种标准,用于评估从目标样品获得的信息。参考样品可能取自健康或正常的组织、器官或个体,从而提供了组织、器官或个体健康状态的判断标准。正常参考样品的状态与目标样品的状态之间的差异可指示疾病发展的风险或者这种疾病或疾患的存在或进一步进展。参考样品可源自异常或患病的组织、器官或个体,从而提供组织、器官或个体的患病状态的标准。异常参考样品的状态与目标样品的状态之间的差异可指示疾病发展的风险降低或者这种疾病或病症的不存在或好转。
[0186]
术语指标的“升高的”或“增加的”水平是指样品中这种指标的水平与参考或参考样品中这种指标的水平相比更高。例如,与在未患有给定疾病的个体的相同液体样品中相比,在患有所述疾病的一个个体的液体样品中可检出更高量的蛋白质具有升高的水平。
[0187]
在某些实施例中,将形成包含针对ctnt的第一抗体、ctnt(分析物)和针对ctnt的第二抗体的夹心,其中第二抗体被可检测地标记。
[0188]
大量的可用标记(也称为染料)通常可分为以下类别,全部类别的总体及其每一个类别均表示如本公开所述的实施例:
[0189]
(a)荧光染料
[0190]
荧光染料例如briggs等人
″
synthesis of functionalized fluorescent dyes and their coupling to amines and amino acids,
″
j.chem.soc.,perkin-trans.1(1997)1051-1058所描述。
[0191]
荧光标记或荧光团包括稀土螯合物(铕螯合物);荧光素类型标记,包括fitc、5-羧基荧光素、6-羧基荧光素;罗丹明标记,包括tamra;丹磺酰;丽丝胺(lissamine);花青;藻红蛋白;得克萨斯红(texas red);及其类似物。采用本文所公开的技术,可将荧光标记缀合至靶标分子所包含的醛基。荧光染料和荧光标记试剂包括可从invitrogen/molecular probes(eugene,oregon,usa)和pierce biotechnology,inc.(rockford,ill.)购得的这类荧光染料和试剂。
[0192]
(b)发光染料
[0193]
发光染料或标记还可进一步划分为以下子类别:化学发光染料和电化学发光染料。
[0194]
不同类别的化学发光标记包括鲁米诺、吖啶类化合物、腔肠素和类似物、二氧杂环
丁烷、基于过氧草酸的系统及其衍生物。对于免疫诊断程序,主要使用基于吖啶的标记(详细综述见dodeigne c.等人,talanta 51(2000)415-439)。
[0195]
用作电化学发光标记的主要相关性标记分别是钌基和铱基电化学发光复合物。已经证明,电化学发光(ecl)作为高灵敏度和选择性方法在分析应用中非常有用。该方法使化学发光分析的分析优势(无背景光信号)和通过采用电极电位更方便地控制反应相结合。通常,钌复合物,尤其是与tpa(三丙胺)在液相或液固界面再生的[ru(bpy)3]2 (在约620nm处释放光子)被用作ecl标记。最近,对铱基ecl标记已有描述(wo2012107419(a1))。
[0196]
(c)放射性标记使用放射性同位素(放射性核素),诸如3h、11c、14c、18f、32p、35s、64cu、68gn、86y、89zr、99tc、111in、123i、124i、125i、131i、133xe、177lu、211at或131bi。
[0197]
金属螯合物的配合物适合用作成像和治疗目的的标记,这是本领域所公知的(us 2010/0111856;us 5,342,606;us 5,428,155;us 5,316,757;us 5,480,990;us 5,462,725;us 5,428,139;us 5,385,893;us 5,739,294;us 5,750,660;us 5,834,456;hnatowich等人,j.immunol.methods 65(1983)147-157;meares等人,anal.biochem.142(1984)68-78;mirzadeh等人,bioconjugate chem.1(1990)59-65;meares等人,j.cancer(1990),增刊10:21-26;izard等人,bioconjugate chem.3(1992)346-350;nikula等人,nucl.med.biol.22(1995)387-90;camera等人,nucl.med.biol.20(1993)955-62;kukis等人,j.nucl.med.39(1998)2105-2110;verel等人,j.nucl.med.44(2003)1663-1670;camera等人,j.nucl.med.21(1994)640-646;ruegg等人,cancer res.50(1990)4221-4226;verel等人,j.nucl.med.44(2003)1663-1670;lee等人,cancer res.61(2001)4474-4482;mitchell等人,j.nucl.med.44(2003)1105-1112;kobayashi等人,bioconjugate chem.10(1999)103-111;miederer等人,j.nucl.med.45(2004)129-137;denardo等人,clinical cancer research 4(1998)2483-90;blend等人,cancer biotherapy&radiopharmaceuticals 18(2003)355-363;nikula等人,j.nucl.med.40(1999)166-76;kobayashi等人,j.nucl.med.39(1998)829-36;mardirossian等人,nucl.med.biol.20(1993)65-74;roselli等人,cancer biotherapy&radiopharmaceuticals,14(1999)209-20)。
[0198]
在一个实施例中,将形成包含针对ctnt的第一抗体、ctnt(分析物)和针对ctnt的第二抗体的夹心,其中第二抗体被可检测地标记并且其中第一抗ctnt抗体能够结合固相或与固相结合。
[0199]
在一个实施例中,将本发明中公开的抗ctnt抗体用于免疫测定法中以测量ctnt。在一个实施例中,将上文公开的抗ctnt抗体用于夹心型免疫测定法。在一个实施例中,将本发明中公开的抗ctnt抗体用作检测抗体。在一个实施例中,如本文公开的抗ctnt抗体用发光染料,特别是化学发光染料或电化学发光染料可检测地标记。
[0200]
上述及其他实施例公开并包含于本发明的说明和实例中。关于根据本发明所采用的任一种方法、用途和化合物的更多相关文献,可通过使用例如电子设备等在公共图书馆和数据库中检索。例如,可利用互联网上的公共数据库“medline”,例如在万维网(world wide web)访问ncbi.nlm.nih.gov/pubmed/medline.html。万维网还有更多的数据库和地址可用,诸如ncbi.nlm.nih.gov/、fmi.ch/biology/research_tools.html、tigr.org/或infobiogen.fr/,都是本领域技术人员已知的,也可以用万维网中lycos.com下的地址访
问。
[0201]
除非另外定义,否则本文中使用的所有技术和科学术语所具有的含义与本发明所属领域普通技术人员通常理解的含义相同。如有歧义,以本专利说明书(包括定义)为准。
[0202]
本文中提供的所有氨基酸序列均从最n末端残基开始并以最c末端残基结束(n
→
c),如同本领域的惯用做法,本发明中用于识别氨基酸的单字母或三字母的代码缩写对应常用于氨基酸的那些代码缩写。
[0203]
关于本说明书表征的实施例,特别是在权利要求书中,其用途是每项从属权利要求所提及的各个实施例均与所述从属权利要求所属的每项权利要求(独立权利要求或从属权利要求)的各个实施例进行组合。例如,若为列举了3个可选方案a、b和c的独立权利要求1、列举了3个可选方案d、e和f的从属权利要求2,以及列举了3个可选方案g、h和i并从属于权利要求1和2的从属权利要求3,除非另有特别说明,否则应理解说明书明确公开了对应于以下组合的实施例:a、d、g;a、d、h;a、d、i;a、e、g;a、e、h;a、e、i;a、f、g;a、f、h;a、f、i;b、d、g;b、d、h;b、d、i;b、e、g;b、e、h;b、e、i;b、f、g;b、f、h;b、f、i;c、d、g;c、d、h;c、d、i;c、e、g;c、e、h;c、e、i;c、f、g;c、f、h;c、f、i。
[0204]
同样,在独立权利要求和/或从属权利要求未列举可选方案的情况下,应理解若从属权利要求向前引用了前述多项权利要求,则其包含的任意主题组合也视为被明确公开。例如,若为独立权利要求1、向前引用权利要求1的从属权利要求2以及向前引用权利要求2和1的从属权利要求3,则结果就是权利要求3和1的主题组合被明确、毫不含糊地公开,权利要求3、2和1的主题组合也是如此。如果进一步存在引用权利要求1至3中任一权利要求的从属权利要求4,则结果就是权利要求4和1的主题组合,权利要求4、21的主题组合,权利要求4、3、1的主题组合以及权利要求4、3、2、1的主题组合被明确、毫不含糊地公开。
[0205]
上述考虑,在细节上作适当修改后,可适用于所有附加权利要求。举一个非限制性实例,鉴于权利要求结构,可以明确、毫不含糊地设想权利要求13、12、1(i)的组合。同样适用于例如权利要求13、11、4(ii)等的组合。
[0206]
本发明的某些方面同样借助附图进行了说明。
[0207]
以下实例将说明本发明:
[0208]
实例1:材料和一般方法
[0209]
重组dna技术
[0210]
使用标准方法来操纵dna,如在sambrook,j.et al.,molecular cloning:a laboratory manual;cold spring harbor laboratory press,cold spring harbor,new york,1989中所述。根据制造商的说明来使用分子生物学试剂。
[0211]
dna序列测定
[0212]
通过在microsynth ag(balgach,switzerland)进行的双链测序来确定dna序列。
[0213]
dna和蛋白质序列分析及序列数据管理
[0214]
vector nt1 advance套件11.5.0版用于序列创建、映射、分析、注释和图解。
[0215]
蛋白质化学和标记技术
[0216]
标准蛋白质化学和标记技术在例如hermanson,g.
″
bioconjugate techniques
″
3rd edition(2013)academic press中提供。
[0217]
生物信息学
[0218]
生物信息学方法在例如keith j.m.(ed.)
″
bioinformatics
″
i卷和ii卷、methods in molecular biology 1525卷和1526卷(2017)springer以及martin,a.c.r.&allen,j.
″
bioinformatics tools for analysis of antibodies
″
(载于下书中:d
ü
bel s.&reichert j.m.(eds.)
″
handbook of therapeutic antibodies
″
wiley-vch(2014))等文献中提供。
[0219]
电化学发光免疫测定法
[0220]
免疫测定法及相关方法在例如wild d.(ed.)
″
the immunoassay handbook
″
4th edition(2013)elsevier中提供。作为电化学发光标记的钌络合物在例如staffilani m.等人inorg.chem.42(2003)7789-7798中提供。通常,为了进行基于电化学发光(ecl)的免疫测定法,会使用2010分析仪或后继系统,例如roche分析仪(roche diagnostics gmbh,mannheim germany),诸如e170、cobas e 601模块、cobas e 602模块、cobas e 801模块和cobas e 411,以及专为这些分析仪设计的roche测定法,各测定法应在标准条件下使用,除非另有说明。
[0221]
实例2:文库构建
[0222]
亲本抗体可变重链是鼠源的(seq id no:30)。构建包含突变的hccdr的文库,其目标是分别在hccdr1、hccdr2和/或hccdr3中进行单氨基酸随机化。在第一步中,生成了四个dna片段,每个片段编码四个不同的亲本抗体框架区之一。框架区1、3和4是通过内部聚合酶链反应获得的,代表框架区2的短片段2(42bp=seq id no:50)在metabion international ag订购(参见图1a)。对片段进行凝胶纯化和定量。在四种附加pcr反应混合物中的每一种中,使用100ng这些dna片段之一作为多核苷酸模板。通过使用包含与亲本cdr相同数量的密码子的多核苷酸文库来添加cdr区,其中所述文库的成员被设计为包含对于各个hccdr中的各个密码子位置具有一个nnk密码子的文库成员。cdr文库中的多核苷酸另外包含能够与邻近于相应cdr的框架区杂交的序列。末端引物用于嵌套pcr扩增。由此(参见图1b)生成了四个具有部分重叠序列的dna片段。执行了重叠pcr,其中末端引物与fw1序列的3
′
端和fw4序列的5
′
端杂交,以将四个片段连接到线性dna文库构建体(参见图1c)。典型的pcr反应用pcr级水填充到100μl反应混合物,该反应混合物包含带有mgso4的10μl 10x pcr缓冲液、200μm dntp混合物、0.5μm正向引物和反向引物、250ng dna模板、5个单位pwo dna聚合酶。典型的pcr开始于94℃5分钟的初始模板变性,采用30个循环(94℃2分钟、60℃45秒、72℃ 1分钟)并包含72℃ 5分钟的最终延伸步骤。引物、模板和片段序列列于表1。文库片段包含在无细胞系统中成功转录和翻译所需的所有调控序列。技术人员能够通过遵循现有技术的方法来生成这样的文库,例如参见hanes,j.&pluckthun,a.(1997),“in vitro selection and evolution of functional proteins by using ribosome display”,proc natl acad sci u.s.a.94,4937-42。
[0223]
表1:
[0224]
用于生成抗ctnt fab片段文库的序列
[0225]
[0226]
[0227]
[0228][0229]
实例3:体外展示
[0230]
制备用于fab展示的缓冲液,并在4℃以颠倒旋转的方式孵育过夜。洗涤缓冲液wb(60mm tris;用acoh调节至ph 7.5、180mm nacl、60mm醋酸镁、5%blocker bsa、33mm kcl、200μg t-rna、0.05%tween 20);珠子洗涤缓冲液bwb(100mm pbs,0.1%tween 20);终止缓冲液sb(用acoh调节至ph 7.5的50mm tris、150mm nacl、50mm醋酸镁、5%blocker bsa(pierce)、33mm kcl、0.5%tween 20、8.2mm ox.谷胱甘肽);洗脱缓冲液(用acoh调节至ph 7.5的55mm tris、165mm nacl、22mm edta、1mg bsa、5000u rrna(5000u)、50μg trna)。
[0231]
每10μl初始悬浮液用100μl洗涤缓冲液(wb)封闭所需体积的磁珠(链霉亲和素包被的珠子),并在4℃下颠倒旋转过夜。25μl珠子用于预淘选步骤,20μl珠子用于淘选每个目标/背景样品。为了去除珠子储存缓冲液中的叠氮化钠,用珠子洗涤缓冲液(bwb)洗涤珠子四次,并用wb洗涤三次。这些步骤是通过施加磁场来收集珠子两分钟并随后丢弃上清液来
进行的。在最后的洗涤步骤之后,珠子在wb中重悬至其初始体积。
[0232]
根据制造商的说明(purefrex
tm ds 2.0)组装了无细胞体外转录和翻译系统。为目标(t)准备了1.5ml反应管,并为背景(bg)准备一个反应管。
[0233]
表达模板(lc)和展示模板(hc)的dna输入以2:1的分子比施加。编码展示和表达模板的dna的量在所有fab展示循环中保持恒定。将体外转录/翻译反应混合物在37℃孵育2小时。孵育后,通过加入500μl终止缓冲液终止反应,然后在1℃以14 000rpm离心15分钟。除非另有说明,否则后续步骤均在4℃进行。将被终止的翻译混合物的上清液(300μl)添加到制备的珠子悬浮液中,并在摇摆平台上孵育30分钟。然后,将悬浮液以13000rpm和1℃离心10分钟,以将具有非特异性结合分子的珠子与具有剩余的三元复合物的上清液分离。将预淘选的上清液(300μl)转移到之前用wb封闭的新的2ml反应管中,并保持在冰上直到进一步使用。以2nm至50nm的最终浓度范围将目标(重组生物素化ctnt)添加到300μl预淘选的上清液中。在每个循环中降低生物素化ctnt的浓度以提高选择压力。将悬浮液在摇摆平台上孵育30分钟。溶液淘选步骤允许生物素化ctnt和三元复合物之间的特异性结合。与目标ctnt结合的三元复合物在20分钟的孵育步骤中被链霉亲和素珠捕获。在循环ii中,使用亲和素珠代替链霉亲和素珠,以防止非特异性结合。
[0234]
洗涤步骤包括在磁场中捕获具有结合的目标-三元复合物的珠子,然后去除上清液。用500μl冰冷的wb洗涤珠子。通过将洗涤步骤的持续时间从5分钟延长到1小时,在随后的展示循环中增加了选择压力。最后的洗涤步骤用于将珠子转移到新的封闭的2ml反应管中。随后用磁场捕获珠子并去除上清液。通过添加100μl含有edta的1x eb并摇动孵育10分钟来执行以下洗脱步骤。mrna从三元复合物中释放。然后将洗脱混合物在1℃以14000rpm离心10分钟。根据制造商的说明使用rneasy minelute清理试剂盒(qiagen)来分离和纯化富集的rna。用16μl无rna酶的水洗脱rna。为了从选择步骤中消化任何剩余的dna,根据制造商的说明使用ambion dna-free
tm
试剂盒。剩余的dna不能在随后的pcr反应中扩增。在dna酶失活后,将悬浮液在13000rpm和室温下离心两分钟。将上清液(50μl)转移到在冰上的新鲜的1.5ml反应管中。纯化的rna立即用于逆转录(rt)。任何剩余的上清液均储存在-80℃。
[0235]
将洗脱的mrna逆转录为cdna。为样品t设置了两个反应,其中包含淘选步骤中的目标。为样品bg和含有水的阴性对照制备了两个进一步的反应。根据样品的数量,制备了主混合物并将预混合物分配到在冰上的0.2ml反应管中。每个反应被接种12μl洗脱的rna和0.5μl逆转录酶。用12μl的无rna酶的水代替rna进行阴性对照。逆转录在pcr热循环仪中在65℃进行45分钟。随后,将cdna样品在冰上孵育5分钟,并在以下步骤中进行扩增。剩余的样品储存在-20℃。实施了两个pcr反应:使用引物frt和rrt进行第一个pcr“pcr on rt”以扩增选择池的cdna。应用了使用引物f1a和r1a的第二个pcr“pcr on rt-pcr”,以重新附接用于体外转录/翻译的调控元件。两个反应均使用pwo dna聚合酶进行。
[0236]
为了提供选择池的足够的dna浓度,为样品t和bg中的每一个设置了四个反应。
[0237]
此外,还设置了四个对照样品。前两个样品来源于对样品t和bg进行mrna分离后的dna消化物,并通过pcr验证以扩增可能剩余的dna。第三和第四样品是rt的阴性对照和使用pcr级水的“pcr on rt”的阴性对照。
[0238]
使用qiaquick凝胶提取试剂盒从制备性1%琼脂糖凝胶中纯化t的pcr产物,随后进行定量并用作“pcr on rt-pcr”的模板。制备了选择池的三个反应和用pcr级水替代dna
模板的一个阴性对照。对于每个反应,使用250ng先前纯化的“pcr on rt”。使用qiaquick凝胶提取试剂盒从1%制备琼脂糖凝胶中纯化pcr产物,并用于随后的展示循环,或进一步修饰用于后续亚克隆到适当的表达系统中。
[0239]
实例4:富集的结合物的周质表达
[0240]
为了分离富集的fab结合物,将突变的鼠可变hc克隆到p60rc_tntm-11-7表达载体中(参见图2),其中包含fab的鼠ch1结构域、鼠vl结构域和鼠cl结构域。使用正向引物5
’‑
gctacaaacgcgtacgctatgcagattcagctggtgcagagcg-3’(sed id no:94)和反向引物rrt 5
’‑
ggaaagcctctgaggaccagcacggatgccctgtgc-3’(seq id no:87)通过pcr扩增模板dna。选择池通过bsiwi和kpni限制性位点克隆到表达载体中。在96孔的深孔块(dwb)中进行周质表达。通过使用integra viaflo96将预培养(“主”)dwb的每孔填充1ml lb(100μg/ml氨苄青霉素),并接种先前实施的亚克隆和转化的分离克隆。每个选择池(循环iii、iv、v)挑选约200个菌落。留出一个未接种的孔作为阴性对照;另一孔接种xl1 blue转化的tnt m-11-7(野生型)fab表达载体作为阳性对照。dwb用透气膜密封,并在30℃的轨道摇床培养箱(750rpm)中孵育过夜。随后,将主dwb的每个孔中的50μl转移到新的“表达”dwb中,该“表达”dwb的每孔用1150ml c.r.a.p培养基(100μg/ml氨苄青霉素)制备,如simmons,l.c.,reilly,d.,klimowski,l.,raju,t.s.,meng,g.,sims,p.,hong,k.,shields,r.l.,damico,l.a.,rancatore,p.&yansura,d.g.(2002)“expression offull-length immunoglobulins in escherichia coli:rapid and efficient production of aglycosylated antibodies”,j immunol methods 263,133-47所述。dwb用透气膜密封,并在30℃的轨道摇床培养箱中孵育过夜。fab表达的诱导是基于phoa启动子以及磷酸盐限制性c.r.a.p培养基。24小时后,具有表达的fab的细胞通过以4000rpm离心10分钟而收获,并在-20℃下储存直至进一步使用。
[0241]
通过添加950μl 40%甘油并在-80℃下储存,将预培养主dwb用于“甘油储备物”。通过将密封的dwb剧烈涡旋5分钟并在室温下再摇动10分钟,将细胞沉淀重新悬浮在50μl b-perii细菌蛋白质提取试剂(thermo fisher scientific)中。细胞裂解物在950μl tris缓冲液(20mm tris ph 7.5,150mm nacl)中稀释,并在离心前孵育10分钟(10分钟,4000rpm)。将含有粗细胞提取物的表达块保持在4℃,直到进一步用于elisa或spr动力学研究。
[0242]
实例5:elisa筛选
[0243]
为了发现用于详细biacore分析的最佳突变体fab结合物,实施了先前的酶联免疫吸附测定(elisa)。elisa设置如图3所描绘。通过在轨道摇床上摇动,生物素化的重组心肌肌钙蛋白t(100nm)在室温下在链霉亲和素96孔板中捕获1小时。抗原肌钙蛋白t在100μl ip缓冲液(pbs ph 7.3,1%bsa)中稀释。随后,使用微孔板洗涤机biotek elx405 select将孔用300μl 1x洗涤缓冲液(150mm nacl,0.05%tween20,0.2%bronidox)洗涤三次。洗涤后,将含有突变的抗ctnt fab结合物的大肠杆菌细胞粗提物在ip缓冲液中按1∶4稀释并转移到肌钙蛋白t捕获孔中。再次将细胞用300μl 1x洗涤缓冲液洗涤三次。在山羊中产生的抗鼠igg(fab特异性)-过氧化物酶标记的抗体(检测抗体)以1∶40 000稀释度(在ip缓冲液中)用于检测结合有肌钙蛋白t的突变的fab片段。将孔再次用300μl 1x洗涤缓冲液洗涤三次,以去除未结合的检测抗体。将微孔板与每孔100μl的abts在室温下孵育30分钟。使用设置为405nm的酶标仪biotek power wave xs测量光密度。亲本抗ctnt抗体的野生型fab用作阳性
对照。鉴定首次命中,并将其细胞粗提取物提交至动力学分析。
[0244]
实例6:基于spr的功能分析
[0245]
详细的动力学研究在ge healthcare 8k仪器上于37℃进行。将biacore cm-5系列s传感器安装到仪器中,并根据制造商的说明进行预处理。系统缓冲液为hbs-et(10mm hepes(ph 7.4),150mm nacl,1mm edta,0.05%(w/v)20)。样品缓冲液是补充1mg/ml cmd(羧甲基葡聚糖凝胶,fluka)的系统缓冲液。在一个实施例中,在cm5生物传感器上建立了抗鼠fab片段捕获系统。兔多克隆pab抗m-igg f(ab
′
)2片段(目录号315-005-047,jackson immuno research)根据制造商的说明使用nhs/edc化学法进行固定。在5μl/min下,将在10mm乙酸钠缓冲液(ph 5.0)中的30μg/ml ramf(ab
′
)2以10.000ru固定在每个流动池上。随后用ph 8.5的1m乙醇胺使传感器饱和。鼠抗tnt抗体fab
′
片段如所述在大肠杆菌细胞中周质表达,并通过已知方法裂解(技术细节参见:andersen,d.c.&reilly,d.e.(2004);production technologies for monoclonal antibodies and their fragments.(curr opin biotechnol 15,456-62)。裂解物在样品缓冲液中按1∶20稀释。fab
′
片段以5ul/min的流速从生物传感器测量细胞上的表达裂解物中捕获2分钟,然后用10倍浓缩hbs-ep缓冲液以20μl/min进行15秒的洗涤步骤。以响应单位(ru)监测fab片段捕获水平(cl)。将重组人tnt(roche,37kda)在样品缓冲液中以30nm稀释,并产生0nm、30nm、10nm、3.3nm、1.1nm、0.37nm tnt浓度的浓度系列。对于3分钟的缔合阶段,分析物浓度系列以80μl/min注射,并监测解离阶段5分钟。在分析物缔合阶段结束时,监测以响应单位(ru)计的“结合后期”(bl)报告点。在每个循环的动力学速率测定之后,通过15秒注射10倍浓缩hbs-ep缓冲液,然后以20ul/min两次1分钟注射100mm hcl来再生捕获系统。ctnt分析物的动力学参数ka[1/ms]、kd[1/s]、t1/2diss[min]、kd[m]和结合化学计量学(摩尔比)(详见:schraeml,m.&biehl,m.(2012);kinetic screening in the antibody development process.methods mol biol 901,171-81.)是根据制造商的说明,使用biaevaluation software(ge healthcare)针对每个fab片段突变体确定的。动力学参数与hc cdr3突变相关。
[0246]
表2:
[0247]
已经构建和分析的mab<tnt>rm-11-7fab位置a102衍生物的动力学数据。
[0248][0249][0250]
表2中的缩写:ka:缔合速率常数[m-1 s-1],kd:解离速率常数[s-1],kd:解离平衡常数kd[m],t/2-diss:复合物半衰期,ln(2)/kd*60[min],wt=亲本(野生型),fab=包含没有给定氨基酸取代(wt)或具有给定氨基酸取代的hc cdr3的fab片段
[0251]
在fab片段衍生物中,mab<tnt>rm-11-7fab a102w显示出最高的分析物复合物稳定性和野生型类似物缔合速率速度(见表2)。从上表2也可以看出,令人惊讶的是,仅a102w取代(氨基酸位置102将丙氨酸(a)取代为色氨酸(w))导致亲和力的大幅增加。与野生型或其他突变体相比,这种突变型fab片段的改进特性也分别从图4和图5中变得显而易见。
[0252]
实例7:hek细胞中抗体fab片段的表达
[0253]
在spr筛选后,根据标准细胞培养程序产生鼠fab片段先导候选抗体。相应的载体和克隆过程描述于norderhaug等人j immunol methods.1997 may 12;204(1):77-87。
[0254]
将编码重链和轻链的cdna克隆到单独载体中,在人巨细胞病毒(cmv)立即早期增强子/启动子区域下游并且随后是bgh多聚腺苷酸化信号。
[0255]
悬浮适应的人胚肾freestyle 293-f细胞系(thermo fisher scientific)用于抗体的瞬时基因表达(tge):根据制造商的指南,用被peipro(polyplus-transfection sa,strasbourg)转染试剂复合的等量的两种表达质粒(总共0.7mg/l细胞培养物)以约2x10e6个活细胞/ml对细胞进行转染。转染后三小时,加入hdac抑制剂丙戊酸(最终浓度:4mm)以增强表达。每天向培养物补充6%(v/v)的基于大豆蛋白胨水解物的供料。转染后七天,通过离心收集培养上清液,并根据标准程序从中纯化抗体。通过已知方法从细胞培养上清液中纯化mab<tnt》rm-11-7(a102w)-fab(igg1)-qtag-bi片段,并使用如所述的白色库氏菌转谷氨酰胺酶将其定点缀合至生物素(steffen等人jbc,sept.22,292,15622-15635,2017)。
[0256]
实例8:ecl测量
[0257]
根据实施例7,抗体fab片段mab《tnt》rm-11-7(a102w)-fab(igg1)-qtag作为生物素化fab片段产生,即mab《tnt》rm-11-7(a102w)-fab(igg1)-qtag-bi并在夹心免疫测定法
中进行测试(参见图6)。将fab片段mab<tnt>rm-11-7(a102w)-fab(igg1)-qtag-bi与如包含在可商购的roche测定法,目录号05092744190(roche diagnostics gmbh,mannheim,germany)中的mab11-7的生物素化野生型fab片段(即包含seq id no:16的cdr3)进行比较。这些生物素化试剂在相应的测定方案中用作试剂1(r1)。钌化检测抗体是包含在roche测定法,目录号05092744190(roche diagnostics gmbh,mannheim,germany)中的抗体。钌化检测抗体对应于r2试剂。
[0258]
使用肌钙蛋白t hs测定说明书,在cobas e170模块上使用带有空白对照(diluent universal,id.11732277122,diluent multi assay,id.03609987170,roche diagnostics gmbh,mannheim,germany)的肌钙蛋白t hs测定方案、来自肌钙蛋白t hs calset(id.05092752190,roche diagnostics gmbh,mannheim,germany)的call和cal2进行测量。
[0259]
该测定法遵循cobas e分析仪的测定方案2,其中样品、r1和r2在第一步中混合孵育9分钟,然后在第二步中加入链霉亲和素包被的磁珠,再孵育9分钟。接下来是预洗步骤;其中附接有免疫复合物的珠子被磁性聚焦到反应比色皿的底部,并且上清液用preclean溶液(roche目录号03004899190)替换两次,然后将整个混合物带到测量池以测量珠子上的构建免疫复合物的ecl-信号。在运行中使用的r1试剂(bi-缀合物)分别是原始可商购的tnt-hs测定法的r1试剂或是在tnt r1缓冲液中包含2.5μg/ml mab<tnt>rm-11-7(a102w)-fab(iggl)-qtag-bi的r1试剂。
[0260]
钌化(检测)抗体是包含在roche测定法,目录号05092744190(roche diagnostics gmbh,mannheim,germany)中的抗体。钌化检测抗体对应于r2试剂。
[0261]
链霉亲和素包被的磁珠始终与r1试剂瓶和r2试剂瓶之一组合使用。测量的样品包括样品稀释剂(diluent universal=缓冲空白)和tnt测定商业校准品(call(约18pg/ml rectnt)和cal2(约4200pg/ml rectnt))。示例性结果如图7所示。从图7可以看出,使用突变抗体mab<tnt>rm-11-7(a102w),空白值从954个计数(亲本)降低到777个计数(a102w)。cal-1信号水平从1432个计数(亲本)增加1.7倍到2460个计数(a102w)。cal-2计数水平从546602个计数(亲本)增加1.8倍到980432个计数(a102w)。由于信噪比是判断测定动力学和灵敏度增加的最重要参数,因此可以令人惊讶地表明,新的(突变)抗体总体上导致灵敏度增加约2倍。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。