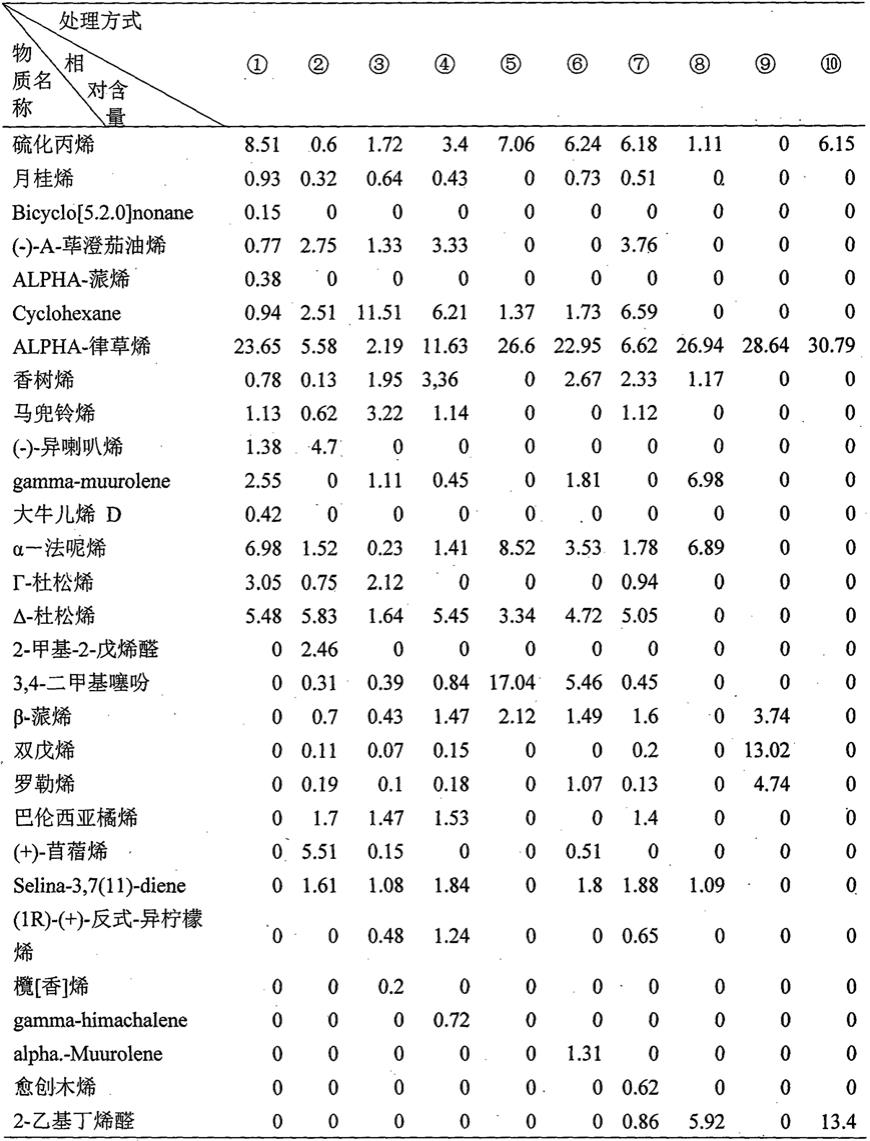
聚乙二醇化尿酸酶的制剂和剂量
1.相关申请
2.本技术根据35 u.s.c.
§
119(e)要求于2019年6月4日提交的美国临时申请序列号62/856,844;于2019年11月8日提交的美国临时申请序列号62/932,728的优先权权益,其各自的全部内容均通过引用并入本文。
发明领域
3.本文中提供了与尿酸酶组合物和/或包含含有免疫抑制剂之合成纳米载体的组合物相关的方法和组合物和药盒(kit)。本文中还提供了用于治疗对象(包括患有高尿酸血症、痛风或与痛风相关的病症的对象)和用于预防痛风发作的方法和组合物和药盒。本文中还提供了确定用于本文中所提供治疗的对象的方法以及用于监测治疗效力的方法。在一些实施方案中,该方法包括在对象中获得或确定抗尿酸酶效价和/或将该抗尿酸酶效价与阈值进行比较的步骤。在这样的实施方案的一些实施方案中,该方法还可包括本文中提供的用于治疗本文中提供的任一对象的任一步骤或方法。
4.发明概述
5.抗药物抗体(anti-drug antibody,ada)的出现是生物治疗性治疗失败和不良超敏反应的常见原因。已示出,包含免疫抑制剂的合成纳米载体能够诱导针对包含尿酸酶之组合物的免疫耐受,导致包含尿酸酶之组合物的效力提高。提高的效力已至少通过与其他治疗相比血清尿酸水平随时间降低的速率显著更高而示出。还已示出,与其他治疗相比,包含免疫抑制剂的合成纳米载体当与包含尿酸酶的组合物伴随施用时能够显著降低痛风发作的发生率。如本文中提供的包含含有免疫抑制剂之合成纳米载体的组合物和包含尿酸酶的组合物可用于有效且持久地(例如,持续至少30天)降低血清尿酸水平和/或降低痛风发作的发生率。
6.还发现使用对象中的抗尿酸酶抗体的量度可有助于对象的治疗。抗尿酸酶抗体的量度可以是对象中的抗尿酸酶效价。该度量可与阈值进行比较。因此,本文中提供的方法包括在本文中提供的任一对象中确定或获得抗尿酸酶抗体水平,例如在来自所述对象的样品中确定或获得抗尿酸酶抗体水平,和/或将所述对象中的抗尿酸酶抗体水平与阈值进行比较。在本文中提供的任一种方法中,抗尿酸酶抗体水平可以作为效价给出。在本文中提供的任一种方法中,阈值为效价小于约1080。在本文中提供的任一种方法中,阈值为约1080。任一种前述方法还可包括如本文中提供的更多步骤中的任一个或治疗方法中的任一种。
7.本文中还提供了以下方法,其包括向如本文中提供的具有低于阈值的抗尿酸酶效价的对象施用单独的或与本文中提供的任一种包含含有免疫抑制剂之合成纳米载体的组合物组合的本文中提供的任一种包含尿酸酶的组合物。本文中还提供了预防痛风发作的方法,其包括向具有低于阈值的抗尿酸酶效价的对象伴随施用包含含有免疫抑制剂之合成纳米载体的组合物和包含尿酸酶的组合物,所述对象例如在该伴随施用时不伴随施用预防痛风发作的另外的治疗剂的对象。在一些实施方案中,所述对象被确定为曾发生或预期会发生因在未伴随施用预防痛风发作的另外的治疗剂的情况下用痛风治疗进行治疗而发生的
痛风发作。所述对象可有此需要。所述对象可以是本文中所述的任一对象。
8.本文中还提供了治疗患有痛风或与痛风相关的病症的具有低于阈值的抗尿酸酶效价的对象的方法,其包括单独或与本文中提供的任一种包含含有免疫抑制剂之合成纳米载体的组合物组合施用本文中提供的任一种包含尿酸酶的组合物。在本文中提供的任一种方法的一个实施方案中,可重复地向对象施用单独或与任一种包含含有免疫抑制剂之合成纳米载体的组合物组合的本文中提供的包含尿酸酶的组合物。所述对象可以是有此需要的对象。所述对象可以是本文中所述的任一对象。
9.在一个方面中,提供了治疗患有痛风或与痛风相关的病症并且具有低于阈值的抗尿酸酶效价的人对象的方法,其包括向对象施用包含尿酸酶和可药用载体的组合物。在一个实施方案中,施用是通过非肌内施用方式。在一个实施方案中,向对象施用包含尿酸酶和可药用载体的组合物多于一次。在一个实施方案中,向对象施用包含尿酸酶和可药用载体的组合物多于两次、多于三次或多于四次。在一个实施方案中,包含尿酸酶和可药用载体的组合物每二至四周施用。在一个实施方案中,包含尿酸酶和可药用载体的组合物每月施用。在一个实施方案中,包含尿酸酶和可药用载体的组合物与包含免疫抑制剂的组合物伴随施用。
10.在一个方面中,提供了治疗患有痛风或与痛风相关的病症并且具有低于阈值的抗尿酸酶效价的对象的方法,其包括向对象伴随施用包含含有免疫抑制剂之合成纳米载体的组合物和包含尿酸酶的组合物。
11.本文中还提供了治疗具有低于阈值的抗尿酸酶效价的可经历痛风发作之对象的方法,其包括与本文中提供的任一种包含含有免疫抑制剂之合成纳米载体的组合物组合施用本文中提供的任一种包含尿酸酶的组合物。在一个方面中,在具有低于阈值的抗尿酸酶效价的对象中预防痛风发作的方法包括向对象伴随施用包含含有免疫抑制剂之合成纳米载体的组合物和包含尿酸酶的组合物。在一个实施方案中,在该伴随施用时不向对象伴随施用预防痛风发作的另外的治疗剂,例如抗痛风发作治疗剂。在一些实施方案中,在该伴随施用时不向对象伴随施用秋水仙碱或nsaid。在一个实施方案中,该对象被确定为曾发生或预期会发生来自用痛风治疗剂(例如降尿酸治疗剂)进行治疗的痛风发作。在一个实施方案中,该对象被确定为曾发生或预期会发生在未伴随施用预防痛风发作的另外的治疗剂的情况下发生的痛风发作。
12.在本文中提供的任一种方法的一个实施方案中,对象被确定或监测为具有或维持低于阈值的抗尿酸酶抗体水平(例如抗体效价)。在本文中提供的任一种方法的一个实施方案中,基于所述确定或监测来调整治疗剂量和/或频率。在本文中提供的任一种方法的一个实施方案中,该方法还包括用于确定或监测对象以确定抗尿酸酶抗体水平(例如抗体效价)的一个或更多个步骤。
13.在本文中提供的任一种方法的一个实施方案中,伴随施用在对象中发生多于一次。在本文中提供的任一种方法的一个实施方案中,伴随施用在对象中发生至少两次(例如,至少三次、四次、五次、六次、七次、八次、九次或十次)。在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物和包含尿酸酶的组合物每二至四周伴随施用。在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物和包含尿酸酶的组合物每月伴随施用。在本文中提供的任一种方法
的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物和包含尿酸酶的组合物每月伴随施用,持续至少三个月(例如,4、5、6、7、7、8、9、10个月或更多个月)。
14.在本文中提供的任一种方法的一个实施方案中,包含尿酸酶的组合物在每次施用(例如每次伴随施用)时以0.1mg/kg至1.2mg/kg尿酸酶的标签剂量施用。在本文中提供的任一种方法的一个实施方案中,包含尿酸酶的组合物在每次施用(例如每次伴随施用)时以0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.7mg/kg、0.8mg/kg、0.9mg/kg、1.0mg/kg、1.1mg/kg或1.2mg/kg尿酸酶的标签剂量施用。在本文中提供的任一种方法的一个实施方案中,包含尿酸酶的组合物在每次施用(例如每次伴随施用)时以0.2至0.4mg/kg尿酸酶的标签剂量施用。
15.在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物在每次伴随施用时以0.05mg/kg至0.5mg/kg免疫抑制剂的标签剂量施用。在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物在每次伴随施用时以0.05mg/kg、0.07mg/kg、0.075mg/kg、0.08mg/kg、0.1mg/kg、0.125mg/kg、0.15mg/kg、0.2mg/kg、0.25mg/kg、0.3mg/kg、0.35mg/kg、0.4mg/kg、0.45mg/kg或0.5mg/kg免疫抑制剂的标签剂量施用。在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物在每次伴随施用时以0.075至0.2mg/kg或0.08至0.125mg/kg免疫抑制剂的标签剂量施用。
16.在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物在每次伴随施用时以0.5mg/kg至6.5mg/kg的标签剂量施用,其中该剂量以包含免疫抑制剂的合成纳米载体的mg给出。在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物在每次伴随施用时以0.55mg/kg、0.6mg/kg、0.65mg/kg、0.7mg/kg、0.75mg/kg、0.8mg/kg、0.85mg/kg、0.9mg/kg、0.95mg/kg、1.0mg/kg、1.10mg/kg、1.125mg/kg、1.5mg/kg、1.75mg/kg、2.0mg/kg、2.5mg/kg、3.0mg/kg、3.5mg/kg、4.0mg/kg、4.5mg/kg、5mg/kg、5.5mg/kg、6.0mg/kg或6.5mg/kg的标签剂量施用,其中该剂量以包含免疫抑制剂的合成纳米载体的mg给出。在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物在每次伴随施用时以0.6至2.5mg/kg、0.7至2.5mg/kg、08至2.5mg/kg、0.9至2.5mg/kg、1.0至2.5mg/kg、1.5至2.5mg/kg、或2.0至2.5mg/kg的标签剂量施用,其中该剂量以包含免疫抑制剂的合成纳米载体的mg给出。在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物在每次伴随施用时以0.65至2.5mg/kg、0.65至2.0mg/kg、0.65至1.5mg/kg或0.65至1.0mg/kg的标签剂量施用,其中该剂量以包含免疫抑制剂的合成纳米载体的mg给出。在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物在每次伴随施用时以0.75至2.0mg/kg、0.8至1.5mg/kg、0.9至1.5mg/kg或1至2mg/kg的标签剂量施用,其中该剂量以包含免疫抑制剂的合成纳米载体的mg给出。在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物在每次伴随施用时以0.9至2mg/kg或1至1.5mg/kg的标签剂量施用,其中该剂量以包含免疫抑制剂的合成纳米载体的mg给出。
17.在本文中提供的任一种方法的一个实施方案中,所述方法还包括在伴随施用之后在不伴随施用另外的治疗剂(例如包含免疫抑制剂的组合物,例如包含含有免疫抑制剂之
合成纳米载体的组合物)的情况下向对象施用包含尿酸酶的组合物至少一次(例如,至少2、3、4、5、6、7、8、9或10次或者更多次)。在本文中提供的任一种方法的一个实施方案中,所述方法还包括在伴随施用之后施用包含尿酸酶的组合物至少两次。在本文中提供的任一种方法的一个实施方案中,所述方法还包括在伴随施用之后每月施用包含尿酸酶的组合物,持续两个月,每次施用均不伴随施用另外的治疗剂,例如包含免疫抑制剂的组合物,例如包含含有免疫抑制剂之合成纳米载体的组合物。在一些实施方案中,包含尿酸酶的组合物在一次或更多次伴随施用之后在没有免疫抑制剂的情况下每次施用时以0.1至1.2mg/kg尿酸酶的标签剂量施用。在一些实施方案中,包含尿酸酶的组合物在一次或更多次伴随施用之后在没有免疫抑制剂的情况下每次施用时以0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.7mg/kg、0.8mg/kg、0.9mg/kg、1.0mg/kg、1.1mg/kg、1.2mg/kg尿酸酶的标签剂量施用。
18.在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物在包含尿酸酶的组合物之前施用,例如在每次伴随施用时。在本文中提供的任一种方法的一个实施方案中,包含含有免疫抑制剂之合成纳米载体的组合物和包含尿酸酶的组合物在彼此的1小时之内施用。
19.在本文中提供的任一种方法的一个实施方案中,不向对象施用另外的治疗剂,例如另外的痛风治疗剂,例如预防痛风发作的另外的痛风治疗剂。在这些实施方案的一个实施方案中,另外的治疗剂(例如另外的痛风治疗剂,例如预防痛风发作的另外的通风治疗剂)不在每次伴随施用时伴随施用。
20.本文中提供的任一种方法、组合物或药盒可用于治疗本文中提供的任一对象。
21.在本文中提供的任一种方法、组合物或药盒的一个实施方案中,对象具有升高的血清尿酸水平。在本文中提供的任一种方法、组合物或药盒的一个实施方案中,对象的血清尿酸水平为≥5mg/dl。在本文中提供的任一种方法、组合物或药盒的一个实施方案中,对象的血清尿酸水平为≥6mg/dl。在本文中提供的任一种方法、组合物或药盒的一个实施方案中,对象的血清尿酸水平为≥7mg/dl。在本文中提供的任一种方法、组合物或药盒的一个实施方案中,对象患有以下或处于患有以下的风险之中:高尿酸血症;急性痛风;具有或不具有痛风石的慢性痛风;特发性痛风;难治性痛风;继发性痛风;未明确的痛风(unspecified gout);与心血管病症、肾病症、肺病症、神经病症、眼病症、皮肤病症或肝病症相关的痛风;或者对象曾发生痛风发病或痛风发作。在本文中提供的任一种方法、组合物或药盒的一个实施方案中,预期对象会发生来自用痛风治疗剂(例如降尿酸治疗剂,例如包含尿酸酶的组合物)进行治疗的痛风发作。在本文中提供的任一种方法、组合物或药盒的一个实施方案中,对象患有具有以下至少一种的痛风:a)痛风石、b)在最近6个月内的痛风发作和c)慢性痛风性关节病。
22.在本文中提供的任一种方法或组合物或药盒的一个实施方案中,尿酸酶是聚乙二醇化尿酸酶。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,聚乙二醇化尿酸酶是pegsiticase(pegsiticase)或pegloticase(pegloticase)。在本文中提供的任一种方法的一个实施方案中,聚乙二醇化尿酸酶是pegsiticase。
23.在本文中提供的任一种方法或组合物或药盒的一个实施方案中,免疫抑制剂包封在合成纳米载体中。
24.在本文中提供的任一种方法或组合物或药盒的一个实施方案中,免疫抑制剂是mtor抑制剂。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,mtor抑制剂是雷帕霉素类似物(rapalog)。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,雷帕霉素类似物是雷帕霉素。
25.在本文中提供的任一种方法或组合物或药盒的一个实施方案中,合成纳米载体是聚合物合成纳米载体。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,聚合物合成纳米载体包含疏水性聚酯。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,疏水性聚酯包含pla、plg、plga或聚己内酯。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,聚合物合成纳米载体还包含peg。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,peg与pla、plg、plga或聚己内酯缀合。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,聚合物合成纳米载体包含pla、plg、plga或聚己内酯,以及与pla、plg、plga或聚己内酯缀合的peg。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,聚合物合成纳米载体包含pla和pla-peg。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,合成纳米载体是如根据本文中提供的任一种例示方法所描述的或可通过本文中提供的任一种例示方法获得的那些。
26.在本文中提供的任一种方法或组合物或药盒的一个实施方案中,使用合成纳米载体的动态光散射获得的粒度分布的平均值是大于120nm的直径。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,直径大于150nm。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,直径大于200nm。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,直径大于250nm。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,直径小于300nm。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,直径小于250nm。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,直径小于200nm。
27.在本文中提供的任一种方法或组合物或药盒的一个实施方案中,合成纳米载体中免疫抑制剂的负载为按重量计7%至12%或8%至12%。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,合成纳米载体中免疫抑制剂的负载为按重量计7%至10%或8%至10%。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,合成纳米载体中免疫抑制剂的负载为按重量计9%至11%。在本文中提供的任一种方法或组合物或药盒的一个实施方案中,合成纳米载体中免疫抑制剂的负载为按重量计7%、8%、9%、10%、11%或12%。
28.在本文中提供的任一种方法的一个实施方案中,每次施用是静脉内施用。在本文中提供的任一种方法的一个实施方案中,静脉内施用是静脉内输注。
29.在本文中提供的任一种方法的一个实施方案中,所述方法还包括向对象施用另外的治疗剂。在本文中提供的任一种方法的一个实施方案中,另外的治疗剂是抗炎治疗剂,例如皮质类固醇。在本文中提供的任一种方法的一个实施方案中,另外的治疗剂是痛风治疗剂,例如经口痛风治疗剂。在本文中提供的任一种方法的一个实施方案中,另外的治疗剂随后施用。在本文中提供的任一种方法的一个实施方案中,另外的治疗剂在完成伴随施用尿酸酶组合物和合成纳米载体组合物的治疗之后施用,例如根据本文中提供的任一种方案。
30.在本文中提供的任一种方法的一个实施方案中,另外的治疗剂是抗痛风发作治
疗。在本文中提供的任一种方法的一个实施方案中,抗痛风发作治疗是伴随地但在施用的每种尿酸酶组合物的施用之前施用的预防性治疗,例如根据本文中提供的任一种方案。在本文中提供的任一种方法的一个实施方案中,抗痛风发作治疗是秋水仙碱或nsaid。
31.在本文中提供的任一种方法的一个实施方案中,另外的治疗剂是皮质类固醇,并且皮质类固醇伴随施用,例如在施用的每种尿酸酶组合物的施用之前伴随施用,例如根据本文中提供的任一种方案。
32.在另一个方面中,方法包括向本文中所述的任何对象施用包含本文中提供的任一剂量(包括标签剂量)的尿酸酶和可药用载体的组合物一次或更多次(例如,2、3、4、5、6、7、8、9或10次或者更多次)。在一些实施方案中,至少一次施用或每次施用是通过非肌内施用方式。在一些实例中,至少一次施用或每次施用是静脉内施用,例如静脉内输注。在一些实施方案中,包含尿酸酶和可药用载体的组合物每两周或四周施用。在一些实施方案中,包含尿酸酶和可药用载体的组合物每月施用。在一些实施方案中,包含尿酸酶和可药用载体的组合物与本文中所述的任一种包含免疫抑制剂的组合物伴随施用。
33.在一个方面中是组合物或药盒,其包含单独或与一种或更多种包含含有免疫抑制剂之合成纳米载体的组合物组合的一种或更多种包含尿酸酶的组合物。每种包含尿酸酶的组合物可以是在任一种组合物或药盒中的如本文中提供的任一种包含尿酸酶的组合物。每种包含尿酸酶的组合物的量可以是使得其在任一种组合物或药盒中提供如本文中提供的任意一个或更多个剂量(包括标签剂量)的尿酸酶。每种包含尿酸酶的组合物可以以冻干形式在任一种组合物或药盒中。每种包含含有免疫抑制剂之合成纳米载体的组合物可以是在任一种组合物或药盒中的如本文中提供的任一种包含含有免疫抑制剂之合成纳米载体的组合物。每种包含含有免疫抑制剂之合成纳米载体的组合物的量可以是使得其在任一种组合物或药盒中提供如本文中提供的任意一个或更多个剂量(包括标签剂量)的包含免疫抑制剂的合成纳米载体或免疫抑制剂。每种包含含有免疫抑制剂之合成纳米载体的组合物可以以冻干形式在任一种组合物或药盒中。每种包含含有免疫抑制剂之合成纳米载体的组合物可处于任一种组合物或药盒中的冷冻混悬液中。在任一种组合物或药盒的一个实施方案中,冷冻混悬液还包含磷酸缓冲盐水(pbs)。在任一种组合物或药盒的一个实施方案中,冻干形式还包含pbs和/或甘露糖醇。在任一种组合物或药盒的一个实施方案中,组合物或药盒还包含0.9%氯化钠,usp。
34.附图简述
35.图1是显示使用dect可视化的痛风石/尿酸沉积物的图像。
36.图2是sel-212的组分的卡通呈现。
37.图3是用空纳米载体 pegsiticase或pegsiticase 0.1x或1x包含雷帕霉素的合成纳米载体(svp-雷帕霉素)处理之后非人灵长类中ada水平的图。
38.图4是单静脉内输注pegsiticase之后1a期临床试验的5个组群中平均血清尿酸(serum uric acid,sua)水平的图。
39.图5是显示1a期临床试验的组群#3以及1b期临床试验的组群#9、组群#4和组群#6中每位对象的血清尿酸水平和尿酸酶特异性ada水平的图示。
40.图6是显示来自1a期临床试验的组群#3以及来自1b期临床试验的组群#9、组群#1、组群#2、组群#3、组群#4、组群#5和组群#6的血清尿酸水平的图。
41.图7从左到右示出了来自两个重复试验的数据,中间是单独的svp-雷帕霉素与单独的pegsiticase(组群#9)的数据,且然后是单独的雷帕霉素与组群#6(sel-212组群)的数据。
42.图8是显示用单独或与包含雷帕霉素的合成纳米载体(svp-雷帕霉素)(0.1或0.3mg/kg)组合的pegsiticase治疗的对象的血清尿酸水平的图示。
43.图9示出了2期临床试验的剂量。
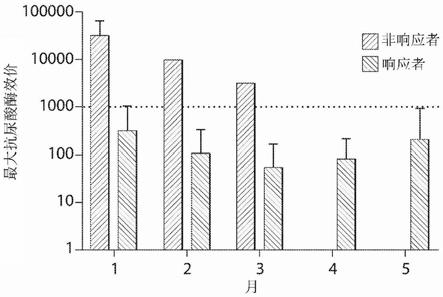
44.图10是示出了抗尿酸酶效价的图。在这种情况下,无响应治疗期的效价为1080或更大。
45.图11是示出了抗尿酸酶效价的图。小于1∶1080的那些的持续尿酸酶活性提高。
46.图12a至12b示出了五个月剂量的与0.2mg/kg pegadricase共施用的包含雷帕霉素的纳米载体的结果。图12a示出了不同剂量的包含雷帕霉素的纳米载体,并且图12b示出了包含雷帕霉素的纳米载体浓度施用的不同组合。
47.图13a至13d示出了提高抗尿酸酶效价导致更低的尿酸酶活性(图13a至13b),而提高包含雷帕霉素的纳米载体浓度导致更高的持续尿酸酶活性(图13c至13d)。在图13a和13c中,使用0.2mg/kg pegadricase的剂量;在图13b和13d中,使用0.4mg/kg pegadricase的剂量。
48.发明详述
49.a.概述
50.痛风可以是痛苦且致残的,并且被认为由过量的尿酸引起。此外,高浓度的尿酸(例如血清尿酸)可提高共病(包括心血管疾病、心脏代谢疾病、关节疾病和肾病)的风险。在美国和欧盟,分别存在大约830万和1000万痛风患者。
51.基于在上文和本文中其他地方提供的实例的研究和数据,已示出所提供的组合物和方法比目前可用的治疗显著更有效,可降低与尿酸酶(例如聚乙二醇化尿酸酶)的递送相关的不期望免疫应答,可提供对患者中血清尿酸水平的强且持久的控制,可向患者(例如患有慢性痛风石性痛风的患者)提供去除疼痛且有害的尿酸沉积物,和/或可显著降低或消除在降尿酸治疗(例如尿酸酶)下可发生的痛风发作的风险。
52.还已表明,使用对象中的抗尿酸酶抗体的量度可有助于确定用于治疗的对象或评估对象的治疗。抗尿酸酶抗体的量度可以是对象的抗尿酸酶效价。该量度可与阈值进行比较并告知治疗决策。
53.b.定义
54.如本文中所用,“另外的治疗剂”是指除另一种治疗之外还使用的任何治疗剂。例如,当所述方法是涉及用包含免疫抑制剂的合成纳米载体进行治疗的方法并且该方法包括使用另外的治疗剂时,该另外的治疗剂除包含免疫抑制剂的合成纳米载体之外。作为另一个实例,当该方法是涉及用包含尿酸酶的组合物和包含含有免疫抑制剂之合成纳米载体的组合物的组合进行治疗的方法,并且该方法包括使用另外的治疗剂时,该另外的治疗剂除尿酸酶和合成纳米载体组合物的组合之外。通常来说,另外的治疗剂将是不同的治疗剂。另外的治疗剂可与另一种治疗剂同时或在不同时间和/或通过相同的施用方式或通过不同的施用方式施用。在一些优选的实施方案中,另外的治疗剂以在另一种治疗剂的有效治疗窗期间为对象提供益处的时间和方式给予。当以特定时间段施用两种组合物时,该时间段通
常从第一组合物的开始至第二组合物的开始进行测量。如本文中所用,当在1小时内给予两种组合物时,例如开始施用第一组合物之前的时间为开始施用第二组合物之前的约1小时。
55.在一些实施方案中,另外的治疗剂是用于治疗痛风或与痛风相关的病症的另一种治疗剂。如本文中所用,“痛风治疗剂”是可施用并且患有痛风的对象由于其施用可从中获得益处的任何治疗剂。在一些实施方案中,痛风治疗剂是经口痛风治疗剂(即,可经口服用或经口给予的痛风治疗剂)。
56.另外的治疗剂可以是本文中所述或本领域以其他方式已知的先前批准的治疗剂中的任一种。在一些实施方案中,另外的治疗剂是降尿酸治疗剂。这样的治疗剂是与没有施用该治疗剂的对象中的血清尿酸水平相比导致对象中血清尿酸水平更低的任一种。这样的降尿酸治疗剂包括尿酸酶。
57.在一些实施方案中,另外的治疗剂是用于预防痛风发作的治疗剂或在本文中也称为抗痛风发作治疗剂。任何可用于预防痛风发作的治疗剂都包括在这类治疗剂中。在这些实施方案中的一些中,用于预防痛风发作的治疗剂在施用另一种治疗剂之前给予。在一些实施方案中,用于预防痛风发作的治疗剂是秋水仙碱。在另一些实施方案中,用于预防痛风发作的治疗剂是nsaid。
58.在一个实施方案中,本文中提供的用于治疗任一对象的任一种方法或者任一种组合物或药盒可分别包括另外的治疗剂的施用或另外的治疗剂。在另一个实施方案中,本文中提供的用于治疗任一对象的任一种方法或者任一种组合物或药盒分别不包括另外的治疗剂的施用(例如在另一种治疗剂的有效治疗窗内)或另外的治疗剂。
[0059]“施用”是指以使得对象中存在药理学结果的方式向对象给予物质。这可以是直接或间接施用,例如通过诱导或指导另一个对象(包括另一个临床医生或对象自身)来进行施用。
[0060]
在用于施用于对象的组合物或剂量的情况下,“有效量”是指在该对象中产生一种或更多种期望应答的组合物或剂量的量。在一些实施方案中,有效量是药效学有效量。因此,在一些实施方案中,有效量是产生本文中提供的一种或更多种期望治疗效果和/或免疫应答的本文中提供的组合物或剂量的任意量。该量可用于体外或体内目的。对于体内目的,该量可以是临床医生认为可对有此需要的对象具有临床益处的量。如本文中提供的任一种组合物或剂量(包括标签剂量)可以是有效量。
[0061]
有效量可涉及降低不期望应答的水平,但在一些实施方案中,其涉及完全防止不期望的应答。有效量还可涉及延迟不期望应答的发生。有效量也可以是产生期望治疗终点或期望治疗结果的量。在另一些实施方案中,有效量可涉及增强期望应答(例如治疗终点或结果)的水平。有效量优选地在本文中提供的任一对象中导致治疗结果或终点和/或降低或消除针对治疗的ada和/或导致痛风发作的预防。可通过常规方法监测前述任一项的实现。
[0062]
当然,有效量将取决于所治疗的特定对象;病症、疾病或障碍的严重程度;包括年龄、身体状况、身高和体重的个体患者参数;治疗的持续时间;并行治疗(如果有的话)的性质;具体施用途径以及在保健从业者的知识和专业之内的类似因素。这些因素是本领域普通技术人员公知的并且仅用常规实验就可解决。通常优选的是使用最大剂量,即根据合理医学判断的最高安全剂量。然而,本领域普通技术人员将理解,出于医学原因、心理原因或出于几乎任何其他原因,患者可坚持较低剂量或可耐受剂量。
[0063]
本发明的任一种组合物中或在本发明的任一种方法中使用的组分的剂量可以指组合物中组分的量、所施用对象接受的各组分的实际量、或标签上显示的量(本文中也称为标签剂量)。可基于提供期望量的组分的合成纳米载体的数量来施用剂量。
[0064]“连接”或“连接的”或者“偶联”或“偶联的”(等)意指在化学上使一个实体(例如部分)与另一个实体缔合。在一些实施方案中,连接是共价的,意指连接发生在在两个实体之间存在共价键的情况下。在非共价实施方案中,非共价连接由非共价相互作用介导,所述非共价相互作用包括但不限于电荷相互作用、亲和相互作用、金属配位、物理吸附、主客体相互作用(host-guest interaction)、疏水相互作用、tt堆积相互作用、氢键键合相互作用、范德华相互作用、磁性相互作用、静电相互作用、偶极-偶极相互作用、和/或其组合。在一些实施方案中,包封是连接形式。
[0065]
除非另有说明,否则本文中所用的“平均”是指算术平均值。
[0066]“伴随”意指以在时间上相关(优选地在时间上充分相关)以提供生理或免疫应答的调节的方式向对象施用两种或更多种物质/药剂,并且甚至更优选地,这两种或更多种物质/药剂组合施用。在一些实施方案中,伴随施用可包括在指定的时间段内(优选地在1个月内,更优选地在1周内,还更优选地在1天内,并且甚至更优选地在1小时内)施用两种或更多种物质/药剂。在一些实施方案中,两种或更多种物质/药剂依次施用。在一些实施方案中,物质/药剂可重复地伴随施用;即多于一次的伴随施用。
[0067]“剂量”是指用于以给定时间施用于对象的药理学活性物质的特定量。除非另有说明,否则针对包含聚乙二醇化尿酸酶的组合物所记载的剂量是指尿酸酶(即,没有peg或包含聚乙二醇化尿酸酶之组合物的任何其他组分的重量的蛋白质)的重量。另外,除非另有说明,否则针对包含含有免疫抑制剂之合成纳米载体的组合物所记载的剂量是指免疫抑制剂的重量(即,没有合成纳米载体组合物的合成纳米载体物质或任何其他组分的重量)。当提及用于施用的剂量时,在本文中提供的任一种方法、组合物或药盒的一个实施方案中,本文中提供的任一种剂量是其在标签上显示的剂量/标签剂量。
[0068]“包封”意指将物质的至少一部分封装在合成纳米载体中。在一些实施方案中,物质完全封装在合成纳米载体中。在另一些实施方案中,包封的物质中的大部分或全部不暴露于合成纳米载体外部的局部环境。在另一些实施方案中,不超过50%、40%、30%、20%、10%或5%(重量/重量)暴露于局部环境。包封不同于吸收,所述吸收将物质的大部分或全部置于合成纳米载体的表面上,并使物质暴露于合成纳米载体外部的局部环境。在本文中提供的任一种方法或组合物的一些实施方案中,免疫抑制剂包封在合成纳米载体内。
[0069]“升高的血清尿酸水平”是指可导致不期望的结果或临床医生会认为升高的对象血清中的任何尿酸水平。在一个实施方案中,本文中提供的任一种方法的对象的血清尿酸水平可以是≥5mg/dl、≥6mg/dl或≥7mg/dl。这样的对象可以是高尿毒症对象。对象是否具有升高的血液尿酸水平可由临床医生确定,并且在一些实施方案中,对象是临床医生已经确定或将确定为具有升高的血清尿酸水平的对象。
[0070]“痛风”通常是指与尿酸累积(例如尿酸晶体在组织和关节中的沉积)和/或临床上相关的升高血清尿酸水平相关的疾病或病症。尿酸的累积可以是由于尿酸的过量产生或尿酸的排泄降低。痛风的范围可从无症状到严重且疼痛的炎性病症。“与痛风相关的病症”是指对象中的以下任何病症,其中该对象经历痛风的局部和/或全身影响,包括炎症和免疫应
答,以及其中该病症由痛风引起或由于痛风而加重,或者该病症可导致或加重痛风。痛风发作是痛风症状的“发病”或恶化,其可随时发生。痛风发作可包括在施用降尿酸治疗之后发生的痛风发作。
[0071]“疏水性聚酯”是指包含一个或更多个聚酯聚合物或其单元并且具有疏水特性的任何聚合物。聚酯聚合物包括但不限于pla、plga、plg和聚己内酯。“疏水性的”是指基本上不参与与水的氢键合的物质。这样的物质的电荷通常是非极性的、主要是非极性的,或者是中性的。合成纳米载体可完全由疏水性聚酯或其单元构成。然而,在一些实施方案中,合成纳米载体包含与其他聚合物或其单元组合的疏水性聚酯或其单元。这些其他聚合物或其单元可以是疏水性的但不一定如此。在一些优选的实施方案中,当合成纳米载体除疏水性聚酯之外还包含一种或更多种其他聚合物或其单元时,其他聚合物或其单元与疏水性聚酯的基质总体上是疏水性的。可在本发明中使用并且包含疏水性聚酯的合成纳米载体的一些实例可见于美国公开no.us 2016/0128986和us 2016/0128987,并且此类合成纳米载体和此类合成纳米载体的公开内容通过引用并入本文。
[0072]
如本文中所用,“免疫抑制剂”是指以下化合物,其可引起对抗原特异性的致耐受性免疫应答,在本文中也称为“免疫抑制作用”。免疫抑制作用通常是指降低、抑制或预防针对特定抗原的不期望免疫应答或者促进期望免疫应答(例如调节性免疫应答)的通过抗原呈递细胞(antigen-presenting cell,apc)的细胞因子或其他因子的产生或表达。当apc获得对识别由该apc呈递的抗原的免疫细胞的免疫抑制功能(在免疫抑制作用下)时,认为免疫抑制作用对所呈递的抗原具有特异性。免疫抑制剂的一些实例包括“mtor抑制剂”,一类抑制mtor的药物,mtor是属于磷脂酰肌醇-3激酶(pi3k)相关激酶(pikk)家族的丝氨酸/苏氨酸特异性蛋白激酶。mtor抑制剂包括但不限于雷帕霉素类似物(例如雷帕霉素),以及atp竞争性mtor激酶抑制剂(例如mtorc1/mtorc2双重抑制剂)。
[0073]
在本文中提供的任一种方法、组合物或药盒的一些实施方案中,本文中提供的免疫抑制剂与合成纳米载体连接。在一些优选的实施方案中,免疫抑制剂是除构成合成纳米载体结构的物质之外的要素。例如,在其中合成纳米载体由一种或更多种聚合物构成的一个实施方案中,免疫抑制剂是除一种或更多种聚合物之外并且与其连接的化合物。在一些实施方案中,例如在合成纳米载体的物质也导致免疫抑制作用的情况下,免疫抑制剂是除导致免疫抑制作用的合成纳米载体物质之外还存在的要素。
[0074]
当包含在包含合成纳米载体(例如与其偶联)的组合物中时,“负载”是基于整个合成纳米载体中物质的总干配方重量的组合物中免疫抑制剂的量(重量/重量)。通常来说,这样的负载计算为合成纳米载体群的平均值。在一个实施方案中,合成纳米载体的平均负载为0.1%至15%。在另一个实施方案中,负载为0.1%至10%。在另一个实施方案中,负载为1%至15%。在另一个实施方案中,负载为5%至15%。在另一个实施方案中,负载为7%至12%。在另一个实施方案中,负载为8%至12%。在另一个实施方案中,负载为7%至10%。在另一个实施方案中,负载为8%至10%。在另一个实施方案中,合成纳米载体群的平均负载为5%、6%、7%、8%、9%、10%、11%、12%、13%、14%或15%。在本文中提供的任一种方法、组合物或药盒中,免疫抑制剂(例如雷帕霉素)的负载可以是本文中提供的任一负载。
[0075]
混悬液中纳米载体的雷帕霉素负载通过将由受试品的hplc分析确定的纳米载体的雷帕霉素含量除以纳米载体质量来计算。总聚合物含量通过干燥纳米载体质量的重量产
量或通过根据药典方法确定纳米载体溶液总有机物含量来测量并针对pva含量校正。
[0076]“合成纳米载体的最大尺寸”意指沿合成纳米载体的任何轴测量的纳米载体的最大尺寸。“合成纳米载体的最小尺寸”意指沿合成纳米载体的任何轴测量的合成纳米载体的最小尺寸。例如,对于球形合成纳米载体,合成纳米载体的最大尺寸和最小尺寸将基本上相同,并且将是其直径的尺寸。类似地,对于立方形合成纳米载体,合成纳米载体的最小尺寸将是其高度、宽度或长度中的最小者,而合成纳米载体的最大尺寸将是其高度、宽度或长度中的最大者。在一个实施方案中,基于样品中合成纳米载体的总数,该样品中合成纳米载体中的至少75%、优选至少80%、更优选至少90%的最小尺寸等于或大于100nm。在一个实施方案中,基于样品中合成纳米载体的总数,该样品中合成纳米载体中的至少75%、优选至少80%、更优选至少90%的最大尺寸等于或小于5μm。优选地,基于样品中合成纳米载体的总数,该样品中合成纳米载体中的至少75%、优选至少80%、更优选至少90%的最小尺寸大于110nm、更优选大于120nm、更优选大于130nm并且更优选还大于150nm。合成纳米载体的最大尺寸与最小尺寸的纵横比(aspect ratio)可根据实施方案而变化。例如,合成纳米载体的最大尺寸与最小尺寸的纵横比可以是1∶1至1,000,000∶1、优选1∶1至100,000∶1、更优选1∶1至10,000∶1、更优选1∶1至1000∶1、还更优选1∶1至100∶1并且还更优选1∶1至10∶1而不等。
[0077]
优选地,基于样品中合成纳米载体的总数,该样品中合成纳米载体中的至少75%、优选至少80%、更优选至少90%的最大尺寸等于或小于3μm、更优选等于或小于2μm、更优选等于或小于1μm、更优选等于或小于800nm、更优选等于或小于600nm并且更优选还等于或小于500nm。在一些优选的实施方案中,基于样品中合成纳米载体的总数,该样品中合成纳米载体中的至少75%、优选至少80%、更优选至少90%的最小尺寸等于或大于100nm、更优选等于或大于120nm、更优选等于或大于130nm、更优选等于或大于140nm,并且更优选还等于或大于150nm。在一些实施方案中,可通过将合成纳米载体混悬在液体(通常为水性)介质中并使用动态光散射(dynamic light scattering,dls)(例如,使用brookhaven zetapals仪器)来获得合成纳米载体尺寸(例如,有效直径)的测量。例如,可将合成纳米载体的混悬液从水性缓冲液稀释到纯化水中,以实现约0.01至0.5mg/ml的最终合成纳米载体混悬液浓度。经稀释的混悬液可直接在合适的吸收池(cuvette)内制备或转移到合适的吸收池中用于dls分析。然后,可以将吸收池放置在dls中,使其平衡至受控温度,并随后基于介质黏度和样品的折射率的合适输入扫描足够的时间以获得稳定且可再现的分布。然后,报告有效直径或分布的平均值。确定高纵横比或非球形合成纳米载体的有效尺寸可需要增强技术(例如电子显微术)以获得更准确的测量。合成纳米载体的“尺寸”或“大小”或“直径”意指粒度分布的平均值,例如使用动态光散射获得的粒度分布的平均值。
[0078]
本文中使用的“获得”是指可通过其获取相应信息或材料的任何方法。因此,可通过实验方法获取相应信息。在一些实施方案中,相应材料可用多种实验或实验室方法来创建、设计(等)。相应信息或材料也可通过例如在报告或材料中给出或提供信息来获取。
[0079]“聚乙二醇化尿酸酶”是指任何与一个或更多个peg(聚(乙二醇)、聚(环氧乙烷)或聚(氧乙烯))分子(即,聚(乙二醇)、聚(环氧乙烷)或聚(氧乙烯)聚合物或其单元)连接的尿酸酶。优选地,在一些实施方案中,一个或更多个peg分子是聚(乙二醇)分子。术语“聚乙二醇化的”或“聚乙二醇化”分别是指缀合形式或与尿酸酶缀合的行为。这样的经修饰尿酸酶被称为聚乙二醇化尿酸酶。聚乙二醇化尿酸酶包括但不限于pegsiticase和pegloticase
[0080]“可药用赋形剂”或“可药用载体”意指与药理学活性物质一起使用以配制组合物的药理学惰性物质。可药用赋形剂包括本领域中已知的多种物质,包括但不限于糖类(例如葡萄糖、乳糖等)、防腐剂(例如抗微生物剂)、重构助剂、着色剂、盐水(例如磷酸缓冲盐水)和缓冲剂。本文中提供的任一种组合物可包含可药用的赋形剂或载体。
[0081]“雷帕霉素类似物”是指雷帕霉素和与雷帕霉素(西罗莫司(sirolimus))在结构上相关(类似物)并且优选地是疏水性的分子。雷帕霉素类似物的一些实例包括但不限于替西罗莫司(temsirolimus,cci-779)、地磷莫司(deforolimus)、依维莫司(everolimus,rad001)、地磷莫司(ridaforolimus,ap-23573)、佐他莫司(zotarolimus,abt-578)。雷帕霉素类似物的另一些实例可见于例如wo公开wo 1998/002441和美国专利no.8,455,510,这样的雷帕霉素类似物的公开内容通过引用整体并入本文。在本文中提供的任一种方法或组合物或药盒中,免疫抑制剂可以是雷帕霉素类似物。
[0082]“对象”意指动物,包括温血哺乳动物,例如人和灵长类;禽类;驯养的家养或农场动物,例如猫、狗、绵羊、山羊、牛、马和猪;实验动物,例如小鼠、大鼠和豚鼠;鱼;爬行动物;动物园动物和野生动物;等。在本文中提供的任一种方法、组合物和药盒中,对象是人。在本文中提供的任一种方法、组合物和药盒中,对象是本文中提供的任一对象,例如患有本文中提供的任一种病症(例如痛风或其他与痛风相关的病症)的对象。
[0083]“合成纳米载体”意指在自然界中未发现并且具有至少一个小于或等于5微米大小的尺寸的离散物体。合成纳米载体可以是多种不同的形状,包括但不限于球形(spheroidal)、立方形(cuboidal)、棱锥形(pyramidal)、长方形(oblong)、圆柱形(cylindrical)、环形(toroidal)等。合成纳米载体包含一个或更多个表面。
[0084]
合成纳米载体可以是但不限于以下一种或多种:基于脂质的纳米粒(在本文中也称为脂质纳米粒,即构成其结构的大部分物质是脂质的纳米粒)、聚合物纳米粒、金属纳米粒、基于表面活性剂的乳液、树枝状聚合物、巴基球、纳米线、病毒样颗粒(即,主要由病毒结构蛋白构成但不具有感染性或感染性低的颗粒)、基于肽或蛋白质的颗粒(在本文中也称为蛋白质颗粒,即构成其结构的大部分物质是肽或蛋白质的颗粒)(例如白蛋白纳米粒)和/或使用纳米材料的组合产生的纳米粒(例如脂质-聚合物纳米粒)。合成纳米载体可以是多种不同的形状,包括但不限于球形、立方形、棱锥形、长方形、圆柱形、环形等。合成纳米载体的一些实例包括(1)gref等的美国专利5,543,158中公开的生物可降解纳米粒,(2)saltzman等的公开美国专利申请20060002852的聚合物纳米粒,(3)desimone等的公开美国专利申请20090028910的光刻法构建的纳米粒,(4)vonandrian等的wo 2009/051837的公开内容,(5)penades等的公开美国专利申请2008/0145441中公开的纳米粒,(6)p paolicelli等,“surface-modified plga-based nanoparticles that can efficiently associate and deliver virus-like particles”nanomedicine.5(6):843-853(2010)中公开的纳米沉淀纳米粒,以及(7)look等,“nanogel-based delivery of mycophenolic acid ameliorates systemic lupus erythematosus in mice”j.clinical investigation 123(4):1741-1749(2013)的那些。
[0085]
合成纳米载体可具有等于或小于约100nm、优选等于或小于100nm的最小尺寸,不包含具有激活补体的羟基的表面,或者作为替代地包含基本上由不是激活补体的羟基的部
分组成的表面。在一个实施方案中,最小尺寸等于或小于约100nm、优选等于或小于100nm的合成纳米载体不包含显著激活补体的表面,或者作为替代地包含基本上由不显著激活补体的部分组成的表面。在一个更优选的实施方案中,最小尺寸等于或小于约100nm、优选等于或小于100nm的根据本发明的合成纳米载体不包含激活补体的表面或者作为替代地包含基本上由不激活补体的部分组成的表面。在一些实施方案中,合成纳米载体不包括病毒样颗粒。在一些实施方案中,合成纳米载体的纵横比可以是大于1∶1、1∶1.2、1∶1.5、1∶2、1∶3、1∶5、1∶7或大于1∶10。
[0086]“治疗”是指施用一种或更多种治疗剂,期望对象可由于该施用而具有所得益处。治疗还可导致预防本文中提供的病症,并且因此治疗包括预防性治疗。当预防性使用时,对象是其中临床医生预期存在发生如本文中提供的病症或其他不期望应答的可能性的对象。在一些实施方案中,预期会发生痛风发作的对象是其中临床医生认为可能将发生痛风发作的对象。治疗可以是直接或间接的,例如通过诱导或指导另一位对象(包括另一个临床医生或对象自身)来治疗该对象。
[0087]“重量%”或“按重量计%”是指一个重量与另一个重量的比值乘以100。例如,重量%可以是一种组分与另一种组分的重量比乘以100,或者一种组分的重量与多于一种组分的总重量的比值乘以100。通常来说,重量%作为合成纳米载体群的平均值或者组合物或混悬液中合成纳米载体的平均值来测量。
[0088]
c.方法及相关组合物
[0089]
尿酸酶和聚乙二醇化尿酸酶
[0090]
本文中所述的方法和组合物以及药盒涉及包含尿酸酶的组合物。通常认为尿酸酶催化尿酸转化成可溶且可被排泄的尿囊素。除人和某些灵长类之外,尿酸酶是所有哺乳动物的内源性酶。编码尿酸酶的基因可从本领域中已知的任何来源(包括哺乳动物和微生物来源)以及通过重组和合成技术获得。对于本领域普通技术人员明显的是,可从来源获得基因并使用标准方法在另一种生物中重组(或转基因)表达和产生。参见erlich,h a,(编辑)(1989)pcr technology.principles and applications for dna amplification.new york:stockton press;sambrook,j,等,(1989)molecular cloning.a laboratory manual,第2版.cold spring harbor,n.y.:cold spring harbor laboratory press。例如,美国专利no.5,700,674描述了在大肠杆菌(e.coli)细胞中重组产生尿酸酶。在一些实施方案中,该酶通过在大肠杆菌中发酵而产生。
[0091]
在一些实施方案中,编码尿酸酶的基因或其部分获自哺乳动物,例如猪、牛、绵羊、山羊、狒狒、猴、小鼠、兔或驯养动物。在一些实施方案中,编码尿酸酶的基因或其部分获自微生物,例如细菌或真菌(包括酵母)。在一些实施方案中,编码尿酸酶的基因获自细菌来源,例如属于链霉菌属(streptomyces spp.)、芽孢杆菌属(bacillus spp.)的细菌,或大肠杆菌。在一些实施方案中,编码尿酸酶的基因获自真菌(包括酵母)来源,例如假丝酵母属(candida spp.)(例如,产朊假丝酵母(candida utilis))、节杆菌属(anthrobacter spp.)(例如,球形节杆菌(anthrobacter globiformis))、酵母属(saccharomyces spp.)、裂殖酵母属(schizosaccaromyces spp.)、裸孢壳属(emericella spp.)、曲霉属(aspergillus spp.)(例如,黄曲霉(aspergillus flavus))和脉孢菌属(neurospora spp.)。在一些实施方案中,尿酸酶来源于产朊假丝酵母。在一些实施方案中,尿酸酶是pegsiticase的(3sbio,
如美国专利no.6,913,915中所述,并且这样的尿酸酶及其描述通过引用并入本文)。在一些实施方案中,尿酸酶来源于黄曲霉。在一些实施方案中,尿酸酶是拉布立酶(rasburicase)(来自sanofi genzyme)。
[0092]
在一些实施方案中,尿酸酶是嵌合尿酸酶,其中编码尿酸酶的基因的部分获自不同来源。例如,编码嵌合尿酸酶的基因的一部分可从一种生物获得,并且编码嵌合尿酸酶的基因的一个或更多个其他部分可从其他生物获得。在一些实施方案中,编码嵌合尿酸酶的基因的一部分获自猪,并且编码嵌合尿酸酶的基因的另一部分获自狒狒。在一些实施方案中,嵌合尿酸酶是pegloticase/的嵌合尿酸酶。
[0093]
变体尿酸酶也在本发明的范围内,其可包含一个或更多个突变(替换、插入、缺失)。可在编码尿酸酶蛋白的核苷酸序列中进行突变,其可以或可以不导致氨基酸突变。通常来说,可进行突变例如以增强蛋白质的产生、蛋白质或编码蛋白质之mrna的周转/半衰期,调节(增强或降低)尿酸酶的酶活性。
[0094]
在另一些实施方案中,编码尿酸酶的基因获自植物或无脊椎动物来源,例如果蝇(drosophila)或秀丽隐杆线虫(c.elegans)。
[0095]
本文中所述的任何尿酸酶蛋白可以是聚乙二醇化的。尿酸酶可使用本领域中已知的方法经由生物相容性连接基团与peg共价键合,如例如park等,anticancer res.,1:373-376(1981);以及zaplipsky和lee,polyethylene glycol chemistry:biotechnical and biomedical applications,j.m.harris,ed.,plenum press,new york,chapter 21(1992)所描述。用于将peg共价连接至尿酸酶的连接基团可以是任何生物相容性连接基团,意味着连接基团无毒并且可在体外或体内使用而不会引起不利影响。或者,peg可直接与尿酸酶缀合,例如直接与尿酸酶的赖氨酸残基缀合。
[0096]
尿酸酶可在尿酸酶蛋白的许多不同氨基酸残基处聚乙二醇化。peg分子和/或与peg缀合的残基的数目可影响尿酸酶的活性。在一些实施方案中,聚乙二醇化尿酸酶包含至少一个peg分子。在一些实施方案中,聚乙二醇化尿酸酶平均每个尿酸酶蛋白包含至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、45、50个或更多个peg分子。在一些实施方案中,聚乙二醇化尿酸酶每个尿酸酶蛋白包含约20至25个peg分子。
[0097]
平均而言,peg的分子量为5kda至100kda。所使用的peg的分子量(大小)以及用于使尿酸酶聚乙二醇化的peg分子的数目二者都可以变化。在一些实施方案中,peg的平均分子量为5kda至100kda、5kda至75kda、5kda至50kda、5kda至30kda、5kda至20kda、5kda至10kda、10kda至75kda、10kda至50kda、10kda至30kda、5kda至30kda、15kda至50kda、15kda至30kda、15kda至25kda、20kda至75kda、30kda至80kda、30kda至70kda、或30kda至50kda。在一些实施方案中,peg的分子量为约5kda、6kda、7kda、8kda、9kda、10kda、11kda、12kda、13kda、14kda、15kda、16kda、17kda、18kda、19kda、20kda、21kda、22kda、23kda、24kda、25kda、30kda、35kda、40kda、45kda、50kda、55kda、60kda、65kda、70kda、75kda、80kda、85kda、90kda、95kda、或100kda。通常来说,peg基于peg的分子量来指代。例如,peg-20是指分子量为20kda的peg分子,且peg-5是指分子量为5kda的peg分子。在一些实施方案中,尿酸酶用分子量为20kda的peg分子(peg-20)聚乙二醇化。
[0098]
聚乙二醇化尿酸酶包括但不限于pegsiticase(可从3sbio获得,并且如美国专利
no.6,913,915中所述,并且这样的聚乙二醇化尿酸酶及其描述通过引用并入本文)和pegloticase/(horizon pharmaceuticals)。
[0099]
优选地,在本文中提供的任一种方法或组合物或药盒的一些实施方案中,聚乙二醇化尿酸酶是pegsiticase,一种与多个20kda分子量聚(乙二醇)分子缀合的重组尿酸酶。pegsiticase的尿酸酶组分可从酵母产朊假丝酵母克隆并在大肠杆菌中表达以产生。
[0100]
尿酸酶(包括聚乙二醇化尿酸酶)的尿酸催化活性可使用本领域中已知的方法或本文中另外提供的方法评估。
[0101]
合成纳米载体
[0102]
可使用多种合成纳米载体。在一些实施方案中,合成纳米载体是球体或球状体。在一些实施方案中,合成纳米载体是平的或片状的。在一些实施方案中,合成纳米载体是立方体或立方体的。在一些实施方案中,合成纳米载体是卵形体或椭圆形体。在一些实施方案中,合成纳米载体是圆柱体、锥体或棱锥形体。
[0103]
在一些实施方案中,期望使用在尺寸或形状方面相对均匀的合成纳米载体群,使得每个合成纳米载体具有类似的特性。例如,基于合成纳米载体的总数,至少80%、至少90%或至少95%的合成纳米载体可具有落在合成纳米载体的平均直径或平均尺寸的5%、10%或20%内的最小尺寸或最大尺寸。
[0104]
合成纳米载体可以是实心的或中空的,并且可包含一个或更多个层。在一些实施方案中,每个层相对于另外的层具有独特的组成和独特的特性。仅举一个实例,合成纳米载体可具有核/壳结构,其中核是一个层(例如聚合物核),且壳是第二层(例如脂质双层或单层)。合成纳米载体可包含多个不同的层。
[0105]
在一些优选的实施方案中,合成纳米载体包含本文中提供的聚合物。聚合物可以是天然或非天然(合成)聚合物。聚合物可以是均聚物或包含两种或更多种单体的共聚物。就序列而言,共聚物可以是随机的、嵌段的,或包含随机和嵌段序列的组合。通常来说,根据本发明的聚合物是有机聚合物。
[0106]
本文中提供的合成纳米载体优选地包含疏水性聚酯。这样的聚酯可包括含有乳酸和乙醇酸单元的共聚物,例如聚(乳酸-乙醇酸)共聚物和聚(丙交酯-乙交酯)共聚物,在本文中统称为“plga”;以及含有乙醇酸单元的均聚物,在本文中称为“pga”;以及含有乳酸单元的均聚物,例如聚-l-乳酸、聚-d-乳酸、聚-d,l-乳酸、聚-l-丙交酯、聚-d-丙交酯和聚-d,l-丙交酯,在本文中统称为“pla”。在一些实施方案中,示例性聚酯包括例如多羟基酸;peg共聚物,以及丙交酯与乙交酯的共聚物(例如pla-peg共聚物、pga-peg共聚物、plga-peg共聚物、及其衍生物)。在一些实施方案中,聚酯包括例如聚(己内酯)、聚(己内酯)-peg共聚物、聚(l-丙交酯-l-赖氨酸)共聚物、聚(丝氨酸酯)、聚(4-羟基-l-脯氨酸酯)、聚[α-(4-氨基丁基)-l-乙醇酸]、及其衍生物。
[0107]
在一些实施方案中,聚酯可以是plga。plga是乳酸和乙醇酸的生物相容性且生物可降解的共聚物,并且不同形式的plga的特征在于乳酸∶乙醇酸的比例。乳酸可以是l-乳酸、d-乳酸或d,l-乳酸。plga的降解速率可通过改变乳酸∶乙醇酸比例来调节。在一些实施方案中,根据本发明使用的plga的特征在于乳酸∶乙醇酸比例为约85∶15、约75∶25、约60∶40、约50∶50、约40∶60、约25∶75、或约15∶85。
[0108]
合成纳米载体可包含一种或更多种也是疏水性的非聚酯聚合物或其单元,和/或
非疏水性的聚合物或其单元。在一些实施方案中,优选地整体上合成纳米载体包含疏水性聚酯,并且在一些实施方案中,其本身是疏水性的。
[0109]
合成纳米载体可包含一种或更多种为非甲氧基封端的普朗尼克(pluronic)聚合物的聚合物,或其单元。“非甲氧基封端的聚合物”意指至少一个末端以甲氧基以外的部分结束的聚合物。在一些实施方案中,聚合物具有至少两个以甲氧基以外的部分结束的末端。在另一些实施方案中,聚合物没有以甲氧基结束的末端。“非甲氧基封端的普朗尼克聚合物”意指除两个末端都具有甲氧基的直链普朗尼克聚合物以外的聚合物。
[0110]
在一些实施方案中,合成纳米载体可包含聚羟基链烷酸酯、聚酰胺、聚醚、聚烯烃、聚丙烯酸酯、聚碳酸酯、聚苯乙烯、硅酮、含氟聚合物、或其单元。可包含在本文中提供的合成纳米载体中的聚合物的另一些实例包括聚碳酸酯、聚酰胺或聚醚、或其单元。在另一些实施方案中,合成纳米载体的聚合物可包含聚(乙二醇)(peg)、聚丙二醇、或其单元。
[0111]
在一些实施方案中,优选地合成纳米载体包含生物可降解的聚合物。因此,在这样的一些实施方案中,合成纳米载体的聚合物可包含聚醚,例如聚(乙二醇)或聚丙二醇或其单元。另外,聚合物可包含聚醚和生物可降解聚合物的嵌段共聚物,使得聚合物是生物可降解的。在另一些实施方案中,聚合物不仅包含聚醚或其单元,例如聚(乙二醇)或聚丙二醇或其单元。
[0112]
在一些实施方案中,根据本发明的聚合物包括根据21 c.f.r.
§
177.2600已被美国食品和药品管理局(fda)批准用于人的聚合物。
[0113]
适用于合成纳米载体的聚合物的另一些实例包括但不限于聚乙烯、聚碳酸酯(例如聚(1,3-二烷-2酮))、聚酸酐(例如聚(癸二酸酐))、聚丙基延胡索酸酯(polypropylfumerate)、聚酰胺(例如聚己内酰胺)、聚缩醛、聚醚、聚酯(例如,聚丙交酯、聚乙交酯、聚(丙交酯-乙交酯)共聚物、聚己内酯、聚羟基酸(例如聚(β-羟基链烷酸酯)))、聚(原酸酯)、聚氰基丙烯酸酯、聚乙烯醇、聚氨酯、聚磷腈、聚丙烯酸酯、聚甲基丙烯酸酯、聚脲、聚苯乙烯和聚胺、聚赖氨酸、聚赖氨酸-peg共聚物和聚(乙烯亚胺)、聚(乙烯亚胺)-peg共聚物。
[0114]
可包含在合成纳米载体中的聚合物的另一些实例包括丙烯酸类聚合物,例如丙烯酸和甲基丙烯酸共聚物、甲基丙烯酸甲酯共聚物、甲基丙烯酸乙氧基乙酯、甲基丙烯酸氰乙酯、甲基丙烯酸氨基烷基酯共聚物、聚(丙烯酸)、聚(甲基丙烯酸)、甲基丙烯酸烷基酰胺共聚物、聚(甲基丙烯酸甲酯)、聚(甲基丙烯酸酐)、甲基丙烯酸甲酯、聚甲基丙烯酸酯、聚(甲基丙烯酸甲酯)共聚物、聚丙烯酰胺、甲基丙烯酸氨基烷基酯共聚物、甲基丙烯酸缩水甘油酯共聚物、聚氰基丙烯酸酯,以及包含前述一种或更多种聚合物的组合。
[0115]
在一些实施方案中,合成纳米载体的聚合物缔合以形成聚合物基质。广泛多种聚合物以及用于由此形成聚合物基质的方法常规是已知的。在一些实施方案中,包含的疏水性聚酯的合成纳米载体在所述合成纳米载体中具有疏水性环境。
[0116]
在一些实施方案中,聚合物可用一个或更多个部分和/或官能团进行修饰。根据本发明可使用多种部分或官能团。在一些实施方案中,聚合物可用聚乙二醇(peg)、用碳水化合物和/或用来自于多糖的非环状聚缩醛进行修饰(papisov,2001,acs symposium series,786:301)。某些实施方案可使用gref等的美国专利no.5543158或von andrian等的wo公开wo 2009/051837的一般教导来进行。
[0117]
在一些实施方案中,聚合物可用脂质或脂肪酸基团进行修饰。在一些实施方案中,脂肪酸基团可以是丁酸、己酸、辛酸、癸酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、花生酸、山萮酸或木蜡酸中的一种或更多种。在一些实施方案中,脂肪酸基团可以是棕榈油酸、油酸、异油酸、亚油酸、α-亚油酸、γ-亚油酸、花生四烯酸、鳕油酸、花生四烯酸、二十碳五烯酸、二十二碳六烯酸或芥酸中的一种或更多种。
[0118]
在一些实施方案中,聚合物可以是直链或支链聚合物。在一些实施方案中,聚合物可以是树枝状聚合物。在一些实施方案中,聚合物可基本上彼此交联。在一些实施方案中,聚合物可基本上没有交联。在一些实施方案中,聚合物可无需进行交联步骤即可根据本发明使用。还应理解,合成纳米载体可包含前述任一种和其他聚合物的嵌段共聚物、接枝共聚物、共混物、混合物和/或加合物。本领域技术人员将认识到,本文中列出的聚合物代表可根据本发明使用的聚合物的示例性而非全面性的列表,只要其满足期望的标准即可。
[0119]
这些和其他聚合物的特性及其制备方法是本领域中公知的(参见例如美国专利6,123,727;5,804,178;5,770,417;5,736,372;5,716,404;6,095,148;5,837,752;5,902,599;5,696,175;5,514,378;5,512,600;5,399,665;5,019,379;5,010,167;4,806,621;4,638,045;以及4,946,929;wang等,2001,j.am.chem.soc.,123:9480;lim等,2001,j.am.chem.soc.,123:2460;langer,2000,acc.chem.res.,33:94;langer,1999,j.control.release,62:7;以及uhrich等,1999,chem.rev.,99:3181)。更一般地,用于合成某些合适聚合物的多种方法描述于concise encyclopedia of polymer science and polymeric amines and ammonium salts,由goethals编辑,pergamon press,1980;principles of polymerization,odian,john wiley&sons,第四版,2004;contemporary polymer chemistry,allcock等,prentice-hall,1981;deming等,1997,nature,390:386;以及美国专利6,506,577、6,632,922、6,686,446、以及6,818,732中。
[0120]
可使用本领域中已知的广泛多种方法制备合成纳米载体。例如,合成纳米载体可通过例如以下的方法形成:纳米沉淀、使用流体通道的流聚焦、喷雾干燥、单和双乳液溶剂蒸发、溶剂萃取、相分离、研磨(包括低温研磨)、超临界流体(例如超临界二氧化碳)处理、微乳液操作、微制造、纳米制造、牺牲层、简单和复杂的凝聚、以及本领域普通技术人员公知的其他方法。作为替代或补充,已经描述了用于单分散半导体、传导性、磁性、有机和其他纳米材料的水性和有机溶剂合成(pellegrino等,2005,small,1:48;murray等,2000,ann.rev.mat.sci.,30:545;和trindade等,2001,chem.mat.,13:3843)。在文献中已经描述了另外的方法(参见例如doubrow,编辑,“microcapsules and nanoparticles in medicine and pharmacy,”crc press,boca raton,1992;mathiowitz等,1987,j.control.release,5:13;mathiowitz等,1987,reactive polymers,6:275;和mathiowitz等,1988,j.appl.polymer sci.,35:755;美国专利5578325和6007845;p.paolicelli等,“surface-modified plga-based nanoparticles that can efficiently associate and deliver virus-like particles”nanomedicine.5(6):843-853(2010))。
[0121]
可使用多种方法如所期望地将免疫抑制剂包封到合成纳米载体中,所述方法包括但不限于c.astete等,“synthesis and characterization of plga nanoparticles”j.biomater.sci.polymer edn,vol.17,no.3,pp.247-289(2006);k.avgoustakis“pegylaed poly(lactide)and poly(lactide-co-glycolide)nanoparticles:
preparation,properties and possible applications in drug delivery”current drug delivery 1:321-333(2004);c.reis等,“nanoencapsulation i.methods for preparation of drug-loaded polymeric nanoparticles”nanomedicine 2:8-21(2006);p.paolicelli等,“surface-modified plga-based nanoparticles that can efficiently associate and deliver virus-like particles”nanomedicine.5(6):843-853(2010)。可使用适合于将物质包封到合成纳米载体中的其他方法,包括但不限于2003年10月14日授权的unger的美国专利6,632,671中公开的方法。
[0122]
在某些实施方案中,合成纳米载体通过纳米沉淀法或喷雾干燥制备。可改变用于制备合成纳米载体的条件以产生具有所期望尺寸或特性(例如,疏水性、亲水性、外部形态、“黏性”、形状等)的颗粒。制备合成纳米载体的方法和使用的条件(例如,溶剂、温度、浓度、空气流量等)可取决于合成纳米载体中包含的物质和/或载体基质的组成。
[0123]
如果通过任何上述方法制备的合成纳米载体具有在所期望范围之外的尺寸范围,则可例如使用筛子对这样的合成纳米载体的尺寸进行调整。
[0124]
优选地,在本文中提供的任一种方法或组合物或药盒的一些实施方案中,合成纳米载体是包含由pla和pla-peg构成的合成纳米载体的那些。pla是更广泛的聚(乳酸-乙醇酸)共聚物或plga家族的生物可降解聚合物中的一部分,所述生物可降解聚合物具有超过30年的商业应用并且是许多批准产品中的配方组分。聚乙二醇或peg在临床试验中已被广泛研究,并且也是许多经批准生物制品中的配方组分。
[0125]
作为一些实例,包含雷帕霉素的合成纳米载体是通过以下方法之一产生或可由其获得的那些:
[0126]
1)特性黏度为0.41dl/g的pla购自evonik industries(rellinghauser straβe 1-11 45128 essen,germany),产品代码为resomer select 100 dl 4a。约5,000da且总特性黏度为0.50dl/g的具有甲基醚封端peg嵌段的pla-peg-ome嵌段共聚物购自evonik industries(rellinghauser straβe 1-11 45128 essen,germany),产品代码为resomer select 100 dl mpeg 5000(15wt%peg)。雷帕霉素购自concord biotech limited(1482-1486 trasad road,dholka 382225,ahmedabad india),产品代码为sirolimus。聚乙烯醇4-88,usp(85%至89%水解,黏度为3.4至4.6mpa
·
s)购自milliporesigma(emd millipore,290 concord road billerica,massachusetts 01821),产品代码1.41350。dulbecco磷酸缓冲盐水1x(dpbs)购自lonza(muenchensteinerstrasse 38,ch-4002 basel,switzerland),产品代码17-512q。脱水山梨醇单棕榈酸酯购自croda international(300-a columbus circle,edison,nj 08837),产品代码span 40。溶液如下制备。通过将pla以150mg/ml和pla-peg-ome以50mg/ml溶解在二氯甲烷中来制备溶液1。通过将雷帕霉素以100mg/ml溶解在二氯甲烷中来制备溶液2。通过将span 40以50mg/ml溶解在二氯甲烷中来制备溶液3。通过将pva以75mg/ml溶解在ph 8的100mm磷酸盐缓冲液中来制备溶液4。通过在厚壁玻璃压力管中添加溶液1(0.50ml)、溶液2(0.12ml)、溶液3(0.10ml)和二氯甲烷(0.28ml)来制备o/w乳液。然后,通过重复吹打(pipetting)将合并的有机相溶液混合。向该混合物中添加溶液4(3ml)。然后,将压力管涡旋混合10秒。接下来,使用具有1/8”锥形尖端的branson digital sonifier 250和浸入冰水浴中的压力管通过以30%振幅声处理1分钟来均化粗制乳液。然后,将乳液添加至含有dpbs(30ml)的50ml烧杯中。将其在室
温下搅拌2小时以使二氯甲烷蒸发并形成纳米载体。通过将纳米载体混悬液转移至离心管并在4℃下以75,600
×
g离心50分钟,除去上清液,并将沉淀物重悬于含有0.25%w/v pva的dpbs中来洗涤一部分纳米载体。重复洗涤操作,并将沉淀物重悬于含有0.25%w/v pva的dpbs中以得到基于聚合物的标称浓度为10mg/ml的纳米载体混悬液。然后,使用来自milliporesigma的0.22μm pes膜注射器式过滤器(emd millipore,290 concord rd.billerica ma,产品代码slgp033rb)过滤纳米载体混悬液。将经过滤的纳米载体混悬液储存在-20℃。
[0127]
2)特性黏度为0.41dl/g的pla购自evonik industries(rellinghauser straβe 1-11 45128essen,germany),产品代码为resomer select 100 dl 4a。约5,000da且总特性黏度为0.50dl/g的具有甲基醚封端peg嵌段的pla-peg-ome嵌段共聚物购自evonik industries(rellinghauser straβe 1-11 45128 essen,germany),产品代码为resomer select 100 dl mpeg 5000(15wt%peg)。雷帕霉素购自concord biotech limited(1482-1486 trasad road,dholka 382225,ahmedabad india),产品代码为sirolimus。脱水山梨醇单棕榈酸酯购自sigma-aldrich(3050 spruce st.,st.louis,mo 63103),产品代码388920。聚乙烯醇(pva)4-88,usp(85%至89%水解,黏度为3.4至4.6mpa
·
s)购自milliporesigma(emd millipore,290 concord road billerica,massachusetts 01821),产品代码1.41350。dulbecco磷酸缓冲盐水1x(dpbs)购自lonza(muenchensteinerstrasse 38,ch-4002 basel,switzerland),产品代码17-512q。溶液如下制备:溶液1:通过将pla以37.5mg/ml、pla-peg-ome以12.5mg/ml、雷帕霉素以8mg/ml和脱水山梨醇单棕榈酸酯以2.5溶解在二氯甲烷中制备聚合物、雷帕霉素和脱水山梨醇单棕榈酸酯的混合物。溶液2:在100mm ph 8磷酸盐缓冲液中以50mg/ml制备聚乙烯醇。通过将溶液1(1.0ml)和溶液2(3ml)在小玻璃压力管中合并制备o/w乳液,并涡旋混合10秒。然后,在压力管浸入冰水浴中的情况下,使用具有1/8”锥形尖端的branson digital sonifier 250通过以30%振幅声处理1分钟来均化制剂。然后,将乳液添加至含有dpbs(15ml)的50ml烧杯中,并用铝箔覆盖。使用与上述相同的材料和方法制备第二o/w乳液,并随后使用新鲜的dpbs等分试样(15ml)将其添加至同一烧杯中。然后,将合并的乳液保持未覆盖并在室温下搅拌2小时以使二氯甲烷蒸发并形成纳米载体。通过将纳米载体混悬液转移至离心管并在75,600
×
g和4℃下离心50分钟,除去上清液,并将沉淀物重悬在含有0.25%w/v pva的dpbs中来洗涤一部分纳米载体。重复洗涤操作,并随后将沉淀物重悬在含有0.25%w/v pva的dpbs中以获得基于聚合物的标称浓度为10mg/ml的纳米载体混悬液。然后,使用来自milliporesigma的0.22μm pes膜注射器式过滤器(emd millipore,290 concord rd.billerica ma,产品代码slgp033rb)过滤纳米载体混悬液。然后,将经过滤的纳米载体混悬液储存在-20℃。
[0128]
免疫抑制剂
[0129]
本文中提供的任何免疫抑制剂均可用于所提供的任一种方法或组合物,并且在一些实施方案中可与合成纳米载体连接。免疫抑制剂包括但不限于mtor抑制剂。mtor抑制剂的一些实例包括雷帕霉素和雷帕霉素类似物(例如,ccl-779、rad001、ap23573、c20-甲代烯丙基雷帕霉素(c20-marap)、c16-(s)-丁基磺酰氨基雷帕霉素(c16-bsrap)、c16-(s)-3-甲基吲哚雷帕霉素(c16-irap)(bayle等chemistry&biology 2006,13:99-107))、azd8055、
bez235(nvp-bez235)、大黄根酸(大黄酚)、地磷莫司(mk-8669)、依维莫司(rad0001)、ku-0063794、pi-103、pp242、替西罗莫司、以及wye-354(可从selleck,houston,tx,usa获得)。
[0130]
优选地,在本文中提供的任一种方法或组合物或药盒的一些实施方案中,免疫抑制剂是雷帕霉素。在这样的一些实施方案中,雷帕霉素优选地包封在合成纳米载体中。雷帕霉素是雷帕鸣(rapamune)的活性成分,雷帕鸣是先前在人中广泛使用并且是目前已获fda批准用于预防13岁或年龄更大的肾移植患者中的器官排斥的免疫抑制剂。
[0131]
当与合成纳米载体偶联时,基于整个合成纳米载体中物质的总干配方重量的与合成纳米载体偶联的免疫抑制剂的量(重量/重量)如本文中其他地方所述。优选地,在本文中提供的任一种方法或组合物或药盒的一些实施方案中,免疫抑制剂(例如雷帕霉素或雷帕霉素类似物)的负载为按重量计7%至12%或8%至12%。
[0132]
给药
[0133]
除非本文中另有说明,否则本文中提供的包含聚乙二醇化尿酸酶的组合物的剂量量(按重量计)以及每瓶的浓度分别是指尿酸酶蛋白的量或浓度,不包括组合物中与其缀合的peg分子或任何添加的赋形剂。在这些情况下,由于聚乙二醇化蛋白质形式的较高重量,聚乙二醇化尿酸酶的实际量将高于所述剂量。在一个实例中,0.4mg/kg包含聚乙二醇化尿酸酶的组合物的剂量是指0.4mg/kg尿酸酶蛋白的剂量。
[0134]
因此,可根据以下方程基于本文中提供的剂量和对象的体重计算用于施用于对象的包含聚乙二醇化尿酸酶的组合物的剂量:
[0135]
(以mg/kg计的剂量(这是尿酸酶蛋白的))
×
(对象体重(kg))/(瓶中每ml的浓度(同样这是尿酸酶蛋白的))=待施用的体积
[0136]
作为一个实例,聚乙二醇化尿酸酶可在无菌水中重构至浓度为6mg/ml。因此,对于该实例,对于施用于体重为90.7kg(200lb)的对象的0.4mg/kg剂量,应向对象施用6.048ml重构的聚乙二醇化尿酸酶组合物:
[0137]
(0.4mg/kg)
×
(90.7kg)/(6mg/ml)=6.048ml
[0138]
在一些实施方案中,将合适体积的包含聚乙二醇化尿酸酶的组合物在可药用赋形剂(例如,无菌盐水溶液)中稀释,用于例如在期望的一段时间(例如,60分钟)内向对象静脉内输注。
[0139]
类似地,除非本文另有说明,否则本文中提供的包含含有免疫抑制剂之合成纳米载体的组合物的剂量量(按重量计)以及每瓶的浓度分别是指免疫抑制剂的量或浓度,并且不包括组合物中的合成纳米载体物质或任何添加的赋形剂或其他组分。由于组合物中合成纳米载体物质和任何添加的赋形剂或其他组分的添加的重量,包含免疫抑制剂的合成纳米载体组合物的实际量将高于所描述的剂量。在一个实例中,0.08mg/kg包含含有免疫抑制剂之合成纳米载体的组合物的剂量是指0.08mg/kg免疫抑制剂的剂量。
[0140]
因此,可根据以下方程基于对象的体重计算用于施用于对象的包含含有免疫抑制剂之合成纳米载体的组合物的剂量:
[0141]
(以mg/kg计的剂量(这是免疫抑制剂的))
×
(对象体重(kg))/(瓶中每ml的浓度(同样,这是免疫抑制剂的)=待施用的体积
[0142]
作为一个实例,包含含有免疫抑制剂之合成纳米载体的组合物的浓度为2mg/ml(这也是免疫抑制剂的浓度)。因此,对于该实例,对于向体重为90.7kg(200lb)的对象施用
0.08mg/kg的剂量,应向对象施用3.6ml组合物:
[0143]
(0.08mg/kg)
×
(90.7kg)/(2mg/ml)=3.6ml
[0144]
包含免疫抑制剂的合成纳米载体中免疫抑制剂(例如,雷帕霉素)的负载可如下确定:使用与免疫抑制剂和合成纳米载体(例如,合成纳米载体包含的聚合物)二者均相容的液液提取从合成纳米载体中提取免疫抑制剂并通过具有对分析物具有特异性的uv检测的反相液相色谱分析提取物。可从在与色谱和纳米粒提取操作相容的条件下制备并伴随地进行分析的合格参考标准品的校准标准曲线准确且精确地计算免疫抑制剂负载(合成纳米载体的含量)。
[0145]
包含含有免疫抑制剂之合成纳米载体的组合物的剂量量(按重量计)可根据以下方程基于免疫抑制剂剂量的量(按重量计)计算:
[0146]
(1/免疫抑制剂的负载)
×
(基于免疫抑制剂的量给予的剂量)=作为包含免疫抑制剂的合成纳米载体的量给予的免疫抑制剂剂量
[0147]
作为一个实例,合成纳米载体中免疫抑制剂的负载可以是约10%,且如果期望0.08mg/kg剂量的免疫抑制剂的话,则作为包含免疫抑制剂的合成纳米载体的量给予的剂量是8mg/kg。
[0148]
存在于聚乙二醇化尿酸酶中的尿酸酶蛋白的量可使用本领域中已知的方法(例如比色法、uv吸光度或氨基酸分析)来确定。比色方法依赖于利用典型的基于染料之反应的可商购获得的标准化试剂盒,例如针对bradford或二辛可宁酸(bicinchoninic acid,bca)测定所述的那些。从合格的蛋白质参考标准品的校准标准曲线准确且精确地计算尿酸酶蛋白量,所述标准品优选地从药典来源购买并使用相同的分光光度计伴随地进行分析。可在同一测定中进行具有类似或不同化学特性的已知蛋白质的单点或多点校准以确保在所选uv吸光度下读出的一致性。还可分析从药物产品的酸水解获得的氨基酸混合物,并且其通常提供精确且准确的定量。通过具有uv或荧光检测的hplc并使用伯胺和仲胺的色谱前或色谱后衍生化来分析氨基酸混合物。在同一测定中分析可商购获得的常见氨基酸混合物以构建单独的氨基酸校准曲线,针对该曲线对每种氨基酸进行定量。在一些实施方案中,通过测量酶活性来补充尿酸酶蛋白量的确定,其可通过测量由在595nm处的uv吸光度监测的过量尿酸的降低来进行。作为替代或补充,尿酸酶活性可使用可商购获得的试剂盒来确定,其可包括例如标记酶促反应产物并针对通过分析已知量的酶建立的校准曲线来测量尿酸酶的响应。
[0149]
与紧邻的上式类似,包含聚乙二醇化尿酸酶的组合物的剂量量(按重量计)可根据以下方程基于尿酸酶剂量的量(按重量计)计算:
[0150]
(1/(聚乙二醇化尿酸酶中尿酸酶的重量/聚乙二醇化尿酸酶的重量))
×
(基于尿酸酶的量给予的剂量)=作为聚乙二醇化尿酸酶的量给予的聚乙二醇化尿酸酶的剂量
[0151]
应当理解,本文中提供的量可以是基于组合物中相应分子的群体的平均量。
[0152]
本文中提供的包含尿酸酶(例如pegsiticase)的组合物的尿酸酶的示例性剂量可以是0.10mg/kg、0.11mg/kg、0.12mg/kg、0.13mg/kg、0.14mg/kg、0.15mg/kg、0.16mg/kg、0.17mg/kg、0.18mg/kg、0.19mg/kg、0.20mg/kg、0.21mg/kg、0.22mg/kg、0.23mg/kg、0.24mg/kg、0.25mg/kg、0.26mg/kg、0.27mg/kg、0.28mg/kg、0.29mg/kg、0.30mg/kg、0.31mg/kg、0.32mg/kg、0.34mg/kg,0.35mg/kg、0.36mg/kg、0.37mg/kg、0.38mg/kg、0.39mg/kg、0.40mg/
kg、0.41mg/kg、0.42mg/kg、0.43mg/kg、0.44mg/kg、0.45mg/kg、0.46mg/kg、0.47mg/kg、0.48mg/kg、0.49mg/kg、0.50mg/kg、0.51mg/kg、0.52mg/kg、0.53mg/kg、0.54mg/kg、0.55mg/kg、0.56mg/kg、0.57mg/kg、0.58mg/kg、0.59mg/kg、0.60mg/kg、0.61mg/kg、0.62mg/kg,0.63mg/kg、0.64mg/kg、0.65mg/kg、0.66mg/kg、0.67mg/kg、0.68mg/kg、0.69mg/kg、0.70mg/kg、0.71mg/kg、0.72mg/kg、0.73mg/kg、0.74mg/kg、0.75mg/kg、0.76mg/kg、0.77mg/kg、0.78mg/kg、0.79mg/kg、0.80mg/kg、0.81mg/kg、0.82mg/kg、0.83mg/kg、0.84mg/kg、0.85mg/kg、0.86mg/kg、0.87mg/kg、0.88mg/kg、0.89mg/kg、0.90mg/kg、0.91mg/kg、0.92mg/kg、0.93mg/kg、0.94mg/kg、0.95mg/kg、0.96mg/kg、0.97mg/kg、0.98mg/kg、0.90mg/kg、1.0mg/kg、1.01mg/kg、1.02mg/kg、1.03mg/kg、1.04mg/kg、1.05mg/kg、1.06mg/kg、1.07mg/kg、1.08mg/kg、1.09mg/kg、1.10mg/kg、1.11mg/kg、1.12mg/kg、1.13mg/kg、1.14mg/kg、1.15mg/kg、1.16mg/kg、1.17mg/kg、1.18mg/kg、1.19mg/kg或1.20mg/kg尿酸酶。
[0153]
包含含有雷帕霉素之合成纳米载体的组合物的雷帕霉素的示例性剂量可以是0.050mg/kg、0.055mg/kg、0.060mg/kg、0.065mg/kg、0.070mg/kg、0.075mg/kg、0.080mg/kg、0.085mg/kg、0.090mg/kg、0.095mg/kg、0.100mg/kg、0.105mg/kg、0.110mg/kg、0.115mg/kg、0.120mg/kg、0.125mg/kg、0.130mg/kg、0.135mg/kg、0.140mg/kg、0.145mg/kg、0.150mg/kg、0.155mg/kg、0.160mg/kg、0.165mg/kg、0.170mg/kg、0.175mg/kg、0.180mg/kg、0.185mg/kg、0.190mg/kg、0.195mg/kg、0.200mg/kg、0.205mg/kg、0.210mg/kg、0.215mg/kg、0.220mg/kg、0.225mg/kg、0.230mg/kg、0.235mg/kg、0.240mg/kg、0.245mg/kg、0.250mg/kg、0.255mg/kg、0.260mg/kg、0.265mg/kg、0.270mg/kg、0.275mg/kg、0.280mg/kg、0.285mg/kg、0.290mg/kg、0.295mg/kg、0.300mg/kg、0.305mg/kg、0.310mg/kg、0.315mg/kg、0.320mg/kg、0.325mg/kg、0.330mg/kg、0.335mg/kg、0.340mg/kg、0.345mg/kg、0.350mg/kg、0.355mg/kg、0.360mg/kg、0.365mg/kg、0.370mg/kg、0.375mg/kg、0.380mg/kg、0.385mg/kg、0.390mg/kg、0.395mg/kg、0.400mg/kg、0.405mg/kg、0.410mg/kg、0.415mg/kg、0.420mg/kg、0.425mg/kg、0.430mg/kg、0.435mg/kg、0.440mg/kg、0.445mg/kg、0.450mg/kg、0.455mg/kg、0.460mg/kg、0.465mg/kg、0.470mg/kg、0.475mg/kg、0.480mg/kg、0.485mg/kg、0.490mg/kg、0.495mg/kg、0.500mg/kg雷帕霉素。
[0154]
本文中提供的包含含有雷帕霉素之合成纳米载体的组合物的示例性剂量可以是0.55mg/kg、0.56mg/kg、0.57mg/kg、0.58mg/kg、0.59mg/kg、0.60mg/kg、0.61mg/kg、0.62mg/kg、0.63mg/kg、0.64mg/kg、0.65mg/kg、0.66mg/kg、0.67mg/kg、0.68mg/kg、0.69mg/kg、0.70mg/kg、0.71mg/kg、0.72mg/kg、0.73mg/kg、0.74mg/kg、0.75mg/kg、0.76mg/kg、0.77mg/kg、0.78mg/kg、0.79mg/kg、0.80mg/kg、0.81mg/kg、0.82mg/kg、0.83mg/kg、0.84mg/kg、0.85mg/kg、0.86mg/kg、0.87mg/kg、0.88mg/kg、0.89mg/kg、0.90mg/kg、0.91mg/kg、0.92mg/kg、0.93mg/kg、0.94mg/kg、0.95mg/kg、0.96mg/kg、0.97mg/kg、0.98mg/kg、0.90mg/kg、1.0mg/kg、1.01mg/kg、1.02mg/kg、1.03mg/kg、1.04mg/kg、1.05mg/kg、1.06mg/kg、1.07mg/kg、1.08mg/kg、1.09mg/kg、1.10mg/kg、1.11mg/kg、1.12mg/kg、1.13mg/kg、1.14mg/kg、1.15mg/kg、1.16mg/kg、1.17mg/kg、1.18mg/kg、1.19mg/kg、1.20mg/kg、1.21mg/kg、1.22mg/kg、1.23mg/kg、1.24mg/kg、1.25mg/kg、1.26mg/kg、1.27mg/kg、1.28mg/kg、1.29mg/kg、1.30mg/kg、1.31mg/kg、1.32mg/kg、1.33mg/kg、1.34mg/kg、1.35mg/kg、1.36mg/kg、1.37mg/kg、1.38mg/kg、1.39mg/kg、1.40mg/kg、1.41mg/kg、1.42mg/kg、1.43mg/kg、1.44mg/kg、
1.45mg/kg、1.46mg/kg、1.47mg/kg、1.48mg/kg、1.49mg/kg、1.50mg/kg、1.51mg/kg、1.52mg/kg、1.53mg/kg、1.54mg/kg、1.55mg/kg、1.56mg/kg、1.57mg/kg、1.58mg/kg、1.59mg/kg、1.60mg/kg、1.61mg/kg、1.62mg/kg、1.63mg/kg、1.64mg/kg、1.65mg/kg、1.66mg/kg、1.67mg/kg、1.68mg/kg、1.69mg/kg、1.70mg/kg、1.71mg/kg、1.72mg/kg、1.73mg/kg、1.74mg/kg、1.75mg/kg、1.76mg/kg、1.77mg/kg、1.78mg/kg、1.79mg/kg、1.80mg/kg、1.81mg/kg、1.82mg/kg、1.83mg/kg、1.84mg/kg、1.85mg/kg、1.86mg/kg、1.87mg/kg、1.88mg/kg、1.89mg/kg、1.90mg/kg、1.91mg/kg、1.92mg/kg、1.93mg/kg、1.94mg/kg、1.95mg/kg、1.96mg/kg、1.97mg/kg、1.98mg/kg、1.99mg/kg、2.00mg/kg、2.01mg/kg、2.02mg/kg、2.03mg/kg、2.04mg/kg、2.05mg/kg、2.06mg/kg、2.07mg/kg、2.08mg/kg、2.09mg/kg、2.10mg/kg、2.11mg/kg、2.12mg/kg、2.13mg/kg、2.14mg/kg、2.15mg/kg、2.16mg/kg、2.17mg/kg、2.18mg/kg、2.19mg/kg、2.20mg/kg、2.21mg/kg、2.22mg/kg、2.23mg/kg、2.24mg/kg、2.25mg/kg、2.26mg/kg、2.27mg/kg、2.28mg/kg、2.29mg/kg、2.30mg/kg、2.31mg/kg、2.32mg/kg、2.33mg/kg、2.34mg/kg、2.35mg/kg、2.36mg/kg、2.37mg/kg、2.38mg/kg、2.39mg/kg、2.40mg/kg、2.41mg/kg、2.42mg/kg、2.43mg/kg、2.44mg/kg、2.45mg/kg、2.46mg/kg、2.47mg/kg、2.48mg/kg、2.49mg/kg、2.50mg/kg、2.51mg/kg、2.52mg/kg、2.53mg/kg、2.54mg/kg、2.55mg/kg、2.56mg/kg、2.57mg/kg、2.58mg/kg、2.59mg/kg、2.60mg/kg、2.61mg/kg、2.62mg/kg、2.63mg/kg、2.64mg/kg、2.65mg/kg、2.66mg/kg、2.67mg/kg、2.68mg/kg、2.69mg/kg、2.70mg/kg、2.71mg/kg、2.72mg/kg、2.73mg/kg、2.74mg/kg、2.75mg/kg、2.76mg/kg、2.77mg/kg、2.78mg/kg、2.79mg/kg、2.80mg/kg、2.81mg/kg、2.82mg/kg、2.83mg/kg、2.84mg/kg、2.85mg/kg、2.86mg/kg、2.87mg/kg、2.88mg/kg、2.89mg/kg、2.90mg/kg、2.91mg/kg、2.92mg/kg、2.93mg/kg、2.94mg/kg、2.95mg/kg、2.96mg/kg、2.97mg/kg、2.98mg/kg、2.99mg/kg、3.00mg/kg、3.01mg/kg、3.02mg/kg、3.03mg/kg、3.04mg/kg、3.05mg/kg、3.06mg/kg、3.07mg/kg、3.08mg/kg、3.09mg/kg、3.10mg/kg、3.11mg/kg、3.12mg/kg、3.13mg/kg、3.14mg/kg、3.15mg/kg、3.16mg/kg、3.17mg/kg、3.18mg/kg、3.19mg/kg、3.20mg/kg、3.21mg/kg、3.22mg/kg、3.23mg/kg、3.24mg/kg、3.25mg/kg、3.26mg/kg、3.27mg/kg、3.28mg/kg、3.29mg/kg、3.30mg/kg、3.31mg/kg、3.32mg/kg、3.33mg/kg、3.34mg/kg、3.35mg/kg、3.36mg/kg、3.37mg/kg、3.38mg/kg、3.39mg/kg、3.40mg/kg、3.41mg/kg、3.42mg/kg、3.43mg/kg、3.44mg/kg、3.45mg/kg、3.46mg/kg、3.47mg/kg、3.48mg/kg、3.49mg/kg、3.50mg/kg、3.51mg/kg、3.52mg/kg、3.53mg/kg、3.54mg/kg、3.55mg/kg、3.56mg/kg、3.57mg/kg、3.58mg/kg、3.59mg/kg、3.60mg/kg、3.61mg/kg、3.62mg/kg、3.63mg/kg、3.64mg/kg、3.65mg/kg、3.66mg/kg、3.67mg/kg、3.68mg/kg、3.69mg/kg、3.70mg/kg、3.71mg/kg、3.72mg/kg、3.73mg/kg、3.74mg/kg、3.75mg/kg、3.76mg/kg、3.77mg/kg、3.78mg/kg、3.79mg/kg、3.80mg/kg、3.81mg/kg、3.82mg/kg、3.83mg/kg、3.84mg/kg、3.85mg/kg、3.86mg/kg、3.87mg/kg、3.88mg/kg、3.89mg/kg、3.90mg/kg、3.91mg/kg、3.92mg/kg、3.93mg/kg、3.94mg/kg、3.95mg/kg、3.96mg/kg、3.97mg/kg、3.98mg/kg、3.99mg/kg、4.00mg/kg、4.01mg/kg、4.02mg/kg、4.03mg/kg、4.04mg/kg、4.05mg/kg、4.06mg/kg、4.07mg/kg、4.08mg/kg、4.09mg/kg、4.10mg/kg、4.11mg/kg、4.12mg/kg、4.13mg/kg、4.14mg/kg、4.15mg/kg、4.16mg/kg、4.17mg/kg、4.18mg/kg、4.19mg/kg、4.20mg/kg、4.21mg/kg、4.22mg/kg、4.23mg/kg、4.24mg/kg、4.25mg/kg、4.26mg/kg、4.27mg/kg、4.28mg/kg、4.29mg/kg、4.30mg/kg、4.31mg/kg、4.32mg/kg、4.33mg/kg、4.34mg/kg、4.35mg/kg、4.36mg/kg、4.37mg/
kg、4.38mg/kg、4.39mg/kg、4.40mg/kg、4.41mg/kg、4.42mg/kg、4.43mg/kg、4.44mg/kg、4.45mg/kg、4.46mg/kg、4.47mg/kg、4.48mg/kg、4.49mg/kg、4.50mg/kg、4.51mg/kg、4.52mg/kg、4.53mg/kg、4.54mg/kg、4.55mg/kg、4.56mg/kg、4.57mg/kg、4.58mg/kg、4.59mg/kg、4.60mg/kg、4.61mg/kg、4.62mg/kg、4.63mg/kg、4.64mg/kg、4.65mg/kg、4.66mg/kg、4.67mg/kg、4.68mg/kg、4.69mg/kg、4.70mg/kg、4.71mg/kg、4.72mg/kg、4.73mg/kg、4.74mg/kg、4.75mg/kg、4.76mg/kg、4.77mg/kg、4.78mg/kg、4.79mg/kg、4.80mg/kg、4.81mg/kg、4.82mg/kg、4.83mg/kg、4.84mg/kg、4.85mg/kg、4.86mg/kg、4.87mg/kg、4.88mg/kg、4.89mg/kg、4.90mg/kg、4.91mg/kg、4.92mg/kg、4.93mg/kg、4.94mg/kg、4.95mg/kg、4.96mg/kg、4.97mg/kg、4.98mg/kg、4.99mg/kg、5.00mg/kg、5.01mg/kg、5.02mg/kg、5.03mg/kg、5.04mg/kg、5.05mg/kg、5.06mg/kg、5.07mg/kg、5.08mg/kg、5.09mg/kg、5.10mg/kg、5.11mg/kg、5.12mg/kg、5.13mg/kg、5.14mg/kg、5.15mg/kg、5.16mg/kg、5.17mg/kg、5.18mg/kg、5.19mg/kg、5.20mg/kg、5.21mg/kg、5.22mg/kg、5.23mg/kg、5.24mg/kg、5.25mg/kg、5.26mg/kg、5.27mg/kg、5.28mg/kg、5.29mg/kg、5.30mg/kg、5.31mg/kg、5.32mg/kg、5.33mg/kg、5.34mg/kg、5.35mg/kg、5.36mg/kg、5.37mg/kg、5.38mg/kg、5.39mg/kg、5.40mg/kg、5.41mg/kg、5.42mg/kg、5.43mg/kg、5.44mg/kg、5.45mg/kg、5.46mg/kg、5.47mg/kg、5.48mg/kg、5.49mg/kg、5.50mg/kg、5.51mg/kg、5.52mg/kg、5.53mg/kg、5.54mg/kg、5.55mg/kg、5.56mg/kg、5.57mg/kg、5.58mg/kg、5.59mg/kg、5.60mg/kg、5.61mg/kg、5.62mg/kg、5.63mg/kg、5.64mg/kg、5.65mg/kg、5.66mg/kg、5.67mg/kg、5.68mg/kg、5.69mg/kg、5.70mg/kg、5.71mg/kg、5.72mg/kg、5.73mg/kg、5.74mg/kg、5.75mg/kg、5.76mg/kg、5.77mg/kg、5.78mg/kg、5.79mg/kg、5.80mg/kg、5.81mg/kg、5.82mg/kg、5.83mg/kg、5.84mg/kg、5.85mg/kg、5.86mg/kg、5.87mg/kg、5.88mg/kg、5.89mg/kg、5.90mg/kg、5.91mg/kg、5.92mg/kg、5.93mg/kg、5.94mg/kg、5.95mg/kg、5.96mg/kg、5.97mg/kg、5.98mg/kg、5.99mg/kg、6.00mg/kg、6.01mg/kg、6.02mg/kg、6.03mg/kg、6.04mg/kg、6.05mg/kg、6.06mg/kg、6.07mg/kg、6.08mg/kg、6.09mg/kg、6.10mg/kg、6.11mg/kg、6.12mg/kg、6.13mg/kg、6.14mg/kg、6.15mg/kg、6.16mg/kg、6.17mg/kg、6.18mg/kg、6.19mg/kg、6.20mg/kg、6.21mg/kg、6.22mg/kg、6.23mg/kg、6.24mg/kg、6.25mg/kg、6.26mg/kg、6.27mg/kg、6.28mg/kg、6.29mg/kg、6.30mg/kg、6.31mg/kg、6.32mg/kg、6.33mg/kg、6.34mg/kg、6.35mg/kg、6.36mg/kg、6.37mg/kg、6.38mg/kg、6.39mg/kg、6.40mg/kg、6.41mg/kg、6.42mg/kg、6.43mg/kg、6.44mg/kg、6.45mg/kg、6.46mg/kg、6.47mg/kg、6.48mg/kg、6.49mg/kg、或6.50mg/kg,其中该剂量作为包含雷帕霉素之合成纳米载体的mg给出。
[0155]
本文中提供的用于包含尿酸酶(例如pegsiticase)的组合物的任一种剂量可用于本文中提供的任一种方法或组合物或药盒。通常来说,当提及要施用于对象的剂量时,该剂量是标签剂量。本文中提供的用于包含含有免疫抑制剂(例如雷帕霉素)之合成纳米载体的组合物的任一种剂量可用于本文中提供的任一种方法或组合物或药盒。通常来说,当提及要施用于对象的剂量时,该剂量是标签剂量。因此,在本文中提供的任一种方法中,剂量是标签剂量。
[0156]
在本文中提供的任一种方法的一些实施方案中,可使用另外的体积(启动体积)来启动输注线以向对象施用本文中提供的任何组合物。
[0157]
本文中提供了许多可能的给药方案。因此,可根据本文中提供的任一种给药方案
来治疗本文中提供的任一对象。作为一个实例,可根据这些给药方案中的任一种用包含尿酸酶(例如聚乙二醇化尿酸酶)的组合物和/或包含含有免疫抑制剂(例如雷帕霉素)的合成纳米载体的组合物治疗本文中提供的任一对象。用于所提供的任一种治疗方法的组合物的施用方式可以是通过静脉内施用,例如静脉内输注,其例如可在约1小时内进行。另外,本文中提供的任一种治疗方法还可包括施用另外的治疗剂,例如降尿酸治疗剂,例如尿酸酶,或抗痛风发作预防性治疗剂。另外的治疗剂的施用可根据本文中提供的任一种适用治疗方案进行。
[0158]
优选地,在一些实施方案中,用包含免疫抑制剂(例如雷帕霉素)的合成纳米载体组合物与包含尿酸酶(例如聚乙二醇化尿酸酶)的组合物的组合进行治疗可包括三个剂量的伴随包含尿酸酶的组合物的合成纳米载体组合物,随后是两个剂量的不伴随施用包含免疫抑制剂的组合物(例如包含免疫抑制剂的合成纳米载体组合物)或不伴随施用另外的治疗剂的尿酸酶。在这样的一个实施方案中,每个剂量可每二至四周施用。在一个实施方案中,提供了方法,通过该方法每月向本文中提供的任一对象伴随施用三个剂量的合成纳米载体组合物和包含尿酸酶的组合物,持续三个月。在另一个实施方案中,该方法还包括单独或在不伴随施用免疫抑制剂(例如包含免疫抑制剂的合成纳米载体组合物)或另外的治疗剂的情况下施用2、3、4、5、6、7、8、9或10个或者更多个月剂量的包含尿酸酶的组合物。在本文中提供的任一种方法的一些实施方案中,在治疗期之前、期间和/或之后的一个或更多个时间点在对象中测量尿酸水平。
[0159]
另外的治疗剂
[0160]
用于升高的尿酸水平、痛风、痛风发作或与痛风相关的病症的另外的治疗剂可施用于本文中提供的任一对象,例如用于降低尿酸水平和/或痛风治疗和/或痛风发作预防。本文中提供的任一种方法可包括施用这些另外的治疗剂中的一种或更多种。在一些实施方案中,本文中提供的任一种方法不包括伴随施用另外的治疗剂。另外的治疗剂的一些实例包括但不限于以下。其他实例对于本领域技术人员而言将是已知的。
[0161]
另外的治疗剂包括抗炎治疗剂(即,可起到减轻炎症作用的任何治疗剂)。抗炎治疗剂包括但不限于皮质类固醇或皮质醇(氢化可的松)衍生物。皮质类固醇包括但不限于糖皮质激素和盐皮质激素。皮质类固醇的另一些实例包括但不限于天然的那些(例如,11-脱氢皮质酮(11-氧代皮质酮、17-脱氧可的松)=21-羟基孕-4-烯-3,11,20-三酮;11-脱氧皮质酮(脱氧皮质酮、去氧皮质酮;21-羟基孕酮)=21-羟基孕-4-烯-3,20-二酮;11-脱氧皮质醇(可托多松、皮甾酮)=17α,21-二羟基孕-4-烯-3,20-二酮;11-酮孕酮(11-氧代孕酮;ketogestin)=孕-4-烯-3,11,20-三酮;11β-羟基孕烯醇酮=3β,11β-二羟基孕-5-烯-20-酮;11β-羟基孕酮(21-脱氧皮质酮)=11β-羟基孕-4-烯-3,20-二酮;11β,17α,21-三羟基孕烯醇酮=3β,11β,17α,21-四羟基孕-5-烯-20-酮;17α,21-二羟基孕烯醇酮=3β,17α,21-三羟基孕-5-烯-20-酮;17α-羟基孕烯醇酮=3β,17α-二羟基孕-5-烯-20-酮;17α-羟基孕酮=17α-羟基孕-4-烯-3,11,20-三酮;18-羟基-11-脱氧皮质酮=18,21-二羟基孕-4-烯-3,20-二酮;18-羟基皮质酮=11β,18,21-三羟基孕-4-烯-3,20-二酮;18-羟基孕酮=18-羟基孕-4-烯-3,20-二酮;21-脱氧皮质醇=11β,17α-二羟基孕-4-烯-3,20-二酮;21-脱氧可的松=17α-羟基孕-4-烯-3,11,20-三酮;21-羟基孕烯醇酮(prebediolone)=3β,21-二羟基孕-5-烯-20-酮;醛固酮=11β,21-二羟基孕-4-烯-3,18,20-三酮;皮质酮(17-脱氧皮质醇)=11
1,4-二烯-3,20-二酮;泼尼立定=11β,17α,21-三羟基-16-亚甲基孕-1,4-二烯-3,20-二酮;利美索龙=11β-羟基-16α,17α,21-三甲基孕-1,4-二烯-3,20-二酮;以及乌倍他索(卤倍他索)=6α,9α-二氟-11β,17α-二羟基-16β-甲基-21-氯孕-1,4-二烯-3,20-二酮);奈德类及相关物(例如,安西奈德=9α-氟-11β,16α,17α,21-四羟基孕-1,4-二烯-3,20-二酮环状16α,17α-缩醛与环戊酮,21-乙酸酯;布地奈德=11β,16α,17α,21-四羟基孕-1,4-二烯-3,20-二酮环状16α,17α-缩醛与丁醛;环索奈德=11β,16α,17α,21-四羟基孕-1,4-二烯-3,20-二酮环状16α,17α-与(r)-环己烷甲醛的缩醛,21-异丁酸酯;地夫可特=11β,21-二羟基-2
′‑
甲基-5
′
h-孕-1,4-二烯[17,16-d]唑-3,20-二酮21-乙酸酯;地索奈德=11β,16α,17α,21-四羟基孕-1,4-二烯-3,20-二酮环状16α,17α-与丙酮的缩醛;福莫可他(氟甲酰龙(fluoroformylone))=3-(2-氯乙氧基)-9α-氟-11β,16α,17α,21-四羟基-20-氧代孕-3,5-二烯-6-甲醛环状16α,17α-与丙酮的缩醛,21-乙酸酯;氟氯缩松奈德(fluclorolone acetonide)(氟氯奈德)=6α-氟-9α,11β-二氯-16α,17α,21-三羟基孕-1,4-二烯-3,20-二酮环状16α,17α-缩醛与丙酮;氟氢缩松(fludroxycortide)(丙酮缩氟氢羟龙(flurandrenolone)、氟氢可舒松(flurandrenolide))=6α-氟-11β,16α,17α,21-四羟基孕-4-烯-3,20-二酮环状16α,17α-与丙酮的缩醛;氟尼缩松=6α-氟-11β,16α,17α,21-四羟基孕-1,4-二烯-3,20-二酮环状16α,17α-与丙酮的缩醛;氟轻松奈德=6α,9α-二氟-11β,16α,17α,21-四羟基孕-1,4-二烯-3,20-二酮环状16α,17α-与丙酮的缩醛;醋酸氟氢松=6α,9α-二氟-11β,16α,17α,21-四羟基孕-1,4-二烯-3,20-二酮环状16α,17α-与丙酮的缩醛,21-乙酸酯;哈西奈德=9α-氟-11β,16α,17α-三羟基-21-氯孕-4-烯-3,20-二酮环状16α,17α-与丙酮的缩醛;以及曲安奈德=9α-氟-11β,16α,17α,21-四羟基孕-1,4-二烯-3,20-二酮环状16α,17α-与丙酮的缩醛);以及另一些(例如,可的伐唑=6,16α-二甲基-11β,17α,21-三羟基-2
′‑
苯基[3,2-c]吡唑并孕-4,6-二烯-20-酮21-乙酸酯;以及ru-28362=6-甲基-11β,17β-二羟基-17α-(1-丙炔基)雄甾-1,4,6-三烯-3-酮)。
[0162]
皮质类固醇(特别是糖皮质激素)具有抗炎和免疫抑制作用,其可有效地控制症状,包括与痛风、痛风发作和/或与痛风相关的病症相关的疼痛和炎症。施用皮质类固醇也可有助于降低与一种或更多种另外的治疗(例如尿酸酶替代治疗)相关的超敏反应。皮质类固醇的另一些非限制性实例包括泼尼松、泼尼松龙、medrol和甲泼尼龙。
[0163]
另外的治疗剂包括用于痛风发作或与任何与痛风或与痛风相关的病症相关的症状相关的疼痛和炎症的短期治疗,包括非类固醇抗炎药(nsaid)、秋水仙碱、经口皮质类固醇。nsaid的一些非限制性实例包括非处方nsaid,例如布洛芬、阿司匹林和萘普生;以及处方nsaid,例如塞来昔布、双氯芬酸、二氟尼柳、依托度酸、吲哚美辛、酮洛芬、酮咯酸、萘丁美酮(nabumetrone)、奥沙普秦、双水杨酸吡罗昔康(piroxiam salsalate)、舒林酸和托美汀。
[0164]
秋水仙碱是通常被认为是用于控制症状的nsaid的替代物的抗炎剂,所述症状包括与痛风、痛风发作和/或与痛风相关的病症相关的疼痛和炎症。
[0165]
另外的治疗剂的另一些实例包括黄嘌呤氧化酶抑制剂,其是抑制黄嘌呤氧化酶,降低或防止黄嘌呤氧化成尿酸,从而降低尿酸产生的分子。黄嘌呤氧化酶抑制剂通常分类为嘌呤类似物和其他类型的黄嘌呤氧化酶抑制剂。黄嘌呤氧化酶抑制剂的一些实例包括别嘌呤醇、羟嘌呤醇、巯异嘌呤、非布索坦、托匹司他、肌醇(例如,植酸和肌-肌醇)、类黄酮(例如,山奈酚、杨梅酮、槲皮素)、咖啡酸和3,4-二羟基-5-硝基苯甲醛(dhnb)。
[0166]
另外的治疗剂的另一些实例包括排尿酸剂。排尿酸剂旨在通过调节肾小管重吸收来提高尿酸的排泄以降低血清尿酸水平。例如,一些排尿酸剂调节尿酸的肾转运蛋白的活性(例如,urat1/slc22a12抑制剂)。排尿酸剂的一些非限制性实例包括丙磺舒、苯溴马隆、雷西那德、磺吡酮。另一些另外的治疗剂也可具有排尿酸活性,例如阿司匹林。
[0167]
另外的治疗剂还包括其他基于尿酸酶的治疗剂,其包括聚乙二醇化尿酸酶。这样的治疗剂例如当输注到人中时已显示降低血液尿酸水平并改善痛风症状。拉布立酶(从黄曲霉中克隆的未聚乙二醇化重组尿酸酶)被批准用于控制患有肿瘤溶解综合征的患者中的尿酸水平(pegloticase)是被多个10kda peg分子结合的重组尿酸酶(主要是具有来自狒狒的羧基末端序列的猪),其被批准用于治疗慢性难治性痛风。然而,如其他地方所述,的临床经验已表明,显著数目的患者会产生抗药物抗体,这会限制药物的长期效力。因此,的在先施用可以是使用本文中提供的方法的禁忌证。
[0168]
本文中提供的治疗可允许患者转换为经口痛风治疗,例如使用黄嘌呤氧化酶抑制剂,除非并且直到这些患者经历随后的尿酸沉积物表现,此时随后根据所提供的任一种方法进行本文中提供的治疗的新疗程。因此,本文中提供的任一种方法可包括在根据提供的任一种方法进行治疗方案之后随后施用经口痛风治疗剂作为另外的治疗剂。认为经口治疗可无法完全防止具有慢性痛风石性痛风病史的患者中尿酸晶体的随时间积聚。因此,预期在这些患者中可能间歇性地需要本文中提供的治疗。因此,在这些对象中,还根据本文中提供的任一种方法向对象进一步施用一种或更多种组合物。
[0169]
本文中提供的治疗可允许患者随后用降尿酸治疗剂(例如尿酸酶)进行治疗。在一些实施方案中,在没有免疫抑制剂的情况下进行。在一些实施方案中,在没有包含免疫抑制剂的合成纳米载体的情况下进行。
[0170]
根据本文中提供的任一种方法的治疗还可包括用抗痛风发作治疗剂(例如用秋水仙碱或nsaid)进行预治疗。因此,本文中提供的任一种方法可进一步包括这样的抗痛风发作治疗剂,其中所述抗痛风发作治疗剂与包含尿酸酶的组合物和包含含有免疫抑制剂之合成纳米载体的组合物伴随施用。
[0171]
确定或监测对象(例如用血清尿酸水平和/或ada的量度)可以是本文中提供的任一种方法中包括的步骤。本文中提供的方法可包括在对象中(例如在来自所述对象的样品中)确定或获得抗尿酸酶抗体水平(例如效价)的步骤,并且该水平可用于确定用于治疗的对象或监测正在进行治疗的对象。在一个实施方案中,治疗可以是本文中提供的任一种治疗。例如,如果抗尿酸酶抗体水平小于阈值(例如,1080),则可指示治疗或者可以不需要调节治疗。如果抗尿酸酶抗体水平大于阈值(例如1080),则可指示调整治疗或进一步监测或评估。
[0172]
在一些实施方案中,如果这样的对象出现不期望的免疫应答,则根据本文中提供的任一种方法进一步向对象施用一种或更多种组合物。在本文中提供的任一种方法的一些实施方案中,用双能计算机断层扫描(dual energy computed tomography,dect)监测对象,其可用于可视化关节和组织中的尿酸沉积物。成像(例如使用dect)可用于评估用本文中提供的任一种方法或组合物进行治疗的效力。因此,本文中提供的任一种方法还可包括
成像步骤,例如使用dect进行。在本文中提供的任一种方法的一些实施方案中,所述对象是其中已用这样的成像(例如用dect)诊断出痛风(例如慢性痛风石性痛风或与痛风相关的病症)的对象。
[0173]
对象
[0174]
本文中提供的对象可需要根据本文中提供的任一种方法或组合物或药盒进行治疗。这样的对象包括具有提高的血清尿酸水平或尿酸沉积物的那些。这样的对象包括患有高尿酸血症的那些。能够确定需要本文中提供的治疗的对象在临床医生的技能范围内。
[0175]
在一些实施方案中,用于如提供的任一种方法中所提供的进行治疗的任一对象患有痛风或与痛风相关的病症或本文中提供的其他病症。在一些实施方案中,对于用于如提供的任一种方法中所提供的进行治疗的任一对象,所述对象曾发生或预期会发生痛风发作。
[0176]
在一些实施方案中,对象患有与痛风相关的侵蚀性骨疾病、与痛风相关的肝硬化或脂肪性肝炎、或内脏痛风,或者处于患有它们的风险之中。
[0177]
在一些实施方案中,对象具有升高的尿酸水平,例如升高的血浆或血清尿酸水平,或者处于具有它们的风险之中。当血液尿酸水平可超过溶解度的生理界限时,尿酸可在组织(包括关节)中结晶,并且可引起痛风和痛风相关病症。
[0178]
在一些实施方案中,血清尿酸水平≥5mg/dl、≥6mg/dl、或≥7mg/dl指示对象可以是用本文中所述的任一种方法或组合物或药盒进行治疗的候选者。在一些实施方案中,这样的对象的血清尿酸水平为≥6mg/dl,例如,为6.1mg/dl至15mg/dl、6.1mg/dl至10mg/dl、7mg/dl至15mg/dl、7mg/dl至10mg/dl、8mg/dl至15mg/dl、8mg/dl至10mg/dl、9mg/dl至15mg/dl、9mg/dl至10mg/dl、10mg/dl至15mg/dl或11mg/dl至14mg/dl。在一些实施方案中,对象的血清尿酸水平为约6.1mg/dl、6.2mg/dl、6.3mg/dl、6.4mg/dl、6.5mg/dl、6.7mg/dl、6.8mg/dl、6.9mg/dl、7.0mg/dl、7.1mg/dl、7.2mg/dl、7.3mg/dl、7.4mg/dl、7.5mg/dl、7.6mg/dl、7.7mg/dl、7.8mg/dl、7.9mg/dl、8.0mg/dl、8.1mg/dl、8.2mg/dl、8.3mg/dl、8.4mg/dl、8.5mg/dl、8.6mg/dl、8.7mg/dl、8.8mg/dl、8.9mg/dl、9.0mg/dl、9.1mg/dl、9.2mg/dl、9.3mg/dl、9.4mg/dl、9.5mg/dl、9.6mg/dl、9.7mg/dl、9.8mg/dl、9.9mg/dl、10.0mg/dl、10.1mg/dl、10.2mg/dl、10.3mg/dl、10.4mg/dl、10.5mg/dl、10.6mg/dl、10.7mg/dl、10.8mg/dl、10.9mg/dl、11.0mg/dl、11.1mg/dl、11.2mg/dl、11.3mg/dl、11.4mg/dl、11.5mg/dl、11.6mg/dl、11.7mg/dl、11.8mg/dl、11.9mg/dl、12.0mg/dl、12.1mg/dl、12.2mg/dl、12.3mg/dl、12.4mg/dl、12.5mg/dl、12.6mg/dl、12.7mg/dl、12.8mg/dl、12.9mg/dl、13.0mg/dl、13.1mg/dl、13.2mg/dl、13.3mg/dl、13.4mg/dl、13.5mg/dl、13.6mg/dl、13.7mg/dl、13.8mg/dl、13.9mg/dl、14.0mg/dl、14.1mg/dl、14.2mg/dl、14.3mg/dl、14.4mg/dl、14.5mg/dl、14.6mg/dl、14.7mg/dl、14.8mg/dl、14.9mg/dl、15.0mg/dl或更高。在一些实施方案中,对象的血浆或血清尿酸水平为5.0mg/dl、5.1mg/dl、5.2mg/dl、5.3mg/dl、5.4mg/dl、5.5mg/dl、5.6mg/dl、5.7mg/dl、5.8mg/dl、5.9mg/dl、6.0mg/dl、6.1mg/dl、6.2mg/dl、6.3mg/dl、6.4mg/dl、6.5mg/dl、6.6mg/dl、6.7mg/dl、6.8mg/dl、6.9mg/dl、或7.0mg/dl。在一些实施方案中,对象的血浆或血清尿酸水平为大于或等于5.0mg/dl、5.1mg/dl、5.2mg/dl、5.3mg/dl、5.4mg/dl、5.5mg/dl、5.6mg/dl、5.7mg/dl、5.8mg/dl、5.9mg/dl、6.0mg/dl、6.1mg/dl、6.2mg/dl、6.3mg/dl、6.4mg/dl、6.5mg/dl、6.6mg/dl、6.7mg/dl、6.8mg/dl、6.9mg/dl、或
7.0mg/dl。
[0179]
在一些实施方案中,对象患有高尿酸血症或处于患有高尿酸血症的风险之中。在一些实施方案中,对象患有以下或处于患有以下的风险之中:痛风、急性痛风、急性间歇性痛风、痛风性关节炎、急性痛风性关节炎、急性痛风性关节病、急性多关节痛风、复发性痛风性关节炎、慢性痛风(具有或不具有痛风石)、痛风石性痛风、慢性痛风石性痛风、慢性晚期痛风(具有或不具有痛风石)、慢性多关节痛风(具有或不具有痛风石)、慢性痛风性关节病(具有或不具有痛风石)、特发性痛风、特发性慢性痛风(具有或不具有痛风石)、原发性痛风、慢性原发性痛风(具有或不具有痛风石)、难治性痛风(例如慢性难治性痛风)、轴性痛风性关节病、痛风发病、痛风发作、足痛风(即,拇趾单关节性关节炎)、手痛风(即,手部单关节性关节炎)、膝痛风(即,膝单关节性关节炎)、痛风性滑囊炎、痛风性脊柱炎、痛风性滑膜炎、痛风性腱鞘炎、影响肌腱和韧带的痛风、铅诱发的痛风(即,铅中毒性痛风)、药物诱发的痛风、由肾受损引起的痛风、由肾病引起的痛风、由肾受损引起的慢性痛风(具有或不具有痛风石)、由肾病引起的慢性痛风(具有或不具有痛风石)、与痛风相关的侵蚀性骨疾病、与痛风相关的卒中、与痛风相关的血管斑块、与痛风相关的肝硬化或脂肪性肝炎、肝相关痛风、偶发性和复发性痛风、痛风中与胰腺损伤相关的糖尿病、痛风加重的一般炎性疾病、其他继发性痛风、或未明确的痛风。
[0180]
在一些实施方案中,对象患有以下或处于患有以下的风险之中:与肾系统相关的病症,例如由痛风引起的泌尿道结石、尿酸尿石症、尿酸肾石症、尿酸肾结石、痛风性肾病、急性痛风性肾病、慢性痛风性肾病、尿酸盐肾病、尿酸肾病和痛风性间质性肾病。
[0181]
在一些实施方案中,对象患有以下或处于患有以下的风险之中:与神经系统相关的病症,例如由痛风引起的外周自主神经病、痛风性神经病、痛风性外周神经病、痛风性嵌压性神经病或痛风性神经炎。
[0182]
在一些实施方案中,对象患有以下或处于患有以下的风险之中:与心血管系统相关的病症,例如代谢综合征、高血压、肥胖、糖尿病、心肌梗死、卒中、血脂异常、高甘油三酯血症、胰岛素抗性/高血糖、冠状动脉疾病/冠心病、与痛风或高尿酸血症相关的冠状动脉疾病或阻塞、心力衰竭、外周动脉疾病、卒中/脑血管疾病、外周血管疾病和由痛风引起的心肌病。
[0183]
在一些实施方案中,对象患有以下或处于患有以下的风险之中:与眼系统相关的病症,包括例如痛风性虹膜炎、由痛风引起的眼炎性疾病、干眼综合征、红眼、葡萄膜炎、高眼内压、青光眼和白内障。
[0184]
在一些实施方案中,对象患有以下或处于患有以下的风险之中:与皮肤相关的病症,包括例如外耳痛风、痛风性皮炎、痛风性湿疹、痛风性脂膜炎和粟疹性痛风(miliarial gout)。
[0185]
组合物和药盒
[0186]
本文中提供的组合物可包含无机或有机缓冲剂(例如,磷酸、碳酸、乙酸或柠檬酸的钠盐或钾盐)和ph调节剂(例如,盐酸、氢氧化钠或氢氧化钾、柠檬酸盐或乙酸盐、氨基酸及其盐)、抗氧化剂(例如,抗坏血酸、α-生育酚)、表面活性剂(例如,聚山梨酯20、聚山梨酯80、聚氧乙烯9-10壬基酚、脱氧胆酸钠)、溶液和/或冷冻/冻干稳定剂(例如,蔗糖、乳糖、甘露糖醇、海藻糖)、渗透调节剂(例如,盐或糖)、抗菌剂(例如,苯甲酸、酚、庆大霉素)、消泡剂
(例如,聚二甲基硅氧烷(polydimethylsilozone))、防腐剂(例如,硫柳汞、2-苯氧基乙醇、edta)、聚合物稳定剂和黏度调节剂(例如,聚乙烯吡咯烷酮、泊洛沙姆488、羧甲基纤维素)和共溶剂(例如,甘油、聚乙二醇、乙醇)。
[0187]
根据本发明的组合物可包含可药用赋形剂。可使用常规药物制造和复配技术制备组合物以获得可用的剂型。适用于实施本发明的技术可见于handbook of industrial mixing:science and practice,edward l..paul,victor a.atiemo-obeng,和suzanne m.kresta编辑,2004 john wiley&sons,inc.;和pharmaceutics:the science of dosage form design,第2版.m.e.auten编辑,2001,churchill livingstone。在一个实施方案中,将组合物与防腐剂一起混悬在无菌注射用盐水溶液中。
[0188]
应理解,本发明的组合物可以以任何合适的方式制备,并且本发明决不限于可使用本文中所述的方法产生的组合物。选择合适的制造方法可需要注意相关的特定要素的特性。
[0189]
在一些实施方案中,组合物在无菌条件下制备或者在最初或最终进行灭菌。这可确保所得组合物是无菌且非感染性的,因此与非无菌组合物相比提高安全性。这提供了有价值的安全措施,尤其是当接受组合物的对象具有免疫缺陷、遭受感染和/或易受感染时。在一些实施方案中,可将组合物冻干并以混悬液形式或作为冻干粉末(根据配制策略)长时间储存而不丧失活性。
[0190]
根据本发明的施用可通过多种途径进行,包括但不限于静脉内途径。可使用常规方法制造和制备本文中提及的组合物用于施用。
[0191]
本发明的组合物可以以有效量(例如本文中其他地方描述的有效量)施用。本文中提供的组合物的剂量可包含不同量的根据本发明的元素。用于给药的组合物中存在的要素的量可根据其性质、要实现的治疗益处和其他这样的参数而变化。用于给药的组合物可根据本文中提供的任一频率施用。
[0192]
本公开内容的另一方面涉及药盒。在一些实施方案中,药盒包含本文中提供的任意一种或更多种组合物。在所提供的任一种药盒的一些实施方案中,药盒包含如本文中提供的任意一种或更多种包含尿酸酶的组合物。优选地,包含尿酸酶的组合物的量提供本文中提供的任意一个或更多个剂量。包含尿酸酶的组合物可在药盒中的一个容器中或多于一个容器中。在所提供的任一种药盒的一些实施方案中,药盒还包含本文中提供的任意一种或更多种合成纳米载体组合物。优选地,合成纳米载体组合物的量提供本文中提供的一个或更多个合成纳米载体剂量。合成纳米载体组合物可在药盒中的一个容器中或多于一个容器中。在所提供的任一种药盒的一些实施方案中,容器是小瓶或安瓿。在所提供的任一种药盒的一些实施方案中,组合物各自以冻干形式在单独的容器中或在同一容器中,使得其可在随后的时间重构。在任一种药盒的一些实施方案中,冻干组合物还包含糖,例如甘露糖醇。在所提供的任一种药盒的一些实施方案中,组合物各自以冷冻混悬液的形式在单独的容器中或在同一容器中,使得其可以在随后的时间重构。在任一种药盒的一些实施方案中,冷冻混悬液还包含pbs。在任一种药盒的一些实施方案中,药盒还包含pbs和/或0.9%氯化钠,usp。在所提供的任一种药盒的一些实施方案中,药盒还包含用于重构、混合、施用等的说明书。在所提供的任一种药盒的一些实施方案中,说明书包含对本文中所述的任一种方法的描述。说明书可以是任何合适的形式,例如作为印刷插页或标签。在本文中提供的任一
种药盒的一些实施方案中,药盒还包含一个或更多个注射器或者其他可将组合物体内递送至对象的装置。
实施例
[0193]
实施例1:sel 212临床试验结果,非人
[0194]
临床前开发
[0195]
使用sel 212处理尿酸酶缺陷型小鼠和野生型小鼠、大鼠和非人灵长类,以评价效力、剂量方案和安全性。
[0196]
在尿酸酶缺陷型小鼠中的概念验证研究
[0197]
在内源性尿酸酶遗传性缺陷型小鼠中进行了药理学研究。该研究评价了以下剂量方案在防止形成针对pegsiticase的ada方面的效力,所述剂量方案由以下组成:用sel 212进行三次免疫接种,然后是单独pegsiticase的数个剂量。处理期由研究的前14天组成。在该研究中,将小鼠分成三个处理组。在处理期期间:
[0198]
·
第一组,称为未处理组,不接受处理;
[0199]
·
第二组,称为pegsiticase组,仅用pegsiticase进行处理;以及
[0200]
·
第三组,称为svp雷帕霉素 pegsiticase组,用与pegsiticase共施用的svp雷帕霉素进行处理。
[0201]
在处理期的第0天、第7天和第14天处理pegsiticase组和svp雷帕霉素 pegsiticase组。然后,在研究的第35天和第42天或在攻击期,将每组用单独的pegsiticase进行处理。记录尿酸酶特异性ada水平以确定针对pegsiticase的ada的形成。测量尿酸水平以确定与pegsiticase共施用的svp雷帕霉素在使尿酸水平降低至低于6mg/dl(这是痛风患者的治疗目标)方面的有效性。
[0202]
抗体形成。当在处理期期间暴露于pegsiticase时,pegsiticase组产生尿酸酶特异性ada。未处理组一经pegsiticase攻击就也产生尿酸酶特异性ada。尽管在处理期和攻击期都暴露于pegsiticase,但svp雷帕霉素 pegsiticase组在任一时期期间都未产生尿酸酶特异性ada。
[0203]
尿酸水平。在最初暴露于pegsiticase之后,未处理组维持约10mg/dl的高尿酸水平。在处理期的第一剂量之后,pegsiticase组记录尿酸水平低于6mg/dl。然而,在处理期和攻击期的后续剂量期间,尿酸水平恢复至远超过6mg/dl的水平。相比之下,svp雷帕霉素 pegsiticase组在整个研究中维持接近于零的尿酸水平。
[0204]
在非人灵长类中的概念验证研究
[0205]
也进行了临床前研究以评价svp雷帕霉素减轻非人灵长类中尿酸酶特异性ada形成的能力。如图3所示,在研究期间:
[0206]
·
pegsiticase单独施用,称为空纳米粒组,或
[0207]
·
与两种剂量水平的svp雷帕霉素中的一种共施用,分别称为svp雷帕霉素0.1x组和svp雷帕霉素1x组。svp雷帕霉素0.1x组接受的svp雷帕霉素剂量水平为0.3mg/kg,svp雷帕霉素1x组接受的svp雷帕霉素剂量水平为3mg/kg。
[0208]
空纳米粒组接受三个月剂量的pegsiticase,并且svp雷帕霉素0.1x组和svp雷帕霉素1x组各自接受三个月剂量与svp雷帕霉素共施用的pegsiticase。然后,所有组接受两
个月剂量的单独pegsiticase。svp雷帕霉素0.1x组接受svp雷帕霉素1x组中施用剂量的十分之一。
[0209]
抗体形成。观察到,截止研究结束,空纳米粒组产生高水平的尿酸酶特异性ada。与空纳米粒组相比,svp雷帕霉素0.1x组和svp雷帕霉素1x组能够显著降低尿酸酶特异性ada的水平,并且在svp雷帕霉素1x组的情况下,抑制抗体的形成。该研究中的观察结果在非入灵长类中证实了在小鼠中观察到的尿酸酶特异性ada减轻。
[0210]
尿酸水平。正如所预期的,由于这些动物中天然存在尿酸酶的活性,单独的pegsiticase或与svp雷帕霉素共施用的pegsiticase对非人灵长类中尿酸水平的作用不能确定。
[0211]
基于这些临床前研究,以及为符合监管指南(称为当前良好实验室规范(good laboratory practice)或glp)而进行的毒理学研究,认为sel 212示出在临床前动物模型中具有足够的效力和安全性以证明进入临床研发是正当的。
[0212]
实施例2:sel 212临床试验结果,人
[0213]
1a期临床试验
[0214]
sel 212的1a期临床试验是在分成五个组群的22个升高的血清尿酸水平大于6mg/dl的对象中进行的单独pegsiticase的递增剂量试验。以以下剂量水平使每个组群接受pegsiticase的单静脉内输注:组群#1,0.1mg/kg;组群#2,0.2mg/kg;组群#3,0.4mg/kg;组群#4,0.8mg/kg;以及组群#5,1.2mg/kg。给药开始于最低剂量,并且仅在整个组群均安全给药之后下一个组群才开始。在输注之后30天时间期间监测对象,其中访视发生在第7天、第14天、第21天和第30天试验访视结束时。评价每位患者的血液和血清的血清尿酸、ada(特别是抗peg、抗尿酸酶和抗pegsiticase)和安全性参数。观察到,pegsiticase没有表现出严重的不良事件,并且在所测试的五个剂量水平下均耐受良好。另外,观察到,pegsiticase迅速降低(在数小时内)并且使每个组群的平均血清尿酸水平维持低于6mg/dl持续14至30天,这取决于剂量水平。与在动物中的临床前研究一致,pegsiticase在该1a期试验中以不同水平在所有对象中诱导尿酸酶特异性ada。
[0215]
图4示出了在试验开始时单静脉内输注pegsiticase之后30天期的过程期间在不同测量间隔(第7、14、21和30天)测试的1a期临床试验的五个组群的平均血清尿酸水平。
[0216]
血清尿酸水平在基线以及第7、14、21和30天测量,并且尿酸酶特异性ada水平在基线以及单静脉内注射pegsiticase之后第7、14和30天测量。未测量1a期临床试验中第21天的尿酸酶特异性ada水平。基于来自1a期临床试验的结果,观察到,耐受剂量的pegsiticase能够实现并维持在不存在抑制性尿酸酶特异性ada下血清尿酸降低至低于目标6mg/dl持续30天的时间。
[0217]
1b期临床试验
[0218]
1b期临床试验招募了63位血清尿酸水平高于6mg/dl的患者,将其分成11个组群。以下列递增剂量水平以递增顺序向四个组群施用单独svp雷帕霉素的单静脉内输注。每个组群由7位患者组成,并且命名如下:组群#1(0.03mg/kg)、组群#3(0.1mg/kg)、组群#5(0.3mg/kg)和组群#7(0.5mg/kg),统称为svp雷帕霉素组群。在单独svp-雷帕霉素的组群已成功且安全地给药之后,将相应剂量水平的svp雷帕霉素与固定剂量的pegsiticase(0.4mg/kg)组合。该组合以单静脉内输注依次共施用,其中svp雷帕霉素输注在
pegsiticase输注之前。对以下六个组群(每个组群5位患者)的组群命名如下,其为组群#2(svp雷帕霉素0.03mg/kg 0.4mg/kg pegsiticase)、组群#4(svp雷帕霉素0.1mg/kg 0.4mg/kg pegsiticase)、组群#6(svp雷帕霉素0.3mg/kg 0.4mg/kg pegsiticase)、组群#10(0.4mg/kg pegsiticase 0.03mg/kg svp雷帕霉素,相隔48小时)、组群#12(svp雷帕霉素0.15mg/kg 0.4mg/kg pegsiticase)和组群#14(svp雷帕霉素0.1mg/kg 0.4mg/kg pegsiticase),统称为sel 212组群。在组群#9中,以0.4mg/kg的剂量水平向5位患者施用固定量的单独pegsiticase,其被称为pegsiticase组群。还提供了这种治疗的方法。在输注之后30天期期间监测对象,其中访视发生在第7天、第14天、第21天和第30天试验访视结束时。评价每位患者的血液和血清的血清尿酸、ada(特别是抗peg、抗尿酸酶和抗pegsiticase)和安全性参数。1b期临床试验的主要目的是评价单独和与固定剂量的pegsiticase组合的svp雷帕霉素的安全性和耐受性。次要临床目的是评价当与施用单独的pegsiticase相比时与pegsiticase共施用的svp雷帕霉素降低血清尿酸水平和减轻尿酸酶特异性ada形成的能力。
[0219]
图5示出了来自1a期临床试验的组群#3的血清尿酸水平,其中对象仅接受固定量的pegsiticase(在相同的0.4mg/kg pegsiticase下)。在第一幅图中还有来自1b期临床试验的组群#9(pegsiticase0.4mg/kg)的数据。该图呈现出两个独立研究中数据的可重复性。在两个组群中,具有血清尿酸的初始控制(水平维持低于6mg/dl)但是第14天过去之后,个体丧失酶活性。在图5中还示出了来自单独svp雷帕霉素组群的数据。所有值在整个30天的测试期间保持基本上相同,表明单独的svp雷帕霉素对血清尿酸水平没有作用。对于接受与pegsiticase共施用的最低剂量svp雷帕霉素的来自1b期临床试验的组群#2,观察到测试的五位对象中有四位维持血清尿酸水平低于6mg/dl至试验的第21天。还观察到接受与pegsiticase共施用的第二最低剂量svp雷帕霉素的来自1b期临床试验的组群#4中五位对象中有四位维持血清尿酸水平低于0.1mg/dl至第30天。对于组群#6(sel 212组群),观察到四个(在所计划的五个中)对象维持血清尿酸水平低于0.1mg/dl至第21天,并且两个(在所计划的五个中)对象维持血清尿酸水平低于0.1mg/dl至第30天。相比之下,对于组群#9(pegsiticase组群),五位对象中的四位截止第30天恢复至基线血清尿酸水平。
[0220]
图5示出了来自1a期临床试验的组群#3以及1b期临床试验中组群#9(pegsiticase组群)中每位对象的血清尿酸水平和尿酸酶特异性ada水平,用于与1b期临床试验中组群#4(sel 212组群)中每位对象的血清尿酸水平和尿酸酶特异性ada水平进行比较。来自1a期临床试验的组群#3与来自1b期临床试验的组群#9一起示出的目的是与来自1b期临床试验的组群#4进行比较,因为这些组群中的对象接受相同固定剂量的pegsiticase。此外,来自1b期临床试验的组群#4在图5中示出是因为与在1b期临床试验中组群#2中的对象相比,来自1b期临床试验的组群#4中的对象接受更高剂量的svp雷帕霉素,所述组群#2是可获得来自1b期临床试验的30天观察期数据的另一sel 212组群。
[0221]
如图5所示,在来自1a期临床试验的组群#3和来自1b期临床试验的组群#9中,第14天观察到尿酸酶特异性ada形成,导致恢复至血清尿酸的基线水平。相比之下,对于来自1b期临床试验的组群#4,观察到在测试的五位对象中的四位中有极低的尿酸酶特异性ada形成,并且相应地维持血清尿酸水平控制至第30天。在1a期临床试验中,第21天未测量尿酸酶特异性ada水平。然而,在进行1a期临床试验的过程中,了解到测量第21天的尿酸酶特异性
ada水平将可用于更充分地理解第14天至第30天之间这种水平的任何变化。因此,对于1b期临床试验,监测第21天的尿酸酶特异性ada水平。
[0222]
对于组群#4(sel 212组群)中的三位对象(在第30天时没有血清尿酸和尿酸酶特异性ada水平或具有非常低的血清尿酸和尿酸酶特异性ada水平)收集第30天之后的另外的血清尿酸和尿酸酶特异性ada数据。对于所有这三位对象,收集第37天的数据,并且对于三位对象中的两位在第42天或第44天再次收集数据。如果适用的话,这三位对象中的每一位在第37天、第42天或第44天没有尿酸酶特异性ada水平或具有非常低的尿酸酶特异性ada水平。在所有三位对象中,在第37天血清尿酸水平保持低于基线。对于可获得第42天或第44天数据的两位对象,截止所测量的最后时间点,血清尿酸水平接近或超过基线。基于来自1b期临床试验数据的观察结果,sel 212能够在组群#4中的大多数对象中控制尿酸水平至少30天。
[0223]
在组合的基础上,结合1a期和1b期临床试验,总共85位对象已经给予sel 212(svp雷帕霉素和pegsiticase)、单独的svp雷帕霉素或单独的pegsiticase。总体上观察到对sel 212及其组分、svp雷帕霉素和pegsiticase耐受良好。在二项1期临床试验中总共有四个严重不良事件或sae。所有sae都完全解决。
[0224]
图6示出了1a期临床试验的组群#3以及1b期临床试验的组群#9(pegsiticase组群)中每位对象的血清尿酸水平和尿酸酶特异性ada水平,用于与1b期临床试验中组群#4(sel-212组群)和组群#6(sel-212组群)中每位对象的血清尿酸水平和尿酸酶特异性ada水平进行比较。来自1a期临床试验的组群#3也与来自1b期临床试验的组群#9一起示出,目的是与来自1b期临床试验的组群#4和组群#6进行比较,因为这些组群中的对象接受相同固定剂量的pegsiticase。此外,示出了来自1b期临床试验的组群#4是因为与1b期临床试验中组群#2中的对象相比,来自1b期临床试验的组群#4中的对象接受更高剂量的svp-雷帕霉素。还包括来自1b期临床试验的组群#6,因为这些对象接受迄今所测试的最高剂量的svp-雷帕霉素(高于组群#2和#4二者)。
[0225]
图7示出了1b期临床试验的组群#6与1b期临床试验的组群#5中sel-212效力的非头对头比较以及来自在2011年美国医学协会杂志(journal of the american medical association)中报道的的两项重复随机化双盲安慰剂对照临床试验的数据。这两项临床试验包括85位接受每两周剂量的的患者、84位接受月剂量的的患者和43位接受安慰剂的患者。
[0226]
已被批准用于以每两周剂量方案治疗难治性痛风,而的月剂量方案尚未批准上市。下面左侧的图示出了临床试验中接受月剂量的对象组群中第一剂量之后4周时间的数据。
[0227]
安慰剂对照对象(在图7中以空心圆表示)在整个四周内具有高于6mg/dl的尿酸水平。如在第3个月和第6个月在80%时间内维持尿酸水平低于6mg/dl所限定的变成响应者的经治疗对象用黑色圆圈表示。如在第3个月和第6个月在80%时间内无法维持尿酸水平低于6mg/dl所限定的变成非响应者的经治疗对象以黑色三角形表示。每月给药组群中仅35%的经治疗对象被归类为响应
者。值得注意的是,即使在四周时,平均尿酸水平在非响应者中高于6mg/dl,代表65%的对象,并且在响应者中高于4mg/dl。所有经治疗对象中的89%产生ada。相比之下,图7右侧的图示出了来自1b期临床试验的组群#5的数据,其接受单剂量的单独的svp-雷帕霉素,并且示出了来自1b期临床试验的组群#6的数据,其接受单剂量的sel-212。在用sel-212治疗的1b期临床试验的组群#6中的所有五位对象均维持血清尿酸水平低于0.1mg/dl至第30天。仅用svp-雷帕霉素治疗的1b期临床试验的组群#5中的对象没有经历尿酸水平的显著降低,因为这样的水平在30天期内保持相对恒定。还示出了来自1b期临床试验的组群#5(接受单剂量的单独的svp-雷帕霉素)与1b期临床试验的组群#9(接受单独的pegsiticase)的数据的比较。
[0228]
虽然认为上述比较可用于评价1b期临床试验的组群#6的结果,但是1b期临床试验和临床试验是由不同研究者在不同地点进行的单独试验。此外,还存在实质性差异,包括例如,临床试验是双盲试验,涉及大量患有难治性痛风的患者,而1b期临床试验在少量尿酸水平升高的对象中以非盲方式评价sel-212。此外,仅可将sel-212与在首次注射之后四周时间的效力进行比较,因为sel-212尚未在多剂量临床试验中进行评价。
[0229]
对于组群#4(sel-212组群)中三位在第30天时没有或具有非常低血清尿酸和尿酸酶特异性ada水平的对象,在第30天之后收集另外的血清尿酸和尿酸酶特异性ada数据。对于所有这三位对象在第37天收集数据,并且对于三位对象中的两位在第42天或第44天再次收集数据。如果适用的话,这三位对象中的每一位在第37天、第42天或第44天没有尿酸酶特异性ada水平或具有非常低的尿酸酶特异性ada水平。在所有三位对象中,在第37天血清尿酸水平保持低于基线。对于可获得第42天或第44天数据的两位对象,截止测量的最后时间点血清尿酸水平接近或超过基线。
[0230]
实施例3-2期临床试验
[0231]
本文中提供了sel-212的2期临床试验。该研究由与数个sel-037剂量伴随施用的多个sel-212剂量组成。sel-212是sel-037和sel-110的组合。sel-037包含pegsiticase(重组聚乙二醇化假丝酵母尿酸盐氧化酶)。sel-110是包封雷帕霉素的包含pla(聚(d,l-丙交酯))和pla-peg(聚(d,l-丙交酯)-嵌段-聚(乙二醇))的纳米粒。
[0232]
sel-037可以以磷酸盐缓冲剂和甘露糖醇作为赋形剂来提供。在施用之前,可将以尿酸酶蛋白测量的6mg的冻干sel-037用1.1ml无菌注射用水(usp,美国药典)重构,其形成6mg/ml浓缩溶液。将足够体积以尿酸酶蛋白测量的0.2mg/kg或0.4mg/kg的重构sel-037在100ml 0.9%注射用氯化钠(usp)中稀释,并以单静脉内输注在60分钟中用输注泵给药。
[0233]
基于雷帕霉素含量以2mg/ml提供sel-110,混悬在pbs中。将基于mg/kg的合适量的sel-110吸入注射器中,并用注射器式输注泵作为iv输注进行施用。如果对象是组群3、4、5、6、7和8的一部分,则在sel-037之前施用sel-110。sel-110与进行125ml生理盐水的60分钟输注同时通过注射器式输注泵以足以在55分钟时间中递送剂量体积的单一稳定速率递送,并随后在60分钟标记时开始sel-037输注(对于组群3、5和7,0.2mg/kg;对于组群4、6和8,0.4mg/kg)。
[0234]
48位对象分成8个给药组群。每个组群由6位患者组成。组群3接受sel-212
(0.05mg/kg的sel-110 0.2mg/kg的pegsiticase),组群4接受sel-212(0.05mg/kg的sel-110 0.4mg/kg的pegsiticase),组群5接受sel-212(0.08mg/kg的sel-110 0.2mg/kg的pegsiticase),组群6接受sel-212(0.08mg/kg的sel-110 0.4mg/kg的pegsiticase),组群7接受sel-212(0.1mg/kg的sel-110 0.2mg/kg的pegsiticase)和组群8接受sel-212(0.1mg/kg的sel-110 0.4mg/kg的pegsiticase)。
[0235]
对象分布
[0236]
所有招募的对象最初随机分成4个组群,使得所有4个组群在达到总共12位对象之后,每个组群包含3位对象。在完成至少一个治疗周期之后,在向所有组群开放招募之前评价对象经历。未来的招募在所有开放组群之间随机化。
[0237]
所研究药物治疗的前驱给药(premedication)
[0238]
所有对象在接受所研究药物前一晚(12h
±
2h)经口接受180mg非索非那定,并且在接受所研究药物(即,对于组群3、4、5、6、7和8,sel-110)之前2
±
1小时再次经口接受180mg非索非那定。此外,他们还在接受所研究药物之前(即,对于组群3、4、5、6、7和8在sel-110之前)1
±
0.5小时静脉内接受甲泼尼龙40mg(或等效药物,例如泼尼松50mg iv或地塞米松8mg iv)。所研究药物的每次治疗给药都会发生这种情况(a部分,治疗期1-3和b部分,治疗期4和5)。组群3-6已经接受第一和第二剂量。
[0239]
痛风发作的前驱给药
[0240]
所有符合所有入选和排除标准的对象都给予用于痛风发作预防的前驱给药。该方案在第一次给予所研究药物之前1周开始,并且只要对象参加临床研究就继续进行。作为单负荷剂量给予对象1.2mg秋水仙碱。然后,他们在其参与试验的剩余部分将继续使用秋水仙碱0.6mg qd。如果存在对秋水仙碱的禁忌证,则使对象接受布洛芬600mg tid或等效剂量的nsaid。如果存在对秋水仙碱和nsaid的禁忌证,则对象不接受痛风发作的前驱给药。只要对象参加临床研究,痛风发作预防用药就持续下去。由于对秋水仙碱的禁忌证而开始接受nsaid作为痛风发作预防药物的对象只要该对象参加研究就继续接受nsaid。
[0241]
组群3、组群4、组群5、组群6、组群7和组群8的治疗持续时间
[0242]
治疗期1-a部分
[0243]
在给药之后45天内筛选对象。一旦他们符合入选/排除标准并且所有评估都被认为是可接受的,则他们就被告知何时开始他们的前驱给药(日期和药物,第-7天)以预防痛风发作。所研究药物的初始给药日指定为第0天。已被分配至组群3、4、5、6、7和8的合格对象接受sel-110(基于mg/kg的剂量)的单iv输注。sel-110通过注射器式输注泵以足以在55分钟时间中递送剂量体积的单一稳定速率递送。伴随施用sel-110,对象在60分钟中接受125ml生理盐水。在此之后(
±
3分钟)通过输注泵输注递送在60分钟中递送的稀释到100ml生理盐水中的sel-037(对于组群3、5和7,0.2mg/kg;对于组群4、6和8,0.4mg/kg)。对象在开始输注sel-110之后在诊所保持9小时以进行安全性评价和pk抽血。在治疗期1第1、7、14、21天对象返回进行pk和pd血液抽取以及治疗期1第7、14、21天对象返回进行安全性和抗体血液抽取。
[0244]
治疗期2-a部分
[0245]
在治疗期2第0天的早晨,向诊所报告对对象进行所研究药物的给药。已被分配至组群3、4、5、6、7和8的合格对象接受sel-110(基于mg/kg的剂量)的单iv输注。sel-110通过
注射器式输注泵以足以在55分钟的时间中递送剂量体积的单一稳定速率递送。伴随施用sel-110,对象在60分钟中接受125ml生理盐水。在此之后(
±
3分钟)通过输注泵输注递送在60分钟中递送的稀释到100ml生理盐水中的sel-037(对于组群3、5和7,0.2mg/kg;对于组群4、6和8,0.4mg/kg)。使对象在开始输注sel-110之后在诊所保持9小时以进行安全性评价和pk抽血。在治疗期2第1、7、14和21天对象返回进行pk和pd血液抽取以及在治疗期2第7、14和21天对象返回进行安全性和抗体血液抽取。
[0246]
治疗期3-a部分
[0247]
在治疗期3第0天的早晨,将向诊所报告对对象进行所研究药物的给药。已被分配至组群3、4、5、6、7和8的合格对象将接受sel-110(基于mg/kg的剂量)的单iv输注。sel-110将通过注射器式输注泵以足以在55分钟的时间中递送剂量体积的单一稳定速率递送。伴随施用sel-110,对象将在60分钟中接受125ml生理盐水。在此之后(
±
3分钟)将通过输注泵输注递送在60分钟中递送的稀释到100ml生理盐水中的sel-037(对于组群3、5和7,0.2mg/kg;对于组群4、6和8,0.4mg/kg)。对象将在开始输注sel-110之后在诊所保持9小时以进行安全性评价和pk抽血。在治疗期3第1、7、14和21天对象将返回进行pk和pd血液抽取以及在治疗期3第7、14和21天对象返回进行安全性和抗体血液抽取。
[0248]
治疗期4-b部分
[0249]
在治疗期4第0天的早晨,将向诊所报告对对象进行所研究药物的给药。对象将通过输注泵在60分钟中接受稀释到100ml生理盐水中的sel-037(对于组群3、5和7,0.2mg/kg;对于组群4、6和8,0.4mg/kg)的单iv输注。对象将在开始输注sel-037之后在诊所中保持9小时以进行安全性评价和pk抽血。在治疗期4第1、7、14和21天对象将返回进行pk和pd血液抽取以及在治疗期4第7、14和21天对象返回进行安全性和抗体血液抽取。
[0250]
治疗期5-b部分
[0251]
在治疗期5第0天的早晨,将向诊所报告对对象进行所研究药物的给药。对象将通过输注泵在60分钟中接受稀释到100ml生理盐水中的sel-037(对于组群3、5和7,0.2mg/kg;对于组群4、6和8,0.4mg/kg)的单iv输注。对象将在开始输注sel-037之后在诊所中保持9小时以进行安全性评价和pk抽血。在治疗期5第1、7、14和21天对象将返回进行pk和pd血液抽取以及在治疗期5第7、14和21天对象返回进行安全性和抗体血液抽取。
[0252]
结果
[0253]
当在实施例2中描述的1期中单独施用pegsiticase时,在接受所研究药物之后的第一个月中,57%(7位患者中的4位)具有痛风病史的患者具有痛风发作的迹象(表1)。然而,相比之下,当在实施例3中描述的2期试验中将包含雷帕霉素的pla/pla-peg合成纳米载体与pegsiticase伴随施用时,在具有痛风病史的对象(63位招募患者中的16位)中仅报告了一例痛风发作(表2)。该对象在仅接受含雷帕霉素纳米载体(不含尿酸酶)的组群中。由于该对象未接受尿酸酶治疗,因此该对象的血清尿酸水平未显著下降。因此,发作与血清尿酸的变化无关。另外一位预先未诊断为痛风的对象报告了治疗后发作。在药物施用之后90分钟内该患者的血清尿酸水平从8.8mg/dl降至0.1mg/dl。因此,虽然该对象在研究之前仅被诊断患有无症状的高尿酸血症,但是发作的确显示与血清尿酸下降相符合。
[0254]
表1.具有痛风病史的对象中的发作
[0255][0256]
表2.sel-212对象中的发作
[0257][0258]
已经进行了2期研究(实施例3)。该研究涉及与pegsiticase一起施用包含雷帕霉
素的pla/pla-peg合成纳米载体的多次iv输注,以评估其安全性和耐受性。将38位对象随机化并给药,其中8位对象被报告遭受痛风发作(表3)。
[0259]
表3.在治疗之后遭受痛风发作的对象
[0260][0261]
将上述对象中的发作率与pegloticase试验中的发作率进行比较。仅选择接受痛风发作预防(使用秋水仙碱或nsaid)的那些对象以匹配pegloticase对象条件。选择发作频率(每位患者每月发作的次数)作为比较发作率的量度。该量度根据试验数据涵盖2个月或2个治疗周期的事实选择;而pegloticase试验的长度从35天(sundy等,pharmacokinetics and pharmacodynamics of intravenous pegylated recombinant mammalian urate oxidase in patients with refractory gout.arthritis and rheumatism.vol.56,no.3,march 2007,pp 1021-1028)至6个月(john s.sundy,md,phd;herbert s.b.baraf,md;robert a.yood,md;等.efficacy and tolerability of pegloticase for the treatment of chronic gout in patients refractory to conventional treatmenttwo randomized controlled trials.jama.2011;306(7):711-720)而不等。选择患者每月频率以能够在试验之间进行比较。
[0262]
组群3和4由于他们被给予相同剂量的包含雷帕霉素的合成纳米载体(0.05mg/kg)而分组在一起用于该分析,并且同样地组群5和6已被分组在一起(具有剂量为0.08mg/kg的包含雷帕霉素的合成纳米载体)。在组群3和4中,已经给予19位对象总共24个治疗周期。并非所有对象都接受了所有治疗,因为某些对象在方案改变后中断。在组群5和6中,迄今为止,已经给予13位对象总共24个治疗周期。这意味着,对于接受痛风发作预防的对象,在48个治疗周期内共发生2次发作。这相当于每个治疗周期0.04次发作;换句话说,发作频率为每位患者每月0.04次发作。
[0263]
相比之下,3期pegloticase试验(john s.sundy,md,phd;herbert s.b.baraf,md;
robert a.yood,md;等.efficacy and tolerability of pegloticase for the treatment of chronic gout in patients refractory to conventional treatmenttwo randomized controlled trials.jama.2011;306(7):711-720)报告了以下:对于接受每两周pegloticase的85位患者,在前3个月内每位患者发作2-3次,并且对于接受每月pegloticase的84位患者,在前3个月内每位患者发作2.7次。这些数值分别相当于发作频率为每位患者每月0.77和0.9次发作。
[0264]
可与两种主要品牌经口降尿酸药物非布索坦和雷西纳德进行进一步比较。在3期随机化双盲多中心试验中,在52周中研究了非布索坦的安全性和效力(michael a.becker,m.d.,h.ralph schumacher,jr.,m.d.,robert l.wortmann,m.d.,patricia a.macdonald,b.s.n.,n.p.,denise eustace,b.a.,william a.palo,m.s.,janet streit,m.s.,和nancy joseph-ridge,m.d.febuxostat compared with allopurinol in patients with hyperuricemia and gout.n engl j med 2005;353:2450-2461,2005年12月8日)。该分析的比较期仅包括施用痛风发作预防的该研究前8周。在80mg/天的剂量下,255位对象中的55位需要治疗至少一次痛风发作。这相当于发作频率为每位患者每月发作至少0.22次,并且可能更高。在120mg/天的剂量下,250位对象中的90位需要治疗至少一次痛风发作,相当于发作频率至少为每位患者每月发作0.36次,并且可能更高。
[0265]
在评估雷西那德的效力和耐受性的2期随机化双盲研究中,给予对象秋水仙碱用于痛风发作预防,并在1个月中用不同剂量的雷西那德进行治疗(perez-ruiz f,sundy js,miner jn for the rdea594-203 study group,等lesinurad in combination with allopurinol:results of a phase 2,randomised,double-blind study in patients with gout with an inadequate response to allopurinol,annals of the rheumatic diseases 2016;75:1074-1080)。在该治疗期期间,在每天以200mg给药的那些中在一个月中46位患者中有10位,在每天以400mg每天给药的那些中在一个月中42位患者中有13位,以及在每天以600mg给药的那些中在一个月中48位患者中有15位报告需要治疗的痛风发作。这相当于发作频率分别为每位患者每月发作0.22、0.31和0.31次。
[0266]
概括不同药物之间发作频率以及其降低血清尿酸(sua)的效力的比较的制表数据汇编于表4中。
[0267]
表4.与其他降尿酸治疗相比每位患者每月的发作
[0268][0269]
*效力的指标。
[0270]
与所有其他药物相比,接受与pegsiticase伴随施用的含雷帕霉素纳米载体的对象的发作频率明显降低。这种意想不到的结果明显优于其他治疗。由于在开始治疗后发生反弹性发作时依从性会大大降低,这也有利于患者对降尿酸治疗剂(例如尿酸酶)的依从性(treatment of chronic gouty arthritis:it is not just about urate-lowering therapy.schlesinger n-semin.arthritis rheum.-2012年10月1日;42(2);155-65)。
[0271]
实施例4-每月给药与聚乙二醇化尿酸酶组合的含雷帕霉素的纳米载体降低了抗药物抗体的形成,导致在症状性痛风患者中产生持续的尿酸酶活性
[0272]
背景:痛风是由由于慢性高尿酸血症引起的关节中单钠尿酸盐(monosodium urate,msu)晶体的沉积引起的。长期治疗侧重于降低sua水平,从而使msu晶体溶解。
[0273]
聚乙二醇化尿酸酶是用于治疗严重慢性痛风的治疗。然而,尿酸酶受抗药物抗体(anti-drug antibody,ada)诱导的限制,这可使效力和安全性受损。sel-212是新的组合产品,其由与由pla和pla-peg(sel-110)构成的含雷帕霉素的纳米载体共施用的聚乙二醇化尿酸酶组成。sel-110被设计成通过诱导耐受性树突细胞和抗原特异性调节性t细胞来降低ada的形成。thuricase的长期治疗活性在患者中维持血清尿酸(sua)水平的持续控制中发挥作用。
[0274]
方法:将具有症状性痛风(≥1痛风石、6个月内痛风发作或痛风性关节病)和升高的sua≥6mg/dl的患者用与sel-110(0.1和0.15mg/kg)组合的固定剂量的聚乙二醇化尿酸酶(0.2mg/kg),或单独的聚乙二醇化尿酸酶(0.2或0.4mg/kg)作为对照进行治疗。患者在28天周期内输注多至5次。监测安全性、耐受性、sua、ada和尿酸酶活性。
[0275]
在本实施例中,“响应者”表示在第21天时血清尿酸值<6mg/ddl并且血清尿酸≤1mg/dl的个体(停止规则)。在本实施例中,“无响应者”是在28天给药周期期间在任何时间血清尿酸水平≥6mg/dl的对象。“最大效价”是在28天给药周期期间观察到的最大效价。
[0276]
使用夹心elisa检测抗尿酸酶抗体。将尿酸酶包被到板上,并使用抗人igg二抗检
测抗尿酸酶igg。通过荧光测定来测量尿酸酶活性。当尿酸酶将尿酸转化为尿囊素和h2o2时,添加辣根过氧化物酶并与h2o2和荧光探针接触以产生可量化的信号。
[0277]
结果:与用单独的聚乙二醇化尿酸酶治疗的6名患者相比,用28天周期x5次组合剂量的sel-110和聚乙二醇化尿酸酶治疗的46名患者的人口统计学特征为23至70岁vs.41至64岁(平均为53.6岁vs.51.8岁),男性97.8%vs.100%,并且白人73.9%vs.33.3%。基线处的平均bmi为34.5vs.38.9kg/m2。71.7%vs.100%的患者肥胖,其中确定的或症状性痛风的平均持续时间为12.5年vs.12.8年。43名sel-212患者可用于评价该分析。
[0278]
使用sel-212的大多数治疗期的最大抗体效价<1080(83.4%,111/133),而使用单独的聚乙二醇化尿酸酶的14.3%(1/7)治疗期的最大抗体效价<1080。
[0279]
对于在接受5次组合剂量的含雷帕霉素纳米载体和聚乙二醇化尿酸酶的组群中招募的患者,针对响应者和非响应者绘制了在治疗期期间观察到的平均最大抗尿酸酶效价(图10)。所有的无响应治疗期的效价≥1080(11/11)。无响应者的平均最大抗尿酸酶效价在连续治疗期中下降,并随后在治疗期4和5中没有患者的效价大于1080。
[0280]
使用单独的聚乙二醇化尿酸酶的7个给药周期的平均尿酸酶活性auc为3437mu/dl*周(图11)。对于具有5个每月剂量sel-212的组群,尿酸酶活性auc被分类为单独给药周期,最大抗尿酸酶效价高于或低于1∶1080的效价。对于最大抗尿酸酶效价大于1∶1080的给药周期,平均尿酸酶活性auc为6776mu/dl*周。对于抗尿酸酶效价小于1∶1080的治疗期,平均尿酸酶活性auc显著更高(p=0.0029),为8924mu/dl*周。数据表明尿酸酶活性auc与抗尿酸酶效价相关,并且与图10一起支持1∶1080的抗尿酸酶效价是临床上相关的。
[0281]
用单独的聚乙二醇化尿酸酶治疗的患者产生了高效价抗体,并在最初两个月内停止研究。将聚乙二醇化尿酸酶与越来越高剂量的含雷帕霉素纳米载体组合,导致在3个月时产生更好的抗尿酸酶效价,其中78%的患者在0.15mg/kg含雷帕霉素纳米载体时的效价≤1∶1080。然而,在第4个月和第5个月内在仅用聚乙二醇化尿酸酶给药的情况下,导致第5个月效价≤1∶1080的患者下降(图12a)。五个每月剂量的聚乙二醇化尿酸酶和含雷帕霉素的纳米载体导致在第5个月时效价≤1∶1080的患者百分比更高(约66%)(图12b)。
[0282]
来自所有组群的数据均用于绘制在给药周期期间针对尿酸酶活性auc达到的最大抗尿酸酶效价(图13a至13b)。图13a示出了0.2mg/kg剂量的聚乙二醇化尿酸酶,并且图13b示出了0.4mg/kg剂量的聚乙二醇化尿酸酶。该图示出了随着抗尿酸酶效价提高,尿酸酶活性auc相应地降低。
[0283]
使用来自所有组群的数据,尿酸酶活性auc显示出含雷帕霉素纳米载体剂量依赖性,其中较高的auc与较高的含雷帕霉素纳米载体剂量相关。图13c示出了0.2mg/kg剂量的聚乙二醇化尿酸酶,并且图13d示出了0.4mg/kg剂量的聚乙二醇化尿酸酶。尿酸酶auc与含雷帕霉素的纳米载体剂量之间的关系显示出在0.4mg/kg聚乙二醇化尿酸酶的剂量时更强。
[0284]
结论:通过降低ada形成,与聚乙二醇化尿酸酶组合的含雷帕霉素的纳米载体的每月给药相对于单独的聚乙二醇化尿酸酶提高了症状性痛风患者中的尿酸酶活性。当抗尿酸酶效价<1080时,患者显示出持续的尿酸酶活性,从而实现28天的治疗间隔。
[0285]
其他实施方案
[0286]
本说明书中公开的所有特征可以以任意组合进行组合。本说明书中公开的每一个特征可由用于相同、等同或类似目的的替代特征置换。因此,除非另有明确说明,否则所公
开的各特征仅为通用的一系列等同或类似特征的一个实例。
[0287]
通过以上描述,本领域技术人员可容易地确定本发明的基本特征,并且在不脱离其精神和范围的情况下,可对本发明进行多种改变和修改以使其适用于多种用途和条件。因此,其他实施方案也在权利要求书之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。