1.本发明属于血管支架技术领域,具体涉及一种肝素钠联合黄酮苷自组装药物涂层支架及其制备方法。
背景技术:
2.目前,心血管疾病作为世界范围内的头号健康杀手,占全球总死亡人数的比例接近30%。1986年,sigwart和puel首次使用不锈钢金属编制而成的支架并将其应用于临床上,这标志着介入心脏病学开始进入金属裸支架(bms)时代,该手术将金属支架送至病变处,然后通过球囊扩张技术将支架撑开,从而支撑起狭窄病变的血管。该方法虽然解决了术后血管弹性回缩、负性重构引起的再狭窄问题,但由于支架释放过程中对血管内皮细胞造成损害,使得炎症细胞向损伤处聚集,因此血管内膜增生且有新生血管的产生,从而产生了支架内再狭窄,这些发生支架内再狭窄的病人通常在半年至一年时需要再次介入治疗。
3.针对支架植入后引起的炎症反应及内膜增生所导致的再狭窄问题,药物涂层支架应运而生。药物涂层支架,即在血管内支架外涂一层药物膜进行药物持久的释放来达到治疗和预防目的。药物涂层支架主要由支架、基质和药物三部分组成。支架成分多为不锈钢、合金或生物材料;基质多选用生物相容性较好的材料,在体内随着材料的降解其携带的药物可被释放出来。
4.申请号为201510825145.x的中国专利公开了一种抗血栓血管支架及其制备方法和应用,该方案通过在人工血管中涂覆利用氧化铝水凝胶为涂层基质承载抗血栓药物而形成的载药水凝胶涂层,得到抗血栓血管支架,在该支架内,载药水凝胶涂层可以携带抗血栓药物,由于氧化铝水凝胶不降解以及人体吸收慢的特点,使药物一直被富集在支架内壁,阻止蛋白沉积,抗血栓作用持久,能够阻止血栓在支架安放或血管替换部位形成,不会引起由于基质的降解而发生的迟发性的血管再狭窄,甚至再梗阻的问题。
5.肝素是一种含有硫酸基团的粘多糖,带有强大的负电荷,具有加强抗凝血酶ⅲ灭活丝氨酸蛋白酶的作用,从而阻止凝血酶的形成,并有阻止血小板聚集等多种抗凝作用。因现在的支架均为金属材料,金属与带负电荷的血液接触可促进凝血过程,而肝素高度带负电荷,血液相容性好,能减少血栓形成,进而降低再狭窄率。
6.申请号为201710863943.0的中国专利公开了一种负载药物的血管支架及其制备方法,包括支架本体及位于支架上的药物涂层,支架涂层外表面为光滑镜面,涂层自支架本体表面向外,依次包括:第一涂层,涂层载体为多巴胺,其上接枝有肝素;第二涂层,涂层载体为plga,包含药物雷帕霉素;第三涂层;涂层载体为plga,包含药物雷帕霉素和姜黄素,三层载药涂层的设计,使得药物在支架植入后逐层释放,按照雷帕霉素、姜黄素、肝素的顺序,符合血栓、平滑肌增殖的发生趋势,且药物有效期延长,可对后续潜在的血栓和平滑肌增生起到抑制作用。
7.在上述技术方案中,通过多层涂层的设计或不同涂层基质的选择使得抗血栓药物作用在支架植入处,对支架引入引起的平滑肌增生起到了抑制作用,但上述方案中并未对
药物的释放速率进行有效的控制,同时,药物支架在植入人体后,经长时间腐蚀,材料本身会老化、降解,过早丧失力学性能,不能起到支撑血管的作用。因此,如何对药物涂层支架中负载药物的释放速率进行有效的控制及延长药物支架的使用寿命,已经成为诸多一线研究人员亟待解决的问题。
技术实现要素:
8.基于现有技术的不足,本发明的目的在于提供了一种肝素钠联合黄酮苷自组装药物涂层支架,采用多层涂层对支架表面进行修饰,提高其耐蚀性和生物相容性,延缓可降解生物支架的降解时间,并通过携带药物进行靶向性局部药物释放治疗,有效防止血管栓塞。
9.本发明还公开了该肝素钠联合黄酮苷自组装药物涂层支架的制备方法,通过层层自组装交联形成紧密多层结构,操作简单、条件温和。
10.为了实现上述目的,本发明采用的技术方案为:
11.一种肝素钠联合黄酮苷自组装药物涂层支架的制备方法,以活化后的金属基裸支架作为基体,在基体表面依次自组装生成过渡层、第一载药层、第二载药层及缓释层;所述过渡层采用盐酸多巴胺溶液浸渍而成,所述第一载药层采用含有黄酮苷的海藻酸钠溶液浸渍而成,所述第二载药层采用含有肝素钠的羟丙基壳聚糖溶液浸渍而成,所述缓释层采用生物可降解聚合物溶液浸渍而成。
12.优选地,所述肝素钠联合黄酮苷自组装药物涂层支架的制备方法,包括以下步骤:
13.步骤一,将经过清洗的金属基裸支架置于活化液中浸泡3~6分钟,取出后再次清洗、干燥,得到基体;其中,所述活化液是含有无机酸、有机酸、缓蚀剂及促进剂的混合水溶液;
14.步骤二,将盐酸多巴胺溶于三羟甲基氨基甲烷盐酸盐缓冲液中,得到盐酸多巴胺溶液;将基体置于盐酸多巴胺溶液中,避光浸渍8~15小时,取出后经水洗、干燥,得到修饰有过渡层的基体;
15.步骤三,将黄酮苷分散于水中,然后加入海藻酸钠,搅拌混合30~60分钟,得到含有黄酮苷的海藻酸钠溶液;将步骤二所得修饰有过渡层的基体置于含有黄酮苷的海藻酸钠溶液中,在搅拌的条件下,浸渍10~20分钟后干燥,再重复浸渍及干燥2~6次,得到接枝有第一载药层的基体;
16.步骤四,将肝素钠溶于水中,然后加入羟丙基壳聚糖,搅拌混合30~60分钟,静置10~30分钟,得到含有肝素钠的羟丙基壳聚糖溶液;将步骤三所得接枝有第一载药层基体置于含有肝素钠的羟丙基壳聚糖溶液中,浸渍5~10小时,取出后干燥,得到接枝有第二载药层的基体;
17.步骤五,将聚乳酸或聚乳酸共聚物加入有机溶剂中,搅拌至溶解,得到生物可降解聚合物溶液;将步骤四所得接枝有第二载药层基体置于生物可降解聚合物溶液中,浸泡1~2小时,清洗后干燥,即得。
18.优选地,步骤一中所述活化液中无机酸的浓度为1~5g/l、有机酸的浓度为5~10g/l、缓蚀剂的浓度为3~8g/l,促进剂的浓度为0.3~1g/l;其中,所述无机酸选自磷酸、硫酸、盐酸及硝酸中的一种或两种以上;所述有机酸选自柠檬酸、乳酸、酒石酸及乙酸中的一种或两种;所述缓蚀剂选用硫脲和苯并三唑;所述促进剂选自烷醇酰胺、脂肪醇聚氧乙烯
醚及十二烷基苯磺酸钠中的一种。
19.优选地,步骤二中所述三羟甲基氨基甲烷盐酸盐缓冲液中三羟甲基氨基甲烷的浓度为0.05mol/l,三羟甲基氨基甲烷盐酸盐缓冲液的ph值为7.9~8.9;三羟甲基氨基甲烷盐酸盐缓冲液中盐酸多巴胺的加入量为1.5~3.5g/l。
20.优选地,步骤三中所述含有黄酮苷的海藻酸钠溶液中黄酮苷的浓度为2~5g/l、海藻酸钠的浓度为8~12g/l。
21.优选地,步骤四中所述含有肝素钠的羟丙基壳聚糖溶液中肝素钠的浓度为5~10g/l,羟丙基壳聚糖的浓度为10~20g/l。
22.优选地,步骤五中所述有机溶剂为二氯甲烷或四氢呋喃;生物可降解聚合物溶液中聚乳酸或聚乳酸共聚物的浓度为15~50g/l。
23.优选地,步骤一及步骤五中所述清洗均采用乙醇与蒸馏水交替冲洗;步骤一至步骤五中所述干燥均采用真空干燥或氮气吹干。
24.采用上述方法制备得到的肝素钠联合黄酮苷自组装药物涂层支架。
25.进一步,所述基体上自组装涂层的总厚度为40~120μm。
26.上述制备方法中所述盐酸多巴胺(cas:62-31-7)、海藻酸钠(cas:9005-38-3)、羟丙基壳聚糖(cas:104673-29-2)、生物可降解聚合物可选用聚乳酸(cas:26023-30-3)或聚乳酸羟基乙酸共聚物(plga,cas:26780-50-7),黄酮苷可选用银杏黄酮苷(cas:481-46-9)或王不留行黄酮苷(cas:53452-16-7),均为普通市售产品。
27.所述肝素钠采用以下步骤制得:
28.(1)原料处理:取冷冻猪肺,自然解冻后用清水清洗去除内外污物和外部皮质脂肪,得到新鲜猪肺500g,将其置于搅拌机中绞成糜状,得到猪肺糜状物,加入等量的水500g和浓度为0.1%的防腐剂,充分搅拌混合均匀,得到原料液1;
29.(2)酶解提取:在原料液1中加入浓度为5~8%的naoh充分搅拌,调节原料液1的ph值为9,得到原料液2,在原料液2中加入新鲜猪胰浆作为酶解剂,加入量为原料液2实际重量的1~1.5%,搅拌均匀后升高温度至40℃,保持原料液2的ph值为7.5~8.0,温度在37~40℃,在此条件下酶解3~4h;再次加入新鲜猪胰浆,搅拌后升温至47~50℃,维持料液ph为8.0~8.5,继续酶解4~5h,酶解完成;
30.酶解完成后加入浓度为7~8%的hcl调节料液ph为5.5~6.0,升高温度至80℃,加入5%的氯化钠,充分搅拌混合均匀,升高温度至90℃保温30min,停止搅拌,趁热过滤去除杂质,得到酶解滤液;
31.待酶解滤液冷却至37℃,用稀碱液调整其ph值为9.0~9.5,过滤,向滤液中加入7~8%的hcl回调ph至9.0~9.5,再进行离子交换处理,得到酶解提取液;
32.(3)离子交换吸附:待酶解提取液冷却至室温,除去浮于液面的油脂薄片层,升高温度至45℃停止加热,在搅拌下加入离子吸附树脂,搅拌吸附处理3h后静置过滤,得到滤液;
33.对肝素进行洗脱:将吸附有肝素成分的树脂用清水漂洗、滤干,加入1.2mol/l的nacl再次进行洗涤、滤干,再次加入4mol/l的nacl进行洗脱,第一次脱液为树脂体积的1.5倍,洗3.5~4.5h;第二次脱液为树脂体积的0.5倍,洗0.5~1.5h;滤干树脂,合并洗脱液;
34.加入稀碱或酸液调节ph为10~11,搅拌30min,静置6h,虹吸出上层清液,抽干下部
沉淀物,合并清液、滤液,加入酸碱液调节其ph为6.0~6.5,加入1.5倍的95%乙醇,沉淀过夜,虹吸吸出上层清液,收集下部沉淀物,抽滤至干,经真空烘干得到猪肺肝素钠粗品;
35.(4)精制:在得到的猪肺肝素钠粗品中加入2%的nacl溶液,加热搅拌至完全溶解,加入5mol/l的naoh溶液,调节溶液ph为8.0~8.2,升高温度至78~80℃,在料液中加入0.15~0.2mol/l高锰酸钾,当紫红色不再褪色达到氧化终点,停止加入高锰酸钾,向其中加入饱和亚硫酸钠溶液至紫红色刚好退尽对料液进行过滤,当料液温度下降到37℃,再次进行过滤,在料液中加入饱和naoh溶液调节料液ph值10.5~11.0,充分搅拌,控制料液温度在25~27℃,并向其中加入3~5%的h2o2溶液,进行再次氧化,氧化时间为16~24h;
36.氧化完成后利用除菌过滤器进行过滤,在过滤液中加入盐酸调节料液ph为5.8~6.5,再向其中加入料液总量0.9倍的95%的乙醇,降低温度,在5~10℃下沉淀24h,收集沉淀物,加入nacl溶液溶解,在加入料液总量3~4倍的95%的乙醇进行沉淀,收集沉淀物,经无水乙醇脱水后利用研钵将沉淀物研细,再经丙酮脱水,利用远红外真空干燥箱在50~65℃下将研细的沉淀物烘干,得到肝素钠精品。
37.本发明所述基体采用金属基裸支架,具体可选用医用不锈钢、镍钛记忆合金或生物镁合金支架,具有良好的力学性能;通过活化液浸泡产生一定的浸蚀效果,使其表面粗糙度均匀,且无腐蚀物堆积,方便进行表面修饰。盐酸多巴胺可在较温和的条件下氧化聚合,在基体表面形成富含反应活性基团的聚合物涂层,为生物分子固定提供了平台;然后依次选择海藻酸钠为基质、黄酮苷为活性成分以及羟丙基壳聚糖为基质、肝素钠为活性成分,通过化学键依次接枝、交联形成安全稳定的三维网络结构,黄酮苷具有改善血液流变学的作用,与肝素联合使用起到了协同作用;最后采用生物可降解聚合物形成缓释层,提高了支架的安全性和耐蚀性,延缓了活性成分的释放,延长了支架的使用寿命,避免了支架在介入和留置过程中的涂层解离脱落。本发明利用层层自组装沉积形成多层涂层,操作简单、条件温和,制得的肝素钠联合黄酮苷自组装药物涂层支架不仅具有良好的生物相容性,还具有抗凝血、抗炎、促内皮等多种生物学功能。
附图说明
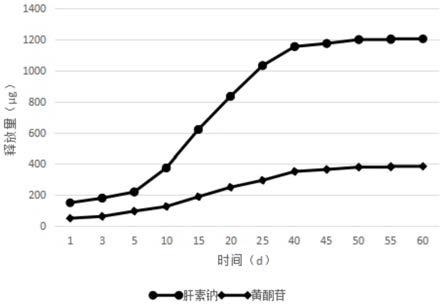
38.图1为实施例1所述肝素钠联合黄酮苷自组装药物涂层支架的肝素钠和黄酮苷释放曲线。
具体实施方式
39.为了使本发明的技术目的、技术方案和有益效果更加清楚,下面结合具体实施例对本发明的技术方案作出进一步的说明,但所述实施例旨在解释本发明,而不能理解为对本发明的限制,实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。
40.实施例1
41.一种肝素钠联合黄酮苷自组装药物涂层支架的制备方法,包括以下步骤:
42.步骤一,将3.0g磷酸、4.0g柠檬酸、3.0g乳酸、1.8g硫脲、3.6g苯并三唑、0.6g烷醇酰胺充分分散于500ml,再加水定容至1l,得到活化液;将金属基裸支架采用乙醇和蒸馏水交替冲洗,然后置于活化液中浸泡3min,取出后再用乙醇和蒸馏水交替冲洗,然后用氮气吹
干,得到基体;
43.步骤二,取50ml浓度为0.1mol/l的三羟甲基氨基甲烷溶液(tris)与14.7ml浓度为0.1mol/l的盐酸(hcl)混匀后,加水稀释至100ml,得到三羟甲基氨基甲烷盐酸盐缓冲液(tris-hcl,ph为8.5),再加入0.2g盐酸多巴胺,搅拌至溶解,得到盐酸多巴胺溶液;将基体置于盐酸多巴胺溶液中,25℃避光浸渍10小时,取出后经水洗,于85℃真空干燥,得到修饰有过渡层的基体;
44.步骤三,将0.4g王不留行黄酮苷(下简称:黄酮苷)分散于100ml水中,然后加入1.0g海藻酸钠,搅拌混合30min,得到含有黄酮苷的海藻酸钠溶液;将步骤二所得修饰有过渡层的基体置于含有黄酮苷的海藻酸钠溶液中,在搅拌的条件下,浸渍10分钟后用氮气吹干,再重复浸渍及干燥4次,得到接枝有第一载药层的基体;
45.步骤四,将0.8g肝素钠溶于100ml水中,然后加入1.5g羟丙基壳聚糖,搅拌混合40分钟,静置20min,得到含有肝素钠的羟丙基壳聚糖溶液;将步骤三所得接枝有第一载药层基体置于含有肝素钠的羟丙基壳聚糖溶液中,浸渍6h,取出后于85℃真空干燥,得到接枝有第二载药层的基体;
46.步骤五,将3g聚乳酸羟基乙酸共聚物加入100ml四氢呋喃中,搅拌至溶解,得到生物可降解聚合物溶液;将步骤四所得接枝有第二载药层基体置于生物可降解聚合物溶液中,浸泡1.5h,用乙醇和蒸馏水交替冲洗,于85℃真空干燥,即得。
47.采用上述方法制备得到的肝素钠联合黄酮苷自组装药物涂层支架。其中,所述金属基裸支架采用316l医用合金支架,长度18mm、直径2.5mm、厚度120μm,肝素钠联合黄酮苷自组装药物涂层支架的厚度约210μm。
48.上述制备方法中所述肝素钠采用以下步骤制得:
49.(1)原料处理:取冷冻猪肺,自然解冻后用清水清洗去除内外污物和外部皮质脂肪,得到新鲜猪肺500g,将其置于搅拌机中绞成糜状,得到猪肺糜状物,加入等量的水500g和浓度为0.1%的防腐剂,充分搅拌混合均匀,得到原料液1;
50.(2)酶解提取:在原料液1中加入浓度为6%的naoh充分搅拌,调节原料液1的ph值为9,得到原料液2,在原料液2中加入新鲜猪胰浆作为酶解剂,加入量为原料液2实际重量的1%,搅拌均匀后升高温度至40℃,保持原料液2的ph值为7.5,温度在40℃,在此条件下酶解3.5h;再次加入新鲜猪胰浆,搅拌后升温至50℃,维持料液ph为8.0,继续酶解4.5h,酶解完成;
51.酶解完成后加入浓度为7%的hcl调节料液ph为6.0,升高温度至80℃,加入5%的氯化钠,充分搅拌混合均匀,升高温度至90℃保温30min,停止搅拌,趁热过滤去除杂质,得到酶解滤液;
52.待酶解滤液冷却至37℃,用稀碱液调整其ph值为9.5,过滤,向滤液中加入7%的hcl回调ph至9.0,再进行离子交换处理,得到酶解提取液;
53.(3)离子交换吸附:待酶解提取液冷却至室温,除去浮于液面的油脂薄片层,升高温度至45℃停止加热,在搅拌下加入离子吸附树脂,搅拌吸附处理3h后静置过滤,得到滤液;
54.对肝素进行洗脱:将吸附有肝素成分的树脂用清水漂洗、滤干,加入1.2mol/l的nacl再次进行洗涤、滤干,再次加入4mol/l的nacl进行洗脱,第一次脱液为树脂体积的1.5
倍,洗4h;第二次脱液为树脂体积的0.5倍,洗1h;滤干树脂,合并洗脱液;
55.加入稀碱或酸液调节ph为10.5,搅拌30min,静置6h,虹吸出上层清液,抽干下部沉淀物,合并清液、滤液,加入酸碱液调节其ph为6.5,加入1.5倍的95%乙醇,沉淀过夜,虹吸吸出上层清液,收集下部沉淀物,抽滤至干,经真空烘干得到猪肺肝素钠粗品;
56.(4)精制:在得到的猪肺肝素钠粗品中加入2%的nacl溶液,加热搅拌至完全溶解,加入5mol/l的naoh溶液,调节溶液ph为8.0~8.2,升高温度至78~80℃,在料液中加入0.15mol/l高锰酸钾,当紫红色不再褪色达到氧化终点,停止加入高锰酸钾,向其中加入饱和亚硫酸钠溶液至紫红色刚好退尽对料液进行过滤,当料液温度下降到37℃,再次进行过滤,在料液中加入饱和naoh溶液调节料液ph值11.0,充分搅拌,控制料液温度在25~27℃,并向其中加入4%的h2o2溶液,进行再次氧化,氧化时间为20h;
57.氧化完成后利用除菌过滤器进行过滤,在过滤液中加入盐酸调节料液ph为6.0,再向其中加入料液总量0.9倍的95%的乙醇,降低温度,在5~10℃下沉淀24h,收集沉淀物,加入nacl溶液溶解,在加入料液总量4倍的95%的乙醇进行沉淀,收集沉淀物,经无水乙醇脱水后利用研钵将沉淀物研细,再经丙酮脱水,利用远红外真空干燥箱在60℃下将研细的沉淀物烘干,得到肝素钠精品。
58.上述肝素钠制备过程中采用的离子吸附树脂为d204树脂,在使用前进行活化的步骤如下:
59.(1)温水泡:将树脂浸泡在55℃的温水中,搅拌30min,用80目尼龙袋沥出水分,再用清水进行漂洗、滤干;
60.(2)酒精泡:将其密封浸泡在酒精中,浸泡24h,再利用80目尼龙袋沥出、沥干,其中乙醇集中收集再次利用;再用清水洗涤至乙醇完全清除,沥干水分;
61.(3)酸处理:在沥干水分的树脂中加入等量盐酸,搅拌4~6h后用80目尼龙袋沥出树脂,再用清水冲洗至ph值为7,沥干水分;
62.(4)碱处理:将沥干水分的树脂中加入等量naoh溶液,搅拌4~6h后用80目尼龙袋沥出树脂,再用清水冲洗至ph值为7,沥干水分;
63.(5)酸处理:在沥干水分的树脂中加入等量盐酸,搅拌4~6h后用80目尼龙袋沥出树脂,再用清水冲洗至ph值为7,沥干水分;将处理后的新树脂,放入nacl溶液中浸泡3~4h,即可。
64.实施例2
65.在实施例1技术方案的基础上,改变以下参数:
66.步骤二,基体在盐酸多巴胺溶液中浸渍时间改为15h;
67.步骤三,修饰有过渡层的基体在含有黄酮苷的海藻酸钠溶液中浸渍10min后干燥,再重复浸渍及干燥改为2次;
68.步骤四,接枝有第一载药层基体在含有肝素钠的羟丙基壳聚糖溶液中浸渍时间改为5h;
69.步骤五,接枝有第二载药层基体置于生物可降解聚合物溶液中浸泡时间改为1h。
70.实施例3
71.在实施例1技术方案的基础上,改变以下参数:
72.步骤二,基体在盐酸多巴胺溶液中浸渍时间改为8h;
73.步骤三,修饰有过渡层的基体在含有黄酮苷的海藻酸钠溶液中浸渍10min后干燥,再重复浸渍及干燥改为6次;
74.步骤四,接枝有第一载药层基体在含有肝素钠的羟丙基壳聚糖溶液中浸渍时间改为10h;
75.步骤五,接枝有第二载药层基体置于生物可降解聚合物溶液中浸泡时间改为2h。
76.比较例1
77.按照实施例1的技术方案,区别在于:省略步骤五;即:肝素钠联合黄酮苷自组装药物涂层支架以活化后的金属基裸支架作为基体,在基体表面依次自组装生成过渡层、第一载药层及第二载药层;不再浸渍生物可降解聚合物溶液生成缓释层。
78.比较例2
79.按照实施例1的技术方案,区别在于:省略步骤三;即:肝素钠联合黄酮苷自组装药物涂层支架以活化后的金属基裸支架作为基体,在基体表面依次自组装生成过渡层、第二载药层及缓释层;不再浸渍含有黄酮苷的海藻酸钠溶液生成第一载药层。
80.下面对实施例1~3所制备的肝素钠联合黄酮苷自组装药物涂层支架进行性能检测。
81.1.亲疏水性
82.以去离子水为测试介质,采用液滴法测量实施例1~3所制备的肝素钠联合黄酮苷自组装药物涂层支架与去离子水的接触角,为了减小实验误差每组样品各选取三个平行样来进行测试,结果如表1所示。
83.表1肝素钠联合黄酮苷自组装药物涂层支架接触角测试结果
[0084][0085]
由表1可见,实施例1~3所制备的肝素钠联合黄酮苷自组装药物涂层支架均表现出很好的疏水性能。由于亲水性材料表面有利于细胞的粘附生长,而疏水性材料表面容易吸附各种蛋白质,不利于细胞的生长。因此,本发明制备的肝素钠联合黄酮苷自组装药物涂层支架表面良好的疏水性能将有效的抑制细胞的生长,提高抗血栓性能。
[0086]
2.药物释放曲线
[0087]
(1)肝素钠释放行为研究
[0088]
用蒸馏水分别配制2μg/ml、4μg/ml、6μg/ml、8μg/ml、10μg/ml、12μg/ml和14μg/ml的肝素钠标准溶液。取各个浓度的肝素钠标准溶液2.5ml,然后分别和等体积的甲苯胺蓝溶液振荡5min混合,再加入5ml的正己烷,继续振荡5min以萃取出水相中的络合物,静置分层。取水相在620nm处进行紫外可见分光测定,得到吸光度值。以肝素钠浓度为横坐标,以吸光度值为纵坐标,绘制肝素钠标准曲线。
[0089]
37℃条件下,将实施例1制备的肝素钠联合黄酮苷自组装药物涂层支架放在5ml pbs溶液(ph=7.4)中进行溶释,每隔一段时间取样(3ml)测试肝素钠浓度,同时补回3ml pbs溶液。经测试、统计,肝素钠的释放量结果如图1所示。
[0090]
(2)黄酮苷释放行为研究
[0091]
用甲醇pbs溶液(体积比pbs:甲醇=9:1)配制1μg/ml、2μg/ml、3μg/ml、4μg/ml、5μg/ml、6μg/ml及7μg/ml的黄酮苷标准溶液。将不同浓度的黄酮苷溶液在260nm测定吸光度值,以黄酮苷浓度为横坐标,以吸光度值为纵坐标,绘制黄酮苷标准曲线。
[0092]
37℃条件下,将实施例1制备的肝素钠联合黄酮苷自组装药物涂层支架放在5ml上述配制的甲醇pbs溶液中进行溶释,每隔一段时间取样(3ml)测试黄酮苷浓度,同时补回3ml甲醇pbs溶液。经测试、统计,黄酮苷的释放量测试结果如图1所示。
[0093]
由图1可知,经过50天后肝素钠接近完全释放,黄酮苷经过50天的持续释放后,最终的释放量约为380μg,说明肝素钠和黄酮苷可在这个体系中保持稳定的释放。
[0094]
3.溶血率测试
[0095]
配制2%红细胞悬浊液:取抗凝的新鲜兔全血以3000r/min的速度离心10min,倒去上清液得到红细胞的悬浊液,并用生理盐水将其离心洗涤2次,将最后得到的红细胞悬浊液和生理盐水按体积比1:49混合。将实施例1~3及对比例1制备的涂层支架作为样品,分别放入干净的离心管中,并向其中分别加入2.5ml 2%红细胞悬浊液和2.5ml生理盐水,另外阴性对照实验采用2.5ml红细胞悬浊液和2.5ml生理盐水来测定吸光度值,阳性对照实验采用2.5ml 2%红细胞悬液,2.0ml生理盐水和0.5ml蒸馏水来测定吸光度值。将上述待测试样放入37℃恒温箱中培养1h,培养结束后,将各试验样品于离心机中以2500r/min的速度离心5min,取上清液并用分光光度计在545nm波长处测定吸光度值(od),计算公式如下:
[0096]
溶血率(%)=(od样品-od阴性)/(od阳性-od阴性)
×
100%。
[0097]
经测试、计算,样品的溶血率结果如表2所示。
[0098]
表2样品溶血率结果
[0099][0100]
由表2可以看出,实施例1~3所制备的肝素钠联合黄酮苷自组装药物涂层支架的溶血率均在1.2%以下,表明制备的样品均具有良好的血液相容性,对红细胞的破坏程度很低,符合生物材料的安全标准。
[0101]
4.血小板粘附测试
[0102]
将实施例1~3及对比例1、2制备的样品作为待测样品,将兔全血在离心机中以1500r/min的速度下离心15min,取上清富血小板血浆(prp);吸取200μl prp滴在待测样品的表面,37℃下培育1h后,用pbs溶液清洗,并用2.5%戊二醛溶液将试样固定1h,固定后的样品分别用50%、60%、70%、80%、90%、95%的乙醇逐级脱水,最后在空气中干燥,观察干燥后的试样,发现在对比例1制备的样品的表面粘附有一些血小板,但未发生变性;对比例2制备的样品的表面有血小板粘附,并且血小板已经长出伪足,开始发生团聚现象;实施例1~3表面均没有观察到血小板的粘附。结果表明实施例1~3制备的肝素钠联合黄酮苷自组装药物涂层支架可以降低血小板的团聚和粘附现象,起到更好地生物学效果。
[0103]
综上可见,实施例1~3制备的肝素钠联合黄酮苷自组装药物涂层支架可以减少凝血、溶血现象的发生,血液相容性好。另外,本发明可以生物镁合金支架为基体,利用本发明所述肝素钠联合黄酮苷自组装药物涂层支架的制备方法,对镁合金表面进行修饰并搭载肝
素钠协同黄酮苷的缓释,不仅延长了镁合金支架的降解时长,还可增加支架的生物相容性,抑制内膜增生、促进早期血管再内皮化;在完成对血管的机械支撑作用后,自行降解消失,避免置入物对人体的长期异物影响。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。