1.本发明涉及杂交水稻选育技术领域,具体涉及一种水稻柱头大小的调查方法。
背景技术:
2.杂交稻的成功研发与推广是我国乃至世界水稻生产史上的巨大突破,可使水稻产量增产15-20%以上。然而杂交稻制种产量低、制种成本高一直是杂交稻在生产上大面积推广的限制因素。加之近年来农村劳动力向城市的大量转移,使得原本人工需求量大的杂交稻制种迫切需要朝着高制种产量、高效率、高效益的技术方向发展。
3.杂交稻的制种过程是通过不育系与恢复系的异交结实来实现的,三系杂交稻不育系的繁种也要通过不育系与保持系的异交来完成。因此,不育系的花器性状和开花习性直接影响杂交稻制种产量。研究表明,影响杂交稻制种产量的不育系的花器性状包括柱头外露率、柱头大小、柱头活力、花柱长、颖花长、颖花长宽比等;其中,柱头外露率与柱头长度呈显著正相关。由于柱头外露率易受开花期环境条件的影响如温度、湿度、降雨等的影响,在操作上还会受不同实验者取样、计数等操作习惯的影响,从而导致季节之间、实验人员之间的重复结果的稳定性不易控制。相对而言,柱头结构的发育过程则更稳定、表型更易准确测量,鉴定大柱头种质资源将有利于开展水稻柱头外露率与异交结实率的育种改良。因此,水稻的大柱头性状的资源发掘与育种应用成为杂交稻制种中对不育系异交能力改良的关键。
4.其中,水稻柱头为二裂柱头,包括毛刷部分和非毛刷部分。在水稻柱头性状的遗传与分子育种研究中对柱头大小的测量是表型调查的重要环节。目前不同研究者对水稻柱头性状的取样及调查方法存在操作差异。一是取样时间的差异:liu et al(2015)及dang et al(2020)均是在水稻盛花期从主茎穗上取正在开放的颖花,一般取样时间集中在上午10:00-12:00,但是10:00-12:00是开花集中时间,不易进行大量材料的取样。二是柱头保存方法的差异:李海彬等(2010)取盛开颖花放于faa固定液(5%福尔马林、5%冰醋酸、90%的50%乙醇)进行固定,固定一个月后再在双目解剖镜下解剖;liu et al(2015)取颖花保存于醋酸与酒精1:3的溶液中;吴健(2017)随机选取中部开花的穗放于4℃冰箱保存;jiang et al(2020)取颖花保存于38%甲醛、乙酸、50%乙醇和甘油的固定液中;dang et al(2020)则取小花于装有水的离心管中,上述保存方法的不足在于不能最大程度保证柱头原有形态,也不能统一待测量颖花的发育时期,易导致测量值出现偏差,且费时费力,不易大量取样。经申请者试验,用70%酒精固定保存颖花,然后解剖柱头进行测量,发现会导致由于液体渗透等引起的柱头毛刷部分粘连、皱缩及柱头变软,导致测量不准确。三是柱头测量方法的差异:李海彬等(2010)是在双目解剖镜下解剖,取出雌蕊在载玻片上滴一滴水,将雌蕊放于水中,加盖玻片,于显微镜下用显微测量尺进行测量,每个雌蕊只测二裂柱头的一裂长度值,此方法制片与观察效率低,不适合大量材料的集中取样观察。
技术实现要素:
5.本发明的目的在于避免现有技术中的不足之处而提供一种水稻柱头大小的调查
方法,该调查方法能准确且高效地测量水稻柱头大小。
6.为实现上述目的,本发明提供以下技术方案:
7.提供一种水稻柱头大小的调查方法,包括以下步骤,
8.s1、在水稻盛花期的上午9:00之前或下午3:00之后于田间采集水稻穗,每个植株选取当日已开花1/3的主穗,使主穗留有茎秆;采用湿润的纸张包裹所述主穗,将主穗带回实验室,将主穗的茎秆插在水中进行保鲜,穗子不能浸泡在水中;
9.s2、按单株取颖花,在每穗中选取即将开放的成熟颖花,将颖花放于洁净平台中用剪刀剪断颖花的基部,左手用镊子压住内颖的边缘,右手用镊子将外颖剥开,使柱头露出,然后用镊子夹住子房部分将其放到载玻片上,将柱头排放在载玻片上,用镊子将柱头摆正位置;
10.s3、将载有柱头的载玻片置于leica m205fa体式显微镜下,所述体式显微镜连接计算机和摄像头,调节体式显微镜的焦距和光照亮度,使柱头能清晰可见,打开optec数码相机软件并设置标尺,拍照保存;
11.s4、将图像输入image-pro plus软件,人工操作软件从而测量单个柱头的毛刷长度、非毛刷长度、柱头宽度以及花柱长度,完成测量。
12.在一些实施方式中,所述s1中,所述茎秆的长度是20cm~35cm。
13.在一些实施方式中,所述纸张是报纸和/或滤纸。
14.在一些实施方式中,所述洁净平台是培养皿。
15.在一些实施方式中,所述s3中,所述标尺设置为1000μm。
16.在一些实施方式中,所述s4中,人工操作image-pro plus软件的流程包括“文件—打开图像—打开标尺—插入单位标尺—设置参数—打开图片—逐一测量柱头各部分—导出文档—保存”。
17.本发明一种水稻柱头大小的调查方法的有益效果:
18.(1)本发明的水稻柱头大小的调查方法采用当日活体颖花进行解剖,其与传统的颖花固定后再解剖测量的操作相比,或与传统用清水浸泡颖花后再解剖测量的操作相比,本发明的活体可以更好的保持柱头原有鲜活形态,不存在因液体渗透等引起的柱头毛刷部分粘连、皱缩及柱头变软等导致的操作上的困难,并减小了测量误差。
19.(2)本发明的水稻柱头大小的调查方法在盛花期上午9:00之前或下午3:00之后取样,其与在盛花期(10:00-12:00)取样相比,本发明的取样时间相对宽松,可以大量取样,且避免10:00-12:00的时间段因开花时散粉导致的大量花粉粒散落在柱头毛刷上而影响测量的现象。
20.(3)本发明的水稻柱头大小的调查方法先解剖、在体视显微镜下即时观察、拍照、电脑保存照片,随后由多人、多时间段在不同电脑上的测量,与在显微镜下解剖的同时用显微测量尺测量相比,本发明的测量方式提高了效率,节省了时间,效果更好。
附图说明
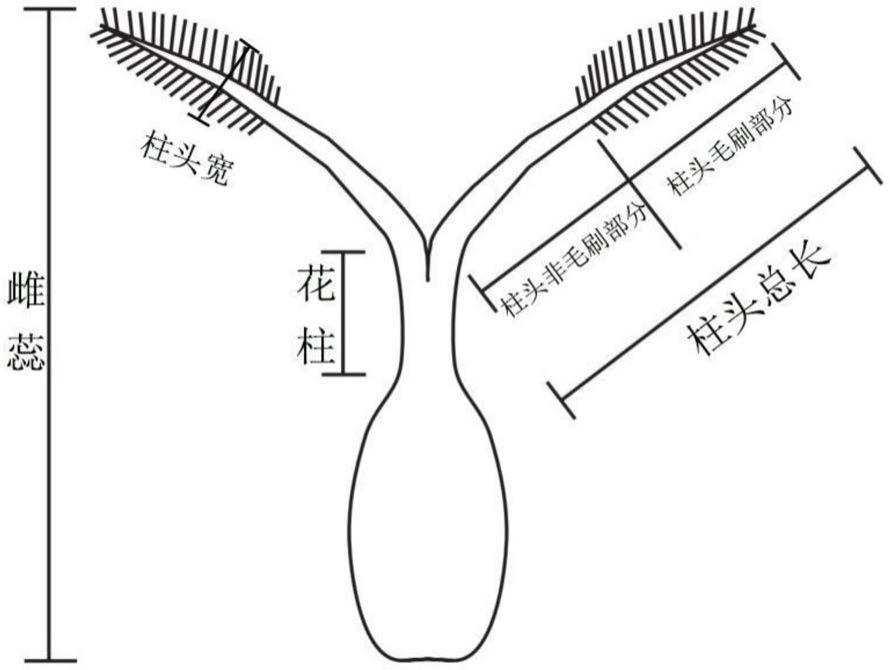
21.图1是实施例的水稻柱头性状测量示意图。
22.图2是实施例的水稻盛花期主穗的图片。
23.图3是实施例的主穗插在水中的图片。
24.图4是实施例的解剖工具。
25.图5是实施例的颖花解剖的操作过程图片。
26.图6是实施例的柱头整齐排列在载玻片上的图片。
27.图7是柱头形态图。
28.图8是实施例的在image-pro plus软件中测量柱头大小的界面图。
具体实施方式
29.以下结合具体实施例和附图对本发明进行详细说明。
30.实施例1
31.提供一种水稻柱头大小的调查方法,包括以下步骤,
32.s1、在水稻盛花期的上午9:00之前或下午3:00之后于田间采集水稻穗,图2所示,在每个植株中选取当日已开花1/3的主穗,使主穗留有茎秆;图3所示,采用湿润的纸张包裹所述主穗,将主穗带回实验室和将主穗的茎秆插在水中进行保鲜,穗子不能浸泡在水中;
33.s2、图4-图6所示,按单株取颖花,在每穗中选取即将开放的成熟颖花,将颖花放于洁净平台中用剪刀剪断颖花的基部,左手用镊子压住内颖的边缘,右手用镊子将外颖剥开,使柱头露出,然后用镊子夹住子房部分将其放到载玻片上,将柱头排放在载玻片上,用镊子将柱头摆正位置;
34.s3、将载有柱头的载玻片置于leica m205fa体式显微镜下,所述体式显微镜连接计算机和摄像头,调节体式显微镜的焦距和光照亮度,使柱头能清晰可见,打开optec数码相机软件并设置标尺,进行拍照保存;
35.s4、将图像输入image-pro plus软件,人工操作所述图像分析测量软件从而如图8所示,测量单个柱头的毛刷长度、非毛刷长度、柱头宽度以及花柱长度,完成测量,其中图1示出了单个柱头的毛刷长度、非毛刷长度、柱头宽度以及花柱长度的测量位置。
36.本实施例中,所述s1中,所述茎秆的长度是20cm~35cm,优先地,所述茎秆的长度是30cm。
37.本实施例中,所述纸张是报纸和/或滤纸。
38.本实施例中,所述洁净平台是培养皿。
39.本实施例中,所述s3中,所述标尺设置为1000μm。
40.本实施例中,所述s4中,人工操作image-pro plus软件的流程包括“文件—打开图像—打开标尺—插入单位标尺—设置参数—打开图片—逐一测量柱头各部分—导出文档—保存”。
41.实施例2
42.短舌野生稻柱头大小调查结果稳定性的鉴定
43.供试材料说明:在2016-2017年四个季节中鉴定出了有大柱头性状的数量性状位点qtl的单片段代换系材料sssls,在此基础上,2018-2019年四个季节选取了7个有重叠片段的sssls(其中4个携带此qtl)进行代换作图,以对其进行qtl验证,并在2020年早晚季进行再次验证。
44.其中,柱头大小的调查方法包括以下步骤:
45.取样:在水稻盛花期的上午9:00之前或下午3:00之后于田间取样,每个sssl及华
粳籼74(hjx74)各选取正常生长的单株6株,每株取当日已开花1/3的主穗,用湿润的报纸或滤纸包裹,带回实验室内,将主穗插在盛水的小桶中。
46.解剖:按单株取颖花,每穗选取次日即将开放的成熟颖花5朵,放于培养皿中,首先用小剪刀剪断颖花的基部,但注意不要剪断柱头。而后左手用镊子压住内颖的边缘,右手用镊子将小花外颖剥开,使柱头露出,然后用镊子夹住子房部分将其放到载玻片上,将5个颖花的柱头整齐排放在载玻片上,用镊子将柱头摆正位置。
47.拍照:将载有柱头的载玻片置于leica m205fa体式显微镜下,所述体式显微镜连接计算机和摄像头,调节体式显微镜的焦距和光照亮度,使柱头能清晰可见,打开optec数码相机软件并设置标尺,进行拍照保存。
48.测量:将图像输入image-pro plus图像分析测量软件,利用image-pro plus测量软件测量柱头各部分,图1所示,包括每个柱头的柱头毛刷长度、柱头非毛刷长度、柱头宽度以及花柱长度,其中柱头总长是指从水稻的花柱与柱头的交界处至柱头顶端的长度,具体的测量流程是:打开image-pro plus测量软件,点击“文件-打开图像-打开标尺-插入单位标尺-设置参数-打开测量-逐一测量柱头各部分-导出文档-保存”,即完成测量。每个材料共测量30个颖花的柱头毛刷长和柱头总长,取平均值作为该材料的性状值。
49.其中,柱头毛刷长度、柱头非毛刷长度、柱头宽度和柱头总长度的计算方法如下:
50.l
柱头毛刷长度
=(l
左毛刷长度
l
右毛刷长度
)/2
51.w
柱头宽度
=(w
左柱头宽
w
右柱头宽
)/2
52.l
柱头非毛刷长度
=(l
左非毛刷长度
l
右非毛刷长度
)/2
53.l
柱头总长度
=l
柱头毛刷长度
l
柱头非毛刷长度
。
54.结果:
55.7个sssls在2018年-2020年的6个季节的柱头性状调查结果见表1、表2。
56.表1 sssls多季节柱头毛刷长测量数据 单位:mm
57.材料2018早季2018晚季2019早季2019晚季2020早季2020晚季平均值hjx741.29
±
0.081.32
±
0.081.23
±
0.061.24
±
0.051.30
±
0.071.33
±
0.061.29
±
0.03sssl11.29
±
0.091.41
±
0.11**1.25
±
0.051.27
±
0.091.30
±
0.071.37
±
0.081.32
±
0.05sssl21.58
±
0.15**1.51
±
0.07**1.51
±
0.09**1.53
±
0.04**1.50
±
0.08**1.60
±
0.10**1.54
±
0.04**sssl31.22
±
0.071.17
±
0.22**1.22
±
0.081.22
±
0.071.21
±
0.06**1.33
±
0.111.23
±
0.05sssl41.55
±
0.10**1.54
±
0.13**1.51
±
0.12**1.65
±
0.09**1.42
±
0.10**1.67
±
0.13**1.56
±
0.08**sssl51.61
±
0.12**1.51
±
0.09**1.54
±
0.10**1.51
±
0.04**-1.63
±
0.10**1.56
±
0.05**sssl61.48
±
0.10**1.56
±
0.08**1.48
±
0.10**1.56
±
0.06**1.55
±
0.08**1.56
±
0.09**1.53
±
0.03**sssl70.95
±
0.141.22
±
0.071.17
±
0.091.18
±
0.071.24
±
0.061.25
±
0.071.17
±
3.09
58.注:**表示在0.01水平上,每个季节内sssl与hjx74存在显著差异。
59.表2 sssls多季节柱头总长测量数据 单位:mm
60.材料2018早季2018晚季2019早季2019晚季2020早季2020晚季平均值hjx741.89
±
0.091.95
±
0.091.88
±
0.091.89
±
0.081.84
±
0.211.91
±
0.091.89
±
0.03sssl11.93
±
0.112.04
±
0.131.95
±
0.081.94
±
0.111.92
±
0.492.08
±
0.111.98
±
0.06sssl22.17
±
0.22**2.01
±
0.082.17
±
0.14**2.09
±
0.07**2.23
±
0.11**2.18
±
0.162.14
±
0.08sssl31.82
±
0.081.76
±
0.24**1.95
±
0.141.85
±
0.091.94
±
0.351.98
±
0.13**1.88
±
0.08sssl42.12
±
0.11**2.10
±
0.16**2.15
±
0.17**2.30
±
0.09**2.16
±
0.70**2.35
±
0.17**2.20
±
0.09**sssl52.21
±
0.17**2.08
±
0.10**2.26
±
0.12**2.21
±
0.06**-2.35
±
0.102.22
±
0.09sssl62.02
±
0.11**2.11
±
0.12**2.05
±
0.14**2.08
±
0.08**2.15
±
0.51**2.04
±
0.122.08
±
0.04**sssl71.60
±
0.181.84
±
0.091.82
±
0.131.68
±
0.101.95
±
0.691.91
±
0.041.80
±
0.12
61.注:**表示在0.01水平上,每个季节内sssl与hjx74存在显著差异。
62.如表1所示,对于柱头毛刷长而言,sssls及hjx74在多季节的性状值稳定,其中4个sssls(表1中的sssl2,sssl4,sssl5,sssl6)柱头毛刷长显著大于hjx74,3个sssls(sssl1,sssl3,sssl7)的柱头毛刷长与hjx74无显著差异。通过7个sssls的代换作图,认为在4个sssls(sssl2,sssl4,sssl5,sssl6)代换片段的重叠区间存在控制柱头毛刷长性状的qtl。
63.如表2所示,对于柱头总长度而言,sssls及hjx74在多季节的性状值稳定,其中4个sssls(表1中的sssl2,sssl4,sssl5,sssl6)柱头总长显著大于hjx74,3个sssls(sssl1,sssl3,sssl7)的柱头总长与hjx74无显著差异。通过7个sssls的代换作图,认为在4个sssls(sssl2,sssl4,sssl5,sssl6)代换片段的重叠区间存在控制柱头总长的qtl。
64.总之,7个sssls及hjx74的柱头毛刷长和柱头总长在6个季节的测量结果稳定,其中sssl2、sssl4、sssl5、sssl6的性状值均显著大于hjx74,说明此4个sssls携带有控制柱头毛刷长和柱头总长的qtl,并通过代换作图实现qtl初步定位。上述结果显示,明本技术方法可以实现多人、多季取样、解剖及测量计算,获得稳定可靠的实验结果。
65.实施例3
66.短舌野生稻柱头毛刷长qtl定位
67.供试材料:2018早晚季利用长柱头单片段代换系sssl6,与受体亲本hjx74杂交,构建f2群体,2019年早季种植f2群体174株,进行连锁分析;2019年早晚季利用4000株f2单株筛选交换株以进行qtl精细定位。
68.取样:在水稻盛花期的上午9:00之前或下午3:00之后于田间取样,sssl6及hjx74选取正常生长的单株6株,f2群体每单株取主穗。每株取当日已开花1/3的主穗,用湿润的报纸或滤纸包裹,带回实验室内,将主穗插在盛水的小桶中。
69.解剖:按单株取颖花,sssl及hjx74每穗选取次日即将开放的成熟颖花5朵,f2群体每穗选取次日即将开放的成熟颖花12朵,放于培养皿中,首先用小剪刀剪断颖花的基部,但注意不要剪断柱头。而后左手用镊子压住内颖的边缘,右手用镊子将小花外颖剥开,使柱头露出,然后用镊子夹住子房部分将其放到载玻片上,将柱头整齐排放在载玻片上,用镊子将柱头摆正位置。
70.拍照:将载有柱头的载玻片置于leica m205fa体式显微镜下,所述体式显微镜连接计算机和摄像头,调节体式显微镜的焦距和光照亮度,使柱头能清晰可见,打开optec数码相机软件并设置标尺,进行拍照保存。
71.测量:利用image-pro plus测量软件,测量柱头各部分,包括每个柱头的毛刷长、非毛刷长、柱头宽以及花柱长(如图1所示),其中柱头总长是指从水稻的花柱与柱头的交界处至柱头顶端的长度。具体的测量流程是:打开image-pro plus测量软件,点击“文件—打开图像—打开标尺—插入单位标尺—设置参数—打开测量—逐一测量柱头各部分—导出文档—保存”,即完成测量。sssl6、hjx74及交换株系各测量6株30个颖花的柱头毛刷长,取平均值作为该材料的性状值。f2单株各取12个颖花的柱头毛刷长,取平均值作为该单株的性状值。
72.计算方法:
73.l
柱头毛刷长度
=(l
左毛刷长度
l
右毛刷长度
)/2
74.结果:通过qtl icimapping软件对f2群体174个单株进行柱头毛刷长与标记的连
锁分析,分析表明,lod值达到24.44,将qtl初步定位在了6号染色体上标记da6和rm253之间,该区间长约328kb,命名为qspbl6-1。随后通过对4000株f2单株筛选交换株,获得11个不同类型的交换株系构成的次级单片段代换系,通过表型与基因型分析,利用代换作图法将qspbl6-1定位在了46kb的区间内,完成了qtl精细定位,便于后续进行基因克隆研究。此研究证明利用该方法取样、解剖及测量,可以进行水稻柱头长度的qtl定位研究,并取得稳定的实验结果。
75.最后应当说明的是,以上实施例仅用以说明本发明的技术方案,而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细地说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。