动物双歧杆菌乳亚种bla80在制备抗轮状病毒感染致腹泻的药物或食物中的应用
技术领域
1.本发明属于微生物技术领域,具体涉及动物双歧杆菌乳亚种 (bifidobacterium animalis subsp.lactis)bla80在制备抗轮状病毒感染致腹泻的药物或食物中的应用。
背景技术:
2.腹泻(diarrhea)作为最常见的消化系统疾病之一,按病程长短,可分为急性腹泻和慢性腹泻两类。急性腹泻发病急剧,病程在2~3周之内,大多系感染引起。慢性腹泻指病程在两个月以上或间歇期在2~4周内的复发性腹泻,发病原因更为复杂,可为感染性或非感染性因素所致。在急性腹泻中,轮状病毒 (rotavirus,rv)是一种常见的感染源,rv主要于每年的11月份至来年5月份侵袭5岁以内的儿童,是秋冬季引起小儿腹泻的主要原因之一。几乎所有儿童在5岁以前都受到过轮状病毒感染。据统计,全球每年约有1.11-1.35亿例轮状病毒腹泻病例,导致数十万名婴儿死亡。
3.对于疾病而言,一般预防效果会好于治疗效果,特别是病毒性疾病,rv感染也不例外,例如注射疫苗是预防病毒感染一个通用手段。cn112724207a公开了一种截短的轮状病毒vp4蛋白、编码序列、制备方法、包含所述蛋白的药物组合物和疫苗,所述vp4蛋白、药物组合物和疫苗可用于预防、减轻或治疗轮状病毒腹泻。然而由于病毒的遗传变异,有效的疫苗保护往往受到影响。
4.cn110623948a公开了一种dyngo-4a和/或dynasore在制备抗轮状病毒感染致腹泻的药物中的应用。所述dyngo-4a和dynasore两种小分子化合物可以有效抑制轮状病毒的感染和复制,可用于制备抗轮状病毒感染致腹泻的药物。但其对细胞存在一定的毒副作用,不适合长期使用。
5.cn108850397a公开了一种止腹泻的益生菌凝胶糖果,所述益生菌凝胶糖果包含益生菌冻干粉组合物,所述益生菌冻干粉组合物至少包含植物乳杆菌冻干粉和动物双歧杆菌乳亚种冻干粉。所述益生菌凝胶糖果安全无毒副作用,携带方便,各原料配合科学,能够改变肠道微生物的组成,平衡肠道菌群,改善肠道健康,从而达到预防和治疗腹泻的作用。
6.基于以上研究可以看到,益生菌具有无毒、无抗药性且适合长期使用的优点,能够广泛用于rv感染腹泻的预防和治疗。但目前关于益生菌抗rv活性的研究仍处于早期阶段,有待进一步的探究,从而拓宽益生菌在病毒性疾病中的应用前景。
技术实现要素:
7.针对现有技术的不足和现实实际的需求,本发明的目的在于提供动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80在制备抗轮状病毒感染致腹泻的药物或食物中的应用。所述动物双歧杆菌乳亚种(bifidobacteriumanimalis subsp.lactis)bla80在体外能抑制轮状病毒对细胞的侵染和增殖,可以有效缓解轮状病毒感染导致的腹泻症状。
subsp.lactis) bla80或动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80与保护剂的组合物。
24.优选地,所述保护剂包括乳化剂、多糖和甘油。
25.优选地,所述乳化剂包括脱脂乳。
26.优选地,所述多糖包括海藻糖和/或蔗糖。
27.本发明中,所述抗轮状病毒感染致腹泻的食物包括固体饮料、发酵乳或发酵果蔬中的任意一种。
28.相对于现有技术,本发明具有以下有益效果:
29.本发明所涉及的动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis) bla80无毒副作用、无免疫应激且无耐药性,具有优良的抗轮状病毒感染作用,将该菌种用于制备抗轮状病毒感染致腹泻的药物或食物,对有效预防和缓解轮状病毒引起的腹泻症状具有重要意义。
附图说明
30.图1为本发明涉及的动物双歧杆菌乳亚种(bifidobacterium animalis subsp. lactis)bla80菌悬液预处理组轮状病毒的增殖结果图;
31.图2为本发明涉及的动物双歧杆菌乳亚种(bifidobacterium animalis subsp. lactis)bla80菌悬液与轮状病毒同时接入组轮状病毒的增殖结果图;
32.图3为本发明涉及的动物双歧杆菌乳亚种(bifidobacterium animalis subsp. lactis)bla80菌悬液在轮状病毒感染后接入组轮状病毒的增殖结果图;
33.图4为本发明涉及的病毒对照组轮状病毒的增殖结果图;
34.图5为本发明涉及的正常细胞对照组轮状病毒的增殖结果图;
35.图6为本发明涉及的各组乳鼠血清炎症因子tnf-α的含量结果图;
36.其中,a,b之间的统计值p《0.01,p《0.01表明二者具有极显著差异;
37.图7为本发明涉及的各组乳鼠血清免疫调节因子ifn-γ的含量结果图;
38.其中,a,b之间统计值p《0.01,a,c之间统计值p《0.01,b,c之间统计值 p《0.01,p《0.01表明二者具有极显著差异。
具体实施方式
39.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
40.下述制备例和实施例中相应材料与原料的来源如下:
41.其中;恒河猴肾细胞ma-104购自通派(上海)生物科技有限公司;人小肠上皮细胞fhs 74int购自武汉普诺赛生命科技有限公司;人轮状病毒wa株(hwa)购自美国模式培养物集存库(american type culture collection,atcc);乳鼠购自上海斯莱克实验动物有限公司;动物双歧杆菌乳亚种(bifidobacteriumanimalis subsp.lactis)bla80为保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏时间为2018年3月5日,保藏编号为cgmcc no.15410 的菌种。其余材料和原料,无特殊说明,均可从商业途径获得。
42.制备例1
43.本制备例提供一种动物双歧杆菌乳亚种(bifidobacterium animalis subsp. lactis)bla80菌悬液,其制备方法如下:
44.挑取平板复壮的动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis) bla80单菌落接种于10ml tpy液体培养基,37℃厌氧培养12h,活化后的菌液以2%的接种量接种于100ml tpy液体培养基中,37℃厌氧培养12h,4℃下 5000g离心10min,取离心后的菌体沉淀,用无菌pbs缓冲溶液重悬,调整菌悬液浓度为109cfu/ml,得到所述动物双歧杆菌乳亚种(bifidobacterium animalissubsp.lactis)bla80菌悬液,4℃保存备用。
45.实施例1
46.本实施例对制备例1得到的动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80菌悬液进行细胞毒性的测定,具体步骤如下:
47.培养小肠上皮细胞:将fhs 74int细胞用添加10%胎牛血清(fatal bovine serun,fbs)的dmem培养基培养,在37℃,5%co2的条件下培养48h进行传代,传代时用0.25%的胰蛋白酶消化约10min。具体步骤如下:
48.将细胞贴壁,用滴管或移液管吸去培养器皿中的旧培养液,随后用pbs溶液洗去残留的旧培养基;向瓶内加入1.5ml消化液(0.25%胰蛋白酶)轻轻摇动培养瓶,使消化液流遍所有细胞表面,随后在倒置显微镜下观察,当细胞收回突起变圆或细胞间隙增大后,吸除或倒掉消化液,加入含血清的新鲜培养液,终止消化,用移液管吸取瓶内培养液,反复吹打消化好的细胞使其脱壁并分散形成细胞悬液,随后计数并分装到新培养瓶中,并补加含血清的新鲜培养液,盖上瓶盖,适度拧紧后再稍回转,以利于co2气体的进入,将培养瓶放回co2培养箱。
49.毒性测定:在96孔板中接种得到的fhs 74int细胞悬液,培养至长出单层细胞。取动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80菌悬液,分别稀释成107cfu/ml、108cfu/ml、109cfu/ml三个梯度,每个梯度各做一纵排,每孔加入100μl不同浓度菌悬液,于37℃,5%co2培养箱中孵育 90min;孵育后弃掉孵育液用pbs缓冲溶液洗涤一次后加入dmem细胞维持液继续培养,同时设立空白对照组,每天观察细胞病变(cytopathic effect,cpe) 情况,当病毒对照组细胞cpe达到80%以上时,用mtt法测定细胞活性。细胞毒性按照下列方式计算:
50.细胞毒性=(对照组od
570
-处理组od
570
)/对照组od
570
×
100%;
51.其中,od
570
为570nm波长处的吸光值。
52.测试结果统计如下表1所示:
53.表1
54.[0055][0056]
由上表数据可知,107cfu/ml组、108cfu/ml组和109cfu/ml组的od
570
值大于对照组od
570
值,表明三个梯度的动物双歧杆菌乳亚种(bifidobacteriumanimalis subsp.lactis)bla80菌悬液对fhs 74int细胞均没有毒性作用,甚至表现出一定程度的促生长作用,其中,108cfu/ml组的od
570
值最高,促生长作用最强。基于此,在后续试验中选择108cfu/ml的动物双歧杆菌乳亚种 (bifidobacterium animalis subsp.lactis)bla80菌悬液测定其对轮状病毒的抑制作用。
[0057]
实施例2
[0058]
本实施例对轮状病毒进行毒力测定,以tcid
50
即半数组织培养感染剂量 (median tissue culture infective dose),指能在培养板孔或试管内引起半数细胞病变或死亡所需的病毒量,用以表征轮状病毒的滴度。
[0059]
增殖轮状病毒:恒河猴肾细胞ma104传代3次,待细胞状态稳定开始接种轮状病毒hwa株。取出轮状病毒,用1640培养液(不含血清)稀释病毒液,病毒稀释后与2μg/ml的胰蛋白酶按1:1(v/v)混合,37℃恒温培养45min。于 ma-104细胞中加入2ml培养好的轮状病毒和胰蛋白酶的混合液,随后于37℃、 5%的co2培养箱培养90min。弃去混合液,加入1640培养液(不含血清)至8 ml,并加入5μg/ml的胰蛋白酶,于37℃,5%的co2培养箱培养。逐日观察,待细胞出现80%以上的病变并有少量细胞脱落时,-80℃冰箱反复冻融3次,使细胞充分裂解病毒释放出来。收集细胞液和细胞碎片于ep管中,4℃,10000 r/min,离心5min,取上清液,用0.22μm细菌滤器过滤,-150℃冰箱冻存备用。
[0060]
采用tcid
50
测定增殖的轮状病毒液中病毒的滴度(tcid
50
/0.1ml),具体步骤如下:
[0061]
将fhs 74int细胞接入96孔板,于37℃,5%的co2恒温培养箱培养至长出单层细胞,在2ml无菌离心管中用dmem培养基将轮状病毒液连续10倍稀释至10-1
、10-2
、10-3
、10-4
、10-5
和10-6
,将稀释好的轮状病毒液接种到长有单层 fhs 74int细胞的96孔板中,每一稀释度接种一列,共接种6列,每列共8孔,每孔接种病毒量为100μl,第7列与第8列接无病毒的dmem培养基做对照,放入37℃,5%co2恒温培养箱孵育1h,随后用移液枪小心吸出轮状病毒孵育液和dmem培养基,加入100μl含2%fbs的dmem细胞维持液,于37℃, 5%co2恒温培养箱培养120h,每天观察并记录细胞病变(cytopathic effect, cpe)情况,按reed-muerch法计算轮状病毒液的tcid
50
,通过此方法得到轮状病毒的tcid
50
为10-4.72
/0.1ml。
[0062]
实施例3
[0063]
本实施例采用mtt法检测动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80菌悬液对轮状病毒的抑制率,具体步骤如下:
[0064]
在96孔板中接种fhs 74int细胞悬液,培养至长出单层细胞,随后进行实验。实验分为5组(包括处理组和对照组):第1组为动物双歧杆菌乳亚种 (bifidobacterium animalis subsp.lactis)bla80菌悬液预处理组,用动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80菌悬液预先处理细胞90 min,洗涤后以100tcid
50
/0.1ml的轮状病毒液感染细胞,于37℃,5%co2培养箱中培养90min,洗涤后继续
培养;第2组为动物双歧杆菌乳亚种 (bifidobacterium animalis subsp.lactis)bla80菌悬液与轮状病毒同时接入组,用动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80菌悬液与 100tcid
50
/0.1ml的轮状病毒液等体积混合后加入96孔板中,于37℃,5%的 co2培养箱中培养90min,弃混合液,更换正常细胞维持液继续培养;第3组为动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80菌悬液在轮状病毒感染后接入组,以100tcid
50
/0.1ml的轮状病毒液感染细胞,放置于 37℃,5%co2培养箱中,90min后洗涤,加入动物双歧杆菌乳亚种 (bifidobacterium animalis subsp.lactis)bla80菌悬液,90min后洗涤,加入正常细胞维持液,继续培养;第4组为病毒对照组;第5组为正常细胞对照组。当病毒对照组细胞cpe达到80%以上时,用mtt法测定细胞活性。以上各组试验均重复3次,取平均值。
[0065]
病毒抑制率按照下列方式计算:
[0066]
病毒抑制率=[(处理组平均od
570
值-病毒对照组平均od
570
值)/(细胞对照组平均od
570
值-病毒对照组平均od
570
值)]
×
100%;
[0067]
其中,od
570
为570nm波长处的吸光值。
[0068]
检测结果统计如下表2所示:
[0069]
表2
[0070][0071][0072]
由上表数据可知,三组处理组均对轮状病毒具有抑制作用,表明动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80菌悬液具有一定的抗轮状病毒作用,其中第1组的抑制率为25.9%,第2组的抑制率为15.5%,第3 组的抑制率为20.7%,表明动物双歧杆菌乳亚种(bifidobacterium animalis subsp. lactis)bla80菌悬液预处理组对轮状病毒的抑制作用更强。
[0073]
实施例4
[0074]
本实施例采用间接免疫荧光法(immunofluorescence assay,ifa)测定轮状病毒的增殖状况。实验分为5组,同实施例3,具体步骤如下:
[0075]
继续培养4h后,弃去96孔板中的培养液,采用pbs缓冲溶液轻洗3次,用80%的冷丙酮于-20℃固定细胞10min,采用pbs缓冲溶液轻洗3次,加入稀释100倍的兔抗rv血清,37℃
作用90min,采用pbs缓冲溶液轻洗3次,加入稀释100倍的fitc-羊抗兔igg,37℃湿盒作用40min,采用pbs缓冲溶液轻洗3次,吸干洗涤液后立刻置荧光显微镜下观察,激发波长为488nm。
[0076]
结果如图1-5所示,其中,图1为动物双歧杆菌乳亚种(bifidobacteriumanimalis subsp.lactis)bla80菌悬液预处理组结果图,图2为动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80菌悬液与轮状病毒同时接入组处理结果图,图3为动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis) bla80菌悬液在轮状病毒感染后接入组处理结果图,图4为病毒对照组结果图,图5为正常细胞对照组结果图,可以看到与病毒对照组相比,三组处理组的图中荧光数量较少,表明三组处理组均可以减少rv对细胞的粘附。但对比图1-3,可以看出三组处理组的结果存在一定的差异,其中动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80菌悬液预处理组结果图中的荧光密度更低,对rv的抑制作用更加显著。
[0077]
实施例5
[0078]
本实施例探究动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis) bla80对感染人rv乳鼠的保护作用。所述乳鼠采用spf级且大便wa均为阴性的美国癌症研究所(institute of cancer researcch,icr)孕晚期母鼠自然娩出的乳鼠,共60只,体重2.3~3.0g,平均2.7g,生后母鼠奶喂养,饲养环境12h 光,12h黑暗,温度23℃,湿度60%。实验乳鼠分为4组:第1组为正常对照组(15只),第2组为轮状病毒感染组(15只),第3组为动物双歧杆菌乳亚种 (bifidobacterium animalis subsp.lactis)bla80预防组(15只),第4组为动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80治疗组(15只)。按如下方法建立腹泻动物模型及干预治疗:
[0079]
第1组乳鼠生后母鼠奶正常喂养,前6天用改良的1ml注射器经口灌服50 μl的pbs溶液;第2组乳鼠生后母鼠奶正常喂养,前3天用改良的1ml注射器经口灌服50μl 0.9%的pbs溶液,第4天用改良的1ml注射器经口灌服 tcid
50
为10-4.72
/0.1ml的hwa株悬液50μl,第5-6天用改良的1ml注射器经口灌服50μl的pbs溶液;第3组乳鼠生后母鼠奶正常喂养,生后第1天起用改良的1ml注射器经口灌服1
×
10
10
cfu/ml的嗜酸动物双歧杆菌乳亚种悬液,连续3天,第4天灌服tcid
50
为10-4.72
/0.1ml的人轮状病毒的hwa株悬液50μl,第5-6天用改良的1ml注射器经口灌服50μl的pbs溶液;第4组乳鼠生后母鼠奶正常喂养,前3天用改良的1ml注射器经口灌服50μl 0.9%的nacl溶液,第4天用改良的1ml注射器经口灌服tcid
50
为10-4.72
/0.1ml的hwa株悬液50 μl和1
×
10
10
cfu/ml的动物双歧杆菌乳亚种(bifidobacterium animalis subsp. lactis)bla80悬液,第5-6天用改良的1ml注射器经口灌服1
×
10
10
cfu/ml动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80悬液。随后各组小鼠正常喂养至10天。
[0080]
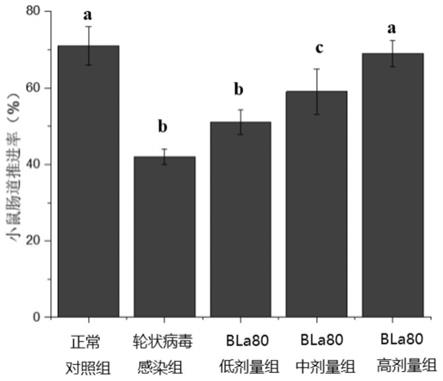
乳鼠腹泻情况观察:第4天开始,至第10天结束,每天2次(早晚各1次),观察乳鼠的腹泻情况,计数乳鼠死亡数量。按试剂说明书用elisa方法检测乳鼠大便hrv抗原。结果统计如下表3所示(其中,表中数据右上标的不同字母表示各组之间存在显著性差异,相同字母表示无显著性差异):
[0081]
表3
[0082][0083]
由上表数据可知,正常对照组乳鼠全过程未见腹泻,无死亡;轮状病毒感染组乳鼠在第4-10天出现明显腹胀,第4-10天排出淡黄色稀水样便,腹泻率达 100%,其中轻型腹泻4只,重型腹泻11只,至第10天死亡8只,死亡率为53.0%;动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80预防组的乳鼠腹泻数仅3只且都为轻型腹泻,至第10天死亡率为13.3%;动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80治疗组的乳鼠腹泻数为5只,至第10天死亡率为20%。与轮状病毒感染组相比,动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80预防组和治疗组的腹泻持续天数及hrv阳性天数明显缩短(p《0.01)。动物双歧杆菌乳亚种(bifidobacteriumanimalis subsp.lactis)bla80预防组和治疗组之间的腹泻持续时间及hrv阳性时间无统计学差异。总体而言动物双歧杆菌乳亚种(bifidobacterium animalissubsp.lactis)bla80预防组的临床表现好于治疗组(数据剔除死亡乳鼠)。
[0084]
乳鼠血清炎症因子tnf-α和免疫调节因子ifn-γ的检测:断头处死乳鼠后取血2-3ml,4℃,2500r/min离心10min,吸取血清。按试剂盒操作,用elisa 方法检测ifn-γ和tnf-α的吸光度值,制作标准曲线并计算出tnf-α和ifn-γ的含量。
[0085]
结果如图6和图7所示,图6为各组乳鼠血清炎症因子tnf-α的含量结果图,图7为各组乳鼠血清免疫调节因子ifn-γ的含量结果图。由图6数据可知,轮状病毒感染组与正常对照组血清中tnf-α含量存在极显著差异(p《0.01),轮状病毒感染组血清中tnf-α含量较高,但经干预后,动物双歧杆菌乳亚种 (bifidobacterium animalis subsp.lactis)bla80预防组和治疗组中血清的tnf-α含量均恢复至正常水平,表明动物双歧杆菌乳亚种(bifidobacterium animalissubsp.lactis)bla80的干预降低了炎症因子的水平。由图7数据可知,正常对照组、轮状病毒感染组与动物双歧杆菌乳亚种(bifidobacterium animalis subsp. lactis)bla80预防组和治疗组之间存在极显著差异(p《0.01),但轮状病毒感染组与动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80治疗组之间无显著差异。另外,动物双歧杆菌乳亚种(bifidobacterium animalis subsp. lactis)bla80预防组血清中ifn-γ含量明显高于正常对照组和动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80治疗组血清中ifn-γ的含量,表明动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80预防组对hrv的免疫应
答效果更好。
[0086]
乳鼠体重观察:
[0087]
分别四组乳鼠在出生后第4天和出生后第10天(即干预后第7天)的体重。结果如下表4所示(其中,表中数据右上标的不同字母表示各组之间存在显著性差异,相同字母表示无显著性差异):
[0088]
表4
[0089][0090]
由上表数据可知,轮状病毒感染组、动物双歧杆菌乳亚种(bifidobacteriumanimalis subsp.lactis)bla80预防组和治疗组乳鼠的体重增长落后于正常对照组乳鼠的体重增长(统计时已去除死亡乳鼠及处死乳鼠)。出生后第4天时,各组小鼠体重无显著性差异,经干预出生后第10天时,轮状病毒感染组、动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80预防组和治疗组乳鼠的体重与正常对照组乳鼠的体重存在极显著差异(p《0.01),动物双歧杆菌乳亚种(bifidobacterium animalis subsp.lactis)bla80预防组和治疗组之间的乳鼠体重不存在显著性差异,但与轮状病毒感染组的乳鼠体重存在显著性差异 (p《0.05)。
[0091]
综上所述,本发明所涉及的动物双歧杆菌乳亚种(bifidobacterium animalissubsp.lactis)bla80无毒副作用且无耐药性,具有优良的抗轮状病毒感染作用,能够对轮状病毒感染的乳鼠表新出较好的保护作用,降低了感染乳鼠的腹泻天数、死亡率和血清中的促炎因子水平,将该菌种用于制备抗轮状病毒感染致腹泻的药物或食物,对有效预防和缓解轮状病毒引起的腹泻症状具有重要意义。
[0092]
申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。