1.本技术属于荧光探针技术领域,具体涉及mno2/eu
3
@mof-867金属有机框架荧光探针、其制备方法及其在检测谷胱甘肽中的应用。
背景技术:
2.谷胱甘肽(gsh)是一种由三个氨基酸组成的小分子肽,它作为体内重要的抗氧化剂和自由基清除剂,对许多重要的生命活动具有重要和普遍的影响,例如gsh能够防御毒素和与自由基或重金属结合,保持氧化还原内稳态,调节细胞增殖。gsh在内源性氧化剂或者外源性氧化剂的作用下很容易被氧化为氧化型谷胱甘肽(gssh)。研究表明,某些疾病与人体内的gsh/gssh的比例有很大关系,比如肝脏疾病、囊状纤维症、精神分裂症、阿尔兹海默症等多种神经系统疾病。因此血清中谷胱甘肽水平可以作为多种疾病的早期检测生物标志物。所以在临床医学的诊断中,设计合成高灵敏度、高选择性的新型gsh探针,对多种疾病的研究、诊断和治疗具有重要意义。
3.近些年来,在gsh的检测方面出现多种方法,包括高效液相色谱法、电化学法、比色法、光化学法、表面增强拉曼光谱法、酶联免疫吸附法以及荧光法等等。其中,荧光检测技术备受关注,因为它具有实时监测、快速响应、高选择性、高灵敏度等特点,同时具有在生物系统中检测的可能性,是成功检测gsh和细胞内成像的重要手段。然而,荧光探针的团聚很可能会导致荧光的淬灭,从而降低了检测的准确性。此外,大多数荧光探针都加入了特殊的功能基团以用于高选择性检测谷胱甘肽,因此谷胱甘肽荧光探针的合成过程往往复杂耗时。
4.为此,本领域亟需提供一种制备简单且高检测准确性的谷胱甘肽荧光探针。
技术实现要素:
5.为了提供一种制备简单且检测准确性高的谷胱甘肽荧光探针,本技术提供了一种金属有机框架荧光探针,其制备过程简便、对gsh的响应灵敏度高,且具有高检测准确性。
6.一方面,本技术提供了金属有机框架荧光探针,该金属有机框架荧光探针包括复合的mno2/eu
3
@mof-867,其中所述eu
3
@mof-867为eu
3
改性的mof-867金属有机框架。
7.可选地,所述mno2呈纳米片状。
8.可选地,所述mno2与所述eu
3
@mof-867的质量比为1:10~1:5。
9.可选地,所述mno2通过原位合成与所述eu
3
@mof-867复合。
10.可选地,所述mno2与所述eu
3
@mof-867通过静电吸附复合而成。
11.另一方面,本技术提供了一种上述金属有机框架荧光探针的制备方法,其特征在于,所述方法包括如下步骤:
12.(1)获得eu
3
@mof-867;
13.(2)原位合成mno2以与eu
3
@mof-867复合:
14.将步骤(1)获得的eu
3
@mof-867、mn源与还原剂混合以获得混合液a,对所述混合液a进行超声处理至混合液变成棕色,经离心、洗涤获得mno2/eu
3
@mof-867。
15.可选地,步骤(1)中所述eu
3
@mof-867通过一锅法合成,包括:将调节剂加入到含有zr源、骨架配合物、eu源的混合液中发生反应,得到所述eu
3
@mof-867。
16.可选地,所述zr源为zr盐;所述eu源为eu盐;所述zr盐包括zrcl4和zrocl2中的至少一种,或其他水溶性zr盐,所述eu盐包括eucl3·
6h2o或其他水溶性eu盐;所述骨架配合物包括2,2
′-
联吡啶-5,5
′-
二甲酸;所述混合液中包括溶剂,所述溶剂包括dmf和dma中的至少一种。
17.可选地,所述zr源、骨架配合物和eu源的摩尔比为1:2:2~1:3:4,其中所述zr源、骨架配合物和eu源的摩尔数以zr原子、骨架配合物中的配体以及eu原子的摩尔数计算;所述调节剂包括乙酸;步骤(1)反应的条件包括:密闭条件下,反应温度为100~120℃,反应时间为18~24h。
18.可选地,所述密闭条件通过高温反应釜实现。
19.可选地,步骤(2)中所述mn源包括kmno4;所述还原剂包括mes缓冲液。
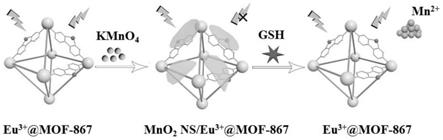
20.可选地,步骤(2)中mn源与所述还原剂的摩尔比为5:1~7:1,其中mn源的摩尔数以mn原子计算。
21.再一方面,本技术提供了一种荧光检测谷胱甘肽的方法,所述方法包括采用上述金属有机框架荧光探针、根据上述方法制备的金属有机框架荧光探针中的至少一种检测谷胱甘肽。
22.可选地,所述方法包括:
23.s1:测定含有金属有机框架荧光探针的溶液的荧光强度,记为f0;
24.s2:将待测液i与含所述有金属有机框架荧光探针的溶液混合得到混合液b,测定所述混合液b进行荧光强度,记为f;
25.s3:比较f与f0。
26.可选地,如果所述f与f0之间的关系满足(f-f0)/f0在1.0~2.5范围内,则待测液i为谷胱甘肽溶液。
27.可选地,所述待测液i的浓度为0.1mm~10mm,所述含有金属有机框架荧光探针中eu
3
@mof-867的浓度为0.2g/l~0.4g/l,所述含有金属有机框架荧光探针中mno2的浓度为0.25mm~0.5mm。
28.可选地,所述待测液i的浓度为0.1mm、0.5mm、1mm、3mm、4mm、5mm、7mm、8mm、10mm中的任意值或者任意两值确定的范围值。
29.可选地,所述方法包括如下步骤:
30.s11:将含有不同浓度的谷胱甘肽溶液分别与含有所述金属有机框架荧光探针溶液混合,并在预设条件下分别测定混合液的荧光强度,建立所述谷胱甘肽的浓度与测定的荧光强度之间的线性函数关系;
31.s12:将待测液ii与含有所述金属有机框架荧光探针溶液混合,测定混合液的荧光强度,利用所述线性函数关系计算得到待测液ii中谷胱甘肽的浓度。
32.可选地,所述预设条件包括:荧光激发波长λex的范围为306~308nm,荧光发射波长λem为615~617nm。
33.具体而言,所述应用包括:(1)mno2/eu
3
@mof-867金属有机框架荧光探针溶液的制备:将mno
2 ns/eu
3
@mof-867溶解在去离子水中以稀释成适宜浓度(例如:0.2g/l的eu
3
@
mof-867和0.25mm的mno2纳米片);(2)gsh标准溶液的制备:用去离子水配制0m,1
×
10-4
m,5
×
10-4
m,1
×
10-3
m,5
×
10-3
m,1
×
10-2
m的标准溶液;(3)荧光探针与gsh反应:取(2)中1ml不同浓度gsh标准溶液与1ml荧光探针溶液混合于5ml离心管中,混合8min;(4)将(3)中的溶液转移入1
×
1cm2石英比色皿中,放入荧光光谱仪进行荧光光谱扫描,激发波长λex=306nm,发射波长λem=617nm;(5)利用荧光光谱仪记录待测物的荧光强度,利用荧光强度与gsh的浓度作标准曲线,利用标准曲线对其他未知浓度的gsh进行定量测量。
34.可选地,所述含有金属有机框架荧光探针中eu
3
@mof-867的浓度为0.2g/l~0.4g/l,所述含有金属有机框架荧光探针中mno2的浓度为0.25mm~0.5mm。
35.可选地,所述线性函数关系为y=202.11x 207.82,r2=0.9957,y为混合液的荧光强度,x为谷胱甘肽的浓度。
36.可选地,x为0m,1
×
10-4
m,5
×
10-4
m、1
×
10-3
m、3
×
10-3
m,4
×
10-3
m、5
×
10-3
m,7
×
10-3
m,8
×
10-3
m、1
×
10-2
m中的任一者或者为任意两值确定的范围值。
37.本技术中,“mof-867”,是指zr6o4(oh)4(bpydc)
12
,bpydc=2,2
′-
联吡啶-5,5
′-
二甲酸。
38.本技术中,“mes缓冲液”是指2-(n-吗啉)乙磺酸缓冲液。
39.本技术产生的有益效果包括:
40.1)本技术首次采用一锅法合成eu
3
@mof-867,合成的eu
3
@mof-867具有金属有机框架独特的刚性结构以及固定的孔隙率,避免了分子聚集导致自身的淬灭。另外,与先合成mof-867,再用eu
3
对mof-867进行改性获得eu
3
@mof-867相比,一锅法合成的eu
3
@mof-867具有较高的产率以及显著提高的荧光强度。
41.2)本技术首次采用一锅法合成eu
3
@mof-867制备过程简单,减少了液体废物的产生。
42.3)本技术首次使用原位合成的mno2(其呈纳米片的形式)与eu
3
@mof-867复合获得了mno2/eu
3
@mof-867,与将预先合成的mno2与eu
3
@mof-867简单混合相比,原位合成的mno2与eu
3
@mof-867复合对eu
3
@mof-867能够实现有效的淬灭。
43.4)本技术所提供的原位合成的mno2(其呈纳米片状)与eu
3
@mof-867复合过程具有制备简单、条件温和的优点。
44.5)本技术所制备的mno2/eu
3
@mof-867,具有良好的水溶液稳定性,便于保存和使用。
45.6)本技术提供的mno2/eu
3
@mof-867对谷胱甘肽具有高度选择性、灵敏性、响应性、且检测操作简便,背景干扰小,这为荧光探针或荧光传感器用于谷胱甘肽检测方面提供了一个可行的尝试。具体而言,在用于检测gsh时,mno2与gsh发生氧化还原反应,使得eu
3
@mof-867的荧光恢复(即switch-on模式),且荧光强度与gsh的浓度呈良好的线性函数关系,可用于快速检测gsh。
附图说明
46.图1示出了根据本技术实施例1与比较例1制备的eu
3
@mof-867的xrd谱图。
47.图2示出了根据本技术实施例1与比较例1制备的eu
3
@mof-867的荧光谱图。
48.图3示出了根据本技术实施例1与比较例2制备的mno2/eu
3
@mof-867的荧光谱图。
49.图4示出了根据本技术实施例2的谷胱甘肽的浓度与测定的荧光强度之间的线性函数关系。
50.图5示出了根据本请实施例2的谷胱甘肽与金属有机框架荧光探针溶液混合后的混合液的荧光强度。
51.图6示出了根据本技术实施例3的各种检测物与金属有机框架荧光探针溶液混合后的混合液的荧光强度。
52.图7示出了根据本技术实施例制备的eu
3
@mof-867、mno
2 ns/eu
3
@mof-867以及mno
2 ns/eu
3
@mof-867应用于检测gsh的示意图。
具体实施方式
53.下面结合实施例详述本技术,但本技术并不局限于这些实施例。
54.在本技术中所公开的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解包括接近这些范围或值。对于数值范围而言,各个范围的端点值和单独的点值之间,可以彼此组合而得到一个或多个新的数值范围,这些数值范围应该被视为在本文中具体公开。
55.如无特别说明,本技术的实施例中的原料均通过商业途径购买。
56.本技术的实施例中荧光强度的检测仪器为f-4600荧光分光光度计(f-4600fl spectrophotometer),检测条件为激发光波长(ex wl):
57.306.0nm;发射光起始波长(em start wl):400.0nm;发射光终止波长(em end wl):750.0nm;扫描速度(scan speed):1200nm/min;激发光狭缝宽度(ex slit):10.0nm;发射光狭缝宽度(em slit):20.0nm;pmt电压(pmt voltage):400v。
58.本技术实施例中的xrd谱图采用的仪器为x'pert pro-1 x射线粉末衍射仪(xrd),检测条件为:3-50-4min快扫,即在4min内扫描3~50度的角度范围。
59.实施例1
60.该实施例示出了本技术mno
2 ns/eu
3
@mof-867金属有机框架荧光探针的制备方法,其包括如下步骤:
61.(1)获得eu
3
@mof-867,具体而言采用一锅法合成eu
3
@mof-867:提供包含zrcl4、2,2
′-
联吡啶-5,5
′-
二甲酸以及eucl3·
6h2o的混合溶液a,然后向所述混合液a加入调节剂,反应完成后经离心、洗涤获得eu
3
@mof-867。具体而言,将117mg zrcl4溶于10ml dmf溶液经超声混合均匀,122mg2,2
′-
联吡啶-5,5
′-
二甲酸(h2bpydc)溶于10ml dmf溶液经超声混合均匀,然后将两种溶液混合均匀再加入10ml dmf、200mg eucl3·
6h2o,超声后加入1g乙酸调节剂,在50ml高温反应釜中、120℃,24h高温反应,冷却至室温,离心后以dmf、甲醇各30ml清洗三次,后真空干燥备用。其中,在该步骤中,所用的zrcl4是过量的,zrcl4的实际用量为大约60mg。
62.(2)原位合成mno2以与eu
3
@mof-867复合:将eu
3
@mof-867溶于水配成eu
3
@mof-867浓度为1g/l的悬浊液,在5ml离心管中依次加入400μl eu
3
@mof-867悬浊液(1g/l)、1ml mes缓冲液(ph=6.0,浓度为0.1m)、50μlkmno4溶液(10mm)以及550μl去离子水以调节总体积为2ml,超声处理30min液体颜色由深紫色变成棕色悬浊液或棕色胶体。经离心收集棕色沉淀,用去离子水洗若干次后再分散于去离子水中,4℃冰箱储存备用,其中,合成的mno2呈
纳米片状;其中,在该步骤中,所用的mes还原剂相对于kmno4是过量的,mes还原剂的实际用量大约为0.0001mmol,实际消耗的kmno4与mes的摩尔比为5:1。
63.比较例1
64.该比较例示出了先合成mof-867,再用eu
3
改性mof-867获得的eu
3
@mof-867。
65.具体而言,将117mg zrcl4溶于10ml dmf溶液经超声混合均匀,122mg 2,2
′-
联吡啶-5,5
′-
二甲酸(h2bpydc)溶于10ml dmf溶液经超声混合均匀,然后将两种溶液混合均匀再加入10ml dmf,超声后加入1g乙酸调节剂,在50ml高温反应釜中、120℃,24h高温反应,冷却至室温,离心后以dmf、甲醇各30ml清洗三次得到mof-867,后真空干燥。随后将其溶于30ml dmf中,后加入200mg eucl3·
6h2o超声混合均匀,转移至在50ml高温反应釜中、120℃,24h高温反应,冷却至室温,离心后以dmf、甲醇各30ml清洗三次得到eu
3
@mof-867,后真空干燥备用。其中,在该步骤中,所用的zrcl4是过量的,zrcl4的实际用量为大约60mg。
66.对实施例1以及对比例1合成的eu
3
@mof-867进行xrd测定,结果如图1所示,实施例1以及对比例1合成的eu
3
@mof-867的xrd谱图(分别对应谱图b和a)与模拟的@mof-867的xrd谱图(对应谱图c)相一致,由此说明实施例1和对比例1中均成功制备了eu
3
@mof-867,且eu
3
的引入并不会破坏mof-867的晶体结构,其中图7中eu
3
@mof-867示意结构中的最小的圆球代表eu。
67.另外,将实施例1以及对比例1合成的eu
3
@mof-867分别经荧光光谱仪进行荧光光谱扫描,在激发波长λ
ex
=306nm,发射波长λ
em
=617nm条件下测定其荧光强度,实施例1合成的eu
3
@mof-867的荧光强度为1404,对比例1合成的eu
3
@mof-867的荧光强度为861.03,具体请参见图2。
68.比较例2
69.该比较例示出了将预先合成的mno2与实施例1合成的eu
3
@mof-867简单混合制备mno2/eu
3
@mof-867。
70.具体而言,将实施例1步骤(1)合成的eu
3
@mof-867溶于水配成eu
3
@mof-867浓度为1g/l的悬浊液,在5ml离心管中依次加入400μl eu
3
@mof-867悬浊液(1g/l)、以及50μl预先制备的与实施例1相同的mno2(10mm)以及1550μl去离子水以调节总体积为2ml,超声处理30min。经离心、去离子水洗若干次后获得mno2/eu
3
@mof-867,再分散于去离子水中,4℃冰箱储存备用。
71.将实施例1制备的mno2/eu
3
@mof-867与该比较例2制备的mno2/eu
3
@mof-867配制成相同的浓度水溶液并分别经荧光光谱仪进行荧光光谱扫描,在激发波长λ
ex
=306nm,发射波长λ
em
=617nm条件下测定其荧光强度,实施例1合成的mno2/eu
3
@mof-867的荧光强度为226.5,对比例2合成的mno2/eu
3
@mof-867的荧光强度为550,具体请参见图3。由此说明,原位合成的mno2与eu
3
@mof-867复合对eu
3
@mof-867能够实现有效的淬灭。
72.实施例2
73.该实施例示出了用实施例1制备的mno2/eu
3
@mof-867金属有机框架荧光探针对检测gsh的响应性,其包括如下步骤:
74.s1:将含有不同浓度的谷胱甘肽溶液分别与含有mno2/eu
3
@mof-867金属有机框架荧光探针溶液混合,并在预设条件下分别测定混合液的荧光强度,建立所述谷胱甘肽的浓度与测定的荧光强度之间的线性函数关系;
75.具体而言,用去离子水配制0m(即0mol/l),1
×
10-4
m,5
×
10-4
m,1
×
10-3
m,3
×
10-3
m,4
×
10-3
m,5
×
10-3
m,7
×
10-3
m,8
×
10-3
m,1
×
10-2
m的标准gsh溶液;取1ml上述不同浓度gsh标准溶液与1mlmno2/eu
3
@mof-867金属有机框架荧光探针溶液(其中包括0.2g/l的eu
3
@mof-867和0.25mm的mno2纳米片)混合于5ml离心管中,混合8min;将混合溶液转移入1
×
1cm石英比色皿中,放入荧光光谱仪进行荧光光谱扫描,激发波长λex=306nm,发射波长λem=617nm;
76.利用荧光光谱仪记录待测混合液的荧光强度,利用荧光强度与gsh的浓度作标准曲线,建立线性方程为:y=202.11x 207.82,r2=0.9957,y为混合液的荧光强度,x为谷胱甘肽的浓度,如图4所示。
77.另外,图5示出了浓度分别为0m,1
×
10-4
m,3
×
10-3
m,5
×
10-3
m,7
×
10-3
m,1
×
10-2
m的gsh标准溶液与mno2/eu
3
@mof-867金属有机框架荧光探针溶液混合后的混合液的荧光强度。通过图6可知,随着gsh浓度增加,mno2逐渐被gsh还原,eu
3
@mof-867的荧光强度逐渐恢复。另外即使gsh浓度为1
×
10-4
m,eu
3
@mof-867的荧光强度明显恢复,说明mno2/eu
3
@mof-867金属有机框架荧光探针具有优异的灵敏度和响应性。
78.其中,图2至图5中的fl为荧光强度。
79.实施例3
80.该实施例示出了用实施例1制备的mno2/eu
3
@mof-867金属有机框架,荧光探针对gsh响应的选择性。
81.取浓度分别为10mm的若干种氨基酸(包括:半胱氨酸cys、丙氨酸ala、谷氨酸glu、酪氨酸tyr、丝氨酸ser),浓度为10mm的若干种电解质溶液(nacl、kcl、mgso4、cacl2、znso4、pbs、tris-hcl)、浓度为10mm的葡萄糖溶液、浓度为10mm的抗坏血酸溶液、浓度为10mg/ml的bsa(牛血清白蛋白)溶液以及1mm的gsh水溶液各1ml。
82.将上述溶液分别与mno2/eu
3
@mof-867金属有机框架荧光探针溶液1ml(其中包括0.2g/l的eu
3
@mof-867和0.25mm的mno2纳米片)混合于5ml离心管中,混合8min;将混合溶液转移入1
×
1cm石英比色皿中,放入荧光光谱仪进行荧光光谱扫描,激发波长λex=306nm,发射波长λem=617nm;利用荧光光谱仪记录荧光强度,如图6所示,结果表明只有gsh能够使荧光探针的荧光强度大幅度上升,抗坏血酸aa与半胱氨酸cys对荧光探针有微弱的荧光上升现象,其他物质对于荧光探针不产生影响。这说明该探针对gsh具有良好的识别作用,即mno2/eu
3
@mof-867金属有机框架荧光探针对gsh具有优异的选择性。另外,本实施例中的gsh的浓度明显低于其他检测物,由此也说明mno2/eu
3
@mof-867金属有机框架荧光探针对gsh具有优异的灵敏度和响应性。
83.其中,在图6中,f0为mno2/eu
3
@mof-867金属有机框架荧光探针溶液的荧光强度,f为检测物与mno2/eu
3
@mof-867的混合液的荧光强度,(f-f0)/f0表示荧光强度增强倍数。
84.另外,图7示出了本技术实施例制备的eu
3
@mof-867、mno2ns(纳米片)/eu
3
@mof-867以及mno2/eu
3
@mof-867应用于检测gsh的示意图。其中,eu
3
@mof-867和mno2/eu
3
@mof-867每个示意结构的左上角的光形箭头代表激发光,右上角的光形箭头代表发射光。
85.其中,本实施例1合成的eu
3
@mof-867在激发光的照射下能够发射荧光;经kmno4原位合成的mno2(mno2/eu
3
@mof-867结构中的灰色片)与eu
3
@mof-867复合后,在激发光的照射下,由于mno2包覆在eu
3
@mof-867的表面,发生了荧光共振能量转移,因此发生荧光淬灭;
当将mno2/eu
3
@mof-867用于检测gsh时,gsh将mno2还原为mn
2
,由此eu
3
@mof-867表面的mno2覆盖片消失,在激发光的照射下能够恢复发射荧光。
86.以上所述,仅是本技术的几个实施例,并非对本技术做任何形式的限制,虽然本技术以较佳实施例揭示如上,然而并非用以限制本技术,任何熟悉本专业的技术人员,在不脱离本技术技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。