1.本发明属于高分子药物技术领域,具体涉及一种疏水性药物微球控释剂及其制备方法和应用。
背景技术:
2.缓释制剂是指能够长时间缓慢非恒速地释放药物的制剂,能够延长药物在体内的作用时间,使药物疗效最大化。微球是第3代药物制剂,也是现代缓释制剂的代表,具有服药周期短、药物作用时间长、安全性高、疗效好等显著的优势,已成为缓释药物制剂领域的研究热点。微球主要是通过控制载体材料的降解速率来控制药物释放速率,进而达到药物控释的作用。随着现代药物制剂技术的迅速发展,医疗需求提高,缓释制剂技术越来越受到科研工作者的广泛关注,人们对微球制剂也提出了更高的要求。
3.可降解聚酯是一种可生物降解的疏水性合成高分子材料,主要包括聚乳酸、聚乙醇酸、聚ε-己内酯、聚β-羟基丁酸、聚β-羟基戊酸以及它们的共聚物,这些材料在应用于微球的材料中占有很大比重。人体体液的主要成分是水,相比于亲水性药物,疏水性药物从疏水性聚酯中扩散出来受到的阻力较大,因此聚酯微球中疏水性药物的释放性能较难达到预期的疗效。因此,现文献多采用如壳聚糖、海藻酸钠、透明质酸、明胶等水溶性高分子作为疏水性药物的载体材料,但这些水溶性高分子的降解行为不可控,容易导致突释,不利于药物的缓慢释放;也有文献以聚乳酸、聚乙醇酸、聚ε-己内酯、聚β-羟基丁酸、聚β-羟基戊酸以及它们的共聚物等疏水性高分子作为疏水性药物的载体材料,制备出具有多孔联通结构的载药微球来提高疏水性药物的释放量,但不同批次微球的孔结构难以控制一致,导致该方式制得的载药微球难以产业化。
4.综上,现有疏水性药物的微球制剂难以实现控释。
技术实现要素:
5.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种疏水性药物微球控释剂,通过各组分的调配,能够加速疏水性药物的释放速度,同时避免突释。
6.本发明还提出一种上述疏水性药物微球控释剂的制备方法。
7.本发明还提出一种上述疏水性药物微球控释剂在制备治疗组织损伤、肠胃疾病、肺部疾病、心脑血管疾病药物中应用。
8.根据本发明的一个方面,提出了一种疏水性药物微球控释剂,包括:
9.可降解微球,所述可降解微球的制备原料包括可降解聚合物;所述可降解聚合物为疏水性可降解聚合物;
10.载药颗粒,所述载药颗粒嵌设于所述可降解微球表面;所述载药颗粒包括疏水性药物和包裹于所述疏水性药物表面的水溶性高分子膜层。
11.根据本发明的一种优选的实施方式,至少具有以下有益效果:
12.(1)本发明提供的载药颗粒包括疏水性药物和其表面包覆的水溶性高分子膜层;同时载药颗粒富集在疏水性可降解微球的表面,因此能够能提升液体缓释介质(主要是水)与载药颗粒的接触面积而有效提升疏水性药物的释放量。
13.(2)本发明的载药颗粒中,水溶性高分子膜层和疏水性药物之间,通过静电力、氢键、亲疏水作用力等非共价键的形式结合,因此水溶性高分子膜层既对疏水性药物有较好亲和力、又不明显影响可降解微球的降解性能。
14.(3)由于疏水性药物不易溶解于缓释介质(主要是水),所以,虽然水溶性高分子包裹的载药颗粒嵌设于可降解微球表面,可直接接触缓释介质,但疏水性药物扩散到缓释介质中的速度仍较慢,从而避免突释;因此本发明所得的疏水性药物微球控释剂中,疏水性药物的释放速度为2.5%~35%/天,可实现长期有效给药。
15.在本发明的一些实施方式中,所述可降解微球的制备原料还包括水溶性高分子。
16.由于在所述可降解微球中引入了水溶性高分子,因此所述可降解微球同时具有亲水性和亲油性。
17.在本发明的一些实施方式中,所述可降解聚合物选自聚3-羟基烷酸酯、聚乳酸、聚己内酯、聚乳酸-羟基乙酸共聚物、聚3-羟基丁酸酯-co-3-羟基戊酸酯、聚(3-羟基丁酸酯)、聚丁二酸丁二酯和聚三亚甲基碳酸酯中的至少一种。
18.在本发明的一些实施方式中,所述可降解聚合物的分子量为10000-80000道尔顿。在本发明的一些实施方式中,所述疏水性药物与水溶性高分子膜层的质量比在1:(1~20)之间。
19.在本发明的一些优选的实施方式中,所述疏水性药物与水溶性高分子膜层的质量比在1:(1~10)之间。
20.在本发明的一些实施方式中,所述水溶性高分子膜层与可降解聚合物的质量比在1:(1~8)之内。
21.通过控制所述疏水性药物、水溶性高分子膜层和可降解聚合物的质量比,能实现疏水性药物微球控释剂的较大载药量,同时提升所述疏水性药物的释放量;还能使所述疏水性药物的释放过程较为平稳,避免突释效应。
22.在本发明的一些实施方式中,所述疏水性药物微球控释剂的粒径为1μm~200μm。
23.在本发明的一些实施方式中,所述疏水性药物选自白藜芦醇、维生素d、n-乙酰基-5-甲氧基色胺(褪黑素)、柚皮苷、3-[[(4-甲基-1-哌嗪基)亚氨基]甲基]-利福霉素(利福平)、二氯苯氧氯酚(三氯生)和双氯苯双胍己烷(洗必泰)中的至少一种。
[0024]
在本发明的一些实施方式中,所述水溶性高分子膜层的制备原料包括羧甲基壳聚糖、透明质酸、聚乙烯醇、白蛋白、聚乙烯亚胺、羧甲基纤维素钠中的至少一种。
[0025]
根据本发明的再一个方面,提出了一种所述疏水性药物微球控释剂的制备方法,包括如下步骤:
[0026]
s1.将所述疏水性药物分散于水溶性高分子的第一水溶液中,反应后清洗、干燥所得固体得所述载药颗粒;
[0027]
s2.将水溶性高分子的第二水溶液分散于所述可降解聚合物的有机溶液中;
[0028]
s3.将步骤s2所得混合物分散于包含表面活性剂和所述载药颗粒的水分散液中,清洗所得沉淀物,干燥后即得。
[0029]
根据本发明的一种优选的实施方式的制备方法,至少具有以下有益效果:
[0030]
(1)本发明的制备方法工艺简单,对设备的要求不高,原料均已产业化、来源易得,成本低廉,易于实现产业化。
[0031]
(2)步骤s3中,在连续相(分散液)中添加载药颗粒,在分散相(步骤s2所得混合物)中添加水溶性高分子,能使装载的疏水性药物均匀分布在微球表面,使药物释放较平稳。
[0032]
(3)本发明采用水包油的乳化溶剂挥发法制备疏水性药物微球控释剂,具体的,首先使用水溶性高分子(亲水性好)包裹疏水性药物,获得水溶性高分子包裹疏水性药物的纳米颗粒(固相);在含可降解聚合物的有机溶剂(油相)中添加水溶性高分子,获得具有一定亲水性的油相(步骤s2);步骤s3中先将载药颗粒分散于含表面活性剂的水溶液中(水相),随后向其中添加具有一定亲水性的油相(步骤s2所得混合物),获得水(含固)包油体系;在持续的搅拌下,油相中的有机溶剂逐渐挥发,其中的可降解聚合物形成所述可降解微球,部分载药颗粒嵌在可降解微球的表面,获得疏水性药物微球控释剂;同时,由于步骤s2所得油相的亲水性较好,在制备过程中,亲水性好的载药颗粒容易嵌入到油相液滴的表面,所以最终获得的疏水性药物微球控释剂表面嵌设富集载药颗粒。
[0033]
在本发明的一些实施方式中,步骤s1中,所述疏水性药物与所述第一水溶液中水溶性高分子的质量比为1:(2~15)。
[0034]
在本发明的一些实施方式中,步骤s1中,所述第一水溶液中水溶性高分子的质量浓度为0.04~0.2g/ml。
[0035]
在本发明的一些实施方式中,步骤s1中,所述分散的方法为搅拌,所述搅拌的速度为6000~18000rpm。
[0036]
在本发明的一些实施方式中,步骤s1中,所述分散可以所述搅拌的基础上,辅助以超声。
[0037]
在本发明的一些实施方式中,步骤s1中,所述分散的时间为1~10min。
[0038]
在本发明的一些实施方式中,步骤s1中,所述反应的温度为55~95℃。
[0039]
在本发明的一些优选的实施方式中,步骤s1中,所述反应的温度为65~80℃。
[0040]
在本发明的一些实施方式中,步骤s1中,所述反应的时间为1~6h。
[0041]
在本发明的一些优选的实施方式中,步骤s1中,所述反应的时间为2~3h。
[0042]
在本发明的一些优选的实施方式中,步骤s1中,所述反应的时间为3~4h。
[0043]
在本发明的一些实施方式中,步骤s1中,所述反应在搅拌条件下进行。
[0044]
在本发明的一些实施方式中,步骤s1中,所述反应在转速为600rpm~1500rpm转速的搅拌条件下进行,具体的搅拌转速还可以是1000rpm。
[0045]
当所述水溶性高分子是羧甲基壳聚糖时,所述反应需在催化剂作用下进行。
[0046]
在本发明的一些实施方式中,所述催化剂为氢氧化钠。
[0047]
所述催化剂可促使所述羧甲基壳聚糖中的羧基和氨基发生交联反应。
[0048]
在本发明的一些实施方式中,步骤s1中,所述清洗的方法为离心和透析中的至少一种。
[0049]
在本发明的一些实施方式中,步骤s1中,所述清洗的方法为以去离子水清洗5~8次。
[0050]
在本发明的一些实施方式中,步骤s1中,所述清洗的过程中,每次清洗中所述载药
颗粒与水的质量体积比约为1g:(300~2000)ml,具体的还可以是1g:600ml、1g:800ml、1g:1000ml、1g:1800ml等。
[0051]
在本发明的一些实施方式中,步骤s1中,所述干燥的方法为冷冻干燥。
[0052]
在本发明的一些实施方式中,步骤s1中,所述干燥的方法为冷冻干燥45~50h。
[0053]
在本发明的一些实施方式中,步骤s1中,所述干燥的方法为冷冻干燥约48h。
[0054]
在本发明的一些实施方式中,步骤s2中所得混合物中,所述水溶性高分子与所述可降解聚合物的质量比为1:(2.5~120)。
[0055]
在本发明的一些实施方式中,步骤s2中,所述第二水溶液和所述有机溶液的体积比为1:(10~50)。
[0056]
在本发明的一些实施方式中,步骤s2中,所述第二水溶液中所述水溶性高分子的质量浓度为0.05~0.3g/ml。
[0057]
步骤s2中,所述第二水溶液中的水溶性高分子的作用是,提升所述有机溶液的亲水性,以方便步骤s3中载药颗粒成功嵌入所述可降解微球表面。
[0058]
在本发明的一些实施方式中,步骤s2中,所述有机溶液的溶剂选自二氯甲烷、三氯甲烷、乙酸乙酯和四氢呋喃中的至少一种。
[0059]
在本发明的一些实施方式中,步骤s2中,所述分散的方法为搅拌,所述搅拌速度为10000~25000rpm。
[0060]
在本发明的一些实施方式中,步骤s2中,所述分散的时间为2min~15min。
[0061]
在本发明的一些实施方式中,步骤s3中,所述表面活性剂选自聚乙烯醇、明胶、吐温、甲基纤维素和司盘中的至少一种。
[0062]
在本发明的一些实施方式中,步骤s3中,所述水分散液中所述表面活性剂的质量分数为0.5%~4.0%。
[0063]
步骤s3中,所述表面活性剂的作用是提升所得疏水性药物微球控释剂的球形度和分散性能。
[0064]
在本发明的一些实施方式中,步骤s3中,所述载药颗粒质量与所述水分散液的体积比为1mg:(1~8)ml。
[0065]
在本发明的一些优选的实施方式中,步骤s3中,所述载药颗粒质量与所述水分散液的体积比为1mg:(1~3)ml。
[0066]
在本发明的一些优选的实施方式中,步骤s3中,所述分散的温度为0℃~50℃。
[0067]
在本发明的一些实施方式中,步骤s3中,所述分散的方法为搅拌,所述搅拌的速度为200~1000rpm。
[0068]
在本发明的一些实施方式中,步骤s3中,所述分散时间为12h~30h。
[0069]
在本发明的一些实施方式中,步骤s3中,所述干燥的方法为冷冻干燥。
[0070]
在本发明的一些实施方式中,步骤s3中,所述干燥的时间为24h~72h。
[0071]
根据本发明的再一个方面,提出了一种所述疏水性药物微球控释剂在制备治疗组织损伤、肠胃疾病、肺部疾病、心脑血管疾病药物中应用。
附图说明
[0072]
下面结合附图和实施例对本发明做进一步的说明,其中:
[0073]
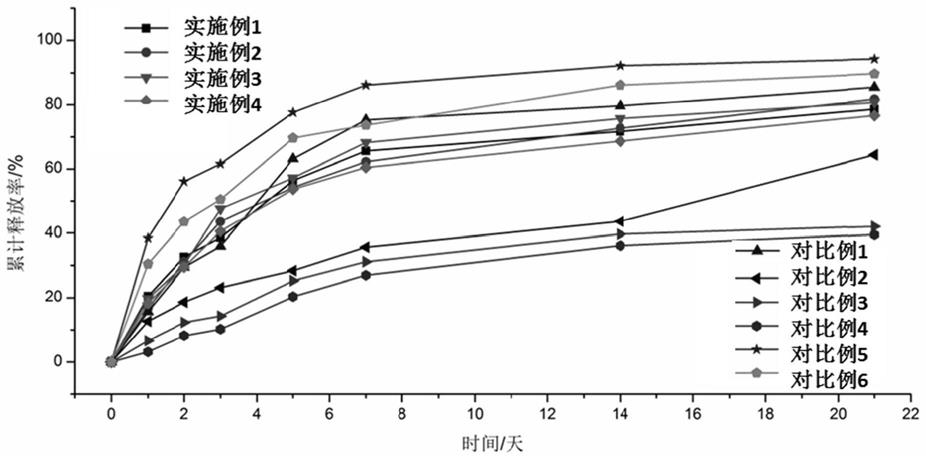
图1为本发明实施例和对比例所得疏水性药物微球控释剂中疏水性药物的体外释放性能。
具体实施方式
[0074]
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
[0075]
实施例1
[0076]
本实施例制备了一种疏水性药物微球控释剂,具体过程为:
[0077]
d1.将100mg柚皮苷与10ml含0.05g/ml的羧甲基壳聚糖的水溶液混合,以18000rpm搅拌2min;
[0078]
d2.在氮气保护下将步骤d1所得混合物倒入95℃的1mol/l的氢氧化钠溶液中以600rpm搅拌4h;
[0079]
反应结束后用去离子水离心清洗8次(每次清洗中,固体与水的质量体积比为1g:1800ml),冷冻干燥48h,得含柚皮苷的羧甲基壳聚糖纳米颗粒(载药颗粒);
[0080]
d3.将500mg聚己内酯(分子量约为3万道尔顿)溶于10ml三氯甲烷,得到聚己内酯溶液;并向其中加入1ml含0.2g/ml的羧甲基壳聚糖水溶液,25℃下以20000rpm搅拌8min;
[0081]
d4.将100mg步骤d2所得载药颗粒分散于100ml含4%的甲基纤维素的水溶液中;并向其中添加步骤d3所得混合物,0℃下以500rpm持续搅拌30h后;对该产物进行水洗并离心三次(每次离心条件为:3000rpm,20min,10℃,固体与水的质量体积比为1g:450ml),收集沉淀产物、冷冻干燥24h得到装载柚皮苷的聚己内酯微球(疏水性药物微球控释剂)。
[0082]
实施例2
[0083]
本实施例制备了一种疏水性药物微球控释剂,具体过程为:
[0084]
d1.将100mg褪黑素与10ml含0.1g/ml的聚乙烯亚胺的水溶液混合,以18000rpm搅拌2min;
[0085]
d2.在65℃,氮气保护下将步骤d1所得混合物以600rpm的转速搅拌3h;反应结束后用去离子水离心清洗6次(每次清洗中,固体与水的质量体积比为1g:1800ml),冷冻干燥48h,得含褪黑素的羧甲基壳聚糖纳米颗粒(载药颗粒);
[0086]
d3.将1.5g聚乳酸-羟基乙酸共聚物(分子量约为3万道尔顿)溶于10ml二氯甲烷,得到聚乳酸-羟基乙酸共聚物溶液;并向其中加入0.5ml含0.1g/ml的聚乙烯亚胺水溶液,25℃下以15000rpm搅拌5min;
[0087]
d4.将150mg步骤d2所得载药颗粒分散于300ml含1.5%的聚乙烯醇1799的水溶液中,并向其中添加步骤d3所得混合物,20℃下以300rpm持续搅拌20h后;对该产物进行水洗并离心三次(每次离心条件为:3000rpm,20min,10℃,固体与水的质量体积比为1g:450ml),收集沉淀产物、冷冻干燥36h得到装载褪黑素的聚乳酸-羟基乙酸共聚物微球(疏水性药物微球控释剂)。
[0088]
实施例3
[0089]
本实施例制备了一种疏水性药物微球控释剂,具体过程为:
[0090]
d1.将100mg利福平与10ml含0.15g/ml的羧甲基纤维素钠的水溶液混合,以6000rpm搅拌10min;
[0091]
d2.在65℃,将步骤d1所得混合物在氮气保护下以600rpm的转速搅拌2h;反应结束后用去离子水离心清洗7次(每次清洗中,固体与水的质量体积比为1g:1800ml),冷冻干燥48h,得含利福平的聚乙烯亚胺纳米颗粒(载药颗粒);
[0092]
d3.将1.2g聚乳酸(分子量约为1万道尔顿)溶于10ml二氯甲烷,并向其中添加0.2ml含0.05g/ml的羧甲基纤维素钠水溶液,25℃下以10000rpm搅拌15min,得到羧甲基纤维素钠/聚乳酸溶液;
[0093]
d4.将200mg步骤d2所得载药颗粒分散于600ml含2%的明胶的水溶液中;并向其中添加步骤d3所得混合物,40℃下以1000rpm持续搅拌24h后;对该产物进行水洗并离心三次(每次离心条件为:3000rpm,20min,10℃,固体与水的质量体积比为1g:450ml),收集沉淀产物、冷冻干燥72h得到装载利福平的聚乳酸微球(疏水性药物微球控释剂)。
[0094]
实施例4
[0095]
本实施例制备了一种疏水性药物微球控释剂,具体过程为:
[0096]
d1.将100mg三氯生与6ml含0.2g/ml的聚乙烯亚胺的水溶液混合,以8000rpm搅拌6min;
[0097]
d2.在55℃,氮气保护下,将步骤d1所得混合物以600rpm的转速搅拌6h,反应结束后用去离子水离心清洗8次(每次清洗中,固体与水的质量体积比为1g:1800ml),冷冻干燥48h,得含三氯生的聚乙烯亚胺纳米颗粒(载药颗粒);
[0098]
d3.将1.2g聚乳酸-羟基乙酸共聚物(分子量约为5万道尔顿)溶于10ml乙酸乙酯,并向其中加入0.8ml含0.3g/ml的聚乙烯亚胺水溶液,25℃下以25000rpm搅拌2min;
[0099]
d4.将200mg步骤d2所得载药颗粒分散于200ml含0.5%的明胶的水溶液中,并向其中添加步骤d3所得混合物,50℃下以200rpm持续搅拌12h后;对该产物进行水洗并离心三次(每次离心条件为:3000rpm,20min,10℃,固体与水的质量体积比为1g:450ml),收集沉淀产物、冷冻干燥36h得到装载三氯生的聚乳酸-羟基乙酸共聚物微球(疏水性药物微球控释剂)。
[0100]
实施例5
[0101]
本实施例制备了一种疏水性药物微球控释剂,具体过程为:
[0102]
d1.将100mg白藜芦醇与5ml含0.04g/ml的羧甲基纤维素钠的水溶液混合,以12000rpm搅拌1min;
[0103]
d2.在55℃,氮气保护下,将步骤d1所得混合物以600rpm的转速继续搅拌2h,反应结束后用去离子水离心清洗6次(每次清洗中,固体与水的质量体积比为1g:1800ml),冷冻干燥48h,得含白藜芦醇的羧甲基纤维素钠纳米颗粒(载药颗粒);
[0104]
d3.将0.8g聚3-羟基丁酸酯-co-3-羟基戊酸酯(分子量约为8万道尔顿)溶于10ml四氢呋喃,并向其中加入0.6ml含0.15g/ml的羧甲基纤维素钠水溶液,25℃下以18000rpm搅拌10min;
[0105]
d4.将100mg步骤d2所得载药颗粒分散于300ml含1%的明胶的水溶液中,并向其中加入步骤d3所得混合物,25℃下以400rpm持续搅拌15h后;对该产物进行水洗并离心三次(每次离心条件为:3000rpm,20min,10℃,固体与水的质量体积比为1g:450ml),收集沉淀产
物、冷冻干燥48h得到装载白藜芦醇的聚3-羟基丁酸酯-co-3-羟基戊酸酯微球(疏水性药物微球控释剂)。
[0106]
对比例1
[0107]
本对比例制备了一种疏水性药物微球控释剂,与实施例2的区别在于:
[0108]
步骤d3中,不包括:“并向其中加入0.5ml含0.1g/ml的聚乙烯亚胺水溶液,25℃下以15000rpm搅拌5min”。
[0109]
对比例2
[0110]
本对比例制备了一种疏水性药物微球控释剂,其中直接将疏水性药物不在可降解微球表面富集,也不预先形成载药颗粒,具体过程为:
[0111]
b1.将1.5g聚乳酸-羟基乙酸共聚物(分子量约为3万道尔顿)及100mg褪黑素溶于10ml二氯甲烷,并向其中加入0.5ml含0.1g/ml的聚乙烯亚胺水溶液,25℃下以15000rpm搅拌5min;
[0112]
b2.将步骤b1所得混合物加入到300ml含1.5%的聚乙烯醇1799的水溶液中,20℃下以300rpm持续搅拌20h后;对该产物进行水洗并离心三次(每次离心条件为:3000rpm,20min,10℃),收集沉淀产物、冷冻干燥36h得到装载褪黑素的聚乳酸-羟基乙酸共聚物微球(疏水性药物微球控释剂)。
[0113]
对比例3
[0114]
本对比例制备了一种疏水性药物微球控释剂,具体与对比例3的区别为:
[0115]
步骤b1中不包括“并向其中加入0.5ml含0.1g/ml的聚乙烯亚胺水溶液,25℃下以15000rpm搅拌5min”。
[0116]
对比例4
[0117]
本对比例制备了一种疏水性药物微球控释剂,具体与实施例2的区别为:
[0118]
步骤d4中,步骤d2所得载药颗粒的添加量为500mg而不是150mg。
[0119]
对比例5
[0120]
本对比例制备了一种疏水性药物微球控释剂,具体与对比例3的区别为:
[0121]
步骤b1中,褪黑素的添加量为500mg,而不是100mg。
[0122]
试验例
[0123]
本试验例测试了实施例和对比例制备的疏水性药物微球控释剂中疏水性药物的体外释放性能,结果见图1。
[0124]
评价方法:体外溶质释放实验在温度37℃,搅拌速度为60rpm条件下,在恒温摇床中进行;具体的将50mg的疏水性药物微球控释剂浸在20ml pbs(ph=7.4)中,定期收集测试液,并补充等量的pbs,将收集的测试液用高效液相色谱法(hplc)测定溶质(疏水性药物)含量;将某时间点溶质的吸光度代入到其标准曲线中,得到这一时间点溶质释放的实际量;将实际量除以疏水性药物微球控释剂中负载疏水性药物的总量即得到这一时间点溶质的累积释放量。
[0125]
由图1可知,与对比例1~5相比,实施例1~5均有正常的药物释放行为,实施例2的释放曲线最为稳定,证明本发明方法制得的疏水性药物微球控释剂对疏水性药物的释放作用有明显的调控作用。与实施例2相比,对比例1中的分散相(步骤d3所的混合物)不添加水溶性高分子,导致含褪黑素的羧甲基壳聚糖纳米颗粒较少,疏水性药物的释放过快;与实施
例2相比,对比例2将褪黑素直接溶解于分散相中,不采用水溶性高分子对疏水性药物进行预包裹,因此疏水性药物释放非常缓慢;与实施例2相比,对比例3将褪黑素直接溶解于分散相中,既不采用水溶性高分子对疏水性药物进行预包裹,在分散相中也不添加水溶性高分子,因此疏水性药物释放最慢;与实施例2相比,对比例4添加的载药颗粒过多,使疏水性药物微球控释剂中疏水性药物能与缓释介质接触的比表面积大幅度增大,出现了严重的突释现象;与实施例2相比,对比例5添加的载药颗粒是实施例2的5倍,且在分散相中不添加水溶性高分子,使微球中疏水性药物能与缓释介质接触的比表面积大幅度增大,出现了突释现象。
[0126]
上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。