1.本发明涉及医药生物技术领域,尤其是涉及宣肺败毒方的新用途及分析方法。
背景技术:
2.人体的健康与肠道内的微生物群落结构息息相关,肠道微生物群在参与疾病的治疗以及在疾病的发生发展中起到重要作用,人体内的肠道菌群是一个复杂的微生态系统,大约含有10
14
个微生物,在机体内参与能量摄入、新陈代谢以及免疫调节等多种生理功能,肠道微生物群的比例对于维持机体内肠道稳态平衡起着至关重要的作用。大量研究证实肠道菌群的调控是中药复方发挥药效的重要途径,作为肠道菌群发酵膳食纤维、碳水化合物以及其它物质等产生的代谢物质,短链脂肪酸主要由碳原子数目为1-6个的饱和脂肪酸组成,是肠道菌群与宿主之间重要的信号分子,在调节机体代谢、维持机体免疫稳态以及调节炎症等方面产生一定影响,一定程度上可维持宿主肠道内稳态,改善肠道健康。
3.宣肺败毒方是《新型冠状病毒感染的肺炎诊疗方案》试行第六、七版中针对新冠肺炎普通型湿毒郁肺证患者的推荐方剂,由13味中药组成,是在麻杏石甘汤等四种经典名方的基础上经过组合优化和药味加减而制,临床上用于治疗轻型及普通型新冠肺炎患者,疗效显著,由于该方药味组成丰富,化学成分复杂,其药效物质基础及作用机制尚不明确,且到目前为止针对该方的研究还不是很广泛,有待深入研究。
技术实现要素:
4.本发明所要解决的技术问题在于提供一种宣肺败毒方的新用途。
5.本发明所要解决的另一技术问题在于提供上述宣肺败毒方用途的分析方法。
6.本发明采用的技术方案是:
7.宣肺败毒方在制备肠道菌群调节药物方面的新用途。
8.优选的,上述宣肺败毒方的新用途,所述菌群为普雷沃氏菌属、脱硫弧菌属、帕拉普氏菌属、臭杆菌、类芽孢八叠球菌属、cf231、yrc22及丁酸弧菌属(butyricimonas属)、布劳特氏菌属、别样棒菌属、考拉杆菌属、多尔氏菌属、双歧杆菌属和/或柯林斯菌属。
9.一种用于测定上述宣肺败毒方用途的分析方法,基于16s rdna基因测序技术对宣肺败毒方干预正常大鼠的肠道微生物组成、功能差异进行分析,步骤如下:
10.(1)粪便样本基因组dna提取
11.采用ctab法提取总基因组dna,在1%琼脂糖凝胶上检测dna浓度和纯度。根据浓度,用无菌水稀释dna至1ng/μl;
12.(2)目标片段pcr扩增及产物纯化
13.使用515f(5
’‑
actcctacgggaggcagca-3’)和806r(5
’‑
ggactachvgggtwtctaat-3’)引物扩增16s rdna基因的v3-v4区,扩增片段大小为500bp,利用qiagen gel extraction kit(qiagen,germany)回收pcr产物纯化;
14.(3)扩增产物荧光定量
15.将等量的1x电泳上样缓冲液(包含syb green荧光染料)与pcr产物混合,在2%琼脂糖凝胶上进行电泳检测,pcr产物以等密度比例混合,所采用的荧光试剂为quant-it picogreen dsdna assay kit,定量仪器为microplate reader(biotek,flx800);
16.(4)测序文库制备
17.采用illumina公司的truseq nano dna lt library prep kit制备测序文库;
18.(5)高通量测序
19.利用illumina公司的novaseqpe250测序仪进行高通量测序;
20.(7)数据处理与统计分析
21.根据qiime质量控制程序,在特定的过滤条件下对原始标签进行质量过滤。使用flash对序列进行拼接,将标签与silva数据库并使用uchime算法进行比较检测嵌合体序列进而得到有效标签。使用uparse软件根据97%的相似度对序列进行otu聚类分析,并基于mothur算法使用silva数据库对分类信息进行注释。根据序列获得的最少序列的样本进行抽平,分析大鼠盲肠内容物中微生物群落的多样性和丰富度,基于物种注释结果,对组间不同分类水平上的物种组成进行比较,然后再采用pcoa分析方法比较各组微生物群落的差异,采用lefse差异判别分析方法,筛选出组间具有显著差异的标志物种。通过kruskal-wallis秩和检验和dunn’test作为事后检验来验证alpha多样性差异的显著性,采用kruskal-wallis以及wilcoxon秩和检验方法并结合p值来筛选差异微生物,p《0.05被认为具有显著性差异。
22.优选的,上述分析方法,为短链脂肪酸的分析方法,基于gc-ms/ms技术对宣肺败毒方干预正常大鼠粪便中短链脂肪酸(scfas)的含量测定,步骤如下:
23.(1)样品的制备
24.称取适量粪便样本于ep管中,加入磷酸以及钢珠,然后均质并涡旋,之后在冰浴下超声,离心,然后取上清液于离心管中,再加入含内标的mtbe溶液,涡旋,冰浴超声,离心,取上清,-20℃冰箱保存,待gc-ms/ms分析;
25.(2)气相色谱-质谱条件
26.气相色谱-质谱条件:agilent 7890b气相色谱仪与配备db-ffap色谱柱(30m*0.25mm*0.25μm)的7000d质谱仪联用,以氦气作为载气,分流模式1:1,柱流速为1.2ml
·
min-1
,柱箱升温程序为90℃保持1min,以25℃/min升至100℃,以20℃/min升至150℃,以25℃/min升至200℃,保持0.5min,后运行3min;进样量为2μl,前进样口温度200℃,传输线温度230℃,离子源温度230℃,四极杆温度150℃,所有样品均在多反应监测模式下进行分析;
27.(3)对照品溶液的配制及标准曲线的建立
28.配制不同浓度的标准品溶液,获取各个浓度标准品的对应定量信号的质谱峰强度数据,以外标与内标浓度比(concentration ratio)为横坐标,外标与内标峰面积比(area ratio)为纵坐标,绘制不同物质的标准曲线;
29.(4)方法学考察
30.1)精密度:
31.日内精密度:准备低高两个浓度的混标样品,每个浓度5份,在气相色谱-质谱条件下,连续进样6次,对各成分的峰面积进行积分,计算各峰面积的相对标准偏差(relative standard deviation,rsd%);
32.日间精密度:准备低高两个浓度的混标样品,每个浓度5份,在气相色谱-质谱条件下,连续进样6次,重复3天,对各成分的峰面积进行积分,计算各峰面积的相对标准偏差(relative standard deviation,rsd%);
33.2)加样回收率:
34.精密称取6份样品,按已知质量的80%、100%、120%加入7种scfas的对照品,按样品的制备方法制备供试品溶液,在气相色谱-质谱条件下上机分析,记录各成分的峰面积以及各成分的平均加样回收率;
35.(5)样本的质控分析
36.以混合标准溶液作为qc样本,在仪器的分析过程中,每间隔10个检测分析样本插入一个qc样本,通过对同一qc样本质谱检测分析的总离子流色谱图(tic)进行重叠展示分析,从而判断数据检测期间仪器的稳定性;
37.(6)scfas的含量测定
38.对检测到的所有粪便样本中的7种scfas的峰面积进行积分,并用内标对所得数据进行校正,然后将样本的积分峰面积比值带入到标准曲线线性方程中进行计算,进一步带入计算公式计算后最终得到实际样本中scfas的绝对含量;
39.(7)统计学分析
40.将得到的所有样本中的各个成分的含量进行t检验以及one-way anova分析其在统计学上的差异。最后对每组差异分组检测到的差异微生物和差异代谢物进行相关性分析,计算微生物和代谢物的spearman相关系数。
41.优选的,上述分析方法,所述短链脂肪酸为乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、己酸。
42.本发明的有益效果是:
43.本发明提供了宣肺败毒方在制备肠道菌群调节药物方面的新用途,通过对宣肺败毒方干预28天的大鼠肠道微生物组和靶向代谢组进行了系统分析,首次发现组间共有14个菌属在统计学上具有显著差异(p《0.05),其中prevotella(普雷沃氏菌属)、desulfovibrio(脱硫弧菌属)、paraprevotella(帕拉普氏菌属)、odoribacter(臭杆菌)、paenisporosarcina(类芽孢八叠球菌属)、cf231、yrc22及butyricimonas属的丰度在给药后显著增加(p《0.05),而blautia(布劳特氏菌属)、allobaculum(别样棒菌属)、phascolarctobacterium(考拉杆菌属)、dorea(多尔氏菌属)、bifidobacterium(双歧杆菌属)、collinsella(柯林斯菌属)的丰度在给药后显著降低(p《0.05)。随后对两组粪便样本进行短链脂肪酸的含量测定,发现乙酸是组间具有极显著差异的代谢物(p《0.01),且乙酸与unidentified_elusimicrobiaceae、unclassified_erysipelotrichaceae两个菌属呈显著正相关,与unidentified_rf16、odoribacter(臭杆菌)、unclassified_paraprevotellaceae、unclassified_bacteroidales、paenisporosarcina(类芽孢八叠球菌)、unidentified_veillonellaceae这6个菌属呈极显著负相关(p《0.01),与unclassified_rikenellaceae、butyricimonas(丁酸弧菌)、cf231、desulfovibrio(脱硫弧菌属)、unidentified_f16这5个菌属呈显著负相关(p《0.05),说明这几种肠道细菌丰度的改变对宣肺败毒方的药效发挥起到重要的作用,提示宣肺败毒方可通过调节肠道菌群相对丰度,影响菌群代谢产物乙酸的含量进一步发挥药效。
附图说明
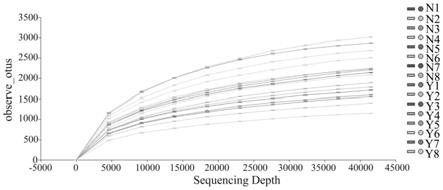
44.图1为稀释曲线图,其中,横坐标为随机抽取的测序数据量,纵坐标为检测到的asv/otu数量,不同颜色的曲线分别代表不同的样本(nacl:正常对照组;y:宣肺败毒组)。
45.图2为alpha多样性指数的分组箱线图。
46.图3为属水平上物种相对丰度柱形图。
47.图4为各组大鼠肠道菌群结构的基于非加权unifrac的主坐标分析(pcoa)图。
48.图5为标志物种的lda效应值柱状图。
49.图6为混标溶液的tic重叠图。
50.图7为样品溶液的tic重叠图。
51.图8为7种scfas的含量直方图,其中,横坐标为含量;纵坐标为样品编号;nacl:正常对照组;y:宣肺败毒组。
52.图9为相关性热图,其中,绿色代表负相关,红色代表正相关。p-value《=0.05为相关性显著,用*表示;p-value《=0.01为相关性非常显著,用**表示。
具体实施方式
53.为了使本领域的技术人员更好的理解本发明的技术方案,下面结合附图及具体实施方式对本发明所述技术方案作进一步的详细说明。
54.实施例1
55.宣肺败毒方(由天津现代创新中药科技有限公司提供)调节肠道菌群的研究
56.1.材料与方法
57.1.1试剂与仪器
58.试剂:agarose(invitrogen,中国),marker(takara,中国),tae(invitrogen,中国),乙酸、丙酸、异丁酸、丁酸、戊酸、己酸、2-甲基戊酸、甲基叔丁基醚(色谱纯,cnw)、异戊酸(aladdin,中国),磷酸(上海沪试,中国)。
59.仪器:pcr扩增仪(abi,中国),酶标仪(biotek,德国),电泳仪(北京六一,中国),凝胶成像系统(北京百晶,中国),high-fidelity dna polymerase(neb,中国),quant-it picogreen dsdna assay kit(invitrogen,中国),nanodrop(thermo scientific,中国),7890b-7000d gc-ms/ms(agilent,美国),5424r离心机(30*1.5/2.0ml,eppendorf,德国),mm400球磨仪(retsch),as60/220.r2电子天平,mix-200多管涡旋振荡器(上海净信,中国),kq5200e超声清洗仪(昆山舒美,中国)。
60.1.2试验动物分组及饲养
61.20只雄性sd大鼠(180-220g),购自北京华阜康生物科技股份有限公司,许可证号scxk(京)2019-0008。饲养环境保持在(25
±
2)℃,相对湿度为(50
±
15)%,明暗周期12h的环境下,自由饮水和进食。适应性喂养1周后,随机分为正常对照组(nacl)和宣肺败毒组(y),每组各8只。按照大鼠与人体表面积折算后的6倍量确定,宣肺败毒方的给药剂量为2.5g
·
kg-1
·
d-1
,正常对照组灌胃等体积的生理盐水,各组均连续灌胃28天。实验结束次日收集各组大鼠粪便,分装于无菌ep管中,置入干冰,后转移至-80℃冰箱贮存。
62.1.3实验材料
63.实验所用的宣肺败毒方由天津现代创新中药科技有限公司提供,生产批号
20200329,规格10g/袋,临床上患者的每天使用量为1次1袋,一日两次。
64.1.4实验内容
65.一种基于16s rdna基因测序技术对宣肺败毒方干预正常大鼠的肠道微生物组成、功能差异分析方法,包括以下步骤:
66.步骤1、粪便样本基因组dna提取
67.1)吸取1000μl ctab裂解液至2.0ml ep管里,加入溶菌酶,将适量的样品加入裂解液中,65度水浴,期间颠倒混匀数次,以使样品充分裂解。
68.2)离心取上清,加酚(ph8.0):氯仿:异戊醇(25:24:1),颠倒混匀,12000rpm离心10min。
69.3)取上清,加氯仿:异戊醇(24:1),颠倒混匀,12000rpm离心10min。
70.4)吸取上清至1.5ml离心管里,加入异丙醇,上下摇晃,-20度沉淀。
71.5)12000rpm离心10min,倒出液体,用1ml 75%乙醇洗涤2次,剩余的少量液体再次离心收集,然后用枪头吸出,之后于超净工作台上吹干。
72.6)加入ddh2o溶解dna样品,必要时可于55-60℃下孵育10min助溶。
73.7)加rnase a 1μl消化rna,37度放置15min。
74.8)采用nanodrop对dna进行定量,通过1%琼脂糖凝胶电泳检测dna浓度和纯度。
75.9)根据浓度,用无菌水将dna浓度稀释至1ng/μl。
76.步骤2、目标片段pcr扩增及产物纯化
77.1)使用515f(5
’‑
actcctacgggaggcagca-3’)和806r(5
’‑
ggactachvgggtwtctaat-3’)引物扩增16s rdna基因的v3-v4区,扩增片段大小为500bp。
78.2)所有pcr反应均使用15μl high-fidelity pcr master mix(new england biolabs,massachusetts,usa)进行,正反向引物2μm,模板dna约10ng,热循环包括98℃的初始变性1min,然后是98℃变性10s,50℃退火30s,72℃延伸30s,30个循环,最后在72℃下延伸5min。
79.3)利用qiagen gel extraction kit(qiagen,germany)回收pcr产物纯化。
80.4)加入200μl 80%乙醇,反向放置在磁力架上,用磁珠吸附到pcr管的另外一面,充分吸附后吸出上清。
81.5)放在室温中静置5min,待酒精挥发完全,磁珠出现裂缝即可。
82.6)加入25μl elution buffer洗脱,然后将pcr管放在吸附架上5min,充分吸附,移出上清到干净的1.5ml离心管中保存。
83.步骤3、扩增产物荧光定量
84.1)将等量的1x电泳上样缓冲液(包含syb green荧光染料)与pcr产物混合,在2%琼脂糖凝胶上进行电泳检测,pcr产物以等密度比例混合,所采用的荧光试剂为quant-it picogreen dsdna assay kit,定量仪器为microplate reader(biotek,flx800)。
85.步骤4、测序文库制备
86.采用illumina公司的truseq nano dna lt library prep kit制备测序文库
87.1)首先对上述扩增产物进行序列末端修复,通过试剂盒中的end repair mix2切除dna序列5’端的突出碱基,同时添加一个磷酸基团,补齐3’端的缺失碱基。
88.2)在dna序列的3’端添加a碱基以防止dna片段自连,同时保证目标序列能与测序
接头相连(测序接头3’端有一个突出的t碱基)。
89.3)在序列5’端添加含有文库特异性标签(即index序列)的测序接头,使dna分子能被固定在flow cell上。
90.4)采用beckman ampure xp beads,通过磁珠筛选去除接头自连片段,纯化添加接头后的文库体系。
91.5)对上述连上接头的dna片段进行pcr扩增,从而富集测序文库模板,并采用beckman ampure xp beads再次纯化文库富集产物。
92.6)通过2%琼脂糖凝胶电泳,对文库做最终的片段选择与优化。
93.步骤5、高通量测序
94.利用illumina公司的novaseqpe250测序仪进行高通量测序。
95.1)上机测序前,需要先对文库在agilent bioanalyzer上进行质检,采用agilent high sensitivity dna kit。合格的文库有且只有单一的峰,且无接头。
96.2)采用quant-it picogreen dsdna assay kit在promega quantifluor荧光定量系统上对文库进行定量,合格的文库浓度应在2nm以上。
97.3)将合格的各上机测序文库(index序列不可重复)梯度稀释后,根据所需测序量按相应比例混合,并经naoh变性为单链进行上机测序。
98.4)使用novaseqpe250测序仪进行双端测序,相应试剂为novaseq 6000spreagent kit(500cycles),获得250bp的成对末端读数。
99.5)根据qiime质量控制程序,在特定的过滤条件下对原始标签进行质量过滤,以获得高质量的清洁标签。使用flash对序列进行拼接,将标签与参考数据库silva数据库并使用uchime算法进行比较检测嵌合体序列,然后去除嵌合体序列,最后得到有效标签。使用uparse软件根据97%的相似度对序列进行otu聚类分析,对于每个代表性序列,基于mothur算法使用silva数据库对分类信息进行注释。根据序列获得的最少序列的样本进行抽平,分析大鼠盲肠内容物中微生物群落的多样性和丰富度,基于物种注释结果,对组间不同分类水平上的物种组成进行比较,然后再采用pcoa分析方法比较各组微生物群落的差异,并采用lefse差异判别分析方法,筛选出组间具有显著差异的标志物种。通过kruskal-wallis秩和检验和dunn’test作为事后检验来验证alpha多样性差异的显著性,采用kruskal-wallis以及wilcoxon秩和检验方法并结合p值来筛选差异菌,p《0.05被认为具有显著性差异。
100.一种基于gc-ms/ms技术对宣肺败毒方干预正常大鼠粪便中短链脂肪酸的含量测定,包括以下步骤:
101.步骤1、样品的制备
102.精密称取20mg粪便样本于2ml ep管中,加入1ml磷酸(0.5%v/v)溶液,以及一颗小钢珠,20hz下球磨仪10s,重复2次并涡旋10min混匀(所有涡旋操作都将涡旋仪频率调到最大),在冰浴下超声5min,在12000r/min、4℃条件下离心10min,取100μl上清液加入到对应的已编号的1.5ml离心管中,然后加入500μl含内标的mtbe溶剂,涡旋3min,冰浴下超声5min,之后在12000r/min、4℃条件下离心10min,离心完后吸取上清液200μl到编号有玻璃内衬管的进样瓶中,-20℃冰箱保存,待gc-ms/ms分析。
103.步骤2、气相色谱-质谱条件
104.气相色谱-质谱条件:agilent 7890b气相色谱仪与配备db-ffap色谱柱(30m*
0.25mm*0.25μm)的7000d质谱仪联用,以氦气作为载气,分流模式1:1,柱流速为1.2ml
·
min-1
,柱箱升温程序为90℃保持1min,以25℃/min升至100℃,以20℃/min升至150℃,以25℃/min升至200℃,保持0.5min,后运行3min。进样量为2μl,前进样口温度200℃,传输线温度230℃,离子源温度230℃,四极杆温度150℃,所有样品均在多反应监测模式下进行分析。
105.步骤3、对照品溶液的配制及标准曲线的建立
106.配制0.005μg
·
ml-1
、0.02μg
·
ml-1
、0.05μg
·
ml-1
、0.1μg
·
ml-1
、0.2μg
·
ml-1
、0.3μg
·
ml-1
、0.5μg
·
ml-1
、1μg
·
ml-1
、2μg
·
ml-1
、5μg
·
ml-1
、8μg
·
ml-1
、10μg
·
ml-1
、20μg
·
ml-1
不同浓度的标准品溶液,获取各个浓度标准品的对应定量信号的质谱峰强度数据,以外标与内标浓度比(concentration ratio)为横坐标,外标与内标峰面积比(area ratio)为纵坐标,绘制不同物质的标准曲线。
107.步骤4、方法学考察
108.3)精密度:
109.日内精密度:准备低高两个浓度的混标样品,每个浓度5份,在气相色谱-质谱条件下,连续进样6次,对各成分的峰面积进行积分,计算各峰面积的相对标准偏差(relative standard deviation,rsd%)。
110.日间精密度:准备低高两个浓度的混标样品,每个浓度5份,在气相色谱-质谱条件下,连续进样6次,重复3天,对各成分的峰面积进行积分,计算各峰面积的相对标准偏差(relative standard deviation,rsd%)。
111.4)加样回收率:
112.精密称取6份样品,按已知质量的80%、100%、120%加入7种scfas的对照品,按样品的制备方法制备供试品溶液,在气相色谱-质谱条件下上机分析,记录各成分的峰面积,并计算各成分的平均加样回收率,由于短链脂肪酸各物质属于内源性物质,因此回收率=(实际值-空白)/理论值*100%。
113.5)样本的质控分析
114.以混合标准溶液作为qc样本,在仪器的分析过程中,每间隔10个检测分析样本插入一个qc样本,通过对同一qc样本质谱检测分析的总离子流色谱图(tic)进行重叠展示分析,从而判断数据检测期间仪器的稳定性。
115.6)scfas的含量测定
116.对检测到的所有样本中的7种scfas的峰面积进行积分,并用内标对所得数据进行校正,然后将样本的积分峰面积比值带入到标准曲线线性方程中进行计算,进一步带入计算公式计算后最终得到实际样本中scfas的绝对含量。
117.粪便样品中scfas含量的计算公式:(mg/g)=c*v*v1/v2/m/1000000
118.v1:磷酸体积(μl);
119.c:样本中积分峰面积比值代入标准曲线得到的浓度值(μg
·
ml-1
);
120.v2:上清液体积(μl);
121.v:样品提取过程中加入提取液的体积(μl);
122.m:称取的样本质量(g)。
123.1.5结果与分析
124.1.16s rdna基因测序结果
125.1.1 alpha多样性分析
126.1.1.1稀释曲线
127.稀释曲线(rarefaction curve)用来反映样本alpha多样性随抽平深度的变化趋势,同时判断测序数据量是否足够合理,通过绘制稀释曲线,可以在相同的测序深度下,比较不同样本中asv/otu数的多少,从而在一定程度上衡量每个样本的多样性高低。如图1所示,当曲线趋于平缓时,表明测序的数据量已足以反映当前样本中绝大多数的微生物多样性信息,继续增加测序深度只会产生少量新的asv/otu,反之则表明alpha多样性尚未接近饱和。
128.1.1.2 alpha多样性指数分析
129.alpha多样性主要用来评估微生物群落的多样性、丰富度和均匀性。chao1指数和observed species指数表征样本中otu(物种)的丰富度,shannon和simpson指数同时反映样本中物种的多样性,faith’s pd指数表征基于进化的多样性,pielou’s evenness指数和good’s coverage指数分别表征微生物群落的均匀度和覆盖度。chao1、observed species值越大,表明菌群丰富度越高;shannon和simpson指数越高,表明物种多样性越丰富。图2显示两组样本菌群通过kruskal-wallis秩和检验分析的alpha多样性指数。结果表明,正常对照组和宣肺败毒组样本组间肠道菌群物种多样性均无统计学差异(p>0.05),说明连续给药28天不会对正常大鼠肠道微生物的丰富度和均匀度造成明显的影响。
130.1.2菌群结构组成分析
131.各样品在属水平上丰度top20的物种相对丰度柱形图如图3所示。从物种组成上看,正常对照组存在149个物种,组成比大于0.01%的有15个,宣肺败毒组存在160个物种,组成比大于0.01%的有16个,从物种丰度上看,正常组与宣肺败毒组的物种丰度存在很大差异,正常对照组中相对丰度较大的有lactobacillus(乳杆菌属)、blautia(布劳特氏菌属)以及oscillospira(颤螺旋菌属),而lactobacillus(乳杆菌属)、cf231以及prevotella(普雷沃菌属)的相对丰度在宣肺败毒组所占比例较大,在属水平上,比较正常组和宣肺败毒组之间的差异,共有14个菌属在统计学上具有显著差异(p<0.05),与正常对照组相比,宣肺败毒组prevotella(普雷沃氏菌属)、desulfovibrio(脱硫弧菌属)、paraprevotella(帕拉普氏菌属)、odoribacter(臭杆菌)、paenisporosarcina(类芽孢八叠球菌属)、cf231、yrc22及butyricimonas属丰度显著增加(p<0.05),而blautia(布劳特氏菌属)、allobaculum(别样棒菌属)、phascolarctobacterium(考拉杆菌属)、dorea(多尔氏菌属)、bifidobacterium(双歧杆菌属)、collinsella(柯林斯菌属)丰度显著降低(p<0.05),差异有统计学意义。
132.1.3β多样性分析
133.采用基于非加权unifrac的pcoa分析各组样本肠道菌群结构的差异性,结果表明各组大鼠的肠道微生物结构有明显差异,见图4所示。
134.1.4 lefse分析
135.为了寻找不同组之间有差异的潜在微生物群,采用lefse(ldaeffect size)分析来对所有分类水平进行差异分析,寻找组间的具有标志性的微生物类群。结果表明正常组和宣肺败毒组之间具有显著差异的35个分类单元,包括2个差异性菌门、3个差异性菌纲、5个差异性菌目、11个差异性菌科以及14个差异性菌属,见图5。分析结果显示,门水平上存在
显著差异的物种有2个,分别为:fusobacteria(梭杆菌门)和tm7菌门,属水平上,正常组中具有显著差异的物种有6个,按lda效应量大小从高到低排序分别为:blautia(布劳特氏菌属)、allobaculum(别样棒菌属)、phascolarctobacterium(考拉杆菌属)、dorea(多尔氏菌属)、bifidobacterium(双歧杆菌属)以及collinsella(柯林斯菌属)。宣肺败毒组中具有显著差异的物种有8个,按lda效应量大小从高到低排序分别为:cf231、prevotella(普雷沃菌属)、paraprevotella(帕拉普氏菌属)、desulfovibrio(脱硫弧菌属)、paenisporosarcina(类芽孢八叠球菌属)、odoribacter(臭杆菌)、butyricimonas菌属及yrc22菌属。
136.2.短链脂肪酸的含量测定结果
137.2.1样本的质控分析
138.混合标准品溶液与样品溶液的总离子流图重叠结果显示样品中7种scfas的保留时间与峰强度均一致,表明在样本的检测期间仪器稳定且数据可靠。从图6、图7中可以看出scfas的色谱峰分离度较好且峰形尖锐,可以进一步对各个代谢物进行质谱定量分析。
139.2.2线性关系考察
140.各待测物在绘制标准曲线时,横坐标代表外标与内标浓度比,纵坐标代表外标与内标峰面积比,从而得到各线性回归方程,并且线性回归方程的相关系数r2均大于0.9942,表明各待测物含量在线性范围内的线性关系良好,符合检测需求。7种scfas的线性回归方程、相关系数以及线性范围见表1。
141.2.3含量测定
142.将检测到的所有样本的积分峰面积比值代入到标准曲线线性方程中进行计算,进一步代入计算公式计算后,最终得到实际样本中该物质的绝对含量,结果见表2。
143.2.4统计学分析
144.为了更直观地展示不同物质之间在含量上的差异以及每种物质在不同样本中的含量分布情况,绘制直方图,见图8,结果显示,与正常对照组相比宣肺败毒组中乙酸及丙酸含量降低,其他5种scfas含量升高,且乙酸含量在给药后具有统计学差异(p<0.01)。
145.3.相关性分析
146.对每组差异分组检测到的差异微生物和差异代谢物进行相关性分析,计算微生物和代谢物的spearman相关系数,通过相关性热图展示每个差异分组里差异微生物分别在不同分类级别水平上与差异代谢物的相关性情况。从图9中可以看出,乙酸与unidentified_elusimicrobiaceae(迷踪菌科未分类属)、unclassified_erysipelotrichaceae(丹毒丝菌科未分类属)两个菌属呈显著正相关,与unidentified_rf16、odoribacter(臭杆菌)、unclassified_paraprevotellaceae(帕拉普氏菌科未分类属)、unclassified_bacteroidales(拟杆菌目未分类属)、paenisporosarcina(类芽孢八叠球菌)、unidentified_veillonellaceae(韦荣氏菌科未分类属)这6个菌属呈极显著负相关(p《0.01),与unclassified_rikenellaceae(理研菌科未分类属)、butyricimonas(丁酸弧菌)、cf231、desulfovibrio(脱硫弧菌属)、unidentified_f16这5个菌属呈显著负相关(p《0.05),说明宣肺败毒方通过影响乙酸的含量进一步调控这些菌群来发挥作用。
147.表1 7种scfas的线性回归方程、相关系数及线性范围
[0148][0149]
表2粪便中短链脂肪酸的含量测定结果(mg
·
g-1
)
[0150][0151][0152]
以上所述实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通工程技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明的权利要求书确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。