1.本发明涉及α-细辛脑的新用途,尤其涉及以α-细辛脑为唯一药理活性成分的药物在治疗缺血性脑卒中方面的应用。本发明可用于临床治疗缺血性脑卒中,属于生物医药领域。
背景技术:
2.脑卒中是全球导致死亡的第二大死亡原因,也是造成永久性残疾的主要原因,造成了巨大的社会和经济负担。在中国虽然脑卒中死亡率呈现降低的趋势。但发病率呈现增长趋势,目前每年有将近240万新增发病人口。脑卒中在临床上可分为出血性脑卒中和缺血性脑卒中,缺血性脑卒中主要是由于动脉粥样硬化导致血栓形成或栓子脱落所致。当缺血性脑卒中发生时,脑内血液循环减少或缺失,进而导致神经元细胞损伤和死亡。
3.脑缺血及再灌注后可造成脑内多种病理级联反应,主要包括能量代谢紊乱、氧化应激、炎症、细胞因子损伤、谷氨酸毒性、ca
2
超载、过量一氧化氮(no)合成、细胞凋亡等。级联反应首先表现为兴奋毒性,在梗死中心区域,由于缺血导致atp耗竭,使钠泵失活,兴奋性氨基酸(谷氨酸)从突触前膜过度释放,致使神经元受损。兴奋性神经递质释放及神经元细胞膜去极化是急性缺血性脑卒中引起细胞损伤和死亡的的关键环节。
4.脑卒中治疗的主要目的是挽救缺血半暗带或梗死核心周围血液灌注不足、无功能但仍可存活的组织。目前临床对于缺血性脑卒中的治疗策略主要是脑血流重建,脑血流重建包括静脉溶栓和动脉内溶栓,以及在血管造影和透视指导下进行血栓摘除手术。溶栓疗法中主要以重组型纤维蛋白酶原激活剂(recombinant tissue plasminogen activator,rtpa)溶栓为主,但 rtpa 溶栓作为一种主要的且有效的治疗方式,其治疗的时间窗口较窄(症状出现后3~4.5h内),只有不到5~7%的患者适用。半暗带缺血细胞死亡的几个关键因素已被确定,包括兴奋性毒性、氧化和亚硝化应激以及炎症。使用神经保护剂不仅能减少神经细胞死亡,而且可以延长溶栓治疗的时间窗。然而,针对这些损伤因素研发的大部分药物,尽管有很好的临床前数据,但临床试验结果尚不能充分证明其有效性。因此,开发新的神经保护剂具有重要意义。
5.γ-氨基丁酸(简称gaba)作为中枢神经系统中一种主要的抑制性神经递质,对脑的发育、神经元再生、神经可塑性等神经网络的调控都具有重要的意义
1.。纹状体超过90%的神经元都是gaba能神经元。研究表明,抑制纹状体神经元的活性有助于促进脑卒中后的神经元再生,并能够改善脑卒中的愈后。α-细辛脑(alpha-asarone)具有镇静、解痉、抗惊厥等作用,其可阻滞na
通道,激活gabaa受体而发挥抗癫痫作用
[2,3]
。此外,其还具有抗氧化应激,抑制谷氨酸受体的表达和谷氨酸在细胞膜上的内流等作用
[4]
。然而迄今为止,α-细辛脑对缺血性脑卒中的治疗作用尚未见报道。
技术实现要素:
[0006]
本发明采用mcao缺血再灌注大鼠模型,对α-细辛脑治疗缺血性脑卒中的作用进行
了系统的研究。本发明人意外地发现,α-细辛脑可有效治疗缺血性脑卒中,且无明显毒副作用。具体地,将其制备成注射剂、口服制剂,经静脉或口服给药,可显著增加大脑中动脉阻塞(middle cerebral artery occlusion, mcao)缺血再灌注大鼠的梗死侧半脑与对侧半脑血流比值,减小脑梗死体积;显著改善其神经功能评分,延长模型大鼠的生存期;显著降低缺血性脑卒中导致的癫痫发生率。在本发明提交前,该技术方案未见报道。本发明为脑卒中的治疗提供了一种有效、安全的药物。
[0007]
本发明通过将α-细辛脑与药学上可接受的辅料组合,制成适宜于人或动物使用的剂型,其给药途径可以是注射、口服、皮下植入、吸入、透皮、黏膜等,给药剂型可以是与不同给药途径相适应的任何剂型,前提是该剂型可使α-细辛脑进入脑内,达到有效治疗浓度。
[0008]
具体的,α-细辛脑在治疗缺血性脑卒中药物中的应用,其为所述药物中的唯一有效成分。优选的,该治疗缺血性脑卒中药物的剂型为注射剂和口服制剂。进一步,α-细辛脑作为所述药物中的唯一有效成分,其与药学上可接受的辅料的总重量比例为1:20~200。该药物治疗缺血性脑卒中的每日有效剂量为2~10mg/kg体重。
[0009]
更进一步的,当所述含有α-细辛脑的药物剂型为注射剂和口服制剂时,优选的剂型为乳剂。该乳剂包含治疗缺血性脑卒中的有效量的α-细辛脑和可药用油作为油相;可药用乳化剂作为乳化剂;其余为水相。
[0010]
在本发明实例中,可药用油为大豆油、中链油、橄榄油、鱼油中的至少之一组成。
[0011]
在本发明实例中,可药用乳化剂为蛋黄卵磷脂、大豆卵磷脂、普朗尼克f-68、聚乙二醇硬脂酸-15(solutol hs15)中的至少之一组成。
[0012]
在本发明实例中,还可根据乳化性能的需要,加入油酸、油酸钠或二者任意比例的混合物。配制时油酸溶于油相,油酸钠溶于水相,二者的混合物则分别溶于油、水两相。
[0013]
在本发明实例中,所述水相为注射用水或纯化水。水相还可含有甘油。
[0014]
当所述药物剂型为乳剂时,α-细辛脑与可药用辅料(含纯化水、注射用水)的总重量比为1: 20~200。乳剂中各组分的重量比为α-细辛脑0.5%~5%、油相5%~20%、乳化剂0.6%~1.8%、甘油0%~2.5%、纯化水或注射用水加至100%。所述的治疗缺血性脑卒中有效量的α-细辛脑,是指乳剂中含有的α-细辛脑能有效地治疗上述疾病。给药对象不同(如人或动物),该有效量也不同。乳剂的给药体积对给药对象来说应适当。α-细辛脑在乳剂中的浓度可在一定范围内变化。浓度变化范围取决于给药量、给药体积和α-细辛脑在油相中的溶解度。例如,浓度范围为0.5%~5.0%,即5mg/ml~50mg/ml。
[0015]
在该乳剂中也可以包含抗氧剂,抗氧剂可包括亚硫酸氢钠、维生素e、焦性没食子酸酯等。当口服给药时,也可以使用其他适宜的添加剂如防腐剂和矫味剂。
[0016]
具体的,制备所述的含有治疗缺血性脑卒中的有效量的α-细辛脑乳剂,其特征在于制备方法包括以下步骤:(1)分别称取处方量的α-细辛脑、辅料;(2)在氮气或其他惰性气体保护条件下,将α-细辛脑溶解于预热至60~80℃的油相中,再将乳化剂、甘油溶解或分散于预热至60~80℃的水相中,其中的乳化剂也可以先溶解或分散于油相中;(3)将上述油相和水相经高速剪切混合,使油相均匀分散于水相中,制备得到初乳;(4)初乳经高压均质,使乳滴平均粒径值不大于0.5μm,过滤,即得含有α-细辛脑的载药
乳剂,将其灌封于玻璃安瓿、输液瓶等适宜药用容器中;根据给药途径的需要,采用适宜方式旋转式热压灭菌,即得。
[0017]
在本发明实例中,用于治疗缺血性脑卒中大鼠的有效剂量为10mg~40mg/kg体重。根据不同种属动物之间的剂量换算关系,当其用作人用治疗缺血性脑卒中药物时,考虑到用药剂量的个体差异,其有效治疗剂量范围为1.0mg~10.0mg/kg体重,优选为1.5mg~4.0mg/kg体重。
[0018]
本发明可用作人用治疗缺血性脑卒中的药物,也可用作人用治疗因缺血性脑卒中引发的癫痫。它可通过注射、口服途径给药。
[0019]
根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。以下通过优选的具体实施例形式对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
具体实施方式
[0020]
实施例1 α-细辛脑注射乳剂的制备称取α-细辛脑0.50~50.0g、注射用大豆油50.0~200.0g,置适宜容器中,在充氮气保护条件下加热至60~80℃,搅拌使溶解;续称取蛋黄卵磷脂6.0~18.0g,加入其中,搅拌使溶解(必要时加入油酸、油酸钠或二者的混合物0.10~0.50g),制得油相,备用。另称取普朗尼克f-68 0~3.0g、甘油0~25.0g,量取水约800ml,在充氮气保护条件下加热至60~80℃,搅拌使溶解;制得水相。将上述油相加入水相,高速剪切5~15分钟,补加水至1000ml,制备成初乳。续将初乳采用高压均质机均质3~6次,使均质后的乳滴平均粒径不大于0.5μm,滤膜过滤,滤液在充氮气保护条件下灌装于5ml~20ml玻璃安瓿中,旋转式热压灭菌121℃
×
8~12 min,即得α-细辛脑注射乳剂,其中含α-细辛脑的浓度为0.5~50mg/ml。
[0021]
实施例2 α-细辛脑注射乳剂的制备称取α-细辛脑10.0g、注射用大豆油50.0g、注射用中链甘油三酯(mct)50.0g,置适宜容器中,在充氮气保护条件下加热至60~80℃,搅拌使溶解;续称取蛋黄卵磷脂12.0g、油酸钠0.3g,加入其中,搅拌使溶解,制得油相,备用。另称取甘油22.0g,量取水约800ml,在充氮气保护条件下加热至60~80℃,搅拌使溶解;制得水相。将上述油相加入水相,高速剪切5~15分钟,补加水至1000ml,制备成初乳。续将初乳采用高压均质机均质3~6次,使均质后的乳滴平均粒径不大于0.5μm,滤膜过滤,滤液在充氮气保护条件下灌装于5ml或10ml玻璃安瓿中,旋转式热压灭菌121℃
×
8 min,即得α-细辛脑注射乳剂,其中含α-细辛脑的浓度为10mg/ml。
[0022]
实施例3 α-细辛脑注射乳剂的制备称取α-细辛脑20.0g、注射用大豆油100.0g、注射用中链甘油三酯(mct)100.0g,置适宜容器中,在充氮气保护条件下加热至60~80℃,搅拌使溶解;续称取蛋黄卵磷脂12.0g、油酸0.3g,加入其中,搅拌使溶解,制得油相,备用。另称取甘油22.0g,量取水约800ml,在充氮气保护条件下加热至60~80℃,搅拌使溶解;制得水相。将上述油相加入水相,高速剪切5~15分钟,补加水至1000ml,制备成初乳。续将初乳采用高压均质机均质3~6次,使均质后的乳滴平均粒径不大于0.5μm,滤膜过滤,滤液在充氮气保护条件下灌装于5ml或10ml玻璃安瓿中,旋
转式热压灭菌121℃
×
8 min,即得α-细辛脑注射乳剂,其中含α-细辛脑的浓度为20mg/ml。
[0023]
实施例4 α-细辛脑注射乳剂的制备称取α-细辛脑1.0g、注射用大豆油100.0g,置适宜容器中,在充氮气保护条件下加热至60~80℃,搅拌使溶解;续称取蛋黄卵磷脂12.0g、油酸0.3g,加入其中,搅拌使溶解,制得油相,备用。另称取甘油22.0g,量取水约800ml,在充氮气保护条件下加热至60~80℃,搅拌使溶解;制得水相。将上述油相加入水相,高速剪切5~15分钟,补加水至1000ml,制备成初乳。续将初乳采用高压均质机均质3~6次,使均质后的乳滴平均粒径不大于0.5μm,滤膜过滤,滤液在充氮气保护条件下灌装于50ml输液瓶中,旋转式热压灭菌121℃
×
8 min,即得α-细辛脑注射乳剂,其中含α-细辛脑的浓度为1mg/ml。
[0024]
实施例5 α-细辛脑口服乳剂的制备制备方法同实施例1,油相可加入药学上可接受量的抗氧剂如维生素e、焦性没食子酸酯等,油相还可加入药学上可接受量的防腐剂,如尼泊金乙酯等;水相可加入药学上可接受量的矫味剂,如具有芳香味的果汁糖浆;水相还可加入药学上可接受量的防腐剂,如苯甲酸、苯甲酸钠等。同法制备成初乳,续将初乳采用高压均质机均质3~6次,使均质后的乳滴平均粒径不大于10μm,滤膜过滤,滤液在充氮气保护条件下灌装于适宜药用包装中,流通蒸汽灭菌100℃
×
15~45 min,或121℃
×
8~12 min,即得α-细辛脑口服乳剂。
[0025]
实施例6 α-细辛脑对脑缺血再灌注大鼠的治疗作用实验材料:spf级雄性sd大鼠,体重200~240g,购于四川省成都达硕实验动物有限公司,合格证号:scxk(川)2020-030。α-细辛脑购于哈尔滨三联药业有限公司。丁苯酞购于河北智恒医药科技股份有限公司。
[0026]
实验分组:sd大鼠随机分为假手术组(p组)、模型组(m组)、β-细辛脑静脉给药组(同法制备成乳剂,10mg/kg,b组)、α-细辛脑乳剂静脉给药低剂量组(10mg/kg,l组)、α-细辛脑乳剂静脉给药高剂量组(20mg/kg,h组)、α-细辛脑乳剂口服给药组(40mg/kg,o组)、丁苯酞组(10mg/kg,c组),每组12只。
[0027]
1. 脑缺血再灌注模型的建立及给药方案以改良的线栓法制作mcao模型:术前大鼠禁食12h,大鼠用10%水合氯醛(350mg/kg)腹腔注射麻醉。仰卧位固定,颈正中线切口,沿胸锁乳突肌内缘钝性分离肌肉和筋膜,分离右侧颈总动脉(cca)、颈外动脉(eca)和颈内动脉(ica),在cca近心端、ica及eca处置线备用。结扎cca、eca,用动脉夹暂时夹闭ica,然后在cca距分叉部约4mm处用针头戳一小孔,将栓线经cca插入到ica,用眼科镊轻推栓线,从血管分叉处开始算距离,当栓线上的标记到达分叉处时,紧紧系牢ica的细线,缝合伤口,待大鼠麻醉清醒后采用zea longga神经功能评分标准判断模型是否成功。缺血2h后,造模成功的大鼠拔出栓线进行再灌注,拔出栓线后立即尾静脉给予相应药物。假手术组除不插入栓线外,其余操作同上。
[0028]
2. mcao模型入选标准参照zea longa神经功能评分,在大鼠麻醉清醒后进行评分,评分为1~3分者入组:0分:无神经功能缺失症状,活动正常者1分:不能完全伸展对侧前爪2分:动物爬行时出现转圈(患侧的对侧追尾现象)3分:身体向偏瘫侧倾倒
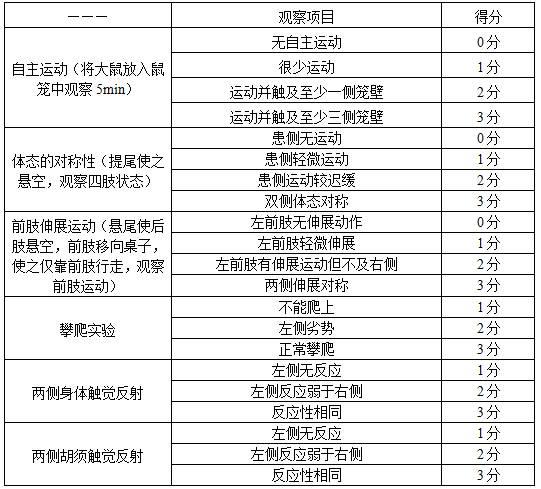
4分:不能自发行走,意识丧失者3. mcao模型排除标准(1)缺血再灌注24h内死亡者(2)取脑时发现颅底出血者(3)ttc染色未见缺血灶者4.神经功能缺损评分缺血再灌注24h后采用garcia jh神经功能评分,评分标准见表1,对大鼠的运动、感觉、攀爬、四肢对称性进行评价,评分范围为1~18分,得分越低,神经功能损伤越重,结果见表2。
[0029]
表1 garcia jh神经功能评分5. 脑梗死体积测定大鼠用10%水合氯醛(350mg/kg)腹腔注射麻醉,生理盐水心脏灌注后取脑,续将脑置于-20℃冰箱冷冻20~30min,便于切片。除去小脑、嗅球和低位脑干。冠状切片,厚度为2mm,第一刀在脑前极与视交叉连线中点处;第二刀在视交叉部位;第三刀在漏斗柄部位;第四刀在漏斗柄与后叶尾极之间。将脑片放入37℃预热的2% ttc染液中避光侵染30 min,每5 min轻微晃动容器,使脑片充分染色。取出脑片,用4%多聚甲醛溶液固定24h后拍照。用image j图像分析系统测量梗死面积及右脑面积,计算大脑相对梗死体积。相对梗死体积=脑梗死总面积/右脑总面积,结果见表2。
[0030]
6. α-细辛脑增加脑缺血再灌注大鼠梗死侧半脑的相对血流量缺血再灌注24h后,大鼠用10%水合氯醛(350mg/kg)腹腔注射麻醉,将其置于俯卧位,暴露颅骨,使用激光散斑对比成像系统监测双侧脑半球血流。续用moorflpi图像分析系统打开脑血流图像,于左右半脑相同部位分别选取6mm
×
4mm区域,测量左右半脑血流。梗死侧半脑血流相对值=梗死侧半脑血流值/对侧半脑血流值,结果见表2。
[0031]
表2 大鼠神经功能评分、脑梗死体积比及梗死半脑血流相对值与模型组比较,
*
p《0.05, **
p《0.01由表2可见,与模型组相比,α-细辛脑静脉给药低剂量组与高剂量组、α-细辛脑口服给药组、丁苯酞组均能显著的改善大鼠的神经功能症状,减少脑梗死面积,增加梗死侧半脑血流相对值(p《0.01);β-细辛脑静脉给药组则无显著差异。综上,α-细辛脑对脑缺血再灌注损伤具有确切的治疗作用。在同等剂量(10mg/kg)给药条件下,α-细辛脑组的治疗作用显著优于β-细辛脑组,与丁苯酞组相当。
[0032]
实施例7 α-细辛脑增加脑缺血再灌注大鼠的长期生存率实验材料、分组和造模方式同实施例6,大鼠缺血2h,再灌注后立即按分组给药方案给药,此后继续给药14天,每天给药一次,模型组和假手术组则给予相同体积的生理盐水。观察并记录大鼠的存活情况,结果见表3。
[0033]
表3脑缺血再灌注大鼠的长期生存率由表3可见,α-细辛脑组的生存率高于模型组、丁苯酞组及β-细辛脑组,表明α-细辛脑有助于延长缺血性脑卒中大鼠的长期生存率。
[0034]
实施例8 α-细辛脑降低大鼠脑缺血再灌注损伤导致的癫痫发生率实验材料、分组、造模方式及给药方案同实施例6,观察缺血再灌注24h内各组大鼠癫痫
发作情况,结果见表4。由表4可见,与模型组、β-细辛脑组、丁苯酞组相比,α-细辛脑低剂量组、高剂量组均无脑缺血再灌注损伤导致的癫痫发作,表明其可降低大鼠脑缺血再灌注损伤导致的癫痫发生率。
[0035]
表4 α-细辛脑对大鼠脑缺血再灌注后癫痫发作的影响与空白乳剂组比较,
*
p《0.05, **
p《0.01注:发作级别参照 racine标准,此标准依据癫痫发作程度将发作行为分为 6级:0 级为无反应或抽搐停止;ⅰ级为节律性嘴角或面部抽动;ⅱ级为点头或甩尾;ⅲ级为单肢抽动;ⅳ级为多肢抽动或强直;
ⅴ
级为全面性强直-阵挛发作。ⅰ、ⅱ和ⅲ级为阵挛性发作,ⅳ和
ⅴ
级为强直性发作。
[0036]
综上药效学研究结果,α-细辛脑确能显著改善缺血性脑卒中大鼠的神经行为学功能,显著降低脑其脑梗死体积,增加梗死侧半脑血流相对值,增加其长期生存率。据此,α-细辛脑有望成为极具应用前景的治疗缺血性脑卒中药物。
[0037]
发明的实用性本发明首次发现α-细辛脑具有治疗缺血性脑卒中的作用,提供了以α-细辛脑为唯一药效成分的乳剂配方与制备方法,并将其用于治疗缺血性脑卒中大鼠模型,证实了其有效性,故本发明有望为临床提供一种新的缺血性脑卒中治疗药物。本发明技术方案先进合理,具有创造性、新颖性和实用性,预期将产生良好的社会与经济效益。参考文献[1]shaoyu g, eyleen l k, goh k a, et al. gaba regulates synaptic integration of newly generated neurons in the adult brain [j]. nature, 2006, 439: 589-593.[2]wang z j, levinson s r, sun l, et al. identification of both gabaa receptors and voltage-activated na( ) channels as molecular targets of anticonvulsant alpha-asarone [j]. front pharmacol, 2014, 5(40):5-11.[3]huang c, li w g, zhang x b, et al. alpha-asarone from acorus gramineus alleviates epilepsy by modulating a-type gaba receptors [j]. neuropharmacology, 2013, 65(2):1-11.[4]lam k y, yao p, wang h, et al. asarone from acori tatarinowii rhizome prevents oxidative stress-induced cell injury in cultured astrocytes: a signaling triggered by akt activation [j]. plos one, 2017, 12(6): 12-17。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。