1.本发明属于生物技术领域,本发明涉及一种核苷检测方法及其应用。
背景技术:
2.核苷酸是一类由嘌呤碱或嘧啶碱、核糖或脱氧核糖以及磷酸三种物质组成的化合物,核苷酸是一种小分子物质,在生物体内,核苷酸是一类非常重要的低分子化合物,具有多种重要的生理功能,可以作为脱氧核糖核酸(dna)、核糖核酸(rna)的前体,也可以作为生理、生化过程的调节物质参与生物体的物质代谢活动, 如参与生物体的能量代谢,与其相关的三磷酸腺苷(atp)、脱氢辅酶等。
3.根据糖的不同,核苷酸可分为核糖核酸及脱氧核糖核酸两类,根据碱基的不同,可分为腺嘌呤核苷酸(腺苷酸、amp)、鸟嘌呤核苷酸(鸟苷酸、gmp)、胞嘧啶核苷酸(胞苷酸、cmp)、尿嘧啶核苷酸(尿苷酸、ump)、胸腺嘧啶核苷酸(胸苷酸、tmp)、及次黄嘌呤核苷酸(肌苷酸、imp)等。
4.核苷是含氮碱基与糖组分缩合成的糖苷,包含核糖核苷、脱氧核糖核苷两类,常见的核苷有腺嘌呤核苷、鸟嘌呤核苷、胞嘧啶核苷、尿嘧啶核苷、胸腺嘧啶核苷)、及次黄嘌呤核苷等。核苷作为能量来源的一类物质,也会被添加在蛋白质类药物生产过程中宿主细胞的培养基中。
5.目前生物类药品的制备生产,尤其是蛋白质类药物的制备生产,不再使用早期的由动物脏器或组织中分离的方法取得,而是使用基因工程技术的方法制备生产。使用基因工程技术获得的蛋白质类药物,大大降低了因动物源而引起的用药风险,并且可以明显的降低生产成本,提高蛋白质类药物的生产质量及产量。
6.在蛋白质类药物的制备生产过程中,常用的方法是将含有需要表达的蛋白质类药物的基因序列的表达载体,转染至合适的宿主细胞中,并进行宿主细胞的培养、表达。其中常用的宿主细胞有原核细胞、真核细胞,现有技术中,蛋白质类药物的大规模生产表达多使用大肠杆菌、酵母菌或哺乳动物细胞,其中cho细胞(chinese hamster ovary cell,中国仓鼠卵巢细胞)是最常用的宿主细胞。
7.中国仓鼠卵巢细胞(cho细胞)哺乳动物表达系统被广泛用于生产蛋白质类药物,其中影响外源基因表达水平的因素有很多,涉及基因的复制、转录和转录后翻译等各级水平;对于整体而言,宿主细胞的生长环境也是一个非常重要的影响因素。
8.在含有目标蛋白质类药物基因的宿主细胞培养过程中,使用何种宿主细胞培养基是关键的控制因素。在蛋白质类药物的生产过程中,不仅要求宿主细胞本身能够快速生长,也要求该宿主细胞能够更好的表达出目标蛋白质类药物。对于含有不同外援基因的宿主细胞而言,需要不同类型的培养基来满足其生长及外源基因的表达;根据所要求表达的目标蛋白质类药物的性质、结构的不同,选择不同类型的宿主细胞培养基。
9.所以,中国仓鼠卵巢细胞(cho细胞)哺乳动物表达系统中,宿主细胞使用的培养基种类是影响蛋白质类药物大规模生产表达的重要因素。对于培养基中的各种成分的检测,
是确保表达系统能够高效表达的关键技术手段。
技术实现要素:
10.本发明提供一种核苷的检测方法及应用,本发明所述的方法采用超高效液相色谱法(uplc)进行cho宿主细胞培养基及细胞培养上清中有效成分的检测,所述的方法能在15分钟内快速地同时检测出胞苷、次黄嘌呤、尿苷、鸟苷、胸苷及腺苷共6种核苷的成分及含量。
11.现有的核苷检测方法多为毛细管电泳法和高效液相色谱法(hplc),只能对少数几个核苷进行同时检测,耗时长、检测核苷种类不够,且目前未有专门针对cho宿主细胞培养基及细胞培养上清中核苷检测的方法。
12.现有技术中所提供的核苷检测方法,耗时长、检测成本高,且没有一种方法可以一次性同时检测胞苷、次黄嘌呤、尿苷、鸟苷、胸苷及腺苷共6种核苷的成分及含量。
13.而本发明所提供的核苷检测方法,可以一次性同时检测胞苷、次黄嘌呤、尿苷、鸟苷、胸苷及腺苷共6种核苷的成分及含量;本发明所提供的核苷检测方法,采用超高效液相色谱法(uplc)能够在短时间内快速、准确地检测出待检样品中的核苷酸种类及含量;本发明所提供的核苷检测方法,适用于血清、蛋白质表达宿主细胞的培养基等干扰成分较多的样品。
14.本发明公开了一种核苷检测方法,该方法使用超高效液相色谱分析法检测核苷,所述检测方法的流动相包括流动相a、流动相b、流动相c;所述流动相a为乙酸铵、或三乙胺,流动相b为乙腈,流动相c为超纯水。
15.如上所述的核苷检测方法,所述流动相a为0.01%~0.1%三乙胺,流动相b为80%~100%乙腈。如上所述的核苷检测方法,优选实施例为流动相a为0.1%三乙胺,流动相b为100%乙腈。
16.如上所述的核苷检测方法,所述流动相a为1mm~10mm的乙酸铵,流动相b为80%~100%乙腈。如上所述的核苷检测方法,优选实施例为流动相a为10mm的乙酸铵,流动相b为100%乙腈。
17.如上所述的核苷检测方法,所述超高效液相色谱检测方法的检测柱温为25℃~45℃。其优选实施例为所述超高效液相色谱检测方法的检测柱温为25℃。
18.如上所述的核苷检测方法,所述超高效液相色谱检测方法的检测流速为0.1ml/min~0.7ml/min,其优选实施例为所述超高效液相色谱检测方法的检测流速为0.3ml/min。
19.如上所述的核苷检测方法,所述超高效液相色谱检测方法的洗脱梯度为:时间(min)%a%b�.0099.90.10.03.0095.05.00.08.5095.05.00.09.000.050.050.010.300.050.050.010.3199.90.10.015.0099.90.10.0
如上所述的核苷检测方法的应用,所述检测方法用于血清中的核苷检测,或蛋白质类药物生产的宿主细胞培养基、及培养上清中的核苷检测。优选实施例所述检测方法用于抗体药物生产的cho宿主细胞的培养基、及培养上清中的核苷检测。
附图说明
20.图1、accq-tag ultra c18 1.7μm 2.1*100mm色谱柱柱温25℃时标准品检测图谱;图2、accq-tag ultra c18 1.7μm 2.1*100mm色谱柱柱温45℃时标准品检测图谱;图3、acquity uplc hss t3 1.7μm 2.1*100mm色谱柱流动相a为10mm的乙酸铵时标准品检测图谱;图4、acquity uplc hss t3 1.7μm 2.1*100mm色谱柱流动相a为0.1%三乙胺时的标准品检测图谱;图5、uplc检测10mg/l标准品与chom-b01培养基中核苷的对比色谱图;图6、cho宿主细胞培养基chom-b02核苷的检测色谱图;图7、cho宿主细胞培养上清样品1的核苷检测色谱图;图8、cho宿主细胞培养上清样品2的核苷检测色谱图。
具体实施方式
21.实施例1:6种核苷标准品配制核苷标准品中含有胞苷、次黄嘌呤、尿苷、鸟苷、胸苷和腺苷共6种,每种核苷浓度均为0.5g/l,加盐酸助溶,选用可可碱作为内标,其浓度为0.5g/l。
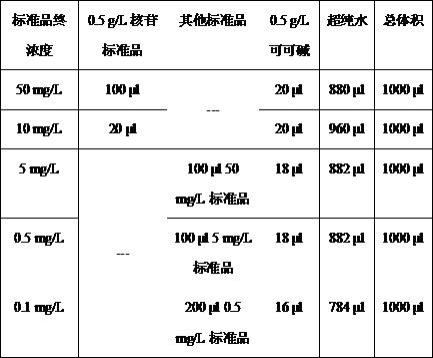
22.使用0.5g/l核苷标准品稀释制备成不同浓度标准品,标准曲线线性范围为0.1-50 mg/l,据此设置标准品浓度分别为50、10、5、0.5和0.1 mg/l。不同浓度标准品中均添加终浓度10 mg/l的可可碱。
23.可可碱溶解方法:称量50mg可可碱,加入约12ml浓盐酸,待溶解后在加水定容至100ml。
24.标准品稀释方法见表1。
25.表1、标准品稀释方法
实施例2:uplc色谱柱检测1)、accq-tag ultra c18 1.7μm 2.1*100mm色谱柱流动相a为:0.1%三乙胺;流动相b为:100%乙腈;流动相c为:milli q水(超纯水),(注:超纯水可用预冷至室温的注射用水替代,但使用前需用0.22 μm滤膜过滤)。
26.uplc色谱柱柱温:25℃或45℃;进样体积:1μl;流速:0.3 ml/min;检测波长:260 nm。
27.检测洗脱条件,梯度洗脱,参数见表2。
28.表2、uplc色谱柱梯度洗脱参数时间(min)流速(ml/min)%a%b�0.399.90.10.03.00.395.05.00.08.500.395.05.00.09.000.30.050.050.010.300.30.050.050.010.310.399.90.10.015.000.399.90.10.0经过上述uplc层析条件后检测图谱见图1及图2,图1为色谱柱柱温25℃时的标准品检测图谱,图2为色谱柱柱温45℃时的标准品检测图谱。
29.2)、acquity uplc hss t3 1.7μm 2.1*100mm色谱柱流动相a为:10mm的乙酸铵、或0.1%三乙胺;流动相b为:100%乙腈;流动相c为:milli q水(超纯水),(注:超纯水可用预冷至室温的注射用水替代,但使用前需用0.22 μm滤膜过滤)。
30.uplc色谱柱柱温:25℃;进样体积:1μl;流速:0.3 ml/min;检测波长:260 nm。
31.检测洗脱条件,梯度洗脱,参数见表2。
32.经过上述uplc层析条件后检测图谱见图3及图4,图3为流动相a为10mm的乙酸铵时的标准品检测图谱,图4为流动相a为0.1%三乙胺时的标准品检测图谱。
33.上述不同uplc色谱柱、不同检测条件下的各标准品及内标物被洗脱出峰的顺序依次为:胞苷、次黄嘌呤、尿苷、鸟苷、胸苷、腺苷、可可碱,参见图1至图4。
34.实施例3、抗体生产中cho宿主细胞培养基、及培养上清中核苷的检测1)、样品准备悬液1000 rpm离心10 min后,取上清-20℃冻存。使用前于室温解冻。
35.样品稀释抗体生产过程中的cho宿主细胞的培养基和培养上清无需稀释,但需添加终浓度10 mg/l的可可碱(每490μl添加10 μl 0.5 g/l可可碱,相当于稀释1.02倍),之后使用3k超滤离心管(millipore,货号ufc500396)超滤处理,超滤后标注“已超滤”或“uf”(ultrafiltration)。
36.3k超滤离心管使用前处理:新的超滤离心管可检漏后直接使用。若为使用过的超滤离心管,弃去其中液体,用纯化水冲洗2次(冲洗不能正对滤膜)。之后加500 μl纯化水14,000 g离心15 min,弃去滤过液,甩去离心管中残余水滴。超滤离心管使用前需检漏(新旧离心管均需检漏,直接使用样品检漏),加200 μl细胞培养上清,1000 rpm离心2 min,若无液体滤下,则超滤离心管完好。
37.超滤离心:14000 g离心15 min,取滤过溶液用于核苷检测。
38.超滤离心管使用后处理:弃去离心管中液体,用纯化水冲洗2次;用0.1 mol/l naoh浸泡2次,每次15 min;若超滤离心管当天不用,改用20%乙醇浸泡15 min,弃去离心管中乙醇并添加20%乙醇于4℃保存。
39.uplc检测:运行样品前,先运行平衡2次,平衡色谱柱2次。
40.方法组为“核苷”,仪器方法为“核苷uplc洗脱方法”,处理方法为“核苷”,终止程序为“核苷检测终止程序”,色谱柱位置保持在位置4。需注意,运行终止程序时,功能设为“平衡色谱柱”,时间为75 min。
41.取100μl超滤处理后样品,添加至全回收瓶(特别需注意,需弹掉瓶底部气泡,气泡会造成进样失败),上机检测核苷含量。
42.第一个标准品图谱结果出来后,检查峰个数和相应位置是否正常。若不正常,流动相或仪器设置可能有问题,需查找问题并解决。
43.以抗体生产过程中cho宿主细胞培养基chom-b01为例,使用acquity uplc hss t3 1.7μm 2.1*100mm色谱柱,流动相a为:10mm的乙酸铵;流动相b为:100%乙腈;流动相c为:milli q水(超纯水),(注:超纯水可用预冷至室温的注射用水替代,但使用前需用0.22 μm滤膜过滤)。
44.uplc色谱柱柱温:25℃;进样体积:1μl;流速:0.3 ml/min;检测波长:260 nm。
45.检测洗脱条件,梯度洗脱,参数见表2。
46.检测cho宿主细胞培养基chom-b01核苷的结果见图5,图5为uplc检测10mg/l标准品与chom-b01培养基中核苷的对比色谱图。
47.检测cho宿主细胞培养基chom-b02核苷的结果见图6。
48.检测cho宿主细胞培养上清样品1的结果,见图7。
49.检测cho宿主细胞培养上清样品2的结果,见图8。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。