1.本发明涉及一种检测金黄色葡萄球菌的电化学适配体传感器及其制备方法与应用方法,属于生物传感器技术领域。
背景技术:
2.金黄色葡萄球菌是一种常见的机会致病菌,通常定植于人类皮肤和粘膜表面,尤其是前鼻孔(约占一般人群的30%)。当宿主的免疫力降低或皮肤和粘膜屏障被破坏时,它可以进入任何器官或进入血液,轻度则引起皮肤和软组织感染(脓疱病、毛囊炎和烫伤皮肤综合征),重度则导致严重的系统性疾病,如菌血症、心内膜炎、骨髓炎、溶血性肺炎和中毒性休克综合征。虽然轻度的皮肤和粘膜感染通常具有自限性,但严重的全身感染通常伴随着高死亡率(20%-50%)、高复发率(5-10%)和持续性损伤(超过三分之一的幸存者)。金黄色葡萄球菌是引起医院获得性感染的主要病原体。由于免疫系统受损和频繁的侵入性手术,高达2%的住院患者感染了金黄色葡萄球菌。金黄色葡萄球菌的毒性越来越强,对抗生素的耐药性也越来越强。
3.快速、有效、准确地诊断金黄色葡萄球菌对于快速治疗感染患者、防止感染传播和减少耐药菌株的形成具有重要意义。现有的检测金黄色葡萄球菌的金标准仍然是培养方法,但它非常耗时,通常需要1-2天才能获得单个菌落,然后需要1-2天才能获得化学鉴定及药敏结果。近年来,发展了一些快速、自动化的检测方法,如酶联免疫吸附试验(elisa)、聚合酶链反应(pcr)、流式细胞术和质谱,虽然只需1-5小时即可得到结果,但是这些方法需要昂贵的仪器、复杂的样品制备以及较高的专业要求,不太适合偏远贫穷地区,也不适合床旁检测。此外,生物传感器法由于其快速、简便、特异、灵敏的特性,已经被越来越被研究人员所关注。但是传统的生物传感器一般被证明临床实用性差,主要是由于生物污染导致的不稳定或不可靠的传感器响应(如蛋白质吸附、血小板粘附和凝块形成)。即使没有靶标,当用au电极构建的传感器检测全血样品时,也可以观察到峰值电流的快速衰减,这归因于血样中生物硫醇的干扰。因此,制备出一种能克服干扰且快速、简便、特异、灵敏的金黄色葡萄球菌检测用生物传感器,使得金黄色葡萄球菌检测诊断时间缩短、临床诊断更准确,这将具有重要的现实意义。
技术实现要素:
4.本发明的目的是针对以上背景技术中的技术问题,提供一种检测金黄色葡萄球菌的电化学适配体传感器及其制备方法与应用方法。
5.本发明提供的方案如下:
6.一种检测金黄色葡萄球菌的电化学适配体传感器的制备方法,包含以下步骤:
7.(1)将玻碳电极与铂丝构成的双电极系统浸入壳聚糖溶液中,用电化学沉积法沉积300-800秒,得到壳聚糖膜修饰的玻碳电极;
8.(2)以壳聚糖膜修饰的玻碳电极为工作电极,以铂丝作为对电极,以ag/agcl电极作为参比电极构成三电极系统,将三电极系统浸入邻苯二酚溶液中,接枝邻苯二酚得到邻苯二酚-壳聚糖膜修饰的玻碳电极;
9.(3)将所得邻苯二酚-壳聚糖膜修饰的玻碳电极浸入金黄色葡萄球菌适配体溶液进行化学结合,得到适配体-邻苯二酚-壳聚糖膜修饰玻碳电极。
10.作为上述技术方案的优选,所述金黄色葡萄球菌适配体的序列为5
′‑
gcaatg gta cgg tac ttc ctc ggc acg ttc tca gta gcg ctc gct ggt cat ccc aca gctacg tca aaa gtg cac gct act ttg ctaa-3
′‑
cho;金黄色葡萄球菌适配体需先溶解在缓冲液中,并进行先加热变性一段时间而后快速冷却,使适配体获得适当的折叠从而结合目标分子。
11.作为上述技术方案的优选,所述步骤(2)中邻苯二酚溶液的浓度控制在1-10mm。
12.基于同一技术构思,本发明还提供一种由上述的制备方法制备得到的检测金黄色葡萄球菌的电化学适配体传感器。
13.基于同一技术构思,本发明还提供一种检测金黄色葡萄球菌的电化学适配体传感器的检测应用方法,包含以下步骤:
14.1)根据金黄色葡萄球菌系列浓度标准溶液的循环伏安法所得出的cv曲线建立标准曲线方程;
15.2)取用或制备待测样品溶液;
16.3)基于步骤2)中制备的待测样品溶液,采用循环伏安法检测待测样品溶液的fc氧化电流峰值;
17.4)根据fc氧化电流峰值与金黄色葡萄球菌浓度之间的标准曲线方程计算得出待测样品溶液中金黄色葡萄球菌的浓度含量。
18.作为上述技术方案的优选,所述标准曲线方程是在微电极传感器的fc-ru
3
双电子介质溶液中加入金黄色葡萄球菌系列浓度标准溶液后得到;金黄色葡萄球菌系列浓度标准溶液为pbs溶液中金黄色葡萄球菌的系列浓度溶液或者全血样本中的金黄色葡萄球菌系列浓度溶液。
19.作为上述技术方案的优选,pbs溶液中金黄色葡萄球菌的系列浓度溶液作为金黄色葡萄球菌系列浓度标准溶液时,所述步骤1)中的标准曲线方程为:δp(μa)=-0.155logc(cfu/ml) 0.059(r2=0.9928);标准曲线方程的检测限(lod)和定量限(loq)分别为2cfu/ml和10cfu/ml。
20.作为上述技术方案的优选,全血样本中的金黄色葡萄球菌系列浓度溶液作为金黄色葡萄球菌系列浓度标准溶液时,所述步骤1)中的标准曲线方程为:δp(μa)=-0.182logc(cfu/ml) 0.092;标准曲线方程的检测限(lod)和定量限(loq)分别为2cfu/ml和10cfu/ml。
21.作为上述技术方案的优选,所述步骤1)建立标准曲线方程的步骤为:
22.a:在电化学适配体传感器中的fc-ru
3
双电子介质溶液中加入已知浓度的金黄色葡萄球菌溶液;采用循环伏安法对已知浓度的金黄色葡萄球菌溶液进行测量,cv的扫描电压从-0.5v到 0.5v,记录cv曲线直到信号稳定;记录该浓度下的金黄色葡萄球菌溶液在信号稳定时的fc氧化电流峰值;
23.b:采用不同浓度的金黄色葡萄球菌溶液重复步骤a,根据各fc氧化电流峰值与不同浓度的金黄色葡萄球菌之间的线性关系得出线性回归方程。
24.作为上述技术方案的优选,所述步骤a中采用循环伏安法进行测量时,每次测量执行7.5循环即可获得稳定信号,最后一个循环即为fc氧化电流峰值测试结果。
25.与现有技术相比,本发明的有益效果为:
26.通过采用玻碳电极、邻苯二酚-壳聚糖膜和fc-ru
3
双电子介质构成氧化还原电容器作为放大系统,并优化选择邻苯二酚-壳聚糖膜的接枝工艺,使得制备得到的电化学适配体传感器的检测灵敏度高。控制壳聚糖的电化学沉积时间,使得制备的壳聚糖膜修饰的玻碳电极的壳聚糖膜厚度适宜,既保证了壳聚糖膜能够包覆住玻碳电极基体以保障邻苯二酚与金黄色葡萄球菌适配体能够足量和均匀的接枝与玻碳电极周围;又使得壳聚糖膜不至于过厚而影响工作电极吸放电子的氧化还原作用。
27.本发明设计并研制的一种灵敏、特异、简便的直接检测金黄色葡萄球菌的电化学适配体传感器。适配体具有较高的特异性、亲和力和重现性,能够成功捕获金黄色葡萄球菌并将其与其他细菌区分开来,具有良好的选择性;同时能够克服全血样本检测时硫基的干扰,具有更高的检测精度。同时本发明的电化学适配体传感器还具有良好的重现性,使得传感器能够多次应用,节约了资源。
28.采用cv法记录由于金黄色葡萄球菌的阻断作用而逐渐降低的fc氧化峰电流信号,无需任何预处理(孵育反应或样品预浓缩),5分钟即可实现金黄色葡萄球菌的定量检测,展示了其在poct系统中的潜在应用。适配体电化学传感器显示出较好的检测性能,低至2cfu/ml的检测限和跨越七个数量级的线性范围(10-107cfu/ml),并且能直接定量的检测全血中的金黄色葡萄球菌。此外,适配体的轻松更换可以保证传感器易于定制,以方便制造适用于细菌测定的实用高性能生物传感器。
附图说明
29.图1为邻苯二酚-壳聚糖膜在fc、ru3 介质中放大电流信号的示意图。其中:(a)为未修饰的玻碳电极在fc、ru3 介质中的电流信号的结果图,(b)为邻苯二酚-壳聚糖膜修饰的玻碳电极在fc、ru3 介质中的电流信号的结果图,(c)为电流放大原理示意图。
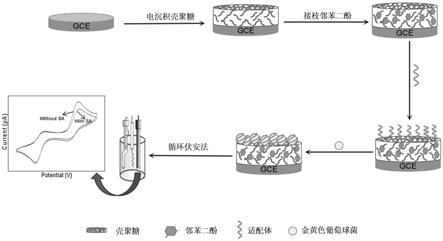
30.图2为金黄色葡萄球菌的电化学适配体传感器制备及检测过程示意图。
31.图3为电沉积壳聚糖不同时间(300s、400s、500s、600s、700s、800s)的传感器的fc氧化峰电流结果图。
32.图4为不同浓度邻苯二酚溶液(1mm、3mm、5mm、7mm、9mm)下传感器的fc氧化峰电流结果图。
33.图5为分别用壳聚糖(chi)、邻苯二酚-壳聚糖(cat-chi)、适配体-邻苯二酚-壳聚糖(apt-chi-cat)膜修饰玻碳电极的ft-ir光谱图。
34.图6为分别用壳聚糖(chi)、邻苯二酚-壳聚糖(cat-chi)、适配体-邻苯二酚-壳聚糖(apt-chi-cat)膜修饰玻碳电极的的x射线光电子能谱图。
35.图7为不同修饰状况下的玻碳电极在含50μm fc和ru
3
的pbs下的典型响应cv曲线图。
36.图8为电化学适配体传感器对不同细菌的选择性情况检测结果图。
37.图9为电化学适配体传感器在不同浓度下(1-109cfu/ml)金黄色葡萄球菌pbs溶液的cvs响应图。
38.图10为图9的fc氧化峰电流值与金黄色葡萄球菌浓度的对数变化关系曲线图。
39.图11为不同放大率下金黄色葡萄球菌(10
10
cfu/ml)与核酸适配体-邻苯二酚-壳聚糖膜结合的低温扫描电镜图像。其中(a)3000倍;(b)6000倍;(c)12000倍;(d)24000倍。
40.图12为金黄色葡萄球菌的革兰氏染色(10
10
cfu/ml),在不同的放大倍数下被电化学捕获情况图;其中:(a)1000倍;(b)3000倍。
41.图13为电化学适配体传感器在全血样本中的fc氧化峰电流值随血液中金黄色葡萄球菌浓度的对数变化关系曲线cv图。
42.图14为在金黄色葡萄球菌(106cfu/ml)存在下,电化学适配体传感器多次循环的cv曲线图。
43.图15为在金黄色葡萄球菌(106cfu/ml)存在下的电化学适配体传感器多个周期的输入-输出电流曲线图。
具体实施方式
44.为了便于理解本发明,下文将本发明做更全面、细致地描述,但本发明的保护范围并不限于以下具体实施例。
45.除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
46.除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到。
47.电化学适配体传感器的设计和响应机制:
48.玻碳电极浸入含有双介质(fc和ru
3
)的pbs(0.1m,ph7.4)溶液中的常规循环伏安法如图1a所示,可观察到两对氧化还原电流峰,一个是fc氧化峰,另一个是ru
3
还原峰(峰值电流约为2μa)。如图1b所示,邻苯二酚-壳聚糖膜修饰的玻碳电极与溶液中的双介质(fc和ru
3
)可以形成氧化还原电容器,并对fc氧化和ru
3
还原电流信号产生放大效应(峰值电流增加到17μa)。电流放大原理如图1c所示,简言之,当正向电压作用在电极上时,介质fc可以通过将电子转移到电极上氧化为fc
,然后通过接受膜中邻苯二酚的电子重新还原为fc,而邻苯二酚则转化为氧化邻苯二酚(邻醌)。当反向电压作用在电极上时,介质ru
3
通过接受来自电极的电子还原为ru
2
,然后通过将电子转移到膜中的氧化邻苯二酚(邻醌),从而将ru
2
再氧化为ru
3
。同时,氧化邻苯二酚(邻醌)则被还原为邻苯二酚结构。这样,一个电子将依次从fc、电极、ru
3
、邻醌、邻苯二酚和fc绕来绕去。只有当电子从fc转移到电极时,它才会被ru
3
迅速捕获并转移回fc。由于fc
直接被邻苯二酚还原而不是从电极接受电子,并且ru
2
被邻醌及时氧化而不是将电子转移到电极,因此fc
还原和ru
2
氧化电流峰值将减小。因此,邻苯二酚-壳聚糖膜修饰电极可以充当氧化还原电容器并放大fc和ru
3
介质中的电流。
49.基础实验用具:
50.1、试剂和细菌
51.壳聚糖(chi,脱乙酰化≥75%),邻苯二酚(cat,≥99),1,1
’‑
二茂铁二甲醇(fc,97%)和氯化六胺钌(ⅲ)(ru
3
,98%)。
52.金黄色葡萄球菌(staphylococcus aureus,s.aureus)、表皮葡萄球菌
(staphylococcus epidermidis,s.epidermidis)、肺炎克雷伯菌(klebsiella pneumoniae,k.pneumoniae)、鲍曼不动杆菌(acinetobacter baumannii,a.baumannii)、铜绿假单胞菌(pseudomonas aeruginosa,p.aeruginosa)、大肠杆菌(escherichia coli,e.coli)、屎肠球菌(enterococcus faecium,e.faecium)、奇异变形杆菌(proteus mirabilis,p.mirabilis)、化脓链球菌(streptococcus pyogenes,s.pyogenes),肺炎链球菌(streptococcus pneumoniae,s.pneumoniae)。首先进行分离培养,选取单个菌落进行增菌,并用pbs制备不同浓度的金黄色葡萄球菌。采用标准平板计数法进行金黄色葡萄球菌计数。
53.2、适配体
54.由上海生物工程技术服务有限公司合成带醛基修饰的金黄色葡萄球菌适配体。序列为5
′‑
gca atg gta cgg tac ttc ctc ggc acg ttc tca gta gcg ctc gct ggt cat ccc aca gctacg tcaaaa gtg cac gct act ttg cta a-3
′‑
cho。将金黄色葡萄球菌适配体溶解在缓冲液(10mm tris
–
hcl,with 150mm nacl,5mm kcl,2mm mgcl2,1mm cacl2,ph 7.4)中,并在95℃加热5分钟,进行变性处理,然后在4℃下快速冷却15分钟,使适配体获得适当的折叠从而结合目标分子。
55.本发明所运用的测定方法:
56.1)、傅里叶变换红外光谱法(ftir)
57.ftir(thermo scientific nicolet is5)用于分析玻碳电极膜上的化学官能团,以确定壳聚糖、邻苯二酚和适配体是否成功沉积在玻碳电极上。壳聚糖、邻苯二酚和适配体分别结合在玻碳电极上后,将膜从玻碳电极上刮下并干燥进行ftir分析。取2mg从玻碳电极上刮下的粉末样品和200mg纯溴化钾,用研钵和杵将混合物研磨成细粉末。然后将混合物压成薄片用来测量ftir光谱(4000~400cm-1
波长,32次扫描,4cm-1
分辨率)。
58.2)、x射线光电子能谱(xps)
59.利用xps分析壳聚糖、邻苯二酚-壳聚糖和适体-邻苯二酚-壳聚糖薄膜中化学元素的化学成分和状态。xps测量是在带有单色a1 kα(1486.6ev)x射线源的thermo scientific k-alpha仪上获得的。使用284.8处的c1s峰作为参考,在超高真空下以50ev通能记录光谱。
60.3)、冷冻电子显微镜
61.利用cryo sem(fei quanta 450)证实金黄色葡萄球菌与适配体-邻苯二酚-壳聚糖膜特异性结合。将结合了金黄色葡萄球菌的适配体-邻苯二酚-壳聚糖膜沾在样品台上的导电碳胶上。然后将带有样品的样品台放入液氮中30秒,快速冷冻。将样品在-90℃下升华10分钟,然后用10ma的电流溅射并镀金60秒。最后,将样品送至扫描电子显微镜样品室进行观察。冷冻温度为-140℃,加速电压为5kv。
62.4)、革兰染色
63.革兰氏染色用于确认金黄色葡萄球菌特异性地结合到适配体-邻苯二酚-壳聚糖膜上。将金黄色葡萄球菌-适配体-邻苯二酚-壳聚糖膜直接印在干净的载玻片上并风干。然后进行革兰氏染色,并在油镜(
×
1000倍)下检查,以发现膜上结合的革兰氏阳性球菌(金黄色葡萄球菌)。
64.实施例1
65.一种检测金黄色葡萄球菌的电化学适配体传感器及其制备方法,如图2所示,包括
以下步骤:
66.(1)将玻碳电极与铂丝构成的双电极系统浸入壳聚糖溶液中,用电化学沉积法沉积,得到壳聚糖膜修饰的玻碳电极。
67.使用1m hcl溶液溶解壳聚糖,然后用1m naoh溶液将其ph调至5-6。用磁力搅拌器搅拌一夜,并过滤壳聚糖溶液以去除未溶解的颗粒。用粒径为1.0μm,0.3μm,0.05μm的氧化铝粉对玻碳电极进行抛光,每次三分钟。将玻碳电极浸泡在蒸馏水中超声处理10分钟,然后用王水(h2so4/30%h2o27:3,v/v)浸泡10分钟,最后用水和乙醇分别冲洗3次。将玻碳电极浸入壳聚糖溶液中,用计时电流法(-0.5~-3v,玻碳电极作为工作电极,铂丝作为对电极)在玻碳电极表面电沉积壳聚糖。电沉积500秒后,将壳聚糖修饰的工作电极从壳聚糖溶液中取出,用蒸馏水冲洗并用氮气进行干燥。
68.(2)以壳聚糖膜修饰的玻碳电极为工作电极,以铂丝作为对电极,以ag/agcl电极作为参比电极构成三电极系统,将三电极系统浸入邻苯二酚溶液中,接枝邻苯二酚得到邻苯二酚-壳聚糖膜修饰的玻碳电极。
69.将步骤(1)获得的工作电极浸入浓度为5mm的邻苯二酚溶液(0.1m pbs,ph7.4)中,采用计时电压法(电压为0.6v,计时500秒,玻碳电极作为工作电极,铂丝作为对电极,ag/agcl电极作为参比电极),将邻苯二酚接枝到壳聚糖上。反应后将邻苯二酚-壳聚糖膜修饰的玻碳电极从邻苯二酚溶液中取出,用蒸馏水洗涤,并用氮气进行干燥。
70.(3)将所得邻苯二酚-壳聚糖膜修饰的玻碳电极浸入金黄色葡萄球菌适配体溶液进行化学结合,得到适配体-邻苯二酚-壳聚糖膜修饰玻碳电极。
71.将所得邻苯二酚-壳聚糖膜修饰的玻碳电极浸入含2μm金黄色葡萄球菌适配体溶液(0.1mpbs,ph7.4)中,温度保持4℃,12小时后用蒸馏水洗涤适配体-邻苯二酚-壳聚糖膜修饰玻碳电极,并用氮气进行干燥。
72.电沉积壳聚糖时间和邻苯二酚浓度的优化设计:
73.壳聚糖的厚度会影响邻苯二酚-壳聚糖薄膜的放大电流信号效果。如果壳聚糖膜太厚,会影响gce、邻苯二酚-壳聚糖膜和氧化还原介体之间的电子交换。但是,壳聚糖膜厚度不足会限制接枝在电极上的邻苯二酚和适配体的数量,会降低修饰电极的性能。
74.因此为了探究壳聚糖修饰电极的最佳性能,本发明采用cv法对壳聚糖的电沉积时间进行了优化选择。如图3所示,壳聚糖的电沉积时间选择为300s、400s、500s、600s、700s、800s;从300秒到800秒,fc氧化电流峰值在沉积500秒时达到最大值。因此,选择电沉积壳聚糖500s来修饰电极为最优。
75.邻苯二酚的浓度也会影响修饰电极的电化学活性,从而影响氧化还原电流峰值的放大。为了获得性能更好的邻苯二酚-壳聚糖膜修饰电极,本发明对邻苯二酚溶液的浓度进行了优化选择试验。本次试验中,壳聚糖电沉积时间为500s,用不同浓度的邻苯二酚溶液(1mm、3mm、5mm、7mm、10mm)制备邻苯二酚-壳聚糖膜修饰电极。如图4所示,修饰电极的fc氧化电流峰值随着邻苯二酚浓度的增加而增加,但当邻苯二酚浓度大于5mm时,其增长速度很慢。因此,使用5mm邻苯二酚溶液修饰电极为最优。
76.对实施例1制备得到的检测金黄色葡萄球菌的电化学适配体传感器进行结构检测与表征:
77.1)电极的修饰和表征:
78.用ftir和xps对电极的修饰进行表征。如图5所示,壳聚糖膜的红外吸收光谱的主要特征吸收峰为3310cm-1
(o-h和n-h的拉伸振动)、2935和2880cm-1
(c-h的拉伸振动)、1617cm-1
(c=o的拉伸振动)、1509cm-1
(c-h和n-h的变形振动)、1380cm-1
(-ch3的弯曲振动)、1309cm-1
(c-o的拉伸振动),1020cm-1
(c-o-c的伸缩振动)。当壳聚糖接枝邻苯二酚后,观察到新的特征吸收峰1640cm-1
、1580cm-1
、1500cm-1
和1450cm-1
,这些主要由苯环骨架振动引起。由于邻苯二酚上引入羟基,特征吸附峰3310cm-1
变得更深和更宽。此外,1735cm-1
处新增的吸附峰说明邻苯二酚与壳聚糖之间发生了希夫碱反应,这证实了邻苯二酚-壳聚糖膜的形成。由于适配体的p-o-c的出现,1090cm-1
的透射率降低,表明适配体-邻苯二酚-壳聚糖膜的形成。此外,如图6所示,xps光谱显示了n-c=o的存在,表明醛基修饰的适配体与壳聚糖的氨基之间通过席夫碱反应形成了酰胺键,这进一步证实了适配体-邻苯二酚-壳聚糖膜的形成。此外,xps光谱显示适配体-邻苯二酚-壳聚糖膜中存在仅存在于适配体中的元素磷,进一步证实了适配体-邻苯二酚-壳聚糖膜的成功形成。
79.2)电化学适配体传感器的电化学特性检测:
80.在含有50μm fc和ru
3
的pbs(0.1m,ph7.4)溶液中,使用cvs测量并研究修饰电极的电化学特性。如图7所示,bare gce显示裸玻碳电极在含有50μm fc和ru
3
的pbs(0.1m,ph7.4)溶液中的典型响应,chi-gce显示壳聚糖膜修饰玻碳电极的典型响应。可以看出,与裸玻碳电极相比,壳聚糖膜修饰的玻碳电极由于氧化还原性低,没有明显的氧化和还原电流。当接枝邻苯二酚后,邻苯二酚-壳聚糖修饰玻碳电极(cat-chi-gce)在fc氧化电流峰值信号以及ru
3
还原电流峰值信号中显示出放大特性,这是氧化还原电容器电极的显著特性。与邻苯二酚-壳聚糖膜修饰玻碳电极(cat-chi-gce)相比,适配体-邻苯二酚-壳聚糖膜修饰玻碳电极(apt-cat-chi-gce)的氧化和还原峰电流没有差异,这意味着邻苯二酚-壳聚糖膜与氧化还原介质之间的电子交换不受适配体的影响。
81.3)电化学适配体传感器的选择性、再现性检测:
82.为了探索电化学适配体传感器的特异性,将制备的电化学适配体传感器用于检测106cfu/ml的表皮葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、大肠杆菌、屎肠球菌、奇异芽胞杆菌、化脓性链球菌和肺炎链球菌。如图8所示,金黄色葡萄球菌的fc氧化电流峰值信号变化远大于其他细菌的fc氧化电流峰值信号变化。将制备邻苯二酚-壳聚糖膜修饰的玻碳电极用于金黄色葡萄球菌的检测,以探讨,邻苯二酚-壳聚糖膜与金黄色葡萄球菌之间是否存在非特异性结合,结果显示邻苯二酚-壳聚糖膜修饰的gce在与金黄色葡萄球菌反应前后fc氧化电流信号峰值电流变化不大,表明邻苯二酚-壳聚糖膜与金黄色葡萄球菌之间不存在非特异性结合。结果表明,由于适配体的高度特异性,该电化学适配体传感器具有很好的特异性。
83.再生性也是电化学传感器在实际应用中的一个重要特征。制备好的电化学适配体传感器检测一次金黄色葡萄球菌(105cfu/ml)后,用无菌水彻底清洗电化学适配体传感器,然后使用2.0m nacl溶液破坏适配体形成的二级结构,并释放结合的金黄色葡萄球菌,从而进行再生。再生的电化学适配体传感器用pbs洗涤三次以去除金黄色葡萄球菌,然后再检测金黄色葡萄球菌溶液。使用再生的电化学适配体传感器检测105cfu/ml金黄色葡萄球菌的电流峰值变化为0.91μa,接近初始电化学适配体传感器(0.94μa),表明其具有良好的再生性能。
84.实施例2
85.一种检测pbs溶液中金黄色葡萄球菌的电化学适配体传感器的检测应用方法。采用实施例1当中制备得到的电化学适配体传感器进行检测,包括以下步骤:
86.1)根据金黄色葡萄球菌系列浓度标准溶液的循环伏安法所得出的cv曲线建立标准曲线方程:
87.a:在电化学适配体传感器中的fc-ru
3
双电子介质溶液中(0.1m pbs中各50μm,ph7.4)加入已知浓度的金黄色葡萄球菌pbs溶液;采用循环伏安法对已知浓度的金黄色葡萄球菌溶液进行测量,cv的扫描电压从-0.5v到 0.5v,记录cv曲线直到信号稳定;记录该浓度下的金黄色葡萄球菌溶液在信号稳定时的fc氧化电流峰值;
88.b:将浓度范围为1-109cfu/ml的不同浓度金黄色葡萄球菌pbs溶液重复步骤a,根据各fc氧化电流峰值与不同浓度的金黄色葡萄球菌之间的线性关系得出线性回归方程。如图9所示,fc氧化电流峰值随着金黄色葡萄球菌浓度的增加而依次降低。fc氧化电流峰值变化与金黄色葡萄球菌浓度的对数值之间具有良好的线性关系。如图10所示,线性范围为10-108cfu/ml,线性回归方程可表示为δp(μa)=-0.155logc(cfu/ml) 0.059(r2=0.9928)。使用方程计算其检测限(lod)和定量限(loq):lod=3σ/k和loq=10σ/k,其中σ=0.0149(含有50μm fc和ru
3
的pbs溶液的标准偏差),k=0.155(校准曲线的斜率)。lod和loq分别计算为2cfu/ml和10cfu/ml,较好的灵敏度归因于邻苯二酚-壳聚糖氧化还原电容器的放大电流效应和适配体对金黄色葡萄球菌的高亲和力。
89.2)取用或制备待测样品溶液;
90.3)基于步骤2)中制备的待测样品溶液,采用循环伏安法检测待测溶液的fc氧化电流峰值;检测待测溶液时,在室温下进行,并对测试前的待测溶液用氮气脱气,去除溶液中的空气;在测试过程中,继续用氮气填充待测溶液。
91.4)根据fc氧化电流峰值与金黄色葡萄球菌浓度之间的标准曲线方程计算得出待测样品溶液中金黄色葡萄球菌的浓度含量。
92.在本实施例中,步骤a中采用循环伏安法进行测量时,每次测量执行7.5个循环即可获得稳定信号,最后一个循环即为fc氧化电流峰值测试结果。
93.采用冷冻扫描电镜和革兰氏染色法对结合在适配体-邻苯二酚-壳聚糖膜上的金黄色葡萄球菌进行验证。图11显示了适配体-邻苯二酚-壳聚糖膜修饰电极与10
10
cfu/ml金黄色葡萄球菌进行cv反应后,结合在适配体-邻苯二酚-壳聚糖膜上在不同放大倍数下的金黄色葡萄球菌。如图11所示,适配体-邻苯二酚-壳聚糖膜被直径约为0.8μm,近球形的葡萄簇状细菌覆盖。同时,对适配体-邻苯二酚-壳聚糖膜进行革兰氏染色,如图12所示,适配体-邻苯二酚-壳聚糖膜上出现革兰染色阳性的球形葡萄簇状细菌。结果表明,金黄色葡萄球菌被适配体特异性捕获后阻止fc的移动,并降低电荷转移速率,导致fc氧化电流峰值信号逐渐降低。fc氧化电流峰值的下降幅度随金黄色葡萄球菌浓度的增加而增大。
94.实施例3
95.一种检测全血样本中金黄色葡萄球菌的电化学适配体传感器的检测应用方法。采用实施例1当中制备得到的电化学适配体传感器进行检测,包括以下步骤:
96.1)根据金黄色葡萄球菌系列浓度标准溶液的循环伏安法所得出的cv曲线建立标准曲线方程:
97.a:在电化学适配体传感器中的fc-ru
3
双电子介质溶液中(0.1m pbs中各50μm,ph7.4)加入已知浓度的全血样本金黄色葡萄球菌溶液;采用循环伏安法对已知浓度的全血样本金黄色葡萄球菌溶液进行测量,cv的扫描电压从-0.5v到 0.5v,记录cv曲线直到信号稳定;记录该浓度下的金黄色葡萄球菌溶液在信号稳定时的fc氧化电流峰值;
98.b:将浓度范围为1-108cfu/ml的不同浓度金黄色葡萄球菌溶液重复步骤a,根据各fc氧化电流峰值与不同浓度的金黄色葡萄球菌之间的线性关系得出线性回归方程。结果如图13所示,线性回归方程为:δp(μa)=-0.182logc(cfu/ml) 0.092(r2=0.9951),线性范围为10-107cfu/ml,检测限(lod)和定量限(loq)分别为2cfu/ml和10cfu/ml。
99.2)取用或制备待测样品溶液;
100.3)基于步骤2)中制备的待测样品溶液,采用循环伏安法检测待测溶液的fc氧化电流峰值;检测待测溶液时,在室温下进行,并对测试前的待测溶液用氮气脱气,去除溶液中的空气;在测试过程中,继续用氮气填充待测溶液。
101.4)根据fc氧化电流峰值与金黄色葡萄球菌浓度之间的标准曲线方程计算得出待测样品溶液中金黄色葡萄球菌的浓度含量。
102.在本实施例中,步骤a中采用循环伏安法进行测量时,每次测量执行7.5个循环即可获得稳定信号,最后一个循环即为fc氧化电流峰值测试结果。原理在于:金黄色葡萄球菌在fc-ru
3
介质(ph 7.4)中带负电荷;因为等电点为ph 2~3,在循环电压的驱动下,带负电荷的金黄色葡萄球菌将不断与适配体结合,但它会在某个时候趋于平衡。为了获得平衡时间,本发明测试并观察了单个测试的cv曲线图和电压输入输出图。如图14、图15中显示的,在最初的12个循环(0-8分钟)期间观察到fc氧化电流的衰减,但在扫描7.5个循环(总共300秒)后,金黄色葡萄球菌和适配体之间的相互作用就已经达到平衡并产生稳定的电流信号。因此,后续的cv测量将进行7.5个循环扫描以获得稳定的信号,并将最后一个循环扫描记录为测试结果。因此本发明的电化学适配体传感器在cv测量检测时只经过7.5个循环(总共300秒),金黄色葡萄球菌和适配体之间的相互作用就能达到平衡,产生稳定的电流信号;与现有技术中的传感器需要在样品溶液中孵育30分钟以上才能平衡探针与靶标之间反应的方法相比,该本发明的检测方法无需样品预处理即可实现及时反应,检测时间短,只需要5分钟就能得到检测结果。
103.上述只是本发明的较佳实施例,并非对本发明作任何形式上的限制。因此,凡是未脱离本发明技术方案的内容,依据本发明技术实质对以上实施例所做的任何简单修改、等同变化及修饰,均应落在本发明技术方案保护的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。