1.本发明属于动物营养与饲料科学技术领域,特别是涉及岩藻多糖在断奶羔羊营养饲料中的应用。
背景技术:
2.我国是海藻生产大国,有丰富的藻类资源,褐藻是附着生活的海洋植物,以海带最为常见。褐藻中含有丰富的功能性植物多糖,如琼脂、羊栖菜多糖和岩藻多糖等,目前已广泛应用到食品和添加剂原料等方面。岩藻多糖(fucoidan)又叫岩藻聚糖硫酸脂、褐藻糖胶、褐藻多糖硫酸酯等,是一种富含硫酸基的大分子多聚糖,主要成分除l-岩藻糖和硫酸基团外,还含有少量半乳糖、甘露糖和木糖等。前人研究发现,岩藻多糖具有多种生物学功能,能激活动物体内抗氧化系统,调节胃肠道微生物平衡,抑制体内炎症因子含量降低体内炎症反应,进而提高机体免疫力,羔羊阶段尤其是断奶阶段是养羊生产的关键环节,在此阶段会受到严重的断奶应激,对其生长性能、胃肠道发育及机体免疫产生影响,岩藻多糖是一种绿色的海洋植物提取物,但大量研究都集中在单胃动物生产中,在反刍动物生产中的应用则鲜有报道,因此我们提出了岩藻多糖在断奶羔羊营养饲料中的应用。
技术实现要素:
3.本发明的目的在于提供岩藻多糖在断奶羔羊营养饲料中的应用,以解决了现有的问题:羔羊在断奶阶段是养羊生产的关键环节,在此阶段会受到严重的断奶应激,对其生长性能、胃肠道发育及机体免疫产生影响。
4.为解决上述技术问题,本发明是通过以下技术方案实现的:
5.本发明为岩藻多糖在断奶羔羊营养饲料中的应用,包括试验材料、试验设计、饲养管理、样品采集与测定方法和数据统计分析,所述试验材料包括:分析纯级别岩藻多糖,样品纯度为90%
6.进一步地,所述试验设计包括以下步骤:
7.步骤一:试验选用24只健康且体重相近的2月龄川中黑山羊(去势公羔),随机分为4组,每组6个重复,每个重复一只,单笼饲养,各组羔羊体重差异不显著(p《0.05);
8.步骤二:在基础饲粮中分别添加0%(对照组)、0.1%、0.3%和0.5%的岩藻多糖,预试期7d,正试期30d;
9.步骤三:试验第31d时每组随机挑选3只屠宰,屠宰前禁食12h,禁水 2h。
10.进一步地,所述饲养管理包括以下步骤:
11.步骤一:试验期间,每组分栏饲喂,每天08:30和17:30清理料槽后饲喂;
12.步骤二:精粗料分开饲喂,先精后粗,自由饮水,预试期每天观察羔羊的采食量,每日饲喂的岩藻多糖分早晚两次拌入饲喂的精料中。饲养期间各组饲喂方式、试验环境及管理模式均相同。
13.进一步地,所述样品采集与测定方法包括生长性能与器官指数、血清抗氧化及免
疫指标测定和肠道形态学观察,所述生长性能与器官指数包括以下步骤:
14.步骤一:预试期结束后,分别在第0、15、30d,在晨饲前对每只山羊进行称重记录;
15.步骤二:每天观察并记录每组的精粗料采食量,用于计算平均日增重 (adg)、平均日采食量(adfi)和料重比(f/g),平均日增重(adg)=总增重/试验天数;平均日采食量(adfi)=总采食量/(羔羊头数
×
试验天数);料重比(f/g)=平均日采食量(adfi)/平均日增重(adg),屠宰后对心脏、肝脏、脾脏、肺脏、肾脏、小肠称重并记录计算器官指数;器官指数(g/kg)=器官重量(g)/宰前活重(kg)。
16.进一步地,所述血清抗氧化及免疫指标测定包括以下步骤:
17.步骤一:预饲一周后,在正试期第15、30d晨饲前颈静脉采血,静置,待有血清析出后,3500r/min离心10min,分装后-20℃保存;
18.步骤二:血清总抗氧化能力(t-aoc)、总超氧化物歧化酶(t-sod)、谷胱甘肽过氧化物酶(gsh-px)、过氧化氢酶(cat)的活性和丙二醛(mda) 的含量均使用南京建成生物工程研究所试剂盒检测;血清免疫球蛋白g (igg)、白细胞介素-1β(il-1β)、肿瘤坏死因子-α(tnf-α)、白细胞介素-6(il-6)、白细胞介素-2(il-2)、白细胞介素-10(il-10) 含量均使用酶联免疫吸附(elisa)竞争法检测试剂盒检测,操作时严格按照试剂盒说明书进行。
19.进一步地,所述肠道形态学观察包括以下步骤:
20.步骤一:取小肠组织(十二指肠、空肠、回肠)中段约2cm肠管,用预冷的pbs冲洗干净后放置于提前加好4%多聚甲醛的15ml无菌离心管中;
21.步骤二:组织固定24h后,经过冲水、梯度酒精脱水、二甲苯透明,石蜡包埋等处理后,切成5μm厚度切片,用苏木精-伊红(he)染色,脱水中性树胶封片,于光学显微镜下观察肠道形态,每张切片选取3处完整且平直的肠绒毛,测量绒毛高度(vh)和隐窝深度(cd),计算绒毛高/隐窝深度(v/c)。
22.进一步地,所述数据统计分析包括以下步骤:
23.步骤一:试验数据先用excel 2019对实试验数据进行初步汇总和整理,用spss 26.0软件中的anova过程进行单因素方差分析,用duncan氏法对平均值进行多重比较,p<0.05表示差异显著。
24.本发明具有以下有益效果:
25.1、本发明可以为岩藻多糖在断奶羔羊及反刍动物健康养殖中的合理应用提供理论依据,岩藻多糖能提高断奶羔羊生长性能、血清抗氧化和免疫能力,改善肠道组织结构,降低羔羊的断奶应激反应,促进羔羊的生长性能、胃肠道发育及机体免疫机能。
26.2、本发明饲粮中添加适宜水平的岩藻多糖能够提高断奶羔羊的采食量和平均日增重,降低料重比,提高机体抗氧化和免疫能力,并有助于改善肠道形态。
27.当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有优点。
附图说明
28.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
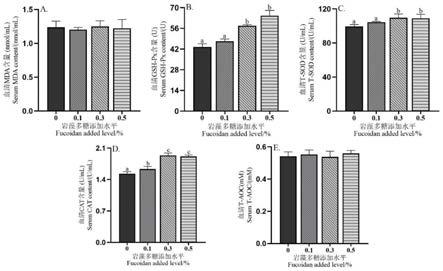
29.图1为本发明饲粮中添加岩藻多糖对断奶羔羊15d血清抗氧化指标的影响图;
30.图2为本发明饲粮中添加岩藻多糖对断奶羔羊30d血清抗氧化指标的影响图;
31.图3为本发明饲粮中添加岩藻多糖对断奶羔羊血清免疫指标的影响图;
32.图4饲粮中添加岩藻多糖对断奶羔羊肠道形态的影响图。
具体实施方式
33.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
34.请参阅图1-4所示,本发明为岩藻多糖在断奶羔羊营养饲料中的应用,包括试验材料、试验设计、饲养管理、样品采集与测定方法和数据统计分析,试验材料包括:分析纯级别岩藻多糖,样品纯度为90%。
35.试验设计包括以下步骤:
36.步骤一:试验选用24只健康且体重相近的2月龄川中黑山羊(去势公羔),随机分为4组,每组6个重复,每个重复一只,单笼饲养,各组羔羊体重差异不显著(p《0.05);
37.步骤二:在基础饲粮中分别添加0%(对照组)、0.1%、0.3%和0.5%的岩藻多糖,预试期7d,正试期30d;
38.步骤三:试验第31d时每组随机挑选3只屠宰,屠宰前禁食12h,禁水 2h。
39.其中基础日粮配制参照我国《肉羊饲养标准》(ny/t861-2004),基础日粮组成及营养水平见表1:
40.表1基础日粮组成及营养水平(风干基础)
[0041][0042]
注:1)预混料为每千克饲料提供the premix provided the following per kg of diets:va 8 000iu,vd 2 000iu,ve 40iu,cu 12mg,fe 70mg,mn 50mg,zn 80mg,i 1.0mg,se 0.27 mg and co 0.3mg.
[0043]
2)代谢能为计算值,其余为实测值。me was a calculated value,while the others were measured values.
[0044]
饲养管理包括以下步骤:
[0045]
步骤一:试验期间,每组分栏饲喂,每天08:30和17:30清理料槽后饲喂;
[0046]
步骤二:精粗料分开饲喂,先精后粗,自由饮水,预试期每天观察羔羊的采食量,每日饲喂的岩藻多糖分早晚两次拌入饲喂的精料中。饲养期间各组饲喂方式、试验环境及管
理模式均相同。
[0047]
样品采集与测定方法包括生长性能与器官指数、血清抗氧化及免疫指标测定和肠道形态学观察,所述生长性能与器官指数包括以下步骤:
[0048]
步骤一:预试期结束后,分别在第0、15、30d,在晨饲前对每只山羊进行称重记录;
[0049]
步骤二:每天观察并记录每组的精粗料采食量,用于计算平均日增重 (adg)、平均日采食量(adfi)和料重比(f/g),平均日增重(adg)=总增重/试验天数;平均日采食量(adfi)=总采食量/(羔羊头数
×
试验天数);料重比(f/g)=平均日采食量(adfi)/平均日增重(adg),屠宰后对心脏、肝脏、脾脏、肺脏、肾脏、小肠称重并记录计算器官指数;器官指数(g/kg)=器官重量(g)/宰前活重(kg)。
[0050]
血清抗氧化及免疫指标测定包括以下步骤:
[0051]
步骤一:预饲一周后,在正试期第15、30d晨饲前颈静脉采血,静置,待有血清析出后,3500r/min离心10min,分装后-20℃保存;
[0052]
步骤二:血清总抗氧化能力(t-aoc)、总超氧化物歧化酶(t-sod)、谷胱甘肽过氧化物酶(gsh-px)、过氧化氢酶(cat)的活性和丙二醛(mda) 的含量均使用南京建成生物工程研究所试剂盒检测;血清免疫球蛋白g (igg)、白细胞介素-1β(il-1β)、肿瘤坏死因子-α(tnf-α)、白细胞介素-6(il-6)、白细胞介素-2(il-2)、白细胞介素-10(il-10) 含量均使用酶联免疫吸附(elisa)竞争法检测试剂盒检测,操作时严格按照试剂盒说明书进行。
[0053]
肠道形态学观察包括以下步骤:
[0054]
步骤一:取小肠组织(十二指肠、空肠、回肠)中段约2cm肠管,用预冷的pbs冲洗干净后放置于提前加好4%多聚甲醛的15ml无菌离心管中;
[0055]
步骤二:组织固定24h后,经过冲水、梯度酒精脱水、二甲苯透明,石蜡包埋等处理后,切成5μm厚度切片,用苏木精-伊红(he)染色,脱水中性树胶封片,于光学显微镜下观察肠道形态,每张切片选取3处完整且平直的肠绒毛,测量绒毛高度(vh)和隐窝深度(cd),计算绒毛高/隐窝深度(v/c)。
[0056]
数据统计分析包括以下步骤:
[0057]
步骤一:试验数据先用excel 2019对实试验数据进行初步汇总和整理,用spss 26.0软件中的anova过程进行单因素方差分析,用duncan氏法对平均值进行多重比较,p<0.05表示差异显著。
[0058]
实施例一:饲粮中添加岩藻多糖对断奶羔羊生长性能的影响
[0059]
由表2可知,四组羔羊初始体重相似,且差异不显著(p》0.05)。
[0060]
试验期0~15d内,各组bw,adg,adfi和f/g均无显著差异(p》0.05);试验期15~30d内,随着岩藻多糖添加量的提高,adg和adfi逐渐升高,且 0.3%和0.5%添加组adg显著高于对照组与0.1%添加组(p《0.05)。adfi随添加量升高显著增加(p《0.05)。0.1%、0.3%和0.5%三个添加组的f/g显著低于对照组(p《0.05),但添加组之间差异不显著(p》0.05)。
[0061]
表2饲粮中添加岩藻多糖对断奶羔羊生长性能的影响
[0062]
[0063][0064]
同行无字母或数据肩标相同字母表示差异不显著(p>0.05),不同小写字母表示差异显著(p<0.05)。下表同。
[0065]
实施例二:饲粮中添加岩藻多糖对器官指数的影响
[0066]
由表3可以看出,饲粮岩藻多糖水平对断奶羔羊器官指数均无显著影响(p》0.05)
[0067]
表3饲粮中添加岩藻多糖对断奶羔羊器官指数的影响
[0068][0069][0070]
实施例三:饲粮中添加岩藻多糖对断奶羔羊血清抗氧化指标的影响
[0071]
由图1可知,断奶羔羊饲粮中添加岩藻多糖饲喂15d时,提高了羔羊血清中gsh-px、
t-sod和cat的活性,且0.3%和0.5%添加组羔羊血清gsh-px和t-sod显著高于0.1%添加组和对照组(p《0.05)。添加组的羔羊血清中 cat均显著高于对照组(p《0.05)。
[0072]
由图2可知,断奶羔羊饲粮中添加岩藻多糖饲喂30d时,显著降低羔羊血清mda含量(p《0.05),但显著提高羔羊血清t-sod和cat含量(p《0.05),并未对羔羊血清gsh-px和t-aoc的活性产生显著影响(p》0.05),数据柱形标注不同小写字母表示差异显著(p《0.05)。下表同。
[0073]
实施例四:饲粮中添加岩藻多糖对断奶羔羊血清免疫指标的影响
[0074]
由图3可知,断奶羔羊饲粮中添加岩藻多糖饲喂30d后,与对照组相比,添加岩藻多糖可显著提高羔羊血清中igg(p《0.05)。添加0.3%和0.5%的岩藻多糖,羔羊血清中il-2和il-10含量显著高于对照组和0.1%添加组 (p《0.05)。添加岩藻多糖,羔羊血清中tnf-α、il-1β和il-6的含量与对照组相比显著降低(p《0.05)。
[0075]
实施例五:饲粮中添加岩藻多糖对断奶羔羊肠道形态的影响
[0076]
由表4可知,饲粮中添加岩藻多糖可显著提高羔羊十二指肠、空肠和回肠的vh(p《0.05),对羔羊十二指肠和空肠的cd无显著影响(p》0.05)。添加0.5%的岩藻多糖,回肠cd显著低于对照组和0.1%、0.3%添加量组(p《0.05)。0.5%岩藻多糖添加量,十二指肠和回肠的v/c显著高于对照组和0.1%、0.3%添加量组(p《0.05),但对空肠v/c无显著影响(p》0.05)。
[0077]
[0078][0079]
表4饲粮中添加岩藻多糖对断奶羔羊肠道形态的影响
[0080]
饲粮中添加岩藻多糖对断奶羔羊生长性能的影响:
[0081]
生长性能参数能够反映畜禽的经济价值,采食量、日增重和料重比是与生长性能密切相关的指标,是养分摄入、消化与吸收的最终表现。本试验结果表明,饲粮中添加0.3%和0.5%岩藻多糖显著提高断奶羔羊的末重,而添加0.1%并无显著影响。在试验中后期(15~30d)饲粮中添加0.3%和0.5%岩藻多糖可显著提高日增重和平均日采食量,降低料重比。但在试验前期 (0~15d)对平均日增重、平均日采食量和料重比无显著影响。研究发现,断奶仔猪日粮中添加500mg/kg的岩藻多糖显著降低了0~14d料重比,但在 0~28d整个试验期,对平均日增重和日采食量无显著影响。在雏鸡日粮中添加岩藻多糖提取物和层黏连蛋白,结果显示,添加岩藻多糖提取物和层黏连蛋白可提高雏鸡总采食量,增加回肠绒毛高度和宽度,提高饲料消化率。而在黄颡鱼幼鱼饲料中添加有效浓度为0.05%、0.10%和0.20%的自提褐藻糖胶饲喂12周发现,与对照组相比添加0.10%自提褐藻糖胶显著促进黄颡鱼幼鱼的生长,且提高幼鱼胃肠道中的脂肪酶活性。岩藻多糖尽管少有在反刍动物上的应用,但本研究结果发现在断奶羔羊的饲粮中添加仍有类似结果,可能是岩藻多糖作为可溶性膳食纤维,能够起到维持消化道菌群稳态,促进胃肠道发育,进而改善机体抗氧化和免疫状态的作用,从而提高动物的生长性能。
[0082]
饲粮中添加岩藻多糖对断奶羔羊血清抗氧化指标的影响:
[0083]
在断奶过程中由于各种环境因素产生变化,常诱发氧化应激,氧化应激会产生大量的自由基,打破体内自由基动态平衡,造成机体代谢紊乱
[16]
,对动物生长发育带来不利影响。t-aoc、t-sod、cat、gsh-px和mda是反应机体抗氧化能力的关键指标,t-aoc是反应机体总抗氧化能力
[17]
,t-sod、 gsh-px和cat是机体重要的自由基清除酶
[18]
,而mda是脂质过氧化的产物, mda含量越多,脂质过氧化程度越高,机体的氧化应激程度越高
[19]
。研究发现,在猪饲粮中添加900mg/kg海藻提取物21d,能显著提高猪肉的抗氧化能力。在肉仔鸡饲粮中添加海藻多糖,经过41d的饲养,结果发现与对照组和抗生素组相比,添加海藻多糖显著提高了肉仔鸡血清gsh-px和sod活性,显著降低mda含量。本研究中,与对照组相比,添加岩藻多糖可显著提高15d与30d羔羊血清中t-sod和cat含量,显著降低30d羔羊血清中 mda含量,这与前人的研究结果相似。综上所述,添加岩藻多糖可以提高断奶羔羊的抗氧化能力,及缓解因断奶造成的机体氧化应激损伤。
[0084]
饲粮中添加岩藻多糖对断奶羔羊血清免疫指标的影响:
[0085]
免疫球蛋白具有抗病毒和细菌等的能力,是机体免疫系统的重要组成部分,igg是介导体液免疫的关键免疫蛋白,血清中igg含量高低能反映机体免疫功能的变化
[22]
。细胞因子是由免疫相关的细胞合成分泌的小肽分子或蛋白,含量较低,但在机体炎症和抗炎过程中发挥高效作用,其在血清中的含量也能反应动物机体的健康状况
[23]
。细胞因子因不同功能可分为抗炎因子与促炎因子,tnf-α、il-1β和il-6是由th1细胞分泌的促炎因子。 tnf-α可促使t细胞产生各种炎症因子,进而促进炎症发生
[24]
。il-1β是促炎因子il-1的主要循环形式,涉及广谱炎性疾病
[25]
。il-6在免疫调节、机体感染免疫反应中起重要作用,其表达失调可引起多种疾病,主要表现为il-6水平增高
[26]
。抗炎因子主要由th2细胞合成分泌的,il-10通过刺激t细胞,促进b细胞增殖,抑制促炎因子的生成等来调控炎症反应
[27]
。 il-2是机体受到应激时产生的糖蛋白,主要调节机体免疫以应对不良外界条件,其含量是动物体细胞免疫的重要标志
[28]
。通过连续灌胃二甲基苯蒽诱发乳腺肿瘤大鼠褐藻糖胶16周,发现与对照组相比灌胃褐藻糖胶降低了小鼠体内炎症因子il-6和tnf-α水平,提高了促炎因子il-10和il-4的水平。在葡聚糖硫酸钠诱导腹泻猪饲粮中添加岩藻多糖,经过56d的饲喂,结果显示,添加岩藻多糖改善了猪体重下降和腹泻等不良症状,同时降低了结肠炎症因子il-6mnra的表达,改善机体炎症。本试验结果显示,岩藻多糖能显著提高羔羊血清igg含量。饲粮添加0.3%和0.5%岩藻多糖,血清中il-2和il-10含量显著高于对照组和0.1%添加组,而添加组血清中 il-1β、il-6和tnf-α含量显著低于对照组。说明0.3%和0.5%添加量组,羔羊免疫功能增强更明显,能更好抵御外界不良环境。
[0086]
饲粮中添加岩藻多糖对断奶羔羊肠道形态的影响:
[0087]
肠道形态表征可以用肠道绒毛高度和隐窝深度直观反映
[31]
,肠绒毛高能反应肠上皮细胞的成熟率
[32]
,与养分消化吸收正相关,而隐窝深度反映肠上皮细胞发育率,绒毛高度与隐窝深度的比值反应肠道综合功能状态,比值越高消化吸收越好
[33]
。在断奶大鼠饲粮中添加枸杞多糖,经过28d的饲喂后发现提高了断奶大鼠空肠绒毛高度和v/c,降低其隐窝深度。在本研究中,添加岩藻多糖显著提高了断奶羔羊十二指肠、空肠、回肠绒毛长和十二指肠v/c,显著降低回肠隐窝深度。综上所述,饲粮中添加岩藻多糖能够一定程度增强小肠物理屏障,改善肠道形态结构,进而提高对营养物质的消化吸收,促进肠道健康进而提高羔羊的生长性能。
[0088]
结论:
[0089]
饲粮中添加适宜水平的岩藻多糖能够提高断奶羔羊的采食量和平均日增重,降低料重比,提高机体抗氧化和免疫能力,并有助于改善肠道形态。因此岩藻多糖能够作为一种新型绿色饲料添加剂在断奶羔羊生产中开发利用。在本试验条件下,饲粮中添加0.3%和0.5%岩藻多糖作用效果相似,故从经济效益方面考虑,0.3%添加量较为合适。
[0090]
本实施例的一个具体应用为:分析纯级别岩藻多糖,样品纯度为90%,然后试验选用24只健康且体重相近的2月龄川中黑山羊(去势公羔),随机分为4组,每组6个重复,每个重复一只,单笼饲养,各组羔羊体重差异不显著(p《0.05),在基础饲粮中分别添加0%(对照组)、0.1%、0.3%和0.5%的岩藻多糖,预试期7d,正试期30d,试验第31d时每组随机挑选 3只屠宰,屠宰前禁食12h,禁水2h,然后试验期间,每组分栏饲喂,每天 08:30和17:30清理料槽后饲喂,精粗料分开饲喂,先精后粗,自由饮水,预试期每天观察羔羊的采食量,每日饲喂
的岩藻多糖分早晚两次拌入饲喂的精料中。饲养期间各组饲喂方式、试验环境及管理模式均相同,而生长性能与器官指数的步骤为,在预试期结束后,分别在第0、15、30d,在晨饲前对每只山羊进行称重记录,每天观察并记录每组的精粗料采食量,用于计算平均日增重(adg)、平均日采食量(adfi)和料重比(f/g),平均日增重(adg)=总增重/试验天数;平均日采食量(adfi)=总采食量/(羔羊头数
×
试验天数);料重比(f/g)=平均日采食量(adfi)/平均日增重 (adg),屠宰后对心脏、肝脏、脾脏、肺脏、肾脏、小肠称重并记录计算器官指数;器官指数(g/kg)=器官重量(g)/宰前活重(kg),血清抗氧化及免疫指标测定的步骤为,预饲一周后,在正试期第15、30d晨饲前颈静脉采血,静置,待有血清析出后,3500r/min离心10min,分装后-20℃保存,然后血清总抗氧化能力(t-aoc)、总超氧化物歧化酶(t-sod)、谷胱甘肽过氧化物酶(gsh-px)、过氧化氢酶(cat)的活性和丙二醛(mda) 的含量均使用南京建成生物工程研究所试剂盒检测;血清免疫球蛋白g (igg)、白细胞介素-1β(il-1β)、肿瘤坏死因子-α(tnf-α)、白细胞介素-6(il-6)、白细胞介素-2(il-2)、白细胞介素-10(il-10) 含量均使用酶联免疫吸附(elisa)竞争法检测试剂盒检测,操作时严格按照试剂盒说明书进行,而肠道形态学观察的步骤为,取小肠组织(十二指肠、空肠、回肠)中段约2cm肠管,用预冷的pbs冲洗干净后放置于提前加好4%多聚甲醛的15ml无菌离心管中,组织固定24h后,经过冲水、梯度酒精脱水、二甲苯透明,石蜡包埋等处理后,切成5μm厚度切片,用苏木精-伊红(he)染色,脱水中性树胶封片,于光学显微镜下观察肠道形态,每张切片选取3处完整且平直的肠绒毛,测量绒毛高度(vh)和隐窝深度 (cd),计算绒毛高/隐窝深度(v/c),然后通过数据统计分析对实验数据进行初步汇总和整理,用spss 26.0软件中的anova过程进行单因素方差分析,用duncan氏法对平均值进行多重比较,p<0.05表示差异显著。
[0091]
在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
[0092]
以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。