预测癌症患者的预后的方法、预测抗癌疗法的有效性的方法和选择适合癌症患者的疗法的方法
1.相关申请的参照
2.本技术享有作为在先日本技术的日本特愿2019-127042(申请日:2019年7月8日)的优先权,其全部公开内容通过引用成为本说明书的一部分。
技术领域
3.本发明涉及预测癌症患者的预后的方法。本发明还涉及:预测抗癌疗法对癌症患者的有效性的方法、及选择适合癌症患者的疗法的方法。本发明还涉及预测生酮饮食疗法中的癌症患者的预后的方法。本发明还涉及:预测生酮饮食疗法对癌症患者的有效性的方法、及选择生酮饮食疗法中的适合癌症患者的疗法的方法。
背景技术:
4.近些年,随着饮食习惯的欧美化,代替胃癌,在欧美常见的大肠癌、乳腺癌、肺癌和前列腺癌等癌症在不断增加。通过早期发现而能够切除的胃癌、大肠癌等癌症种类的情况下,患者的生命预后正得到改善,但作为难治性癌症的胰腺癌、骨肉瘤等通常难以早期发现,临床上的对应存在重大课题。现有的癌症治疗主要为手术切除、化学疗法和放射线治疗,化学疗法对肺癌、胰腺癌的治疗效果并不能说充分。因此,还需要开发对癌症患者有效的疗法,尤其强烈需要针对难治性癌症患者的新型疗法。
5.另外,酮体是乙酰乙酸、β-羟基丁酸、丙酮的总称,在生物体内于肝脏内通过脂肪酸的β氧化而合成。人体在禁食状态、由于长时间运动而导致葡萄糖供给不足时,会分解脂肪并由脂肪酸产生酮体,将其作为能量源(非专利文献1)。作为旨在使体内产生大量酮体的饮食,作为高脂低糖饮食的生酮饮食一直是已知的,摄取生酮饮食会使血液中的酮体浓度升高。虽然此前报道了生酮饮食疗法对癌症的治疗有效(专利文献1),但尚不存在能够预测生酮饮食疗法对癌症患者的效果的简便的指标。
6.现有技术文献
7.专利文献
8.专利文献1:国际公开第2017/038101号
9.非专利文献
10.非专利文献1:vidali s,et al.,int j biochem cell biol.63,55-59(2015)
技术实现要素:
11.本发明的目的在于,提供对癌症患者预测预后的方法、及预测抗癌疗法对癌症患者的有效性的方法。本发明的目的还在于,提供选择适合癌症患者的疗法的方法。本发明的目的还在于,提供对实施生酮饮食疗法的癌症患者预测预后的方法、及预测生酮饮食疗法对该患者的有效性的方法。本发明的目的还在于,提供选择生酮饮食疗法中的适合癌症患者的疗法的方法。
12.本发明人等此次对癌症患者的与营养状态、糖代谢状态和炎症状态相关的指标进行了研究,结果发现:使用这些指标能够预测癌症患者的预后,并且能够预测抗癌疗法对癌症患者的效果,进而能够选择适合癌症患者的疗法。本发明人等还发现:对于实施了控制糖类的高脂肪饮食疗法的晚期癌症患者而言,使用血白蛋白浓度、血糖值和血crp浓度作为指标能够预测癌症患者的预后,并且能够预测生酮饮食疗法对癌症患者的效果,进而能够对于癌症患者选择疗法。本发明基于这些见解。
13.根据本发明,提供以下的发明。
14.[1]一种预测癌症患者的预后的方法,其特征在于,使用选自由癌症患者的营养状态的指标、糖代谢状态的指标和炎症状态的指标组成的组中的至少1种指标作为预后的指标。
[0015]
[2]一种预测抗癌疗法对癌症患者的有效性的方法,其特征在于,使用选自由癌症患者的营养状态的指标、糖代谢状态的指标和炎症状态的指标组成的组中的至少1种指标作为抗癌疗法对癌症患者的有效性的指标。
[0016]
[3]一种选择适合癌症患者的疗法的方法,其特征在于,使用选自由癌症患者的营养状态的指标、糖代谢状态的指标和炎症状态的指标组成的组中的至少1种指标作为选择适合癌症患者的疗法的指标。
[0017]
[4]一种癌症患者的治疗方法,其包括如下工序:实施上述[3]中记载的方法来选择适合癌症患者的疗法的工序;及对该患者实施所选择的疗法的工序。
[0018]
[5]根据上述[1]~[4]中任一项所述的方法,其使用营养状态的指标、糖代谢状态的指标和炎症状态的指标的组合作为指标。
[0019]
[6]根据上述[1]~[5]中任一项所述的方法,其中,营养状态的指标为白蛋白的血液浓度。
[0020]
[7]根据上述[1]~[6]中任一项所述的方法,其中,糖代谢状态的指标为葡萄糖的血液浓度。
[0021]
[8]根据上述[1]~[7]中任一项所述的方法,其中,炎症状态的指标为c反应蛋白(crp)的血液浓度。
[0022]
[9]根据上述[1]~[8]中任一项所述的方法,其中,癌症患者是功能状态评分(performance status)为2以下的难治性癌症患者。
[0023]
[10]根据上述[1]和[5]~[9]中任一项所述的方法,其中,癌症患者是实施了生酮饮食疗法的患者。
[0024]
[11]根据上述[2]和[5]~[9]中任一项所述的方法,其中,癌症患者是实施了生酮饮食疗法的患者。
[0025]
[12]根据上述[3]和[5]~[9]中任一项所述的方法,其中,癌症患者是实施了生酮饮食疗法的患者。
[0026]
[13]根据上述[4]~[9]中任一项所述的方法,其中,癌症患者是实施了生酮饮食疗法的患者。
[0027]
[14]根据上述[10]~[13]中任一项所述的方法,其中,生酮饮食疗法依据下述(a)、(b)和(c)而实施:
[0028]
(a)在最初的1周,以实际体重50kg为基准时,每天的卡路里约1500kcal,以脂质约
140g:蛋白质约60g:糖类(除膳食纤维以外的碳水化合物)约10g的比率向对象提供饮食,
[0029]
(b)在第2周~第3个月,将糖类的每天摄取量设为约20g以下,每天的卡路里约1400~约1600kcal,以脂质约120~约140g:蛋白质约70g:糖类约20g的比率向对象提供饮食,以及
[0030]
(c)在第3个月之后,将糖类的1次摄取量设为约10g/次且将每天摄取量设为约30g以下,其它依据前述(2),以此方式向对象提供饮食。
[0031]
以下有时将上述[1]和[10]的预测方法简称为“本发明的预后预测方法”。以下有时将上述[2]和[11]的预测方法简称为“本发明的抗癌疗法的有效性的预测方法”。以下有时将上述[3]和[12]的选择方法简称为“本发明的选择方法”。以下有时将上述[4]和[13]的治疗方法简称为“本发明的治疗方法”。
[0032]
根据本发明,提供:使用营养状态的指标、糖代谢状态的指标和炎症状态的指标中的至少1种作为指标的预测癌症患者的预后的方法、预测抗癌疗法对癌症患者的有效性的方法和选择适合癌症患者的疗法的方法。根据本发明,还提供:使用营养状态的指标、糖代谢状态的指标和炎症状态的指标中的至少1种作为指标的预测生酮饮食疗法中癌症患者的预后的方法、预测生酮饮食疗法对癌症患者的有效性的方法和选择生酮饮食疗法中的适合癌症患者的疗法的方法。
附图说明
[0033]
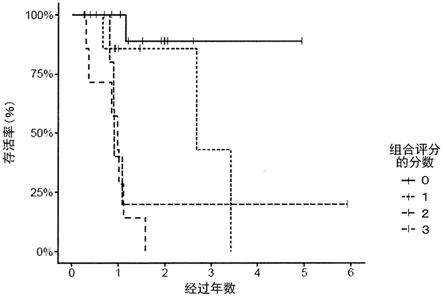
图1是示出以血白蛋白浓度、血糖值和血crp浓度的组合作为指标的、基于卡普兰-梅耶(kaplan-meier)法的存活率曲线的图。
具体实施方式
[0034]
《《定义》》
[0035]
《生酮饮食疗法》
[0036]
本发明中,“生酮饮食”是指“控制糖类的高脂肪饮食”,“生酮饮食疗法”是指:基于让对象摄取生酮饮食的疗法。
[0037]
此处,“高脂肪饮食”是指:摄取相当于总摄取能量的约30%以上的能量的脂肪的饮食。该数值是基于:根据日本平成17年和18年国民健康
·
营养调査,通常从脂质中摄取总摄取能量的30%以上。“高脂肪饮食”可以通过摄取脂肪量所相当的能量相对于总摄取能量的比例来规定,该比例的下限值可以为约50%、约55%、约60%、约65%或约70%,该比例的上限值可以为约95%、约90%、约85%或约80%。这些下限值和上限值可以分别任意组合为数值范围。“高脂肪饮食”例如可以是:摄取相当于总摄取能量的约50%~约95%、约60%~约90%、约65%~约85%或约70%~约80%的能量的脂肪的饮食。需要说明的是,本发明中,能量比率以每1g脂肪为9kcal进行计算。
[0038]“高脂肪饮食”另外是指:在以实际体重50kg作为基准时,每天摄取约80g以上的脂肪的饮食。“高脂肪饮食”可以通过以实际体重50kg为基准时的每天的摄取脂肪量来规定,该摄取脂肪量的下限值可以为约80g、约85g、约90g、约95g、约100g、约105g、约110g、约115g或约120g,该摄取脂肪量的上限值可以为约180g、约175g、约170g、约165g、约160g、约155g、约150g、约145g、约140g。这些下限值和上限值可以分别任意组合为数值范围。“高脂肪饮
食”可以为:在以实际体重50kg作为基准时,摄取每天约80g~约180g、每天约90g~约170g、每天约100g~约160g、每天约110g~约150g或每天约120g~约140g的脂肪的饮食。
[0039]
另外,“控制糖类”是指:在以实际体重50kg作为基准时,每天摄取约100g以下的糖类。该数值是由2010年的日本厚生劳动省的营养报告中记载的如下内容计算而得到的:“假如将基础代谢量设为1500kcal/天,则大脑的能量消耗量为300kcal/天,相当于葡萄糖75g/天。如上所述,除大脑以外的组织也利用葡萄糖作为能量源,因此推测葡萄糖的所需量至少为100g/天,即推测可消化碳水化合物的最低必需量约为100g/天”,应理解其可能会发生变动。“控制糖类饮食”可以通过以实际体重50kg作为基准时的每天的摄取糖类量来规定,该摄取糖类量的下限值可以为约5g、约10g、约15g、约20g、约25g或约60g,该摄取脂肪量的上限值可以为约70g、约35g、约30g、约25g、约20g、约15g。这些下限值和上限值可以分别任意组合为数值范围。在以实际体重50kg作为基准时,“控制糖类饮食”可以摄取每天约60~70g、每天约5g~约15g、每天约15g~约25g或每天约25g~约35g的糖类。
[0040]
本发明中的生酮饮食的优选方式中,可以对导入期的糖类限制进行进一步限制,例如可以限制为约20g/天以下或约10g/天以下。通过对导入期的糖类限制进行进一步限定,从而能够迅速诱导血酮体(乙酰乙酸、β-羟基丁酸)。但是,导入初期的饮食内容与以往的饮食习惯不同,因此难以持续,通过逐渐地减少对糖类摄取量的限制,从而能够使生酮饮食持续,也观察到治疗效果。因此,糖类的限制量(碳水化合物的摄取量)只要具有由初始量时的严格限制(例如,约10g/天以下)逐渐放宽这样的特征,则不限定于约10g/天
→
约20g/天
→
约30g/天等。因此,例如,根据情况,初始导入量可以以约5~约15g/天或其左右(
±
约5g/天)开始,在第2阶段可以以约15~约25g/天或其左右(
±
约5g/天)加以维持,在最后的维持阶段,可以以约25~约35g/天或其左右(
±
约10g/天)持续进行。
[0041]
本发明中的生酮饮食可以基于酮比(脂质/(蛋白质 糖类))(质量比)来确定。此处,本发明中的生酮饮食可列举出酮比约为1以上(优选约为2以上、更优选约为2.5以上)的饮食,酮比的上限值例如可以为约4或约3.5。另外,酮比例如可以设定为约1~约2,导入时可以设为约2。只要酮比满足该定义,蛋白质和糖类的量就可以是任意量,优选为每天约30g以下,更优选为每天约20g以下,进一步优选为每天约10g以下,或者也可以根据时期将这些进行组合。1次摄取量只要在每天摄取量的范围内就可以是任何范围,但可以优选设为1次约10g以下。
[0042]
作为本发明中的生酮饮食的优选方式,可列举出ketone formula(817-b;株式会社明治制)和与其具有同等组成的组合物及其改性物(例如,进一步降低了ketone formula(817-b)中糖类和/或蛋白质者(例如,在ketone formula(817-b)中将各成分独立地变更
±
约5%、
±
约10%、
±
约15%、
±
约20%或
±
约25%者))。
[0043]
本发明中的生酮饮食中,也可以组合使用中链脂肪酸油。此处“中链脂肪酸油”是指:构成油脂的脂肪酸的长度为中链的脂肪酸油,也称为中链甘油三酯(mct:medium chain triglyceride)或中链脂肪酸甘油三酯,代表性地指:由碳数为6~12、优选为碳数8~12的脂肪酸构成者、由碳数8~11的脂肪酸构成者、或由碳数8~10的脂肪酸构成者。
[0044]
中链脂肪酸油存在于椰子、棕榈果等棕榈科植物等的植物体、牛奶等乳制品所含的油脂中,因此可以将从这些油脂(优选为棕榈仁油等植物油脂)中提取(包括粗提取)或精制(包括粗精制)的中链脂肪酸油直接使用或作为原料使用。或者,也可以使用基于化学合
成法而得到的产物、市售品作为中链脂肪酸油。中链脂肪酸油例如可以利用日清mct油、日清mct粉(the nisshin oillio group,ltd.制)、特级初榨椰子油(the nisshin oillio group,ltd.制)。
[0045]
本发明中,生酮饮食疗法可以通过让对象在规定时间(例如3个月)内连续摄取上述那样的生酮饮食来实施。本发明中的生酮饮食疗法中,可以通过营养强化剂等让对象摄取必需的微量元素、维生素。
[0046]
本发明中,生酮饮食疗法例如可以如下实施。
[0047]
(1)在最初的1周,基于实际体重将卡路里设为约30kcal/kg体重,脂质没有限制,蛋白质没有限制,目标是糖类(除膳食纤维以外的碳水化合物)约10g以下。具体而言,在导入初期,将实际体重设为50kg,每天的卡路里约1500kcal且成为脂质约140g:蛋白质约60g:糖类约10g的比率。目标是酮比(脂质/(蛋白质 糖类))为2。其它营养素可以没有限制地摄取。必需的微量元素、维生素通过营养强化剂等的使用来适宜摄取。时间可以适宜增减,可以为数天到数周。
[0048]
(2)在第2周~第3个月,以血酮体值为参考,调整糖类量且利用ketone formula和mct油调整中链脂肪酸的摄取量。例如,进行指导以避免使乙酰乙酸为500μmol/l以上、β-羟基丁酸为1000μmol/l以下,尽可能以乙酰乙酸1000μmol/l以上、β-羟基丁酸2000μmol/l以上为目标。糖类的每天摄取量为约20g以下,每天的卡路里为约1400~约1600kcal,为脂质约120~约140g:蛋白质约70g:糖类约20g的比率,目标是酮比为约1~约2。在补充卡路里时,可以优选使用mct油和ketone formula。时间可以适宜增减,两周可稍微提前或延长,第3个月也可以稍微提前或延长(允许1、2周或数周的偏差程度)。
[0049]
(3)在第3个月之后,碳水化合物的1次摄取量设为10g/天,每天摄取量设为约30g以下,其它依据上述(2)。由于为(2)之后,因此当第3个月有偏差时,本身也会有偏差。
[0050]
《癌》
[0051]
本发明中“癌”以包括正常细胞发生突变而出现的肿瘤的含义来使用。癌可能产生自全身任何器官、组织。作为本发明中“癌”,可列举出肺癌、卵巢癌、膀胱癌、口唇腺样囊性癌、肾癌、尿路上皮癌、大肠癌、前列腺癌、多形性胶质母细胞瘤、胰腺癌、乳腺癌、黑色素瘤、肝癌、胃癌、和食道癌等癌,癌症患者是指患有癌症的人。
[0052]
本发明中“抗癌疗法”是指针对癌症的疗法,例如可列举出切除/摘除术等手术疗法、化学疗法、放射线疗法、car-t细胞疗法等癌症免疫疗法和生酮饮食疗法等饮食疗法,也包括这些中的一部分或全部的组合。
[0053]
本发明中成为抗癌疗法(特别是生酮饮食疗法)的对象的癌症患者可以为难治性癌症患者。作为难治性癌症,可列举出iv期的晚期癌症、难以切除的癌症、难以早期发现的癌症、转移性癌症等目前认为难以治疗的种类、病期的癌症。作为难治性癌症患者,可列举出功能状态评分为2以下的难治性癌症患者。
[0054]
《《预后预测方法》》
[0055]
本发明的预后预测方法中,使用选自由营养状态的指标、糖代谢状态的指标和炎症状态的指标组成的组中的至少1种指标作为预后的指标。
[0056]
本发明中“营养状态的指标”是指与营养状态相关的指标,是指能够通过血液检测、尿液检测、身体测量、体力测定、运动功能测定等而测定或计算的指标。营养状态的指标
只要是与营养状态相关的指标就没有特别限定,例如可列举出:包含在由对象得到的血液、尿液等生物试样中且与营养状态相关的物质或这些在生物试样中的浓度等,更具体而言,可列举出白蛋白、前白蛋白(甲状腺素运载蛋白)、转铁蛋白、视黄醇结合蛋白(rpb)、各种氨基酸或它们的衍生物(3-甲基组氨酸、bcaa、亮氨酸、异亮氨酸、缬氨酸等)等的血液浓度、尿液浓度等。另外,作为与营养状态相关的指标,可以是通过对象的身体测量、体力测定、运动功能测定等而测定或计算、且与营养状态相关的指标,例如可列举出瘦体重、肌肉量、体重指数(bmi:body mass index)、瘦体重率、肌力(握力、膝伸展肌力等)、骨骼肌指数(smi:skeletal muscle index)、相位角(pa:phase angle)、指环测试(finger-ring test)、正常步行速度、最大步行速度、起立行走试验(tug:timed up and go test)、衰弱指数、肌肉减少症指标等。进而,作为营养状态的指标,可以使用前述与营养状态相关的指标中的任1种,也可以组合多种前述与营养状态相关的指标而使用。例如,作为营养状态的指标,不仅可以组合血白蛋白浓度,还可以组合瘦体重、肌力等。
[0057]
本发明中“糖代谢状态的指标”是指与糖代谢状态相关的指标,是指通过血液检测、尿液检测等而能够测定或算出的指标。糖代谢状态的指标只要是与糖代谢状态相关的指标就没有特别限定,例如可列举出:包含在由对象得到的血液、尿液等生物试样中且与糖代谢状态相关的物质或它们在生物试样中的浓度等,更具体而言,可列举出空腹血糖值、随机血糖值、胰岛素、胰高血糖素、c肽、肠促胰岛素、葡萄糖依赖性促胰岛素多肽(gip:gastric inhibitory polypeptide,肠抑胃肽)、glp-1、脂肪细胞因子(adipocytokine)、瘦素、脂联素、ages、hba1c、糖化白蛋白、1,5-无水葡萄糖醇、果糖胺等的血液浓度、尿液浓度等。另外,作为与糖代谢状态相关的指标,可以是与对象的胰岛素抵抗、胰岛素分泌能力相关的指标,例如可列举出基于糖耐量测定的葡萄糖或胰岛素的auc、cmax、tmax、120分钟后血糖值/胰岛素、胰岛素指数、homa-ir、胰岛素抵抗/敏感性指标、糖摄取能力指标、homa-β(胰岛素分泌能力指标)等。进而,作为糖代谢状态的指标,可以使用前述与糖代谢状态相关的指标中的任1种,也可以组合多种前述与糖代谢状态相关的指标而使用。例如,作为糖代谢状态的指标,不仅可以组合空腹时血糖值,还可以组合血胰岛素浓度、hba1c的浓度等。
[0058]
本发明中“炎症状态的指标”是指与炎症状态相关的指标,是指通过血液检测、尿液检测等而能够测定或算出的指标。炎症状态的指标只要是与炎症状态相关的指标就没有特别限定,例如可列举出:包含在由对象得到的血液、尿液等生物试样中且与炎症状态相关的物质或它们在生物试样中的浓度等,更具体而言,可列举出c反应蛋白(crp)、炎症性细胞因子、tnf-α、ifnγ、白细胞介素类(il-1、il-6、il-8、il-12、il-18等)、趋化因子、mcp-1(ccl2)、mip-1α、mcp-2、hmgb-1、α1-球蛋白组分、α1-抗胰蛋白酶,α1-抗胰凝乳蛋白酶,α1-酸性糖蛋白、血清淀粉样蛋白a(saa)、α2-球蛋白组分、结合珠蛋白、铜蓝蛋白、铁蛋白、白细胞数、中性粒细胞/淋巴细胞比(nlr)、血小板/淋巴细胞比(plr)等。另外,作为与炎症状态相关的指标,可以是具有抑制炎症症状作用的物质、炎症性细胞因子拮抗物质或这些在生物试样中的浓度等,例如可列举出抗炎性细胞因子(tgf-β)、白细胞介素类(il-4、il-10、il-11等)、可溶性肿瘤坏死因子受体(stnf-r:soluble tumor necrosis factor-receptor)、白介素1受体拮抗剂(il-1ra:interleukin 1 receptor antagonist)等。进而,作为炎症状态的指标,可以使用前述与炎症状态相关的指标中的任1种,也可以组合多种前述与炎症状态相关的指标而使用。例如,作为炎症状态的指标,不仅可以组合血crp浓度,还
可以组合血液中或尿液中白细胞介素类的浓度等。
[0059]
本发明的预后预测方法中,可以首先实施(a)测定被检对象的营养状态、糖代谢状态或炎症状态的指标的工序。营养状态、糖代谢状态或炎症状态的指标的测定可以通过公知的方法来实施。例如,使用与营养状态、糖代谢状态或炎症状态相关的物质在生物试样中的浓度作为营养状态、糖代谢状态或炎症状态的指标时,在血液检测、尿液检测中利用公知的方法对从对象中采集的生物试样等进行测定并计算即可。另外,营养状态的指标也可以利用身体测量、体力测定、运动功能测定等公知的方法进行测定、计算。另外,糖代谢状态的指标可以依据糖耐量测定等公知的步骤进行测定、计算。例如,使用白蛋白、葡萄糖和c反应蛋白等的血液浓度作为营养状态、糖代谢状态或炎症状态的指标时,其为定期健康诊断等的血液检测的检测对象,这些的测定可以依据公知的步骤来实施。
[0060]
本发明的预后预测方法中,可以进一步实施如下工序:基于前述工序(a)中测定的对象的营养状态、糖代谢状态或炎症状态的指标的值,对被检对象确定预后(包括生酮饮食疗法中的预后)的工序。该工序中,通过比较前述工序(a)中测定的该对象的营养状态、糖代谢状态或炎症状态的指标的值和与营养状态、糖代谢状态或炎症状态相关的参照值,从而示出该对象的预后为不良(或良好)。此处,“比较”前述工序(a)中测定的被检对象的营养状态、糖代谢状态或炎症状态的指标的值和与营养状态、糖代谢状态或炎症状态相关的参照值不仅包括比较前述工序(a)中测定的指标的绝对值与参照值的绝对值的情况,还包括如下情况:使用对前述工序(a)中测定的指标的值和参照值分别使用进行加减乘除、对数(log)转换、asin转换等运算而得的值进行比较的情况;使用前述工序(a)中测定的指标的值与参照值之间的变化量、变化率的情况。即,本发明的预后预测方法可以还包括如下工序:(b)比较对象的营养状态、糖代谢状态或炎症状态的指标的值和与营养状态、糖代谢状态或炎症状态相关的参照值,确定对象的预后为不良(或良好)。另外,本发明的预后预测方法中,预后为不良是指:规定时间内的存活率更低、癌症进展(例如,肿瘤的大小增大、出现新病变)、抗癌疗法中出现副作用或副作用增强等。本发明的预后预测方法中,预后良好是指:规定时间内的存活率更高、癌萎缩(例如,肿瘤的大小减小、未出现新病变)、抗癌疗法中不出现副作用、或副作用减弱等。
[0061]
作为与营养状态相关的参照值,可以使用某一基准时间点的同一对象的与营养状态相关的值、各种指南和各种报告中记载的与营养状态相关的值等。例如,可以测定对象开始进行抗癌疗法之前的营养状态的指标,将该指标的值作为参照值后,测定对象开始进行抗癌疗法并经过规定时间后的营养状态的指标(实施前述工序(a)),对两者进行比较(实施前述工序(b))。另外,对于已开始进行抗癌疗法的对象,可以如下进行:测定在某一基准时间点的营养状态的指标,将该指标的值作为参照值后,测定经过规定时间后的营养状态的指标(实施前述工序(a)),对两者进行比较(实施前述工序(b))。进而,也可以如下进行:将各种指南和各种报告中记载的营养状态的指标的值作为参照值,对已开始进行抗癌疗法的对象测定营养状态的指标(实施前述工序(a)),对两者进行比较(实施前述工序(b))。
[0062]
作为与糖代谢状态相关的参照值,可以使用某一基准时间点的同一对象的与糖代谢状态相关的值、各种指南和各种报告中记载的与糖代谢状态相关的值等。例如,可以测定对象开始进行抗癌疗法之前的糖代谢状态的指标,将该指标的值作为参照值后,测定对象开始进行抗癌疗法并经过规定时间后的糖代谢状态的指标(实施前述工序(a)),对两者进
行比较(实施前述工序(b))。另外,对于已开始进行抗癌疗法的对象,可以如下进行:测定某一基准时间点的糖代谢状态的指标,将该指标的值作为参照值后,测定经过规定时间后的糖代谢状态的指标(实施前述工序(a)),对两者进行比较(实施前述工序(b))。进而,也可以如下进行:将各种指南和各种报告中记载的糖代谢状态的指标的值作为参照值,对已开始进行抗癌疗法的对象测定糖代谢状态的指标(实施前述工序(a)),对两者进行比较(实施前述工序(b))。
[0063]
作为与炎症状态相关的参照值,可以使用某一基准时间点的同一对象的与炎症状态相关的值、各种指南和各种报告中记载的与炎症状态相关的值等。例如,可以测定对象开始进行抗癌疗法之前的炎症状态的指标,将该指标的值作为参照值后,测定对象开始进行抗癌疗法并经过规定时间后的炎症状态的指标(实施前述工序(a)),对两者进行比较(实施前述工序(b))。另外,对于已开始进行抗癌疗法的对象,可以如下进行:测定某一基准时间点的炎症状态的指标(实施前述工序(a)),对两者进行比较(实施前述工序(b))。进而,也可以如下进行:将各种指南和各种报告中记载的炎症状态的指标的值作为参照值,对已开始进行抗癌疗法的对象测定炎症状态的指标(实施前述工序(a)),对两者进行比较(实施前述工序(b))。
[0064]
例如,前述工序(a)中测定的营养状态的指标为白蛋白的血液浓度的情况下,被检对象中血白蛋白浓度低于参照值时,示出对象的预后为不良,被检对象中血白蛋白浓度高于参照值时,示出对象的预后为良好。例如,前述工序(a)中测定的糖代谢状态的指标为葡萄糖的血液浓度的情况下,被检对象中血糖值高于参照值时,示出对象的预后为不良,被检对象中血糖值低于参照值时,示出对象的预后为良好。例如,前述工序(a)中测定的炎症状态的指标为c反应蛋白(crp)的血液浓度的情况下,被检对象中血crp浓度高于参照值时,示出对象的预后为不良,被检对象中血crp浓度低于参照值时,示出对象的预后为良好。
[0065]
本发明的预后预测方法中,用于预测预后的指标可以是营养状态的指标、糖代谢状态的指标和炎症状态的指标中的任1种,也可以是这些中的一部分或全部的组合。组合2种指标来实施工序(b)时,可以通过对各指标确定参照值并对任1种指标与对应的参照值进行比较,来确定对象的预后为不良(或良好)。另外,组合3种指标来实施工序(b)时,可以通过对各指标确定参照值并对2种或3种(优选为至少1种)指标与对应的参照值进行比较,来确定对象的预后为不良(或良好)。进而,本发明的预后预测方法中,为了进一步提高预后预测的精度,也可以对于营养状态的指标、糖代谢状态的指标和炎症状态的指标中的任1种以上利用系数进行加权后用于预测预后。例如,为了进一步提高预后预测的精度,也可以对于营养状态的指标、糖代谢状态的指标和炎症状态的指标中的任1种以上组合利用系数进行加权和加减乘除、对数转换、asin转换等运算并用于预测预后。该运算可以人工进行,也可以利用ai(人工智能)等的功能。
[0066]
前述工序(a)和(b)可以在任意时期对癌症患者实施。例如,将各种指南和各种报告中记载的营养状态、糖代谢状态或炎症状态的指标的值作为参照值时,可以在任意时期对用于与该参照值进行比较的营养状态、糖代谢状态或炎症状态的指标实施前述工序(a)和(b)。另外,例如,测定某一基准时间点的营养状态、糖代谢状态或炎症状态的指标,将该指标的值作为参照值时,可以在从该基准时间点起经过规定时间后(例如,经过1周~24个月之间的任意时间后)实施前述工序(a)和(b)。
[0067]
对于已实施抗癌疗法的癌症患者,例如,可以将抗癌疗法开始前的营养状态、糖代谢状态或炎症状态的指标的值作为参照值,在从开始抗癌疗法起经过规定时间后(例如,经过1周~24个月之间的任意时间后)实施前述工序(a)和(b);也可以测定开始抗癌疗法后的某一基准时间点的营养状态、糖代谢状态或炎症状态的指标,将该指标的值作为参照值,在从该基准时间点起经过规定时间后(例如,经过1周~24个月之间的任意时间后)实施前述工序(a)和(b)。另外,可以将各种指南和各种报告中记载的营养状态、糖代谢状态或炎症状态的指标的值作为参照值,在任意时期实施前述工序(a)和(b)。为了进一步提高预后预测的精度,上述的规定时间也可以根据确定参照值时的时期来确定。
[0068]
根据本发明的预后预测方法,能够预测或判断癌症患者的预后。因此,本发明的预后预测方法在确定抗癌疗法的治疗方针时在提供适合的判断材料方面是有用的。即,本发明的预后预测方法可以用于利用抗癌疗法治疗癌症时的辅助治疗,对象的预后是否不良的判断(或是否良好的判断)可以最终由医生根据情况并结合其它发现来进行。根据本发明的预后预测方法,还能够预测或判断生酮饮食疗法中的癌症患者的预后。因此,本发明的预后预测方法在确定生酮饮食疗法的治疗方针时在提供适合的判断材料方面是有用的。即,本发明的预后预测方法可以用于利用生酮饮食疗法治疗癌症的辅助治疗。
[0069]
《《有效性预测方法》》
[0070]
本发明的抗癌疗法的有效性的预测方法中,使用选自由营养状态的指标、糖代谢状态的指标和炎症状态的指标组成的组中的至少1种指标作为抗癌疗法的有效性的指标。
[0071]
本发明的抗癌疗法的有效性的预测方法中,可以首先实施(c)测定被检对象的营养状态、糖代谢状态或炎症状态的指标的工序。营养状态、糖代谢状态或炎症状态的指标及其测定如本发明的预后预测方法中的记载所述。
[0072]
本发明的抗癌疗法的有效性的预测方法中,可以进一步实施如下工序:基于前述工序(c)中测定的对象的营养状态、糖代谢状态或炎症状态的指标的值,对被检对象确定抗癌疗法(包括生酮饮食疗法)的有效性的工序。该工序中,比较前述工序(c)中测定的该对象的营养状态、糖代谢状态或炎症状态的指标的值和与营养状态、糖代谢状态或炎症状态相关的参照值,由此示出抗癌疗法对该对象的有效性低(或高)。此处,“比较”前述工序(c)中测定的被检对象的营养状态、糖代谢状态或炎症状态的指标的值和与营养状态、糖代谢状态或炎症状态相关的参照值不仅包括比较前述工序(c)中测定的指标的绝对值与参照值的绝对值的情况,还包括如下情况:使用对前述工序(c)中测定的指标的值与参照值分别使用进行加减乘除、对数转换、asin转换等运算而得的值进行比较的情况;使用前述工序(c)中测定的指标的值与参照值之间的变化量、变化率的情况。即,本发明的抗癌疗法的有效性的预测方法可以还包括如下工序:(d)比较对象的营养状态、糖代谢状态或炎症状态的指标的值和与营养状态、糖代谢状态或炎症状态相关的参照值,来确定抗癌疗法对对象的有效性低(或高)。另外,本发明的抗癌疗法的有效性的预测方法中,抗癌疗法的有效性低是指:规定时间内的癌症的恢复率更低、癌症进展(例如,肿瘤的大小增大、出现新病变)、抗癌疗法出现副作用或副作用增强等。本发明的抗癌疗法的有效性的预测方法中,抗癌疗法的有效性高是指:规定时间内的癌症的恢复率更高、癌萎缩(例如,肿瘤的大小减小、未出现新病变)、抗癌疗法中未出现副作用、或副作用降低等。
[0073]
本发明的抗癌疗法的有效性的预测方法中的与营养状态相关的参照值、与糖代谢
状态相关的参照值、与炎症状态相关的参照值如本发明的预后预测方法中的记载所述。例如,前述工序(c)中测定的营养状态的指标为白蛋白的血液浓度的情况下,被检对象中血白蛋白浓度低于参照值时,示出抗癌疗法的有效性低,被检对象中血白蛋白浓度高于参照值时,示出抗癌疗法的有效性高。例如,前述工序(c)中测定的糖代谢状态的指标为葡萄糖的血液浓度的情况下,被检对象中血糖值高于参照值时,示出抗癌疗法的有效性低,被检对象中血糖值低于参照值时,示出抗癌疗法的有效性高。例如,前述工序(c)中测定的炎症状态的指标为c反应蛋白(crp)的血液浓度的情况下,被检对象中血crp浓度高于参照值时,示出抗癌疗法的有效性低,被检对象中血crp浓度低于参照值时,示出抗癌疗法的有效性高。
[0074]
本发明的抗癌疗法的有效性的预测方法中,用于预测有效性的指标可以是营养状态的指标、糖代谢状态的指标和炎症状态的指标中的任1种,可以是这些中的一部分或全部的组合。组合2种指标来实施工序(d)时,可以通过对各指标确定参照值并对任1种指标与对应的参照值进行比较,来确定抗癌疗法对对象的有效性低(或高)。另外,组合3种指标来实施工序(d)时,可以通过对各指标确定参照值并对2种或3种(优选为至少1种)指标与对应的指标进行比较,来确定抗癌疗法对对象的有效性低(或高)。进而,本发明的抗癌疗法的有效性的预测方法中,为了进一步提高有效性预测的精度,也可以对营养状态的指标、糖代谢状态的指标和炎症状态的指标中的任1种以上利用系数进行加权后用于预测有效性。例如,为了进一步提高有效性的预测的精度,也可以对营养状态的指标、糖代谢状态的指标和炎症状态的指标中的任1种以上组合利用系数进行加权与加减乘除、对数转换、asin转换等运算,用于有效性的预测。该计算可以人工进行,也可以利用ai(人工智能)等的功能。
[0075]
前述工序(c)和(d)可以在任意时期对癌症患者实施。例如,将各种指南和各种报告中记载的营养状态、糖代谢状态或炎症状态的指标的值作为参照值时,可以在任意时期对用于与该参照值进行比较的营养状态、糖代谢状态或炎症状态的指标实施前述工序(c)和(d)。另外,例如,测定某一基准时间点的营养状态、糖代谢状态或炎症状态的指标,将该指标的值作为参照值时,可以在从该基准时间点起经过规定时间后(例如,经过1周~24个月之间的任意时间后)实施前述工序(c)和(d)。
[0076]
对于已实施抗癌疗法的癌症患者,例如,可以将抗癌疗法开始前的营养状态、糖代谢状态或炎症状态的指标的值作为参照值,在从开始抗癌疗法起经过规定时间后(例如,经过1周~24个月之间的任意时间后)实施前述工序(c)和(d);也可以测定在开始抗癌疗法后的某一基准时间点的营养状态、糖代谢状态或炎症状态的指标,将该指标的值作为参照值,在从该基准时间点起经过规定时间后(例如,经过1周~24个月之间的任意时间后)实施前述工序(c)和(d)。另外,可以将各种指南和各种报告中记载的营养状态、糖代谢状态或炎症状态的指标的值作为参照值,在任意时期实施前述工序(c)和(d)。为了进一步提高预测抗癌疗法的有效性的精度,上述的规定时间也可以根据确定参照值时的时期来确定。
[0077]
根据本发明的抗癌疗法的有效性的预测方法,能够预测或判断抗癌疗法对癌症患者的有效性。因此,本发明的抗癌疗法的有效性的预测方法在确定抗癌疗法的治疗方针时在提供适合的判断材料方面是有用的。即,本发明的抗癌疗法的有效性的预测方法可以用于利用抗癌疗法治疗癌症的辅助治疗,抗癌疗法对对象是否有效的判断可以最终由医生根据情况并结合其它发现来进行。另外,根据本发明的抗癌疗法的有效性的预测方法,能够预测或判断生酮饮食疗法对癌症患者的有效性。因此,本发明的抗癌疗法的有效性的预测方
法在确定生酮饮食疗法的治疗方针时在提供适合的判断材料方面是有用的。即,本发明的抗癌疗法的有效性的预测方法可以用于利用生酮饮食疗法治疗癌症的辅助治疗。
[0078]
《《适合的疗法的选择方法》》
[0079]
本发明的选择方法中,使用选自由营养状态的指标、糖代谢状态的指标和炎症状态的指标组成的组中的至少1种指标作为选择适合癌症患者的疗法的指标。
[0080]
本发明的选择方法中,可以首先实施(e)测定被检对象的营养状态、糖代谢状态或炎症状态的指标的工序。营养状态、糖代谢状态或炎症状态的指标及其测定如本发明的预后预测方法中的记载所述。
[0081]
本发明的选择方法中,可以进一步包括如下工序:基于前述工序(e)中测定的对象的营养状态、糖代谢状态或炎症状态的指标的值,确定抗癌疗法(包括生酮饮食疗法)对被检对象的有效性的工序。该工序中,比较前述工序(e)中测定的该对象的营养状态、糖代谢状态或炎症状态的指标的值和与营养状态、糖代谢状态或炎症状态相关的参照值,由此示出抗癌疗法对该对象的有效性低(或高)。本发明的选择方法中,抗癌疗法的有效性低是指:规定时间内的癌症的恢复率更低、癌症进展(例如,肿瘤的大小增大、出现新病变)、抗癌疗法出现副作用或副作用增强等。本发明的选择方法中,抗癌疗法的有效性高是指:规定时间内的癌症的恢复率更高、癌症萎缩(例如,肿瘤的大小减小、未出现新病变)、抗癌疗法中未出现副作用、或副作用降低等。因此,抗癌疗法在对象中的有效性低时,可以选择除对象的抗癌疗法以外的其它抗癌疗法(例如,切除/摘除术等手术疗法、化学疗法、放射线疗法、car-t细胞疗法等癌症免疫疗法和生酮饮食疗法等饮食疗法以及这些中的一部分或全部的组合)作为适合的疗法。另外,抗癌疗法对对象的有效性高时,可以继续或中止对象的抗癌疗法。此处,“比较”前述工序(e)中测定的被检对象的营养状态、糖代谢状态或炎症状态的指标的值和与营养状态、糖代谢状态或炎症状态相关的参照值不仅包括比较前述工序(e)中测定的指标的绝对值与参照值的绝对值的情况,还包括如下情况:使用对前述工序(e)中测定的指标的值与参照值分别进行加减乘除、对数转换、asin转换等运算而得的值进行比较的情况;使用前述工序(e)中测定的指标的值与参照值之间的变化量、变化率的情况。即,本发明的选择方法可以还包括如下工序:(f)比较对象的营养状态、糖代谢状态或炎症状态的指标的值和与营养状态、糖代谢状态或炎症状态相关的参照值,确定希望选择除对象的抗癌疗法以外的抗癌疗法(或者希望继续或中止对象的抗癌疗法)。
[0082]
本发明的选择方法中的与营养状态相关的参照值、与糖代谢状态相关的参照值、及与炎症状态相关的参照值如本发明的预后预测方法中的记载所述。例如,前述工序(e)中测定的营养状态的指标为白蛋白的血液浓度的情况下,被检对象中血白蛋白浓度低于参照值时,示出希望选择除对象的抗癌疗法以外的抗癌疗法,被检对象中血白蛋白浓度高于参照值时,示出希望继续或中止对象的抗癌疗法。例如,前述工序(e)中测定的糖代谢状态的指标为葡萄糖的血液浓度的情况下,被检对象中血糖值高于参照值时,示出希望选择除对象的抗癌疗法以外的抗癌疗法,被检对象中血糖值低于参照值时,示出希望继续或中止对象的抗癌疗法。例如,前述工序(e)中测定的炎症状态的指标为c反应蛋白(crp)的血液浓度的情况下,被检对象中血crp浓度高于参照值时,示出希望选择除对象的抗癌疗法以外的抗癌疗法,被检对象中血crp浓度低于参照值时,示出希望继续或中止对象的抗癌疗法。
[0083]
本发明的选择方法中,选择中使用的指标可以是营养状态的指标、糖代谢状态的
指标和炎症状态的指标中的任1种,也可以是这些中的一部分或全部的组合。组合2种指标来实施工序(f)时,可以对各指标确定参照值并对任1种指标与对应的参照值进行比较,来确定希望选择除对象的抗癌疗法以外的抗癌疗法(或者希望继续或中止对象的抗癌疗法)。另外,组合3种指标来实施工序(f)时,可以对各指标确定参照值并对2种或3种(优选为至少1种)指标与对应的指标进行比较,来确定希望选择除对象的抗癌疗法以外的抗癌疗法(或者希望继续或中止对象的抗癌疗法)。进而,本发明的选择方法中,为了进一步提高选择的精度,也可以对营养状态的指标、糖代谢状态的指标和炎症状态的指标中的任1种以上利用系数进行加权后用于选择适合癌症患者的疗法。例如,为了更适宜地进行选择适合癌症患者的疗法,也可以对营养状态的指标、糖代谢状态的指标和炎症状态的指标中的任1种以上组合利用系数进行加权与加减乘除、对数转换、asin转换等运算,用于选择适合癌症患者的疗法。该计算可以人工进行,也可以利用ai(人工智能)等的功能。
[0084]
前述工序(e)和(f)可以在任意时期对癌症患者实施。例如,将各种指南和各种报告中记载的营养状态、糖代谢状态或炎症状态的指标的值作为参照值时,可以在任意时期对用于与该参照值进行比较的营养状态、糖代谢状态或炎症状态的指标实施前述工序(e)和(f)。另外,例如,测定某一基准时间点的营养状态、糖代谢状态或炎症状态的指标,将该指标的值作为参照值时,可以在从该基准时间点起经过规定时间后(例如,经过1周~24个月之间的任意时间后)实施前述工序(e)和(f)。
[0085]
对于已实施抗癌疗法的癌症患者,例如,可以将抗癌疗法开始前的营养状态、糖代谢状态或炎症状态的指标的值作为参照值,在从开始抗癌疗法起经过规定时间后(例如,经过1周~24个月之间的任意时间后)实施前述工序(e)和(f);也可以测定开始抗癌疗法后的某一基准时间点的营养状态、糖代谢状态或炎症状态的指标,将该指标的值作为参照值,在从该基准时间点起经过规定时间后(例如,经过1周~24个月之间的任意时间后)实施前述工序(e)和(f)。另外,可以将各种指南和各种报告中记载的营养状态、糖代谢状态或炎症状态的指标的值作为参照值,在任意时期实施前述工序(e)和(f)。为了进一步提高选择适合癌症患者的疗法的精度,上述的规定时间也可以根据确定参照值时的时期来确定。
[0086]
根据本发明的选择方法,可以选择适合癌症患者的疗法。因此,本发明的选择方法在确定抗癌疗法的治疗方针时在提供适合的判断材料方面是有用的。即,本发明的选择方法可以用于利用抗癌疗法治疗癌症的辅助治疗,是否应该选择除对象的抗癌疗法以外的其它抗癌疗法的判断可以最终由医生根据情况并结合其它发现来进行。另外,根据本发明的选择方法,可以选择生酮饮食疗法中的适合癌症患者的疗法。因此,本发明的选择方法在确定生酮饮食疗法的治疗方针时在提供适合的判断材料方面是有用的。即,本发明的选择方法可以用于利用生酮饮食疗法治疗癌症的辅助治疗,对象是否应该选择除生酮饮食疗法以外的抗癌疗法的判断可以最终由医生根据情况并结合其它发现来进行。
[0087]
根据本发明的另一方面,提供一种癌症患者的治疗方法,其中,实施本发明的选择方法并选择适合癌症患者的抗癌疗法,对该患者实施所选择的抗癌疗法。根据本发明的另一方面,提供一种生酮饮食疗法中的癌症患者的治疗方法,其中,实施本发明的选择方法而选择生酮饮食疗法中的适合癌症患者的抗癌疗法,对该患者实施所选择的抗癌疗法。本发明的治疗方法中适合的抗癌疗法的选择可以如前所述依据本发明的选择方法来实施。
[0088]
根据本发明,以营养状态的指标、糖代谢状态的指标和炎症状态的指标中的至少1
种作为指标,能够预测癌症患者的预后,并且能够预测抗癌疗法对癌症患者的效果,进而可以选择适合癌症患者的疗法。因此根据本发明,能够更有效地实施抗癌疗法,甚至在改善患者qol、提供与患者个人匹配的疗法(个性化营养、精准医疗等)方面是有利的。根据本发明,以能够通过通常的血液检测、尿液检测、身体测量、体力测定、运动功能测定等测定的营养状态的指标、糖代谢状态的指标和炎症状态的指标中的至少1种作为指标,能够预测癌症患者的预后,并且能够预测抗癌疗法对癌症患者的效果,进而可以对癌症患者选择适合的疗法,在这些方面是有利的。
[0089]
根据本发明,另外,以实施了控制糖类的高脂肪饮食疗法的晚期癌症患者的营养状态的指标、糖代谢状态的指标和炎症状态的指标中的至少1种作为指标,能够预测该癌症患者的预后,并且能够预测生酮饮食疗法对癌症患者的效果,进而可以选择适合癌症患者的疗法。因此根据本发明,能够更有效地实施生酮饮食疗法中的抗癌疗法,甚至在改善患者qol、提供与患者个人匹配的疗法(个性化营养、精准医疗等)方面是有利的。根据本发明,以能够通过通常的血液检测、尿液检测、身体测量、体力测定、运动功能测定等测定的营养状态的指标、糖代谢状态的指标和炎症状态的指标中的至少1种作为指标,能够预测生酮饮食疗法中的癌症患者的预后,并且能够预测生酮饮食疗法对癌症患者的效果,进而可以选择生酮饮食疗法中的适合癌症患者的疗法,在这些方面是有利的。
[0090]
实施例
[0091]
基于以下的例子对本发明进行进一步具体地说明,但本发明不限定于这些例子。
[0092]
例1:以血白蛋白浓度、血糖值和血crp浓度的组合为指标的癌症的预后预测效果
[0093]
(1)被检者的选择
[0094]
被检者为55名(男性24名、女性31名)癌症患者,以4期、功能状态评分(ps)为0~2、能经口摄取的患者为对象。被检者的平均年龄为55.8
±
12.1岁、平均身高为162.3
±
8.7cm、平均体重为54.7
±
12.1kg。疾病中,肺癌12例、大肠癌9例、乳腺癌5例、膀胱癌2例、卵巢癌2例、其它21例。另外,治疗史中,化学疗法42例、手术32例、放射线17例。
[0095]
(2)试验方法
[0096]
针对上述(1)中记载的各种癌症患者,除了通常的治疗(手术疗法、化学疗法、放射线疗法等)之外实施了生酮饮食疗法。在导入生酮饮食时,说明会出现暂时低血糖、恶心、倦怠感等,实际的营养学指导是在多年来对以癫痫患者为对象实施了生酮饮食指导的营养师的指导下进行的。调理对象一同参与了营养指导。生酮饮食疗法的详情如下所述。
[0097]
a在最初的1周,以实际体重为基础将卡路里设为30kcal/kg,脂质没有限制,蛋白质没有限制,目标是碳水化合物(为除膳食纤维以外的碳水化合物,相当于糖类,以下同样)的每天摄取量为10g以下。具体而言,将体重设为50kg,每天摄取卡路里为1500kcal,设为脂质140g:蛋白质60g:碳水化合物10g的比率。酮比[脂质(g):(蛋白质(g) 碳水化合物(g))]目标为2:1。其它营养素可以没有限制地摄取。必需的微量元素、维生素可以使用营养强化剂等进行适宜摄取。在导入生酮饮食时,依据营养师制作的菜单摄取了饮食。
[0098]
b在第2周~3个月,以血酮体值为参考,调整了饮食内容。进行了指导,以避免血酮体值为乙酰乙酸500μmol/l以上、β-羟基丁酸1000μmol/l以下,尽量以乙酰乙酸1000μmol/l以上、β-羟基丁酸2000μmol/l以上为目标。碳水化合物的每天摄取量为20g以下,每天摄取卡路里为1400~1600kcal,设为脂质120~140g:蛋白质70g:碳水化合物20g的比率。酮比
[脂质(g):(蛋白质(g) 碳水化合物(g))]目标为2:1~1:1。另外,在补充卡路里时,使用“ketone formula”(株式会社明治制)或“mct油”(the nisshin oillio group,ltd.制)。
[0099]
c在3个月之后,将碳水化合物的1次摄取量设为10g,每天摄取量为30g以下,其它依据b。
[0100]
生酮饮食(脂质为75~80%,也称为ketogenic diet)一直以来被长期用于小儿癫痫患者,其安全性也已得到确认,因此在2010年版cochrane library中有所记载,针对实际上的方针,也引用该文献作为参考。确认了:在导入初期可能出现的暂时恶心、倦怠感、低血糖等能够得到充分应对。由于是脂质较多的饮食,因此由于偏好的问题而可能会以一定的比例出现无法持续进行生酮饮食的患者。针对这些问题,可以与营养师共同来应对。
[0101]
(3)评价方法
[0102]
作为主要评价项目,使用导入生酮饮食前后的pet-ct图像,评价了生酮饮食疗法对癌症的治疗效果。具体而言,依据recist指南(therasse p,et al.,j natl cancer inst,2000,vol 92,no.3,205-216),对生酮饮食开始前的图像、与自生酮饮食开始起3个月后(以下有时简称为“试验开始后3个月”)的图像进行比较,判断了治疗效果。治疗效果分类为:肿瘤完全消失即“完全缓解(cr)”、肿瘤缩小30%以上即“部分奏效(pr)”、肿瘤的大小没有变化即“稳定(sd)”、肿瘤尺寸的直径总和增加20%以上且直径总和的绝对值也增加5mm以上或出现新病变即“进展(pd)”。另外,作为副评价项目,使用基于卡普兰-梅耶法的存活率曲线评价了试验开始后约6年的存活率。
[0103]
在试验开始后3个月内,从被检者采血,测定了血白蛋白浓度、血糖值和血crp浓度。对于血白蛋白浓度,将4.0g/dl以上设为0分、将小于4.0g/dl设为1分,对于血糖值,将90mg/dl以下设为0分、将超过90mg/dl设为1分,对于血crp浓度,将0.5mg/dl以下设为0分、将超过0.5mg/dl设为1分进行分值化。对各被检者计算出总得分,将被检者分为血白蛋白浓度、血糖值和血crp浓度的组合分数的总得分(以下有时简称为“组合评分”)为0分、1分、2分或3分的组。另外,依据文献(meidenbauer et al.,nutr metab,2015mar 11;12:12)计算出试验开始后3个月的葡萄糖-生酮指数。消化器官症状评分的变化使用胃肠道症状评定量表(gastrointestinal symptom rating scale,以下有时简称为“gsrs评分”)进行评价。另外,qol的一般情况调查表(癌症治疗的qol评分)的变化使用调查问卷(eortc qlq-c30)进行评价。
[0104]
(4)结果
[0105]
在55例被检者中,有5例未实施试验、11例试验中止、2例被排除在解析之外,对于除这些病例之外的37例,评价了3个月持续生酮饮食的效果。试验开始后3个月的葡萄糖-生酮指数有31例达到中等程度(moderate)以上的酮症,但gsrs评分和qol的一般情况调查表未观察到显著变化。对于癌症治疗效果,完全缓解(cr)为0例、部分奏效(pr)为4例、稳定(sd)为20例、进展(pd)为12例、np(not performed;未执行)为1例。另外,存活率如图1所示,风险数量(number at risk,在那个时间点存活的患者数)如表1所示。
[0106]
[表1]
[0107]
表1:组合评分组中的风险数量(在那个时间点存活的患者数)
[0108][0109]
存活期中值为979天(最大2164天),22例在试验结束时存活。利用在试验开始后3个月的血白蛋白浓度、血糖值和血crp浓度的计分而分组时,总得分为0分的为14例、1分为8例、2分为7例、3分为8例,由图1确认了:根据分数,存活期可观察到显著差异(对数秩检验、p《0.001)。另外确认了:抗癌疗法对于血白蛋白浓度、血糖值和血crp浓度的组合的分数更低的癌症患者组更有效。另外确认了:根据血白蛋白浓度、血糖值和血crp浓度的组合评分能够预测预后,因此能够选择适合癌症患者的疗法。以上的结果表明:通过使用实施了3个月生酮饮食疗法的患者的血白蛋白浓度、血糖值和血crp浓度的组合作为指标,从而能够预测癌症患者的预后(特别是生酮饮食疗法中的癌症患者的预后)、能够对癌症患者(特别是生酮饮食疗法中的癌症患者)选择疗法、能够预测抗癌疗法对癌症患者的有效性(特别是生酮饮食疗法的有效性)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。