稳定喜树碱药物组合物
1.本技术是申请日为2016年10月15日、申请号为201680073535.9(国际 申请号为pct/us2016/057247)、名称为“稳定喜树碱药物组合物”的发明专 利申请的分案申请。
2.优先权要求
3.本专利申请要求如下的权益:美国临时专利申请序列号62/242,835(提交 日为2015年10月16日)、62/242,873(提交日为2015年10月16日)、 62/244,061(提交日为2015年10月20日)和62/244,082(提交日为2015年10 月20日),将其各自整体内容并入本技术以作参考。
技术领域
4.本技术涉及稳定包含喜树碱化合物的药物组合物,包括稳定以减少储存 过程中溶血脂质形成的脂质体喜树碱药物制剂。
背景技术:
5.喜树碱化合物(如伊立替康或拓扑替康)可用于治疗人体内的肿瘤和/或 癌症。例如,用于治疗某些形式的癌症的可注射脂质体药品可以制备为包封 喜树碱化合物的脂质体分散体。脂质体喜树碱组合物可将喜树碱化合物与聚 阴离子捕获剂一起包封在包含胆固醇和一种或多种磷脂(“pl”)的脂质体中。 然而,在喜树碱中磷脂的水解和活性内酯结构的水解可以在具有一种或多种 磷脂的喜树碱脂质体中发生。脂质体磷脂如磷脂酰胆碱(“pc” )的水解分解 可以改变从脂质体中的喜树碱化合物例如伊立替康的释放。pl(例如pc)水 解的第一步可导致形成溶血-pl(例如溶血磷脂酰胆碱(“溶血-pc”),其为甘油 磷酸胆碱脂肪酸单酯)。
6.脂质体喜树碱组合物至少在两个方面受到ph的影响。首先,脂质体喜 树碱(例如脂质体伊立替康)的磷脂水解分解倾向于为ph依赖性,认为ph值 为6.0或6.5使磷脂酰胆碱的水解最小化。ph大于6.5的条件倾向于增加(1) 喜树碱化合物(例如伊立替康)转化为活性较小的羧酸盐形式和(2)脂质体中 溶血-pc的量。其次,喜树碱化合物在活性较小的羧酸形式(主要在中性和碱 性ph下)和在酸性ph下主要的活性较大的内酯形式之间经历ph-依赖性转 化。例如,伊立替康的羧酸盐形式转化为内酯形式主要发生在ph为6.0(约 85%的伊立替康为活性较大的内酯形式)至ph为7.5(仅约15%的伊立替康为 活性较大的内酯形式)。在ph为6.5,约65%的伊立替康为活性较大的内酯 形式。
7.出乎意料地发现,在ph为6.5制备的含磷脂脂质体喜树碱的稳定性受 到在储存过程中在冷藏条件(2-8℃)下形成溶血-pc的不利影响。例如,样品 12(在ph为6.5制备的包封在伊立替康脂质体中的伊立替康蔗糖八硫酸酯, 所述伊立替康脂质体包含摩尔比为3:2:0.015的dspc、胆固醇和mpeg-2000
‑ꢀ
dspe)的伊立替康脂质体组合物随后在制备之后的前3个月冷藏储存(2-8℃) 期间产生的溶血-pc超过30mol%(相对于伊立替康脂质体组合物中的磷脂酰 胆碱的总量)(以及在前9个月期间产生大于35mol%溶血-pcr)。
8.因此,仍需要稳定的喜树碱药物组合物。例如,需要较稳定、改善的伊 立替康脂质
体制剂,其在制备之后在2-8℃冷藏储存期间产生较少的溶血
‑ꢀ
pc。本发明解决了该需求。
技术实现要素:
9.本发明提供具有改善稳定性的新型喜树碱药物组合物(例如脂质体伊立 替康),其包括包含含酯磷脂的喜树碱脂质体组合物,其中溶血磷脂(“溶血
‑ꢀ
pl”)(例如溶血磷脂酰胆碱或“溶血-pc”)的形成率降低。本发明部分基于出乎 意料的如下认识:可以制备喜树碱化合物的脂质体组合物(例如伊立替康), 从而在2-8℃的长时间储存之后产生减少量的溶血磷脂。如下出乎意料地发 现使得可以制备这样稳定的脂质体组合物:在脂质体制备过程中控制特定参 数(药物和磷脂相对于捕获剂量的比率、脂质体制剂的ph、和脂质体制剂中 捕获剂抗衡离子的量)协同减少喜树碱脂质体制剂储存期间溶血磷脂的形成。 本发明为设计和识别改善的脂质体组合物提供极其有价值的信息,其较为稳 健同时降低与开发这样的组合物相关的成本。
10.包含一种或多种磷脂(包括含peg的磷脂)的稳定的喜树碱组合物优选 在4℃储存的前6个月期间形成不大于20mol%的溶血-pl(相对于总脂质体 磷脂),和/或在4℃储存的前9个月期间形成不大于25mol%的溶血-pl。稳 定的伊立替康脂质体优选在制备喜树碱组合物之后在4℃储存的前9个月 期间以每月小于约2mol%(例如0.5-1.5mol%)溶血-pl的平均速率形成溶血
‑ꢀ
pl。优选的稳定的喜树碱组合物包括在包含胆固醇和一种或多种磷脂(包括 含peg的磷脂)的脂质体伊立替康组合物中的伊立替康或其盐(例如伊立替 康蔗糖八硫酸酯),所述脂质体伊立替康组合物在4℃储存6个月期间形成 不大于20mol%溶血-pc(相对于总脂质体磷脂)和/或在4℃储存9个月期间 (例如在制备之后的前6和/或9个月的稳定性测试期间)形成不大于25mol% 溶血-pc。稳定的伊立替康脂质体可以在4℃的储存期间(例如在制备之后的 前9个月的稳定性测试期间)以每月小于约2mol%(例如0.5-1.5mol%)的溶 血-pc的速率形成溶血-pc。稳定的包含磷脂酰胆碱的伊立替康脂质体组合 物可以在制备之后在2-8℃的前9个月的稳定性测试期间产生小于1mg溶 血-pc。
11.在第一种实施方式中,稳定的脂质体喜树碱组合物的ph大于6.5(例如 7.0-7.5,包括7.25、7.3或7.5),并且包含包封伊立替康和硫酸酯聚阴离子捕 获剂(例如伊立替康硫糖酯或“sos”)、具有伊立替康/硫酸酯化合物克当量比 (“er”)为大于0.9(例如0.9-1.1)的脂质体。伊立替康sos脂质体制剂的er可 以如下计算:使用式:er=i/(sn),测定脂质体共包封的伊立替康(i)和硫酸 酯化合物(s)的摩尔量每单位(例如1ml)的脂质体组合物,其中n是硫酸酯 化合物阴离子的化合价(例如对于硫糖酯,n为8,和对于游离硫酸根so
42-, n为2)。优选地,硫酸酯化合物(s)为蔗糖八硫酸酯,其含有8个硫酸酯部分 每摩尔sos。
12.在第二种实施方式中,稳定的脂质体喜树碱组合物使用特定比率的喜树 碱、阴离子捕获剂和形成脂质体的磷脂得到,所述组合物具有的稳定性比率 (“sr”)优选大于约950(例如950-1050),包括制备的伊立替康脂质体的sr为 大于约990(例如990-1,100,包括992-1,087)。该实施方式提供由稳定性比率 所反映的预测脂质体稳定性的制备标准,如下面更充分地解释的。本发明的 该实施方式部分基于如下发现:当基于磷脂的包含喜树碱的脂质体通过(1)喜 树碱化合物(例如伊立替康、拓扑替康等)与(2)包封多硫酸酯化阴离子捕获剂 (例如蔗糖八硫酸酯)的脂质体反应制备时,所得载药脂质体的稳定性取决于 捕获剂-脂质体中硫酸酯基团的初始浓度和脂质体中包封的喜树碱与磷脂的 比率。稳定性比率
3-磷酸胆碱(dspc)和甲氧基封端的聚乙二醇-二硬脂酰磷脂酰乙醇胺 (例如mpeg-2000-dspe),包封500mg(
±
10%)伊立替康每mmol总脂质体磷 脂。稳定的脂质体伊立替康组合物优选包含提供总的约4.3mg伊立替康部 分每ml所述脂质体伊立替康组合物的伊立替康脂质体,其中至少约98%的 伊立替康包封在伊立替康脂质体中(例如作为伊立替康蔗糖八硫酸酯,例如 上式(i)的化合物)。某些优选的脂质体组合物为储存稳定的脂质体伊立替康 组合物,所述脂质体伊立替康组合物具有7.00-7.50的ph(例如7.0、7.25、 7.3、7.5)并且包含包封伊立替康蔗糖八硫酸酯的伊立替康脂质体在单室双层 囊泡(unilamellar bilayer vesicles)中的分散体,所述囊泡由胆固醇和磷脂1,2
‑ꢀ
二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)和甲氧基封端的聚乙二醇(mw 2000)
‑ꢀ
二硬脂酰磷脂酰乙醇胺(mpeg-2000-dspe)组成,所述脂质体伊立替康组合 物包含伊立替康部分的浓度等同于,以伊立替康无水游离碱的克数计,500 mg(
±
10%)伊立替康每mmol总脂质体磷脂和4.3mg伊立替康每ml所述脂 质体伊立替康组合物,所述储存稳定的脂质体伊立替康组合物在4℃储存的 前6个月期间稳定化以形成小于1mg/ml的溶血-pc。例如,某些优选的药 物脂质体伊立替康组合物在含水等渗缓冲液中包含4.3mg/ml伊立替康部分 的包封在伊立替康中的伊立替康或其盐(例如伊立替康蔗糖八硫酸酯)、6.81 mg/ml的1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、2.22mg/ml的胆固醇、 和0.12mg/ml的甲氧基封端的聚乙二醇(mw 2000)-二硬脂酰磷脂酰乙醇胺 (mpeg-2000-dspe),所述脂质体组合物在2-8℃储存3个月之后包含小于10mol%的溶血磷脂酰胆碱(溶血-pc),在2-8℃储存6个月(或180天)包含 小于20mol%的溶血磷脂酰胆碱(溶血-pc),和/或在2-8℃储存9个月之后 包含小于25mol%的溶血磷脂酰胆碱(溶血-pc)。
18.在一些实施方式中,脂质体组合物通过方法制备,所述方法包括:在有 效地将500g(
±
10%)的伊立替康部分/mol磷脂加载到包含pl的捕获剂脂质 体中以及允许tea阳离子从捕获剂脂质体释放的条件下,将包含伊立替康 部分的溶液与捕获剂脂质体接触以形成伊立替康sos脂质体,所述捕获剂 脂质体作为tea8sos以浓度为0.4-0.5m(基于硫酸酯基团浓度)包封三乙基 铵(tea)和蔗糖八硫酸酯(sos)捕获剂(优选tea8sos捕获剂溶液),和(b)将 伊立替康sos脂质体与2-[4-(2-羟基乙基)哌嗪-1-基]乙磺酸(hepes)组合以 得到ph为7.25-7.50的伊立替康脂质体组合物,从而得到在4℃储存3个月 期间稳定化以形成小于10mol%的溶血磷脂酰胆碱(溶血-pc)(相对于在伊立 替康脂质体组合物中的磷脂酰胆碱的总量)的伊立替康脂质体组合物。
[0019]
例如,本发明提供伊立替康脂质体组合物,其包含在单室脂质的双层囊 泡中的包封伊立替康蔗糖八硫酸酯(sos)的稳定伊立替康脂质体,所述囊泡 的直径为约110nm,其由1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、胆固醇 和甲氧基封端的聚乙二醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000
‑ꢀ
dspe)组成,其中稳定的伊立替康脂质体通过方法得到,所述方法包括以下 步骤:(a)在有效地将500g(
±
10%)的伊立替康部分/mol磷脂加载到捕获剂脂 质体中以及允许tea阳离子从捕获剂脂质体释放的条件下,将伊立替康与 捕获剂脂质体接触以形成伊立替康sos脂质体,所述捕获剂脂质体作为 tea8sos以浓度为0.4-0.5m(基于硫酸酯基团浓度)包封三乙基铵(tea)阳离 子和蔗糖八硫酸酯(sos)捕获剂,和(b)将伊立替康sos脂质体与2-[4-(2-羟 基乙基)哌嗪-1-基]乙磺酸(hepes)组合,以得到ph为7.25-7.50的伊立替康 脂质体组合物,从而得到在4℃储存3个月期间稳定化以形
成小于10mol% 的溶血磷脂酰胆碱(溶血-pc)(相对于在伊立替康脂质体组合物中的磷脂酰胆 碱的总量)的伊立替康脂质体组合物。
[0020]
脂质体伊立替康组合物可用于治疗诊断患有各种形式癌症的患者。例如, 可施用脂质体伊立替康以治疗小细胞肺癌(sclc),而无需其它抗肿瘤剂。在 一些实施方式中,组合施用脂质体伊立替康组合物和其它抗肿瘤剂。例如, 可施用脂质体伊立替康组合物、5-氟尿嘧啶和甲酰四氢叶酸(无需其它抗肿瘤 剂)以治疗基于吉西他滨的治疗之后疾病进展从而诊断患有转移性胰腺癌的 患者。可施用脂质体伊立替康组合物、5-氟尿嘧啶、甲酰四氢叶酸和奥沙利 铂(无需其它抗肿瘤剂)以治疗诊断为先前未治疗的胰腺癌的患者。可施用脂 质体伊立替康组合物、5-氟尿嘧啶、甲酰四氢叶酸和egfr抑制剂(例如寡克 隆抗体egfr抑制剂,例如mm-151)以治疗诊断患有结肠直肠癌的患者。
[0021]
除非本说明书中另外说明,否则脂质体组合物以一定比率包含相对于磷 脂摩尔数为一定克数的伊立替康(游离碱或盐形式),所述比率等同于由471g 或500g(
±
10%)伊立替康游离碱每摩尔磷脂提供的比率。
[0022]
本技术使用的(和除非另外说明)“伊立替康部分”仅指伊立替康内酯;即, 伊立替康内酯无水游离碱。
[0023]
本技术使用的(和除非另外说明)术语“喜树碱”包括喜树碱和喜树碱衍生 物,其包括伊立替康、拓扑替康、勒托替康、silatecan、etirinotecan pegol、 tas 103、9-氨基喜树碱、7-乙基喜树碱、10-羟基喜树碱、9-硝基喜树碱、 10,11-亚甲基二氧基喜树碱、9-氨基-10,11-亚甲基二氧基喜树碱、9-氯-10,11
‑ꢀ
亚甲基二氧基喜树碱、(7-(4-甲基哌嗪基亚甲基)-10,11-亚乙基二氧基-20(s)
‑ꢀ
喜树碱、7-(4-甲基哌嗪基亚甲基)-10,11-亚甲基二氧基-20(s)-喜树碱和7-(2
‑ꢀ
n-异丙基氨基)乙基)-(20s)-喜树碱及其立体异构体、盐和酯。
[0024]
本技术使用的(和除非另外说明)的“dls”是指动态光散射,“bdp”是指 散装药品。
[0025]
在一些实施方式中,本发明的脂质体包封一种或多种捕获脂质体中的药 物的试剂(下文中称为捕获剂)。
[0026]
本说明书中使用的“缓释组合物”包括伊立替康组合物,其当以每两周一 次对应于70mg/m2伊立替康游离碱的剂量施用于人时提供80至125%的以 下药代动力学参数:cmax 37.2(8.8)μg伊立替康(作为无水游离碱)/ml和 auc
0-∞
1364(1048)h
·
μg伊立替康/ml(对于伊立替康);或(对于sn-38),cmax5.4(3.4)μg sn-38(作为无水游离碱)/ml;auc
0-∞
620(329)h
·
ng sn-38/ml。
[0027]
除非另外指明,否则脂质体制剂可以包含(例如球形或基本上球形)具有 至少一个脂质双层的囊泡,并且可以任选地包括多室和/或单室囊泡,和包封 和/或不包封药物活性化合物(例如喜树碱)和/或捕获剂的囊泡。例如,除非另 外指明,否则包含喜树碱脂质体的药物脂质体制剂可以任选地包括不包含喜 树碱化合物的脂质体,包括单室和多室脂质体的混合物而含有或不含喜树碱 化合物和/或捕获剂。
附图说明
[0028]
图1a显示伊立替康脂质体的示意图,伊立替康脂质体包封包含作为蔗 糖八硫酸酯盐的呈凝胶状态或沉淀状态的伊立替康的含水空间。
[0029]
图1b显示图1a中伊立替康脂质体的赤道横截面。
[0030]
图2a为图表,其显示稳定性比率相对于液体伊立替康脂质体组合物在 4℃储存9个月之后的溶血-pc的相对量(mol%)的关系,脂质体组合物在制 备之后但在储存之前具有指定的ph值。
[0031]
图2b为图表,其显示稳定性比率相对于液体伊立替康脂质体组合物在 4℃储存6个月之后的溶血-pc的相对量(mol%)的关系,脂质体组合物在制 备之后但在储存之前具有指定的ph值。
[0032]
图2c为图表,其显示稳定性比率相对于液体伊立替康脂质体组合物在 4℃储存6个月之后的溶血-pc的相对量(mol%)的关系,脂质体组合物在制 备之后但在储存之前具有指定的ph值。
[0033]
图3a为图表,其显示稳定性比率为1047且ph为6.5的两种伊立替康 脂质体组合物的溶血-pc的相对量(mol%)相对于在4℃储存的月数的关系。
[0034]
图3b为图表,其显示稳定性比率分别为992和942以及在制备之后但 在储存之前的ph为6.5的两种伊立替康脂质体组合物的溶血-pc的相对量 (mol%)相对于在4℃储存的月数的关系。
[0035]
图3c为图表,其显示稳定性比率为785和在制备之后但在储存之前的 ph为6.5的伊立替康脂质体组合物的溶血-pc的相对量(mol%)相对于在4℃ 储存的月数的关系。
[0036]
图3d为图表,其显示稳定性比率为约724、使用硫酸酯基团浓度为0.65 m的tea8sos制备和在制备之后但在储存之前的ph为6.5的两种伊立替 康脂质体组合物的溶血-pc的相对量(mol%)相对于在4℃储存的月数的关 系。
[0037]
图4a为图表,其显示稳定性比率为约1047和在制备之后但在储存之 前的ph为7.25的三种伊立替康脂质体组合物的溶血-pc的相对量(mol%)相 对于在4℃储存的月数的关系。以伊立替康部分的浓度等同于由5mg/ml伊 立替康盐酸盐三水合物提供的浓度制备脂质体样品5(空心正方形),而同样 以20mg/ml伊立替康盐酸盐三水合物制备脂质体样品13(实心三角形)。样 品13中的脂质体以与在样品5中的相同方式制备,但最终脂质体组合物中 每毫升的脂质体组分(即,磷脂、胆固醇、伊立替康和硫糖酯)与样品5相比 增加四倍。
[0038]
图4b为图表,其显示稳定性比率为约1047和在制备之后但在储存之 前的ph值为7.25和7.5的两种伊立替康脂质体组合物的溶血-pc的相对量 (mol%)相对于在4℃储存的月数的关系。
[0039]
图4c为图表,其显示稳定性比率为约785和在制备之后但在储存之前 的ph值为7.25和7.5的两种伊立替康脂质体组合物的溶血-pc的相对量 (mol%)相对于在4℃储存的月数的关系。
[0040]
图5为图表,其显示稳定性比率为1046-1064和在制备之后但在储存之 前的ph值为7.3的三种伊立替康脂质体组合物的溶血-pc浓度(mg/ml)相对 于在4℃储存的月数的关系。
[0041]
图6为图表,其显示稳定性比率为1046-1064和在制备之后但在储存之 前的ph值为7.3的三种伊立替康脂质体组合物的溶血-pc浓度(mg/ml)相对 于在4℃储存的月数的关系。
[0042]
图7为图表,其显示具有不同量的取代铵(质子化tea)的伊立替康脂质 体组合物在4℃的储存期间形成溶血-pc的估计速率(mg/ml/月)。
[0043]
图8为通过在水溶液中以不同比例(即克当量比为1:9至9:1)组合伊立 替康盐酸盐三水合物和三乙基铵硫糖酯形成的沉淀物中伊立替康和硫糖酯 的克当量的图。x轴显示样品中三乙基铵硫糖酯(sos)相比于伊立替康无水游 离碱的克当量的相对克当量总量。
[0044]
图9显示图表,其绘制在4℃储存12-36个月期间12种不同伊立替康 蔗糖八硫酸酯脂质体产品批号的平均粒度,其中对每个样品得到的数据进行 线性回归。
[0045]
图10为图9所示的伊立替康蔗糖八硫酸酯产品批号的粒度多分散性指 数(pdi)的图表,其中对每个样品得到的数据进行线性回归。
[0046]
图11a为在4℃储存12-36个月期间13种不同伊立替康蔗糖八硫酸酯 产品批号的ph的图表,其中对每个样品得到的数据进行线性回归。
[0047]
图11b为在4℃储存12个月期间16种不同伊立替康蔗糖八硫酸酯产 品批号的ph的图表,其中对每个样品得到的数据进行线性回归。
[0048]
图12为在36个月期间两种伊立替康脂质体组合物中的溶血-pc的浓度 (mg/ml)的图表,以及从各伊立替康脂质体样品得到的相应数据点的最佳拟 合线性回归。
[0049]
图13a为在全量程的方法a的代表性色谱图。
[0050]
图13b为在放大比例的方法a的代表性色谱图。
具体实施方式
[0051]
稳定的喜树碱组合物可以包括包封一种或多种喜树碱化合物的脂质体。 脂质体可以用于施用药物,包括化疗药物。本发明提供稳定的包含喜树碱化 合物组合物的磷脂,例如脂质体伊立替康,其产生较少量的溶血磷脂例如溶 血-pc。
[0052]
喜树碱脂质体可以在脂质组合物(例如包含磷脂的囊泡)内部包封喜树 碱和捕获剂。例如,图1a显示描绘直径约110nm并且具有包封伊立替康的 脂质膜的伊立替康脂质体的示意图。该示意图中的脂质膜包含含酯磷脂 mpeg-2000-dspe。mpeg-2000-dspe脂质位于双层膜的内部和外部脂质层 中,因此mpeg-2000-dspe脂质的peg部分分别位于脂质体中或脂质体的 外表面上。图1b显示图1a中一般描述脂质体的特定实施方式的横截面, 其中单层脂质双层膜包括dspc、胆固醇和mpeg-2000-dspe以及包封伊立 替康蔗糖八硫酸酯。
[0053]
现已发现,可以制备新型稳定的包含含酯磷脂的伊立替康脂质体组合物, 所述脂质体组合物在2-8℃例如在4℃长期储存之后具有低水平的溶血-pc, 所述脂质体组合物包括包封伊立替康蔗糖八硫酸酯(sos)的脂质体(伊立替 康-sos脂质体)并且在冷藏储存期间显著降低溶血-pc的形成。本发明部分 基于许多出乎意料的观察。首先,当包封伊立替康的量相对于共包封sos捕 获剂的量增加时,伊立替康-sos脂质体组合物在冷藏储存期间令人惊讶地 具有显著较少的溶血-pc。其次,当包含伊立替康-sos脂质体的含水介质在 制备之后但储存之前的ph大于6.5时,伊立替康-sos脂质体组合物在冷藏 储存期间令人惊讶地具有较少的溶血-pc。第三,当组合物中测定的残留脂 质体捕获剂铵/取代铵阳离子的量低于100ppm时,伊立替康-sos脂质体组 合物令人惊讶地具有较少的溶血-pc。
[0054]
脂质体喜树碱组合物的成分脂质
[0055]
本领域已知各种脂质、特别是磷脂可以是脂质体的成分,例如磷脂酰乙 醇胺和磷
12、优选ph 6.5-8的ph范围内进行大于50%的离 子化,当在含水介质中时,或者可选地,阴离子基团的pka为3或更小、优 选2或更小。在一种优选的实施方式中,捕获剂含有pka为1.0或更小的硫 酸酯部分。在一种非限制性实例中,聚阴离子捕获剂可以具有的电荷密度为 至少两个、三个或四个带负电基团每单位,例如每个在碳链中的环或碳原子 或每个在糖中的单糖单元。
[0065]
在本发明的一些实施方式中,通过使用聚阴离子化糖或聚阴离子化多元 醇与一种或多种其它单价或多价阴离子(例如氯离子、硫酸根、磷酸根等)的 混合物作为捕获剂,可以增加脂质体组合物的释放速率。在增加缓释组合物 释放速率的另一种非限制性实例中,不同聚阴离子化程度(degree ofpolyanionization)的不同聚阴离子化糖和/或聚阴离子化多元醇的混合物用作 捕获剂。
[0066]
在一些实施方式中,本发明脂质体内部的聚阴离子化程度为脂质体中、 例如捕获喜树碱或喜树碱衍生物化合物的脂质体中的总阴离子的大于90%、 或大于99%、或0.1%至99%、10%至90%、或20%至80%。
[0067]
在一些实施方式中,捕获剂为硫酸酯化糖和/或多元醇。本发明的示例性 硫酸酯化糖为硫酸酯化蔗糖,其包括但不限于蔗糖六硫酸酯、蔗糖七硫酸酯 和蔗糖八硫酸酯(参见ochi.k.,et al.,1980,chem.pharm.bull.,v.28,p.638
‑ꢀ
641)。类似地,在碱催化剂存在下与三氯氧化磷或二乙基磷酰氯反应产生多 磷酸酯化多元醇或糖。多磷酸酯化多元醇也是从天然来源分离出来的。例如, 可以从玉米中分离肌醇多磷酸,例如肌醇六磷酸(植酸)。适于实施本发明的 各种硫酸酯化、磺酸酯化和磷酸酯化糖和多元醇公开于例如美国专利号 5,783,568中,将其整体内容并入本技术以作参考。多元醇和/或糖与多于一 个硼酸分子的络合也导致聚阴离子化(多硼酸酯化)产物。在碱存在下多元醇 和/或糖与二硫化碳的反应产生聚阴离子化(聚二硫代碳酸酯化、聚原黄原酸 酯化)衍生物。聚阴离子化的多元醇或糖衍生物可以以游离酸的形式分离并 且用适宜的碱中和,例如用碱金属氢氧化物、氢氧化铵中和,或优选用取代 胺中和,例如对应于本发明取代铵的胺,其为纯净形式或取代氢氧化铵的形 式从而提供本发明取代铵的聚阴离子盐。或者,聚阴离子化多元醇/糖的钠盐、 钾盐、钙盐、钡盐或镁盐可以通过任何已知方法(例如通过离子交换)进行分 离并且转化为适宜的形式,例如取代铵盐形式。硫酸酯化糖捕获剂的非限制 性实例为硫酸酯化蔗糖化合物,其包括但不限于蔗糖六硫酸酯、蔗糖七硫酸 酯和蔗糖八硫酸酯(sos)。示例性多元醇捕获剂包括肌醇多磷酸,例如肌醇 六磷酸(也称为植酸ihp)或其它二糖的硫酸酯化形式。
[0068]
在本发明的一种优选实施方式中,捕获剂为硫酸酯化聚阴离子,其非限 制性实例为蔗糖八硫酸酯(sos)。硫糖酯也称为蔗糖八硫酸酯或蔗糖硫酸酯 钠(sos)。制备各种盐(例如铵盐、钠盐或钾盐)形式的硫糖酯的方法在本领域 是公知的(例如美国专利4,990,610,将其整体内容并入本技术以作参考)。蔗 糖八硫酸酯(也称为硫糖酯)为完全取代的蔗糖硫酸酯,其为完全质子化形式, 具有式(ii)的结构:
[0069][0070]
制备各种盐(例如铵盐、钠盐或钾盐)形式的硫糖酯的方法在本领域是公 知的(参见例如美国专利号4,990,610,将其整体内容并入本技术以供参考)。 同样,预想到其它二糖例如乳糖和麦芽糖的硫酸酯化形式,以产生乳糖八硫 酸酯和麦芽糖八硫酸酯。
[0071]
在一些实施方式中,本发明的脂质体制剂包含喜树碱化合物例如伊立替 康或拓扑替康和阴离子捕获剂例如sos。本发明的脂质体优选包括与阴离子 捕获剂呈化学计量比的喜树碱化合物。例如,伊立替康脂质体制剂可以以约 8:1的摩尔比包封伊立替康和蔗糖八硫酸酯。脂质体的稳定组合物可以包封 式(i)的伊立替康组合物,其中x为约8:
[0072][0073]
脂质体伊立替康可以包含包封在脂质体中的式(i)的组合物。优选地,式 (i)的组合物在包含胆固醇和一种或多种磷脂(例如包括含peg的磷脂)的脂 质体中形成(例如沉淀出)。例如,式(i)的组合物可以在脂质体中如下形成: (1)喜树碱化合物(例如伊立替康、拓扑替康等)与(2)包封多硫酸酯化阴离子捕 获剂(例如蔗糖八硫酸酯)的脂质体反应,在形成稳定的脂质体伊立替康组合 物过程中。优选地,脂质体伊立替康组合物的ph为大于6.5(例如7.0-7.5, 包括7.25、7.3和7.5)。
[0074]
优选的稳定的喜树碱组合物包括脂质体伊立替康。
[0075]
稳定的喜树碱组合物包括以伊立替康部分的浓度等同于由4.5至5.5 mg/ml伊立替康盐酸盐三水合物提供的浓度(即,3.9-4.8mg/ml伊立替康无 水游离碱)包含伊立替康或其盐的高密度喜树碱化合物脂质体制剂,并且包 含dspc的浓度为6.13至7.49mg/ml(优选约6.81mg/ml)、胆固醇的浓度 为2-2.4mg/ml(优选约2.22mg/ml)和mpeg-2000-dspe的浓度为0.11-0.13 mg/ml(优选约0.12mg/ml),其特征在于在冷藏储存期间(2-8℃)存在少量的 溶血-pc(如果有的话),同时也提供适宜量的喜树碱化合物,优选以更有效的 内酯形式提供。本发明包括药物喜树碱化合物脂质体组合物,其可以在制备 之后在冷藏下(即,在2-8℃)储存至少前6个月,优选至少前9个月,而不形 成大于20mol%水平的溶血-pc。更优选
地,本发明提供组合物,其包含伊立 替康部分的量等同于由4.7-5.3mg/ml伊立替康盐酸盐三水合物(即,4.1-4.6 mg伊立替康部分的无水游离碱)提供的量(伊立替康可以作为包封在脂质体 中的蔗糖八硫酸酯存在),以及包含6.4-7.2mg/ml的(dspc)、2.09-2.35mg/ml 的胆固醇和约0.113-0.127mg/ml的mpeg-2000-dspe,其当在2-8℃储存 6或9个月时含有不大于20mol%溶血-pc,或当在2-8℃储存21个月时含 有不大于2mg/ml的溶血-pc。
[0076]
计算伊立替康/硫酸酯化合物的克当量比(er)
[0077]
各伊立替康脂质体制剂的伊立替康/硫酸酯化合物克当量比(er)可以如 下进行计算:使用式:er=i/(sn),测定脂质体共包封的伊立替康(i)和硫酸 酯化合物(s)的摩尔量每单位(例如1ml)的脂质体组合物,其中n是硫酸酯 化合物阴离子的化合价(例如对于硫糖酯,n为8,和对于游离硫酸根so4
2-, n为2)。例如,包含7.38mm伊立替康和1.01mm硫糖酯(n=8)的脂质体伊 立替康硫糖酯组合物将具有er为7.38/(1.01
×
8)=0.913。优选地,硫酸酯化 合物(s)为蔗糖八硫酸酯,其含有8个硫酸酯部分每摩尔sos。脂质体组合物 将具有ph为7.1至7.5并且具有以下的er范围之一:优选0.85至1.2、 0.85-1.1,或最优选0.9至1.05,例如约1.02。或者,脂质体组合物将具有伊 立替康部分的量等同于由500g(
±
10%)伊立替康无水游离碱每摩尔磷脂提供 的量并且具有以下的er范围之一:优选0.85至1.1,最优选0.9至1.05,例 如约1.02。
[0078]
稳定的喜树碱组合物的ph
[0079]
脂质体组合物的ph可以调节或以其它方式选择以提供所需的储存稳定 性性质(例如通过在4℃储存180天期间减少脂质体中溶血-pc的形成),例 如通过在约6.5-8.0或其间任何适宜的ph值(包括例如7.0-8.0和7.25)制备组 合物。在一些实施方式中,ph为约6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、 7.3、7.4、7.5、7.6、7.7、7.8、7.9或8.0。制备伊立替康脂质体,其具有特定 的ph值,伊立替康部分等同于由伊立替康无水游离碱浓度(mg/ml)和各种 浓度的蔗糖八硫酸酯提供的那种,如本技术描述的更详细内容提供的。更优 选地,在制备之后和储存之前的ph为7.1至7.5,甚至更优选为约7.2至7.3 之间,最优选约7.25。ph可以通过标准方法调节,例如适当使用1n hcl或 1n naoh。
[0080]
在本发明的一些实施方式中,脂质体伊立替康制剂在制备之后但储存之 前的ph大于6.5,优选为7.2至7.3。在本发明的一些实施方式中,ph为7.2 至7.5。
[0081]
稳定的喜树碱组合物的化合物克当量比(“er”)
[0082]
稳定的脂质体喜树碱组合物可以具有的ph为大于6.5并且包含包封伊 立替康和硫酸盐聚阴离子捕获剂、具有伊立替康/硫酸酯化合物克当量比 (“er”)为大于0.9(例如0.9-1.1)的脂质体。伊立替康sos脂质体制剂的er可 以如下计算:使用式:er=i/(sn),测定脂质体共包封的伊立替康(i)和硫酸 酯化合物(s)的摩尔量每单位(例如1ml)的脂质体组合物,其中n是硫酸酯 化合物阴离子的化合价(例如对于硫糖酯,n为8,和对于游离硫酸根so
42-, n为2),i为脂质体伊立替康组合物中包封的伊立替康的浓度,s为脂质体 伊立替康组合物中包封的蔗糖八硫酸酯的硫酸酯基团浓度。优选地,硫酸酯 化合物(s)为蔗糖八硫酸酯,其含有8个硫酸酯部分每摩尔sos。
[0083]
虽然优选直接测定脂质体伊立替康组合物中包封蔗糖八硫酸酯的硫酸 酯基团浓度(s
·
n),但s
·
n可以由如下测定:脂质体磷脂浓度(p,mol/l),脂 质体的内部空间中的sos硫酸酯基团浓度(用于制备捕获剂脂质体的溶液中 的sos硫酸酯基团浓度;参数b,参见
本技术中的稳定性比率定义),和脂 质体内部(截留)体积,即在脂质体囊泡的内部空间内隔离的体积,每单位脂 质体磷脂(ve,l/mol磷脂):
[0084]s·
n=p
·
ve
·b[0085]
举例来说,对于通过100-nm聚碳酸酯过滤器挤出得到的磷脂酰胆碱-胆 固醇脂质体,其截留体积可以接近于1.7l/mol磷脂(mui,et al.1993,biophys.j., vol 65,p.443-453)。在这种情况下,伊立替康(分子量586.7)定量加载到 471g/mol磷脂和sos硫酸酯基团浓度为0.45m的包封sos的脂质体中,将 得到er为:
[0086]
(471/586.7)/(1.7
·
0.45)=1.049
[0087]
在sos浓度为0.65m硫酸酯基团时,er将为:
[0088]
(471/586.7)/(1.7
·
0.65)=0.726
[0089]
类似地,伊立替康(分子量586.7)定量加载到500g(
±
10%)/mol磷脂和 sos硫酸酯基团浓度为0.45m的包封sos的脂质体中,将得到er为约 1.11,在sos浓度为0.65m硫酸酯基团时,er将为约0.77。
[0090]
制备稳定的喜树碱组合物
[0091]
稳定的喜树碱组合物可以包含喜树碱脂质体。脂质体已用于施用药物, 包括化疗药物。涉及包封药物的脂质体的各种技术及其制备方法在本领域中 通常是已知的,因此在本技术不作任何进一步详述。参见例如美国专利号 8,147,867,将其整体内容并入本技术以作参考。
[0092]
在一些实施方式中,囊泡内包封一种或多种喜树碱化合物的脂质体包含 至少一种磷脂。喜树碱化合物可以在多步骤方法中加载或以其它方式截留在 脂质体中,所述方法包括(a)形成在包含磷脂的脂质体囊泡内包封阴离子捕 获剂和阳离子的捕获剂脂质体,和(b)随后在有效地将喜树碱化合物加载到 捕获剂脂质体中以及用捕获剂将喜树碱化合物保留在脂质体中的条件下,使 捕获剂脂质体与喜树碱化合物接触,以形成喜树碱脂质体。
[0093]
喜树碱化合物可利用脂质体膜上的梯度加载到捕获剂脂质体中,使喜树 碱化合物进入捕获剂脂质体中以形成喜树碱脂质体。优选地,捕获剂脂质体 具有跨膜浓度梯度的跨膜阳离子例如铵或取代铵,当加热到高于脂质体脂质 成分的相变温度时,喜树碱化合物可有效地导致交换捕获剂脂质体中的铵盐 /取代铵盐。优选地,捕获剂在捕获剂脂质体中的浓度高于其在捕获剂脂质体 周围的介质内的浓度。此外,除铵/取代铵阳离子产生的梯度之外,捕获剂脂 质体还可以包含一个或多个跨膜梯度。例如,捕获剂脂质体组合物中包含的 脂质体可以另外或可选地包括跨膜ph梯度、离子梯度、电化学电位梯度和 /或溶解度梯度。
[0094]
在一些实施方式中,用于制备脂质体的捕获剂(例如sos和/或另一硫酸 酯化多元醇捕获剂,包括其可接受的盐)的硫酸酯基团浓度为0.3-08、0.4-.05、 0.45-0.5、0.45-.0475、0.45-0.5、0.3、0.4、0.45、0.475、0.5、0.6、0.7或0.8 m,例如这些特定值的
±
10%。在一种优选的实施方式中,用于制备脂质体的 捕获剂为sos和硫酸酯基团的浓度为约0.45m或约0.475m。在一种更优 选的实施方式中,用于制备脂质体的捕获剂为sos和硫酸酯基团的浓度为0.45m或0.475m。
[0095]
优选地,如下将喜树碱化合物加载到捕获剂脂质体中:在适宜温度,例 如在加载期间高于组分磷脂最初相变温度的温度,同时在加载喜树碱化合物 之后降低到低于组分
磷脂的最初相变温度、优选在约室温,将喜树碱化合物 在含水介质中用捕获剂脂质体培育。培育时间通常基于组分脂质的性质、待 加载到脂质体中的喜树碱化合物和培育温度。通常,几分钟(例如30-60分钟) 到几个小时的培育时间为充分的。
[0096]
由于实现高的截留效率为大于85%、典型地大于90%,因此通常不需要 除去非截留的实体。然而,如果有这样的需要,则可以通过各种方法从组合 物中除去非截留的喜树碱化合物,例如尺寸排阻色谱法、透析、超滤、吸附 和沉淀。
[0097]
在一些实施方式中,喜树碱脂质体为伊立替康脂质体。伊立替康脂质体 可以通过方法制备,所述方法包括以下步骤:(a)制备包含三乙胺(tea)的脂 质体作为硫糖酯的三乙基铵盐(tea-sos),和(b)随后在有效地将伊立替康 进入脂质体并且允许相应量的tea离开脂质体(从而耗尽或降低所得脂质体 上的tea浓度梯度)的条件下,使tea-sos脂质体与伊立替康接触。
[0098]
喜树碱脂质体载药期间脂质体外的离子强度
[0099]
在本发明的一些实施方式中,脂质体的喜树碱加载在离子强度小于等同 于50mm nacl或更优选地小于等同于30mm nacl的水溶液中进行。载药之 后,可加入较浓的盐溶液例如nacl溶液,以将离子强度提高至高于等同于 50mm nacl的离子强度,或更优选地,高于等同于100mm nacl、优选等同 于约140-160mm nacl的离子强度。
[0100]
捕获剂阳离子
[0101]
当加热到高于如上所述脂质组分的相变温度时,本发明的阳离子可以以 提供将喜树碱化合物加载到捕获剂脂质体中的有效量而包封到捕获剂脂质 体中。选择阳离子使得在将喜树碱化合物加载到脂质体的过程中阳离子可以 离开捕获剂脂质体。在制备加载有喜树碱化合物的脂质体之后,可以除去脂 质体外的阳离子。
[0102]
在本发明的一些实施方式中,脂质体中的阳离子与捕获剂一起为取代铵 化合物。在本发明的一些实施方式中,取代铵化合物的pka为至少约8.0。 在本发明的一些实施方式中,取代铵化合物的pka为至少约8.0、至少约8.5、 至少约9.0、至少9.5、至少10.0、至少10.5或至少11.0,如在环境温度在水 溶液中测定的。在本发明的一些实施方式中,取代铵化合物的pka为约8.0
‑ꢀ
12.0、约8.5.-11.5或约9.0-11。在一种优选的实施方式中,pka约为tea的 pka,或约为dea的pka。
[0103]
这样取代铵化合物的非限制性实例为下式的化合物:n(r1)(r2)(r3)(r4)
, 其中r1、r2、r3和r4各自独立地为氢或具有至多18个总碳原子的有机基 团,其中r1、r2、r3和r4中至少之一为具有至多8个碳原子的烃基的有机 基团,其可以为烷基、亚烷基、杂环烷基、环烷基、芳基、烯基或环烯基或 其羟基取代的衍生物,其烃部分任选地包括一个或多个s、o或n原子从而 形成醚、酯、硫醚、胺或酰胺键。取代铵可以是位阻铵化合物(例如具有至少 一个直接连接至铵氮原子的具有仲或叔碳原子的有机基团)。此外,r1、r2、 r3和r4中至少之一必须为氢。优选地,取代铵阳离子为三乙基铵(质子化 tea)或二乙基铵(质子化dea)。
[0104]
当喜树碱化合物加载到包封阴离子捕获剂的脂质体中时,在有效形成喜 树碱化合物脂质体的条件下,可以减少捕获剂脂质体中取代铵阳离子的浓度。 本发明的脂质体可以包括阴离子捕获剂和铵或取代铵阳离子,其随后被除去 和/或由在随后的载药步骤中加载到脂质体中的喜树碱化合物替代。
[0105]
在一种优选的实施方式中,喜树碱化合物脂质体中铵或取代铵阳离子的 浓度低
sn-甘 油-3-磷酸胆碱(dspc)、胆固醇和甲氧基封端的聚乙二醇(mw 2000)-二硬脂 酰磷脂酰乙醇胺(mpeg-2000-dspe)的脂质混合物,以产生tea-sos捕获剂 脂质体。除去未包封在tea-sos捕获剂脂质体中的(tea)8sos之后,在如 下条件下使用伊立替康溶液将伊立替康加载到所得包含tea-sos捕获剂脂 质体的制剂中:导致除去tea和加载到脂质体中由500g(
±
10%)伊立替康无 水游离碱每摩尔在tea-sos捕获剂脂质体制剂中的磷脂提供总量的伊立替 康。伊立替康脂质体组合物的ph为6.5(根据本技术实施例部分的“ph测量
”ꢀ
小节进行测量),其中4.3mg伊立替康部分在伊立替康脂质体中每ml伊立 替康脂质体组合物。这些包含磷脂酰胆碱的脂质体伊立替康组合物在3个月 冷藏储存(2-8℃)期间产生溶血-pc的水平超过30mol%(相对于在伊立替康 脂质体组合物中的磷脂酰胆碱的总量)(和在9个月期间产生大于35mol%溶 血-pc)。
[0117]
计算示例性实施方式中稳定性比率和溶血-pc的量
[0118]
根据本技术中描述的方法制备一系列不同的伊立替康脂质体制剂(每个 样品的制备和表征的附加实验细节包括在以下实施例中)。伊立替康脂质体 制剂各自测定的溶血-pc的量总结于表1a(冷藏储存9个月之后进行的溶血
ꢀ‑
pc测定)和表1b(冷藏储存6个月之后进行的溶血-pc测定,对于表1a中 所列样品的子集)中。各伊立替康脂质体制剂包含直径为约110
±
20nm、优选 110
±
10nm的单室双层脂质体,其用蔗糖八硫酸酯捕获剂包封伊立替康。脂 质体由具有3:2:0.015摩尔比的dspc、胆固醇和mpeg-2000-dspe的混合 物形成和然后加载有伊立替康的浓度为约471g伊立替康部分(伊立替康或 其盐提供伊立替康部分的量等同于500g(
±
10%)的无水伊立替康hcl)每摩尔 磷脂。各伊立替康脂质体制剂包含不同量的sos捕获剂并且在不同的ph值 配制。在不同时间测量各伊立替康脂质体制剂中溶血-pc的量,包括测量在 连续冷藏储存(在4℃)9个月之后的所有样品。表1a中的所有样品都使用对 于sos的质子化tea抗衡离子进行加载(即,将伊立替康加载到包封各种浓 度tea8sos的脂质体中,如表1a所示)。
[0119]
表1a:伊立替康脂质体稳定性比率和溶血-pc(在4℃的9个月之后)a[0120][0121]a根据方法b测量,如本技术描述的。
[0122]
图2a显示描绘在4℃储存9个月之后表1a的各样品中测量溶血-pc 的量的图。样品12在表1a和图2a中标记为参比。稳定性比率大于约900 和ph大于6.5(例如7.25和7.5)的两种样品在4℃冷藏储存9个月之后都包 含小于20mol%溶血-pc。图2c为稳定性比率随着液体伊立替康脂质体组合 物在4℃储存6个月之后的溶血-pc的相对量(mol%)变化而变化的图(表6 中的数据)。用空心圆圈表示的数据点对应于在制备之后但储存之前测量的 ph大于6.5(7.25或7.5)的伊立替康样品。菱形表示的数据点对应于在制备之 后但储存之前测量的ph值为6.5的伊立替康样品。在制备各样品的过程中, 稳定性比率如本技术定义的那样进行计算。在制备各样品之后储存的前6个 月之后测量mol%溶血-pc。
[0123]
表1b:伊立替康脂质体稳定性比率和溶血-pc(在4℃ 6个月之后)b[0124][0125]b根据方法b测量,如本技术描述的。
[0126]
图2b显示描绘在4℃储存6个月之后表1b的各样品中测量溶血-pcc 的量的图。稳定性比率大于约989和ph大于6.5(例如7.25和7.5)的两种样 品在4℃冷藏储存6个月之后都包含小于20mol%溶血-pc。
[0127]
图3a-3d为显示选自表1a和1b、ph为6.5的伊立替康脂质体制剂中 mol%溶血-pc的图。各样品在4℃储存0、1、3、6、9和/或12个月之后测 定溶血-pc。这些图包括对于数据的线性回归线,作为评估各样品中溶血
‑ꢀ
pc(mol%)随着时间推移的增长率。各图的斜率、y截距和r2值的总结显示 于下表1c中。
[0128]
表1c:在ph 6.5随着冷藏储存时间(月数)变化而变化的mol%溶血-pc
[0129][0130]
在一些实施方式中,在稳定性比率大于942的伊立替康脂质体中,在直 径为约100nm(例如100
±
20nm)的脂质体中包封的包含伊立替康sos的伊 立替康脂质体制剂的稳定性显著增加。通过维持500g(
±
10%)伊立替康部分 (如上解释的,基于无水游离碱)相对于总的磷脂的载药比不变,但改变sos 捕获剂的浓度,评价稳定性比率对于脂质体制剂中溶血-pc的形成的作用。 表2提供表1中伊立替康脂质体制剂中检测到的mol%溶血-pc的量的总结, 所述伊立替康脂质体制剂在与(对比)样品12(6.5)相同的ph但在不同浓度的 sos捕获剂(即,在不同的稳定性比率)配制。表2说明对于包含sos捕获剂 和伊立替康的伊立替康脂质体,其具有稳定性比率为大于942,会减少在冷 藏储存期间溶血-pc的形成。相对于参比伊立替康脂质体制剂,将sos捕获 剂的量减少至多30%(即,增加稳定性比率),导致在9个月冷藏储存之后的 溶血-pc量稍微增加约1%。但是,增加在伊立替康脂质体制剂中sos捕获 剂的量从而稳定性比率大于942,导致在4℃冷藏储存9个月之后的溶血
‑ꢀ
pc存在量(mol%)显著地并且出乎意料地下降。例如,与样品3相比,随后 稳定性比率递增5%从而稳定性比率大于942(即,样品2的稳定性比率为 992)导致溶血-pc的存在量(mol%)惊人地减少34%,等同于与样品12相比, 溶血-pc的量(mol%)减少33%(如在4℃冷藏储存9个月测量的)。总体而 言,在4℃冷藏储存9个月之后,与参比样品12相比,通过提高伊立替康 脂质体的稳定性比率从而稳定性比率大于942,实现溶血-pc(mol%)减少约 28-51%。在一些实施方式中,伊立替康sos脂质体组合物的稳定性比率为 大于942。在优选的实施方式中,伊立替康sos脂质体制剂的稳定性比率为 942-1130或更大(例如稳定性比率为992-1047)。
[0131]
表2:伊立替康脂质体的稳定性比率和溶血-pc(在4℃、ph 6.5的9个 月之后)
[0132][0133]
表2说明稳定性比率为大于942(优选大于950,最优选大于992)在稳定 ph为6.5、包含sos捕获剂和伊立替康的伊立替康脂质体以减少在冷藏储 存期间脂质体中溶血-pc的形成的临界性。总体而言,通过制备伊立替康脂 质体组合物从而ph为6和稳定性比率大于950(例如950-1050),实现在4℃ 储存6个月期间脂质体中的溶血-pc减少约28-51%。相对于用于制备参比伊 立替康脂质体制剂(对比样品3和12)的相应sos捕获剂浓度,用于制备捕 获剂脂质体的sos捕获剂浓度减少(即,增加稳定性比率)至多30%,导致在 冷藏储存9个月之后溶血-pc的量稍微增加约1%。但是,在加载伊立替康 以形成稳定性比率为992或更高的伊立替康脂质体制剂之前,增加用于形成 捕获剂脂质体的sos捕获剂的量,导致在制备之后在所得伊立替康脂质体 冷藏储存的前9个月之后溶血-pc形成显著地和出乎意料地下降。例如,表 2数据显示,稳定性比率增加5%从而稳定性比率大于942导致在4℃储存 9个月之后溶血pc减少34%(样品2相比于样品3)。稳定性比率从992(样品 2)增至1047(sr增加6%)导致在4℃储存9个月之后产生的溶血-pc减少 26%(样品6相比于样品2),和在4℃储存9个月之后产生的溶血-pc增加8%(样品1相比于样品2)。因此,优选稳定性比率大于1000的伊立替康sos 脂质体组合物,包括稳定性比率为1000-1200或更大(例如稳定性比率为 1053-111)的伊立替康sos脂质体制剂。
[0134]
在本发明的一些实施方式中,通过升高在制备之后但储存之前制剂的 ph从而使ph大于6.5,直径为约100
±
20nm、优选100
±
10nm的脂质体中 包封的包含伊立替康sos的伊立替康脂质体制剂稳定性显著增加。通过维 持471g或500g伊立替康部分(如上解释的,基于无水游离碱)每摩尔磷脂的 载药比不变但改变伊立替康脂质体组合物最终ph的ph,评价ph对于脂质 体制剂中溶血-pc形成的作用。表3提供在不同ph值配制的表1中伊立替 康脂质体制剂中溶血-pc的量的总结。表3a报告关于伊立替康脂质体制剂 的来自表1的数据,所述伊立替康脂质体制剂通过使脂质体(包封tea8sos 硫酸酯基团的浓度为0.6m)加载有总的471g伊立替康部分(如上解释的,基 于无水游离碱)每摩尔磷脂(即,稳定性比率为471/0.6或785)而形成。计算关 于样品4和样品9两者(两者在制备之后但储存之前的ph都为6.5)的溶血
‑ꢀ
pc形成的%变化。表3b报告关于伊立替康脂质体制剂的来自表1的数据, 所
journal of pharmacy和pharmacology (1993)v 45,is 6,pp 490-495)。
[0140]
图4a-4c描绘显示各样品在4℃储存0、1、3、6和/或9个月之后,选 自表1a和1b的ph为7.25或7.5的伊立替康脂质体制剂中测量的mol%溶 血-pc的图。这些图包括对于各样品中随着时间推移的溶血-pc增长率的线 性回归线。对于各图的斜率、y截距和r2值的总结显示于下表4中。在稳定 性比率大于942(例如1047)和ph为7.25或7.5的伊立替康脂质体制剂样品 中观察到较低量的溶血-pc(例如在ph 7.25将图4a和4c中的样品5、7和 13与样品10比较,或在ph 7.5将图4b中的样品8与图4c中的样品11比 较)。此外,在9个月之后在稳定性比率低于942的伊立替康脂质体制剂中 测量到较多的溶血-pc(例如样品10和11中为785,两者在6个月之后具有 大于20mol%的溶血-pc,甚至在ph为大于6.5)。
[0141]
表4:在ph》6.5随着冷藏储存时间(月数)变化而变化的mol%溶血-pc
[0142][0143]
表5:在sr》942在冷藏储存6和9个月之后的mol%溶血-pc
[0144]
含小于约2mg/ml(或小于约30mol%)溶血-pc。
[0156]
缓释组合物可以包含脂质体。脂质体通常包含含有一个或多个包封含水 内部的脂质双层的囊泡。脂质体组合物通常包括介质(例如脂质体外部的含 水流体)中的脂质体。脂质体脂质可以包括两亲性脂质组分,其在与含水介质 接触之后自发形成双层膜,如磷脂,例如磷脂酰胆碱。脂质体也可以包括膜 硬化组分,如固醇,例如胆固醇。在一些情况下,脂质体也包括与亲水性聚 合物缀合的脂质,例如聚乙二醇(peg)液体衍生物,其可以减少脂质体聚集 的倾向性,并且还具有其它有益效果。一种这样的peg-脂质为n-(甲氧基
‑ꢀ
peg)-氧基羰基-二硬脂酰基-磷脂酰乙醇胺,其中peg部分的分子量为约 2000,或mpeg-2000-dspe。脂质体通常具有微米或亚微米范围的尺寸,并 且因它们携带药物物质(包括抗癌药物,例如伊立替康)的能力和以各种有益 方式改变它们的药物性质而予以广泛认可。制备和表征药物脂质体组合物的 方法在本领域中是已知的(参见,例如lasic d.liposomes:from physics toapplications,elsevier,amsterdam 1993;g.gregoriadis(ed.),liposometechnology,3
rd edition,vol.1-3,crc press,boca raton,2006;hong等人,美 国专利8,147,867,出于所有目的将它们的整体内容并入本技术中以作参考)。
[0157]
在一些实施方式中,脂质体根据本技术中的一个或多个实施例或其它实 施方式中所述进行制备,但最终脂质体组合物的浓度增加使得制剂包含伊立 替康部分的浓度等同于伊立替康盐酸盐三水合物的浓度为约10、15、20、25、 30、35、40、45或50mg/ml。在一些实施方式中,伊立替康部分的浓度等 同于5-10、10-20、20-30、30-40或40-50mg/ml的伊立替康盐酸盐三水合 物。在一些实施方式中,本节提及的脂质体组合物用于治疗哺乳动物的脑肿 瘤或任何其它病症,如美国专利号8,658,203所述,将其整体内容并入本申 请以作参考。
[0158]
包封伊立替康的脂质体制剂可以为包含脂质体的可注射制剂(包括可以 在施用于患者之前随后用药用稀释剂稀释的可注射制剂)。在一些实施方式 中,将一定量的伊立替康或其盐加入到包含一种或多种捕获剂的脂质体中, 其中伊立替康存在伊立替康部分的浓度等同于,以伊立替康无水游离碱的克 数计,200g、300g、400g、500g、600g或700g每摩尔磷脂。在一些实施 方式中,伊立替康在载药过程中存在伊立替康部分的浓度等同于,以伊立替 康无水游离碱的克数计,200至300g、400至550g、450至600g,或600至 700g每摩尔磷脂。优选地,约500g(
±
10%)部分加载到伊立替康脂质体每摩 尔脂质体磷脂中,包括471g伊立替康部分每摩尔总的伊立替康脂质体磷脂。 本技术中具体的实例包括测量包含471g伊立替康部分每摩尔总脂质体磷脂 的稳定的伊立替康脂质体,以及测量包含500g伊立替康部分每摩尔总脂质 体磷脂的伊立替康脂质体。
[0159]
在一些实施方式中,等同于由脂质体制剂中伊立替康无水游离碱提供的 浓度的伊立替康部分的浓度为约2.5、约3.0、约3.5、约4.0、约4.3、约4.5、 约5.0、约5.5或约6.0mg/ml。在一些实施方式中,等同于由脂质体制剂中 伊立替康无水游离碱提供的浓度的伊立替康部分的浓度为2.5-3.5、3.5-4.5、 4.5-5.5或5.5-6.5mg/ml。最优选其为4.5-5.5mg/ml。在优选的实施方式中, 脂质体制剂中伊立替康部分的浓度为约4.3mg/ml伊立替康无水游离碱每 ml,在一种更优选的实施方式中,其为4.3mg/ml伊立替康无水游离碱每 ml。脂质体制剂可以为在体积为约10ml的脂质体制剂中包含约43mg伊 立替康无水游离碱
的小瓶,其可以随后稀释(例如稀释成500ml的药用稀释 剂),然后静脉内施用于患者。
[0160]
因此,本发明的一些实施方式提供制备伊立替康脂质体制剂的方法,所 述伊立替康脂质体制剂包含在单层脂质的双层囊泡中的包封伊立替康蔗糖 八硫酸酯(sos)的稳定伊立替康脂质体,所述双层囊泡由1,2-二硬脂酰-sn-甘 油-3-磷酸胆碱(dspc)、胆固醇和甲氧基封端的聚乙二醇(mw 2000)-二硬脂 酰磷脂酰乙醇胺(mpeg-2000-dspe)组成,所述方法包括以下步骤:(a)在有 效将500g(
±
10%)伊立替康部分每摩尔磷脂加载到捕获剂脂质体中的条件下, 将包含伊立替康的溶液与以硫酸酯浓度为0.4-0.5m(由tea8sos提供)包封 三乙基铵(tea)阳离子和蔗糖八硫酸酯(sos)捕获剂而不含伊立替康的捕获 剂脂质体接触,以形成伊立替康sos脂质体,和(b)将伊立替康sos脂质 体与2-[4-(2-羟基乙基)哌嗪-1-基]乙磺酸(hepes)组合以得到ph为7.25-7.50 的伊立替康脂质体制剂,从而得到在4℃储存3个月期间稳定化以形成小于 10mol%的溶血磷脂酰胆碱(溶血-pc)(相对于伊立替康脂质体中磷脂酰胆碱 的总量)的伊立替康脂质体制剂。
[0161]
储存稳定的伊立替康脂质体可以在多步骤中制备,其包括形成包含tea 的脂质体,然后当tea离开脂质体时将伊立替康加载到脂质体中。第一步 骤可以包括通过在tea硫糖酯溶液中水合和分散脂质体脂质形成包含tea
‑ꢀ
硫糖酯的脂质体。这可以例如如下进行:将包括dspc和胆固醇的脂质溶解 在加热的乙醇中,并且在大于脂质体脂质的转变温度(tm)的温度例如60℃ 或更大将溶解和加热的脂质溶液分散在tea-硫糖酯水溶液中。脂质分散体 可以如下形成平均尺寸为75-125nm(例如80-120nm,或在一些实施方式中, 90-115nm)的脂质体:挤出穿过具有限定孔径例如100nm的行迹蚀刻的聚碳 酸酯膜。tea-硫糖酯可以包括相对于每摩尔当量硫糖酯为至少8摩尔当量 的tea,以得到可以具有硫酸酯浓度为约0.40-0.50m和如下ph(例如约6.5) 的溶液:所述ph选择为在分散和挤出步骤期间防止脂质体磷脂不可接受的 降解(例如ph选择为在这些步骤期间使脂质体磷脂降解最小化)。然后,在 伊立替康包封之前,非截留tea-sos可以从脂质体分散体例如通过渗析、 凝胶色谱、离子交换或超滤除去。这些脂质体可以通过将足够的伊立替康加 载到脂质体中以减少所得脂质体组合物中tea的量至如下水平来稳定:所 述水平导致小于在4℃或更常见地在5
±
3℃ 180天之后例如以mg/ml/月 计测量的溶血-pc形成的给定最大水平,或单位时间内pc转化成溶血-pc的 百分比,例如mol%溶血-pc/月。接下来,在加载过程中从脂质体交换到外部 介质中的tea连同任何未截留的伊立替康通常通过任何适宜已知方法(例如 通过凝胶色谱、渗析、渗滤、离子交换或超滤)从脂质体中除去。脂质体外部 介质可以交换为在期望的ph缓冲的可注射等渗流体(例如等渗氯化钠溶液)。
[0162]
在一些实施方式中,当tea的量为小于约25ppm或小于约20ppm时, 可以得到在4℃ 180天之后包含约3.9-4.7mg/ml的伊立替康和小于20%溶 血-pc的伊立替康脂质体组合物。升高在脂质体外部的伊立替康脂质体组合 物的ph也可以储存稳定包含大于25ppm tea的伊立替康硫糖酯脂质体, 导致伊立替康脂质体在4℃ 180天之后形成小于20%的另外的溶血-pc。例 如,在脂质体外部包含约4-5mg伊立替康/ml和100ppm tea和ph为约7-8的伊立替康脂质体组合物也可以在4℃ 180天之后形成小于20%的溶血
ꢀ‑
pc。在另一实施例中,脂质体组合物包含约3.9-4.7mg/ml伊立替康和外部 介质的脂质体的ph为7-8,其中残留tea的量小于约25ppm(或优选地, 小于20ppm),在4℃、180天内在脂质体组合物内积聚的溶血-pc的量可以 为10mol%或更少。
[0163]
本发明因此提供伊立替康脂质体组合物,其包含在溶血-pc稳定性比率 为至少990(例如990-1100或约1111)的磷脂脂质体中包封的伊立替康硫糖酯。
[0164]
本发明也提供伊立替康脂质体组合物,所述组合物包含等同于由伊立替 康无水游离碱提供的4.3mg/ml(
±
10%)部分和0.4-0.5m浓度的在囊泡中包 封的硫酸酯,所述囊泡包含3:2摩尔比的dspc和胆固醇,和比率为400-600 g伊立替康/mol在囊泡中的磷脂。
[0165]
本发明也提供伊立替康脂质体组合物,其总的包含约4.3mg伊立替康 部分/ml,其中至少98%伊立替康与蔗糖八硫酸酯(sos)以约8:1的伊立替 康:sos摩尔比包封在脂质体组合物内,脂质体的平均尺寸为75-125nm。稳 定的高密度伊立替康脂质体的尺寸优选为约110nm(
±
20nm),更优选110 nm(
±
10nm)(在脂质体载药之后测量)。优选地,药物组合物中至少约95%的 伊立替康包封在脂质体中。脂质体优选包含3:2摩尔比的dspc和胆固醇。
[0166]
本发明也可以提供制备药物的方法,所述药物包含在单室脂质的双层囊 泡中的包封伊立替康蔗糖八硫酸酯(sos)的稳定伊立替康脂质体,所述囊泡 由1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、胆固醇和甲氧基封端的聚乙二 醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000-dspe)组成,所述方法包 括以下步骤:(a)在有效将伊立替康部分加载到捕获剂脂质体中以及允许tea 阳离子从捕获剂脂质体释放的条件下,将伊立替康与捕获剂脂质体接触,所 述捕获剂脂质体作为tea8sos以硫酸酯浓度为0.4-0.5m包封三乙基铵(tea) 阳离子和蔗糖八硫酸酯(sos)捕获剂而不含伊立替康,以形成伊立替康sos 脂质体,(b)将伊立替康sos脂质体与2-[4-(2-羟基乙基)哌嗪-1-基]乙磺酸 (hepes)组合以得到ph为7.25-7.50的伊立替康脂质体制剂,从而得到在4℃ 储存3个月期间稳定化以形成小于10mol%的溶血磷脂酰胆碱(溶血-pc)(相 对于伊立替康脂质体中磷脂酰胆碱的总量)的伊立替康脂质体制剂,和(c)配 制伊立替康sos脂质体和hepes的组合作为药物。
[0167]
在这些方法的一些实施方式中,伊立替康脂质体制剂中的伊立替康sos 脂质体总的包含小于100ppm tea。在一些实施方式中,单层脂质的双层囊 泡由6.81mg/ml 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、2.22mg/ml的胆 固醇、和0.12mg/ml的甲氧基封端的聚乙二醇(mw 2000)-二硬脂酰磷脂酰 乙醇胺(mpeg-2000-dspe)组成。在一些实施方式中,伊立替康脂质体制剂 总的包含500g(
±
10%)伊立替康每摩尔总的稳定的伊立替康脂质体磷脂,伊 立替康脂质体制剂中至少98%的伊立替康包封在伊立替康脂质体中。在一些 实施方式中,伊立替康脂质体制剂进一步包含4.05mg/ml 2-[4-(2-羟基乙基) 哌嗪-1-基]乙磺酸(hepes)。在一些实施方式中,伊立替康脂质体制剂进一步 包含8.42mg/ml氯化钠。在一些实施方式中,伊立替康脂质体制剂具有伊 立替康部分的浓度等同于由约4.3mg/ml伊立替康无水游离碱提供的浓度。 在一些实施方式中,稳定的伊立替康脂质体包封式(i)的化合物中的伊立替康 和sos,其中x=8。
[0168]
在一些实施方式中,组合物在2-8℃储存3个月之后包含小于2mol% 溶血-pc。在一些实施方式中,组合物在2-8℃储存3个月之后包含小于5 mol%溶血-pc。在一些实施方式中,脂质体组合物在2-8℃储存6个月之后 包含小于10mol%溶血-pc。在一些实施方式中,组合物在2-8℃储存9个 月之后包含小于10mol%溶血-pc。在一些实施方式中,组合物在2-8℃储 存6个月之后包含小于5mol%溶血-pc。在一些实施方式中,组合物在2-8℃ 储存9个月之后包含小于5mol%溶血-pc。在一些实施方式中,组合物在2
‑ꢀ
8℃储存6个月之后包含小于2mol%溶血-pc。在一些实施方式中,组合物 在2-8℃储存9个月之后包含小于
2mol%溶血-pc。在一些实施方式中,组 合物在2-8℃储存12个月之后包含小于10mol%溶血-pc。在一些实施方式 中,组合物在2-8℃储存12个月之后包含小于5mol%溶血-pc。在一些实 施方式中,组合物在2-8℃储存12个月之后包含小于2mol%溶血-pc。在 一些实施方式中,组合物在2-8℃储存24个月之后包含小于10mol%溶血
‑ꢀ
pc。在一些实施方式中,组合物在2-8℃储存24个月之后包含小于5mol% 溶血-pc。在一些实施方式中,组合物在2-8℃储存24个月之后包含小于2 mol%溶血-pc。在一些实施方式中,组合物包含小于100ppm取代铵。在一 些实施方式中,组合物包含20至80ppm取代铵化合物,其为质子化的tea 或dea。
[0169]
在其它实施方式中,作为用于喜树碱组合物制剂的包含一个或多个组分 小瓶的试剂盒,提供稳定的喜树碱组合物。例如,用于脂质体伊立替康制剂 的试剂盒可以包括以下(储存在单独的容器中或同一容器的单独部分):
[0170]
●
伊立替康溶液(例如注射用伊立替康hcl);
[0171]
●
包封捕获剂的脂质体(例如由蔗糖八硫酸酯溶液形成的捕获剂脂质 体);和
[0172]
●
用于将伊立替康溶液和捕获剂脂质体组合以形成脂质体伊立替康组 合物的说明书,所述脂质体伊立替康组合物包含治疗有效量的在脂质体伊立 替康脂质体中包封的伊立替康(例如500g(
±
10%)伊立替康每摩尔总的在捕获 剂脂质体中的磷脂和4.3mg总的伊立替康每ml脂质体伊立替康组合物)。
[0173]
喜树碱组合物的治疗用途
[0174]
喜树碱组合物(包括本发明在此公开的伊立替康脂质体和其它组合物和 制剂)可以用于治疗和治疗方法,和/或用于制备治疗疾病例如癌症的药剂。 在一些实施方式中,治疗包括施用用于治疗癌症的喜树碱组合物。例如,癌 症选自由以下组成的组:基底细胞癌、髓母细胞瘤、肝细胞癌、横纹肌肉瘤、 肺癌、骨肿瘤、胰腺癌、皮肤癌、头颈部癌、皮肤或眼内的黑色素瘤、子宫 癌、卵巢癌、直肠癌、肛门癌、胃癌、结肠癌、乳癌、子宫癌、输卵管癌、 子宫内膜癌、宫颈癌、阴道癌,外阴癌、霍奇金病、食管癌、小肠癌、内分 泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎 癌、前列腺癌、慢性或急性白血病、淋巴细胞性淋巴瘤、膀胱癌、肾或输尿 管癌、肾癌、肾盂癌、中枢神经系统肿瘤、原发性中枢神经系统淋巴瘤、脊 柱轴肿瘤、脑干胶质瘤和垂体腺瘤、或一种或多种这些癌症的组合。在一些 实施方式中,癌症为胰腺癌,任选地胰腺腺癌,例如转移性胰腺癌,例如基 于吉西他滨的治疗之后已经发生疾病进展的症状。在一些实施方式中,癌症 为卵巢癌。在一些实施方式中,癌症为小细胞肺癌。在一些实施方式中,癌 症为胆道癌。
[0175]
当用作治疗时,脂质体组合物可以与一种或多种其它化合物或组合物用 于治疗方案。施用脂质体组合物与一种或多种其它化合物或组合物可以为同 时的、单独的或按顺序的。一种或多种其它化合物或组合物可以为另外的治 疗剂,例如另外的抗癌剂,或可以为设计为改善治疗剂的负面副作用的化合 物。在一些实施方式中,脂质体组合物与甲酰四氢叶酸一起施用。在一些实 施方式中,脂质体组合物与5-氟尿嘧啶(5-fu)一起施用。在一些实施方式中, 脂质体组合物与甲酰四氢叶酸和5-氟尿嘧啶(5-fu)一起施用。该三联疗法可 以用于治疗胰腺癌,如前述段落中讨论的。5-fu可施用的剂量为2400mg/m2, 甲酰四氢叶酸可施用的剂量为200mg/m2(l式)或400mg/m2(l d消旋式)。 在一些实施方式中,组合物也在吉西他滨的治疗方案中施用。
[0176]
在一些实施方式中,在脂质体组合物用于治疗卵巢癌的情况下,脂质体 组合物与
parp(多腺苷二磷酸-核糖聚合酶)抑制剂一起施用。
[0177]
在一些实施方式中,缓释基质可以为配置为保留捕获剂的纳米颗粒(例 如二氧化硅或聚合物)或聚合物聚集体(例如peg聚合物)。载药期间,基质 可以在有效保留喜树碱化合物和捕获剂两者的条件下与喜树碱化合物接触, 形成稳定的缓释制剂。
[0178]
在一些实施方式中,稳定的喜树碱组合物为伊立替康sos脂质体制剂, 其配制用于在对流增强递送治疗期间脑实质内施用至患者。等同于由最终脂 质体制剂中伊立替康无水游离碱提供的浓度的伊立替康部分的浓度为约17、 约20、约25、约30、约35或约40mg/ml。在一些实施方式中,等同于由 最终脂质体制剂中伊立替康无水游离碱提供的浓度的伊立替康部分的浓度 为17-20、17-25、17-30、17-35或17-40mg/ml。最优选地,等同于由伊立 替康脂质体制剂中伊立替康无水游离碱(例如伊立替康蔗糖八硫酸酯)提供的 浓度的伊立替康部分的总浓度为17mg/ml或35mg/ml。脂质体制剂可以在 以如下伊立替康部分的浓度将伊立替康蔗糖八硫酸酯脂质体包封于脂质体 制剂中的无菌容器中,所述伊立替康部分的浓度等同于由约17mg/ml或约 35mg/ml或17-35mg/ml伊立替康无水游离碱提供的浓度,用于局部施用至 患者(例如进入诊断患有胶质瘤的患者脑中,进入脑内的一部位作为对流增 强递送治疗的一部分)。17-35mg/ml浓度的伊立替康脂质体可以等同地表示 为在20-40mg of伊立替康盐酸盐三水合物每ml伊立替康脂质体制剂中存 在伊立替康无水游离碱的量。例如,脂质体伊立替康制剂可以如下剂量施用 至患者脑中(例如经由手术置于一肿瘤内位置的一个或多个导管):提供总的 伊立替康部分等同于由17mg、26mg、52mg或70mg总的伊立替康无水游 离碱提供的那种。在约2-4小时(例如2-3小时、3-4小时或2-4小时)的时间 内,伊立替康脂质体制剂递送到患者脑内的肿瘤内位置的伊立替康总体积可 以为约1-2ml(例如1.0、1.5或2.0ml)。
[0179]
伊立替康脂质体优选包含包封在由脂质形成的囊泡内的伊立替康硫糖 酯,所述脂质包含3:2摩尔比的dspc和胆固醇。囊泡可以也包含聚乙二醇 (peg)衍生的磷脂,例如mpeg-2000-dspe。mpeg-2000-dspe的量可以为 小于1mol%的脂质体脂质(例如约0.3mol%在由3:2:0.015摩尔比的dspc、 胆固醇和mpeg-2000-dspe组成的囊泡中)。peg可以分配在包封伊立替康 的脂质体脂质囊泡的内部和外部两者上。包封的伊立替康优选为蔗糖硫酸酯 (硫糖酯)、例如伊立替康硫糖酯(cas登记号1361317-83-0)的盐形式。优选 地,伊立替康脂质体组合物中至少95%和最优选至少约98%的伊立替康包封 在脂质体囊泡中,其中伊立替康部分的总浓度为约3.87-4.73mg伊立替康(无 水游离碱)每ml伊立替康脂质体组合物。伊立替康脂质体组合物在脂质体外 部的ph优选为约6.5-8.0,或约6.6-8.0、6.7-8.0、6.8-8.0、6.9-8.0或7.0-8.0, 优选为约7.2-7.6。在一些实施方式中,ph为约7.2-7.5。在一些实施方式中, ph为约7.25。在其它实施方式中,ph为约7.25-7.5。在其它实施方式中, ph为约7.4-7.5。
[0180]
组合的实施方式
[0181]
本技术进行编号的实施方式的特征可以与本技术公开的其它实施方式 的特征组合,包括涉及组合物的实施方式和涉及制剂的实施方式。
[0182]
上述方法具有与本说明书其它地方所述组合物和制剂的实施方式相同 的特征,因为它们涉及这些组合物和制剂的制备。关于组合物和制剂公开的 特征也可以与前述段落中公开的方法组合。因此,前述小节的特征以及本申 请其它地方例如下面编号的实施方
式部分,可以与本小节各段落的方法中公 开的特征进行组合。
[0183]
例如,以下为本技术公开和/或示例的各种实施方式组合的实施例:
[0184]
●
伊立替康脂质体组合物在4℃ 180天储存之后包含约3.9-4.7mg/ml 的伊立替康部分和小于20%溶血-pc。
[0185]
●
包含在磷脂脂质体中包封的伊立替康硫糖酯的伊立替康脂质体组合 物的溶血-pc稳定性比率为至少990(例如990-1100或约1111)。
[0186]
●
伊立替康脂质体组合物,所述组合物包含4.3mg/ml(
±
10%)伊立替康 部分和0.4-0.5m浓度的在囊泡中包封的硫酸酯,所述囊泡包含3:2摩尔比 的dspc和胆固醇,和比率为450-550g伊立替康/mol总的在囊泡中的磷脂。
[0187]
●
伊立替康脂质体组合物,其总的包含约4.3mg伊立替康部分/ml,其 中至少98%伊立替康与蔗糖八硫酸酯(sos)以约8:1的伊立替康:sos摩尔比 包封在脂质体组合物内,脂质体的平均尺寸为75-125nm。
[0188]
●
前述实施方式任一项的组合物,其中伊立替康脂质体通过方法得到, 所述方法包括以下步骤:将伊立替康与包封在磷脂脂质体内的三乙基铵(tea) 硫糖酯接触。
[0189]
●
前述实施方式的组合物,其中tea-sos的浓度为约0.40-0.50m。
[0190]
●
前述实施方式任一项的组合物,其中脂质体的尺寸为约110 nm(
±
10%)。
[0191]
●
前述实施方式任一项的组合物,其包含约433g伊立替康部分/mol磷 脂。
[0192]
●
前述实施方式任一项的组合物,其中伊立替康脂质体组合物包含小于 约100ppm的三乙胺。
[0193]
●
前述实施方式任一项的组合物,其中伊立替康脂质体组合物为脂质体 在液体中的溶液,其中伊立替康脂质体外部液体的ph为约7.0-8.0,例如 7.25-7.5,例如7.25,任选地其中伊立替康脂质体外部的液体为药用可注射流 体。
[0194]
●
前述实施方式任一项的组合物,其包含伊立替康部分的量等同于由 4.5-5.5mg/ml伊立替康盐酸盐三水合物提供的量。
[0195]
●
前述实施方式任一项的组合物,其中伊立替康脂质体组合物中至少约 95%的伊立替康包封在脂质体中。
[0196]
●
前述实施方式任一项的组合物,其中脂质体包含3:2摩尔比的dspc 和胆固醇,例如其中脂质体包含摩尔比为3:2:0.015的dspc、胆固醇和 mpeg(2000)-dspe。
[0197]
●
前述实施方式任一项的组合物,稳定性比率为990-1200。
[0198]
●
前述实施方式任一项的组合物具有脂质体包封的伊立替康/硫糖酯的 克当量比为至少0.9、至少0.95、至少0.98、至少0.99或基本1.0。
[0199]
●
前述实施方式任一项的组合物,其中在约4℃储存180天之后脂质 体磷脂包含不大于20mol%溶血-pc。
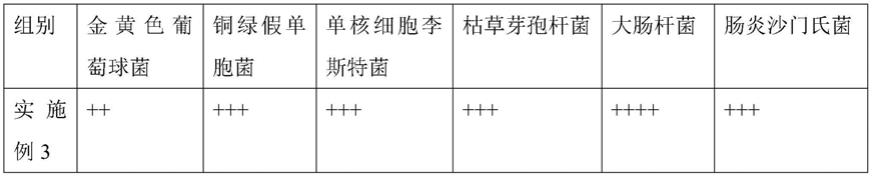
[0200]
●
前述实施方式任一项的组合物,其中伊立替康脂质体组合物进一步包 含伊立替康脂质体外部的ph为约7.0-8.0的药用可注射流体,包含4.3mg/ml 伊立替康(计算为游离碱),所述伊立替康脂质体组合物任选地通过方法得到, 所述方法包括以下步骤:将伊立替康与包封在磷脂脂质体中的三乙基铵(tea) 硫糖酯接触,所述磷脂脂质体任选地具有包封的tea硫糖酯的浓度为约 0.40-0.50n。
[0201]
●
前述实施方式任一项的组合物,其中组合物包含约433g伊立替康部 分/mol磷
脂,和不大于约100ppm的包封在磷脂脂质体中的三乙基铵。
[0202]
●
前述实施方式任一项的组合物,其具有包封的伊立替康/硫糖酯的克 当量比为至少0.9。
[0203]
●
前述实施方式任一项的组合物,其中至少90%,例如至少92%、至少 95%、至少96%、至少97%、至少98%或至少99%(换言之,基本全部)包封 的伊立替康硫糖酯为沉淀或凝胶形式的化学计量盐,其包含八分子伊立替康 每分子硫糖酯。
[0204]
●
前述实施方式任一项的组合物,其中至少98%、例如至少99%的包 封的伊立替康硫糖酯为沉淀或凝胶形式的化学计量盐,其包含八分子伊立替 康每分子硫糖酯。
[0205]
●
前述实施方式任一项的伊立替康脂质体组合物,其具有不大于约100 ppm的三乙基铵(tea)。
[0206]
●
前述实施方式任一项的伊立替康脂质体组合物,其具有不大于约20 ppm的三乙基铵(tea)。
[0207]
●
前述实施方式任一项的伊立替康脂质体组合物,其具有总体积为约 10ml。
[0208]
●
前述实施方式任一项的伊立替康脂质体组合物,其包含6.81mg/ml 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、2.22mg/ml胆固醇和0.12mg/ml 甲氧基封端的聚乙二醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000
‑ꢀ
dspe)。
[0209]
●
前述实施方式任一项的伊立替康脂质体组合物,其在伊立替康脂质体 内部和外部两者均包含聚乙二醇。
[0210]
●
配制用于施用至患者的稳定的可注射单位剂量伊立替康脂质体组合 物,组合物包含伊立替康的剂量足以递送70mg伊立替康每m2患者体表面 积,其中:
[0211]
○
至少99%伊立替康包封在包含磷脂和胆固醇的囊泡中,其中至多20 mol%磷脂为溶血-pc,其余为dspc,其中囊泡在ph为7.0-8.0的可 注射流体中;或
[0212]
○
可注射单位剂量脂质体组合物为单位剂量的上述实施方式任一项的 脂质体组合物。
[0213]
●
可注射伊立替康脂质体单位剂型,其包含:
[0214]
○
在包含磷脂的脂质体中包封的单位剂型中至少约98%的伊立替康, 所述磷脂包含不大于约20mol%溶血-pc;和
[0215]
○
根据上述实施方式任一项的脂质体组合物。
[0216]
●
上述实施方式中公开的单位剂型,其中伊立替康包封在由脂质膜包围 的囊泡中,所述脂质膜基本由1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、胆 固醇和甲氧基封端的聚乙二醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg
‑ꢀ
2000-dspe)组成。
[0217]
●
实施方式29或30的单位剂型,其中单位剂型包含至少约6.81mg/ml 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、约2.22mg/ml胆固醇和约0.12 mg/ml甲氧基封端的聚乙二醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg
‑ꢀ
2000-dspe)l。
[0218]
●
实施方式29-31任一项的单位剂型,其中单位剂型进一步包含作为缓 冲剂的2-[4-(2-羟基乙基)哌嗪-1-基]乙磺酸(hepes)和作为等渗剂的氯化钠。
[0219]
●
根据实施方式1-27任一项的脂质体组合物,或根据实施方式29-32 任一项的单位剂量,其用于治疗。
[0220]
●
本技术实施方式中公开的脂质体组合物或单位剂量,其用于治疗癌症。
[0221]
●
本技术实施方式公开使用的脂质体组合物或单位剂量,其中所述癌症 选自由以下组成的组:基底细胞癌、成神经管细胞瘤癌、肝癌、横纹肌肉瘤、 肺癌、骨癌、胰腺癌、皮肤癌、头或颈部癌、皮肤或眼内的黑色素瘤、子宫 癌、卵巢癌、直肠癌、肛门区域的癌症、胃癌、结肠癌、乳腺癌、子宫癌、 输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、食道癌、 小肠癌、内分泌系统癌症、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、 尿道癌、阴茎癌、前列腺癌、慢性或急性白血病、淋巴细胞性淋巴瘤、膀胱 癌、肾或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统肿瘤、原发性中枢神 经系统淋巴瘤、脊柱轴肿瘤、脑干胶质瘤和垂体腺瘤,或这些癌症中的一种 或多种的组合。
[0222]
●
根据上述实施方式任一项的脂质体组合物或单位剂量,其中癌症为胰 腺癌,任选地胰腺腺癌,例如转移性胰腺癌,例如其中基于吉西他滨的治疗 之后已经发生疾病进展的症状。
[0223]
●
根据上述实施方式任一项的脂质体组合物或单位剂量,其中癌症为结 肠癌。
[0224]
●
根据上述实施方式任一项的脂质体组合物或单位剂量,其中脂质体组 合物或单位剂量用于与甲酰四氢叶酸和/或5-氟尿嘧啶一起使用,任选地其 中脂质体组合物或单位剂量、甲酰四氢叶酸和/或5-氟尿嘧啶的施用为同时 的、单独的或按顺序的。
[0225]
●
根据上述实施方式任一项的脂质体组合物或单位剂量,其中脂质体以 提供等同于80mg/m2伊立替康盐酸盐三水合物的量的伊立替康的剂量施用。
[0226]
●
在有此需要的患者中治疗在基于吉西他滨的治疗之后疾病进展之后 的转移性胰腺癌的方法,所述方法包括向患者静脉内施用本技术任一项实施 方式的可注射伊立替康脂质体单位剂型或根据上述实施方式任一项的单位 剂量,其在单位剂型中包含至少约98%伊立替康,所述单位剂型包封在包含 含磷脂的脂质体中,包含小于约20%溶血-pc的量从而提供等同于80mg/m2伊立替康盐酸盐三水合物的量的伊立替康。
[0227]
●
储存稳定的脂质体伊立替康组合物,其具有7.00-7.50的ph并且包 含包封伊立替康蔗糖八硫酸酯的伊立替康脂质体在单室双层囊泡中的分散 体,所述囊泡由胆固醇和磷脂1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)和甲 氧基封端的聚乙二醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000-dspe) 组成,所述脂质体伊立替康组合物包含伊立替康部分的浓度等同于,以伊立 替康无水游离碱的克数计,500mg伊立替康每mmol总脂质体磷脂和4.3mg 伊立替康每ml所述脂质体伊立替康组合物,所述储存稳定的脂质体伊立替 康组合物在4℃储存6个月期间稳定化以形成小于1mg/ml溶血-pc。
[0228]
●
上述实施方式的脂质体伊立替康组合物,其通过包括以下步骤的方法 制备:
[0229]
(a)形成脂质在溶液中的分散体,所述溶液由硫酸酯浓度为0.4至0.5m 的dea8sos制备和ph为5至7,所述分散体中的脂质分别为约3:2:0.015 摩尔比的dspc、胆固醇和mpeg-2000-dspe;
[0230]
(b)将60-70℃的脂质分散体挤出穿过至少一个0.1μm膜以形成脂质 体;
[0231]
(c)基本上除去在所述脂质体外部的源自dea8sos和/或dea8sos的 离子;
[0232]
(d)将在60-70℃温度的脂质体与使用伊立替康游离碱或伊立替康盐制 备的溶液接触,由此形成包封伊立替康的脂质体的制剂;
[0233]
(e)基本上除去在所述脂质体外部的源自tea8sos和/或dea8sos和 依立替康成分的物质;和
[0234]
(f)将所述组合物的ph调节为7.0-7.5。
[0235]
●
上述实施方式任一项的脂质体伊立替康组合物,其中所述脂质分散体 挤出穿过至少两个叠放的0.1μm的聚碳酸酯膜。
[0236]
●
上述实施方式任一项的脂质体伊立替康组合物,其中所述脂质体的平 均尺寸为110nm,平均尺寸通过动态光散射确定,其中尺寸通过累积量方法 确定。
[0237]
●
上述实施方式任一项的脂质体伊立替康组合物,其具有的总伊立替康 部分含量等同于4.3mg/ml伊立替康无水游离碱。
[0238]
●
上述实施方式任一项的脂质体伊立替康组合物,其中:
[0239]
在步骤(a)中,所述脂质体由硫酸酯浓度为0.43-0.47m的dea8sos形 成;和
[0240]
在步骤(d)中,使用伊立替康游离碱或伊立替康盐制备的溶液具有的伊立 替康部分含量等同于500g(
±
10%)伊立替康无水游离碱每摩尔dspc;和
[0241]
在步骤(f)中,将所述组合物的ph调节为7.2至7.3。
[0242]
●
前述实施方式任一项的脂质体组合物,其在约4℃储存之前含有小 于1mol%的溶血磷脂酰胆碱(溶血-pc),其在约4℃储存180天之后含有20 mol%或更少(相对于总脂质体磷脂)的溶血-pc。
[0243]
●
上述实施方式任一项的脂质体组合物,其在约4℃储存6、9或12个 月之后含有20mol%或更少(相对于总脂质体磷脂)的溶血磷脂酰胆碱(溶血
‑ꢀ
pc)。
[0244]
●
上述实施方式任一项的脂质体伊立替康组合物,其总的包含6.1至7.5 mg dspc/ml、2至2.4mg胆固醇/ml和0.11至0.13mg mpeg-2000-dspe/ml, 全部都在含水等渗缓冲液中。
[0245]
●
上述实施方式任一项的脂质体伊立替康组合物,其中所述脂质体伊立 替康包含浓度为2至20mm的在等渗hepes含水缓冲液中的伊立替康脂质 体。
[0246]
●
上述实施方式任一项的脂质体伊立替康组合物,其进一步包含浓度为 130-160mm的氯化钠。
[0247]
●
上述实施方式任一项的脂质体伊立替康组合物,其中包封在所述脂质 体中的所述伊立替康作为蔗糖八硫酸酯盐呈凝胶状态或沉淀状态。
[0248]
●
上述实施方式任一项的脂质体伊立替康组合物,其中所述伊立替康脂 质体的直径为95-115nm,其通过准弹性光散射测量。
[0249]
●
上述实施方式任一项的脂质体伊立替康组合物,其总的包含6.81mgdspc/ml、2.22mg胆固醇/ml、和0.12mg mpeg-2000-dspe/ml、4.05mg/mlhepes含水缓冲液和8.42mg氯化钠/ml。
[0250]
●
上述实施方式任一项的脂质体伊立替康组合物,其具有的ph为7.25, 其中所述伊立替康脂质体的直径为110nm,其通过准弹性光散射测量。
[0251]
●
上述实施方式任一项的脂质体伊立替康组合物,其在约4℃储存6个 月之后形成小于1mg/ml的溶血磷脂酰胆碱(溶血-pc)。
[0252]
●
上述实施方式任一项的脂质体伊立替康组合物,其通过包括以下步骤 的方法制备:
[0253]
(a)形成脂质在硫酸酯浓度为约0.45m的dea8sos溶液中的分散体, 所述溶液的ph为约6.5,所述分散体中的脂质分别由摩尔比为3:2:0.015的 1,2-二硬脂酰-sn-甘油-3-磷
酸胆碱(dspc)、胆固醇和甲氧基封端的聚乙二醇 (mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000-dspe)组成;
[0254]
(b)将60-70℃的脂质分散体挤出穿过至少一个0.1μm膜以形成脂质 体;
[0255]
(c)除去在所述脂质体外部的源自dea8sos的离子;
[0256]
(d)将在60-70℃温度的脂质体与使用伊立替康盐酸盐三水合物制备的 溶液接触,以形成包封约500g(
±
10%)伊立替康每摩尔总脂质体磷脂的脂质 体制剂;
[0257]
(e)除去在所述脂质体外部的源自tea8sos和依立替康成分的物质;和
[0258]
(f)将所述组合物的ph调节为约7.3。
[0259]
●
上述实施方式任一项的脂质体伊立替康组合物,其总的包含小于100 ppm的dea。
[0260]
●
上述实施方式任一项的脂质体伊立替康组合物,其总的包含小于100 ppm的dea。
[0261]
●
上述实施方式任一项的脂质体伊立替康组合物,其中在约4℃储存6 个月之后,至少98%的伊立替康包封在所述伊立替康脂质体中。
[0262]
●
伊立替康脂质体制剂,其包含在单层脂质的双层囊泡中的包封伊立替 康蔗糖八硫酸酯(sos)的稳定伊立替康脂质体,所述囊泡的直径为约110nm, 由1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、胆固醇和甲氧基封端的聚乙二 醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000-dspe)组成,其中稳定的 伊立替康脂质体通过方法得到,所述方法包括以下步骤:
[0263]
(a)在有效将500g(
±
10%)伊立替康部分每摩尔总脂质体磷脂加载到捕 获剂脂质体中以及允许从捕获剂脂质体释放dea阳离子的条件下,将伊立 替康与捕获剂脂质体接触,所述捕获剂脂质体作为tea8sos以浓度为0.4
‑ꢀ
0.5m(基于硫酸酯基团浓度)包封二乙基铵(dea)阳离子和蔗糖八硫酸酯 (sos)捕获剂而不含伊立替康,以形成伊立替康sos脂质体,和
[0264]
(b)将伊立替康sos脂质体与2-[4-(2-羟基乙基)哌嗪-1-基]乙磺酸 (hepes)组合,以得到ph为7.25-7.50的伊立替康脂质体制剂,从而得到在 4℃储存3个月期间稳定化以形成小于10mol%的溶血磷脂酰胆碱(溶血
‑ꢀ
pc)(相对于伊立替康脂质体中磷脂酰胆碱的总量)的伊立替康脂质体制剂。
[0265]
●
上述实施方式任一项的伊立替康脂质体制剂,其中伊立替康脂质体制 剂中的伊立替康sos脂质体总的包含小于100ppm tea。
[0266]
●
上述实施方式任一项的伊立替康脂质体制剂,其中单室脂质的双层囊 泡由6.81mg/ml 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、2.22mg/ml的胆 固醇、和0.12mg/ml的甲氧基封端的聚乙二醇(mw 2000)-二硬脂酰磷脂酰 乙醇胺(mpeg-2000-dspe)组成。
[0267]
●
上述实施方式任一项的伊立替康脂质体制剂,其总的包含500mg伊 立替康每摩尔总的稳定的伊立替康脂质体磷脂,伊立替康脂质体制剂中至少 98%的伊立替康包封在伊立替康脂质体中.
[0268]
●
上述实施方式任一项的伊立替康脂质体制剂,其中伊立替康脂质体制 剂在ph为约7.25-7.50进一步包含约4.05mg/ml 2-[4-(2-羟基乙基)哌嗪-1
‑ꢀ
基]乙磺酸(hepes)。
[0269]
●
上述实施方式任一项的伊立替康脂质体制剂,其中伊立替康脂质体制 剂进一
步包含约8.42mg/ml氯化钠。
[0270]
●
上述实施方式任一项的伊立替康脂质体制剂,其具有总的约4.3mg 伊立替康每ml伊立替康脂质体制剂。
[0271]
●
前述实施方式任一项的组合物,其中伊立替康脂质体通过方法得到, 所述方法包括以下步骤:将伊立替康与包封在磷脂脂质体中的铵接触。
[0272]
●
伊立替康脂质体制剂,其包含在单层脂质的双层囊泡中的包封伊立替 康蔗糖八硫酸酯(sos)的稳定伊立替康脂质体,所述囊泡的直径为约110nm, 由1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、胆固醇和甲氧基封端的聚乙二 醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000-dspe)组成,其中稳定的 伊立替康脂质体通过方法得到,所述方法包括以下步骤:
[0273]
(a)在有效将500g(
±
10%)伊立替康部分每摩尔总脂质体磷脂加载到捕 获剂脂质体中以及允许从捕获剂脂质体释放铵阳离子的条件下,将伊立替康 与包封铵阳离子和蔗糖八硫酸酯(sos)捕获剂的捕获剂脂质体接触,以形成 伊立替康sos脂质体,和
[0274]
(b)将伊立替康sos脂质体与2-[4-(2-羟基乙基)哌嗪-1-基]乙磺酸 (hepes)组合,以得到ph为7.25-7.50的伊立替康脂质体制剂,从而得到在 4℃储存3个月期间稳定化以形成小于10mol%的溶血磷脂酰胆碱(溶血
‑ꢀ
pc)(相对于伊立替康脂质体中磷脂酰胆碱的总量)的伊立替康脂质体制剂。
[0275]
●
sn38脂质体制剂,其包含在脂质体中包含伊立替康和/或sn-38的稳 定脂质体,脂质体包含1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、胆固醇和 甲氧基封端的聚乙二醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000
‑ꢀ
dspe),所述脂质体制剂在4℃储存3个月期间稳定化以形成小于10mol% 的溶血磷脂酰胆碱(溶血-pc)(关于磷脂酰胆碱在脂质体中的总量)。
[0276]
●
上述实施方式任一项的伊立替康脂质体制剂,其中稳定的伊立替康脂 质体在式(i)的组合物中包封30-100ppm tea或dea、伊立替康和sos,其 中x为8。
[0277][0278]
在一种实施方式中,本技术公开的伊立替康脂质体组合物为包含伊立替 康硫糖酯的稳定的伊立替康脂质体组合物,所述伊立替康硫糖酯包封在溶血
ꢀ‑
pc稳定性比率为至少990(例如990-1100或约1111)的磷脂脂质体中,其中 脂质体组合物包括以下特征中的至少之一:
[0279]
(i)脂质体的尺寸为约110nm(
±
10%),
[0280]
(ii)组合物包含约433g或至少约433g伊立替康部分/mol磷脂,
[0281]
(iii)组合物包含小于约100ppm的三乙胺,
[0282]
(iv)组合物包含在伊立替康脂质体外部ph为约7.25的药用可注射流 体,
[0283]
(v)脂质体包含3:2摩尔比的dspc和胆固醇,
[0284]
(vi)组合物脂质体包封伊立替康/硫糖酯的克当量比为至少0.9、至少 0.95、至少0.98或基本1.0;和
[0285]
(vii)至少90%、例如至少92%、至少95%、至少96%、至少97%、至 少98%或至少99%(换言之,基本全部)包封的伊立替康硫糖酯为沉淀或凝胶 形式的化学计量盐,其包含八分子伊立替康每分子硫糖酯。
[0286]
在一种实施方式中,本技术公开的伊立替康脂质体组合物为包含伊立替 康硫糖酯稳定的伊立替康脂质体组合物,所述伊立替康硫糖酯包封在溶血
‑ꢀ
pc稳定性比率为至少990(例如990-1100或约1111)的磷脂脂质体中,其中:
[0287]
(i)脂质体的尺寸为约110nm(
±
10%),
[0288]
(ii)组合物包含约433g或至少约433g伊立替康部分/mol磷脂,
[0289]
(iii)组合物包含小于约100ppm的三乙胺,
[0290]
(iv)组合物包含在伊立替康脂质体外部ph为约7.25的药用可注射流 体,
[0291]
(v)脂质体包含3:2摩尔比的dspc和胆固醇,
[0292]
(vi)组合物脂质体包封伊立替康/硫糖酯的克当量比为至少0.9、至少 0.95、至少0.98或基本1.0;和
[0293]
(vii)至少90%、例如至少92%、至少95%、至少96%、至少97%、至 少98%或至少99%(换言之,基本全部)包封的伊立替康硫糖酯为沉淀或凝胶 形式的化学计量盐,其包含八分子伊立替康每分子硫糖酯。
[0294]
实施方式1:储存稳定的脂质体伊立替康组合物,其具有7.00-7.50的 ph并且包含包封伊立替康蔗糖八硫酸酯的伊立替康脂质体在囊泡中的分散 体,所述囊泡由胆固醇和磷脂1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)和甲 氧基封端的聚乙二醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000-dspe) 组成,所述脂质体伊立替康组合物包含伊立替康部分的浓度等同于,以伊立 替康游离无水碱的克数计,500mg(
±
10%)伊立替康部分每mmol总脂质体磷 脂和4.3mg伊立替康部分每ml所述脂质体伊立替康组合物,所述储存稳定 的脂质体伊立替康组合物在4℃储存的前6个月期间稳定化以形成小于20 mol%溶血-pc。
[0295]
实施方式2:储存稳定的脂质体伊立替康组合物,其具有7.00-7.50的 ph并且包含包封伊立替康蔗糖八硫酸酯的伊立替康脂质体在单室双层囊泡 中的分散体,所述囊泡由胆固醇和磷脂1,2-二硬脂酰-sn-甘油-3-磷酸胆碱 (dspc)和甲氧基封端的聚乙二醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg
‑ꢀ
2000-dspe)组成,所述脂质体伊立替康组合物包含伊立替康部分的浓度等同 于,以伊立替康游离无水碱的克数计,500mg(
±
10%)伊立替康部分每mmol 总脂质体磷脂和4.3mg伊立替康部分每ml所述脂质体伊立替康组合物,所 述储存稳定的脂质体伊立替康组合物具有的伊立替康/硫酸酯化合物克当量 比为0.85-1.2。
[0296]
实施方式3:储存稳定的脂质体伊立替康组合物在4℃储存的前6个月 期间稳定化以形成小于20mol%溶血-pc,脂质体伊立替康组合物通过方法 制备,所述方法包括以下步骤:
[0297]
(a)形成脂质在由硫酸酯浓度为0.4至0.5m的tea8sos和/或dea8sos 制备和ph为5至7的溶液中的分散体,所述分散体中的脂质分别为约 3:2:0.015摩尔比的dspc、胆固醇和mpeg-2000-dspe;
[0298]
(b)将60-70℃的脂质分散体挤出穿过至少一个0.1μm膜以形成脂质 体;
[0299]
(c)基本上除去在所述脂质体外部的源自tea8sos和/或dea8sos的 离子;
[0300]
(d)将在60-70℃温度的脂质体与使用伊立替康游离碱或伊立替康盐制 备的溶液接触,由此形成包封伊立替康的脂质体的制剂;
[0301]
(e)基本上除去在所述脂质体外部的源自tea8sos和/或dea8sos和 依立替康成分的物质;和
[0302]
(f)将所述组合物的ph调节为7.0-7.5。
[0303]
实施方式4:实施方式1-3任一项的脂质体伊立替康组合物,其通过包 括以下步骤的方法制备:
[0304]
(a)形成脂质在由硫酸酯浓度为0.4至0.5m的tea8sos制备和ph为 5至7的溶液中的分散体,所述分散体中的脂质分别为约3:2:0.015摩尔比的 dspc、胆固醇和mpeg-2000-dspe;
[0305]
(b)将60-70℃的脂质分散体挤出穿过至少一个0.1μm膜以形成脂质 体;
[0306]
(c)基本上除去在所述脂质体外部的源自tea8sos的离子;
[0307]
(d)在温度为60-70℃将脂质体与使用伊立替康游离碱或伊立替康盐 制备的溶液接触,由此形成包封伊立替康的脂质体的制剂;
[0308]
(e)基本上除去在所述脂质体外部的源自tea8sos和依立替康成分的 物质;和
[0309]
(f)将所述组合物的ph调节为7.0-7.5。
[0310]
实施方式5:实施方式4的脂质体伊立替康组合物,其中所述脂质分散 体挤出穿过至少两个叠放的0.1μm的聚碳酸酯膜。
[0311]
实施方式6:前述实施方式任一项的脂质体伊立替康组合物,其中所述 脂质体的平均尺寸为110nm,平均尺寸通过动态光散射确定,其中尺寸通过 累积量方法确定。
[0312]
实施方式7:前述实施方式任一项的脂质体伊立替康组合物,其具有的 总伊立替康部分含量等同于4.3mg/ml伊立替康无水游离碱。
[0313]
实施方式8:实施方式3-6任一项的脂质体伊立替康组合物,其中:
[0314]
在步骤(a)中,所述脂质体由硫酸酯浓度为0.43-0.47m的tea8sos形 成;和
[0315]
在步骤(d)中,使用伊立替康游离碱或伊立替康盐制备的溶液具有的伊立 替康部分含量等同于500g(
±
10%)的伊立替康无水游离碱每摩尔dspc;和
[0316]
在步骤(f)中,将所述组合物的ph调节为7.2至7.3。
[0317]
实施方式9:前述实施方式任一项的脂质体组合物,其在约4℃储存之 前含有小于1mol%的溶血磷脂酰胆碱(溶血-pc),其在约4℃储存180天之 后含有20mol%或更少(相对于总脂质体磷脂)的溶血-pc。
[0318]
实施方式10:实施方式9的脂质体组合物,其在约4℃储存6、9或12 个月之后含有20mol%或更少(相对于总脂质体磷脂)的溶血磷脂酰胆碱(溶血
ꢀ‑
pc)。
[0319]
实施方式11:前述实施方式任一项的脂质体伊立替康组合物,其总的包 含6.1至7.5mg dspc/ml、2至2.4mg胆固醇/ml和0.11至0.13mg mpeg
‑ꢀ
2000-dspe/ml,全部都在含水
等渗缓冲液中。
[0320]
实施方式12:前述实施方式任一项的脂质体伊立替康组合物,其中所述 脂质体伊立替康包含浓度为2至20mm的在等渗hepes含水缓冲液中的伊 立替康脂质体。
[0321]
实施方式13:前述实施方式任一项的脂质体伊立替康组合物,其进一步 包含浓度为130-160mm的氯化钠。
[0322]
实施方式14:前述实施方式任一项的脂质体伊立替康组合物,其中包封 在所述脂质体中的所述伊立替康作为蔗糖八硫酸酯盐呈凝胶状态或沉淀状 态。
[0323]
实施方式15:前述实施方式任一项的脂质体伊立替康组合物,其中所述 伊立替康脂质体的直径为95-115nm,其通过准弹性光散射测量。
[0324]
实施方式16:前述实施方式任一项的脂质体伊立替康组合物,其总的包 含6.81mg dspc/ml、2.22mg胆固醇/ml、和0.12mg mpeg-2000-dspe/ml、 4.05mg/ml hepes含水缓冲液和8.42mg氯化钠/ml。
[0325]
实施方式17:前述实施方式任一项的脂质体伊立替康组合物,其具有的 ph为7.25,其中所述伊立替康脂质体的直径为110nm,其通过准弹性光散 射测量。
[0326]
实施方式18:前述实施方式任一项的脂质体伊立替康组合物,其在约 4℃储存6个月之后形成小于1mg/ml的溶血磷脂酰胆碱(溶血-pc)。
[0327]
实施方式19:前述实施方式任一项的脂质体伊立替康组合物,其通过包 括以下步骤的方法制备:
[0328]
(a)形成脂质在tea8sos硫酸酯浓度为约0.45m的溶液中的分散体, 所述溶液的ph为约6.5,所述分散体中的脂质分别由摩尔比为3:2:0.015的 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、胆固醇和甲氧基封端的聚乙二醇 (mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000-dspe)组成;
[0329]
(b)将60-70℃的脂质分散体挤出穿过至少一个0.1μm膜以形成脂质 体;
[0330]
(c)除去在所述脂质体外部的源自tea8sos的离子;
[0331]
(d)在温度为60-70℃将脂质体与使用伊立替康盐酸盐三水合物制备 的溶液接触,从而形成包封约500g(
±
10%)伊立替康每摩尔总脂质体磷脂的 脂质体制剂;
[0332]
(e)除去在所述脂质体外部的源自tea8sos和依立替康成分的物质; 和
[0333]
(f)将所述组合物的ph调节为约7.3。
[0334]
实施方式20:前述实施方式任一项的脂质体伊立替康组合物,其总的包 含小于100ppm的tea。
[0335]
实施方式21:前述实施方式任一项的脂质体伊立替康组合物,其总的包 含30-100ppm的tea或dea。
[0336]
实施方式22:前述实施方式任一项的脂质体伊立替康组合物,其中在约 4℃储存6个月之后,至少98%的伊立替康包封在所述伊立替康脂质体中。
[0337]
实施方式23:前述实施方式任一项的脂质体伊立替康组合物,其在所述 伊立替康脂质体中包含式(i)的伊立替康组合物,其中x为8:
[0338][0339]
实施例
[0340]
在下面的实施例中描述几种伊立替康脂质体制剂的合成和表征。除非实 施例中另有说明,否则这些伊立替康脂质体可以通过以下多步骤方法得到。 因此本发明也提供制备伊立替康脂质体的方法及其变型和组合,所述方法符 合本小节和实施例中所述的制备方法。
[0341]
首先,将形成脂质体的脂质溶解于加热的乙醇中。这些脂质包括dspc、 胆固醇和mpeg-2000-dspe。除非另外指明,否则dspc、胆固醇和mpeg
‑ꢀ
2000-dspe存在的摩尔比为3:2:0.015。所得乙醇-脂质组合物在如下条件下 分散于包含取代铵和聚阴离子的含水介质中:有效形成适宜尺寸(例如80
‑ꢀ
120nm或95-115nm等)的基本上单室脂质体,所述基本上单室脂质体包含取 代铵离子和聚阴离子捕获剂(sos)。脂质体分散体可以例如如下形成:在大 于脂质转变温度的温度(例如60-70℃),将乙醇脂质溶液与包含取代铵离子 和聚阴离子的水溶液混合,然后在压力下将所得脂质悬浮液(多层脂质体)挤 出穿过一个或多个行迹蚀刻的例如聚碳酸酯膜过滤器,所述膜过滤器具有限 定的孔径,例如50nm、80nm、100nm或200nm。优选取代铵为质子化三乙 胺(tea)或二乙胺(dea),聚阴离子为蔗糖八硫酸酯(sos),优选以化学计量 比组合(例如tea8sos)。tea8sos的浓度可以基于伊立替康加载到脂质体 中的量进行选择(例如基本或完全耗尽脂质体上的浓度加载梯度,和/或提供 包含约1:8摩尔比的sos和伊立替康的脂质体)。例如,为了以471g或500 g伊立替康部分/mol磷脂制备伊立替康sos脂质体,优选使用tea8sos的 浓度为约0.4-0.5m硫酸酯基团(例如0.45m或0.475m硫酸酯基团,或0.45 m或0.475m sos)。然后除去所有或基本上所有非截留tea或sos(例如通 过凝胶过滤,渗析或超滤/渗滤)。
[0342]
然后,在有效将伊立替康加载到捕获剂脂质体中的条件下(即,在允许伊 立替康进入脂质体中以与离开脂质体的tea交换的条件下),将所得捕获剂 脂质体(例如包封取代铵化合物,例如tea8sos或dea8sos)与伊立替康溶 液接触。加载伊立替康的溶液(例如15毫克/毫升的无水伊立替康-hcl,其可 以使用相应量的伊立替康-hcl三水合物制备)优选包含渗透剂(例如5%葡萄 糖)和ph为6.5(除非另有说明,在本说明书中提到的ph值在室温测定)。药 载通过增加组合物的温度高于脂质体脂质的转变温度(例如增至60-70℃)以 加速取代铵化合物(例如tea)和伊立替康的跨膜交换来促进。在一些实施方 式中,伊立替康硫糖酯在脂质体中呈凝胶状态或沉淀状态。
[0343]
优选继续通过脂质体与取代铵化合物(例如tea或dea)跨膜交换来加 载伊立替
康,直到全部或基本上全部取代铵化合物(例如tea)从脂质体中除 去,从而耗尽所有或基本所有跨膜脂质体的浓度梯度。优选地,伊立替康脂 质体加载过程一直持续到伊立替康与sos的克当量比为至少0.9、至少0.95、 0.98、0.99或1.0(或范围为约0.9-1.0、0.95-1.0、0.98-1.0或0.99-1.0)。优选 地,伊立替康脂质体加载过程一直持续到至少90%、至少95%、至少98%或 至少99%或更多的tea从脂质体内部除去。在本发明的一些实施方式中, 以此方法使用tea8sos制备的伊立替康sos脂质体组合物包含小于100 ppm tea。在本发明的一些实施方式中,以此方法使用tea8sos制备的伊 立替康sos脂质体组合物包含20-100ppm、20-80ppm、40-80ppm或40-100 ppm tea。
[0344]
可以除去脂质体外伊立替康和取代铵化合物(例如tea或dea)以得到 最终伊立替康脂质体产品。这种除去可以通过各种方法促进,其中非限制性 实施例包括凝胶(尺寸排阻)色谱法、渗析法、离子交换法和超滤/渗滤法。脂 质体外部介质替换为可注射的药用流体,例如缓冲(ph为7.1至7.5,优选ph 为7.2至7.3)等渗盐水。最后,脂质体组合物进行灭菌,例如通过0.2微米过 滤,将其分配到单剂量小瓶中、标记和储存,例如在2-8℃冷藏,直至使用。 在除去剩余脂质体外伊立替康和铵/取代铵离子(例如tea)的同时,脂质体外 部介质可以用药用流体替代。
[0345]
量化捕获剂
[0346]
为了本发明的目的,脂质体捕获剂和取代铵化合物抗衡离子(例如 tea8sos)基于用于制备脂质体的浓度定量和基于捕获剂的硫酸酯基团数目 计算。例如,0.1m tea8sos会在本技术中表示为0.8m/l硫酸酯,因为每 个sos分子都有八个硫酸酯基团。在其中使用不同捕获剂的情况下,该计算 会进行调整,取决于阴离子基团数目(例如硫酸酯基团)每分子捕获剂。
[0347]
量化伊立替康脂质体制剂中的溶血-pc
[0348]
在伊立替康蔗糖八硫酸酯脂质体制剂中测试的溶血-pc数量得到图11b 和12中的数据是通过实施例9中描述的hplc方法(“方法a”)得到的。
[0349]
采用不同的制备(tlc)方法(本技术,“方法b”),从本技术的样品1-23得 到溶血-pc测量值,溶血磷脂通过以下tlc方法、然后进行磷酸盐分析而不 是上面刚讨论的hplc方法(方法a)测定。通过方法b按照下列步骤测量溶 血-pc。将包含约500nmol磷脂(pl)(例如0.05ml的10mm pl脂质体溶液) 的脂质体样品的等分试样使用用水平衡的pd-10柱(ge healthcare)脱盐。将 样品用水从柱中洗脱出来,分成三份,每份含约150nmol pl,然后用离心浓 缩器(savant speed vac concentrator,model#svc100x)真空干燥。将干燥的 脂质溶解在30μl氯仿/甲醇(5/1,体积/体积)中并且使用玻璃注射器施用至正 相硅胶tlc板(uniplate by analtech,目录号44921)的非吸附区域。tlc通 过由氯仿/甲醇/30%氢氧化铵/水(60/40/2.5/3.75,v/v/v/v)组成的流动相来运行, 并且使用碘蒸气显示脂质。pl的测定如下进行:将tlc上的对应于磷脂和 溶血磷脂的斑点分到单独的12
×
75mm硼硅酸盐管中以进行随后的磷酸盐 分析。
[0350]
实施例中提供脂质体共包封的伊立替康和硫酸酯化合物的摩尔量量化。
[0351]
材料
[0352]
对于制备实施例1中的样品1-5和13以及实施例2中的样品12和14
‑ꢀ
18,usp gmp等级伊立替康盐酸盐(( )-7-乙基-10-羟基喜树碱10-[1,4'-联哌 啶]-1`-羧酸酯,单盐酸
盐,三水合物,cas登记号100286-90-6)购自 sinopharm(taipei,taiwan);1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)和甲氧 基封端的聚乙二醇(mw-2000)-二硬脂酰磷脂酰乙醇胺((mpeg-2000-dspe) 购自avanti polar lipids(alabaster,al,usa);超纯胆固醇(chol)得自 calbiochem(la jolla,ca,usa);和蔗糖八硫酸酯得自euticals(lodi,italy)。
[0353]
对于制备实施例1中的样品6-11,伊立替康盐酸盐三水合物得自 pharmaengine(taiwan);1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)和甲氧基封 端的聚乙二醇(mw-2000)-二硬脂酰磷脂酰乙醇胺((mpeg-2000-dspe)购自 avanti polar lipids(alabaster,al,usa);超纯胆固醇(chol)得自 calbiochem(la jolla,ca,usa);和蔗糖八硫酸酯得自euticals(lodi,italy)。
[0354]
对于制备实施例8中的样品19-23,长春瑞滨(vnb)作为长春瑞滨酒石 酸盐10mg/ml的溶液(glaxo-smithkline)得自药房,和拓扑替康(tpt)粉末 作为赠品得自taiwan liposome company(taipei,taiwan)。
[0355]
所有其它分析纯或纯度更高的化学品都得自普通供应商。
[0356]
方法:使用下列方法制备样品1-5和13(实施例1)以及样品6-11和19
‑ꢀ
23(实施例2)以及样品12和14-18(实施例3),除非下文另有说明。
[0357]
三乙基铵蔗糖八硫酸酯制剂
[0358]
三乙基铵蔗糖八硫酸酯(tea8sos)和二乙基铵蔗糖八硫酸酯(dea8sos) 由蔗糖八硫酸酯的钠盐使用离子交换色谱法制备。简言之,将15g蔗糖八硫 酸酯(钠盐)溶解于水中,得到浓度为2.64m的硫酸酯。采用dowex 50w-8x
‑ꢀ
200阳离子交换树脂制备蔗糖八硫酸酯的酸性形式。将定义的树脂用2体积 的1n naoh洗涤两次,然后用ddh2o(双蒸馏水)洗涤至中性ph,用2体积 的1n hcl洗涤两次,最后用ddh2o洗涤至中性,然后重复。柱中倒入体积 为450ml的树脂中,并且用3体积3n hcl洗涤,然后用ddh2o冲洗,直到 电导率达到小于1μs/cm。将蔗糖八硫酸酯(钠盐)溶液(大约10%柱容量)加载 到柱上并且用ddh2o洗脱。柱洗脱液使用电导检测器监测以检测蔗糖八硫 酸酯从柱中的洗脱。将酸性蔗糖八硫酸酯然后用三乙胺或二乙胺滴定至ph 为6-7,硫酸酯含量使用从b.sorbo et al.,methods in enzymology,143:3-6, 1984修改的方法测定(参见硫酸酯测定)。最终将溶液稀释至硫酸酯浓度对应 于0.65m硫酸酯。ph值通常在6-7的范围内。残留钠使用钠电极测定,不 再使用大于1mol%残留钠的任何溶液。
[0359]
硫酸酯基团测定
[0360]
蔗糖八硫酸酯溶液中的硫酸酯含量用浊度测定法测定。溶液由下列物质 组成:(1)在100ml水中的15g peg 6000和1.02g乙酸钡;(2)在1ml水中的 142mg硫酸钠;(3)钡工作溶液:滴加0.1ml的硫酸钠溶液至100ml钡溶液, 同时搅拌。这种溶液在使用前应该平衡1小时,并且可以保存不超过一周; (4)0.4m柠檬酸三钠溶液;(118mg柠檬酸三钠/ml水);和(5)从1n硫酸在水 中稀释的10mm的硫酸酯标准品。使用硼硅酸盐试管将标准品和溶液制成最 终体积为100μl。标准品在0.2-1μmol硫酸酯(20-100μl的10mm标准品)范 围内制备。对于0.6m硫酸酯溶液的样品,使用1/100和体积为100μl的稀 释液(0.6μmol)。每100μl样品/标准品用100μl 70%高氯酸处理并且在110
‑ꢀ
120℃加热12分钟。冷却之后,加入0.8ml的0.4m柠檬酸三钠溶液,然后 涡旋。将0.25ml体积来自搅拌的钡工作溶液转移到每个管中并且立即涡旋。 允许所有样品/标准品平衡1小时,然后涡旋并且测量600nm处的吸光度。 使
用so4浓度相对od600的线性标准曲线来确定未知的so4浓度。
[0361]
通过hplc进行的蔗糖八硫酸酯测定
[0362]
样品中蔗糖八硫酸酯的浓度(mg/ml)可以基于已知浓度标准品产生的蔗 糖八硫酸酯峰的面积来计算。然后使用计算出的蔗糖八硫酸酯浓度计算样品 中硫酸酯的浓度(mm)。
[0363]
待分析的样品通过hplc进行色谱分析,其使用phenomenex,bondclone10μnh2,300 x 3.90mm,pn 00h-3128-c0,或watersμbondapak nh
2 10μm (3.9mm x 300mm),使用0.60m硫酸铵流动相的part no.wat084040, 以1.00ml/min在40℃的柱温洗脱的ph为3.0。样品通过折射率检测器进 行检测,该检测器也处于40℃,例如使用agilent的hplc和折射率检测器。 usp蔗糖八硫酸酯钾七水合物用作参考标准;cas 76578-81-9,登记号 1551150。
[0364]
sos测定标准和测定对照样品使用关于基线积分的基线进行积分。ea
‑ꢀ
sos样品然后使用关于基线积分的基线进行积分。这可以在空隙体积谷至 sos尾部末端之前进行手动开始基线,然后在tea峰开始时和两峰之间的 低点处放下一条线。注意:如果在空洞体积谷至sos尾部末端之前开始的单 个基线穿过tea和sos峰之间的低点,则可以使用两条单独的线,它们将 相对于基线的方法逼近基线。tea-sos样品在相对于sos峰保留时间的相 对保留时间约为0.45时显示tea峰。
[0365]
药物分析
[0366]
伊立替康的hplc分析在dionex系统上进行,dionex系统使用c
18
反 相硅胶柱(supelco c
18
柱,内径250mm
×
4mm,粒度5μm),前面是supelco c
18
保护柱。使用50μl的样品注射体积,并且将柱使用流动相以1.0ml/min的 流速等速地洗脱,流动相由0.21m三乙基铵乙酸铵水溶液(ph 5.5)和乙腈 (73:27,v:v)组成。伊立替康和sn-38通常分别在5.1分钟和7.7分钟洗脱。 伊立替康使用二极管阵列检测器通过在375nm处的吸光度检测,sn-38通过 荧光(370nm激发和535nm发射)检测。
[0367]
磷酸盐测定
[0368]
下面的磷酸盐测定方法用于分析样品1-23。改进的bartlett磷酸盐测定 可用于测量磷脂(pl)。将范围为10-40nmol的磷酸盐标准品放入12
×
75mm 硼硅酸盐管中,并且作为样品进行正确处理。将硫酸(100μl的6m h2so4) 加入到放置在加热块中的每个管中,并且加热至180℃达45分钟。向每个 管中加入过氧化氢(20μl的30%溶液),然后在150℃加热30分钟。将钼酸 铵(0.95ml的2.2g/l溶液)和抗坏血酸(50μl的10%水溶液)随后加入每个管中。 涡旋之后,将管在沸水中显影15分钟,然后冷却至室温。对于使用薄层色 谱法(tlc)的溶血脂质分析,通过在1000rpm离心5分钟使二氧化硅沉淀, 通过读取823nm处的吸光度测量上清液中的蓝色。不含二氧化硅的样品可 以排除离心步骤。
[0369]
药物保留和稳定性
[0370]
脂质体伊立替康的稳定性(以药物保留量计)通过使用pd-10(sephadexg-25)尺寸排阻柱从脂质体外伊立替康分离脂质体伊立替康来测定。药物泄 漏通过比较伊立替康(hplc)与脂质体外伊立替康分离前后的pl(磷脂测定 中所述)比率来测定。伊立替康的降解通过观察hplc分析之后色谱图中另 外的峰来测定。伊立替康与磷脂的比率和药物包封率分别使用下式1和2计 算。
[0371]
(1)伊立替康与磷脂的比率=[伊立替康](mg/ml)
×
1000
[0372]
(g伊立替康/mol pl)[磷脂](mm)
[0373]
(2)包封率(%)=(伊立替康与磷脂的比率)ac
[0374]
(伊立替康与磷脂的比率)bc
[0375]
其中(伊立替康与磷脂的比率)ac为在g-25尺寸排阻柱上纯化后的药物 与磷脂的比率,(伊立替康与磷脂的比率)bc为在柱上纯化之前的药物与磷脂 的比率。
[0376]
脂质体组合物中包封和游离的伊立替康的测定
[0377]
实施例3和4的伊立替康硫糖酯脂质体组合物中的脂质体包封和游离 (未包封)的伊立替康使用柱(cartridge)吸附法测定。oasis 60mg 3cc hlb柱(waters)依次如下物质进行调理:2ml甲醇,1ml hepes-缓冲盐水(hbs; 5mm hepes,140mm nacl,ph 6.5)和0.5ml 10%在生理盐水中的人血清白 蛋白,接着1ml的hbs。脂质体伊立替康硫糖酯组合物用生理盐水稀释至 约2.2mg/ml伊立替康,并且将0.5ml等分试样施用于盒上。收集洗脱液, 将柱用两份hbs(1.5ml,3ml)冲洗,并且将冲洗液与洗脱液合并以制成脂质 体级分。将柱另外用1.5ml hbs冲洗,并且用两份3ml甲醇-hcl(90体积% 甲醇,10体积%18mm hcl)洗脱。将洗脱液合并,制成游离药物级分。脂质 体药物级分转移至25ml容量瓶中,将游离药物级分转移至10ml容量瓶 中,加甲醇-hcl至刻度,混合均匀,并且将脂质体级分的烧瓶在60℃加热 10分钟以溶解药物。冷却之后,过滤溶液,并且将两级分中的伊立替康在 phenomenex luna c18(2)柱上使用反相hplc定量,用20mm磷酸钾ph3.0 甲醇混合物(体积比60:40)等浓度洗脱,在254nm处进行uv检测。对药物 峰进行积分,并且通过与在相同条件使用伊立替康盐酸盐三水合物usp参 考标准得到的线性标准曲线进行比较,计算样品中伊立替康的量。药物包封 率计算为包封药物相对于样品中游离和包封药物的总量的百分比。
[0378]
ph测量
[0379]
ph值始终在环境温度(即,20-25℃)使用电位滴定标准玻璃电极方法测 量。通过将玻璃电极置于脂质体制剂中并且获取ph读数,相应地测量脂质 体制剂的ph值。
[0380]
分析样品的tea/dea ppm
[0381]
样品分析通过顶空气相色谱(gc)分离如下进行:使用毛细管gc柱 (50m
×
0.32mm
×
5μmrestek rtx-5(5%苯基-95%二甲基聚硅氧烷))进行梯度温 度洗脱,然后进行火焰离子化检测(fid)。分析样品制剂和标准制剂,并且比 较所得峰面积响应。残留胺(例如tea或二乙胺(dea))的量使用外部标准进 行定量。在tea的情况下,标准≥99%。其它试剂包括三乙二醇(teg)、氢 氧化钠和去离子(di)水。
[0382]
gc条件为:载气:氦气;柱流速:20cm/sec(1.24ml/min);分流比: 0:1(只要符合所有系统适用性标准,都可以进行调整);注射模式:分流0:1; 内衬:2mm直槽(建议但不要求);注入口温度:140℃,检测器温度:260 ℃(fid);初始柱温箱温度:40℃;柱温箱程序:
[0383][0384]
54分钟运行时间
[0385]
顶空参数:平台温度:90℃;样品循环温度:100℃;传输线温度:100 ℃;平衡时间:60分钟;注射时间:1分钟;小瓶压力:10psi;加压时间: 0.2分钟;摇动:进行(中等);进样量:1.0ml顶部空间;gc循环时间:60 分钟(建议但不要求)。
[0386]
如果未检测到tea,则报告为“未检测到”;如果tea结果《30ppm, 则报告为《ql(30ppm);tea的结果≥30ppm,则报告为整数。
[0387]
测定脂质体尺寸
[0388]
脂质体粒度测量到使用动态光散射(dls)使用malvern zeta sizer nanozs
tm
或类似仪器在含水缓冲液(例如10mm nacl,ph 6.7)中在23-25℃使用 累积量方法测量。记录z-平均粒度和多分散性指数(pdi)。仪器性能使用100 nm聚合物的纳米球nist溯源标准(thermo scientific 3000系列纳米球尺寸 标准p/n 3100a或等同于包括hydrodynamic diameter的分析证书)验证。本 申请使用的“dls”是指动态光散射和“bdp”是指散装药品。
[0389]
实施例1:sos捕获剂浓度和ph在脂质体伊立替康制剂储存稳定性上 的作用
[0390]
本研究的目的特别是确定包封伊立替康和蔗糖八硫酸酯(sos)捕获剂的 脂质体在约4℃储存一定时间时的物理和化学稳定性的任何变化。对于本研 究,降低脂质体sos捕获剂浓度,同时471克伊立替康部分每总摩尔数的 磷脂的比例得以维持。
[0391]
一系列伊立替康sos脂质体制剂在多步骤方法中采用不同浓度的sos 捕获剂并且将最终脂质体制剂的ph值调节至不同ph值来制备。伊立替康 sos脂质体制剂各自包含伊立替康部分的浓度等同于5mg/ml伊立替康盐 酸盐三水合物。样品1-5和13的伊立替康sos脂质体制剂通过实施例1的 多步骤方法制备。
[0392]
dspc、胆固醇(chol)和peg-dspe称量的量分别相当于3:2:0.015摩尔 比(例如1264mg/412.5mg/22.44mg)。将脂质溶解于氯仿/甲醇(4/1,v/v)中, 充分混合,并且分成4等份试样(a-d)。将每个样品使用旋转蒸发器在60℃ 蒸发至干燥。通过在室温置于真空(180微托)12小时从脂质中除去残留的氯 仿。将干燥的脂质在60℃溶解于乙醇中,加入适宜浓度的预热tea8sos, 使最终醇含量为10%。脂质浓度约为75mm。脂质分散体使用lipex热机筒 挤出机(northern lipids,canada)在约65℃挤出穿过2个叠放的0.1μm聚碳 酸酯膜(nuclepore
tm
)10次,以产生典型平均直径为95-115nm的脂质体(由准 弹性光散射确定;参见“测定脂质体尺寸”小节)。挤出脂质体的ph值根据需 要进行调整,以校正挤出过程中ph值的变化。脂质体通过离子交换色谱和 尺寸排阻色谱的组合进行纯化。首先,dowex
tm
ira 910树脂用1n naoh处 理,接着用去离子水洗涤3次,然后洗涤3n hcl 3次,然后用水多次洗涤。 脂质体穿过制备的树脂,洗脱级分的电导率通过使用流动池电导率计 (pharmacia,uppsala,sweden)测量。如果电导率小于15μs/cm,则认为该级 分为可接受的以用于进一步纯化。然后将脂质体洗脱液施加到用去离子水平 衡的sephadex g-75(pharmacia)柱上,并且测量收集的脂质体级分的电导率 (通常小于1μs/cm)。跨膜等渗性如下实现:加入40%葡萄糖溶液至最终浓 度5%(w/w),并且从储备溶液(0.5m,ph6.5)中加入缓冲液(hepes)至最终浓度 10mm。
[0393]
伊立替康的储备溶液如下制备:将伊立替康
·
hcl三水合物粉末溶解于 去离子水中以得到15mg/ml的无水伊立替康-hcl,同时考虑到每批次的分 析证书中得到的含水量和杂质含量。药载如下开始:加入500g伊立替康hcl 无水(对应于471g伊立替康无水游离碱)每摩尔脂质体磷脂的量的伊立替康, 在热水浴中加热至60
±
0.1℃达30分钟。将溶液从水
浴中移出后通过浸入 冰冷水中进行迅速冷却。脂质体外药物通过尺寸排阻色谱,使用用hepes缓 冲盐水(10mm hepes,145mm nacl,ph 6.5)平衡和洗脱的sephadex g75柱 除去。样品通过hplc分析伊立替康和通过bartlett方法分析磷酸盐(参见小 节“磷酸盐测定”)。为了储存,将样品分成4ml等份,并且使用1n hcl或 1n naoh调节ph,在无菌条件下无菌过滤,并且填充到无菌透明玻璃小瓶 中,所述小瓶在氩气下用内衬螺纹帽密封并且放入4℃的恒温控制 冰箱中。在规定的时间点,从每个样品中取出等分试样并且测试其外观、脂 质体尺寸、药物/脂质比率以及药物和脂质化学稳定性。
[0394]
关于实施例1,脂质体尺寸分布在稀释的样品中通过动态光散射使用 coulter nano-sizer在90度角测定,并且用累积量方法得到的平均值
±
标准偏 差(nm)表示。
[0395]
样品1-5和13的伊立替康脂质体制剂进一步如下得到。新挤出的脂质 体包含两组,每组以如下浓度并入tea8sos作为捕获剂:(a)0.45m硫酸 酯基团(112.0
±
16nm),(b)0.475m硫酸酯基团(105.0
±
16nm),(c)0.5m硫 酸酯基团(97
±
30nm),和(d)0.6m硫酸酯基团(113
±
10nm)。在实施例1的描 述中,样品1-5和13以471g伊立替康无水游离碱每摩尔总脂质体磷脂的初 始比率进行加载和如上所述纯化(等同于500g伊立替康hcl无水)。样品1、 5和13来源于挤出样品(a);样品2来自挤出样品(b);样品3和4分别来自 挤出样品(c)和(d)。纯化之后,使用1n hcl或1n naoh进行ph调节,然 后灭菌和填充小瓶。来自样品1-5的数据显示于表7(实施例1)中,来自样品 13的数据显示于表8(实施例2)中。
[0396]
样品6-11的伊立替康脂质体制剂进一步如下得到。新挤出的脂质体包 含两组,每组以如下浓度并入tea8sos作为捕获剂:(a)0.45m硫酸酯基 团(116
±
10nm)和(b)0.6m硫酸酯基团(115.0
±
9.0nm)。样品6-8来源于挤出 样品(a),样品9-11来自挤出样品(b)。纯化之后,如果需要,通过适宜添加 1n hcl或1n naoh来进行ph调节。样品12按照实施例2中的描述进行 制备,并且为了对比的目的,其包括在表7中。
[0397]
对于某些伊立替康脂质体组合物来说,具有脂质体外ph值、伊立替康 游离碱浓度(mg/ml)和各种浓度的蔗糖八硫酸酯的伊立替康脂质体列于下表 6(在4℃储存6个月)和下表7中,并且根据本技术描述的更详细内容进行 制备。
[0398]
图4a-4c为显示选自表7的ph大于6.5(即,每个图中所示的7.25或 7.5)的伊立替康脂质体制剂中mol%溶血-pc的图。溶血-pc在各样品于4℃ 储存的前1个月、前3个月、前6个月和/或前9个月之后用本技术公开的 方法b(tlc)进行测定。这些图包括各样品数据的线性回归线,作为对于各 样品中溶血-pc随时间推移的增长率(mol%)的估计值。令人惊讶的是,增加 伊立替康脂质体制剂的ph从而大于6.5(例如7.25和7.5)降低了4℃冷藏储 存期间测量的溶血-pc的量,与在相当的稳定性比率形成的伊立替康脂质体 相比。这种倾向性在各种浓度的脂质体伊立替康下是明显的。例如,关于在 强度为约4.3mg伊立替康部分/ml所制备的脂质体伊立替康组合物,样品 5和7中mol%溶血-pc水平的测定值在所有数据点都显著较低(在制备之后 在4℃储存前1个月、前6个月和前9个月之后),与在ph 6.5测量样品1 中的mol%溶血pc水平(表7中的数据)相比。类似地,关于在强度为约18.8 mg伊立替康部分/ml所制备的脂质体伊立替康组合物,样品13中测量的 mol%溶血-pc水平在所有数据点都显著较低(在制备之后在4℃储存前1个 月和前9个月之后),与在ph 6.5测量样品12或样品14的mol%溶血pc水 平(表8中的数据)相比。
[0399]
表6:冷藏储存6个月之后的溶血-pc测量
[0400][0401]
实施例1中对比稳定性研究的另外结果在下表7中提供。mol%溶血-pc 在脂质体制剂于4℃储存1、3、6、9和/或12个月之后测定,如表7所示。 对于各样品,表7提供用于制备脂质体的sos浓度,其表示为硫酸酯基团 的摩尔浓度(一个包含8个硫酸酯基团的sos分子)。除非另外指明,否则表 7中所有的伊立替康脂质体分别使用伊立替康部分(如上解释的,基于无水游 离碱)相对于总的磷脂的比率为471g伊立替康部分(等同于500g无水伊立 替康hcl盐中伊立替康部分的量)每摩尔总脂质体磷脂制备。表7也包含各 样品的稳定性比率,计算为471g伊立替康部分(基于无水游离碱)每摩尔磷 脂除以用于制备脂质体的硫酸酯基团以mol/l计的浓度的比率。表7中所述 样品的脂质体各自具有约89-112nm的测量尺寸(体积加权平均值)和至少 87.6%的伊立替康包封率。包封率根据小节“药物保留和稳定性”测定。
[0402]
表7:具有各种稳定性比率和ph的伊立替康脂质体制剂(由3:2:0.015摩 尔比的dspc、胆固醇(chol)和peg-dspe形成的脂质体囊泡)c[0403]
[0404]
[0405][0406]c根据方法b测量,如本技术描述的。
[0407]
该储存稳定性研究的结果表明,用于制备脂质体的sos捕获剂浓度(测 量为摩尔浓度的硫酸酯)减少,同时伊立替康无水游离碱(以g计)相对于总脂 质体磷脂(以mol计)的比率保持不变,导致伊立替康sos脂质体的储存稳定 性较大,其通过伊立替康脂质体制剂在4℃冷藏储存6个月和9个月之后溶 血-pc的检出量进行测量。在制备为ph为6.5的脂质体制剂中(参见本技术 描述的“ph测量”方法),在脂质体制备过程中减少sos捕获剂浓度导致脂质 体制剂在4℃储存之后的溶血-pc检出量减少。
[0408]
不受理论的约束,认为在制备过程中一旦由脂质体外捕获剂进行纯化之 后,脂质体的内部空间就被酸化。这可以是由于如下导致的:在除去脂质体 外tea8sos之后从脂质体内部至脂质体外部捕获剂盐的胺组分重新分配, 其中每次出现在脂质体内析出氢离子。加入能够质子化的药物例如伊立替康, 也分配在脂质体的外部和内部空间之间。在脂质体内部分配的药物质子化和 质子化药物与硫糖酯的结合影响药物在脂质体内的加载并且导致tea和氢 离子两者的脂质体内浓度降低,从而降低脂质体内的酸化程度。在伊立替康 脂质体的情况下,假设在载药量为500g伊立替康盐酸盐(即471mg伊立替 康)/mol脂质体磷脂(其中sos的硫酸酯浓度为0.6m)时,过量脂质体内tea 耗竭不完全。虽然不是在脂质体中保留药物的基础,但这可以提供酸性脂质 体内部,这可有助于降解药物和脂质体的脂质组分,如样品7和13所看到 的。相比之下,样品8和5具有相同载药量为500g伊立替康盐酸盐(即, 471mg伊立替康部分)/mol,但是分别具有较低sos浓度为0.45m硫酸酯和 0.475m硫酸酯。在这些特定情况下,溶血脂测量的水平较低。最终,显然的 是,最稳定的脂质体制剂将较高的药物/捕获剂比率与较高的外部ph值(即 ph为7.25)结合起来。
[0409]
样品1-11的伊立替康脂质体在4℃保持良好的胶体稳定性至多9个月, 如通过没有沉淀和相对窄和可再现的粒度分布判断的,其中伊立替康部分的 浓度对应于4.71mg/ml伊立替康无水游离碱。伊立替康在长时间储存期间 有效和稳定地截留并且具有最小渗漏(《10%)(参见本技术描述的“药物保留 和稳定性”方法)。
115nm的脂质体。根据需要 (用1n naoh)将挤出的脂质体的ph调节至选定制剂的ph。脂质体通过离子 交换色谱和尺寸排阻色谱的组合进行纯化。首先,dowex
tm
ira 910树脂用 1n naoh处理,接着用去离子水洗涤3次,然后洗涤3n hcl 3次,然后用 水多次洗涤。洗脱级分的电导率通过使用流动池电导率计(pharmacia, uppsala,sweden)测量。如果电导率小于15μs/cm,则认为该级分为可接受 的以用于进一步纯化。然后将脂质体洗脱液施加到用去离子水平衡的 sephadex g-75(pharmacia)柱上,并且测量收集的脂质体级分的电导率(通常 小于1μs/cm)。跨膜等渗性如下实现:加入40%葡萄糖溶液至最终浓度 5%(w/w),并且从储备溶液(0.5m,ph6.5)中加入缓冲液(hepes)至最终浓度 10mm。
[0417]
伊立替康的储备溶液如下制备:将326.8mg伊立替康
·
hcl三水合物粉 末溶解在20.0ml去离子水中以得到15mg/ml的无水伊立替康-hcl,同时 考虑到每批次的分析证书中得到的含水量和杂质含量。药载如下开始:以 500g/mol或750g/mol磷脂加入伊立替康无水游离碱,在热水浴中加热至60
ꢀ±
0.1℃达30分钟。将溶液从水浴中移出之后通过浸入冰冷水中进行迅速冷 却。脂质体外药物通过尺寸排阻色谱,使用用hepes缓冲盐水(10 mm)(hbs)(对于样品a,ph为6.5,对于样品b,为ph为7.25的组氨酸缓 冲盐水)平衡和洗脱的sephadex g75柱除去。样品通过hplc分析伊立替康 和通过bartlett方法分析磷酸盐(参见磷酸盐测定)。
[0418]
为了储存,将样品分成4ml等份,并且根据需要使用1n hcl或1nnaoh调节ph,在无菌条件下无菌过滤,并且填充到无菌透明玻璃小瓶中, 所述小瓶在氩气下用内衬螺纹帽密封并且放入4℃的恒温控制冰箱 中。在规定的时间点,从每个样品中取出等分试样并且测试其外观、尺寸、 药物/脂质比率以及药物和脂质化学稳定性。
[0419]
脂质体尺寸在稀释的样品中通过动态光散射使用coulter nano-sizer在 90度角测定,并且用累积量方法得到的平均值
±
标准偏差(nm)表示。
[0420]
来自对比稳定性研究的结果提供于表8(对于使用tea8sos捕获剂原料 制备的样品)和表9(对于使用dea8sos捕获剂原料制备的样品)中。
[0421]
表8:用tea8sos捕获剂在hepes缓冲液中制备的伊立替康脂质体(10 mm)d[0422][0423]d根据方法b测量,如本技术描述的。
[0424]
样品13(实施例2,表8)的储存浓度比样品1-5(实施例1)大4倍(20mg 伊立替康/ml),并且仍然保持良好的胶体稳定性,没有可观察到的聚集或沉 淀。
[0425]
表9:在ph 7.25用硫酸酯基团浓度为0.65m的dea8sos捕获剂制备的 伊立替康脂质体)e[0426]
[0427][0428]e根据方法b测量,如本技术描述的。
[0429]
新挤出的脂质体尺寸包封(a)0.65m硫酸酯的tea8sos(113.0
±
23.8nm) 或(b)0.65m硫酸酯基团的dea8sos(103.2
±
21.1nm)(唯一的例外是样品13, 其具有0.45m硫酸酯基团)。得到来自(a)的样品12和14和来自样品(b)的 样品15-18,其中样品12、14、15和16的加载量为471g伊立替康无水游 离碱(等同于500g伊立替康hcl无水)每摩尔总脂质体磷脂,样品16-18的 加载量为750g伊立替康部分(如上解释的,基于无水游离碱)每摩尔磷脂。 纯化之后,使用1n hcl或1n naoh适宜地如表7和8中所述将ph调节至 ph为6.5或7.25。样品12如实施例1中所述制备,并且为了比较目的而包 括在表8中。
[0430]
数据显示,脂质体在4℃时保持良好的胶体稳定性至多一年,如通过没 有沉淀和相对窄和可再现的粒度分布判断的。其次,显然胶体稳定性对于较 浓样品在高ph和高药物与磷脂比率储存时也是良好的,表明在伊立替康部 分浓度等同于20mg/ml和40mg/ml的伊立替康盐酸盐三水合物时,脂 质体为稳定的并且可以阻止聚集体的形成。
[0431]
在所有情况下,伊立替康稳定地截留在脂质体中,渗漏率低并且转化为 活性细胞毒素sn-38的转化率低(即,sn38相比于伊立替康和sn38的相对 量);在所有情况下小于0.5mol%,例外是样品12,小于0.1mol%sn-38。 数据由本技术描述的“药物保留和稳定性”方法和“药物分析”方法得到。
[0432]
在已经调节至ph为6.5和以比率为471g伊立替康部分(如上述解释的, 使用等同量的500g伊立替康hcl无水)每摩尔磷脂制备的样品中测量到溶 血-pc水平增加,对于样品12和14达到36-37mol%(相对于总的磷脂酰胆 碱),然而调节ph至7.25使得脂质体较不易于形成溶血-脂质,其中对于样 品15在一年之后的溶血-pc水平接近仅11mol%(相对于总的磷脂酰胆碱)。
[0433]
将脂质体的ph从6.5调节到7.25对胶体稳定性或药物渗漏没有不利影 响。
[0434]
实施例3:在不同量tea(sos捕获剂抗衡离子)下稳定的伊立替康脂质 体的储存稳定性
[0435]
伊立替康脂质体通过将伊立替康加载到包封蔗糖八硫酸酯(sos)和取代 铵抗衡离子(如质子化tea)的脂质体中制备。改变在载药的伊立替康sos脂 质体中取代铵的残留量的作用如下进行评价:制备多种包含不同量包封的残 留取代铵离子的伊立替康sos脂质体,将这些伊立替康sos脂质体在4℃ 冷藏储存6个月,然后测量这些伊立替康sos脂质体中溶血-pc(以mol计 %)的量。
[0436]
数据表明,减少伊立替康sos脂质体中取代铵离子的量导致在4℃冷 藏储存6个月之后溶血-pc水平较低。特别地,具有小于100ppm(例如20
‑ꢀ
100ppm tea)取代铵的伊立替康sos脂质体在4℃冷藏储存6个月之后表 现出较低水平的溶血-pc形成。
[0437]
六个批次(样品24-29)的脂质体伊立替康硫糖酯根据本发明的某些实施 方式制备,按照本技术描述的方案,具有稳定性比率为1046-1064,脂质组 合物中dspc、胆固醇和mpeg-2000-dspe的摩尔比分别为3:2:0.015。
[0438]
表10中溶血-pc的量通过hplc(本技术的方法a)测定。
[0439]
表10:在ph 7.3的伊立替康脂质体制剂(在囊泡中包封的伊立替康sos,所 述囊泡由dspc、胆固醇(chol)和peg-dspe以3:2:0.015的摩尔比形成)
[0440][0441]f根据方法a测量,如本技术描述的。
[0442]g根据方法a测量,如本技术描述的。
[0443]
如下得到脂质体(100-115nm):将在tea-sos溶液(0.4-0.5m硫酸酯) 中分散的脂质挤出穿过100-nm聚碳酸酯膜(nuclepore),从脂质体外tea
‑ꢀ
sos通过切向流动渗滤缓冲液交换渗透平衡葡萄糖溶液进行纯化,通过使温 度升至68℃加载有伊立替康,搅拌30分钟,快速冷却,并且从脂质体外 tea和任何非包封的药物通过切向流动渗滤缓冲液交换缓冲生理氯化钠溶 液进行纯化。伊立替康硫糖酯脂质体组合物通过穿过0.2-μm膜过滤器进行 过滤灭菌,无菌分装到无菌玻璃瓶中,并且在冷藏条件下(5
±
3℃)培育。在 冷藏储存时间约为0、3、6、9个月和在一些情况下12个月时,取出每批的 重复小瓶并且使用利用蒸发散射检测器进行的hplc方法分析溶血-pc的累 积量。脂质体组合物的特征还在于颗粒尺寸、伊立替康和脂质体磷脂浓度、 脂质体组合物的ph、伊立替康/硫糖酯克当量比(iri/sos比)和残留的三乙基 铵(质子化tea)(作为三乙胺)。平均粒度(d)和多分散指数(pdi)通过使用malvern zeta sizer nanozs
tm
的dls法测定。脂质体组合物中伊立替康的浓 度通过hplc测定。总的磷脂在脂质体于硫酸/过氧化氢混合物中消化之后, 通过蓝色磷钼酸盐分光光度法进行测定。
[0444]
药物/脂质(dl)比率通过将以g计的药物量(作为无水游离碱)除以脂质 体制剂中脂质体磷脂的摩尔量来计算。脂质体截留的sos在脂质体穿过用 生理盐水洗脱的sephadex g-25凝胶色谱柱(pd-10,ge healthcare)之后定量。 为了确定伊立替康/sos克当量比,将0.1ml等份洗脱的脂质体级分一式三 份与0.05ml 70%高氯酸混合,在95-100℃水解1小时,用0.8ml 1m乙酸 钠中和,过滤除去不溶性脂质产物,并且基本如方法下所述通过比浊法使用 钡-peg试剂测定滤液中硫糖酯衍生的硫酸酯基团的量。将另一组相同脂质 体洗脱液的三份等分试样在70%酸化(0.1m hcl)异丙醇水溶液中溶解,并且 通过分光光度法在365nm处测定伊立替康。每个洗脱的脂质体级分中的伊 立替康/硫糖酯克当量比(iri/sos比率)如下计算:药物的测量摩尔浓度除以硫 酸酯基团的测量摩尔浓度。ph如小节“ph测
量”中所述测量。tea如下进行 定量:通过利用毛细管gc柱上的梯度温度洗脱进行顶空气相色谱(gc)分离, 然后通过火焰离子化检测(fid)进行。结果表示为ppm(份每百万份)的tea。 tea的水平通过针对标准品的外部定量进行测定。
[0445]
5、6、7、10、11a、11b和12中的数据得自脂质体伊立替康样品,所 述脂质体伊立替康样品如下制备:使0.4-0.5m tea8sos捕获剂脂质体加载 有约400-600mg(例如约500g)伊立替康部分每摩尔总的磷脂(稳定性比率范 围为约1000-1200)和制备之后的ph为约7.0-7.5(例如约7.25)。这些脂质体 伊立替康样品中各自的溶血-pc量在图5-7中所示的时间点使用实施例9的 hplc方法进行测量。
[0446]
将溶血-pc的积累数据(以mg溶血-pc/ml脂质体组合物计)相对于储存 时间进行绘制,如图5(样品24-26/批次1-3)或图6(样品27-29/批次4-6)上所 示。观察到线性关系,其中溶血-pc积累从约0.008mg/ml/月变为约 0.06mg/ml/月,较高的比率为具有较高tea量的组合物的特征。储存180天 (约6个月)时的溶血-pc积累量从多点数据的线性近似确定,并且表示为pc 的mol%,其中溶血-pc的分子量等于523.7g/mol。所有六批(样品24-29; 参见表10)在冷藏储存180天时积累小于20mol%溶血-pc。小于20ppm tea 和iri/sos克当量比大于0.98的批次显示最少的溶血-pc累积(少于约0.015 mg/ml/月,在180天时的溶血-pc为3.0mol%或更少);小于80ppm tea的 批次以约0.03mg/ml/月或更少的速率累积溶血-pc,并且在180天具有小 于7mol%溶血-pc;具有100ppm残留tea的批次以约0.06mg/ml/月的速 率累积溶血-pc,并且在180天时具有约10mol%溶血-pc。
[0447]
图7为显示在稳定的伊立替康硫糖酯脂质体组合物储存于5
±
3℃的溶 血-pc积累速率(以mg/ml/月计)相对于tea含量(以ppm计)的图,以及来 自数据的线性回归线。五个另外批次的脂质体伊立替康硫糖酯类似于实施例 3进行制备。该制剂储存的伊立替康部分(如上解释的,基于无水游离碱)为 约4.3mg/ml伊立替康无水游离碱每ml,并且定期分析实施例3所述的溶 血-pc形成和tea含量。溶血-pc积累速率计算为线性回归线的斜率,所述 线性回归线如下得到:针对每个批次溶血-pc数据相对于储存时间进行拟合, 用bdp/dp成对批次的平均tea读数相对于tea含量绘图(图6)。从图中 可以看出,制剂在速率为小于0.02mg/ml/月具有约25ppm或更少的tea 积累的溶血-pc(在180天时间内为小于2.5mol%溶血-pc增加);制剂在速率 为小于0.033mg/ml/月具有小于约70ppm tea积累的溶血-pc(在180天时 间内为小于4.3mol%溶血-pc增加),和所有制剂在速率为小于0.062mg/ml/ 月具有小于约100ppm的tea和积累的溶血-pc(在180天时间内为小于8.0 mol%溶血-pc增加)。
[0448]
样品24、25和28各自具有小于20ppm(例如约10-20ppm)取代铵离子 (质子化tea)和在4℃冷藏储存6个月之后观察到最低量的溶血-pc(2.2-3 mol%溶血-pc)。将样品26和27进行比较,将伊立替康sos脂质体中残留 的取代胺捕获剂抗衡离子(例如质子化tea)的量从约39ppm增至79 ppm(103%增加),伴随在180天之后观察到溶血-pc的量出乎意料地下降(从 6.9mol%降至5.4mol%,溶血-pc降低22%)。但是,伊立替康sos脂质体中 残留的取代铵离子(例如质子化tea)的量从79ppm(样品27)进一步增至100 ppm(样品29)(即,27%增加),伴随在4℃冷藏储存6个月之后观察到溶血
‑ꢀ
pc的量另外增加87%(即,从样品27中的5.4mol%增至样品29中的10.1 mol%)。
[0449]
实施例4:伊立替康与硫糖酯的相互作用
[0450]
图8为显示通过在水溶液中以各种比例的硫糖酯(sos)将伊立替康盐酸 盐和三乙基铵硫糖酯组合而形成的沉淀物中伊立替康和硫糖酯的克当量量 的图,如实施例4所述。
[0451]
当伊立替康盐酸盐溶液与包含三乙基铵硫糖酯的脂质体组合时,可以清 除氢离子,可以形成伊立替康硫糖酯盐。为了研究伊立替康和三乙基铵硫糖 酯之间的反应,我们制备25mm(16.93mg/ml)伊立替康盐酸盐三水合物 usp水溶液和250meq/l(31.25mm)三乙基铵硫糖酯(tea-sos)溶液(基本如
ꢀ“
方法”部分中所述)。将等分的伊立替康盐酸盐溶液用水稀释,加热至65℃, 并且与等份的tea-sos溶液合并,产生9:1至1:9的一系列伊立替康-sos 克当量比,两者化合物加在一起的总克当量浓度等于25meq/l。样品通过涡 旋迅速混合,在65℃培育30分钟,在冰水中冷冻,并且使其在4-6℃平衡 过夜。在所有样品中,都观察到沉淀。第二天,将样品在10000xg离心5分 钟,并且在14000xg另外离心5分钟,分离澄清的上清液(相对于松散的大 量白色至浅褐色的沉淀物),分析未沉淀的伊立替康和sos,基本如实施例 中所述,从而确定沉淀物的量和组成。将结果针对样品中sos的克当量百分 比作图(图8)。在sos的20-80当量%范围内,两者组分的图由两个线性分 支组成,这两个分支在50当量%处相交,表明伊立替康和硫糖酯形成不溶性 盐,化学计量为一个伊立替康分子每一个硫糖酯的硫酸酯基团(即,八个伊立 替康(iri)分子每一个硫糖酯(sos)分子):
[0452]
8iri.hcl tea8sos
→
(iri.h)8sos
↓
teacl
[0453]
尽管质子化伊立替康分子和硫糖酯阴离子的分子尺寸和形状存在显著 差异,但它们的盐令人惊讶地保持相近的化学计量比,即对于一个硫糖酯分 子为八个质子化伊立替康分子,即使在任一组分大大过量下也是如此(图8)。 因此,伊立替康硫糖酯可以以较差溶解性的沉淀态或凝胶状形式存在于脂质 体中。盐沉淀保持严格化学计量的事实允许该过程提前至硫糖酯的几乎所有 或基本全部硫酸酯基团都与药物分子结合的点。与实施例6的伊立替康-硫 糖酯克当量比测量相一致,加载伊立替康以得到本发明的稳定脂质体的过程, 在一些实施方式中,可以包含化学计量药物盐的脂质体沉淀物,直到至少 90%、至少95%、甚至至少98%并且在一些情况下基本所有游离脂质体硫酸 酯通过其伊立替康盐的沉淀和/或凝胶化而从脂质体水相中消耗。
[0454]
实施例5:伊立替康硫糖酯的制备和溶解度测定
[0455]
将量为1.64g伊立替康盐酸盐三水合物加入到160ml用0.008ml 1nhcl酸化的水中,并且在65℃水浴中加热搅拌直至药物溶解。在剧烈搅拌 下加入5ml 0.46m(基硫酸酯浓度)三乙基铵硫糖酯,再搅拌5分钟。在4-6℃ 过夜储存之后,淡黄色油状沉淀物固化成脆性物质。将物质用玻璃棒研磨, 得到蓬松的灰白色沉淀物,并且在冷藏下培育25天。沉淀物通过离心分离, 弃去上清溶液。将小丸重新悬浮于5倍体积的去离子水中,通过离心沉淀出; 重复该洗涤步骤另外两次直至悬浮液的ph为约5.8。最终,将小丸重新悬浮 于等体积去离子水中,得到约26ml或伊立替康含量为46.0mg/ml(游离碱) 的产物(理论产率为84%)。将等份产物溶解于1n hcl中并且分析伊立替康 (通过分光光度法在365nm处在270%含水异丙醇-0.1n hcl中)和对于在稀释 (1:4)高氯酸中水解后的硫酸酯使用硫酸钡比浊法测定。发现伊立替康与so4的摩尔比率为1.020
±
0.011。将等份的伊立替康硫糖酯悬浮液加入到去离子 水中,从而最终药物盐浓度为0.93、1.85和3.71mg/ml。将样品在搅拌下在 4-6℃培育22小时,固体物质通过在14000g下离心10分钟除去,上清液 中的伊立替康通过分光光度法进行分析。发现溶液中的伊立替康浓度分别为 58.9
±
0.90μg/ml、63.2
±
0.6μg/ml和
63.4
±
1.3μg/ml,即,它们的平均值 对应于伊立替康硫糖酯的摩尔溶解度为1.32
×
10-5
m。
[0456]
实施例6:各种伊立替康脂质体
[0457]
本实施例的所有实验都如下进行:使用25mm挤出机、中空纤维或用于 初始渗滤步骤的切向流动过滤(tff)设置、微尺度药载和用于最终渗滤的tff 设置、随后为eav过滤。由于载药材料的体积有限,稀释之后的最终过滤使 用生物安全柜中的20cm
2 eav过滤器而不是两个ebv过滤器完成。
[0458]
表11:
[0459][0460][0461]h根据方法a测量,如本技术描述的。
[0462]
参考表11,制备具有不同量溶血-pc的一系列不同的伊立替康脂质体。 除非另外指明,否则伊立替康脂质体将伊立替康蔗糖八硫酸酯包封在由 3:2:0.015摩尔比的dspc、胆固醇和mpeg2000dspe组成的囊泡中。
[0463]
样品30(批次1)如下得到:如实施例1中所述制备脂质体(除了如本实施 例中所示之外),然后在脂质体挤出之后将挤出的脂质体在72℃保持8小时, 在8小时结束时ph调节
至6.2-6.9,得到具有约45mol%溶血-pc(即,约1.7 mg/ml)的组合物。认为mlv制备的时间是时间0。该实验使用来自基线实 验1的等分试样进行。制备样品30(批次1)的组合物中脂质体具有较低的 dspc:胆固醇摩尔比(约2:1代替其它样品中的3:1)。所得伊立替康脂质体组 合物具有高水平的溶血-pc(即,大于1mg/ml和大于40mol%溶血-pc)。
[0464]
样品31a和31b(批次2a和2b)使用实施例1的方法制备,其中进行修改 以测试在伊立替康药载之前增加在脂质体中tea-sos溶液浓度的作用和将 伊立替康载药比减少15%对所得伊立替康脂质体组合物特性的影响。样品 31a(2a)的材料如下得到:形成具有包含dspc和胆固醇(以表11提供中的比 率)的囊泡的脂质体,所述囊泡以0.5m硫酸酯基团浓度包封tea-sos溶液 以形成多层囊泡(mlv),将这些脂质体与伊立替康盐酸盐溶液以510g伊立 替康无水游离碱/mol pl的量接触以将药物加载到脂质体中。样品31b(2b)的 材料如下得到:将样品31a(2a)的脂质体组合物在40℃维持1周,然后再次 分析样品。样品31a和31b(2a和2b)的所得伊立替康脂质体组合物两者都 包含非常低水平的溶血-pc(即,样品31a(2a)中的小于约0.06mg/ml或4 mol%和样品31b(2b)中的约0.175mg/ml)。
[0465]
样品32a和32b(批次分别为3a和3b)使用实施例1的方法制备,其中进 行修改,选择研究制剂缓冲液ph值与降低的伊立替康载药比的组合作用。 样品32a(3a)的材料如下得到:形成具有包含dspc和胆固醇(以表10中提供 的比率)的囊泡的脂质体,所述囊泡包封tea-sos溶液的溶液以形成mlv, 将这些脂质体与伊立替康接触以将药物加载到脂质体中,在脂质体中以表11 中所示的伊立替康载药比(比样品33(4)和34(5)更低的伊立替康载药比)在选 择以提供ph为约6.50(替代样品30(1)中的ph为约7.25)的缓冲液中形成伊 立替康蔗糖八硫酸酯。样品32b(3b)的材料如下得到:将样品3a的组合物在 40℃维持1周,然后再次分析样品。所得伊立替康脂质体组合物32a(3a)和 32b(3b)两者分别包含低水平的0.076mg/ml和0.573mg/ml的溶血-pc。
[0466]
样品33(4)和34(5)根据实施例1中所述方法制备。样品33(4)和34(5)的 材料如下得到:形成具有包含dspc和胆固醇(以表11提供中的比率)的囊泡 的脂质体,所述囊泡包封tea-sos溶液的溶液以形成mlv,将这些脂质体 与伊立替康接触以将药物加载到脂质体中,在脂质体中以500g伊立替康部 分(基于无水游离碱)/mol磷脂在选择提供ph为约7.25(替代样品3a和3b中 的ph为约6.5)的缓冲液中形成伊立替康蔗糖八硫酸酯。所得伊立替康脂质 体组合物3a和3b两者分别包含低水平的0.24mg/ml和0.79mg/ml的溶血
ꢀ‑
pc。
[0467]
图12为显示样品33(4)(圆圈,下线)和样品34(5)(“ ”数据点,上线)中测 量溶血-pc的量的图。与样品33(4)相比,样品34(5)中溶血-pc形成率较高。
[0468]
图12中数据点的线性拟合如下:
[0469]
样品33(4):溶血-pc,mg/ml=0.0513596 0.0084714*累积年龄
[0470]
样品34(5):溶血-pc,mg/ml=0.1766736 0.0279783*累积年龄
[0471]
在22个月时,制剂样品33和34中伊立替康脂质体的总溶血-pc浓度 分别为0.24mg/ml和0.79mg/ml。
[0472]
实施例7:伊立替康脂质体注射液
[0473]
储存稳定的伊立替康脂质体制剂的一个优选实施例是以销 售的产品(伊立替康脂质体注射液)(merrimack pharmaceuticals,inc., cambridge,ma)。
产品为拓扑异构酶抑制剂,其与伊立替康盐酸 盐三水合物一起配制成脂质体分散体,用于静脉使用。指示产 品,其与氟尿嘧啶和甲酰四氢叶酸组合,用于治疗基于吉西他滨的治疗之后 在疾病进展之后患有转移性胰腺癌的患者。
[0474]
产品的推荐剂量为70mg/m2,其通过静脉输注施用90分 钟,每两周一次。将产品与甲酰四氢叶酸和氟尿嘧啶组合施用 以用于治疗某些形式的胰腺癌。在这些已知为ugt1a1*28等位基因纯合子 的胰腺癌患者中产品的推荐起始剂量为50mg/m2,其通过静脉 输注施用90分钟。将产品的剂量增至70mg/m2,其在随后的循 环中为耐受的。对于血清胆红素高于正常值上限的患者,不存在推荐剂量的 产品。
[0475]
将产品如下施用至患者。首先,将计算体积的产品从小瓶中取出。然后将该量的产品在500ml 5%葡萄糖注 射液,usp或0.9%氯化钠注射液,usp中稀释,并且通过缓慢倒置混合。 稀释液应该避光。然后在制备4小时内当在室温储存时或制备24小时内当 在冷藏条件下[2℃至8℃(36
°
f至46
°
f)]储存时施用稀释液。稀释的溶液在 施用之前允许达到室温,不应冷冻。然后在不使用在线过滤器的情况下在90 分钟内输注稀释液,并且丢弃未使用的部分。
[0476]
将产品(拓扑异构酶抑制剂)与伊立替康盐酸盐三水合物一 起配制成脂质体分散体,用于静脉使用。伊立替康盐酸盐三水合物的化学名 称为(s)-4,11-二乙基-3,4,12,14-四氢-4-羟基-3,14-二氧代1h-吡喃并[3’,4’:6,7]
‑ꢀ
吲哚嗪并[1,2-b]喹啉-9-基-[1,4’联哌啶]-1
’‑
羧酸酯,单盐酸盐,三水合物。实 验式为c
33h38
n4o6·
hcl
·
3h2o,分子量为677.19g/mol。分子结构为:
[0477][0478]
产品提供为无菌、白色至微黄色不透明的等渗脂质体分散 体。每10ml单剂量小瓶包含等同量的43mg伊立替康游离碱,浓度为4.3 mg/ml伊立替康无水游离碱每ml(即,4.3mg伊立替康部分/ml)。脂质体为 单层脂质的双层囊泡,直径为约110nm,包封包含作为蔗糖八硫酸酯盐的呈 凝胶状态或沉淀状态的伊立替康的含水空间。囊泡由1,2-二硬脂酰-sn-甘油
‑ꢀ
3-磷酸胆碱(dspc)6.81mg/ml、胆固醇2.22mg/ml和甲氧基封端的聚乙二 醇(mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000-dspe)0.12mg/ml组成。 每ml也包含作为缓冲液的2-[4-(2-羟基乙基)哌嗪-1-基]乙磺酸(hepes)4.05 mg/ml和作为等渗剂的氯化钠8.42mg/ml。
[0479]
伊立替康脂质体注射液为包封在脂质双层囊泡或脂质体中的拓扑异构 酶1抑制剂。拓扑异构酶1通过诱导单链断裂来缓解dna中的扭转应变。 伊立替康及其活性代谢物sn-38可逆结合至拓扑异构酶1-dna复合物并且 防止单链断裂的重新连接,从而导致暴露
时间依赖性双链dna损伤和细胞 死亡。在具有人类肿瘤异种移植物的小鼠中,伊立替康脂质体以伊立替康hcl 等效剂量比伊立替康hcl低5倍进行施用,实现sn-38的类似肿瘤内暴露。
[0480]
在接受产品的癌症患者中,评价总的伊立替康和总的sn
‑ꢀ
38的血浆药代动力学,产品作为单剂或组合化学治疗的形式施 用,剂量为50至155mg/m2,353名癌症患者使用群体药代动力学分析。
[0481]
以70mg/m2作为单剂或组合化学治疗的形式施用之后,总的伊立替康 和总的sn-38的药代动力学参数呈现如下。
[0482]
表12:总的伊立替康和总的sn-38的平均值(
±
标准偏差)总结
[0483][0484]cmax
:最大血浆浓度
[0485]
auc
0-∞
:在外推至时间无穷大的血浆浓度曲线下的面积
[0486]
t
1/2
:终端消除半衰期
[0487]
cl:清除率
[0488]vd
:分配体积
[0489]
在剂量范围50至155mg/m2内,总的伊立替康的cmax和auc随着剂 量而增加。此外,总的sn-38的cmax随剂量成比例增加;但是,总的sn
‑ꢀ
38的auc随剂量的增加量小于随剂量成比例增加量。
[0490]
直接测量伊立替康脂质体显示95%伊立替康保持被脂质体包封,总的和 包封形式之间的比率不随着施用后的从0至169.5小时的时间而变化。
[0491]
产品应该储存在2℃至8℃(36
°
f至46
°
f),应该避光,不 应冷冻。
[0492]
将多个产品制剂置于长期稳定状态并且在2-8℃(冷藏条件) 储存12-36个月后进行分析。结果在图9、10、11a和11b中的图中绘制, 如下所述。在一项研究中,测量12个产品制剂在12-36个月内 的粒度(图9)和粒度分布(图10)。所有样品的pdi保持远低于0.1,低于约 0.05。在另一项研究中,测量13个不同产品制剂在12-36个月 内的ph(图11a)。研究期间,所有样品的ph保持大于6.8。在另一项研究 中,测量16个不同产品制剂在冷藏储存期间在12个月内的溶 血-pc的量(图11b)。所有样品的溶血-pc的量保持低于1mg/ml。
[0493]
为了测定在不同时间点储存的产品实施方式中伊立替康游 离碱的浓度的目的,伊立替康游离碱如“实施例”部分中提供的进行定量。为 了测定在不同时间点储存的产品实施方式中的脂质组合物的目 的,使用本领域标准的标准hplc方法对脂质进行定量。
[0494]
为了测定在不同时间点储存的产品实施方式的脂质体的平 均粒度
(d)和多分散指数(pdi)的目的,将dls方法与malvern zeta sizer nanozstm结合使用。
[0495]
为了测定在不同时间点存储的产品实施方式中溶血-pc的 存在的目的,溶血-pc按照“实施例”部分的描述定量。此外,在本发明上下 文中也可以预想,溶血-pc可以如说明书中所述通过hplc定量。
[0496]
实施例8:拓扑替康和长春瑞滨脂质体
[0497]
这项储存稳定性研究的目的是确定用蔗糖八硫酸酯捕获剂制备的拓扑 替康(tpt)脂质体和长春瑞滨(vnb)脂质体在4℃储存时的物理和化学稳定 性的任何变化。具体地说,该研究检查在脂质体制备期间,蔗糖八硫酸酯(sos) 捕获剂浓度从0.6m减至0.45m硫酸酯基团,同时维持所示拓扑替康或长 春瑞滨与磷脂的比例低于每摩尔磷脂,是否会对在脂质体样品中溶血-pc的 存在量产生影响。类似地,检查ph从6.5增加到7.5的效果,以确定该ph 值增加是否降低溶血-pc在脂质体中组合物中的存在。将tpt和vnb用 sos捕获剂包封在包含3:2:0.015摩尔比的dspc、胆固醇(chol)和peg-dspe 的脂质体中。研究的制剂参数包括:溶液的ph(6.5-7.5)、脂质体制备期间蔗 糖八硫酸酯捕获剂的浓度(0.45-0.6m硫酸酯)、包封的药物(tpt或vnb)和 药物与脂质的比率(在脂质体加载期间,500g tpt hcl每摩尔磷脂;对于vnb, 在脂质体加载期间,350至450g vnb部分每摩尔磷脂)。在该稳定性研究期 间监测脂质体的各种物理化学性质为:脂质体尺寸、药物与磷脂的比率、药 物包封率、一般外观和溶血-脂质形成。
[0498]
dspc、胆固醇(chol)和peg-dspe称出的量分别对应于3:2:0.015的摩 尔比(790.15mg/257.8mg/14.0mg)。将脂质溶解于氯仿/甲醇(4/1,v/v)中,充 分混合,分成2等份(a和b)。每个样品在60℃使用旋转蒸发仪蒸发至干 燥。残留氯仿通过在室温置于真空下(180微托)12小时从脂质中除去。将干 燥的脂质在60℃溶解于乙醇中,和加入适宜浓度的预热tea8sos使得最终 乙醇含量为10%(v/v)。总的磷脂浓度为约75mm。将脂质溶液挤出穿过0.1 μm的聚碳酸酯膜(nuclepore
tm
)10次,以产生典型平均直径为95-115nm的 脂质体。根据需要,将挤出的脂质体的ph调节(用1n naoh)至ph为6.5。 脂质体通过离子交换色谱和尺寸排阻色谱的组合进行纯化。首先,dowex
tm ira 910树脂用1n naoh处理,接着用去离子水洗涤3次,然后用3n hcl 洗涤3次,然后用水多次洗涤。洗脱级分的电导率通过使用流动池电导率计 (pharmacia,uppsala,sweden)测量。如果电导率小于15μs/cm,则认为该级 分为可接受的以用于进一步纯化。然后将脂质体洗脱液施加到用去离子水平 衡的sephadex g-75(pharmacia)柱上,并且测量收集的脂质体级分的电导率 (通常小于1μs/cm)。加入40%葡萄糖溶液以实现最终浓度为5%(w/w),并 且从储备溶液(0.5m,ph6.5)中加入缓冲液(hepes)至最终浓度10mm。
[0499]
拓扑替康盐酸盐的储备溶液通过将50mg溶解在10ml去离子水中制备。 在结果表13中,药物以每种制剂指示的药物/脂质比加入到脂质体溶液中。 对于tpt加载,在加载之前将ph调节至ph为6.0。长春瑞滨直接从药房的 商用usp注射溶液中加入,并且所得混合物的ph在加热之前用1n naoh 调节至6.5。药载如下开始:加热脂质体/药物混合物至60℃达30分钟。将 溶液从水浴中移出后通过浸入冰冷水中进行迅速冷却。脂质体外药物通过尺 寸排阻色谱,使用用ph 6.5的hepes缓冲盐水(hbs)平衡和洗脱的sephadexg75柱除去。样品通过hplc分析伊立替康和通过bartlett方法分析磷酸盐 (参见磷酸盐测定)。
[0500]
为了储存,将样品分成4ml等份,并且根据需要使用1n hcl或1nnaoh调节ph,在无
菌条件下无菌过滤,并且填充到无菌透明玻璃小瓶中, 所述小瓶在氩气下用内衬螺纹帽密封并且放入4℃的恒温控制冰箱 中。在规定的时间点,从每个样品中取出等分试样并且测试其外观、尺寸、 药物/脂质比率以及药物和脂质化学稳定性。脂质体尺寸在稀释的样品中通过 动态光散射使用coulter nano-sizer在90度角测定,并且用累积量方法得到 的平均值
±
标准偏差(nm)表示。
[0501]
来自对比稳定性研究的结果提供于表13中。
[0502]
表13:用tea8sos捕获剂制备的拓扑替康和长春瑞滨脂质体(0.6n sos 硫酸酯基团,以2mg/ml的药物浓度储存)
[0503]
[0504][0505]i根据方法b测量,如本技术描述的。
[0506]
j 500g拓扑替康hcl每摩尔总的磷脂
[0507]
样品19和20中未观察到储存介质的ph对加载拓扑替康的脂质体中溶 血脂的产生的影响。样品19和20中的两者制剂在9个月之后表现出接近30 mol%的溶血脂质,但是样品19在ph为6.5储存,样品20在ph为7.25储 存。
[0508]
与两者脂质体喜树碱相比,脂质体长春瑞滨对脂质的水解更具抵抗力, 因为在样品21中测量到最高量的溶血-脂质,其在9个月之后具有9.5mol% 的溶血-脂质。虽然不明显,但我们也可以检测对稳定性比率和存储介质的ph 的依赖性。较高的稳定性比率导致脂质水解减少(将样品21与23进行比较)。 ph为7.25也减少观察到的脂质水解量(将样品21与22进行比较)。
[0509]
实施例9:用于测量溶血-pc的hplc方法(“方法a”)
[0510]
测试伊立替康蔗糖八硫酸酯脂质体制剂中溶血-pc的量以得到图11b和 图12中的数据,是使用hplc通过蒸发光散射检测得到的。适宜的hplc 方法(本技术中称为“方法a”)为用于测量药品中硬脂酸、溶血-pc、胆固醇和 dspc(1,2-二硬脂酰-sn-甘油-3-磷酸胆碱)的量的定量方法。将脂质体使用甲 醇-四氢呋喃溶液分解为它们各自的脂质组分。脂质组分使用配备有蒸发光 散射检测器的反相高压液相色谱进行定量。
[0511]
样品和标准品制备
[0512]
标准品制备:
[0513]
溶血pc
[0514]
五点标准曲线如下制备:将适宜量的溶血pc用85:15甲醇-四氢呋喃稀 释至目标最终浓度为4、8、20、32和40μg/ml。
[0515]
硬脂酸
[0516]
五点标准曲线如下制备:将适宜量的硬脂酸用85:15甲醇-四氢呋喃稀 释至目标最终浓度为2、4、10、16和20.4μg/ml。
[0517]
胆固醇
[0518]
五点标准曲线如下制备:将适宜量的胆固醇用85:15甲醇-四氢呋喃稀 释至目标最终浓度为90、144、183.7、224.9和266.6μg/ml。
[0519]
dspc
[0520]
五点标准曲线如下制备:将适宜量的dspc用85:15甲醇-四氢呋喃稀 释至目标最终浓度为220、352、449、549.8和651.7μg/ml。
[0521]
分析对照
[0522]
分析对照如下制备:将硬脂酸在稀释剂(85:15甲醇-四氢呋喃)中稀释至 目标最终浓度为9.0μg/ml和18.0μg/ml。
[0523]
样品制备:
[0524]
样品如下制备:将每个样品在85:15的甲醇-四氢呋喃溶液中稀释至目 标最终dspc浓度为475μg/ml。
[0525]
溶液稳定性
[0526]
测试样品标准品和分析对照当储存在环境温度时已经表现出在溶液中 可接受的稳定性达至多48小时。
[0527]
仪器和仪器参数
[0528]
如果需要,适宜的高压色谱系统配备蒸发光散射检测器能够在整个运行 过程中改变增益和过滤器设置,以确保适当的峰检测。仪器操作参数列于表 14中。
[0529]
表14:色谱条件
[0530]
[0531][0532]
表15:系统适用性
[0533]
2000-dspe;
[0550]
(b)将60-70℃的脂质分散体挤出穿过至少一个0.1μm膜以形成脂质体;
[0551]
(c)基本上除去在所述脂质体外部的源自tea8sos的离子;
[0552]
(d)将在60-70℃温度的脂质体与使用伊立替康游离碱或伊立替康盐制 备的溶液接触,由此形成包封伊立替康的脂质体的制剂;
[0553]
(e)基本上除去在所述脂质体外部的源自tea8sos和依立替康成分的物 质;和
[0554]
(f)将所述组合物的ph调节为7.0-7.5。
[0555]
项5.项4的脂质体伊立替康组合物,其中将所述脂质分散体挤出穿过 至少两个叠放的0.1μm的聚碳酸酯膜。
[0556]
项6.前述项任一项的脂质体伊立替康组合物,其中所述脂质体的平均 尺寸为110nm,所述平均尺寸通过动态光散射测定,其中尺寸通过累积量方 法测定。
[0557]
项7.前述项任一项的脂质体伊立替康组合物,其具有的总伊立替康部 分含量等同于4.3mg/ml伊立替康无水游离碱。
[0558]
项8.项3-6任一项的脂质体伊立替康组合物,其中:
[0559]
在步骤(a)中,所述脂质体由硫酸酯浓度为0.43-0.47m的tea8sos形 成;和
[0560]
在步骤(d)中,使用伊立替康游离碱或伊立替康盐制备的溶液具有的伊立 替康部分含量等同于500g(
±
10%)的伊立替康无水游离碱每摩尔dspc;和
[0561]
在步骤(f)中,将所述组合物的ph调节为7.2至7.3。
[0562]
项9.前述项任一项的脂质体组合物,其在约4℃储存之前含有小于1 mol%的溶血磷脂酰胆碱(溶血-pc),其在约4℃储存180天之后含有20mol% 或更少(相对于总脂质体磷脂)的溶血-pc。
[0563]
项10.项9的脂质体组合物,其在约4℃储存6、9或12个月之后含有 20mol%或更少(相对于总脂质体磷脂)的溶血磷脂酰胆碱(溶血-pc)。
[0564]
项11.前述项任一项的脂质体伊立替康组合物,其全部都在含水等渗缓 冲液中,总的包含6.1至7.5mg dspc/ml、2至2.4mg胆固醇/ml和0.11至 0.13mg mpeg-2000-dspe/ml。
[0565]
项12.前述项任一项的脂质体伊立替康组合物,其中所述脂质体伊立替 康包含在等渗hepes含水缓冲液中的浓度为2至20mm的伊立替康脂质 体。
[0566]
项13.前述项任一项的脂质体伊立替康组合物,其进一步包含浓度为 130-160mm的氯化钠。
[0567]
项14.前述项任一项的脂质体伊立替康组合物,其中包封在所述脂质体 中的所述伊立替康作为蔗糖八硫酸酯盐呈凝胶状态或沉淀状态。
[0568]
项15.前述项任一项的脂质体伊立替康组合物,其中所述伊立替康脂质 体的直径为95-115nm,其通过准弹性光散射测量。
[0569]
项16.前述项任一项的脂质体伊立替康组合物,其总的包含6.81mgdspc/ml、2.22mg胆固醇/ml、和0.12mg mpeg-2000-dspe/ml、4.05mg/mlhepes含水缓冲液和8.42mg氯化钠/ml。
[0570]
项17.前述项任一项的脂质体伊立替康组合物,其具有的ph为7.25, 其中所述伊立替康脂质体的直径为110nm,其通过准弹性光散射测量。
[0571]
项18.前述项任一项的脂质体伊立替康组合物,其在约4℃储存6个月 之后形成小于1mg/ml的溶血磷脂酰胆碱(溶血-pc)。
[0572]
项19.前述项任一项的脂质体伊立替康组合物,其通过包括以下步骤的 方法制备:
[0573]
(a)形成脂质在硫酸酯浓度为约0.45m的tea8sos的溶液中的分散体, 所述溶液的ph为约6.5,所述分散体中的脂质分别由摩尔比为3:2:0.015的 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、胆固醇和甲氧基封端的聚乙二醇 (mw 2000)-二硬脂酰磷脂酰乙醇胺(mpeg-2000-dspe)组成;
[0574]
(b)将60-70℃的脂质分散体挤出穿过至少一个0.1μm膜以形成脂质体;
[0575]
(c)除去在所述脂质体外部的源自tea8sos的离子;
[0576]
(d)将在60-70℃温度的脂质体与使用伊立替康盐酸盐三水合物制备的 溶液接触,从而形成包封约500g(
±
10%)伊立替康每摩尔总脂质体磷脂的脂 质体的制剂;
[0577]
(e)除去在所述脂质体外部的源自tea8sos和依立替康成分的物质;和
[0578]
(f)将所述组合物的ph调节为约7.3。
[0579]
项20.前述项任一项的脂质体伊立替康组合物,其总的包含小于100 ppm的tea。
[0580]
项21.前述项任一项的脂质体伊立替康组合物,其总的包含30-100ppm 的tea或dea。
[0581]
项22.前述项任一项的脂质体伊立替康组合物,其中在约4℃储存6个 月之后,至少98%的伊立替康包封在所述伊立替康脂质体中。
[0582]
项23.前述项任一项的脂质体伊立替康组合物,其包含在所述伊立替康 脂质体内的式(i)的伊立替康组合物,其中x为8:
[0583]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。