1.本发明属于医药技术领域,具体涉及一种基于单宁酸修饰技术的纳米粒的制备方法及其在肿瘤靶向和光热治疗方面的应用。
背景技术:
2.据报道,由于老龄化和人口增长,世界每年新增癌症病例将从2018年的1810万例增至2040年的2940万例,癌症已成为威胁人类健康的一大要素。
3.单宁酸(ta)是一种结构中含有大量羟基的多元酚,它能够在fe3 的参与下形成聚单宁酸分子层(pta)包覆在纳米颗粒表面。该分子层能通过迈克尔加成或席夫碱反应,将含有氨基或巯基的靶向基团以化学键连接方式修饰于纳米颗粒表面,并能通过静电作用力、氢键以及疏水作用力等物理方式吸附靶向基团,因此靶向基团的修饰效率高且稳定,不易脱落,修饰适用性广泛。整个修饰过程能够在ph 7.4温和的中性条件下快速完成,因此不会影响药物的稳定性。另一方面,pta在近红外光(nir)照射下可以将光能转化为热能,光热稳定性较好。且单宁酸为植物来源,生物相容性好,无明显细胞毒性。这些特性使其在实现肿瘤光热治疗及靶向治疗方面具备了潜在优势。
4.化疗是目前肿瘤治疗的传统治疗手段之一,而大多化疗药物,如紫杉醇、喜树碱等均存在水溶性差、缺乏特异选择性等问题,从而使其临床应用受到了较大制约。将药物制备成为载药纳米粒或药物纳米晶体的形式可解决其溶解性差的问题。并且,通过pta表面修饰技术,可在载药纳米粒或药物纳米晶体表面稳定连接靶向肿瘤细胞的配体,如多肽(crgd)、叶酸、透明质酸等,从而实现纳米制剂的主动靶向。光热疗法(photothermal therapy,ptt)是近年来发展的一种在肿瘤治疗领域具有很大应用潜力的治疗手段,其可以通过非侵入性热消融方式消除肿瘤。在nir照射下,光敏剂通过光热转换作用产生的局部高温(>42℃)可通过破坏肿瘤细胞膜、破坏细胞骨架、抑制dna合成等方式促进癌细胞凋亡。将pta修饰于药物纳米晶体表面,不仅可发挥pta的ptt作用,还可实现对肿瘤进行ptt和化疗的联合治疗。
5.因此,本项目以紫杉醇(ptx)为模型药,采用反溶剂法制备了紫杉醇纳米晶体(pnc),并通过聚单宁酸修饰技术分别制备了聚单宁酸修饰的紫杉醇纳米晶体(pnc-pta)和基于聚单宁酸技术修饰的靶向紫杉醇纳米晶体(pnc-pta-crgd)。pnc-pta可实现对肿瘤细胞进行ptt和化疗的联合治疗。通过在系统表面进一步修饰靶向配体crgd,可实现对ptx的主动靶向递送,从而提高治疗的特异性。这为拓宽纳米材料在肿瘤治疗方面的应用,提高肿瘤的临床治疗效果,减轻癌症患者痛苦提供了新的治疗思路和应用前景。
技术实现要素:
6.针对上述情况,本发明的目的在于制备一种基于pta修饰技术的纳米粒,用于实现药物的靶向递送或光热治疗以及光热与化疗对肿瘤的联合治疗。
7.本发明的技术解决方案是,该纳米系统由药物纳米粒、pta或药物纳米粒、pta、靶
向基团构成。所述的药物纳米粒为紫杉醇纳米晶体,靶向基团为crgd。
8.基于聚单宁酸修饰技术的具有光热治疗功能的纳米粒制备方法如下:
9.1)药物纳米晶体的制备
10.本项目选择一线化疗药物紫杉醇ptx为模型药,通过反溶剂法制备紫杉醇纳米晶体,简称pnc。将ptx溶于有机溶剂中,蒸发溶剂后进行水化,后通过探头超声得到pnc混悬液。
11.具体步骤如下:
12.称取3-12mg原料药紫杉醇与12-48mg表面活性剂泊洛沙姆(f127),加入1.5-6ml二氯甲烷,使其溶解完全,转移至茄形烧瓶中。经旋转蒸发除去溶剂,得到紫杉醇、f127混合物薄膜。然后加入3-12ml去离子水,进行2-5小时水化处理。待紫杉醇以晶体形式析出后,在冰水浴条件下使用超声波细胞破碎仪,进行超声粉碎(功率:150w;频率:2s开,2s关;时长:10-20min),得到纳米级别的紫杉醇纳米混悬剂。最后通过离心(5000-20000rpm,10-30min)收集沉淀得到pnc。
13.2)pnc-pta的制备
14.将1)中得到的pnc分散至ph 7.4的缓冲溶液中,将一定量的ta溶液、fecl3溶液依次加入,水浴超声后,离心去除多余的pta,即得pnc-pta。
15.具体步骤如下:
16.将纯化后的pnc分散至n-二甘氨酸缓冲溶液中(10mm,ph 7.4),浓度为1-3mg/ml。加入一定体积的ta溶液(40mg/ml),使ptx与ta质量比约为5∶2,水浴超声20-30s,后加入一定体积的fecl3溶液(10mg/ml,ta与fecl3质量比为1∶2),再次水浴超声20-30s。经两次离心去除多余的pta(5000-20000rpm,10-30min),得到pnc-pta。
17.基于聚单宁酸修饰技术的具有靶向功能的纳米粒制备方法如下:
18.1)pnc的制备方法同基于“基于聚单宁酸修饰技术的具有光热治疗功能的纳米粒制备”中pnc的制备方法;
19.2)pnc-pta的制备方法除ta与fecl3质量比为2∶1-1∶2外,其余同基于“基于聚单宁酸修饰技术的具有光热作用的纳米粒制备”中pnc-pta的制备方法;
20.3)pnc-pta-crgd的制备
21.将2)得到的pnc-pta分散于ph 7.4的缓冲液中,浓度为1-3mg/ml。后加入一定量crgd溶液,使得ptx与crgd的质量比约为2∶1。于室温搅拌条件下,孵育1h,经两次离心(5000-20000rpm,10-30min),得到pnc-pta-crgd。
22.本发明有益效果:本发明制备的基于pta修饰技术的具有靶向治疗或ptt功能的纳米粒,分别有效用于将药物靶向递送肿瘤治疗并实现光热治疗,实现了pta修饰技术在靶向及光热领域的应用。pnc-pta相较于pnc对肿瘤细胞具有明显更强的毒性;pnc-pta-crgd在体外细胞层面体现了其对肿瘤的特异选择性。
23.本发明利用pta的修饰作用,制备了具有ptt或肿瘤主动靶向功能的pnc。结合pta的光热转换作用及pnc的化疗作用,pnc-pta可实现ptt与化疗的联合治疗。利用pta可通过化学及物理作用连接具有氨基或巯基靶向配体的作用,制备而成的pnc-pta-crgd可实现肿瘤靶向治疗,有效克服了肿瘤治疗效果不佳、药物选择性差、安全性低等问题,方法稳定可靠,所得产品性能稳定,使用方便,操作简单,原料安全无毒,成本低,副作用小,对肿瘤细胞
有明显的抑制效果,是ptt联合化疗及肿瘤靶向治疗药物方面的创新,具有巨大的经济和社会效益。
附图说明
24.图1实施例1制备的pnc(a)、pnc-pta(b)和实施例2制备的pnc-pta-crgd(c)的透射电镜结果。透射电镜下可以观察到,纳米晶体均呈长棒状,长径约300-500nm,短径约50nm。样品形貌在修饰前后未发生改变。在透射电镜下未能观察到pta和crgd的存在。
25.图2实施例1制备的pnc、pnc-pta和实施例2制备的pnc-pta-crgd的x衍射图谱。药物在pnc中仍以晶体形式存在,但结晶度有所下降。pnc-pta和pnc-pta-crgd与pnc的衍射峰位置相同,但峰强度进一步下降,这说明在包覆pta和crgd的过程中,药物的晶体形式未发生改变,可能是由于pta的遮蔽作用,使得衍射峰强度减弱。
26.图3实施例1制备的pnc、pnc-pta和实施例2制备的pnc-pta-crgd的差式量热扫描分析(dsc)图谱。结果显示药物在纳米晶体中主要以晶体形式存在,但结晶度有所下降。
27.图4实施例1制备的pnc-pta体外升温曲线。温度上升对pta具有浓度依赖性。
28.图5实施例1制备的pnc-pta体外光热细胞毒性考察。****:p<0.0001 by sidak’s multiple comparisons test.
29.图6实施例1制备的pnc-pta肿瘤生长抑制效果(a)及小鼠体重变化(b)
30.图7实施例2制备的pnc、pnc-pta、pnc-pta-crgd及taxol体外细胞靶向性考察
具体实施方式
31.以下实施例旨在进一步说明本发明。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
32.实施例1 基于聚单宁酸修饰技术的具有光热功能的纳米粒制备
33.1)pnc的制备
34.首先,将6mg原料药紫杉醇与24mg表面活性剂泊洛沙姆(f127),加入3ml二氯甲烷,使其溶解完全,转移至茄形烧瓶中。经旋转蒸发除去溶剂,得到紫杉醇、f127混合物薄膜。然后加入6ml去离子水,进行3小时水化处理。待紫杉醇以晶体形式析出后,在冰水浴条件下使用超声波细胞破碎仪,进行超声粉碎(功率:150w;频率:2s开,2s关;时长:15min),得到纳米级别的紫杉醇纳米混悬剂。最后通过离心(14000rpm,15min)收集沉淀得到纯化的pnc。
35.2)pnc-pta的制备
36.将1)中制得的纯化pnc分散至1.5ml n-二甘氨酸缓冲溶液中(10mm,ph 7.4)。加入30μl的ta溶液(40mg/ml),水浴超声30s,后加入240μl fecl3溶液(10mg/ml,ta与fecl3质量比为1∶2),再次水浴超声30s。经两次离心去除多余的pta(14000rpm,15min),得到pnc-pta。
37.实施例2 基于聚单宁酸修饰技术的具有肿瘤靶向功能的纳米粒制备
38.1)pnc的制备
39.首先,将6mg原料药紫杉醇与24mg表面活性剂泊洛沙姆(f127),加入3ml二氯甲烷,使其溶解完全,转移至茄形烧瓶中。经旋转蒸发除去溶剂,得到紫杉醇、f127混合物薄膜。然后加入6ml去离子水,进行3小时水化处理。待紫杉醇以晶体形式析出后,在冰水浴条件下使用超声波细胞破碎仪,进行超声粉碎(功率:150w;频率:2s开,2s关;时长:15min),得到纳米
级别的紫杉醇纳米混悬剂。最后通过离心(14000rpm,15min)收集沉淀得到纯化的pnc。
40.2)pnc-pta的制备
41.将1)中制得的纯化pnc分散至1.5ml n-二甘氨酸缓冲溶液中(10mm,ph 7.4)。加入30μl的ta溶液(40mg/ml),水浴超声30s,后加入240μl fecl3溶液(10mg/ml,ta与fecl3质量比为1∶2),再次水浴超声30s。经两次离心去除多余的pta(14000rpm,15min),得到pnc-pta。
42.3)pnc-pta-crgd的制备
43.将2)得到的pnc-pta分散于1.5ml n-二甘氨酸缓冲溶液中(10mm,ph 7.4),加入1.5ml crgd溶液(1mg/ml),使得ptx与crgd的质量比约为2∶1。于室温搅拌条件下,孵育1h,经两次离心(14000rpm,15min),得到pnc-pta-crgd。
44.实施例3 纳米粒的zeta电位表征
45.在本实施例中对实施例1制备得到的pnc、pnc-pta和实施例2制备得到pnc-pta-crgd进行形态表征,方法如下:
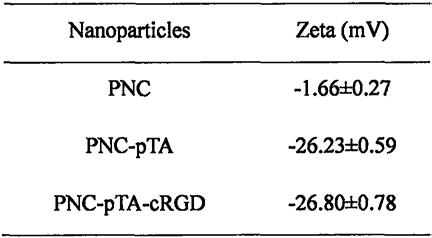
46.将1-2滴pnc、pnc-pta和pnc-pta-crgd悬液分别分散于1ml磷酸盐缓冲溶液(10mm,ph=7.4)中,利用马尔文激光粒度仪对各纳米粒的zeta电位进行考察。平行测定三次。pnc表面电位为-1.66
±
0.27mv,近似电中性,在包覆了pta后,电位下降至-26.23
±
0.59mv,证明pta已包覆。具体结果如表1所示。
47.表1 不同样品zeta电位测定结果(n=3)
[0048][0049]
实施例4 纳米粒的形态表征
[0050]
在本实施例中对实施例1制备得到的pnc、pnc-pta和实施例2制备得到pnc-pta-crgd进行形态表征,方法如下:
[0051]
利用tem对粒子的实际形态和大小进行观察。采用醋酸铀负染色法进行观察:取少量实施例1制备得到的pnc、pnc-pta和实施例2制备得到pnc-pta-crgd的混悬剂分别滴于400-mesh载样铜网上,约20s后用滤纸将铜网上多余的液体吸干,并滴加少量浓度为1%的醋酸铀溶液,约20s后再次用滤纸吸干铜网上残余的液体。制样完成后于透射电镜下进行观察。详细结果见附图1。
[0052]
实施例5 药物在纳米粒中存在状态的表征
[0053]
在本实施例中对实施例1制备得到的pnc、pnc-pta和实施例2制备得到pnc-pta-crgd中紫杉醇药物的存在状态进行表征,方法如下:
[0054]
利用x射线衍射仪,分别对pnc、pnc-pta和pnc-pta-crgd样品冻干粉末进行测定。辐射源:cu-kα;起始角:4
°
(2θ);终止角:50
°
(2θ);扫描速度:4
°
/min;步长:0.02
°
。电压和电流分别为40kv和40ma;分别取适量原料药ptx和制备得到的pnc、pnc-pta和pnc-pta-crgd样品冻干粉,在30℃到250℃范围内进行dsc测定。升温速率为10℃/min。详细结果见图2和图
3。
[0055]
实施例6 pta的包覆量测定
[0056]
在本实施例中对实施例1制备得到的pnc-pta中pta的包覆量进行测定,方法如下:
[0057]
首先配制浓度为0、1.2、2、5、10、20、50、100μg/ml的ta标准溶液,通过bca试剂盒,以浓度对吸光度作图,绘制ta溶液的标准曲线。后将60μl实施例1制备得到pnc-pta样品悬液与600μl bca试剂混合,室温避光反应1h,并设置空白对照组。离心后取200μl上清液于96孔板中,利用酶标仪测定样品于562nm波长处的吸光度,代入标准曲线中求ta含量。以上实验平行测定三次。pnc-pta中pnc的含量通过hplc法测定:取10μl实施例1制备得到pnc-pta样品悬液溶解于990μl乙腈-水按1∶1比例混合的溶液中,离心后取上清液测定。流速为0.5ml/min,检测波长为227nm。ta的含量按如下公式进行计算,其中w
ta
代表ta质量,w
pnc
代表pnc质量:
[0058]
ta(wt%)=w
ta
/(w
pnc
w
ta
)
×
100
[0059]
pnc-pta中pta的包覆量约为11.50%。具体数据如表2所示。
[0060]
表2 bca试剂盒法测得ta的包覆量(n=3)
[0061][0062]
实施例7 靶向配体crgd的修饰量测定
[0063]
在本实施例中对按照实施例2制备得到pnc-pta-crgd中crgd的修饰量进行表征,方法如下:
[0064]
配制浓度为0、15.625、31.25、62.5、100、200μg/ml的crgd标准溶液,利用hplc进样分析,以浓度对峰面积绘制crgd的标准曲线。后称取2.5mg crgd,溶于2.5ml n-二甘氨酸缓冲液中,利用hplc测定包覆前crgd的浓度,将实施例2中2)得到的pnc-pta分散于1.5ml去离子水中,加入1.5ml上述crgd溶液,于室温搅拌条件下,孵育1h,离心(14000rpm,15min),后利用hplc对上清液中未包覆的crgd进行定量。以上实验平行测定两次。pnc的含量通过hplc法测定:取10μl实施例1制备得到pnc-pta样品悬液溶解于990μl乙腈-水按1∶1比例混合的溶液中,离心后取上清液测定。流速为0.5ml/min,检测波长为227nm。通过以下公式计算pnc-pta-crgd中crgd的修饰量:
[0065]
crgd(wt%)=w
crgd
/(w
pnc-pta
w
crgd
)
×
100
[0066]
(w
crgd
代表crgd质量,w
pnc-pta
代表pnc-pta质量)
[0067]
pnc-pta-crgd中crgd的修饰量约为9.26%。具体数据如表3所示。
[0068]
表3 crgd修饰率(n=2)
[0069][0070]
实施例8 pnc-pta的体外升温效果考察
[0071]
在本实施例中对实施例1制备得到的pnc-pta的体外升温效果进行了考察,方法如下:将pta浓度为25、50、100、200μg/ml的pnc-pta悬浮液1ml,在808nm激光(2w cm-2
)下照射7min。用红外摄像机记录溶液温度,用flir工具软件进行分析。在一定范围内,pta浓度越大,升温效果越显著。具体结果见图4。
[0072]
实施例9 pnc-pta的光热细胞毒性考察
[0073]
在本实施例中对实施例1制备得到的pnc-pta的ptt联合化疗的细胞毒性进行了考察,方法如下:
[0074]
①
细胞培养:首先,将4t1细胞置于适量含10%胎牛血清和1%双抗的rpmi-1640完全培养基中,将培养皿放置到37℃恒温培养箱中进行培养(相对湿度为95%,co2浓度为5%),每隔两天进行一次传代处理,待细胞贴壁后即可用于细胞毒性实验。
[0075]
②
mtt溶液配制:精密称取100mg mtt,溶于20ml pbs(ph=7.4)中,使用0.22μm滤器过滤除菌,得到浓度为5mg/ml的mtt溶液,4℃避光保存。
[0076]
③
给药:将4t1细胞以每孔10000个细胞的密度接种于96孔板,过夜生长,分别用浓度为1、10、50、100、200μg/ml(以ptx浓度计)的pnc-pta悬液处理细胞4h。然后将细胞置于808nm,2w cm-2
的激光下,照射5min。后将含药培养基替换为新鲜培养基,再孵育24h。对照组细胞给予同等浓度pnc-pta处理但不经激光照射。
[0077]
④
采用mtt法评价pnc-pta光热联合化疗对hepg2细胞的毒性作用:将再次吸去培养基,并使用pbs溶液(ph=7.4)清洗1-2遍,后在每孔中添加100μl的新鲜培养基,并于每孔中加入15μl mtt溶液(5mg/ml),于37℃条件下继续培养4h。4h后吸去上清液,每孔加入150μl的dmso,充分混匀。用酶标仪测定562nm条件下的吸光度(a)值。将各测试孔的值减去背景的值(完全培养基加mtt,无细胞接种),按照以下公式计算细胞存活率:
[0078]
cell viability(%)=abs test/abs control
×
100
[0079]
(其中abs test代表样品组的吸光度值;abs control代表对照组的吸光度值)
[0080]
结果显示pnc-pta联合激光治疗的细胞毒性明显强于单纯化疗。具体实验结果见图5。
[0081]
实施例10 pnc-pta对4t1肿瘤的生长抑制效果
[0082]
在本实施例中对实施例1制备得到的pnc-pta对4t1肿瘤的生长抑制效果进行了考察,方法如下:
[0083]
选择4-5周龄雌性balb/c小鼠(购自spf《北京》生物科技有限公司)建造肿瘤模型。所有动物程序均经北京中医药大学动物护理与使用委员会批准。在balb/c小鼠右大腿上侧皮下注射1
×
107个4t1细胞,以建立4t1异种移植模型。当肿瘤体积达到200-300mm3时,随机分为2组。实验组给予瘤内注射pnc-pta(ptx含量为100μg) 激光治疗,对照组给予单纯瘤内注射pnc-pta(ptx含量为100μg)治疗。每两天记录小鼠的肿瘤体积和体重,并计算肿瘤体积:体积=长度
×
宽度2/2。当肿瘤体积达到2000mm3时,人道处死小鼠。
[0084]
结果显示,pnc-pta联合激光治疗相较于单纯化疗可明显抑制4t1肿瘤的生长。小鼠体重基本不变,证明制剂安全性较好。具体结果见图6。
[0085]
实施例11 pnc-pta-crgd的体外靶向性考察
[0086]
在本实施例中对实施例3制备得到的pnc、pnc-pta、pnc-pta-crgd对αvβ3受体过表达的肝癌细胞(hepg2细胞)细胞的毒性进行了考察,方法如下:
[0087]
①
细胞培养:首先,将hepg2细胞置于适量含10%胎牛血清和1%双抗的rpmi-1640完全培养基中,将培养皿放置到37℃恒温培养箱中进行培养(相对湿度为95%,co2浓度为5%),每隔两天进行一次传代处理,待细胞贴壁后即可用于细胞毒性实验。
[0088]
②
mtt溶液配制:精密称取100mg mtt,溶于20ml pbs(ph=7.4)中,使用0.22μm滤器过滤除菌,得到浓度为5mg/ml的mtt溶液,4℃避光保存。
[0089]
③
采用mtt法评价pnc-pta-crgd对hepg2细胞的体外靶向作用:将hepg2细胞以1
×
104个/每孔的密度,铺种在96孔板上,待细胞贴壁后,弃去旧的培养基,分别更换为100μl浓度为10nm、100nm、1000nm、10000nm与50000nm的taxol、pnc、pnc-pta、pnc-pta-crgd的含药培养基,后将96孔板放置于37℃恒温培养箱中继续培养12h,取出96孔板,置于显微镜下观察细胞的生长状况,再次吸去培养基,并使用pbs溶液(ph=7.4)清洗1-2遍,后在每孔中添加100μl的新鲜培养基后继续培育24h。最后于每孔中加入15μl mtt溶液(5mg/ml),于37℃条件下继续培养4h。4h后吸去上清液,每孔加入150μl的dmso,充分混匀。用酶标仪测定562nm条件下的吸光度(a)值。将各测试孔的值减去背景的值(完全培养基加mtt,无细胞接种),按照以下公式计算细胞存活率:
[0090]
cell viability(%)=abs test/abs control
×
100
[0091]
(其中abs test代表样品组的吸光度值;abs control代表对照组的吸光度值)
[0092]
结果显示,相较于未修饰crgd的纳米粒,pnc-pta-crgd对hepg2细胞具有更强的毒性,在体外层面证明了其靶向效果。具体结果见图7。
[0093]
从以上结果可以看出,本发明提供的基于pta修饰的纳米粒在肿瘤光热治疗和肿瘤药物靶向治疗方面均具有较大的应用前景。
[0094]
申请人声明,本发明通过上述实施例来说明本发明的纳米药物组合物及其制备方法和应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。