1.本发明属于生物分子分析试剂技术领域,具体涉及一种基于唾液特异性岩藻糖基化结构糖谱及其检测方法和应用。
背景技术:
2.过去半个世纪以来科技和技术的进步对患者的确诊有了极大的提高,癌症患者的生存率也翻了一番。然而作为头号杀手的肺癌,发病率和死亡率仍然居高不下。如果肿瘤仍局限于局部(肺内)或处于早期,患者的五年生存率超过56-60%。遗憾的是目前的技术手段,只有不到16%的肺癌病例能够成功早期诊断;绝大多数确诊病例,肺癌细胞已扩散到其他器官,其五年生存率不足5%。早期诊断出患有癌症的患者极有可能获得治愈性治疗和长期生存:例如,在第一阶段被诊断出的肺癌患者中,有57%的病人可以生存5年或更长时间,而在第四阶段中只有3%的病人可以存活。因此,针对早期诊断的肺癌肿瘤的开发有着极其重要的健康和经济意义。血液中的dna、rna、蛋白质、代谢物和微生物群等分子也可能存在于唾液中。因此这些分子浓度变化可用作生物标志物来检测早期癌症或监测对治疗管理的反应。研究表明,即使在症状出现之前,简单的唾液测试也可以在最早阶段检测出口腔和喉咙的疾病。这类测试在唾液中寻找明显的遗传差异,在检测口腔癌方面的准确率超过90%。将乳腺癌患者与对照组进行比较时,唾液中蛋白质ca15-3的浓度水平可能呈正相关。最近的其他研究发现,唾液可用于以前所未有的准确度检测肺癌患者是否具有肺癌相关突变。然而,对于唾液蛋白的聚糖分析是否可靠且稳健诊断肺癌的方法尚无报道。
3.因此,有必要研发一种基于唾液特异性岩藻糖基化结构糖谱及其检测方法和应用解决上述问题。
技术实现要素:
4.本发明目的是提供一种基于唾液特异性岩藻糖基化结构糖谱及其检测方法和应用。
5.本发明的一种技术方案是:
6.一种基于唾液特异性岩藻糖基化结构糖谱,包括如下通式结构:
[0007][0008]
其中,
[0009]
f为岩藻糖;
[0010]
g为半乳糖;
[0011]
m为甘露糖;
[0012]
n为乙酰氨基葡糖;
[0013]
α1,2代表g单糖的碳2与f单糖的碳1连接;
[0014]
α1,3代表n单糖的碳3与f单糖的碳1连接;
[0015]
α1,6代表n单糖的碳6与f单糖的碳1连接。
[0016]
本发明的另一技术方案是:
[0017]
一种基于唾液特异性岩藻糖基化结构糖谱的检测方法,包括步骤:
[0018]
1)从蛋白质中提取聚糖;
[0019]
2)确定聚糖岩藻糖链接的方法;
[0020]
3)唾液特异性岩藻糖基化结构糖谱的检测。
[0021]
进一步的,步骤1)中,所述从蛋白质中提取聚糖包括:
[0022]
(1)填充移液管制备:
[0023]
将微米级多孔筛板加入空心移液管;
[0024]
将表面修饰有醛基的纳米级多孔微米球形树脂填充到空心移液管,填充后空心移液管称为填充移液管;
[0025]
将另一个微米级多孔筛板加入至所述填充移液管中,将醛基树脂固定于所述填充移液管中;
[0026]
(2)蛋白固相结合
[0027]
将蛋白质溶于去离子水中,用塑料离心管存放溶解后的蛋白质;
[0028]
将所述溶解后的蛋白质加热变性,冷却至室温后加入二硫苏糖醇还原,最后加入碘乙酰胺将蛋白质烷基化,获得样本;
[0029]
通过洗脱和离心将反应缓冲液替换为pbs,同时加入氰硼氢化钠室温反应,将蛋白与固相形成的-c=n-还原成-c-n-共价键;
[0030]
将所述填充移液管上的样本清洗;
[0031]
(3)n-聚糖制备
[0032]
在所述填充移液管中加入n-糖苷酶,使用碳酸氢铵缓冲溶液,将n-聚糖从所述填
充移液管树脂上固定的蛋白质酶解至碳酸氢铵缓冲溶液中;
[0033]
通过离心收集上清液,再加入稀释乙腈洗脱填充移液管树脂,并收集上清液,重复此步骤一次;
[0034]
将所有收集的上清液合并,取其中部分用质谱仪器分析聚糖成分和丰度。
[0035]
进一步的,在步骤(2)中所述通过洗脱和离心将反应缓冲液替换为pbs,同时加入氰硼氢化钠室温反应,将蛋白与固相形成的-c=n-还原成-c-n-共价键之前还包括:调节样本ph值至10,加入柠檬酸钠和醋酸钠配制的缓冲液,反应使蛋白质n-端和/或赖氨酸与固相树脂上的醛基反应结合;再加入氰硼氢化钠到所述样本中反应,将-c=n-还原形成-c-n-共价键。
[0036]
进一步的,在步骤(3)之前还包括确定α1,2岩藻糖、α1,3岩藻糖和α1,6岩藻糖中的任意一种或多种。
[0037]
进一步的,所述确定α1,2岩藻糖包括:加入α1-2岩藻糖苷酶到所述填充移液管树脂固相中,将α1,2岩藻糖酶解;通过所述酶解反应,将α1,2岩藻糖从聚糖上酶切,所得聚糖分子量如果相差一个岩藻糖,则推断含有一个α1,2岩藻糖,如果相差两个岩藻糖分子量,则推断含有两个α1,2岩藻糖,以此类推;如果α1-2岩藻糖苷酶酶切后聚糖仍含有岩藻糖,则推断该聚糖可含有α1,3岩藻糖和/或核心α1,6岩藻糖。
[0038]
进一步的,所述确定α1,3岩藻糖包括:在所述填充移液管树脂固相中加入α1-2,3,4岩藻糖苷酶,将α1,3岩藻糖酶解;通过所述酶解反应将α1,3岩藻糖从聚糖上酶切,所得聚糖分子量如果相差一个岩藻糖,则推断含有一个α1,3岩藻糖,如果相差两个岩藻糖分子量,则推断含有两个α1,3岩藻糖,以此类推;如果α1-2,3,4岩藻糖苷酶酶切后聚糖仍含有岩藻糖,则推断该聚糖可能为核心α1,6岩藻糖。
[0039]
进一步的,所述确定α1,6岩藻糖包括:在所述填充移液管树脂固相中加入α1-2,4,6岩藻糖苷酶,将α1,6岩藻糖酶解;通过所述酶解反应将α1,6岩藻糖从聚糖上酶切,所得聚糖分子量如果相差一个岩藻糖,则推断含有一个核心α1,6岩藻糖,如果相差两个岩藻糖分子量,则推断含有两个核心α1,6岩藻糖,以此类推;如果α1-2,4,6岩藻糖苷酶酶切后聚糖仍含有岩藻糖,则证实该聚糖含有α1,3岩藻糖。
[0040]
进一步的,在步骤2)中,所述确定聚糖岩藻糖链接的方法包括:将糖蛋白固定于所述填充移液管树脂固相上,在固相上用岩藻糖糖苷酶酶切。
[0041]
上述方式所制备的一种基于唾液特异性岩藻糖基化结构糖谱的检测方法在制备肺癌检测仪器中的应用。
[0042]
本发明提供了一种基于唾液特异性岩藻糖基化结构糖谱及其检测方法,通过采用移液管技术,高通量对临床唾液样本分析,鉴定出与肺癌特异性的岩藻糖聚糖标志物,用于肺癌诊断检测,具体优点如下:
[0043]
1)早期诊断,采用唾液检测既方便又对患者无伤害,样本易收集;
[0044]
2)与血液化验相比,血液中蛋白来源广泛,反应身体的整体变化,聚糖糖谱分析癌症和健康或非癌症人群没有可识别的明显特征;
[0045]
3)采用填充移液管,可以使用自动化液体处理仪器大规模处理样本,例如将填充移液管设置在96孔或384孔板,采用agilent bravo automated liquid handling platform,可同时对96或384临床样本进行检测;
[0046]
4)本发明除用于唾液样本的分析,也可对其他临床样本的聚糖糖谱分析,包括尿液、肺灌洗液、胃冲洗液、血液、脑脊髓等。
附图说明
[0047]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中,
[0048]
图1为本发明所述的一种基于唾液特异性岩藻糖基化结构糖谱的结构示意图;
[0049]
图2为本发明中采用移液管填充树脂固定和酶解切除聚糖的工作流程示意图;
[0050]
图3为本发明中确定聚糖岩藻糖链接岩藻糖苷酶分析示意图;
[0051]
图4为本发明中唾液特异性岩藻糖结构和丰度解析示意图;
[0052]
图5为本发明中唾液聚糖在肺癌患者中与非肺癌和健康人群结构组成和丰度比较图。
具体实施方式
[0053]
本发明公开了一种基于唾液特异性岩藻糖基化结构糖谱的检测方法,首先采集人体唾液标本,接着从唾液中提取蛋白质,然后将聚糖从糖蛋白质上水解富集,再用质谱对聚糖结构解析和丰度定量分析,最后确定样本中聚糖糖谱。通过对健康、非癌症和肺癌唾液分析,鉴定高丰度核心岩藻糖和支链岩藻糖的糖谱,可用于肺癌的临床筛查。本方法对高发病率和高死亡率肺癌的早期筛查和治疗等方面有着重要意义。
[0054]
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和实施例进一步说明本发明的技术方案。但是本发明不限于所列出的实施例,还应包括在本发明所要求的权利范围内其他任何公知的改变。
[0055]
首先,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
[0056]
其次,本发明利用结构示意图等进行详细描述,在详述本发明实施例时,为便于说明,示意图会不依一般比例作局部放大,而且所述示意图只是实例,其在此不应限制本发明保护的范围。此外,在实际制作中应包含长度、宽度及深度的三维空间。
[0057]
一种基于唾液特异性岩藻糖基化结构糖谱,包括如下通式结构:
[0058][0059]
其中,
[0060]
f为岩藻糖;
[0061]
g为半乳糖;
[0062]
m为甘露糖;
[0063]
n为乙酰氨基葡糖;
[0064]
α1,2代表g单糖的碳2与f单糖的碳1连接;
[0065]
α1,3代表n单糖的碳3与f单糖的碳1连接;
[0066]
α1,6代表n单糖的碳6与f单糖的碳1连接;
[0067]
上述结构中实线所连的每个单糖在所有聚糖中存在;虚线所连的每个单糖是指有或没有均可(即一根虚线表示有两种结构的聚糖)。具体结构可参阅图1,图1为本发明所述的一种基于唾液特异性岩藻糖基化结构糖谱的结构示意图。
[0068]
实施例1
[0069]
从蛋白质中提取聚糖。
[0070]
请参阅图2,图2为本发明中采用移液管填充树脂固定和酶解切除聚糖的工作流程示意图。如图2所示,
[0071]
1)填充移液管制备
[0072]
将孔径为5-20微米的多孔筛板加入体积为20-200微升的空心移液管中;
[0073]
将表面修饰有醛基的纳米级多孔微米球形树脂填充到空心移液管,其中,多孔微米球形树脂为30-120微米,填充后空心移液管称为填充移液管;
[0074]
将另一个孔径为5-20微米的多孔筛板加入填充移液管,将醛基树脂固定于填充移液管中;
[0075]
2)蛋白固相结合
[0076]
将蛋白质溶于体积为200-400微升的去离子水中,用容量为1.5-2毫升的塑料离心管存放溶解后的蛋白质;
[0077]
在温度为90℃的条件下,将蛋白质加热10分钟,使得蛋白质变性,待冷却至室温后加入二硫苏糖醇还原,具体为12毫摩尔二硫苏糖醇,在温度为37℃的条件下反应1小时,最后加入碘乙酰胺将蛋白质烷基化,具体为16毫摩尔碘乙酰胺在避光的条件下室温反应1小时,经过处理的蛋白质后称作样本;
[0078]
接着,在填充移液管里进行以下步骤;
[0079]
调节样本ph至ph值为10,可加快蛋白质与填充移液管中固相树脂醛基的结合,方法为加入柠檬酸钠和醋酸钠配制的缓冲液,其最终浓度为100毫摩尔柠檬酸钠,50毫摩尔醋酸钠,在室温下反应2-3小时,蛋白质n-端和/或赖氨酸与固相树脂上的醛基反应结合;
[0080]
再加入氰硼氢化钠,其最终浓度为50毫摩尔的氰硼氢化钠,在室温条件下,于样本中反应2-3小时,将-c=n-还原形成稳定的-c-n-共价键(此处两个步骤也可以省略,这两个步骤能将双键变成单键);
[0081]
通过洗脱和离心将反应缓冲液替换为ph值为7.2-7.4的pbs,同时加入50毫摩尔氰硼氢化钠于室温条件下反应4-6小时,将蛋白与固相形成的-c=n-还原成-c-n-共价键,通过此步骤确保所有双键变成单键;
[0082]
填充移液管上样本的清洗,用体积比为10%的稀释的乙腈洗脱5-6次填充移液管中的树脂,再用体积比为10%的甲酸清洗5-6次,接着用0.9-1.0摩尔的氯化钠清洗5-6次,最后用去离子水洗脱5-6次;
[0083]
3)n-聚糖制备
[0084]
在填充移液管中加入1-2单位的n-糖苷酶pngase f(new england biolabs,usa),使用100-200微升20-25毫摩尔碳酸氢铵缓冲溶液,在温度为37℃的条件下反应4-6小时,将n-聚糖从填充移液管树脂上固定的蛋白质酶解至碳酸氢铵缓冲溶液中;
[0085]
通过在离心力1000-2000rpm的条件下离心2-4分钟收集上清液,再加入100-200微升体积比为10%的乙腈洗脱填充移液管树脂,并收集上清液,重复此步骤一次;
[0086]
将所有收集的上清液合并,总量为300-600微升,取其中3-6微升用质谱仪器分析聚糖成分和丰度。
[0087]
实施例2
[0088]
确定聚糖岩藻糖链接的方法。
[0089]
请参阅图3,图3为本发明中确定聚糖岩藻糖链接岩藻糖苷酶分析示意图。如图3所示,将糖蛋白用实施例1的方法固定于填充移液管树脂固相上,聚糖结构为(h5n4f3或h5n4f(1,3)f(1,2
)
f(1,6))在固相上用岩藻糖糖苷酶酶切,这里实心圆表示甘露糖,空心圆表示半乳糖,正方形表示n-乙酰氨基葡萄糖或n-乙酰半乳糖胺,三角表示岩藻糖。以下(1)、(2)和(3)步骤,在实施例1中第3步n-聚糖制备之前进行,且这3个步骤可平行进行;
[0090]
(1)确定α1,2岩藻糖
[0091]
加入2-4单位的α1-2岩藻糖苷酶(new england biolabs)到填充移液管树脂固相
①
,具体为100-200微升50-60毫摩尔醋酸钠
①
,在温度为37℃的条件下酶切1小时,将α1,2岩藻糖酶解;
[0092]
该反应将α1,2岩藻糖从聚糖上酶切,所得聚糖分子量如果相差一个岩藻糖,则推断为含有一个α1,2岩藻糖,如果相差两个岩藻糖分子量,则推断含有两个α1,2岩藻糖,以此类推,上述反应的原理为:将α1,2岩藻糖从聚糖上酶切,所得聚糖分子量相差146.0-146.4da即含有一个α1,2岩藻糖,所得聚糖分子量相差292.0-292.8da即含有两个α1,2岩藻糖,以此类推;如果α1-2岩藻糖苷酶酶切后聚糖仍含有岩藻糖,则推断该聚糖可含有α1,3岩藻糖和/或核心α1,6岩藻糖。
[0093]
(2)确定α1,3岩藻糖
[0094]
在填充移液管树脂固相中加入α1-2,3,4岩藻糖苷酶(genovis ab,sweden)
②
,在
温度为37℃的条件下反应酶切,加入2-4单位α1-2,3,4岩藻糖苷酶到100-200微升20-30毫摩尔tris
②
中,在温度为37℃的条件下酶切30分钟,将α1,3岩藻糖酶解;
[0095]
该反应将α1,3岩藻糖从聚糖上酶切,如果所得聚糖分子量相差一个岩藻糖,则推断含有一个α1,3岩藻糖,如果相差两个岩藻糖分子量,则推断含有两个α1,3岩藻糖,以此类推,上述反应的原理为:将α1,3岩藻糖从聚糖上酶切,所得聚糖分子量相差146.0-146.4da即含有一个α1,3岩藻糖,所得聚糖分子量相差292.0-292.8da即含有两个α1,3岩藻糖,以此类推;如果α1-2,3,4岩藻糖苷酶酶切后聚糖仍含有岩藻糖,则可能为核心α1,6岩藻糖。
[0096]
(3)确定α1,6岩藻糖
[0097]
在填充移液管树脂固相中加入α1-2,4,6岩藻糖苷酶(new england biolabs)
③
,在温度为37℃的条件下反应酶切,加入2-4单位α1-2,4,6岩藻糖苷酶到100-200微升50-60毫摩尔醋酸钠
③
中,在温度为37℃的条件下反应1小时,将α1,6岩藻糖酶解;
[0098]
该反应将α1,6岩藻糖从聚糖上酶切,如果所得聚糖分子量相差一个岩藻糖,则推断含有一个核心α1,6岩藻糖,如果相差两个岩藻糖分子量,则推断含有两个核心α1,6岩藻糖,以此类推,上述反应的原理为:将α1,6岩藻糖从聚糖上酶切,所得聚糖分子量相差146.0-146.4da即确认含有一个核心α1,6岩藻糖,所得聚糖分子量相差292.0-292.8da,即确认含有两个核心α1,6岩藻糖,以此类推;如果α1-2,4,6岩藻糖苷酶酶切后聚糖仍含有岩藻糖,则证实该聚糖含有α1,3岩藻糖。
[0099]
实施例3
[0100]
唾液特异性岩藻糖基化结构糖谱的检测方法
[0101]
请参阅图4,图4为本发明唾液特异性岩藻糖结构和丰度解析示意图。其中,(a)用α1,2岩藻糖苷酶(f2)确定α1,2岩藻糖结果,并伴随其它岩藻糖聚糖的增加,图中对h5n4f4和h5n4f3两个岩藻糖聚糖用f2酶解分析,证实这两种聚糖的结构。(b)用α1-2,3,4岩藻糖苷酶(f234)确定核心岩藻糖和其它岩藻糖结构,结果表明聚糖有一个核心岩藻糖和α1,2/α1,4结构。这里h代表hex,n代表hexnac,f代表fucose。
[0102]
根据上一步中原理,以聚糖h5n4f(1,2)2(1,3)(1,6)和h5n4f(1,2)2(1,6)为例子分析结构和丰度,该结构中包含四个岩藻糖,即为两个α1,2、一个α1,3和一个核心α1,6;
[0103]
将2-4单位α1-2岩藻糖苷酶(f2)加入到填充移液管树脂固相中,即100-200微升50-60毫摩尔醋酸钠中,在温度为37℃条件下反应1小时酶切,将α1-2岩藻糖酶解。质谱分析结果为h5n4f(1,2)2(1,3)(1,6)降低,h5n4f(1,3)(1,6)增加,确定该聚糖含α1,2岩藻糖;唾液中如含有h5n4f(1,2)2(1,6),经过2-4单位的f2(α1-2岩藻糖苷酶)酶解,得到中间产物h5n4f(1,2)(1,6)和终产物h5n4f(1,6)。质谱鉴定h5n4f(1,2)2(1,6)降低,h5n4f(1,2)(1,6)增加,同时h5n4f(1,6)增加,确定唾液中含有核心α1,6结构;唾液中如含有h5n4f(1,2)2(1,3)(1,6),经过α1-2,4,6岩藻糖苷酶(f234)酶切,h5n4f(1,2)2(1,6),h5n4f(1,2)(1,6)和h5n4f(1,6)均增加,确定该聚糖结构和丰度;
[0104]
根据上述方法,确定唾液中所有聚糖结构和丰度。
[0105]
唾液特异性岩藻糖基化结构糖谱在肺癌患者中与非肺癌和健康人群具有不同的特点,请参阅图5,图5为本发明唾液聚糖在肺癌患者中与非肺癌和健康人群结构组成和丰度比较。如图5所示,在健康人群中,糖6和糖10高表达,其他聚糖丰度较低或没有检测到;在非癌症人群中,聚糖9,12,14和16丰度高,但其他聚糖丰度较低或没有检测到;在肺癌患者
中,岩藻糖聚糖丰度高,最为显著的聚糖有1,2,3,4,7,8,11,12,13,14,16,17和19。这些聚糖均含有α1,6核心岩藻糖,高分子两聚糖含有一个或多个α1,2和α1,3。可以得出在癌症患者唾液中含有特异高岩藻糖化聚糖,且丰度远远高于其他群体。
[0106]
根据上述原理,富集提取500维克唾液中糖蛋白聚糖,采用质谱分析聚糖结构和丰度,使用所提取聚糖的1/10测量,质量质荷比测试范围从1200da到3000da,将健康人群、非癌症(或其他疾病)和肺癌病人质荷比对齐排列,且聚糖丰度坐标调整一致(104),每一个峰代表一种成分的聚糖,高度代表聚糖相对含量。肺癌唾液中所含特异性聚糖包括:糖1、糖2、糖3、糖4、糖5、糖7、糖10、糖11、糖13、糖15、糖16、糖17、糖19、糖20、糖21;健康人群高丰度聚糖包括:糖6、糖10、糖14。非癌症人群唾液聚糖包括:糖9、糖12、糖14、糖16、糖20。
[0107]
实施例4
[0108]
基于唾液特异性岩藻糖基化结构糖谱的检测方法的应用。
[0109]
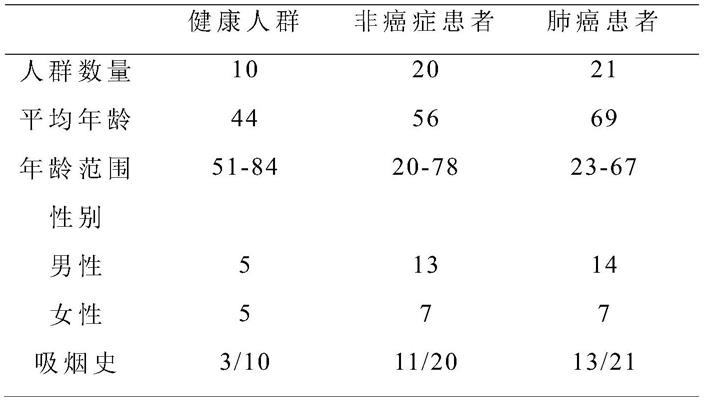
肺癌唾液特异性岩藻糖结构糖谱通过对临床样本分析得到,分别对肺癌患者、非肺癌和健康人群按本发明所述方法制备和分析聚糖结构和丰度。请参阅表1,表1为本发明所检测的人体唾液样本。
[0110][0111]
表1
[0112]
如表1所示,临床样本包括人群为健康(10),非癌症患者(20),和肺癌患者(21)。这3类人群平均年龄为44、56和69,涵盖的年龄范围从20到84岁,且包含男性和女性患者,为排除吸烟史对结果的影响,吸烟人群人数有健康(3),非癌症患者(11)和肺癌患者(13)。聚糖糖谱见图5,所有样本糖谱有类似的成分和丰度构成,统计分析小时误差在10-15%。如图5所示,肺癌患者唾液含有聚糖结构糖4,糖7,糖8,糖11,糖13,糖15,糖16,糖17,糖19。非癌症患者则含有糖9和糖12,且与健康人群比较糖6和糖10含量极低。
[0113]
与现有技术相比,本发明的有益效果是:本发明提供了一种一种基于唾液特异性岩藻糖基化结构糖谱及其检测方法和应用,便于早期诊断,样本易收集,对患者无伤害,具有优良的应用前景。
[0114]
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。