使用辅酶q10联合疗法治疗癌症
1.本技术是申请日为2014年4月8日、申请号为201480032725.7、 发明名称为“使用辅酶q10联合疗法治疗癌症”的发明专利申请的分 案申请。
2.相关申请
3.本技术要求2013年4月8日提交的美国临时专利申请第 61/809,840号的优先权,该临时专利申请的内容全文并入本文中。
技术领域
4.本发明总体涉及治疗肿瘤疾病的方法,其包括施用辅酶q10 (coq10)和化疗剂。
背景技术:
5.癌症是目前发达国家中的主要死亡原因之一。癌症的诊断传统上 涉及严重的健康并发症。癌症可以引起毁容、慢性或急性疼痛、病变、 器官衰竭或者甚至死亡。常被诊断出的癌症包括胰腺癌、乳腺癌、肺 癌、黑素瘤、淋巴瘤、癌瘤、肉瘤、非霍奇金淋巴瘤、白血病、子宫 内膜癌、结肠和直肠癌、前列腺癌和膀胱癌。传统上,许多癌症(例 如,乳腺癌、白血病、肺癌等)用外科手术、化疗、放射或其组合来 治疗。已知癌症治疗中使用的化疗剂在患者中产生若干严重且使人不 快的副作用。例如,一些化疗剂导致神经病、肾毒性(例如,高血脂、 蛋白尿、低蛋白血症、它们的组合等)、口腔炎、粘膜炎、呕吐、脱 发、厌食、食道炎、闭经、免疫力下降、贫血、高音听力损失、心脏 毒性、疲劳、神经病或其组合。仍然期望用于治疗包括癌症在内的肿 瘤疾病的改进方法和能够递送生物活性剂以帮助治疗疾病及其它病 症的组合物。
6.辅酶q10(本文中也称coq10)、泛醌或泛癸利酮是一种流行的 营养补充剂并可以作为维生素样补充剂以胶囊形式见于营养品商店、 保健食品商店、药店等中,从而通过泛醇(coq10的还原形式)的抗 氧化剂性能帮助保护免疫系统。coq10广泛存在于大多数人体组织及 其它哺乳动物的组织中,并聚集在线粒体中。coq10是非常亲脂性的 且大多不溶于水。该不溶性与具有如以下coq10的结构中所示烃性 质的50个碳原子的类异戊二烯侧链有关。
7.
技术实现要素:
8.本发明提供了通过向受试者施用coq10和至少一种化疗剂来治 疗受试者的肿瘤疾病的方法,以便肿瘤疾病得到治疗。
9.在一些实施方式中,所述方法包括(a)向受试者施用辅酶q10 (coq10);(b)中断
60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少 90%、至少95%或至少100%。
14.在某些实施方式中,所述反应包括减小肿瘤负荷、减小肿瘤大小、 抑制肿瘤生长、减慢肿瘤生长、按照recist标准的改善、在治疗前 患有进行性肿瘤疾病的受试者中实现肿瘤疾病稳定、延长到肿瘤疾病 进展的时间和增加存活时间中的任意一种或多种。
15.在前述方法的一个优选实施方式中,coq10局部施用。在另一个 优选实施方式中,coq10通过吸入施用。在另一个优选实施方式中, coq10通过注射或输注施用。在另一个优选实施方式中,coq10通过 静脉内给药施用。在进一步的优选实施方式中,coq10通过连续静脉 内输注施用。在又进一步的优选实施方式中,coq10的剂量通过经 24小时连续输注施用。
16.在某些实施方式中,coq10以约5mg/kg、约10mg/kg、约 12.5mg/kg、约20mg/kg、约25mg/kg、约30mg/kg、约35mg/kg、约 40mg/kg、约45mg/kg、约50mg/kg、约55mg/kg、约58mg/kg、约 58.6mg/kg、约60mgkg、约75mg/kg、约78mg/kg、约100mg/kg、约 104mg/kg、约125mg/kg、约150mg/kg、约175mg/kg、约200mg/kg、 约300mg/kg或约400mg/kg的剂量施用。
17.本发明还提供了一种改进针对受试者的肿瘤疾病的化疗治疗方 案的方法,其包括在开始化疗治疗方案之前使用辅酶q10(coq10) 对患肿瘤疾病的受试者预治疗足够的时间,其中所述化疗治疗方案包 括施用一种或多种化疗剂,使得相对于单独使用化疗治疗方案的治 疗,肿瘤疾病的反应被改善。在前述方法的某些实施方式中,化疗治 疗方案不包括施用coq10。在前述方法的一些实施方式中,在开始化 疗治疗方案之前停止coq10的预治疗。
18.在前述方法的一个优选实施方式中,受试者在开始化疗治疗方案 之前使用coq10预治疗至少24小时、至少48小时、至少1周、至 少2周、至少3周、至少4周、至少5周、至少6周、至少7周或至 少8周。在另一个优选实施方式中,受试者在开始化疗治疗方案之前 使用coq10预治疗约24小时、约48小时、约1周、约2周、约3 周、约4周、约5周、约6周、约7周或约8周。
19.在前述方法的另一个优选实施方式中,在coq10预治疗开始后 至少24小时、在coq10预治疗开始后一周或多周、在coq10预治疗 开始后两周或更多周、在coq10预治疗开始后三周或更多周、在 coq10预治疗开始后四周或更多周、在coq10预治疗开始后五周或 更多周、在coq10预治疗开始后六周或更多周、在coq10预治疗开 始后七周或更多周或者在coq10预治疗开始后八周或更多周,开始 化疗治疗方案。
20.在前述方法的某些实施方式中,相对于单独使用化疗治疗方案的 治疗,所述反应改善至少2%、至少3%、至少4%、至少5%、至少 6%、至少7%、至少8%、至少9%、至少10%、至少11%、至少12%、 至少13%、至少14%、至少15%、至少16%、至少17%、至少18%、 至少19%、至少20%、至少21%、至少22%、至少23%、至少24%、 至少25%、至少26%、至少27%、至少28%、至少29%、至少30%、 至少31%、至少32%、至少33%、至少34%、至少35%、至少36%、 至少37%、至少38%、至少39%、至少40%、至少41%、至少42%、 至少43%、至少44%、至少45%、至少46%、至少47%、至少48%、 至少49%、至少50%、至少55%、至少60%、至少65%、至少70%、 至少75%、至少80%、至少85%、至少90%、至少95%或至少100%。
21.在前述方法的某些实施方式中,反应包括减小肿瘤负荷、减小肿 瘤大小、抑制肿瘤生长、减慢肿瘤生长、按照recist标准的改善、 在治疗前患有进行性肿瘤疾病的受试者中实现肿瘤疾病稳定、延长到 肿瘤疾病进展的时间和增加存活时间中的任意一种或多种。
22.在一些实施方式中,coq10局部施用。在其它实施方式中,coq10 通过吸入施用。在其它实施方式中,coq10通过注射或输注施用。在 另一个实施方式中,coq10通过静脉内给药施用。
23.在进一步的实施方式中,coq10通过连续静脉内输注施用。在更 进一步的实施方式中,coq10的剂量通过经24小时连续静脉内输注 施用。
24.在某些实施方式中,coq10以约5mg/kg、约10mg/kg、约 12.5mg/kg、约20mg/kg、约25mg/kg、约30mg/kg、约35mg/kg、约 40mg/kg、约45mg/kg、约50mg/kg、约55mg/kg、约58mg/kg、约 58.6mg/kg、约60mgkg、约75mg/kg、约78mg/kg、约100mg/kg、约 104mg/kg、约125mg/kg、约150mg/kg、约175mg/kg、约200mg/kg、 约300mg/kg或约400mg/kg的剂量施用。
25.本发明还提供了一种治疗受试者的肿瘤疾病的方法,其包括: (a)向受试者施用coq10;和(b)以比用来治疗肿瘤疾病的化疗剂 的标准剂量低的剂量向受试者施用至少一种化疗剂,使得肿瘤疾病被 治疗。在某些实施方式中,在向受试者施用所述至少一种化疗剂之前 中断coq10的施用。在其它实施方式中,在向受试者施用所述至少 一种化疗剂之后继续施用coq10。
26.在前述方法的某些实施方式中,coq10在施用所述至少一种化疗 剂之前施用至少24小时、至少48小时、至少1周、至少2周、至少 3周、至少4周、至少5周、至少6周、至少7周或至少8周。在前 述方法的其它实施方式中,coq10在施用所述至少一种化疗剂之前施 用约24小时、约48小时、约1周、约2周、约3周、约4周、约5 周、约6周、约7周或约8周。
27.在前述方法的其它实施方式中,在coq10施用开始后至少24小 时、在coq10施用开始后一周或多周、在coq10施用开始后两周或 更多周、在coq10施用开始后三周或更多周、在coq10施用开始后 四周或更多周、在coq10施用开始后五周或更多周、在coq10施用 开始后六周或更多周、在coq10施用开始后七周或更多周或在coq10 施用开始后八周或更多周,施用所述至少一种化疗剂。
28.在前述方法的某些实施方式中,coq10局部施用。在其它实施方 式中,coq10通过吸入施用。在其它实施方式中,coq10通过注射或 输注施用。在其它实施方式中,coq10通过静脉内给药施用。在其它 实施方式中,coq10通过连续静脉内输注施用。在其它实施方式中, coq10通过经24小时连续输注施用。
29.在前述方法的某些实施方式中,coq10以约5mg/kg、约10mg/kg、 约12.5mg/kg、约20mg/kg、约25mg/kg、约30mg/kg、约35mg/kg、 约40mg/kg、约45mg/kg、约50mg/kg、约55mg/kg、约58mg/kg、约 58.6mg/kg、约60mgkg、约75mg/kg、约78mg/kg、约100mg/kg、约 104mg/kg、约125mg/kg、约150mg/kg、约175mg/kg、约200mg/kg、 约300mg/kg或约400mg/kg的剂量施用。
30.在前述方法的某些实施方式中,所述至少一种化疗剂包含选自拓 扑异构酶i抑制剂、拓扑异构酶ii抑制剂、有丝分裂抑制剂、烷化剂、 铂化合物和抗代谢物的化疗剂。在一些实施方式中,所述至少一种化 疗剂包含拓扑异构酶ii抑制剂。在一个优选实施方式中,拓扑异构酶 ii抑制剂包含多柔比星、表柔比星、伊达比星、米托蒽醌、洛索蒽醌、 依托泊苷
和替尼泊苷中的至少一种。在其它实施方式中,所述至少一 种化疗剂包含拓扑异构酶i抑制剂。
31.在一个优选实施方式中,拓扑异构酶i抑制剂包含伊立替康、托 泊替康、9
‑
硝基喜树碱、喜树碱和喜树碱衍生物中的至少一种。在其 它实施方式中,所述至少一种化疗剂包含抗代谢物。在一个优选实施 方式中,抗代谢物包含5
‑
氟尿嘧啶、卡培他滨、吉西他滨、甲氨喋呤 和依达曲沙中的至少一种。在其它实施方式中,所述至少一种化疗剂 包含烷化剂。
32.在一个优选实施方式中,烷化剂包含氮芥、亚乙基亚胺化合物、 烷基磺酸盐、亚硝基脲、达卡巴嗪、环磷酰胺、异环磷酰胺和美法仑 中的至少一种。在其它实施方式中,所述至少一种化疗剂包含铂化合 物。在一个优选实施方式中,铂化合物包含顺铂、奥沙利铂和卡铂中 的至少一种。在其它实施方式中,所述至少一种化疗剂包含有丝分裂 抑制剂。在一个优选实施方式中,有丝分裂抑制剂包含紫杉醇、多西 紫杉醇、长春碱、长春新碱、长春瑞滨和鬼臼毒素衍生物中的至少一 种。
33.在前述方法的某些实施方式中,所述至少一种化疗剂包含选自以 下的化疗剂:阿米福汀(氨磷汀)、顺铂、达卡巴嗪(dtic)、放 线菌素、二氯甲基二乙胺(氮芥)、链脲佐菌素、环磷酰胺、卡莫司 汀(bcnu)、洛莫司汀(ccnu)、多柔比星(阿霉素)、多柔比 星脂质体(阿霉素脂质体)、吉西他滨(健择)、柔红霉素、柔红霉 素脂质体(daunoxome)、甲基苄肼、丝裂霉素、阿糖胞苷、依托泊 苷、氨甲喋呤、5
‑
氟尿嘧啶(5
‑
fu)、长春碱、长春新碱、博来霉素、 紫杉醇(泰素)、多西紫杉醇(泰索帝)、阿地白介素、天冬酰胺酶、 白消安、卡铂、克拉屈滨、喜树碱、cpt
‑
11、10
‑
羟基
‑7‑
乙基
‑
喜树碱 (sn38)、达卡巴嗪、s
‑
i卡培他滨、替加氟、5'
‑
脱氧氟尿苷、uft、 恩尿嘧啶、脱氧胞苷、5
‑
氮杂胞嘧啶、5
‑
氮杂脱氧胞嘧啶、别嘌呤醇、 2
‑
氯腺苷、三甲曲沙、氨喋呤、亚甲基
‑
10
‑
脱氮杂
‑
氨喋呤(mdam)、 奥沙利铂(oxaplatin)、吡铂、四铂、沙铂、铂
‑
dach、奥马铂、ci
‑
973、 jm
‑
216和它们的类似物、表柔比星、依托泊苷磷酸盐、9
‑
氨基喜树碱、 10,11
‑
亚甲基二氧喜树碱、karenitecin、9
‑
硝基喜树碱、tas 103、长 春地辛、l
‑
苯丙氨酸氮芥、异环磷酰胺(ifosphamidemefosphamide)、 培磷酰胺、氯乙环磷酰胺、卡莫司汀、司莫司汀、埃博霉素a
‑
e、拓 优得、6
‑
巯基嘌呤、6
‑
硫鸟嘌呤、安吖啶、依托泊苷磷酸盐、karenitecin、 阿昔洛韦、伐昔洛韦、更昔洛韦、金刚烷胺、金刚乙胺、拉米夫定、 齐多夫定、贝伐单抗、曲妥珠单抗、利妥昔单抗、5
‑
氟尿嘧啶、卡培 他滨、喷司他汀、三甲曲沙、克拉屈滨、氟尿苷、氟达拉滨、羟基脲、 异环磷酰胺、伊达比星、美司钠、伊立替康、米托蒽醌、拓扑替康、 亮丙瑞林、甲地孕酮、美法仑、巯基嘌呤、普卡霉素、米托坦、培门 冬酶、喷司他汀、哌泊溴烷、普卡霉素、链脲佐菌素、他莫昔芬、替 尼泊苷、睾内酯、硫鸟嘌呤、塞替派、尿嘧啶氮芥、长春瑞滨、苯丁 酸氮芥、顺铂、多柔比星、紫杉醇(泰素)、博莱霉素、mtor、表皮 生长因子受体(egfr)和成纤维细胞生长因子(fgf)及其组合。
34.在前述方法的一个优选实施方式中,所述至少一种化疗剂包含吉 西他滨、5
‑
氟尿嘧啶、顺铂、卡培他滨、甲氨喋呤、依达曲沙、多西 紫杉醇、环磷酰胺、多柔比星和伊立替康中的至少一种。
35.在前述方法的某些实施方式中,肿瘤疾病选自癌瘤、肉瘤、淋巴 瘤、黑素瘤和白血病。在一个优选实施方式中,肿瘤疾病选自胰腺癌、 乳腺癌、肝癌、皮肤癌、肺癌、结肠癌、前列腺癌、甲状腺癌、膀胱 癌、直肠癌、子宫内膜癌、肾癌、骨癌、脑癌、子宫颈癌、胃癌、口 癌和口腔癌、成神经细胞瘤、睾丸癌、子宫癌和外阴癌。在进一步的 优选实施方式中,皮肤癌
选自黑素瘤、鳞状细胞癌、基底细胞癌和皮 肤t
‑
细胞淋巴瘤(ctcl)。在另一个优选的实施方式中,肿瘤疾病 为三阴性乳腺癌。
36.在前述方法的某些实施方式中,肿瘤疾病是难治性疾病。在前述 方法的某些实施方式中,肿瘤疾病未能响应至少一种、两种、三种、 四种、五种、六种、七种、八种或更多种既往的治疗。在前述方法的 某些实施方式中,肿瘤疾病是晚期癌症。在前述方法的某些实施方式 中,所述方法还包括选择患有难治性肿瘤疾病的受试者来进行治疗。 在前述方法的某些实施方式中,所述方法还包括选择患有未响应至少 一种、两种、三种、四种、五种、六种、七种、八种或更多种既往治 疗的肿瘤疾病的受试者来进行治疗。在前述方法的某些实施方式中, 所述方法还包括选择患有晚期癌症的受试者来进行治疗。
37.在前述方法的优选实施方式中,受试者为人。
38.在前述方法的某些实施方式中,化疗剂包含吉西他滨、顺铂、多 西紫杉醇、环磷酰胺、多柔比星、伊立替康和5
‑
氟尿嘧啶中的至少一 种。
39.在前述方法的一个优选实施方式中,所述方法包括每周一次施用 约100mg/kg的吉西他滨至约10mg/kg的吉西他滨,施用3周,休止 一周。
40.在前述方法的另一个优选实施方式中,所述方法包括每三周向受 试者施用5mg/kg多西紫杉醇、1mg/kg多柔比星和35mg/kg环磷酰胺, 施用六个周期。
41.在前述方法的某些实施方式中,化疗剂为sn38且肿瘤疾病为前 列腺癌,化疗剂为sn38且肿瘤疾病为肝癌,化疗剂为多柔比星且肿 瘤疾病为乳腺癌,化疗剂为多柔比星且肿瘤疾病为胰腺癌,化疗剂为 多柔比星且肿瘤疾病为肝癌,化疗剂为5
‑
氟尿嘧啶且肿瘤疾病为乳腺 癌,化疗剂为5
‑
氟尿嘧啶且肿瘤疾病为三阴性乳腺癌,化疗剂为5
‑ꢀ
氟尿嘧啶且肿瘤疾病为肝癌,化疗剂为顺铂且肿瘤疾病为肺癌,化疗 剂为4
‑
hcp且肿瘤疾病为乳腺癌,化疗剂为4
‑
hcp且肿瘤疾病为三 阴性乳腺癌,化疗剂为4
‑
hcp且肿瘤疾病为乳腺癌,化疗剂为4
‑
hcp 且肿瘤疾病为卵巢癌,化疗剂为他莫昔芬且肿瘤疾病为乳腺癌,化疗 剂为吉西他滨且肿瘤疾病为肺癌,化疗剂为氟他胺且肿瘤疾病为前列 腺癌,或者化疗剂为戈舍瑞林且肿瘤疾病为前列腺癌。
42.在其中coq10以静脉内coq10制剂提供的一些实施方式中,静 脉内coq10制剂包含(1)水性溶液、(2)分散成颗粒的纳米分散 体的coq10和(3)分散稳定剂与调理作用缩减剂中的至少一种,其 中coq10的纳米分散体分散成平均粒度小于200nm的纳米颗粒。
43.在一些实施方式中,分散稳定剂选自聚乙二醇化蓖麻油、 cremophor el、cremophor rh 40、聚乙二醇化维生素e、维生素e tpgs和二肉豆蔻酰基磷脂酰基胆碱(dmpc)。在一些实施方式中, 分散稳定剂优选是dmpc。
44.在一些实施方式中,调理作用缩减剂选自泊洛沙姆类和泊洛沙胺 类(poloxamines)。在一些优选实施方式中,调理作用缩减剂为泊洛 沙姆188。在一些优选实施方式中,调理作用缩减剂为泊洛沙姆188 且分散稳定剂为dmpc。
45.在一些实施方式中,coq10制剂分别具有4%、3%和1.5%重量/ 体积比的coq10、dmpc和泊洛沙姆188。
46.在一些实施方式中,coq10以局部coq10制剂提供,其中所述 局部coq10制剂为3%的coq10乳膏剂,其包含:(1)相a,其具 有组合物的约4.0重量/重量%的c12
‑
15烷基苯甲酸酯、组合物的约 2.00重量/重量%的鲸蜡醇、约1.5重量/重量%的硬脂醇、硬脂酸甘油 酯
和约4.5重量/重量%的peg
‑
100;(2)相b,其具有约2.00重量/ 重量%的甘油、约1.5重量/重量%的丙二醇、约5.0重量/重量%的乙 氧基二甘醇、约0.475重量/重量%的苯氧乙醇、约40重量/重量%的 卡波姆分散体、约16.7重量/重量%的纯化水;(3)相c,其具有约 1.3重量/重量%的三乙醇胺、约0.5重量/重量%的乳酸、约2.0重量/ 重量%的乳酸钠溶液、约2.5重量/重量%的水;(4)相d,其具有约 1.0重量/重量%的二氧化钛;和(5)相e,其具有约15.0重量/重量 %的coq10 21%浓缩物。
47.在某些实施方式中,coq10以用于吸入的制剂提供,其中所述制 剂包含含有适于连续雾化的脂质体颗粒分散体的药物组合物,所述组 合物包含:平均直径在约30和500nm之间的脂质体颗粒分散体,每 个脂质体颗粒包含疏水性生物活性剂、磷脂和水性分散介质,其中疏 水性生物活性剂:磷脂的比率在约5:1和约1:5之间,疏水性生物活 性剂在组合物的约0.1和30重量/重量%之间,磷脂在组合物的约0.1 和30重量/重量%之间,并且脂质体颗粒分散在水性分散介质中,并 且其中在对受试者施用时,组合物特征在于足以向受试者提供治疗剂 量的疏水性生物活性剂的连续雾化。在某些实施方式中,水性分散介 质包含水或水性盐溶液。在某些实施方式中,脂质体颗粒分散体为连 续可吸入气雾剂的形式,其包含多个含有脂质体颗粒的分散体并具有 在约1和5μm之间的质量中值气体动力学直径(mmad)的水性液 滴。在某些实施方式中,组合物特征在于经过至少15分钟连续雾化, 约50和100%之间的平均百分传输率(apt)。在某些实施方式中, 经过至少15分钟连续雾化,所述多个液滴具有约1和5μm之间的 mmad。
48.化疗剂包括但不限于环磷酰胺、紫杉烷类(例如,紫杉醇或多西 紫杉醇)、白消安、顺铂、甲氨喋呤、柔红霉素、多柔比星、美法仑、 克拉屈滨、长春新碱、长春碱、苯丁酸氮芥、他莫昔芬、泰素、依托 泊苷(vp
‑
16)、多柔比星、5
‑
氟尿嘧啶(5fu)、喜树碱、放线菌素
ꢀ‑
d、丝裂霉素c、顺铂(cddp)、考布他汀和伊立替康;以及它们 的衍生物和前药。化疗剂包括抗血管生成剂。抗血管生成剂包括但不 限于血管抑素;内皮抑素;16kda催乳素片段;层粘连蛋白肽;纤连 蛋白肽;组织金属蛋白酶抑制剂(timp 1、2、3、4);纤溶酶原激 活物抑制剂(pai
‑
1、
‑
2);肿瘤坏死因子α;tgf
‑
β1;干扰素(ifn
‑
α、
ꢀ‑
β、
‑
γ);elr
‑
cxc趋化因子:il
‑
12;sdf
‑
1;mig;血小板因子4 (pf
‑
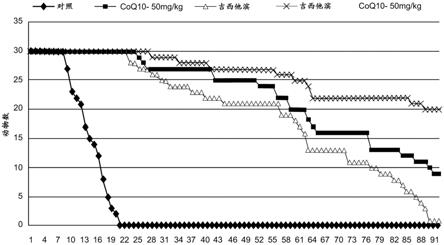
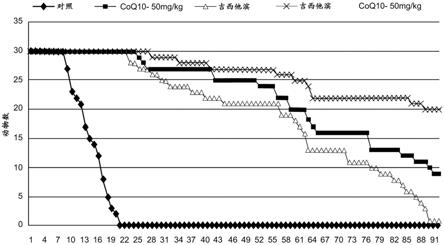
4);ip
‑
10;血小板反应蛋白(tsp);sparc;2
‑
甲氧基雌二 醇增殖蛋白相关蛋白;苏拉明;沙利度胺;可的松;烟曲霉素 (agm
‑
1470、tnp
‑
470);他莫昔芬;韩国槲寄生提取物(白果槲 寄生(viscum album coloratum));类视黄醇;cm101;地塞米松和白 血病抑制因子(lif)。本文中还提供了其它化疗剂。
49.在一些实施方式中,抗代谢物包括嘌呤或嘧啶类似物中的至少一 种。在一些实施方式中,抗代谢物包括吉西他滨、5
‑
氟尿嘧啶、卡培 他滨、甲氨喋呤和依达曲沙中的至少一种。在一些优选实施方式中, 抗代谢物为吉西他滨。
50.在一些实施方式中,蒽环类抗生素为拓扑异构酶ii抑制剂。在一 些实施方式中,拓扑异构酶ii抑制剂包括多柔比星、表柔比星、伊达 比星、米托蒽醌、洛索蒽醌、依托泊苷和替尼泊苷中的至少一种。在 一些优选实施方式中,拓扑异构酶ii抑制剂为多柔比星。
51.在一些实施方式中,化疗剂为拓扑异构酶i抑制剂。在一些实施 方式中,拓扑异构酶i抑制剂包括伊立替康、托泊替康、9
‑
硝基喜树 碱、喜树碱和喜树碱衍生物中的至少一种。
52.施用化疗剂的途径和方法是本领域已知的。
53.在一些实施方式中,所述方法包括其中对受试者每天一次静脉内 施用至少约50mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 与化疗剂共施用一个周期的方案。
54.在一些实施方式中,所述方法包括其中对受试者每天两次静脉内 施用至少约50mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 与化疗剂共施用一个周期的方案。
55.在一些实施方式中,所述方法包括其中对受试者每天三次静脉内 施用至少约50mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 与化疗剂共施用一个周期的方案。
56.在一些实施方式中,所述方法包括其中对受试者每天一次静脉内 施用至少约75mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 与化疗剂共施用一个周期的方案。
57.在一些实施方式中,所述方法包括其中对受试者每天两次静脉内 施用至少约75mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 与化疗剂共施用一个周期的方案。
58.在一些实施方式中,所述方法包括其中对受试者每天三次静脉内 施用至少约75mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 与化疗剂共施用一个周期的方案。
59.在一些实施方式中,所述方法包括其中对受试者每天一次静脉内 施用至少约50mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 并随后施用化疗剂一个周期的方案。
60.在一些实施方式中,所述方法包括其中对受试者每天两次静脉内 施用至少约50mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 并随后施用化疗剂一个周期的方案。
61.在一些实施方式中,所述方法包括其中对受试者每天三次静脉内 施用至少约50mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 并随后施用化疗剂一个周期的方案。
62.在一些实施方式中,所述方法包括其中对受试者每天一次静脉内 施用至少约75mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 并随后施用化疗剂一个周期的方案。
63.在一些实施方式中,所述方法包括其中对受试者每天两次静脉内 施用至少约75mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 并随后施用化疗剂一个周期的方案。
64.在一些实施方式中,所述方法包括其中对受试者每天三次静脉内 施用至少约75mg/kg/剂的静脉内coq10制剂,施用3周,休止一周, 并随后施用化疗剂一个周期的方案。
65.在某些实施方式中,每天施用coq10而没有三周间隔处的一周 休止。在某些实施方式中,每天施用coq10直至观察到限制性毒性。
66.在一些实施方式中,所述方法包括其中在施用化疗剂之前通过连 续输注对受试者静脉内施用coq10的方案。在一些实施方式中,在 施用化疗剂之前连续输注24小时。
67.在某些实施方式中,在一剂coq10施用完成24小时内开始施用 化疗剂。在某些实施方式中,在一剂coq10施用完成18小时内开始 施用化疗剂。在某些实施方式中,在一剂coq10施用完成12小时内 开始施用化疗剂。在某些实施方式中,在一剂coq10施用完成6小 时内开始施用化疗剂。在某些实施方式中,在一剂coq10施用完成4 小时内开始施用化疗剂。在某些实施方式中,在一剂coq10施用完 成3小时内开始施用化疗剂。在某些实施方式中,在一剂coq10施 用完成2小时内开始施用化疗剂。在某些实施方式中,在一剂coq10 施用完成1小时内开始施用化疗剂。
68.在某些实施方式中,在coq10预治疗后,在化疗剂治疗过程中 继续coq10的治疗。
69.在其中在化疗剂之前施用coq10的一些实施方式中,在施用两 个或更多个(例如,2、3、4、5、6、7、8个等)周期的化疗剂之前 施用两个或更多个周期的coq10(例如,2、3、4、5、6、7、8个周 期等)。
70.在某些实施方式中,在施用化疗剂之前施用足够时间和量的 coq10以达到coq10的稳态。
71.在某些实施方式中,在化疗剂治疗开始之前施用负荷剂量的 coq10。
72.在其中在化疗剂之前施用coq10的一些实施方式中,在施用一 个周期的化疗剂之前施用一个周期的coq10。在某些实施方式中,在 每个治疗周期中在每个剂量的化疗剂之前施用coq10。在某些实施方 式中,与化疗剂周期交替地施用多个周期的coq10。在某些实施方式 中,在每个治疗周期中在每个剂量的化疗剂之前施用coq10。在某些 实施方式中,在每个剂量的化疗剂之前和与每个剂量的化疗剂同时施 用coq10。在某些实施方式中,在每个周期的化疗剂施用之前和与每 个周期的化疗剂施用同时施用coq10。
73.在其中在化疗剂之前施用coq10的一些实施方式中,在施用两 个或更多个(例如,2、3、4、5、6、7、8个等)周期的化疗剂之前 施用一个周期的coq10。
74.应理解,化疗剂常常以混合物(cocktail)形式施用。如本文所用, 化疗剂应理解为一种或多种(例如,1、2、3、4、5、6、7、8种等) 化疗剂。此外,应理解,在施用多个周期的化疗剂时,每个周期中使 用的具体给药方案和/或化疗剂不必相同。然而,在某些实施方式中, 化疗剂及其给药方案对所有周期都是相同的。
75.在某些实施方式中,coq10通过与化疗剂相同的施用途径施用。 在某些实施方式中,coq10通过与化疗剂不同的施用途径施用。
76.在一些实施方式中,治疗受试者的肿瘤疾病,其包括胰腺癌、乳 腺癌、皮肤癌、肝癌、癌瘤、肉瘤、淋巴瘤、黑素瘤或白血病中的至 少一种。在某些实施方式中,治疗受试者的肿瘤疾病,其包括实体肿 瘤。在某些实施方式中,治疗受试者的肿瘤疾病,其包括非实体肿瘤。
77.本发明还涉及以下项目:
78.项目1.一种治疗受试者的肿瘤疾病的方法,所述方法包括:
79.(a)向所述受试者施用辅酶q10(coq10);
80.(b)中断coq10的施用;和
81.(c)在已中断coq10的施用后,向所述受试者施用至少一种化 疗剂,
82.使得所述肿瘤疾病被治疗。
83.项目2.一种治疗受试者的肿瘤疾病的方法,所述方法包括:
84.(a)向所述受试者施用辅酶q10(coq10);
85.(b)在开始coq10的施用后,向所述受试者施用至少一种化疗 剂;和
86.(c)在开始所述至少一种化疗剂的施用后,继续使用coq10治 疗,
87.使得所述肿瘤疾病被治疗。
88.项目3.根据项目1或2所述的方法,其中所述coq10在施用一 剂所述至少一种化疗剂之前施用至少24小时。
89.项目4.根据项目1或2所述的方法,其中所述coq10在施用一 剂所述至少一种化疗剂之前施用至少48小时。
90.项目5.根据项目1或2所述的方法,其中所述coq10在施用一 剂所述至少一种化疗剂之前施用至少1周。
91.项目6.根据项目1或2所述的方法,其中所述coq10在施用一 剂所述至少一种化疗
更多周、在coq10预治疗开始后六周或更多周、在coq10预治疗开 始后七周或更多周或者在coq10预治疗开始后八周或更多周,开始 所述化疗治疗方案。
108.项目23.根据项目10所述的方法,其中相对于单独使用所述化 疗治疗方案的治疗,所述反应改善至少5%、至少10%、至少15%、 至少20%、至少30%、至少40%或至少50%。
109.项目24.根据项目20
‑
23中任一项所述的方法,其中所述反应包 括减小肿瘤负荷、减小肿瘤大小、抑制肿瘤生长、在治疗前患有进行 性肿瘤疾病的受试者中实现肿瘤疾病稳定、延长到肿瘤疾病进展的时 间和增加存活时间中的任意一种或多种。
110.项目25.根据项目20所述的方法,其中所述coq10局部施用。
111.项目26.根据项目20所述的方法,其中所述coq10通过吸入施 用。
112.项目27.根据项目20所述的方法,其中所述coq10通过注射或 输注施用。
113.项目28.根据项目20所述的方法,其中所述coq10通过静脉内 给药施用。
114.项目29.根据项目20所述的方法,其中所述coq10通过连续静 脉内输注施用。
115.项目30.根据项目20所述的方法,其中所述coq10通过经24 小时连续输注施用。
116.项目31.根据项目27
‑
30中任一项所述的方法,其中所述coq10 以约5mg/kg、约10mg/kg、约12.5mg/kg、约20mg/kg、约25mg/kg、 约30mg/kg、约35mg/kg、约40mg/kg、约45mg/kg、约50mg/kg、约 55mg/kg、约58mg/kg、约58.6mg/kg、约60mgkg、约75mg/kg、约 78mg/kg、约100mg/kg、约104mg/kg、约125mg/kg、约150mg/kg、 约175mg/kg、约200mg/kg、约300mg/kg或约400mg/kg的剂量施用。
117.项目32.一种治疗受试者的肿瘤疾病的方法,所述方法包括:
118.(a)向所述受试者施用辅酶q10(coq10);和
119.(b)以比用来治疗所述肿瘤疾病的化疗剂的标准剂量低的剂量 向所述受试者施用至少一种化疗剂,
120.使得所述肿瘤疾病被治疗。
121.项目33.根据项目32所述的方法,其中在向所述受试者施用所 述至少一种化疗剂之前中断coq10的施用。
122.项目34.根据项目32所述的方法,其中在向所述受试者施用所 述至少一种化疗剂之后继续coq10的施用。
123.项目35.根据项目32所述的方法,其中所述coq10在施用所述 至少一种化疗剂之前施用至少24小时、至少48小时、至少1周、至 少2周、至少3周或至少4周。
124.项目36.根据项目32所述的方法,其中在coq10施用开始后至 少24小时、在coq10施用开始后一周或多周、在coq10施用开始后 两周或更多周、在coq10施用开始后三周或更多周、在coq10施用 开始后四周或更多周、在coq10施用开始后五周或更多周、在coq10 施用开始后六周或更多周、在coq10施用开始后七周或更多周或者 在coq10施用开始后八周或更多周,施用所述至少一种化疗剂。
125.项目37.根据项目32所述的方法,其中所述coq10局部施用。
126.项目38.根据项目32所述的方法,其中所述coq10通过吸入施 用。
127.项目39.根据项目32所述的方法,其中所述coq10通过注射或 输注施用。
128.项目40.根据项目32所述的方法,其中所述coq10通过静脉内 给药施用。
129.项目41.根据项目32所述的方法,其中所述coq10通过连续静 脉内输注施用。
130.项目42.根据项目32所述的方法,其中所述coq10通过经24 小时连续输注施用。
131.项目43.根据项目39
‑
42中任一项所述的方法,其中所述coq10 以约5mg/kg、约10mg/kg、约12.5mg/kg、约20mg/kg、约25mg/kg、 约30mg/kg、约35mg/kg、约40mg/kg、约45mg/kg、约50mg/kg、约 55mg/kg、约58mg/kg、约58.6mg/kg、约60mgkg、约75mg/kg、约 78mg/kg、约100mg/kg、约104mg/kg、约125mg/kg、约150mg/kg、 约175mg/kg、约200mg/kg、约300mg/kg或约400mg/kg的剂量施用。
132.项目44.根据前述项目中任一项所述的方法,其中所述至少一种 化疗剂包含选自拓扑异构酶i抑制剂、拓扑异构酶ii抑制剂、有丝分 裂抑制剂、烷化剂、铂化合物和抗代谢物的化疗剂。
133.项目45.根据项目44所述的方法,其中所述至少一种化疗剂包 含拓扑异构酶ii抑制剂。
134.项目46.根据项目45所述的方法,其中所述拓扑异构酶ii抑制 剂包含多柔比星、表柔比星、伊达比星、米托蒽醌、洛索蒽醌、依托 泊苷和替尼泊苷中的至少一种。
135.项目47.根据项目44所述的方法,其中所述至少一种化疗剂包 含拓扑异构酶i抑制剂。
136.项目48.根据项目47所述的方法,其中所述拓扑异构酶i抑制 剂包含伊立替康、托泊替康、9
‑
硝基喜树碱、喜树碱和喜树碱衍生物 中的至少一种。
137.项目49.根据项目44所述的方法,其中所述至少一种化疗剂包 含抗代谢物。
138.项目50.根据项目49所述的方法,其中所述抗代谢物包含5
‑
氟 尿嘧啶、卡培他滨、吉西他滨、甲氨喋呤和依达曲沙中的至少一种。
139.项目51.根据项目44所述的方法,其中所述至少一种化疗剂包 含烷化剂。
140.项目52.根据项目51所述的方法,其中所述烷化剂包含氮芥、 亚乙基亚胺化合物、烷基磺酸盐、亚硝基脲、达卡巴嗪、环磷酰胺、 异环磷酰胺和美法仑中的至少一种。
141.项目53.根据项目44所述的方法,其中所述至少一种化疗剂包 含铂化合物。
142.项目54.根据项目53所述的方法,其中所述铂化合物包含顺铂、 奥沙利铂和卡铂中的至少一种。
143.项目55.根据项目44所述的方法,其中所述至少一种化疗剂包 含有丝分裂抑制剂。
144.项目56.根据项目55所述的方法,其中所述有丝分裂抑制剂包 含紫杉醇、多西紫杉醇、长春碱、长春新碱、长春瑞滨和鬼臼毒素衍 生物中的至少一种。
145.项目57.根据前述项目中任一项所述的方法,其中所述至少一种 化疗剂包含选自以下的化疗剂:阿米福汀(氨磷汀)、顺铂、达卡巴 嗪(dtic)、放线菌素、二氯甲基二乙胺(氮芥)、链脲佐菌素、 环磷酰胺、卡莫司汀(bcnu)、洛莫司汀(ccnu)、多柔比星(阿 霉素)、多柔比星脂质体(阿霉素脂质体)、吉西他滨(健择)、柔 红霉素、柔红霉素脂质体、甲基苄肼、丝裂霉素、阿糖胞苷、依托泊 苷、甲氨喋呤、5
‑
氟尿嘧啶(5
‑
fu)、长春碱、长春新碱、博来霉素、 紫杉醇(泰素)、多西紫杉醇(泰素帝)、阿地白介素、天冬酰胺酶、 白消安、卡铂、克拉屈滨、喜树碱、cpt
‑
11、10
‑
羟基
‑7‑
乙基
‑
喜树碱 (sn38)、达卡巴嗪、s
‑
i卡培他滨、替加氟、5'
‑
脱氧氟尿苷、uft、 恩尿嘧啶、脱氧胞苷、5
‑
氮杂胞嘧啶、5
‑
氮杂脱氧胞嘧啶、别嘌呤醇、 2
‑
氯
腺苷、三甲曲沙、氨喋呤、亚甲基
‑
10
‑
脱氮杂氨喋呤(mdam)、 奥沙利铂、吡铂、四铂、沙铂、铂
‑
dach、奥马铂、ci
‑
973、jm
‑
216 和它们的类似物、表柔比星、依托泊苷磷酸盐、9
‑
氨基喜树碱、10,11
‑ꢀ
亚甲基二氧喜树碱、karenitecin、9
‑
硝基喜树碱、tas 103、长春地辛、 l
‑
苯丙氨酸氮芥、异环磷酰胺、培磷酰胺、氯乙环磷酰胺卡莫司汀、 司莫司汀、埃博霉素a
‑
e、拓优得、6
‑
巯基嘌呤、6
‑
硫鸟嘌呤、安吖 啶、依托泊苷磷酸盐、karenitecin、阿昔洛韦、伐昔洛韦、更昔洛韦、 金刚烷胺、金刚乙胺、拉米夫定、齐多夫定、贝伐单抗、曲妥珠单抗、 利妥昔单抗、5
‑
氟尿嘧啶、卡培他滨、喷司他汀、三甲曲沙、克拉屈 滨、氟尿苷、氟达拉滨、羟基脲、异环磷酰胺、伊达比星、美司钠、 伊立替康、米托蒽醌、拓扑替康、亮丙瑞林、甲地孕酮、美法仑、巯 基嘌呤、普卡霉素、米托坦、培门冬酶、喷司他汀、哌泊溴烷、普卡 霉素、链脲佐菌素、他莫昔芬、替尼泊苷、睾内酯、硫鸟嘌呤、塞替 派、尿嘧啶氮芥、长春瑞滨、苯丁酸氮芥、顺铂、多柔比星、紫杉醇 (泰素)、博莱霉素、mtor、表皮生长因子受体(egfr)和成纤维 细胞生长因子(fgf)及其组合。
146.项目58.根据前述项目中任一项所述的方法,其中所述至少一种 化疗剂包含吉西他滨、5
‑
氟尿嘧啶、顺铂、卡培他滨、甲氨蝶呤、依 达曲沙、多西紫杉醇、环磷酰胺、多柔比星和伊立替康中的至少一种。
147.项目59.根据前述项目中任一项所述的方法,其中所述肿瘤疾病 选自癌瘤、肉瘤、淋巴瘤、黑素瘤和白血病。
148.项目60.根据前述项目中任一项所述的方法,其中所述肿瘤疾病 选自胰腺癌、乳腺癌、肝癌、皮肤癌、肺癌、结肠癌、前列腺癌、甲 状腺癌、膀胱癌、直肠癌、子宫内膜癌、肾癌、骨癌、脑癌、子宫颈 癌、胃癌、口癌和口腔癌、成神经细胞瘤、睾丸癌、子宫癌和外阴癌。
149.项目61.根据项目60所述的方法,其中所述皮肤癌选自黑素瘤、 鳞状细胞癌、基底细胞癌和皮肤t
‑
细胞淋巴瘤(ctcl)。
150.项目62.根据前述项目中任一项所述的方法,其中所述肿瘤疾病 为三阴性乳腺癌。
151.项目63.根据前述项目中任一项所述的方法,其中所述受试者为 人。
152.项目64.根据前述项目中任一项所述的方法,其中所述至少一种 化疗剂包含吉西他滨、顺铂、多西紫杉醇、环磷酰胺、多柔比星、伊 立替康和5
‑
氟尿嘧啶中的至少一种。
153.项目65.根据项目64所述的方法,其中所述方法包括每周一次 施用约100mg/kg的吉西他滨至约10mg/kg的吉西他滨,施用3周, 休止一周。
154.项目66.根据项目64所述的方法,其中所述方法包括每三周向 所述受试者施用5mg/kg多西紫杉醇、1mg/kg多柔比星和35mg/kg环 磷酰胺,施用六个周期。
附图说明
155.图1为示出在使用人胰腺肿瘤miapaca
‑
2细胞的胰腺癌异种小 鼠模型中,单独或与吉西他滨联合的每天一次静脉内coq10给药对 存活时间(天)的影响的曲线图。在该图中,第1天指开始治疗的那 天。
156.图2为示出在使用人胰腺肿瘤miapaca
‑
2细胞的胰腺癌异种小 鼠模型中,单独或与吉西他滨联合的每天一次静脉内coq10给药对 死亡时肿瘤大小的影响的照片。组1中的肿瘤在治疗开始后20天时 采集。组2中的肿瘤在治疗开始后50
‑
60天时采集。组3中的肿瘤
在 治疗开始后40
‑
50天时采集。组4中的肿瘤在治疗开始后50
‑
60天时 采集。
157.图3为示出在使用人胰腺肿瘤miapaca
‑
2细胞的胰腺癌异种小 鼠模型中,单独或与吉西他滨联合的每天一次静脉内coq10给药对 死亡时肿瘤大小的影响的曲线图。组1中的肿瘤在治疗开始后20天 时采集。组2中的肿瘤在治疗开始后50
‑
60天时采集。组3中的肿瘤 在治疗开始后40
‑
50天时采集。组4中的肿瘤在治疗开始后50
‑
60天 时采集。
158.图4为示出在使用人胰腺肿瘤miapaca
‑
2细胞的胰腺癌异种小 鼠模型中,单独或与吉西他滨联合的每天两次静脉内coq10给药对 存活时间(天)的影响的曲线图。在该图中,第1天指开始治疗的那 天。
159.图5a为示出使用吉西他滨、coq10、coq10静脉内制剂或与吉 西他滨联合的coq10静脉内制剂处理6小时对体外miapaca
‑
2胰腺 癌细胞存活力的影响的图表。
160.图5b为示出使用吉西他滨、coq10、coq10静脉内制剂或与吉 西他滨联合的coq10静脉内制剂处理6小时对体外sk
‑
br3乳腺癌细 胞存活力的影响的图表。
161.图6a为示出使用多柔比星、coq10、coq10静脉内制剂或与多 柔比星联合的coq10静脉内制剂处理6小时对体外miapaca
‑
2胰腺 癌细胞存活力的影响的图表。
162.图6b为示出使用多柔比星、coq10、coq10静脉内制剂或与多 柔比星联合的coq10静脉内制剂处理6小时对体外sk
‑
br3乳腺癌细 胞存活力的影响的图表。
163.图7为示出在使用人胰腺肿瘤miapaca
‑
2胰腺癌细胞的胰腺癌 异种小鼠模型中,每天一次静脉内coq10与多柔比星或单独的多柔 比星给药对存活时间的影响的曲线图。
164.图8为示出在使用人胰腺肿瘤miapaca
‑
2细胞的胰腺癌异种小 鼠模型中,单独或与吉西他滨联合地每天三次以指定剂量腹膜内给药 coq10静脉内制剂对存活时间的影响的曲线图。在该图中,第1天指 开始治疗的那天。
165.图9a为示出单独或与coq10(100μm)联合使用化疗剂伊立替 康(sn38)处理对体外hep3b肝癌细胞存活力的影响的图表。存活 力通过活细胞计数来评估。值相对于既未用coq10又未用化疗剂处 理的细胞数归一化。
166.图9b为示出单独或与coq10(100μm)联合使用化疗剂顺铂处 理对体外hep3b肝癌细胞存活力的影响的图表。存活力通过活细胞 计数来评估。值相对于既未用coq10又未用化疗剂处理的细胞数归 一化。
167.图9c为示出单独或与coq10(100μm)联合使用化疗剂5
‑
氟尿 嘧啶处理对体外hep3b肝癌细胞存活力的影响的图表。存活力通过 活细胞计数来评估。值相对于既未用coq10又未用化疗剂处理的细 胞数归一化。
168.图10为示出单独或与coq10(100μm)联合使用化疗剂多柔比 星处理对体外hep3b肝癌细胞存活力的影响的图表。存活力通过活 细胞计数来评估。值相对于既未用coq10又未用化疗剂处理的细胞 数归一化。
169.图11a
‑
11b示出了用单独或与coq10(100μm)联合的吉西他 滨处理的mia
‑
paca2胰腺癌细胞的图像。(a)辅酶q10在加入化疗 之前6小时添加,或(b)辅酶q10与化疗同时添加。
170.图12a
‑
12b为示出其中miapaca2胰腺癌细胞用单独或与 coq10(100μm)联合的吉西他滨处理的生长抑制/细胞死亡促进分析 的结果的图表。(a)辅酶q10在加入化疗之前6小时添加,或(b) 辅酶q10与化疗同时添加。生长抑制/细胞死亡促进通过活细胞计数 来评估。值相对于既未用coq10又未用化疗剂处理的细胞数归一化。
171.图13为示出其中在通过使用染色活细胞的细胞示踪染料cfse 的流式细胞分析来评估增殖之前,miapaca2胰腺癌细胞用单独或与 coq10联合的吉西他滨处理的增殖分析结果的图表。值相对于既未用 coq10又未用化疗剂处理的细胞数归一化。
172.图14为示出其中在通过使用染色死细胞的碘化丙啶的流式细胞 分析来评估剩余粘附细胞的凋亡之前,miapaca2胰腺癌细胞用单独 或与coq10联合的吉西他滨处理的分析的结果的图表。值相对于既 未用coq10又未用化疗剂处理的细胞数归一化。
173.图15为示出在使用人胰腺肿瘤miapaca
‑
2胰腺癌细胞的胰腺癌 异种小鼠模型中,与吉西他滨(150mg/kg/剂,每3周1次)联合的 coq10静脉内制剂(75mg/kg/剂)每天三次腹膜内给药对存活时间的 影响的曲线图。在吉西他滨治疗开始前0、1、2或3周开始施用coq10。 在该图中,第1天指开始治疗的那天。
174.图16示出了coq10处理对体外各种肿瘤细胞系存活力的影响。 细胞用100μm coq10处理48
‑
72小时。
175.图17示出了coq10处理对体外乳腺癌细胞(mda
‑
mb231和 skbr
‑
3)和非致瘤性对照细胞(mcf12a)中的基础耗氧率(ocr)、 细胞外酸化率(ecar)和活性氧物质(ros)的影响。细胞用100μm coq10处理24小时。
176.图18示出了coq10处理对乳腺癌细胞(mda
‑
mb231和skbr
‑
3) 中的半胱天冬酶3活性的影响。
177.图19示出了在a549、pc3和skov3癌细胞中,使用coq10与 各种化疗剂的组合的共处理与预处理的效果。
178.图20示出了经受coq10(100μm)与化疗剂(5
‑
氟尿嘧啶,5
‑
fu; 多柔比星,doxo;sn38,伊立替康活性代谢物)共处理或coq10预 处理(6小时)接着与化疗剂共孵育的mda
‑
mb231和skbr
‑
3乳腺 癌细胞及mcf12a对照细胞。在48小时后评估活细胞的数量。p值 表示双因素方差分析的交互作用。与单独的化疗剂相比,*p<0.05。
179.图21示出了携带三阴性乳腺癌(tnbc)异种移植物并用具有和 不具有75mg/kg体重的coq10(bpm 31510)的tac方案(5mg/kg 多西紫杉醇、1mg/kg多柔比星和35mg/kg环磷酰胺)治疗的小鼠的 存活曲线。tac每三周给予,共六个周期。
180.图22示出了用100μm coq10(bpm 31510)和100ng/ml多柔比 星共处理的skbr
‑
3乳腺癌细胞。使用可裂解的荧光底物随时间监测 半胱天冬酶3活性。
181.图23示出了用增加剂量的coq10(bpm 31510)处理的 mda
‑
mb231和skbr
‑
3乳腺癌细胞及mcf12a非致瘤性对照细胞。 在48小时后评估活细胞数量。使用非线性回归分析计算ec
50
值。
182.图24示出了用100μm coq10(bpm 31510)处理48小时的 mda
‑
mb231和skbr
‑
3乳腺癌细胞及mcf12a非致瘤性对照细胞。 分别使用碘化丙啶(pi)和cfse细胞示踪剂测量经coq10处理的细 胞中的细胞死亡和增殖。
183.图25示出了用100μm coq10(bpm 31510)处理24小时的 mda
‑
mb231和skbr
‑
3乳腺癌细胞及mcf12a非致瘤性对照细胞。 在seahorse xf96分析仪中使用线粒体毒素(寡霉素、cccp和鱼藤 酮)顺序注射来评估线粒体功能。还测量dcf荧光作为以相同方式 处理的细胞中活性氧物质产生的指示。与对照相比,*p<0.05,n.s. 表示无统计学显著性。
184.图26示出了使用100μm coq10(bpm31510)的人胰腺癌细胞 (pcca2)预处理,接着
使用吉西他滨(0.1、1和5μm)处理,或者 这些细胞使用coq10和吉西他滨共处理。与单独的吉西他滨相比, 预处理和共处理均显著减少活细胞的数量(*p<0.05)。
185.图27示出了在人胰腺癌异种移植小鼠模型中,用于评价单独或 与吉西他滨联合的coq10(bpm 31510)对动物存活的影响的三个治 疗方案。
186.图28示出了在人胰腺癌异种移植小鼠模型中,coq10(api 31510)和吉西他滨的方案2(图27中描述)治疗对动物存活的影响。 单独的吉西他滨对比吉西他滨 coq10(50mg/kg),p=7.3e
‑8187.图29示出了在人胰腺癌异种移植小鼠模型中,coq10(api 31510)和吉西他滨的方案3(图27中描述)治疗对动物存活的影响。 单独的吉西他滨对比吉西他滨 coq10(50mg/kg),p=7.3e
‑8188.图30示出了在人胰腺癌异种移植小鼠模型中,各种浓度的coq10 (bpm 31510)随时间(天)对动物存活的影响。与50mg/kg coq10 相比,以200mg/kg连续输注coq10显著改善存活(p<0.00001)。 例如,200mg/kg coq10治疗的小鼠在300天时具有最高的存活率(存 活概率),50mg/kg coq10治疗的小鼠在300天时具有最低的存活率 (存活概率),和100mg/kg coq10治疗的小鼠在300天时具有介于 其它两个治疗组之间的存活率(存活概率)。
189.图31示出了在人胰腺癌小鼠异种移植模型中,coq10和吉西他 滨随时间(天)对动物存活的影响。在人胰腺癌小鼠异种移植模型中, 在吉西他滨 coq10治疗开始之前六十天使用coq10(200mg/kg) 预治疗与在治疗方案开始时使用吉西他滨 coq10治疗相比改善了 存活。例如,在200天时,在吉西他滨开始之前使用coq10治疗60 天并持续使用coq10治疗的小鼠具有最高的存活率(存活概率), 从开始使用吉西他滨和coq10治疗的小鼠具有第二高的存活率,从 开始使用coq10治疗的小鼠具有第三高的存活率,而对照小鼠具有 最低的存活率。
具体实施方式
190.i.定义
191.根据本公开并如本文所用,除明确指出以外,以下术语定义为具 有以下含义。
192.如本文所用,“药学上可接受的”组分是适用于人和/或动物而无过 度的不良副作用(如毒性、刺激和过敏反应)并具有合理的收益/风 险比的那些。
[0193]“治疗”是意图防止疾病发展或改变疾病的病理、症状或体征而进 行的干预。因此,“治疗”指治疗性治疗及预防性或防止性措施。需要 治疗的那些包括已经患有疾病的那些以及要预防疾病的那些。如本文 所用,“治疗”指的是接近于标准化值(例如在健康患者或个体中获得 的值)的症状或体征,例如,如使用常规统计检验测定的,与标准化 值的差异小于50%,在一些实施方案中与标准化值的差异小于约 25%,在其它实施方案中与标准化值的差异小于10%,和在再其它的 实施方案中存在与标准化值无明显差异的症状。如本文所用,治疗可 包括减小肿瘤负荷、抑制肿瘤生长,包括在治疗前患有进行性疾病的 受试者中诱导稳定的疾病、延长到进展的时间或增加存活时间。增加 可相对于合适的对照或预期的结果来确定。如本文所用,治疗可包括 与合适的对照相比,在肿瘤负荷减小或不减小的情况下增加受试者的 存活。治疗不必是治愈性的。
[0194]
如本文所用,“周期”应理解为用于施用coq10或化疗剂的方案。 通常,化疗剂不作
为单一治疗或以连续的固定间隔(例如,每天、每 周)的治疗施用。周期包括化疗治疗的时间及之后在下次治疗之前的 间隔。例如,周期持续4周,可具有第1天、第2天和第3天的治疗 及然后从第4天到第28天不进行治疗。然后周期再次开始。或者, 作为另一实例,3周的周期可在第1和第8天进行治疗,而在第2至 7天和第9至21天不进行治疗。在某些实施方式中,周期可包括按照 相同或不同时间表的化疗剂组合的治疗,然后是非治疗窗口以允许恢 复。
[0195]
在某些实施方式中,在施用至少一个周期的至少一种化疗剂之前 施用一个周期的coq10。在其它实施方式中,在施用至少一个周期的 至少一种化疗剂之前施用两个或更多个周期的coq10。在进一步的实 施方式中,在施用至少一个周期的化疗剂之前施用三个或更多个周期 的coq10。在又进一步的实施方式中,在施用至少一个周期的化疗剂 之前施用四个或更多个周期的coq10。
[0196]
如本文所用,“连续输注”应理解为连续地施用治疗剂至少24小 时的时间。连续输注通常通过使用泵、任选地使用可植入泵来实现。 连续输注可在治疗周期的背景下施用。例如,一剂治疗剂可通过各周 的每周一次24小时的连续输注来施用。使用连续输注的治疗不需要 在整个治疗期间向受试者输注治疗剂。
[0197]
应理解,连续输注可包括短暂的施用中断,例如以更换被施用的 辅酶q10的储器。连续施用通常通过泵的使用来促进。连续输注的进 行不包括故意的任何明显给药中断。如本文所用,中断以评估生命体 征和/或进行实验室评估以确保患者的安全和不发生不可接受的不良 事件不被认为是明显的中断。因设备故障如泵故障导致的中断不是故 意的中断。
[0198]
术语“肿瘤疾病”、“癌症”或“肿瘤”是本领域公知的,且指的是在 例如受试者中存在具有致癌细胞典型特性(例如失控的增殖、永生性、 转移可能性、快速的生长和增殖速率、减少的细胞死亡/凋亡以及某 些特征性形态特征)的细胞。
[0199]
如本文所用,“肿瘤疾病”、“癌症”或“肿瘤”指在人类中发现的所 有类型的癌症或赘生物或恶性肿瘤,包括但不限于:白血病、淋巴瘤、 黑素瘤、癌瘤和肉瘤。如本文所用,术语或语言“肿瘤疾病”、“癌症”、
ꢀ“
赘生物”和“肿瘤”可互换地使用并以单数或复数形式指的是已经经 历恶性转化的细胞,所述恶性转化使得它们对于宿主生物体是病理性 的。原发性癌细胞(即,从恶性转化部位附近获得的细胞)可通过已 建立的技术特别是组织学检查容易地与非癌细胞区分开来。如本文所 用,癌细胞的定义不仅包括原发性癌细胞,而且包括癌干细胞,以及 癌祖细胞或源自癌细胞祖先的任意细胞。这包括转移的癌细胞以及源 自癌细胞的体外培养物和细胞系。
[0200]“实体肿瘤”是可基于肿瘤团块检测的肿瘤,例如通过如cat扫 描、mr成像、x
‑
射线、超声或触诊的程序;和/或其因为在可获自患 者的样品中一种或多种癌症特异性抗原的表达而可检测。肿瘤不必具 有可测量的维度。
[0201]
在提及通常表现为实体肿瘤的癌症类型时,“临床可检测的”肿瘤 是基于肿瘤团块可检测的肿瘤,例如通过如cat扫描、mr成像、 x
‑
射线、超声或触诊的程序;和/或其因为在可获自患者的样品中一 种或多种癌症特异性抗原的表达而可检测。
[0202]
如本文所用,“可检测的肿瘤”是在实体肿瘤的情况中,可例如使 用成像方法(例如,x
‑
射线、ct扫描、有或无造影剂的磁共振成像、 超声)、触诊或其它物理检查方法,和/或通过外科手术方法或活检 的直接观察(通常与组织学分析结合);或者在非实体肿瘤例如
白血 病的情况中,通过血液样品的分析如全血计数或组织学分析,确认存 在于受试者中的肿瘤。在某些实施方式中,肿瘤可基于某些标志物的 存在来检测。应理解,肿瘤的诊断和检测可包括多种试验和诊断方法。
[0203]
术语“肉瘤”通常指由如胚性结缔组织的物质构成并通常由包埋 在纤维性或均质物质中的紧密包装的细胞组成的肿瘤。可用iv制剂 中的coq10胶状分散体治疗的肉瘤实例包括例如软骨肉瘤、纤维肉 瘤、淋巴肉瘤、黑素肉瘤、粘液肉瘤、骨肉瘤、abemethy肉瘤、脂 肉瘤、脂肪肉瘤、腺泡状软组织肉瘤、成釉细胞肉瘤、葡萄状肉瘤、 绿色瘤肉瘤、绒毛膜癌、胚胎性肉瘤、维尔姆斯肿瘤肉瘤、子宫内膜 肉瘤、间质肉瘤、尤因氏肉瘤、筋膜肉瘤、纤维母细胞肉瘤、巨细胞 肉瘤、粒细胞肉瘤、霍奇金肉瘤、特发性多发性色素沉着出血性肉瘤、 b细胞免疫母细胞肉瘤、淋巴瘤、t细胞免疫母细胞肉瘤、詹森肉瘤、 卡波西肉瘤、库普弗细胞肉瘤、血管肉瘤、白色肉瘤、恶性间叶瘤肉 瘤、骨膜外肉瘤、网状细胞肉瘤、劳斯肉瘤、浆液囊性肉瘤、滑膜肉 瘤和毛细血管扩张性肉瘤。
[0204]
术语“黑素瘤”用来指从皮肤及其它器官的黑素细胞系统产生的 肿瘤。可用iv制剂中的coq10胶状分散体治疗的黑素瘤包括例如肢 端
‑
雀斑样痣性黑素瘤、无黑色素性黑素瘤、良性幼年黑素瘤、 cloudman黑素瘤、s91黑素瘤、harding
‑
passey黑素瘤、幼年黑素瘤、 恶性雀斑样痣黑素瘤、恶性黑素瘤、结节性黑素瘤、甲下黑素瘤和浅 表扩散黑素瘤。
[0205]
术语“癌瘤”是指由倾向于浸润周围组织并引起转移的上皮细胞 构成的恶性新生长。可用如本文所述的iv制剂中的coq10胶状分散 体治疗的癌瘤包括例如腺泡癌(acinar carcinoma)、腺泡状癌(acinouscarcinoma)、腺囊性癌(adenocystic carcinoma)、腺样囊性癌(adenoidcystic carcinoma)、腺瘤癌(carcinoma adenomatosum)、肾上腺皮 质癌(carcinoma of adrenal cortex)、肺泡癌(alveolar carcinoma)、 肺泡细胞癌(alveolar cell carcinoma)、基底细胞癌(basal cellcarcinoma)、基底细胞性癌(carcinoma basocellulare)、基底细胞样 癌(basaloid carcinoma)、基底鳞状细胞癌(basosquamous cellcarcinoma)、细支气管肺泡癌(bronchioalveolar carcinoma)、细支 气管癌(bronchiolar carcinoma)、支气管原癌(bronchogeniccarcinoma)、髓状癌(cerebriform carcinoma)、胆管细胞癌 (cholangiocellular carcinoma)、绒毛膜癌(chorionic carcinoma)、 胶样癌(colloid carcinoma)、粉刺状癌(comedo carcinoma)、子宫 体癌(corpus carcinoma)、筛状癌、铠甲状癌、皮肤癌(carcinomacutaneum)、圆柱细胞癌、柱状细胞癌、导管癌、硬癌(carcinomadurum)、胚胎性癌、髓样癌(encephaloid carcinoma)、表皮样癌、 腺样上皮癌、外植癌、溃疡性癌、纤维癌(carcinoma fibrosum)、胶 样癌(gelatiniform carcinoma)、胶状癌(gelatinous carcinoma)、巨 大细胞癌(giant cell carcinoma)、巨细胞癌(carcinomagigantocellulare)、腺癌、颗粒细胞癌、发基质癌、血样癌、肝细胞 癌、许特耳细胞癌、透明癌(hyaline carcinoma)、肾透明细胞样癌 (hypemephroid carcinoma)、幼稚型胚胎性癌、原位癌、表皮内癌、 上皮内癌、krompecher癌、支气管k细胞癌(kulchitzky
‑
cellcarcinoma)、大细胞癌、豆状癌(lenticular carcinoma)、豆状癌 (carcinoma lenticulare)、脂瘤癌、淋巴上皮癌、髓样癌(carcinomamedullare)、髓样癌(medullary carcinoma)、黑色素癌、软癌(carcinomamolle)、梅克尔细胞癌、粘液癌、胶样癌、粘液细胞癌、粘液表皮 样癌、粘液癌、粘液性癌(mucinous carcinoma)、粘液癌(carcinomamuciparum)、粘液细胞癌(carcinoma mucocellulare)、粘
液表皮样癌(mucoepidermoidcarcinoma)、粘液癌(carcinomamucosum)、粘液癌(mucouscarcinoma)、粘液瘤样癌、鼻咽癌、燕麦细胞癌、骨化性癌、骨样癌、乳头状癌、门脉周围癌、浸润前癌(preinvasivecarcinoma)、棘细胞癌、软糊状癌(pultaceouscarcinoma)、肾脏的肾细胞癌、储备细胞癌、肉瘤样癌、施奈德癌、硬癌(scirrhouscarcinoma)、阴囊癌、印戒细胞癌、单纯癌、小细胞癌、马铃薯样癌、球样细胞癌、梭形细胞癌、海绵样癌、鳞状癌、鳞状细胞癌、绳捆癌(stringcarcinoma)、血管扩张性癌(carcinomatelangiectaticum)、毛细管扩张性癌(carcinomatelangiectodes)、移行细胞癌、结节性皮癌(carcinomatuberosum)、结节性癌、疣状癌和绒毛状癌(carcinomavillosum)。
[0206]
癌症分期的具体标准取决于具体的癌症类型,其基于肿瘤大小、组织学特征、肿瘤标志物及本领域技术人员已知的其它标准。通常,癌症分期可描述如下:
[0207]
0期:原位癌
[0208]
i期、ii期和iii期:数越高表示疾病越广泛:较大的肿瘤大小和/或癌症扩散超出其最先在其中出现的器官到附近的淋巴结和/或邻近原发性肿瘤位置的组织或器官
[0209]
iv期:癌症已扩散到远处的组织或器官
[0210]
如本文所用,术语“治疗(treat)”、“处理(treating)”或“疗法(treatment)”优选指获得有利或期望的临床结果的行为,所述有利或期望的临床结果包括但不限于减轻或改善疾病或病症的一个或多个体征或症状(例如,部分或完全退化)、减轻疾病程度、疾病的稳定状态(即,不恶化,获得稳定的疾病)、改善或缓和疾病状态、减小进展率或时间以及缓解(无论是部分的还是完全的)。癌症的“治疗”也可指与在不存在治疗的情况下与预期的存活相比延长的存活。治疗不必是治愈性的。在某些实施方式中,治疗包括如由有资质的个体如治疗医生使用例如公认的疼痛和生活质量(qol)评估工具判断的疼痛减轻或生活质量qol提高中的一种或多种。在某些实施方式中,治疗不包括如由有资质的个体如治疗医生使用例如公认的疼痛和生活质量(qol)评估工具判断的疼痛减少或qol提高中的一种或多种。
[0211]
recist标准为临床上公认的用来提供实体肿瘤测量的标准方法,并为肿瘤大小变化的客观评估提供定义的用于临床试验中的评估标准。这样的标准也可用来监测经受实体肿瘤的治疗的个体的反应。recist1.1标准在eisenhauer等,newresponseevaluationcriteriainsolidtumors:revisedrecistguideline(version1.1).eur.j.cancer.45:228
‑
247,2009中详细讨论,其以引用方式并入本文中。靶病灶的反应标准包括:
[0212]
完全反应(cr):所有靶病灶均消失。任意病理性淋巴结(无论是靶标还是非靶标)必须在短轴上减小到<10mm。
[0213]
部分反应(pr):以基线直径总和为参照,靶病灶的直径总和减小至少30%。
[0214]
进行性疾病(pd):以研究中的最小总和(这包括基线总和,如果其在研究中是最小的)为参照,靶病灶的直径总和增大至少20%。除20%的相对增大外,总和必须还显示至少5mm的绝对增大。(注:一个或多个新病灶的出现也被视为是进展。)
[0215]
稳定的疾病(sd):以研究时的最小直径总和为参照,既不充分缩小至达到pr标准又不充分增大至达到pd标准。
[0216]
recist 1.1标准还考虑非靶病灶,其被定义为可能可测量但不必 被测量,且仅应当在期望时间点定性评估的病灶。非靶病灶的反应标 准包括:
[0217]
完全反应(cr):所有非靶病灶消失并且肿瘤标志物水平正常 化。所有淋巴结在大小上都必须是非病理性的(短轴<10mm)。
[0218]
非cr/非pd:一个或多个非靶病灶留存和/或肿瘤标志物水平保 持高于正常限度。
[0219]
进行性疾病(pd):现存非靶病灶的明确进展(强调原初)。 一个或多个新病灶的出现也被视为进展。为在非靶疾病的基础上取得
ꢀ“
明确进展”,必须有非靶疾病整体水平的实质性恶化,使得即便在靶 疾病中存在sd或pr的情况下,总体肿瘤负荷也充分增大至应当中 断治疗。一个或多个非靶病灶尺寸的适度“增大”通常不足以作为明确 进展状态。因此面对靶疾病中的sd或pr,仅仅基于非靶疾病中的变 化而称为总体进展是极其少见的。
[0220]
在急性白血病中治疗反应的临床可接受标准如下:
[0221]
完全缓解(cr):患者必须无白血病相关的所有症状并具有嗜 绝对中性粒细胞计数≥1.0x109/l、血小板计数≥100x109/l以及具有 <5%胚细胞且无auer小体的正常骨髓。
[0222]
血细胞计数恢复不完全的完全缓解(cri):按照ce,但具有残 余的血小板减少症(血小板计数<100x109/l)或残余的嗜中性粒细 胞减少症(绝对嗜中性细胞计数<1.0x109/l)。
[0223]
部分缓解(pr):骨髓胚细胞减少≥50%至骨髓中5至25%异常 细胞;或若存在auer小体,胚细胞<5%的cr。
[0224]
治疗失败:治疗未能实现cr、cri或pr。复发。
[0225]
确认的cr后复发:白血病胚细胞在外周血中重现,或者不可归 因于任意其它原因(例如,巩固治疗后的骨髓再生)的骨髓中≥5%的 胚细胞,或者出现新的发育异常的变化。
[0226]“化疗剂”是指用于治疗癌症的药物。化疗剂包括但不限于小分 子、激素和激素类似物以及生物制剂(例如,抗体、肽药物、核酸药 物)。在某些实施方式中,化疗不包括激素和激素类似物。
[0227]“化疗方案”是用于治疗癌症的临床上接受的给药方案,其包括依 照特定时间表以特定量向受试者施用一种或多种化疗剂。在某些实施 方式中,化疗剂可以是临床试验中的药剂。
[0228]
如本文所用,“共施用”或“联合疗法”应理解为使用单独的制剂或 单一药物制剂施用两种或更多种活性剂,或者以任意顺序相继施用, 使得存在两种(或全部)活性剂同时发挥其生物活性的时间段。本文 中预想一种活性剂(例如,coq10)可改善第二药剂的活性,例如, 可使靶细胞如癌细胞对第二药剂的活性敏感。共施用不要求药剂在相 同时间、以相同频率或通过相同给药途径施用。如本文所用,“共施 用”或“联合疗法”包括施用coq10化合物与一种或多种另外的抗癌剂 如化疗剂,或者施用两种或更多种coq10化合物。本文中提供了抗 癌剂(包括化疗剂)的实例。
[0229]
在优选实施方式中,在本文中提供的治疗方法中与coq10联合 施用的另外的抗癌剂例如化疗剂或化疗方案不包括coq10,排除 coq10。
[0230]
化疗方案可包括依照预定“周期”施用药物,所述“周期”包括施用 和不施用一种或多种用于治疗癌症的药剂的时间间隔。例如,可以连 续三周每周一次或多次施用药剂,然后一周不施用药剂,以提供四周 的周期。可以重复该周期以使得受试者经受三个治疗
周、一个非治疗 周、三个治疗周、一个非治疗周,等等,持续期望数量的周期。在某 些实施方式中,在每个周期结束时或每隔一个周期评估治疗疗效和实 验室值(例如,肝酶、血计数、肾功能)。
[0231]“化疗方案失败的受试者”是根据recist 1.1标准(参见 eisenhauer等,2009和如上文讨论的)患有对使用化疗方案的治疗无 反应或停止反应的癌症的受试者,即在单独的或与在可能的情况下通 常临床上指定与化疗结合的外科手术和/或放疗相结合的化疗方案过 程中或结束后,未在靶病灶中获得至少稳定的疾病(即,稳定的疾病、 部分反应或完全反应);或未实现至少非靶病灶的非cr/非pd(即, 非cr/非pd或完全反应)的受试者。失败的化疗方案导致例如肿瘤 生长、增大的肿瘤负荷和/或肿瘤转移。在一些实施方式中,如本文 所用,失败的化疗方案包括由于剂量限制性毒性如iii级或iv级毒性 而终止的治疗方案,所述剂量限制性毒性不能被解决以允许继续或恢 复使用引起毒性的化疗剂或方案的治疗。在一些实施方式中,失败的 化疗方案包括在延长的时间段内,如至少1个月、至少2个月、至少 3个月、至少4个月、至少5个月、至少6个月、至少12个月、至少 18个月或低于临床定义的治愈的任意时间段,对于所有靶和非靶病灶 不导致至少稳定疾病的治疗方案。在一些实施方式中,失败的化疗方 案包括在化疗剂治疗过程中导致至少一个靶病灶的进行性疾病,或在 治疗方案结束后不到2周、不到1个月、不到两个月、不到3个月、 不到4个月、不到5个月、不到6个月、不到12个月或不到18个月 或者不到低于临床定义的治愈的任意时间段导致进行性疾病的治疗 方案。
[0232]
失败的化疗方案不包括其中经癌症治疗的受试者达到临床定义 的治愈,例如在治疗方案结束后5年的完全反应,以及其中受试者随 后例如在治疗方案结束后超过5年、超过6年、超过7年、超过8年、 超过9年、超过10年、超过11年、超过12年、超过13年、超过14 年或超过15年诊断出不同癌症的治疗方案。例如,患有儿科癌症的 受试者可能在该儿科癌症治愈后的生活中发生癌症。在这样的受试者 中,治疗儿科癌症的化疗方案被认为已成功。
[0233]“难治性癌症”是外科手术无效的恶性肿瘤,其在开始对化疗或放 疗无反应,或者其随时间变得对化疗或放疗无反应。
[0234]“治疗有效量”是足以治疗受试者的疾病的量。治疗有效量可以一 次或多次施用来施用。
[0235]
术语“施用(administer)”、“给药(administering)”或“用药 (administration)”包括向受试者的系统中或向受试者中或受试者上的 特定区域递送药物组合物或药剂的任意方法。在某些实施方式中,药 剂经口递送。在某些实施方式中,药剂肠胃外施用。在某些实施方式 中,药剂通过注射或输注递送。在某些实施方式中,药剂局部递送, 包括经粘膜递送。在某些实施方式中,药剂通过吸入递送。在本发明 的某些实施方式中,药剂通过肠胃外递送来施用,包括静脉内、肌内、 皮下、髓内注射以及鞘内、直接心室内、腹膜内、鼻内或眼内注射。 在一个实施方式中,本文提供的组合物可通过直接注射到肿瘤来施 用。在一些实施方式中,本发明的制剂可通过静脉内注射或静脉内输 注来施用。在某些实施方式中,本发明的制剂可通过连续输注来施用。 在某些实施方式中,施用不是口服的。在某些实施方式中,施用是全 身性的。在某些实施方式中,施用是局部的。在一些实施方式中,可 组合一种或多种给药途径,如静脉内和肿瘤内、或者静脉内和经口、 或者静脉内和口服、静脉内和局部、或者静脉内和经皮或经粘膜。施 用药剂可通过多人协同工作来进行。施用药剂包
括例如向受试者开具 待施用药剂的处方和/或直接或通过他人提供通过自身递送(如通过 口服递送)、皮下递送、通过中心导管的静脉内递送等来服用特定药 剂的指导;或者由受过训练的专业人员递送,如静脉内递送、肌内递 送、肿瘤内递送等。
[0236]“不良事件”或“ae”由取决于严重度的等级表征。一些ae(例如, 恶心、低血液计数、疼痛、降低的血液凝结)可以被治疗,使得可以 继续或恢复特定化疗方案。一些不良事件(例如,心脏、肝脏或肾脏 功能的损失;恶心)可能不是可治疗的,从而需要终止药物治疗。ae 等级的确定和适当的干预可由本领域技术人员确定。不良事件的通用 术语标准(ctcae)第4.0版(出版日期:2009年5月28日)提供 了如下的不良事件分级量表:
[0237]
1级:轻度;无症状或轻微症状;仅有临床或诊断观察;不需要 干预。
[0238]
2级:中等;需要最低限度的、局部的或非侵入性的干预;限制 适龄的日常器械活动(adl)。
[0239]
3级:严重或医学上显著但不直接威胁生命的;需要住院治疗或 延长住院治疗;致残,限制自我护理的adl。
[0240]
4级:威胁生命的后果;需要紧急干预。
[0241]
5级:与不良事件相关的死亡。
[0242]
如本文所用,术语“存活”是指已经治疗疾病或病症如癌症的受试 者的生命的延续。存活时间可从任意点如进入临床试验的时间、早前 治疗方案完成或失败的时间、诊断的时间等定义。
[0243]
如本文所用,“调理作用”是指如本文所述的亲脂性生物活性剂经 标记以由吞噬细胞摄取和破坏的过程。调理作用包括调理素结合到生 物活性剂。在调理素结合到膜后,吞噬细胞被吸引到活性剂。调理素 是充当吞噬过程的结合增强剂的任意分子。
[0244]
如本文所用,术语“调理作用缩减剂”是指与活性剂结合地作用以 降低调理素充当吞噬过程的结合增强剂的能力的任意药剂。
[0245]
如本文所用,“分散体”是指其中任意性质(例如,固体、液体或 气体)的胶体尺寸的颗粒分散在不同组成或状态的连续相中的体系。 在静脉内药物递送中,连续相基本上是水而分散的颗粒可以是固体 (混悬液)或不混溶的液体(乳液)。
[0246]
待通过本发明方法治疗的“受试者”可以是指人或非人动物,优选 哺乳动物,更优选人。在某些实施方式中,受试者在开始使用本发明 方法治疗之前具有可检测的肿瘤。在某些实施方式中,受试者在使用 本发明方法开始治疗时具有可检测的肿瘤。
[0247]
如本文所用,术语“安全和治疗有效量”是指当以本公开的方式使 用时,足以产生期望的治疗反应而无过度的不良副作用(如毒性、刺 激或过敏反应)并具有合理的收益/风险比的组分量。
[0248]“治疗有效量”是指在施用于患者以治疗疾病时,足以使这样的疾 病治疗生效的化合物量。在施用以预防疾病时,该量足以避免或延迟 疾病发作。“治疗有效量”将根据化合物、疾病及其严重度以及待治疗 的患者的年龄、体重等而发生变化。治疗有效量不必是治愈性的。治 疗有效量不必一起防止疾病或病症发生。相反,治疗有效量是至少延 迟或减少疾病或病症的发作、严重度或进展的量。疾病进展可例如通 过肿瘤负荷、到进展的时间、存活时间或本领域中使用的其它临床测 量中的一种或多种来监测。
[0249]
术语“治疗效果”指由药理活性物质在动物、特别是哺乳动物和更 特别是人中引
起的局部或全身性效果。该术语因此是指预期用在疾病 的诊断、治愈、缓解、治疗或预防中或者用在增强动物或人中的期望 身体或精神发育和状况中的任意物质。短语“治疗有效量”是指以可适 用于任意治疗的合理收益/风险比产生一些期望的局部或全身性效果 的这种物质的量。在某些实施方式中,化合物的治疗有效量将取决于 其治疗指数、溶解度等。
[0250]“预防(preventing)”或“防止(prevention)”是指降低获得疾病 或病症的风险(即,使得疾病的临床体征或症状中的至少之一不在可 能暴露于或易患该疾病但尚未经历或显示出该疾病症状的受试者中 发生)。预防不要求疾病或病症在受试者中从未发生或复发。
[0251]
术语“病症(disorders)”和“疾病(diseases)”被包涵性地使用并 且指的是与身体的任意部位、器官或系统(或其任意组合)的正常结 构或功能的任意偏离。特定的疾病由特征性的症状和体征表现,包括 生物学、化学和物理学变化,并常常与多种其它因素相关联,包括但 不限于人口统计学、环境、职业、遗传和医疗史因素。某些特征性的 体征、症状和相关因素可通过多种方法量化以给出重要的诊断信息。
[0252]
在本技术中出现一系列列举数值的所有地方,应理解任意所列举 的数值可以是数值范围的上限或下限。还应理解本发明涵盖所有这样 的数值范围,即具有数值上限和数值下限的组合的一个范围,其中上 限和下限各自的数值都可以是本文中列举的任意数值。本文提供的范 围应理解为包括该范围内的所有值。例如,1
‑
10应理解为包括值1、 2、3、4、5、6、7、8、9和10中的全部,并视情况包括分数值。表 达为“高达”某个值(例如高达5)的范围应理解为所有值(包括该范 围的上限),例如0、1、2、3、4和5,并视情况包括分数值。至多 一周或在一周内应理解为包括0.5、1、2、3、4、5、6或7天。类似 地,由“至少”限定的范围应理解为包括所提供的较低值和所有更高的 值。
[0253]
除非另有指出,所有百分比形式是重量/重量。
[0254]
如本文所用,“约”应理解为包括在平均值的三个标准偏差内或特 定领域中的标准公差范围内。在某些实施方式中,约应理解为不超过 0.5的变异。
[0255]
冠词“一(a)”和“一个(an)”在本文中用以指一个或超过一个(即, 至少一个)该冠词的语法客体。举例来说,“一个元素”指一个元素或 超过一个元素。
[0256]
术语“包括”在本文中用以指短语“包括但不限于”并可与其互换 地使用。
[0257]
除非上下文另有明确指出,术语“或”在本文中包含性地用以指术 语“和/或”并可与其互换地使用。
[0258]
术语“例如”在本文中用以指短语“例如但不限于”并可与其互换 地使用。
[0259]
如本文所用,术语“标准剂量”是指常用于治疗病症的治疗剂剂 量。例如,治疗剂生产商在产品说明书中描述的治疗剂推荐剂量应视 为标准剂量。化疗剂的标准剂量实例在表3中提供。
[0260]
例如,如表3中所示,用于静脉内使用以治疗卵巢癌的吉西他滨 的标准剂量为在每个21天周期的第1和8天,30分钟的1000mg/m2; 用于静脉内使用以治疗乳腺癌的吉西他滨标准剂量为在每个21天周 期的第1和8天,30分钟的1250mg/m2;用于静脉内使用以治疗非 小细胞肺癌的吉西他滨标准剂量为在每个28天周期的第1、8和15 天,30分钟的1000mg/m2或在每个21天周期的第1和8天,30分 钟的1250mg/m2;以及用于静脉内使用以治疗胰腺癌的吉西他滨标准 剂量为前7周内每周一次,然后休止一周,然后在在每个28天周期 的3周
内每周一次30分钟的1000mg/m2。
[0261]
ii.辅酶q10化合物
[0262]
应理解,本发明中提供的所有方法可涉及施用任意其它的辅酶 q10化合物或其组合来代替辅酶q10。辅酶q10化合物旨在包括一类 coq10化合物。对本文所述方法有效的辅酶q10化合物包括coq10、 coq10代谢物、coq10的生物合成前体、coq10类似物、coq10衍 生物和coq10相关化合物。coq10类似物包括不具有或具有至少一 个异戊二烯基重复的类似物。coq10具有以下结构:
[0263][0264]
其中,x为10。在本发明中,coq10化合物可包括coq10衍生 物,其中x为4
‑
10的任意数量的异戊二烯基单元、或6
‑
10的任意数 量的异戊二烯基单元或8
‑
10的任意数量的异戊二烯基单元、或9
‑
10 个异戊二烯基单元。coq10包括完全氧化的型式(也称泛醌)、部分 氧化的型式(也称半醌或泛半醌)或者完全还原的型式(也称泛醇) 或其任意混合物或组合。在某些实施方式中,用于治疗癌症的coq10 化合物为泛醌。在某些实施方式中,用于治疗癌症的coq10化合物 为泛醇。
[0265]
在本发明的某些实施方式中,治疗剂为辅酶q10(coq10)。辅 酶q10,在本文中也称coq10,还被称为泛醌或泛癸利酮。coq10 是公知的并且还被描述于国际公布号wo 2005/069916(申请号 pct/us2005/001581)、wo 2008/116135(申请号pct/us08/57786)、 wo2010/132507(申请号pct/us2010/034453)、wo 2011/112900 (申请号pct/us2011/028042)和wo2012/174559(申请号 pct/us2012/043001)中,它们中每一者的全文通过引用明确并入本 文。coq10是存在于真核细胞线粒体电子传递系统中的一系列聚戊二 烯基2,3
‑
二甲氧基
‑5‑
甲基苯醌(泛醌)中的一种。人类细胞仅产生 coq10并且其见于所有人类细胞的细胞和线粒体膜中,并在具有高能 量需求的器官如肝脏和心脏中具有最高水平。已估计coq10的身体 库为约2克,其中超过50%是内源性的。每天需要来自饮食或生物合 成的大约0.5克coq10。coq10在全球补充剂市场以成吨的量生产并 可获自kaneka,其工厂在德克萨斯州的pasadena和日本的 takasagoshi。
[0266]
辅酶q10相关化合物包括但不限于苯醌类、类异戊二烯类、法尼 醇类、乙酸法尼基酯、焦磷酸法尼基酯、1
‑
苯丙氨酸、d
‑
苯丙氨酸、 dl
‑
苯丙氨酸、1
‑
酪氨酸、d
‑
酪氨酸、dl
‑
酪氨酸、4
‑
羟基
‑
苯基丙酮酸酯、 4
‑
羟基
‑
苯基乳酸酯、4
‑
羟基
‑
肉桂酸酯、酪氨酸或苯丙氨酸的二肽和 三肽、3,4
‑
二羟基扁桃酸酯、3
‑
甲氧基
‑4‑
羟基苯基乙二醇、3
‑
甲氧基
ꢀ‑4‑
羟基扁桃酸酯、香草酸、乙酸苯酯、吡哆醇、s
‑
腺苷基甲硫氨酸、 泛醇、甲羟戊酸、焦磷酸异戊酯、丁酸苯酯、4
‑
羟基
‑
苯甲酸酯、焦磷 酸十异戊二烯基酯、β
‑
羟基丁酸酯、3
‑
羟基
‑3‑
甲基
‑
戊二酸酯、乙酰肉 毒碱、乙酰乙酰肉毒碱、乙酰甘氨酸、乙酰乙酰甘氨酸、肉毒碱、乙 酸、丙酮酸、3
‑
羟基
‑3‑
甲基戊二酰肉毒碱;丝氨酸、丙氨酸、半胱氨 酸、甘氨酸、苏氨酸、羟脯氨酸、
release drug delivery systems,j.r.robinson,ed., marcel dekker,inc.,new york,1978。
[0273]
例如,coq10化合物如coq10可配制用于肠胃外递送,例如用 于皮下、静脉内、肌内或肿瘤内注射。组合物可以以单次浓注、多次 注射或者通过连续输注(例如,静脉内或通过腹膜透析)施用。对于 肠胃外给药,可将组合物配制为无菌的无热原形式。
[0274]
为了实施本发明,使用药学上可接受的载体将本文中所公开的化 合物配制成适于全身施用的剂型是在本发明的范围之内。通过适当选 择载体和适合的制造实施方法,本公开的组合物,特别是配制为溶液 的那些,可以肠胃外施用,如通过静脉内注射。
[0275]
该类化合物的毒性和疗效可通过标准药物程序在细胞培养物或 实验动物中测定,例如,用于测定ld50(群体50%致死的剂量)和 ed50(50%群体中治疗有效的剂量)。毒性与治疗效果之间的剂量比 为治疗指数,且其可表示为比率ld50/ed50。显示出大的治疗指数的 化合物可能是合乎需要的。从这些细胞培养物分析和动物研究获得的 数据可用于制定人用的剂量范围。该类化合物的剂量可在具有很少或 无毒性的包括ed50的循环浓度范围内。剂量可在该范围内根据所采 用的剂型和所使用的给药途径变化。
[0276]
适用于本发明的药物组合物包括其中以有效量包含活性成分以 实现其预期目的的组合物。有效量的确定完全在本领域技术人员的能 力之内,尤其是参照本文提供的详细公开。除活性成分外,这些药物 组合物可含有帮助将活性化合物加工成可以药用的制剂的合适的药 学上可接受载体,包括赋形剂和辅剂。针对静脉内施用配制的制剂可 以是胶状分散剂的溶液的形式。
[0277]
用于肠胃外给药的药物组合物包括水溶性形式的活性化合物的 水性溶液。另外,活性化合物的混悬液可制备为适宜的油性注射混悬 剂。适合的亲脂性溶剂或媒介包括脂肪油如芝麻油或者合成脂肪酸酯 (如油酸乙酯或甘油三酯类)或者脂质体。水性注射混悬剂可含有增 加混悬液粘度的物质如羧甲基纤维素钠、山梨糖醇或葡聚糖。任选地, 混悬液还可含有适合的稳定剂或提高化合物溶解度以允许制备高度 浓缩溶液的试剂。
[0278]
iv.制剂
[0279]
活性剂(例如coq10化合物,如coq10)可在用于所需的给药途径 的任意药学上可接受的载体中递送。如本文所用,包含coq10化合 物的制剂被配制用于任意给药途径,另有明确指示除外。在优选的实 施方式中,所述制剂用于通过注射、输注或局部给药来施用。在某些 实施方式中,coq10化合物不经口递送。
[0280]
用于本发明方法的优选治疗制剂包含微粒形式的活性剂(例如, coq10化合物,例如coq10)以用于例如静脉内施用。这样的静脉内 制剂在例如wo2011/112900(申请号pct/us2011/028042)中提供, 其全文通过引用明确并入本文,并且如wo2011/112900(申请号 pct/us2011/028042)中所述的示例性静脉内制剂被用于下文所述的 实施例。通过高压均质化,活性剂(例如,coq10化合物,例如coq10) 颗粒被缩小以产生小到足以通过200nm除菌过滤器的颗粒。小到足 以通过200nm除菌过滤器的颗粒可静脉内注射。这些颗粒远小于血 细胞并因此将不栓塞毛细血管。红细胞例如为6微米
×
2微米的圆盘。 颗粒被分散并通过稳定剂包裹或包围。虽然不希望受到任何理论的束 缚,但据信稳定剂被吸引到疏水性治疗剂,使得疏水性治疗剂的分散 颗粒被稳定剂包围,而形成混悬剂或乳剂。混悬剂或乳剂中的分散颗 粒包含稳定剂表面和由固体微粒形式(混悬剂)或不可混溶的液体形 式(乳剂)
的疏水性治疗剂(例如coq10化合物如coq10)组成的 核心。分散颗粒可被确立在脂质体的亲脂性区域中。
[0281]
分散的胶体体系允许在不使用助溶剂的情况下制剂的高载药量。 此外,在不依赖于内源性低密度脂蛋白载体的情况下实现高且相对可 再现的血浆水平。更重要的是,由于疏水性治疗剂的胶体颗粒的被动 积累,制剂允许在实体肿瘤中维持高药物水平。
[0282]
优选的静脉内制剂基本上包含连续的水相和分散的固体(混悬 剂)或分散的不可混溶液体(乳剂)。其中颗粒大部分由活性剂(药 物)自身组成的分散胶体体系可以通常递送比连续溶解体系更多的每 单位体积的药物,如果该体系可制备为充分稳定的话。
[0283]
作为制剂介质,水性溶液可包括hank溶液、ringer溶液、磷酸 盐缓冲盐水(pbs)、生理盐水缓冲液或其它适合的盐或组合,以达 到用于肠胃外递送制剂的适宜ph和渗透压。可使用水性溶液来将用 于施用的制剂稀释至期望浓度。例如,可使用水性溶液来将用于静脉 内施用的制剂从约4重量/体积%的浓度稀释至较低浓度以便于施用 较低剂量的coq10。该水性溶液可含有增大溶液粘度的物质,如羧甲 基纤维素钠、山梨糖醇或葡聚糖。
[0284]
活性剂(例如,coq10化合物,例如coq10)被分散在水性溶液 中以使得形成胶状分散体,其中疏水性治疗剂的纳米分散颗粒被分散 稳定剂覆盖或包裹或围绕而形成活性剂(例如,coq10化合物,例如 coq10)颗粒的纳米分散体。纳米分散的活性剂(例如,coq10化合 物,例如coq10)颗粒具有由被稳定剂包围的疏水性治疗剂形成的核 心。类似地,在某些方面,稳定剂为具有亲水性部分和亲脂性部分的 磷脂。在均质化时,磷脂形成脂质体或其它纳米颗粒。在某些方面, 这些脂质体是双层的单片层脂质体,而在其它实施方式中,脂质体是 双层的多片层脂质体。分散的活性剂(例如,coq10化合物,例如 coq10)颗粒被分散到由磷脂形成的脂质体的双层结构的亲脂性部分 中。在某些其它方面,脂质体的核心,如活性剂(例如,coq10化合 物,例如coq10)颗粒的纳米分散体的核心,由疏水性治疗剂形成, 且外层由磷脂的双层结构形成。在某些实施方式中,胶状分散体通过 冻干工艺处理,从而纳米颗粒分散体被转化为干粉。
[0285]
在一些实施方式中,所用注射或输注用制剂是如wo2011/112900 中制备的纳米混悬液形式的含coq10的4%无菌水性胶状分散体。在 某些实施方式中,制剂包含水性溶液;分散以形成颗粒的胶状纳米分 散体的疏水性活性剂,例如coq10、coq10前体或代谢物或coq10 相关化合物;以及分散稳定剂和调理作用缩减剂中的至少一种;其中 活性剂的胶状纳米分散体被分散成平均粒度小于200nm的纳米分散 颗粒。
[0286]
在某些实施方式中,分散稳定剂包括但不限于聚乙二醇化蓖麻 油、el、rh 40、聚乙二醇化维生素e、维 生素e tpgs和二肉豆蔻酰基磷脂酰基胆碱(dmpc)。
[0287]
在某些实施方式中,调理作用缩减剂是泊洛沙姆和泊洛沙胺。
[0288]
在某些实施方式中,胶状纳米分散体是混悬液或乳液。任选地, 胶状纳米分散体是晶体形式或过冷熔体形式。
[0289]
在某些实施方式中,注射或输注用制剂包含冻干保护剂如营养性 糖,包括但不限于乳糖、甘露糖、麦芽糖、半乳糖、果糖、山梨糖、 棉子糖、神经氨酸、葡糖胺、半乳糖胺、n
‑
甲基葡糖胺、甘露糖醇、 山梨糖醇、精氨酸、甘氨酸和蔗糖或其任意组合。
[0290]
在某些实施方式中,注射或输注用制剂包含水性溶液;分散以形 成颗粒的胶状纳
米分散体的疏水活性剂;以及分散稳定剂和调理作用 缩减剂中的至少一种。活性剂的胶状纳米分散体分散成粒度小于 200nm的纳米分散颗粒。在一些实施方式中,分散稳定剂选自天然或 半合成的磷脂。例如,适合的稳定剂包括聚乙氧基化(又称聚乙二醇 化)蓖麻油(el)、聚乙氧基化氢化蓖麻油( rh 40)、生育酚聚乙二醇琥珀酸酯(聚乙二醇化维生素e、维生素e tpgs)、失水山梨糖醇脂肪酸酯胆汁酸和胆汁酸盐或 二肉豆蔻酰基磷脂酰基胆碱(dmpc)。在一些实施方式中,稳定剂 是dmpc。
[0291]
在某些实施方式中,制剂适合于肠胃外施用,包括静脉内、腹膜 内、原位、颅内、肌内、皮下、髓内注射以及鞘内、直接心室内、鼻 内或眼内注射。在某些实施方式中,制剂以设计为稳定颗粒的纳米混 悬液的4:3:1.5的比率分别含有coq10、二肉豆蔻酰基磷脂酰基胆碱 和泊洛沙姆188。在一些实施方式中,制剂包含磷酸盐缓冲盐水溶液, 其含有磷酸氢二钠、磷酸二氢钾、氯化钾、氯化钠和注射用水。在某 些实施方式中,纳米混悬液形式的含coq10的4%无菌水性胶状分散 体以例如1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:11、 1:12、1:13、1:14、1:15、1:16、1:17、1:18、1:19、1:20或由该值中 的任意两个所包括的其它适宜比率提供的磷酸盐缓冲盐水溶液中稀 释。
[0292]
在一些实施方式中,制剂为局部制剂。coq10化合物的局部制剂 在例如wo2010/132507(pct申请号pct/us2010/034453)、 wo2008116135(pct申请号pct/us2008/116135)和wo2005/069916 (pct申请号pc/us2005/001581)中提供,其每一篇的全文通过引 用明确并入本文。
[0293]
适于局部施用的制剂包括适于渗透通过皮肤的液体或半液体制 剂,如搽剂、洗剂、乳膏剂、软膏剂或糊剂,以及适于施用于眼、耳 或鼻的滴剂。根据本公开的滴剂可包括无菌水性或油性溶液或混悬 液,并可通过将活性成分溶解至杀细菌剂和/或杀真菌剂和/或其它任 何适合的防腐剂的合适水溶液中来制备,并且在一些实施方式中包括 表面活性剂。然后可通过过滤使所得溶液澄清化和除菌,并通过无菌 技术转移到容器中。适于包含在滴剂中的杀细菌和杀真菌剂的实例是 硝酸或乙酸苯汞(0.002%)、苯扎氯铵(0.01%)和醋酸氯己定(0.01%)。 用于制备油性溶液的适合溶剂包括甘油、稀酒精和丙二醇。
[0294]
根据本公开的洗剂包括适于应用到皮肤或眼的那些。洗眼剂可包 括任选地含有杀细菌剂的无菌水性溶液并可通过与制备滴剂的方法 类似的方法制备。应用到皮肤的洗剂或搽剂还可包含加快干燥和冷却 皮肤的试剂(如醇)和/或保湿剂(如甘油)或油(如蓖麻油或花生 油)。
[0295]
可用于本发明方法的乳膏剂、软膏剂或糊剂是供外用的活性成分 的半固体制剂。它们可在合适机器的帮助下通过将单独的或以水性或 非水性流体的溶液或混悬液中的细碎或粉末形式的活性成分与油脂 或非油脂基质混合来制得。基质可包括烃如硬、软或液体石蜡、甘油、 蜂蜡、金属皂;粘胶;天然来源的油如杏仁油、玉米油、花生油、蓖 麻油或橄榄油;羊毛脂或其衍生物,或者脂肪酸(如硬脂酸或油酸) 及醇(如丙二醇)或大粒凝胶。制剂中可引入任何适合的表面活性试 剂,例如阴离子、阳离子或非离子表面活性试剂,如失水山梨糖醇酯 或其聚氧乙烯衍生物。也可包含悬浮剂如天然树胶、纤维素衍生物或 无机材料(如硅质二氧化硅)及其它成分如羊毛脂。
[0296]
在一些实施方式中,局部递送媒介的其余组分可以是水或水相, 在某些实施方式
中是纯化的(如去离子的)水、甘油、丙二醇、乙氧基二甘醇、苯氧基乙醇和交联的丙烯酸聚合物。这样的递送媒介组合物可含有基于组合物总重量约50至约95%的量的水或水相。存在的水的具体量不是关键性的,而是可调节的,以获得期望粘度(通常为约50cps至约10,000cps)和/或其它组分的浓度。局部递送媒介可具有至少约30厘泊的粘度。
[0297]
局部制剂还可包含油相,包括例如可进而包含润肤剂、脂肪醇、乳化剂、它们的组合等的油相。例如,油相可包含润肤剂如c12
‑
15烷基苯甲酸酯(可商购自finetexinc.(edison,n.j.)的finsolv
tm
tn)、癸酸
‑
辛酸甘油三酯(可商购自huls的miglyol
tm
812)等。其它可采用的适合的润肤剂包括植物衍生油(玉米油、红花油、橄榄油、澳洲坚果油等);各种合成酯,包括癸酸酯、亚油酸酯、二亚油酸酯、异硬脂酸酯、富马酸酯、癸二酸酯、乳酸酯、柠檬酸酯、硬脂酸酯、棕榈酸酯等;合成的中链甘油三酯、硅油或聚合物;脂肪醇,如鲸蜡醇、硬脂醇、鲸蜡硬脂醇、月桂醇、它们的组合等;和乳化剂,包括硬脂酸甘油酯、peg
‑
100硬脂酸酯、硬脂酸甘油酯、硬脂酸甘油酯se、中和的或部分中和的脂肪酸,包括硬脂酸、棕榈酸、油酸等;含有脂肪酸的植物油提取物、peg
‑
150硬脂酸酯、peg
‑
8月桂酸酯、peg
‑
8油酸酯、peg
‑
8硬脂酸酯、peg
‑
20硬脂酸酯、peg
‑
40硬脂酸酯、peg
‑
150二硬脂酸酯、peg
‑
8二硬脂酸酯、它们的组合等;或在本领域技术人员技能范围内的用于润肤的其它非极性化妆品或药学上可接受的材料、它们的组合等。
[0298]
局部制剂还可包含脂质体浓缩物,其包含例如磷脂,如卵磷脂、溶血卵磷脂、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇、磷脂酰甘油、磷脂酸、磷脂酰丝氨酸、溶血磷脂酰胆碱、溶血磷脂酰乙醇胺、溶血磷脂酰甘油、溶血磷脂酸、溶血磷脂酰丝氨酸、peg
‑
磷脂酰乙醇胺、pvp
‑
磷脂酰乙醇胺及其组合、至少一种亲脂性生物活性剂和至少一种增溶剂。脂质体浓缩物可以以组合物的约0.5重量%至约20重量%的量与具有至少一种渗透促进剂的至少一种药学上可接受的载体组合。磷脂可以以组合物的约2重量%至约20重量%的量存在于组合物中,且生物活性剂可以以组合物的约0.5重量%至约20重量%的量存在。
[0299]
也可使用经皮渗透促进剂来促进coq10的递送。示例的是亚砜类如乙氧基二甘醇、1,3
‑
丁二醇、异戊二醇、1,2
‑
戊二醇、丙二醇、2
‑
甲基丙
‑2‑
醇、丙
‑2‑
醇、乙基
‑2‑
羟基丙酸酯、己
‑
2,5
‑
二醇、二(2
‑
羟丙基)醚、戊
‑
2,4
‑
二醇、丙酮、聚氧乙烯(2)甲醚、2
‑
羟基丙酸、2
‑
羟基辛酸、丙
‑1‑
醇、1,4
‑
二氧六环、四氢呋喃、丁
‑
1,4
‑
二醇、丙二醇二壬酸酯、聚氧丙烯15硬脂基醚、辛醇、油醇的聚氧乙烯酯、油醇、月桂醇、己二酸二辛酯、己二酸二癸酯、己二酸二异丙酯、癸二酸二异丙酯、癸二酸二丁酯、癸二酸二乙酯、癸二酸二甲酯、癸二酸二辛酯、辛二酸二丁酯、壬二酸二辛酯、癸二酸二苄酯、邻苯二甲酸二丁酯、壬二酸二丁酯、肉豆蔻酸乙酯、壬二酸二甲酯、肉豆蔻酸丁酯、琥珀酸二丁酯、邻苯二甲酸二癸酯、油酸癸酯、己酸乙酯、水杨酸乙酯、棕榈酸异丙酯、月桂酸乙酯、壬酸2
‑
乙基己基酯、异硬脂酸异丙酯、月桂酸丁酯、苯甲酸苄酯、苯甲酸丁酯、月桂酸己酯、癸酸乙酯、辛酸乙酯、硬脂酸丁酯、水杨酸苄酯、2
‑
羟基辛酸、二甲亚砜、甲基磺酰甲烷、n,n
‑
二甲基乙酰胺、n,n
‑
二甲基甲酰胺、2
‑
吡咯烷酮、1
‑
甲基
‑2‑
吡咯烷酮、5
‑
甲基
‑2‑
吡咯烷酮、1,5
‑
二甲基
‑2‑
吡咯烷酮、1
‑
乙基
‑2‑
吡咯烷酮、膦氧化物、糖酯、四氢糠醇、脲、二乙基
‑
间
‑
甲苯酰胺、1
‑
十二烷基氮杂环庚
‑2‑
酮及其组合。
[0300]
增溶剂,特别是用于局部施用的增溶剂,可包括但不限于聚氧化烯葡聚糖、蔗糖的脂肪酸酯、寡葡糖苷的脂肪醇酯、甘油的脂肪酸酯、聚氧乙烯的脂肪酸酯、失水山梨糖醇
的聚乙氧基化脂肪酸酯、聚(环 氧乙烷)的脂肪酸酯、聚(环氧乙烷)的脂肪醇醚、聚(环氧乙烷)的烷基 酚醚、聚氧乙烯
‑
聚氧丙烯嵌段共聚物、乙氧基化油及其组合。
[0301]
局部制剂可包含润肤剂,包括但不限于苯甲酸c12
‑
15烷基酯、 癸酸
‑
辛酸甘油三酯、植物衍生油、癸酸酯、亚油酸酯、二亚油酸酯、 异硬脂酸酯、富马酸酯、癸二酸酯、乳酸酯、柠檬酸酯、硬脂酸酯、 棕榈酸酯、合成中链甘油三酯、硅油、聚合物及其组合;脂肪醇选自 鲸蜡醇、硬脂醇、鲸蜡硬脂醇、月桂醇及其组合;和乳化剂选自硬脂 酸甘油酯、聚乙二醇100硬脂酸酯、中和的脂肪酸、部分中和的脂肪 酸、聚乙二醇150硬脂酸酯、聚乙二醇8月桂酸酯、聚乙二醇油酸酯、 聚乙二醇8硬脂酸酯、聚乙二醇20硬脂酸酯、聚乙二醇40硬脂酸酯、 聚乙二醇150二硬脂酸酯、聚乙二醇8二硬脂酸酯及其组合。
[0302]
局部制剂可包含中和相,所述中和相包含水、胺、乳酸钠和乳酸 中的一种或多种。
[0303]
水相可进一步任选地包含一种或多种水相,其包含与粘度调节剂 任选地组合的渗透促进剂,所述粘度调节剂选自交联的丙烯酸聚合 物、短梗霉多糖、甘露聚糖、硬化葡聚糖、聚乙烯吡咯烷酮、聚乙烯 醇、瓜耳胶、羟丙基瓜耳胶、黄原胶、阿拉伯树胶(acacia gum)、 阿拉伯胶(arabia gum)、黄蓍胶、半乳聚糖、角豆胶、刺梧桐树胶、 刺槐豆胶、角叉菜胶、果胶、支链淀粉、琼脂、榅桲籽、大米淀粉、 玉米淀粉、马铃薯淀粉、小麦淀粉、藻类提取物、葡聚糖、琥珀酰葡 聚糖、羧甲基淀粉、甲基羟丙基淀粉、藻酸钠、藻酸丙二醇酯、聚丙 烯酸钠、聚乙基丙烯酸酯、聚丙烯酰胺、聚乙烯亚胺、膨润土、硅酸 铝镁、锂皂石、水辉石和无水硅酸。
[0304]
局部制剂还可包含颜料如二氧化钛。
[0305]
在实施方式中,用于本发明方法的局部制剂包含量为组合物的约 5重量%至约20重量%的油相,所述油相包含苯甲酸c12
‑
15烷基酯 或癸酸/辛酸甘油三酯、鲸蜡醇、硬脂醇、硬脂酸甘油酯和聚乙二醇 100硬脂酸酯;量为组合物的约60重量%至约80重量%的水相,所 述水相包含甘油、丙二醇、乙氧基二甘醇、苯氧乙醇、水和交联的丙 烯酸聚合物;量为组合物的约0.1重量%至约15重量%的中和相,所 述中和相包含水、三乙醇胺、乳酸钠和乳酸;量为组合物的约0.2重 量%至约2重量%的颜料,所述颜料包含二氧化钛;和量为组合物的 约0.1重量%至约30重量%的脂质体浓缩物,所述脂质体浓缩物包含 失水山梨糖醇的聚乙氧基化脂肪酸酯、辅酶q10、磷脂酰胆碱卵磷脂、 苯氧乙醇、丙二醇和水,其中丙二醇和乙氧基二甘醇以组合物的3重 量%至约15重量%的合并量存在,并且辅酶q10以组合物的约0.75 重量%至约10重量%的量存在。用于本发明方法的其它制剂在例如 wo2008/116135(pct申请号pct/us08/57786)和wo2010/132507 (pct/us2010/034453)中提供,其每一篇的全文通过引用方式明确 并入本文。
[0306]
在一个实施方式中,用于本发明方法的局部制剂为如us 2011/0027247所述的3%coq10乳膏剂,其全文通过引用并入本文。 在一个实施方式中,3%的coq10包含:
[0307]
(1)相a,其含有组合物的约4.0重量/重量%的苯甲酸c12
‑
15 烷基酯或癸酸/辛酸甘油三酯、组合物的约2.00重量/重量%的鲸蜡醇、 约1.5重量/重量%的硬脂醇、约4.5重量/重量%的硬脂酸甘油酯和 peg
‑
100;
[0308]
(2)相b,其含有约2.00重量/重量%的甘油、约1.5重量/重量 %的丙二醇、约5.0重量/重量%的乙氧基二甘醇、约0.475重量/重量 %的苯氧乙醇、约40重量/重量%的卡波姆分散体、约16.7重量/重量 %的纯化水;
[0309]
(3)相c,其含有约1.3重量/重量%的三乙醇胺、约0.5重量/ 重量%的乳酸、约2.0重量/重量%的乳酸钠溶液、约2.5重量/重量% 的水;
[0310]
(4)相d,其含有约1.0重量/重量%的二氧化钛;和
[0311]
(5)相e,其含有约15.0重量/重量%的coq10 21%浓缩物。
[0312]
coq10 21%浓缩物组合物(上述3%乳膏剂中的相e)可通过如 下所述组合相a和b制备。相a包含21重量/重量%的泛癸利酮usp (coq10)和25重量/重量%的聚山梨酸酯80nf。相b包含10.00 重量/重量%的丙二醇usp、0.50重量/重量%的苯氧乙醇nf、8.00重 量/重量%的卵磷脂nf(phospholipon 85g)和35.50重量/重量% 的纯化水usp。所有重量百分数都是相对于整个coq10 21%浓缩物 组合物的重量。百分数和进一步的详情列于下表中。
[0313]
表1
[0314]
相商品名inci名称百分数aritabate 80聚山梨酸酯8025.000aubidecarenone泛醌21.000bpurified water水35.500bpropylene glycol丙二醇10.000bphenoxyethanol苯氧乙醇0.500bphospholipon 85g卵磷脂8.000总计
ꢀꢀ
100.000
[0315]
将苯氧乙醇和丙二醇置于适合的容器中并混合直至澄清。向第二 容器(混合罐1)中加入要求量的水。在混合的同时加热混合罐1至 45和55℃之间。向水中加入苯氧乙醇/丙二醇溶液并混合至其澄清且 均匀。当混合罐1中的水相内容物在45至55℃范围内时,在低到中 度混合下加入phospholipon g。在避免任何起泡的同时,混合混合罐1的内容物直至phospholipon 85g均匀分散。向适合的容器(混合罐 2)中加入聚山梨酸酯89并加热至50和60℃之间。然后向混合罐2 中加入泛癸利酮。在使温度保持在50和60℃之间的同时,混合混合 罐2直至全部泛癸利酮溶解。在全部泛癸利酮都已溶解后,将水相缓 慢转移至混合罐2。当所有材料都已合并时,使内容物均质化直至分 散体平滑且均匀。在小心不要过热的同时使温度保持在50和60℃之 间。然后停止均质化并将混合罐2的内容物转移到适合的容器以进行 贮存。
[0316]
在一些实施方式中,用于本发明的任何施用途径的制剂可包含约 0.001至约20%(重量/重量)的coq10,更优选地约0.01%和约15% 之间、甚至更优选地约0.1%至约10%(重量/重量)之间的coq10。 在某些实施方式中,用于本发明的任何施用途径的制剂可包含约1% 至约10%(重量/重量)的coq10。在某些实施方式中,用于本发明 的任何施用途径的制剂可包含约2%至约8%(重量/重量)的coq10。 在某些实施方式中,用于本发明的任何施用途径的制剂可包含约2% 至约7%(重量/重量)的coq10。在某些实施方式中,用于本发明的 任何施用途径的制剂可包含约3%至约6%(重量/重量)的coq10。 在某些实施方式中,用于本发明的任何施用途径的制剂可包含约3% 至约5%(重量/重量)的coq10。在某些实施方式中,用于本发明的 任何施用途径的制剂可包含约3.5%至约4.5%(重量/重量)的coq10。 在某些实施方式中,用于本发明的任何施用途径的制剂可包含约3.5% 至约5%
(重量/重量)的coq10。在一个实施方式中,制剂包含约4% (重量/重量)的coq10。在一个实施方式中,制剂包含约8%(重量 /重量)的coq10。在各种实施方式中,制剂包含约0.1%、0.2%、0.3%、 0.4%、0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、 11%、12%、13%、14%、15%、16%、17%、18%、19%或20%(重 量/重量)的coq10或由所列举的任意两个值所包括的任意范围。在 某些实施方式中,制剂可按照重量/体积百分比而不是重量/重量百分 比制备。取决于制剂,coq10的浓度在重量/重量和重量/体积百分比 形式中可以相同或大致相同。coq10可从kaneka q10以粉末形式的 kaneka q10(usp泛癸利酮)获得(pasadena,texas,usa)。本文示 例的方法中使用的coq10具有以下特性:残余溶剂满足usp 467要 求;水含量低于0.0%、低于0.05%或低于0.2%;炽灼残渣为0.0%、 低于0.05%或低于0.2%低于;重金属含量低于0.002%或低于0.001%; 纯度介于98
‑
100%之间或为99.9%或99.5%。
[0317]
在某些实施方式中,制剂中coq10的浓度为1mg/ml至150 mg/ml。在一个实施方式中,制剂中coq10的浓度为5mg/ml至125 mg/ml。在一个实施方式中,制剂中coq10的浓度为10mg/ml至100 mg/ml。在一个实施方式中,制剂中coq10的浓度为20mg/ml至90 mg/ml。在一个实施方式中,coq10的浓度为30mg/ml至80mg/ml。 在一个实施方式中,coq10的浓度为30mg/ml至70mg/ml。在一个 实施方式中,coq10的浓度为30mg/ml至60mg/ml。在一个实施方 式中,coq10的浓度为30mg/ml至50mg/ml。在一个实施方式中, coq10的浓度为35mg/ml至45mg/ml。应理解,具有前述值的任意 之一作为上限或下限的其它范围也旨在作为本发明的部分,例如, 10mg/ml至50mg/ml或20mg/ml至60mg/ml。
[0318]
在某些实施方式中,制剂中coq10的浓度为约10、15、20、25、 30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、 45、46、47、48、49、50、55、60、65、70、75、80、85、90或95mg/ml。 在一个实施方式中,制剂中coq10的浓度为约50mg/ml。在一个实 施方式中,制剂中coq10的浓度为约60mg/ml。在一个实施方式中, 制剂中coq10的浓度为约30mg/ml。在优选实施方式中,制剂中 coq10的浓度为约40mg/ml。应理解,具有这些值的任意之一作为 上限或下限的范围也旨在作为本发明的部分,例如,37mg/ml和 47mg/ml之间或31mg/ml和49mg/ml之间。
[0319]
应理解,可类似地制备含有coq10前体、代谢物和相关化合物 的制剂。
[0320]
iv.联合疗法
[0321]
本文提供了通过向有需要的受试者共施用coq10和至少一种化 疗剂来治疗受试者的肿瘤病症的方法。如本文所用,术语“共施用”是 指在化疗剂施用之前、与化疗剂施用同时或基本同时、在化疗剂施用 之后或与化疗剂施用间隔地施用coq10。在某些实施方式中,coq10 在化疗剂之前和与化疗剂同时施用。在某些实施方式中,coq10在化 疗剂之前但不与化疗剂同时施用,即,coq10施用在开始化疗剂治疗 或开始化疗剂施用之前中断。在一个实施方式中,可根据本发明方法 在联合疗法中使用静脉内(iv)coq10制剂与至少一种其它化疗剂。 在一个实施方式中,可根据本发明方法在联合疗法中使用局部coq10 制剂与至少一种其它化疗剂。在一个实施方式中,可根据本发明方法 在联合疗法中使用可吸入coq10制剂与至少一种其它化疗剂。coq10 和/或其药物制剂及其它化疗剂可加和地或更优选协同地起作用。在 一个实施方式中,coq10和/或其制剂与另一化疗剂的施用同时施用。 在另一个实施方式中,coq10和/或其药物制剂在另一化疗剂的施用 之前或之后施用。在一
个实施方式中,coq10和另外的化疗剂协同地 起作用。在一些实施方式中,协同结果是在肿瘤病症的治疗中。在其 它实施方式中,协同结果是在与化疗剂相关毒性的调节中。在一个实 施方式中,coq10和另外的化疗剂加和地起作用。在一个实施方式中, coq10使肿瘤病症、癌症或癌细胞对另一化疗剂的治疗敏感。在一个 实施方式中,在化疗剂治疗之前的coq10预治疗使肿瘤病症、癌症 或癌细胞对另一化疗剂的治疗敏感。在一个实施方式中,coq10预治 疗以及在化疗剂治疗之前所述治疗的中断使肿瘤病症、癌症或癌细胞 对另一化疗剂的治疗敏感。
[0322]
在一些实施方式中,coq10是静脉内coq10制剂、吸入coq10 制剂或局部coq10制剂的形式。静脉内coq10制剂在2011年3月 11日提交的wo2011/112900中公开。wo2011/112900的公开内容全 文并入本文。局部coq10制剂在2010年5月11日提交的美国专利 申请公开第us2011/0027247号中公开。us2011/0027247的公开内容 全文并入本文。吸入coq10制剂在2012年6月8日提交的美国专利 公开第20120321698号和2008年12月5日提交的美国专利公开第 20110142914号中公开。coq10和化疗剂不必通过相同施用途径递送。 在某些实施方式中,coq10不经口施用。
[0323]
在一些实施方式中,提供了通过共施用静脉内coq10制剂与化 疗剂来治疗肿瘤病症的方法。在某些实施方式中,化疗剂为吉西他滨、 多柔比星、顺铂、5
‑
氟尿嘧啶和伊立替康。在一些实施方式中,化疗 剂为抗代谢物或蒽环类药物。化疗剂通常属于各种不同类别,包括例 如:1.拓扑异构酶ii抑制剂(细胞毒性抗生素),如蒽环类/蒽二酮 类,例如多柔比星、表柔比星、伊达比星和奈莫柔比星,蒽醌类,例 如米托蒽醌和洛索蒽醌,及鬼臼毒素类,例如依托泊苷和替尼泊苷; 2.影响微管形成的药剂(有丝分裂抑制剂),如植物生物碱类(例 如,属于源自植物的生物活性且细胞毒性的碱性含氮分子家族的化合 物),例如紫杉烷类,如紫杉醇和多西紫杉醇,和长春花生物碱类, 例如长春碱、长春新碱和长春瑞滨,以及鬼臼毒素的衍生物;3.烷 化剂,如氮芥、亚乙基亚胺化合物、烷基磺酸酯和其它具有烷化作用 的化合物如亚硝基脲、达卡巴嗪、环磷酰胺、异环磷酰胺和美法仑; 4.抗代谢物(核苷抑制剂),例如叶酸类,如叶酸、氟嘧啶、嘌呤 或嘧啶类似物如5
‑
氟尿嘧啶、卡培他滨、吉西他滨、甲氨喋呤和依达 曲沙;5.拓扑异构酶i抑制剂,如托泊替康、伊立替康和9
‑
硝基喜树 碱及喜树碱衍生物;和6.铂化合物/络合物,如顺铂、奥沙利铂和卡 铂。
[0324]
用于本发明方法的示例性化疗剂包括但不限于阿米福汀(氨磷 汀)、顺铂、达卡巴嗪(dtic)、放线菌素、二氯甲基二乙胺(氮 芥)、链脲佐菌素、环磷酰胺、卡莫司汀(bcnu)、洛莫司汀(ccnu)、 多柔比星(阿霉素)、多柔比星脂质体(阿霉素脂质体)、吉西他滨 (健择)、柔红霉素、柔红霉素脂质体(daunoxome)、甲基苄肼、 丝裂霉素、阿糖胞苷、依托泊苷、氨甲喋呤、5
‑
氟尿嘧啶(5
‑
fu)、 长春碱、长春新碱、博来霉素、紫杉醇(泰素)、多西紫杉醇(泰索 帝)、阿地白介素、天冬酰胺酶、白消安、卡铂、克拉屈滨、喜树碱、 cpt
‑
i1、10
‑
羟基
‑7‑
乙基
‑
喜树碱(sn38)、达卡巴嗪、s
‑
i卡培他滨、 替加氟、5'
‑
脱氧氟尿苷、uft、恩尿嘧啶、脱氧胞苷、5
‑
氮杂胞嘧啶、 5
‑
氮杂脱氧胞嘧啶、别嘌呤醇、2
‑
氯腺苷、三甲曲沙、氨喋呤、亚甲 基
‑
10
‑
脱氮杂氨喋呤(mdam)、奥沙利铂、吡铂、四铂、沙铂、铂
ꢀ‑
dach、奥马铂、ci
‑
973、jm
‑
216及其类似物、表柔比星、依托泊 苷磷酸盐、9
‑
氨基喜树碱、10,11
‑
亚甲基二氧喜树碱、karenitecin、9
‑ꢀ
硝基喜树碱、tas 103、长春地辛、l
‑
苯丙氨酸氮芥、异环磷酰胺、 培磷酰胺、氯乙环磷酰胺、卡莫司汀、司莫司汀、埃博霉素a
‑
e、拓 优得、6
‑
巯基嘌呤、6
‑
硫鸟嘌呤、
安吖啶、依托泊苷磷酸盐、karenitecin、 阿昔洛韦、伐昔洛韦、更昔洛韦、金刚烷胺、金刚乙胺、拉米夫定、 齐多夫定、贝伐单抗、曲妥珠单抗、利妥昔单抗、5
‑
氟尿嘧啶、卡培 他滨、喷司他汀、三甲曲沙、克拉屈滨、氟尿苷、氟达拉滨、羟基脲、 异环磷酰胺、伊达比星、美司钠、伊立替康、米托蒽醌、拓扑替康、 亮丙瑞林、甲地孕酮、美法仑、巯基嘌呤、普卡霉素、米托坦、培门 冬酶、喷司他汀、哌泊溴烷、普卡霉素、链脲佐菌素、他莫昔芬、替 尼泊苷、睾内酯、硫鸟嘌呤、塞替派、尿嘧啶氮芥、长春瑞滨、苯丁 酸氮芥、顺铂、多柔比星、紫杉醇(泰素)、博莱霉素、mtor、表皮 生长因子受体(egfr)和成纤维细胞生长因子(fgf)及其基于特 定肿瘤或癌症的适宜治疗标准对于本领域技术人员来说显而易见的 组合。
[0325]
在某些实施方式中,用于本发明的联合疗法的另外的化疗剂为生 物剂。生物剂(也称生物制剂)为生物系统如生物体、细胞或重组系 统的产物。该类生物剂的实例包括核酸分子(例如,反义核酸分子)、 干扰素、白细胞介素、集落刺激因子、抗体(例如,单克隆抗体)、 抗血管生成剂和细胞因子。示例性的生物剂在下文更详细地讨论并通 常属于各种不同类别,包括例如:1.激素、激素类似物和激素复合 物,例如雌激素和雌激素类似物、孕酮、孕酮类似物和孕激素、雄激 素、肾上腺皮质类固醇、抗雌激素、抗雄激素、抗睾酮、肾上腺类固 醇抑制剂和抗促黄体生成激素;和2.酶、蛋白、肽、多克隆和/或单 克隆抗体,如白细胞介素、干扰素、集落刺激因子等。
[0326]
在一个实施方式中,生物制剂是干扰素。干扰素(ifn)是身体 中天然存在的一种类型的生物剂。干扰素也在实验室中产生并在生物 疗法中给予癌症患者。它们已被证实改善了癌症患者的免疫系统对抗 癌细胞的方式。
[0327]
干扰素可直接作用于癌细胞以减慢其生长,或者它们可使癌细胞 变为具有更正常的行为的细胞。一些干扰素还可刺激自然杀伤细胞 (nk)、t细胞和巨噬细胞,其是血流中帮助对抗癌细胞的白血细 胞类型。
[0328]
在一个实施方式中,生物制剂是白细胞介素。白细胞介素(il) 刺激许多免疫细胞的生长和活性。它们是身体内天然存在的蛋白(细 胞因子和趋化因子),但也可在实验室中制备。一些白细胞介素刺激 起到破坏癌细胞作用的免疫细胞如淋巴细胞的生长和活性。
[0329]
在另一个实施方式中,生物制剂是集落刺激因子。集落刺激因子 (csf)是给予患者以激励骨髓内的干细胞产生更多血细胞的蛋白。 身体持续地需要新的白细胞、红细胞和血小板,尤其是在存在癌症时。 csf与化疗一起提供以帮助增强免疫系统。当癌症患者接受化疗时, 骨髓产生新的血细胞的能力被抑制,使得患者更易于发生感染。免疫 系统的一些部分在没有血细胞的情况下不能起作用,因此集落刺激因 子激励骨髓干细胞产生白细胞、血小板和红细胞。在具有适当的细胞 生成的情况下,可以继续其它癌症治疗,从而允许患者安全地接受更 高剂量的化疗。
[0330]
在另一个实施方式中,生物制剂是抗体。抗体,如单克隆抗体, 是结合于癌细胞的在实验室中产生的药剂。
[0331]
单克隆抗体药剂不会破坏健康细胞。单克隆抗体通过各种不同的 机制实现其治疗效果。它们可在产生细胞凋亡或程序性细胞死亡中具 有直接作用。它们可阻断生长因子受体,从而有效地抑止肿瘤细胞增 殖。在表达单克隆抗体的细胞中,它们可导致抗独特型抗体形成。
[0332]
可用于本发明的联合治疗的抗体的实例包括抗
‑
cd20抗体,例如 但不限于西妥昔
单抗、托西莫单抗、利妥昔单抗和替伊莫单抗。抗
ꢀ‑
her2抗体也可与辅酶q10联合使用来治疗癌症。在一个实施方式 中,抗
‑
her2抗体为曲妥珠单抗(赫赛汀)。可与辅酶q10联合使 用来治疗癌症的抗体的其它实例包括抗
‑
cd52抗体(例如,阿仑单 抗)、抗
‑
cd
‑
22抗体(例如,依帕珠单抗)和抗
‑
cd33抗体(例如, 吉妥单抗奥佐米星)。抗
‑
vegf抗体也可与辅酶q10联合使用来治 疗癌症。在一个实施方式中,抗
‑
vegf抗体为贝伐单抗。在其它实施 方式中,生物剂为抗体,其为抗
‑
egfr抗体,例如西妥昔单抗。另一 个实例为抗糖蛋白17
‑
1a抗体依决洛单抗。许多其它的抗肿瘤抗体是 本领域已知的并且本领域技术人员将理解其为本发明所涵盖。
[0333]
在另一个实施方式中,生物制剂为细胞因子。细胞因子疗法使用 蛋白(细胞因子)来帮助受试者的免疫系统识别和破坏癌性的那些细 胞。细胞因子在身体中由免疫系统天然产生,但也可在实验室中产生。 该疗法用于晚期黑素瘤并与辅助疗法(在主要癌症治疗之后或之外给 予的疗法)一起使用。细胞因子疗法到达身体的所有部分来杀灭癌细 胞并防止肿瘤生长。
[0334]
在另一个实施方式中,生物制剂为融合蛋白。例如,可在联合疗 法中使用重组人apo2l/trail(genetech)。apo2l/trail为设 计以激活促凋亡受体dr4和dr5二者的第一种双重促凋亡受体激动 剂,促凋亡受体dr4和dr5参与细胞凋亡(程序性细胞死亡)的调 控。
[0335]
在一个实施方式中,生物制剂为治疗性核酸分子。核酸治疗剂是 本领域熟知的。核酸治疗剂包括与细胞中的靶序列互补的单链和双链 (即,具有长度为至少15个核苷酸的互补区的核酸治疗剂)核酸二 者。治疗性核酸可针对基本上细胞中的任意靶核酸序列。在某些实施 方式中,核酸治疗剂靶向于编码血管生成刺激剂如vegf、fgf或肿 瘤生长刺激剂如egfr的核酸序列。
[0336]
反义核酸治疗剂为单链核酸治疗剂,通常长度为约16至30个核 苷酸,并且与靶细胞中的靶核酸序列互补,无论是在培养物中还是在 生物体中。
[0337]
在另一个方面,药剂为单链反义rna分子。反义rna分子与靶 mrna内的序列互补。反义rna可通过与mrna碱基配对并物理地 阻碍翻译机制来以化学计量方式抑制翻译,参见dias,n.等,(2002) mol cancer ther 1:347
‑
355。反义rna分子可具有约15
‑
30个与靶 mrna互补的核苷酸。涉及反义核酸、化学修饰和治疗用途的专利在 例如涉及含化学修饰rna的治疗化合物的美国专利第5,898,031号, 涉及使用这些化合物作为治疗剂的方法的美国专利第6,107,094号, 涉及通过施用单链化学修饰rna样化合物治疗患者的方法的美国专 利第7,432,250号,和涉及含单链化学修饰rna样化合物的药物组合 物的美国专利号7,432,249中提供。美国专利第7,629,321号涉及使用 具有多个rna核苷酸和至少一个化学修饰的单链寡核苷酸裂解靶 mrna的方法。本段中列出的专利中的每一个的整个内容以引用方式 并入本文。
[0338]
用于本发明的方法中的核酸治疗剂还包括双链核酸治疗剂。在本 文中可互换地使用的“rnai剂”、“双链rnai剂”、双链rna(dsrna) 分子(也称“dsrna剂”、“dsrna”、“sirna”、“irna剂”)是指核糖 核酸分子的复合物,其具有包含两个反向平行的且基本上互补(如下 文所定义)的核酸链的双链体结构。如本文所用,rnai剂还可包括 dsirna(参见例如美国专利公开第20070104688号,其以引用方式 并入本文中)。通常,每条链的大多数核苷酸为核糖核苷酸,但如本 文中所述,各条链或全部两条链还可包含一个或多个非核糖核
苷酸, 例如脱氧核糖核苷酸和/或修饰的核苷酸。另外,如本说明书中所用,
ꢀ“
rnai剂”可包括具有化学修饰的核糖核苷酸;rnai剂可在多个核苷 酸处包含实质性修饰。该类修饰可包括本文中公开的或本领域中已知 的所有修饰类型。就本说明书和权利要求书的目的而言,如sirna 型分子中所用的任何该类修饰都涵盖在“rnai剂”内。在本发明的方 法中使用的rnai剂包括具有例如2011年11月18日提交的美国临 时申请第61/561,710号、2010年9月15日提交的国际申请第 pct/us2011/051597号和pct公布wo 2009/073809中公开的化学修 饰的药剂,它们中的每一者的整个内容以引用方式并入本文中。
[0339]
用于本发明的方法中的其它示例性生物剂包括但不限于吉非替 尼(易瑞沙)、阿那曲唑、二乙基己烯雌酚、雌二醇、普力马林、雷 洛昔芬、孕酮、异炔诺酮(norethynodrel)、炔孕酮(esthisterone)、 地美炔酮(dimesthisterone)、醋酸甲地孕酮、醋酸甲羟孕酮、己酸 羟孕酮、炔诺酮、甲睾酮、睾酮、地塞米松、强的松、氢化可的松、 甲强龙(solumedrol)、他莫昔芬、氟维司群、托瑞米芬、氨鲁米特、 睾内酯、屈洛昔芬、阿那曲唑、比卡鲁胺、氟他胺、尼鲁米特、戈舍 瑞林、氟他胺、亮丙瑞林、曲普瑞林、氨鲁米特、米托坦、戈舍瑞林、 西妥昔单抗、厄洛替尼、伊马替尼、托西莫单抗、阿仑单抗、曲妥珠 单抗、吉妥单抗、利妥昔单抗、替伊莫单抗(ibritumomab tiuxetan)、 贝伐单抗、地尼白介素(denileukin diftitox)、达利珠单抗、干扰素 α、干扰素β、抗
‑4‑
lbb、抗
‑4‑
lbbl、抗
‑
cd40、抗
‑
cd154、抗
‑
ox40、 抗
‑
ox40l、抗
‑
cd28、抗
‑
cd80、抗
‑
cd86、抗
‑
cd70、抗
‑
cd27、抗
ꢀ‑
hvem、抗
‑
light、抗
‑
gitr、抗
‑
gitrl、抗
‑
ctla
‑
4、可溶性ox40l、 可溶性4
‑
ibbl、可溶性cd154、可溶性gitrl、可溶性light、可 溶性cd70、可溶性cd80、可溶性cd86、可溶性ctla4
‑
ig、及其基于特定肿瘤或癌症的适宜治疗标准对于本领域技术人员来说 显而易见的组合。药剂的可溶性形式可通过操作性地连接药剂与例如 ig
‑
fc区而制备为例如融合蛋白。
[0340]
应注意,可与本文提供的辅酶q10和辅酶q10制剂联合地施用 不止一种另外的抗癌化疗剂,例如2、3、4、5或更多种。例如,在 一个实施方式中,可与辅酶q10联合地施用两种另外的化疗剂。在一 个实施方式中,可与辅酶q10联合地施用三种另外的化疗剂。在一个 实施方式中,可与辅酶q10联合地施用四种另外的化疗剂。在一个实 施方式中,可与辅酶q10联合地施用五种另外的化疗剂。本文中提供 的化疗剂的适宜剂量和施用途径是本领域已知的。
[0341]
在某些实施方式中,本发明的方法包括通过连续输注所提供的辅 酶q10和与另外的抗癌剂或干预(例如,放射、外科手术、骨髓移植) 的联合疗法来治疗癌症。在某些实施方式中,“联合疗法”包括用辅酶 q10治疗来减小肿瘤负荷和/或改善临床反应。与姑息治疗或减轻药物 副作用(例如,减轻恶心、疼痛、焦虑或炎症,使凝血正常化)的治 疗一并施用辅酶q10不视为是癌症的联合治疗。
[0342]
在某些实施方式中,通过连续输注用辅酶q10治疗与待治疗的特 定癌症的标准治疗联合,例如施用标准剂量的一种或多种化疗剂。特 定癌症类型的标准治疗可由本领域技术人员基于例如癌症的类型和 严重度、受试者的年龄、体重、性别和/或病史,以及既往治疗的成 功或失败来决定。
[0343]
在某些实施方式中,对患有白血病,特别是all或aml的受试 者的治疗,辅酶q10的施用(例如,静脉内,例如连续输注)与以下 治疗中的一者或优选二者联合。
[0344]
1、氟达拉滨,优选地以15mg/m2的剂量静脉内施用15
‑
30分钟
±
15 分钟,每12小时
施用一次,施用5天(或在65岁以上或ecog行为 状态3的患者中持续4天)。
[0345]
2、阿糖胞苷,优选地以0.5g/m2在250ml生理盐水中静脉内施用 2小时
±
20分钟,每12小时
±
2小时施用一次,施用5天(或在65岁 以上或ecog行为状态3的患者中持续4天)。
[0346]
在某些实施方式中,向受试者施用1、2、3、4或5个周期的联 合治疗。在每一个周期结束时评估受试者的反应标准。还在每一周期 的整个过程中监测受试者的不良事件(例如,凝血、贫血、肝和肾功 能等)以确保治疗方案充分耐受。
[0347]
在某些实施方式中,通过连续输注辅酶q10对患有实体瘤的受试 者的治疗与以下治疗中的一种或多种联合。
[0348]
1、吉西他滨,优选地通过静脉内施用,每周剂量以600mg/m2开始,并基于受试者对药物的耐受性调节剂量。
[0349]
2、5
‑
氟尿嘧啶(5
‑
fu),优选地通过静脉内施用,每周剂量以350mg/m2起始,并基于受试者对药物的耐受性调节剂量,其与 100mg/m2的亚叶酸联合施用。
[0350]
3、多西紫杉醇,优选通过静脉内施用,每周一次,起始剂量为 20mg/m2,并基于受试者对药物的耐受性调节剂量。
[0351]
在某些实施方式中,向受试者施用1、2、3、4或5个周期的联 合治疗。在每一个周期结束时评估受试者的反应标准。还在每一周期 的整个过程中监测受试者的不良事件(例如,凝血、贫血、肝和肾功 能等)以确保治疗方案充分耐受。
[0352]
在其它实施方式中,以比在特定肿瘤疾病的标准治疗下用来治疗 肿瘤疾病的化疗剂的标准剂量低的剂量施用化疗剂。化疗剂的标准剂 量是本领域技术人员已知的,并可例如从化疗剂生产商提供的产品说 明书获得。化疗剂的标准剂量的实例在表3中提供。在某些实施方式 中,化疗剂的施用剂量比该化疗剂针对特定肿瘤疾病的标准剂量低 5%、10%、20%、30%、40%、50%、60%、70%、80%或90%。在某 些实施方式中,化疗剂的施用剂量为该化疗剂针对特定肿瘤疾病的标 准剂量的95%、90%、85%、80%、75%、70%、65%、60%、55%、 50%、45%、40%、35%、30%、25%、20%、15%、10%或5%。在其 中施用非coq10化疗剂的组合的一个实施方式中,化疗剂中的至少 之一以比该化疗剂针对特定肿瘤疾病的标准剂量低的剂量施用。在其 中施用化疗剂(例如,非coq10)的组合的一个实施方式中,化疗剂 中的至少两者以比该化疗剂针对特定肿瘤疾病的标准剂量低的剂量 施用。在其中施用化疗剂(例如,非coq10)的组合的一个实施方式 中,化疗剂中的至少三者以比该化疗剂针对特定肿瘤疾病的标准剂量 低的剂量施用。在其中施用化疗剂(例如,非coq10)的组合的一个 实施方式中,所有的化疗剂均以比该化疗剂针对特定肿瘤疾病的标准 剂量低的剂量施用。
[0353]
在某些实施方式中,辅酶q10以在单独递送时治疗有效的量施 用,即辅酶q10作为治疗性抗癌剂施用和/或发挥作用,而不是主要 作为减轻其它化疗或其它癌症治疗的副作用的药剂。
[0354]
v.肿瘤疾病的治疗
[0355]
可采用本发明的联合疗法来治疗肿瘤疾病。相应地,本发明提供 了治疗或预防受试者的肿瘤疾病的方法,其包括以足以治疗或预防肿 瘤疾病的量向受试者施用本发明的制剂,从而治疗或预防肿瘤疾病。 也可采用本发明的制剂来抑制肿瘤细胞生长。相应地,本发明还提供 了抑制受试者中肿瘤细胞生长的方法,其包括向受试者静脉内施用本 发明的
制剂,以便肿瘤细胞生长被抑制。在某些实施方式中,治疗癌 症包括与对照如群体对照相比,延长存活或延长到达肿瘤进展的时 间。在某些实施方式中,受试者是人类受试者。在优选实施方式中, 受试者在施用第一剂coq10之前被确定为患有肿瘤。在某些实施方 式中,受试者在第一次施用coq10之时患有肿瘤。
[0356]
这样的联合疗法包括例如与本文中描述或引入的化疗剂共施用 的coq10制剂。在某些实施方式中,治疗受试者的肿瘤疾病的方法 包括:(a)向受试者施用辅酶q10(coq10);(b)中断coq10 的治疗;和(c)在已中断施用coq10后,向受试者施用至少一种化 疗剂,其中肿瘤疾病被治疗。
[0357]
在其它实施方式中,治疗受试者的肿瘤疾病的方法包括:(a) 向受试者施用辅酶q10(coq10);(b)在开始施用coq10后,向 受试者施用至少一种化疗剂;和(c)在开始施用所述至少一种化疗 剂后,继续coq10的治疗,其中肿瘤疾病被治疗。
[0358]
在其它实施方式中,治疗受试者的肿瘤疾病的方法包括:在开始 化疗治疗方案之前使用辅酶q10(coq10)对患肿瘤疾病的受试者预 治疗足够的时间,其中所述化疗治疗方案包括施用一种或多种化疗 剂,使得与单独使用化疗治疗方案的治疗相比,肿瘤疾病的反应被改 善。
[0359]
还在其它的实施方式中,治疗受试者的肿瘤疾病的方法包括: (a)向受试者施用辅酶q10(coq10);和(b)以比用来治疗肿瘤 疾病的化疗剂的标准剂量低的剂量向受试者施用至少一种化疗剂,使 得肿瘤疾病被治疗。
[0360]
在前述各个实施方式中,可在coq10施用开始后至少24小时、 在coq10施用开始后一周或多周、在coq10施用开始后两周或更多 周、在coq10施用开始后三周或更多周、在coq10施用开始后四周 或更多周、在coq10施用开始后五周或更多周、在coq10施用开始 后六周或更多周、在coq10施用开始后七周或更多周或在coq10施 用开始后八周或更多周开始施用所述至少一种化疗剂。
[0361]
在一个优选的实施方式中,在coq10施用开始后至少24小时开 始施用所述至少一种化疗剂。在另一个优选的实施方式中,在coq10 施用开始后24小时至4周开始施用所述至少一种化疗剂。在进一步 优选的实施方式中,在coq10施用开始后2至4周开始施用所述至 少一种化疗剂。在又进一步优选的实施方式中,在coq10施用开始 后2周开始施用所述至少一种化疗剂。在又进一步优选的实施方式中, 在coq10施用开始后1周开始施用所述至少一种化疗剂。在又进一 步优选的实施方式中,在coq10施用开始后3周开始施用所述至少 一种化疗剂。在又进一步优选的实施方式中,在coq10施用开始后4 周开始施用所述至少一种化疗剂。在又进一步优选的实施方式中,在 coq10施用开始后5周开始施用所述至少一种化疗剂。在又进一步优 选的实施方式中,在coq10施用开始后6周开始施用所述至少一种 化疗剂。在又进一步优选的实施方式中,在coq10施用开始后7周, 开始施用所述至少一种化疗剂。在又进一步优选的实施方式中,在 coq10施用开始后8周开始施用所述至少一种化疗剂。
[0362]
coq10制剂可以是吸入制剂、静脉内制剂或局部制剂。在某些实 施方式中,coq10制剂不是口服制剂。例如,静脉内制剂可在药学上 可接受的载体中包含coq10或其代谢物。在一些实施方式中,这样 的制剂可包含约0.001%至约20%(重量/重量)的coq10,更优选地 约0.01%和约15%之间、甚至更优选地约0.1%至约10%(重量/重量) 之间的coq10,更
优选地约3%至约5%(重量/重量)的coq10。在 一个实施方式中,制剂包含约4%(重量/重量)的coq10。在一个实 施方式中,制剂包含约8%(重量/重量)的coq10。在各种实施方式 中,制剂包含约0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%、 10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20% (重量/重量)的coq10。如本文中还指出的,本公开的组合物可以 是液体形式,能够通过本领域技术人员能力范围内的任意施用方式或 途径引入到受试者中。例如,组合物可通过包括但不限于静脉内、瘤 内、腹膜内、它们的组合等等的施用途径施用。
[0363]
在一些实施方式中,化疗方案与coq10制剂共施用以治疗肿瘤 疾病。可以在化疗方案施用之前、与化疗方案施用同时或基本同时、 在化疗方案施用之前并与化疗方案施用同时、与化疗方案施用间隔或 在化疗方案施用之后施用coq10制剂。在某些实施方式中,在化疗 剂施用之前施用负荷剂量的coq10。在某些实施方式中,在化疗剂施 用之前施用coq10以达到coq10的稳态水平。当联合疗法包括静脉 内coq10制剂时,对受试者静脉内施用coq10以使得肿瘤疾病被治 疗或预防。在一个实施方式中,对受试者静脉内施用coq10以使得 对化疗剂的反应被改善,例如相对于单独使用化疗剂的治疗。
[0364]
对受试者施用在约0.5mg/kg至约10,000mg/kg、约5mg/kg至约 5,000mg/kg、约10mg/kg至约3,000mg/kg范围内的一剂coq10。在 一个实施方式中,施用在约10mg/kg至约1,400mg/kg范围内的辅酶 q10。在一个实施方式中,施用在约10mg/kg至约650mg/kg范围内 的辅酶q10。在一个实施方式中,施用在约10mg/kg至约200mg/kg 范围内的辅酶q10。在各种实施方式中,以约2mg/kg、5mg/kg、 10mg/kg、15mg/kg、20mg/kg、25mg/kg、30mg/kg、35mg/kg、40mg/kg、 45mg/kg、50mg/kg、55mg/kg、58mg/kg、58.6mg/kg、60mg/kg、65mg/kg、 70mg/kg、75mg/kg、78mg/kg、80mg/kg、85mg/kg、90mg/kg、95mg/kg、 100mg/kg、104mg/kg、110mg/kg、120mg/kg、130mg/kg、140mg/kg、 150mg/kg、160mg/kg、170mg/kg、180mg/kg、190mg/kg或200mg/kg 的剂量施用辅酶q10。还应理解,具有这些值中的任意之一作为上限 或下限的范围也旨在作为本发明的部分,例如,约50mg/kg至约200mg/kg或约650mg/kg至约1400mg/kg。在一个实施方式中,施用 的剂量为至少约1mg/kg、至少约5mg/kg、至少约10mg/kg、至少约 12.5mg/kg、至少约20mg/kg、至少约25mg/kg、至少约30mg/kg、至 少约35mg/kg、至少约40mg/kg、至少约45mg/kg、至少约50mg/kg、 至少约55mg/kg、至少约58mg/kg、至少约58.6mg/kg、至少约60mg/kg、 至少约75mg/kg、至少约78mg/kg、至少约100mg/kg、至少约104mg/kg、 至少约125mg/kg、至少约150mg/kg、至少约175mg/kg、至少约 200mg/kg、至少约300mg/kg或至少约400mg/kg。
[0365]
在某些实施方式中,以每天至少一剂施用coq10。在某些实施方 式中,以每天至少两剂施用coq10。在某些实施方式中,以每天至少 三剂施用coq10。在某些实施方式中,以每天一剂施用coq10。在某 些实施方式中,以每天两剂施用coq10。在某些实施方式中,以每天 三剂施用coq10。在某些实施方式中,coq10通过连续输注施用。
[0366]
例如,在一些实施方式中,前述方法包括静脉内施用coq10的 方案,例如至少约50mg/kg的coq10,每天一次,施用3周,任选地 休止一周,并随后施用化疗剂。在其它实施方式中,所述方法包括静 脉内施用coq10的方案,例如至少约75mg/kg的coq10,每天一次, 施用3周,任选地休止一周,并随后施用化疗剂。
[0367]
coq10吸入制剂的剂量范围可与供注射施用的那些相似。应理 解,用于通过吸入
递送的喷雾器或其它装置是本领域已知的并可与本 发明的方法结合使用。
[0368]
局部coq10的剂量通常取决于待治疗的区域的大小。例如,局 部施用的coq10可用于皮肤癌的治疗。coq10以足以覆盖病变的量 通常每天一次或两次局部施加到癌性病变部位,例如,像向丘疹施加 痤疮药物一样。如果受试者有许多治疗的病变,则将coq10施加到 多个部位,从而增大施用于受试者的总剂量。如果受试者具有单一病 变,则将coq10施加到该单一部位。
[0369]
在一个实施方式中,联合疗法的化疗剂为吉西他滨。当联合疗法 包括施用coq10制剂和吉西他滨时,对受试者施用coq10制剂和吉 西他滨(例如,二者均静脉内施用)使得肿瘤疾病被治疗或预防。对 受试者施用在约10mg/m2至约10,000mg/m2、约10mg/m2至约 5,000mg/m2、约10mg/m2至约3,000mg/m2范围内的一剂吉西他滨。 在一个实施方式中,施用在约10mg/m2至约1,500mg/m2范围内的吉 西他滨。在一个实施方式中,施用在约10mg/m2至约1000mg/m2范围 内的吉西他滨。在一个实施方式中,施用在约10mg/m2至约750mg/m2范围内的吉西他滨。在一个实施方式中,施用在约10mg/m2至约 500mg/m2范围内的吉西他滨。在一个实施方式中,施用在约10mg/m2至约400mg/m2范围内的吉西他滨。在一个实施方式中,施用在约 10mg/m2至约300mg/m2范围内的吉西他滨。在一个实施方式中,施 用在约10mg/m2至约200mg/m2范围内的吉西他滨。在一个实施方式 中,施用在约10mg/m2至约100mg/m2范围内的吉西他滨。在一个实 施方式中,施用在约10mg/m2至约70mg/m2范围内的吉西他滨。在各 种实施方式中,以约10mg/m2、20mg/m2、30mg/m2、40mg/m2、50mg/m2、 60mg/m2、65mg/m2、70mg/m2、80mg/m2、90mg/m2、100mg/m2、 100mg/m2、200mg/m2、300mg/m2、400mg/m2、500mg/m2、600mg/m2、 700mg/m2、800mg/m2、900mg/m2、1000mg/m2、1500mg/m2、2000mg/m2、 3000mg/m2的剂量施用吉西他滨。应理解,具有这些值中的任意之一 作为上限或下限的范围也旨在作为本发明的部分。在一个实施方式 中,吉西他滨的施用剂量为至少约10mg/m2、至少约30mg/m2、至少 约50mg/m2、至少约65mg/m2、至少约100mg/m2、至少约150mg/m2、 至少约200mg/m2、至少约300mg/m2、至少约400mg/m2、至少约 500mg/m2、至少约600mg/m2、至少约700mg/m2、至少约750mg/m2、 至少约800mg/m2、至少约900mg/m2、至少约1000mg/m2或至少约 1500mg/m2。在一些实施方式中,方案包括共施用静脉内coq10制剂 和化疗剂如吉西他滨。
[0370]
在第一示例性方案(每天一次方案)中,每天一次施用剂量为至 少约50mg/kg/剂或至少约75mg/kg/剂的静脉内coq10制剂,连续3 周,然后休止一周,同时每周一次施用150mg/kg/剂的吉西他滨,连 续3周,然后休止一周。图1示出了根据第一方案共施用静脉内coq10 制剂和静脉内吉西他滨的联合疗法方案的结果。
[0371]
在第二示例性方案(每天两次方案)中,每天两次施用剂量为至 少约50mg/kg/剂或至少约75mg/kg的静脉内coq10制剂,连续3周, 然后休止一周,同时每周一次施用150mg/kg/剂的吉西他滨,施用3 周,休止一周。图4示出了根据第二方案共施用静脉内coq10制剂 和静脉内吉西他滨的联合疗法方案的结果。
[0372]
在第三示例性方案(每天三次方案)中,每天施用三次剂量为至 少约50mg/kg/剂或至少约75mg/kg/剂的静脉内coq10制剂,连续3 周,然后休止一周,同时每周一次施用150mg/kg/剂的吉西他滨,施 用3周,休止一周。图8示出了根据第三方案共施用静脉内coq10 制剂和静脉内吉西他滨的联合疗法方案的结果。
[0373]
在第四示例性方案(预治疗方案)中,每天三次施用剂量为至少 约75mg/kg/剂的
静脉内coq10制剂,施用至少24小时、1天、2天、 3天、4天、5天、6天、1周、2周、3周或更多。在某些实施方式中, 在施用第一剂化疗剂之前使用预治疗方案。在某些实施方式中,在施 用每一剂化疗之前使用预治疗方案。在某些实施方式中,在施用每个 周期的化疗之前使用预治疗方案。
[0374]
在修改的方案1至4中,coq10每天以指定的剂量通过连续输注 施用而不是每天以1、2或3个分开的剂量施用。
[0375]
例如,在某些实施方式中,前述方法包括静脉施用至少约50mg/kg 的静脉内coq10制剂的方案,每天一次,施用3周,休止一周,并 施用约100mg/kg的吉西他滨和约10mg/kg的吉西他滨之间的吉西他 滨,每周一次,施用3周,休止一周。
[0376]
在其它实施方式中,所述方法包括静脉内施用至少约50mg/kg的 静脉内coq10制剂的方案,每天两次,施用3周,休止一周,并施 用约100mg/kg的吉西他滨和约10mg/kg的吉西他滨之间的吉西他滨, 每周一次,施用3周,休止一周。在其它实施方式中,所述方法包括 静脉内施用至少约50mg/kg的静脉内coq10制剂的方案,每天三次, 施用3周,休止一周,并施用约100mg/kg的吉西他滨和约10mg/kg 的吉西他滨之间的吉西他滨,每周一次,施用3周,休止一周。在进 一步实施方式中,所述方法包括静脉内施用至少约75mg/kg的静脉内 coq10制剂的方案,每天一次,施用3周,休止一周,并施用约 100mg/kg的吉西他滨和约10mg/kg的吉西他滨之间的吉西他滨,每 周一次,施用3周,休止一周。在进一步实施方式中,所述方法包括 静脉内施用至少约75mg/kg的静脉内coq10制剂的方案,每天两次, 施用3周,休止一周,并施用约100mg/kg的吉西他滨和约10mg/kg 的吉西他滨之间的吉西他滨,每周一次,施用3周,休止一周。还在 其它的实施方式中,所述方法包括静脉内施用至少约75mg/kg的静脉 内coq10制剂的方案,每天三次,施用3周,休止一周,并施用约 100mg/kg的吉西他滨和约10mg/kg的吉西他滨之间的吉西他滨,每 周一次,施用3周,休止一周。
[0377]
在某些实施方式中,前述方法包括每三周向受试者施用5mg/kg 的多西紫杉醇、1mg/kg的多柔比星和35mg/kg的环磷酰胺,施用六 个周期。
[0378]
在一些实施方式中,联合疗法方案包括向有需要的受试者共施用 静脉内coq10制剂和化疗剂如吉西他滨。在一个实施方式中,联合 疗法的吉西他滨通过静脉输注以约1000mg/m2的剂量施用,每周一 次,至多7周(或直至毒性使得有必要减小或暂停剂量),然后治疗 休止一周,作为第一治疗周期。在某些实施方式中,在不存在剂量限 制性毒性的情况下,以期望剂量和频率每天施用coq10。在一个实施 方式中,第一施用周期后接着由每4周中连续3周的每周一次输注组 成的后续周期。在一个实施方式中,基于患者经受的血液学毒性的程 度调节吉西他滨的剂量。在一个实施方式中,当患者的绝对粒细胞计 数大于或等于1000
×
106/l并且患者的血小板计数大于或等于 100,000
×
106/l时,可每周一次向患者施用1000mg/m2的全剂量。在 一个实施方式中,当患者的绝对粒细胞计数介于约500
‑
999
×
106/l之 间或患者的血小板计数介于约50,000
‑
99,000
×
106/l之间时,可每周一 次向患者施用全剂量的75%,例如750mg/m2。在一个实施方式中, 当患者的绝对粒细胞计数小于500
×
106/l或患者的血小板计数小于 50,000
×
106/l时,应暂停施用吉西他滨直至患者的绝对粒细胞计数大 于或等于500
×
106/l或患者的血小板计数大于或等于50,000
×
106/l。
[0379]
批准用于各种癌症类型中的化疗剂的适宜给药方案的指导是本 领域已知的。本
文提供的coq10治疗方案可基于本文提供的示例性 教导而与其它已知治疗方案结合。
[0380]
在一些实施方式中,方案包括共施用静脉内coq10制剂和化疗 剂如吉西他滨。在第一方案(一天一次方案)中,每天一次施用剂量 为至少约58mg/kg、至少约58.6mg/kg、至少约78mg/kg或至少约 104mg/kg的静脉内coq10制剂,至多7周(或直至毒性使得有必要 减少或暂停剂量),任选地接着由每4周中连续3周的每天一次输注 组成的后续周期;同时每周一次施用至少约1000mg/m2或至少约 750mg/m2的吉西他滨,至多7周(或直至毒性使得有必要减少或暂 停剂量),任选地接着由每4周中连续3周的每天一次输注组成的后 续周期。在第二方案(每天两次方案)中,每天两次施用剂量为至少 约58mg/kg、至少约58.6mg/kg、至少约78mg/kg或至少约104mg/kg 的静脉内coq10制剂,至多7周(或直至毒性使得有必要减少或暂 停剂量),任选地接着由每4周中连续3周的每天一次输注组成的后 续周期;同时每周一次施用至少约1000mg/m2或至少约750mg/m2的 吉西他滨,至多7周(或直至毒性使得有必要减少或暂停剂量),任 选地接着由每4周中连续3周的每天一次输注组成的后续周期。在第 三方案(每天三次方案)中,每天三次施用剂量为至少约58mg/kg、 至少约58.6mg/kg、至少约78mg/kg或至少约104mg/kg的静脉内 coq10制剂,至多7周(或直至毒性使得有必要减少或暂停剂量), 任选地接着由每4周中连续3周的每天一次输注组成的后续周期;同 时每周一次施用至少约1000mg/m2或至少约750mg/m2的吉西他滨, 至多7周(或直至毒性使得有必要减少或暂停剂量),任选地接着由 每4周中连续3周的每天一次输注组成的后续周期。在某些实施方式 中,coq10通过连续输注施用,总日剂量基于上面方案1
‑
3中提供的 那些。在某些实施方式中,在不存在剂量限制性毒性的情况下,以期 望剂量和频率每天施用coq10。
[0381]
在一个实施方式中,基于患者经受的血液学毒性程度调节吉西他 滨的剂量。在一个实施方式中,当患者的绝对粒细胞计数大于或等于 1000
×
106/l并且患者的血小板计数大于或等于100,000
×
106/l时,可 每周一次向患者施用1000mg/m2的全剂量。在一个实施方式中,当患 者的绝对粒细胞计数介于约500
‑
999
×
106/l之间或患者的血小板计数 介于约50,000
‑
99,000
×
106/l之间时,可每周一次向患者施用全剂量的 75%,例如750mg/m2。在一个实施方式中,当患者的绝对粒细胞计数 小于500
×
106/l或患者的血小板计数小于50,000
×
106/l时,应暂停施 用吉西他滨直至患者的绝对粒细胞计数大于或等于500
×
106/l或患者 的血小板计数大于或等于50,000
×
106/l。
[0382]
在本文提供的联合治疗方法的一个实施方式中,每周一次施用 coq10制剂。在一个实施方式中,每周2次施用coq10制剂。在一 个实施方式中,每周3次施用coq10制剂。在另一个实施方式中, 每周5次施用coq10制剂。在一个实施方式中,每天一次施用coq10 制剂。在一个实施方式中,每天两次施用coq10制剂。在一个实施 方式中,每天三次施用coq10制剂。在其中通过输注施用iv制剂的 一些实施方式中,剂量通过约1小时、2小时、3小时、4小时或更长 输注施用。在一个实施方式中,iv coq10制剂通过约4小时输注施 用。在某些实施方式中,iv coq10制剂通过约6、8、10、12、14、 16、18、20、22或24小时输注施用。
[0383]
在另一个实施方式中,coq10以约10mg/kg和约10,000mg/kg之 间、约20mg/kg至约5000mg/kg、约50mg/kg至约3000mg/kg、约 100mg/kg至约2000mg/kg、约200mg/kg至约1000mg/kg或约300mg/kg 至约500mg/kg的剂量以静脉内coq10制剂的形式施用,其中所述 coq10制剂包含约1%和10%之间的辅酶q10。在一个实施方式中, coq10制剂包含约3%至
约5%的辅酶q10。在一个实施方式中,coq10 制剂包含约4%的辅酶q10。在一个实施方式中,coq10制剂包含约 8%的辅酶q10。在其它实施方式中,coq10 iv制剂包含约1%、1.5%、 2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、 7.5%、8%、8.5%、9%、9.5%或10%的辅酶q10。应理解,具有这些 值中的任意之一作为上限或下限的范围也旨在作为本发明的部分。
[0384]
在某些实施方式中,在施用第一剂化疗剂或化疗方案之前至少8 小时、至少12小时、至少18小时、至少24小时、至少36小时、至 少48小时、至少3天、至少4天、至少5天、至少6天、至少1周、 至少2周、至少3周、至少4周、至少5周、至少6周、至少7周或 至少8周开始施用coq10。在一个实施方式中,在开始使用化疗剂或 化疗方案治疗之前中断施用coq10,即,化疗剂的治疗排除了coq10 的治疗。在一个实施方式中,在开始使用化疗剂或化疗方案治疗之后 继续或恢复施用coq10,使得coq10和化疗剂被同时施用例如至少 一个周期。
[0385]
当用在联合疗法中以治疗癌症时,静脉内coq10制剂可在药学 上可接受的载体中,其可作为单一疗法、与针对给定适应症的至少一 种其它化疗剂联合、在手术干预以彻底移除肿瘤后与放疗联合、与其 它针对癌症的替代性和/或补充性的可接受疗法联合等,以治疗有效 量施用于肿瘤发生区域。在某些实施方式中,本公开还提供了通过向 患者的肿瘤发生区域施用本公开的组合物来重新激活突变的/灭活的 p53蛋白的方法。
[0386]
一般来说,可使用包括本文描述的coq10制剂和化疗剂中任一 的联合疗法来预防性地或治疗性地治疗任何肿瘤。在一个特别的实施 方式中,使用联合疗法来治疗实体肿瘤。在本发明的各种实施方式中, 使用联合疗法来治疗或预防以下癌症:脑癌、中枢神经系统癌、头颈 癌、前列腺癌、乳腺癌、睾丸癌、胰腺癌、肝癌、结肠癌、膀胱癌、 尿道癌、胆囊癌、肾癌、肺癌、非小细胞肺癌、黑素瘤、间皮瘤、子 宫癌、子宫颈癌、卵巢癌、肉瘤、骨癌、胃癌、皮肤癌和髓母细胞瘤。 在优选实施方式中,使用联合疗法来治疗三阴性乳腺癌(tnbc)。 在一个实施方式中,可使用包括本文描述的coq10的联合疗法来治 疗绿色白血病,例如原发性绿色白血病或者继发性或转移性绿色白血 病,例如其存在于、迁移到或转移到特定器官如肺、肝脏或中枢神经 系统。
[0387]
然而,使用本发明的联合疗法的治疗不限于前述癌症类型。适合 于联合疗法治疗的癌症实例包括但不限于例如霍奇金病、非霍奇金淋 巴瘤、多发性骨髓瘤、成神经细胞瘤、乳腺癌、卵巢癌、肺癌、横纹 肌肉瘤、原发性血小板增多症、原发性巨球蛋白血症、小细胞肺肿瘤、 原发性脑肿瘤、胃癌、结肠癌、恶性胰腺胰岛瘤、恶性类癌瘤、膀胱 癌、恶化前皮肤病变、皮肤癌、睾丸癌、淋巴瘤、甲状腺癌、成神经 细胞瘤、食道癌、泌尿生殖道癌、恶性高钙血症、宫颈癌、子宫内膜 癌、肾上腺皮质癌和前列腺癌。在一个实施方式中,可与化疗剂联合 使用本文描述的coq10 iv制剂来治疗或预防各种类型的皮肤癌(例 如,鳞状细胞癌或基底细胞癌)、胰腺癌、乳腺癌、前列腺癌、肝癌 或骨癌。在一个实施方式中,使用包括coq10的联合疗法来治疗皮 肤肿瘤疾病,包括但不限于鳞状细胞癌(包括sccis(原位)和更侵 袭性的鳞状细胞癌)、基底细胞癌(包括浅表、结节性和浸润性基底 细胞癌)、黑素瘤和光化性角化病。在一个实施方式中,可用包括 coq10的联合疗法治疗的肿瘤疾病或癌症不是黑素瘤。在一个实施方 式中,肿瘤疾病是梅克尔细胞癌(mcc)。在一个实施方式中,可用 包括coq10的联合疗法治疗的肿瘤疾病或癌症不是皮肤癌。
[0388]
在某些实施方式中,包括coq10的联合疗法对癌细胞可具有的 效果可以部分地取
决于癌细胞显示的代谢和氧化流的各种状态。可利 用coq10来打断和/或干扰致癌细胞糖酵解依赖性的转化和增加的乳 酸利用。由于其与癌症状态相关,这种对肿瘤微环境的糖酵解和氧化 流的干扰可以以减少癌细胞发展的方式影响细胞凋亡和血管生成。在 一些实施方式中,coq10与糖酵解和氧化流因子的相互作用可增强 coq10在癌症中发挥其恢复性凋亡作用的能力,同时建立用于药物发 现和开发的可行药物靶点。
[0389]
在一个实施方式中,施用本文中所述或引入的coq10和化疗剂 减小了患有肿瘤疾病的受试者的肿瘤大小、重量或体积,延长了到进 展的时间,抑制了肿瘤生长和/或延长了存活时间。在优选实施方式 中,coq10通过注射,例如通过静脉内施用如本文中所述或引入的静 脉内coq10制剂来施用。在某些实施方式中,相对于施用单独的 coq10或单独的化疗剂的相应对照受试者,施用coq10和化疗剂减 小受试者的肿瘤大小、重量或体积,延长到进展的时间,抑制肿瘤生 长和/或延长存活时间至少1%、2%、3%、4%、5%、10%、20%、30%、 40%、50%、60%、70%、80%、90%、100%、200%、300%、400% 或500%。在其它实施方式中,施用coq10和化疗剂使在治疗前患有 进行性肿瘤疾病的受试者的肿瘤疾病稳定化。
[0390]
本发明还涉及通过向人或其它动物静脉内施用有效的、非毒性量 的coq10来治疗这样的人或动物中的肿瘤的方法。本领域技术人员 将能够通过常规实验确定对于治疗恶性肿瘤的目的而言有效的、非毒 性量的coq10。例如,coq10的治疗有效量可随如受试者的疾病分期 (例如,i期对iv期)、年龄、性别、医学并发症(例如,免疫抑制 病症或疾病)和体重以及coq10在受试者中引起期望反应的能力的 因素而变化。可以调整剂量方案以提供最佳治疗反应。例如,可以每 天施用若干分开的剂量或通过连续输注施用,或者可以根据治疗情况 的迫切性需要按比例降低剂量。
[0391]
在另一个方面,本发明还提供了治疗或预防人的侵袭性肿瘤疾病 的方法。这些方法包括以治疗有效剂量向人静脉内施用coq10,同时 共施用化疗剂,以便发生侵袭性肿瘤疾病的治疗或预防。在一个实施 方式中,这些方法包括以比针对较低侵袭性或非侵袭性肿瘤疾病使用 或选择的剂量方案低的所选定剂量向受试者静脉内施用coq10,以便 发生侵袭性肿瘤疾病的治疗或预防。在某些实施方式中,侵袭性肿瘤 疾病包括胰腺癌、肝细胞癌、尤因氏肉瘤、转移性乳腺癌、转移性黑 素瘤、脑癌(星形细胞瘤、胶质母细胞瘤)、神经内分泌癌、结肠癌、 肝癌、肺癌、骨肉瘤、非雄激素依赖性前列腺癌、卵巢癌、皮肤癌和 非霍奇金淋巴瘤。
[0392]
在另一个方面,本发明提供了尤其是在皮肤癌治疗中与通过任意 施用路径施用的化疗剂联合的局部施用coq10的方法。这样的方法 包括在第一次施用化疗剂之前用coq10预治疗。
[0393]
在相关的方面,本发明提供了治疗或预防人的非侵袭性肿瘤疾病 的方法。这些方法包括以治疗有效剂量向受试者静脉内共施用coq10 和化疗剂,以便发生非侵袭性肿瘤疾病的治疗或预防。在一个实施方 式中,这些方法包括以比针对侵袭性肿瘤疾病使用或选择的剂量方案 高的所选定剂量向受试者施用coq10,以便发生非侵袭性肿瘤疾病的 治疗或预防。在某些实施方式中,非侵袭性肿瘤疾病包括非转移性乳 腺癌、雄激素依赖性前列腺癌、小细胞肺癌和急性淋巴细胞性白血病。
[0394]
在本发明的一些实施方式中,肿瘤疾病的治疗或预防经由coq10 与蛋白质或选自
scidγ(nsg)小鼠中。nsg小鼠模型缺乏先天免疫 系统和适应性免疫系统,并提供了适合人肿瘤在体内生长的生物环 境。miapaca
‑
2是良好确认的人源胰腺癌细胞系,其可用来在免疫抑 制动物中建立胰腺肿瘤。在开始治疗之前让miapaca
‑
2肿瘤在小鼠中 发展平均至少3周。将具有可触知肿瘤的动物随机分成治疗组。图中 示出的结果表明研究中从治疗的第一天起的存活天数。
[0405]
使用上面提供的方法将miapaca
‑
2细胞(1
×
107个细胞每动物) 注射到nsg小鼠中。将具有可触知肿瘤的小鼠随机分成如下的4个 组,每组30只小鼠:
[0406]
i.组1
‑
无治疗。
[0407]
ii.组2
‑
静脉内施用4%辅酶q10,50mg/kg/天。
[0408]
iii.组3
‑
每周静脉内单次施用吉西他滨,150mg/kg/周,施用3 周,休止一周。以四周时间间隔重复该周期。
[0409]
iv.组4
‑
静脉内施用4%辅酶q10(50mg/kg/天)和每周静脉内 单次施用吉西他滨(150mg/kg,施用3周,休止一周)的联合。以四 周时间间隔重复该周期。
[0410]
观察小鼠的活力和二次症状,并通过触诊监测肿瘤生长。在死亡 时,从小鼠采集肿瘤并测量、称重和分析肿瘤血管的存在。
[0411]
存活曲线示于图1中。如所示出的,未治疗组显示出急剧上升的 死亡率,而单独的coq10、吉西他滨及coq10的组合产生了与未治 疗的对照相比寿命的延长。单独的coq10比单独的吉西他滨对存活 具有显著更高的影响。用吉西他滨与coq10的组合治疗的动物显示 出与其它组相比统计学显著的存活延长和长期缓解。
[0412]
死亡时从动物采集的肿瘤示于图2中。治疗开始后第20天从组1 (对照)动物采集肿瘤。治疗开始后第50
‑
60天从组2(单独辅酶q10) 动物采集肿瘤。治疗开始后第40
‑
50天从组3(单独吉西他滨)动物 采集肿瘤。治疗开始后第50
‑
60天从组4(吉西他滨 辅酶q10)动物 采集肿瘤。图2中示出的肿瘤大小代表在所示时间段时每组中总体上 观察到的肿瘤大小。
[0413]
虽然在从治疗组(组2
‑
4)采集肿瘤的日期之前20
‑
40天从对照 组(组1)中的动物采集肿瘤,但从图2很明显,在死亡之时,对照 组中的肿瘤平均而言显著大于任何治疗组中的那些。这些结果表明辅 酶q10和吉西他滨二者均抑制了人肿瘤异种小鼠模型中胰腺肿瘤的 生长。
[0414]
另外,对肿瘤称重以定量测定大小。这些结果示于图3中。平均 而言,来自单独用辅酶q10治疗(组2)的小鼠的肿瘤显著小于来自 对照组中小鼠的肿瘤(组2对比组1,p<0.001)或来自吉西他滨治疗 组中小鼠的肿瘤(组2对比组3,p<0.001)。发现来自用辅酶q10 和吉西他滨联合治疗(组4)的小鼠的肿瘤平均而言显著小于来自单 独用辅酶q10治疗的小鼠的肿瘤(组2对比组4,p=0.01)或单独用 吉西他滨治疗的小鼠的肿瘤(组3对比组4,p<0.0001)。
[0415]
类似地,注意到与对照组中的肿瘤相比,可触知肿瘤在治疗组中 减小。此外,肿瘤的组织学分析揭示出与至少来自未治疗的对照小鼠 的肿瘤相比,来自用辅酶q10治疗的小鼠肿瘤中的肿瘤血管减少(数 据未示出)。未进行肿瘤血管的定量分析。
[0416]
这些数据证实,与未治疗的对照小鼠相比和与单独用吉西他滨 (一种批准用于治疗人胰腺肿瘤的药剂)治疗的小鼠相比,向携带胰 腺肿瘤的小鼠静脉内施用辅酶q10抑制了胰腺肿瘤生长。此外,静脉 内施用的辅酶q10与吉西他滨组合比单独用任一药剂的治疗
更有效 地抑制了小鼠中胰腺肿瘤的生长。
[0417]
还观察到,静脉内施用的辅酶q10导致胰腺肿瘤中的血管量至少 比来自未治疗对照小鼠的肿瘤减少,进一步证实辅酶q10在癌症治疗 中的有效性。
[0418]
这些数据还证实,与未治疗的对照动物相比和与单独用吉西他滨 (一种批准用于治疗人的胰腺肿瘤的药剂)治疗的动物相比,向携带 胰腺肿瘤的小鼠静脉内施用辅酶q10增加了小鼠的存活时间。此外, 辅酶q10与吉西他滨组合比单独用任一药剂的治疗更有效地增加了 携带胰腺肿瘤的小鼠的存活时间。
[0419]
实施例2
‑
方案2
‑‑
一天两次iv coq10和每周一次吉西他滨组 合用于治疗胰腺癌
[0420]
使用上面提供的方法将miapaca
‑
2细胞(1
×
107个细胞每动物) 注射到nsg小鼠中。将具有可触知肿瘤的小鼠随机分成如下4个组, 每组30只小鼠:
[0421]
在第二方案中,给药
[0422]
i.对照,无治疗。
[0423]
ii.腹膜内施用50mg/kg的静脉4%coq10静脉内制剂,每天两 次,施用3周,休止一周。
[0424]
iii.每周一次150mg/kg的吉西他滨,施用3周,休止一周。
[0425]
iv.腹膜内施用50mg/kg的静脉4%coq10静脉内制剂,每天两 次,施用3周,休止一周,以及150mg/kg剂量的吉西他滨,每周一 次,施用3周,休止一周。
[0426]
在该实施例中,腹膜内施用coq10静脉内制剂以避免因施用频 率导致的血管损伤。
[0427]
监测小鼠的存活。如图4中所示,结果证实与未治疗的小鼠或单 独用吉西他滨治疗的小鼠相比,单独或与吉西他滨联合使用coq10 治疗的小鼠的存活增加。这些数据证实,单独或与吉西他滨组合的 coq10比单独的吉西他滨在胰腺癌治疗中更有效。
[0428]
实施例3
‑
胰腺癌和乳腺癌的体外联合疗法(coq10 吉西他滨)
[0429]
体外细胞存活力分析
[0430]
使用各细胞系的标准培养条件将细胞系(例如,miapaca
‑
2、 hep3b和/或sk
‑
br3细胞系)保持在培养物中。用coq10或指定化 疗剂在指定浓度下处理细胞达指定时间。在预定的孵育时间后,使用 常规方法染色细胞以区分活细胞和非活细胞。通过显微镜或流式细胞 仪对细胞计数。将处理后的细胞数针对未处理样品中的细胞数归一 化。
[0431]
具体而言,为体外评估与吉西他滨联合的coq10的疗效,将 miapaca
‑
2胰腺癌细胞保持在培养物中并暴露于增加浓度的与 coq10、4%coq10静脉内制剂或coq10静脉内制剂的赋形剂组合的 吉西他滨。图5a示出了用单独或与吉西他滨组合的coq10或4% coq10静脉内制剂处理6小时对miapaca
‑
2胰腺癌细胞的影响。图 5b示出了用单独或与吉西他滨联合的coq10或4%coq10静脉内制 剂处理6小时对sk
‑
br3乳腺癌细胞的影响。结果证实,在暴露于与 吉西他滨组合的4%coq10静脉内制剂之后,在6小时处胰腺癌和乳 腺癌细胞中的细胞死亡均增加。与单独用吉西他滨处理相比,用吉西 他滨和4%coq10静脉内制剂联合处理导致细胞死亡增加。
[0432]
实施例4
‑
胰腺癌和乳腺癌的体外联合疗法(coq10 多柔比星)
[0433]
为体外评估与多柔比星组合的coq10的疗效,将miapaca
‑
2胰 腺癌细胞保持在培养物中并暴露于增加浓度的与coq10、4%coq10 静脉内制剂或coq10静脉内制剂的赋形剂
组合的吉西他滨。图6a示 出了用单独或与多柔比星组合的coq10或coq10静脉内制剂处理6 小时对miapaca
‑
2胰腺癌细胞的影响。图6b示出了用单独或与多柔 比星组合的coq10或4%coq10静脉内制剂处理6小时对sk
‑
br3乳 腺癌细胞的影响。结果证实,在暴露于与多柔比星组合的coq10的 4%coq10静脉内制剂之后,在6小时时胰腺癌和乳腺癌细胞均诱发 了增加的细胞死亡。与单独用多柔比星处理相比,用多柔比星和4% coq10静脉内制剂联合处理导致细胞死亡的增加。
[0434]
为确认体外观察到的结果,使用上述miapaca
‑
2小鼠异种模型 来评估单独或与coq10静脉内制剂联合的多柔比星增加小鼠存活的 活性。如图7中所示,与单独用多柔比星治疗相比,coq10静脉内制 剂与多柔比星联合提高了生存力。
[0435]
发现在胰腺癌的治疗中,单独的coq10或与多柔比星联合的 coq10比吉西他滨或多柔比星在实现与有益的治疗终点相关的反应 中更有效,最显著的是增加存活。静脉内coq10还在乳腺癌的治疗 中具有潜在效用。在至多42天的胰腺癌异种小鼠模型中,单独或与 吉西他滨联合的coq10制剂将生存力延长至42天。与单独用多柔比 星的治疗相比,联合施用coq10与多柔比星降低了胰腺癌异种小鼠 模型中观察到的死亡率。
[0436]
实施例5
‑
方案3
‑
每天三次iv coq10和每周一次吉西他滨组 合
[0437]
将相等数量的miapaca2人胰腺肿瘤细胞(1
×
107个)悬浮在中并注射到小鼠中。在开始治疗之前让肿瘤发展平均至 少3周。
[0438]
将具有可触知肿瘤的小鼠随机分成如下5个组,每组30只小鼠:
[0439]
i.组1
‑
无治疗。
[0440]
ii.组2
‑
腹膜内施用4%coq10静脉内制剂,50mg/kg/剂,每天 3次(150mg/kg/天)。
[0441]
iii.组3
‑
腹膜内施用4%辅酶q10静脉内制剂,75mg/kg/剂,每 天3次(225mg/kg/天)。
[0442]
iv.组4
‑
腹膜内施用4%辅酶q10静脉内制剂(50mg/kg/剂,每 天3次(150mg/kg/天))和每周一次静脉内施用吉西他滨(150mg/kg, 施用3周,休止一周)的组合。以四周时间间隔重复该周期。
[0443]
v.组5
‑
腹膜内施用4%辅酶q10静脉内制剂(75mg/kg/剂,每 天3次(225mg/kg/天))和每周一次静脉内施用吉西他滨(150mg/kg, 施用3周,休止一周)的组合。以四周时间间隔重复该周期。
[0444]
辅酶q10的高频率施用阻止了静脉内施用辅酶q10,因为由高频 率静脉内注射导致血管损伤。观察动物的存活力并通过触诊监测肿瘤 生长。
[0445]
图8中示出了到第417天收集的存活结果。未治疗的对照组(组 1)中的所有小鼠到开始向组2
‑
5中的小鼠施用治疗剂后第23天全部 死亡。相比之下,在每个治疗组(组2
‑
5)中,至少50%的动物在治 疗开始后第130天存活。在两个治疗剂量中单独用辅酶q10治疗的动 物比对照动物显示出显著增加的存活。此外,在治疗过程中,用辅酶 q10和吉西他滨的组合治疗的动物与单独用相同剂量的辅酶q10治 疗的小鼠相比显示出增加的存活。
[0446]
实施例6
‑
致癌细胞和正常细胞对辅酶q10的相对敏感性
[0447]
研究并比较辅酶q10处理对各种致癌和正常细胞系的影响。通过 监测细胞凋亡的诱导评估细胞对辅酶q10的敏感性。细胞的coq10 处理如下文“材料和方法”中所详细描述的那样进行。如下文所述,通 过监测早期凋亡的指示(例如,bcl
‑
2表达、半胱天冬酶激活和
[0451][0452]
材料和方法
[0453]
细胞制备与处理
[0454]
在皿或瓶中制备的细胞
[0455]
在含5%co2水平的37℃孵育箱中于t
‑
75培养瓶中用补充了 10%胎牛血清(fbs)、1%psa(青霉素、链霉素、两性霉素b) (invitrogen and cellgro)的相关培养基培养细胞直至达到70
‑
80%的 汇合。为收获细胞用于处理,向瓶中加入1ml胰蛋白酶,吸出,用 另外3ml进行胰蛋白酶化并于37℃下孵育3
‑
5分钟。然后用等体积 的培养基使细胞中和,并随后将溶液于10,000rpm下离心8分钟。吸 出上清液并用8.5ml培养基再悬浮细胞。用库尔特计数器对500ul重 悬液和9.5ml异丙醇的混合物读取两次,并确定待接种到每个皿中的 细胞的适宜数量。一式三份对对照组和浓度范围0至200μm的组进 行检验。从500μm coq
‑
10储备溶液进行连续稀释以在适宜的皿中获 得期望实验浓度。取决于细胞类型和实验方案,将皿于含5%co2水 平的37℃孵育箱中孵育0
‑
72小时。
[0456]
蛋白质分离和定量
[0457]
在皿中制备的细胞
[0458]
在细胞处理孵育期结束后,进行蛋白质分离。用2ml冰冷1x磷 酸盐缓冲盐水(pbs)将所有处理组的皿洗涤两次,并用1ml冰冷1x 磷酸盐缓冲盐水(pbs)洗涤一次。仅在最初2次洗涤后从皿中吸出 pbs。使用来自第三次洗涤的最终体积,将细胞轻轻刮下并收集到微 量离心管中,且于10,000rpm下离心10分钟。离心后,吸出上清液 并用50ul裂解缓冲液(每100ul裂解缓冲液中1ul蛋白酶和磷酸酶 抑制剂)裂解球粒。然后将样品于
‑
20℃下冷冻过夜。
[0459]
在瓶中制备的细胞
[0460]
在细胞处理孵育期结束后,进行蛋白质分离。用5ml冰冷1x pbs 将所有处理组的烧瓶洗涤两次,并用3ml冰冷1x pbs洗涤一次。仅 在最初2次洗涤后从瓶中吸出pbs。使用来自第三次洗涤的最终体积, 将细胞轻轻刮下并收集到15ml离心管中,且于10,000rpm下离心10 分钟。离心后,吸出上清液并用适宜量的裂解缓冲液(每100ul裂解 缓冲液中1ul蛋白酶和磷酸酶抑制剂)裂解球粒。裂解缓冲液体积取 决于球粒尺寸。将样品转移到微量离心管中并于
‑
20℃下冷冻过夜。
[0461]
蛋白质定量
[0462]
在蛋白质分离的第二天将样品于
‑
4℃解冻并超声处理以确保均 质化。使用micro bca蛋白分析试剂盒(pierce)进行蛋白质定量。 为制备用于免疫印迹法的样品,制备β
‑
巯基乙醇(sigma)对样品缓 冲液(bio
‑
rad)的1:19溶液。用β
‑
巯基乙醇
‑
样品缓冲溶液将样品 1:1稀释,在95℃下沸腾5分钟,并于
‑
20℃下冷冻过夜。
[0463]
免疫印迹法
[0464]
bcl
‑
2、半胱天冬酶
‑
9、细胞色素c
[0465]
使用自bca蛋白分析获得的蛋白质原始平均浓度确定每孔加载 的样品体积。对于每一处理时间点,加载大约30
‑
60μg蛋白质。使蛋 白质一式三份在12%tris
‑
hcl预制凝胶或手铸凝胶上 于1x运行缓冲液中85和100伏下跑胶。然后于100伏下使蛋白质转 移到硝酸纤维素纸上1小时,并在5%牛奶溶液中再封闭1小时。将 膜放置在一抗(1ul ab:1000ul tbst)(cell signaling)中于
‑
4℃下 过夜。第二天,用tris
‑
缓冲盐水(tbst)洗涤膜三次, 每次十分钟,然后于
‑
4℃下施加二抗(抗
‑
兔;1ul ab:1000ul tbst) 一小时。再用tbst洗涤膜三次,每次十分钟,并完成使用pico或 femto底物
的化学发光然后将膜于产生最佳视觉效果的 时间间隔显影。显影后,将膜保持在
‑
4℃下的tbst中直至可测量肌 动蛋白水平。
[0466]
肌动蛋白
[0467]
将膜在肌动蛋白一抗(1ul ab:5000ul tbst)(cell signaling 公司)中于
‑
4℃下放置1小时,用tbst洗涤三次,每次十分钟,然 后于
‑
4℃下施加二抗(抗
‑
小鼠;1ul ab:1000ul tbst)一小时。再 用tbst洗涤膜三次,每次十分钟,并完成使用pico底物的化学发光 (pierce)。然后将膜于产生最佳视觉效果的时间间隔显影。
[0468]
膜联蛋白v分析
[0469]
将细胞在pbs中洗涤两次并再悬浮于结合缓冲液(0.1m hepes, ph 7.4;1.4m nacl;25mm cacl2)中。将100μl样品加到含5μl膜联 蛋白
‑
pe染料或7
‑
add的培养管中。混合细胞并在室温下无光孵育 15分钟。其后,向每一样品中加入400μl 1x结合缓冲液并通过流式 细胞仪对它们进行分析。
[0470]
实施例7
‑
coq10处理在体内使肿瘤对化疗剂敏感
[0471]
使用实施例6中的方法测试细胞以确定用coq10和化疗剂处理 细胞的相对时机是否对细胞杀灭有影响,例如通过促进细胞凋亡、诱 导肿瘤裂解、抑制细胞增殖。
[0472]
简言之,如实施例6中那样培养细胞。单独地或联合地用coq10 和化疗剂或者用适宜的媒介对照处理细胞。对于用coq10和化疗剂 二者处理的细胞,使细胞以各种顺序接触coq10和化疗剂。使用和化疗剂的各种浓度。还使用各种处理时间。示例性的条件在 下表中提供。
[0473][0474]
对各coq10和化疗剂使用适宜的媒介对照。
[0475]
在如所示用coq10和化疗处理后,采集细胞并使用上文提供的 方法分析存活力和细胞凋亡。经证实,在用化疗处理之前用coq10 预处理比用coq10和化疗共同处理或在化疗之后用coq10处理在细 胞杀灭中更有效。具体而言,用coq10预处理,然后用coq10和化 疗同时处理在细胞杀灭中有效。用coq10预处理和中断coq10,接 着用化疗处理在细胞杀灭中也有效。不受理论束缚,据认为coq10 通过改变磷酸戊糖旁路、糖酵解和氧化磷酸化中关键调控酶的表达而
ꢀ“
再教育”依赖于糖酵解的癌症(glycolysis addicted cancers)利用线 粒体呼吸链作为能量源。coq10在癌细胞中实现的代谢切换与导致凋 亡途径重演的涉及tp53、bcl
‑
2/bax和vegf的新型集成信号传导交 互的诱导相关。数据表明coq10在使癌细胞对化疗剂的细胞毒性作 用敏感而同时对正常细胞提供保护方面直接影响线粒体中心途径。
[0476]
实施例8
‑
coq10处理在体内使肿瘤对化疗剂敏感
[0477]
在体内肿瘤异种移植模型中,对小鼠移植肿瘤。例如,向nsg 小鼠中注射悬浮在matrigel中的miapaca
‑
2胰腺癌细胞。或者, 在异种移植小鼠模型中使用其它肿瘤细胞系,例如三阴性乳腺癌、肝 癌、前列腺癌、黑素瘤、肉瘤、癌瘤细胞系。也可使用化学诱导的肿 瘤和其它癌症动物模型。在所有动物中,于治疗开始之前确认肿瘤的 存在。
[0478]
测试各种序列方案和coq10与化疗剂的组合减小肿瘤负荷和/或 减少肿瘤转移的能力。例如,使用实施例7中的表中提供的示例性方 案。如实施例7中的表中所示治疗#1和治疗#2各自可以是使用该药 剂的一个或多个周期治疗。例如,在一些动物中,在治疗2中的一个 或多个周期的化疗剂之前施用在治疗1中的2个或更多个周期的 coq10。在一些动物中,在施用治疗2中的多个周期的化疗之前施用 治疗1中的一个周期的coq10。
[0479]
使用常规方法如卡尺、成像分析来监测肿瘤体积。在研究结束时, 切除肿瘤并使用常规方法分析例如大小(例如,重量和体积)、组织 学特征、分级和血管形成。在用化疗剂治疗之前用一个或多个周期的 coq10治疗证明比共施用coq10和化疗剂或单独施用化疗剂更有效。
[0480]
实施例9
‑
coq10处理增强化疗剂在体外肝癌细胞处理中的功效
[0481]
在标准条件下培养hep3b肝癌细胞。用化疗剂伊立替康(sn38)、 顺铂、5
‑
氟尿嘧啶或多柔比星在指定的浓度下单独或与coq10 (100μm)联合地处理细胞预定的时间段。
[0482]
通过活细胞计数评估生长抑制/促进细胞死亡。结果示于图9a
‑
9c 和10中。coq10证明提高了所有化疗剂的功效,增加细胞死亡并减 少活细胞数量。这些数据表明这些治疗剂的组合比单独的化疗剂在肝 癌治疗中更有效。
[0483]
实施例10
‑
coq10对胰腺癌中细胞凋亡机构的线粒体启动 (mitochondrial priming)以增强化疗功效
[0484]
不受机理的束缚,据认为,coq10实现从糖酵解向增强的线粒体 氧化磷酸化的代谢切换,导致癌症中细胞凋亡的重演。研究coq10 的作用以确定用coq10预处理是否导致线粒体启动,从而增强标准 治疗化疗剂的细胞毒性作用。将miapaca
‑
2人胰腺癌细胞(a)在用 吉西他滨处理之前用coq10预处理或(b)用coq10和吉西他滨共同 处理。监测处理对细胞存活力的影响并将结果示于图10
‑
14中。
[0485]
与单独用吉西他滨处理相比,coq10处理导致miapaca
‑
2细胞 增殖减少。用coq10处理miapaca
‑
2细胞在预处理和共同处理方案 中均增强了吉西他滨的细胞毒性潜能。
[0486]
实施例11
‑
coq10对胰腺癌中细胞凋亡机构的线粒体启动以增强化 疗功效
[0487]
将相等数量的miapaca2人胰腺肿瘤细胞(1
×
107个)悬浮在中并注射到小鼠中。在开始治疗之前让肿瘤发展平均至 少3周。
[0488]
将具有可触知肿瘤的小鼠如下随机分成5个组,每组30只小鼠:
[0489]
i.组1
‑
无治疗。
[0490]
ii.组2
‑
腹膜内施用4%辅酶q10静脉内制剂(75mg/kg/剂,每 天3次(225mg/kg/天))并在同一天开始每周一次静脉内施用吉西他滨 (150mg/kg,施用3周,休止一周)。
[0491]
iii.组3
‑
腹膜内施用4%辅酶q10静脉内制剂(75mg/kg/剂,每 天3次(225mg/kg/天))并于coq10治疗开始后一周开始每周一次静 脉内施用吉西他滨(150mg/kg,施用3周,休止一周)。
[0492]
iv.组4
‑
腹膜内施用4%辅酶q10静脉内制剂(75mg/kg/剂,每 天3次(225mg/kg/天))并于coq10治疗开始后两周开始每周一次静 脉内施用吉西他滨(150mg/kg,施用3周,休止一周)。
[0493]
v.组5
‑
腹膜内施用4%辅酶q10静脉内制剂(75mg/kg/剂,每 天3次(225mg/kg/天))并于coq10治疗开始后三周开始每周一次静 脉内施用吉西他滨(150mg/kg,施用3周,休止一周)。
[0494]
高频率施用辅酶q10阻止了静脉内施用辅酶q10,因为高频率静 脉内注射导致血管损伤。通过触诊观察动物的存活和肿瘤生长。
[0495]
早期时间点表明在静脉内coq10预治疗之后使用吉西他滨在胰腺 癌模型中产生与共同治疗方案相比改善的存活(图15)。不受机理的束 缚,数据表明coq10可以是可行的线粒体启动剂以在胰腺癌中使癌细胞 对吉西他滨的细胞毒性作用敏感。数据证实,coq10的加入提高了吉西 他滨在胰腺癌中的细胞毒性作用,并与未治疗的对照相比在最后的时间 点以统计学显著的方式增加存活(参见下文)。另外,coq10治疗接着 吉西他滨治疗与改善的存活相关(参见,例如,与化疗同时开始的coq1075mg/kg,对比coq10 75mg/kg
×
3周然后化疗)。
[0496]
条件1条件2p
‑
值对照coq10 75mg/kg,与化疗同时开始<0.00001对照coq10 75mg/kg
×
1周然后化疗<0.00001对照coq10 75mg/kg
×
2周然后化疗<0.00001对照coq10 75mg/kg
×
3周然后化疗<0.00001coq10 75mg/kg,与化疗同时开始coq10 75mg/kg
×
1周然后化疗0.26503coq10 75mg/kg,与化疗同时开始coq10 75mg/kg
×
2周然后化疗0.45960coq10 75mg/kg,与化疗同时开始coq10 75mg/kg
×
3周然后化疗0.02724*coq10 75mg/kg
×
1周然后化疗coq10 75mg/kg
×
2周然后化疗0.82980coq10 75mg/kg
×
1周然后化疗coq10 75mg/kg
×
3周然后化疗0.20885coq10 75mg/kg
×
2周然后化疗coq10 75mg/kg
×
3周然后化疗0.15515
[0497]
实施例12
‑
各种癌细胞类型的体外coq10单一疗法
[0498]
为评估coq10的体外功效,将各种癌细胞(miapaca
‑
2胰腺癌 细胞、skov
‑
3卵巢癌细胞、pc
‑
3前列腺癌细胞、ht
‑
29结肠癌细胞、 mcf7乳腺癌细胞、mda
‑
mb231乳腺癌细胞、skbr
‑
3乳腺癌细胞、 a549肺癌细胞、hep3b肝癌细胞)保持在培养物中并暴露于100μm coq10 48
‑
72小时。图16示出了coq10处理对各种癌细胞的影响。 结果证实在暴露于coq10后癌细胞中的细胞死亡增加。
[0499]
实施例13
‑
coq10对细胞代谢和半胱天冬酶3活性的影响
[0500]
在用100μm coq10处理24小时的mda
‑
mb213和skbr
‑
3乳腺 癌细胞中测量基础耗氧率(ocr)和细胞外酸化率(ecar)。图17 示出了coq10处理对乳腺癌细胞中ocr和ecar的影响。用coq10 处理的乳腺癌细胞中较高ocr
‑
ecar比率表明coq10在乳腺癌细胞 中增加了氧化磷酸化(oxphos)而减少了糖酵解。还在经100μm coq10处理24小时的mda
‑
mb213和skbr
‑
3乳腺癌细胞及非致瘤 性对照细胞(mcf12a)中测量活性氧物质(ros)的产生。线粒体 代表已知参与细胞死亡途径激活的ros的重要来源。图17显示 coq10处理在乳腺癌细胞和对照
细胞二者中增加了ros的产生。
[0501]
在经100μm coq10处理72
‑
96小时的mda
‑
mb213和skbr
‑
3 乳腺癌细胞及未处理的对照mda
‑
mb213和skbr
‑
3乳腺癌细胞中比 较半胱天冬酶3活性。半胱天冬酶3是内在(线粒体)和外在凋亡途 径都需要的执行者(executioner)半胱天冬酶。图18显示coq10处 理在mda
‑
mb213和skbr
‑
3乳腺癌细胞中提高了半胱天冬酶3活 性。
[0502]
实施例14
‑
在各种癌细胞中coq10预处理和共处理的体外分析
[0503]
用coq10及分别化疗剂顺铂、多西紫杉醇和环磷酰胺预处理或 共处理a549肺癌细胞、pc3前列腺癌细胞和skov3卵巢癌细胞。 对于预处理,将细胞用coq10处理6小时,然后向培养基中加入指 定的化疗剂。因此,对于预处理组,coq10处理在化疗剂处理过程中 持续。化疗剂处理的时间长度随细胞类型而异。a549细胞用顺铂处 理48小时,pc3细胞用多西紫杉醇处理48小时,和skov3细胞用 环磷酰胺处理72小时。共处理和预处理的细胞用化疗剂处理相同的 时间长度。图19示出了用coq10和化疗剂共处理或预处理的影响。
[0504]
实施例15
‑
三阴性乳腺癌(tnbc)动物模型对单独的或与标准方案 化疗联合的coq10的反应的评价
[0505]
在用和不用coq10的情况下,用tac方案(5mg/kg多西紫杉醇、 1mg/kg多柔比星和35mg/kg环磷酰胺)治疗携带三阴性乳腺癌 (tnbc)异种移植物的小鼠。tac每三周施用,施用六个周期。也 用单独的coq10治疗小鼠。单独或与tac方案联合的coq10显著改 善了存活。参见图21。
[0506]
实施例16
‑
coq10和化疗剂处理的乳腺癌细胞的体外研究
[0507]
使不同受体状态的人乳腺癌细胞(skbr3、mda
‑
mb231)经受 (a)coq10预处理(6小时)然后与化疗剂(5
‑
氟尿嘧啶,5
‑
fu; 多柔比星,doxo;sn38,伊立替康活性代谢物)共孵育48小时或(b) 用coq10与化疗剂共处理。与非致瘤性乳腺细胞(mcf12a)比较癌 细胞反应。48小时后评估活细胞的数量。分别使用碘化丙啶(pi)和 cfse细胞示踪物来测量处理的细胞中的细胞死亡和增殖。当与化疗 剂比较时,单独的coq10或者coq10加标准治疗的预处理和共处理 策略都导致活乳腺癌细胞的显著减少;然而,在非致瘤性mcf12a 细胞中观察到最低的影响。参见图20、23和24。
[0508]
此外,coq10与化疗剂联合放大了半胱天冬酶3活化和凋亡细胞 死亡,这表明coq10增强凋亡信号传导。参见图22。合在一起,这 些数据证实coq10是与恶性肿瘤的基础遗传构成无关地重新啮合癌 细胞的细胞代谢和凋亡机构的新型药剂。此外,coq10通过调节线粒 体代谢和氧化应激增强标准治疗化疗剂在乳腺癌细胞中的细胞毒性。 这些发现确认coq10是在包括tnbc的乳腺癌(其否则将具有差预 后且治疗选择有限)中具有多种效用(作为单一药剂或联合)的新型 药剂。
[0509]
为确定线粒体生物能学的作用及活性氧物质的产生,将 mda
‑
mb231和skbr
‑
3乳腺癌细胞及mcf12a对照细胞用100μm coq10(bpm 31510)处理24小时。在seahorse xf96分析仪中使用 线粒体毒素(寡霉素、cccp和鱼藤酮)的顺序注射评估线粒体功能。 还测量dcf荧光作为在以相同方式处理的细胞中活性氧物质产生的 指标。细胞生物能学分析揭示出coq10使细胞代谢从糖酵解转换至 线粒体代谢,并且该代谢转换与活性氧物质(ros)的显著增加相关。 参见图25。
[0510]
实施例17
‑
单独的或与吉西他滨联合的coq10的预治疗、剂量和施 用途径在人胰
腺癌异种移植小鼠模型中的影响
[0511]
在人胰腺癌的异种移植小鼠模型中评价图27中示出的三个治疗 方案(方案1、方案2和方案3)以确定单独的或与吉西他滨联合的 coq10对动物存活的影响。方案1的治疗的效果在上面的实施例1中 描述。以三个不同的静脉内剂量(50mg/kg或75mg/kg体重每天,方 案3)施用的coq10与存活的剂量依赖性增加相关,并且具有对吉西 他滨的加和作用。参见图29。连续输注coq10与三剂(50mg/kg或 75mg/kg)的coq10相比显著改善了存活率,最好结果出现在 200mg/kg处。参见图30。单独用coq10预治疗六十天然后与吉西他 滨联合也和与单独的吉西他滨或coq10相比改善的存活结果相关。 参见图31。数据表明单独或与标准治疗化疗剂联合的coq10的剂量 和施用途径影响并改善胰腺癌动物模型中的存活。
[0512]
实施例18
‑
coq10预处理接着吉西他滨处理对体外人胰腺癌细胞的 存活的影响
[0513]
将人胰腺癌细胞(pcca2)用100μm coq10预处理接着用吉西他 滨(0.1、1和5μm)处理或者用coq10与吉西他滨共同处理。与单 独的吉西他滨相比,预处理和共同处理均显著减少活细胞数量(*p< 0.05)。参见图26。
[0514]
实施例19
‑
在众多癌细胞中与各种化疗联合的coq10的体外分析
[0515]
用coq10与不同的癌症治疗剂的联合处理各种癌细胞以确定联 合疗法对细胞存活和细胞代谢的影响。癌细胞和相应的对照细胞示于 下表中。
[0516][0517][0518]
测试了以下癌症治疗剂:
[0519][0520][0521]
使用以下分析来测量细胞存活和代谢。
[0522]
分析方法仪器细胞计数台盼蓝nexcelon细胞计数仪增殖固定细胞中的碘丙啶流式细胞仪细胞死亡碘丙啶流式细胞仪凋亡(半胱天冬酶3)半胱天冬酶3染料荧光显微镜roscm
‑
dcfda染料流式细胞仪耗氧量线粒体应激seahorse胞外分析仪细胞外酸化糖酵解途径seahorse胞外分析仪
[0523]
细胞在以下生长培养基中培养:
[0524][0525][0526]
补充剂
[0527][0528]
接种细胞的方法
[0529]
对于细胞计数、增殖和活性氧物质(ros)测量,细胞量及接种和处理方法相同。在添加处理剂的同时接种细胞。如下将细胞接种在24
‑
孔板中:
[0530]
样品细胞/孔样品细胞/孔样品细胞/孔skbr
‑
360kpc360kht
‑
29100kmda23160kpaca250kbt54930kmcf
‑
750kpanc
‑
150khep3b60kmcf12a60ka
‑
549100kskov
‑
360k
[0531]
对于测量细胞凋亡的半胱天冬酶3分析,将细胞接种在玻璃12孔板中,其中细胞处于110k/孔的比率下并让其粘附5小时至18小时,然后添加处理。为测量耗氧量和细胞外酸化,将细胞接种在seahorsexf
‑
96板中。各种细胞系的细胞数实例示于下表中:
[0532]
样品细胞/孔skbr
‑
310kmda23110kmcf12a30k
[0533]
化疗剂的来源、溶剂和原液浓度示于下表中:
[0534][0535][0536]
对于每项化疗,测试的浓度范围可源从本领域已知的浓度范围。 针对如下表中所示的每种化疗剂生成剂量反应曲线:
[0537][0538][0539]
对于共处理实验,对每种细胞系选择以下剂量:
[0540][0541]
根据端点分析优化处理时间,例如:对于代谢分析,使用较短的 孵育时间;对于细胞计数,使用较长的孵育时间。基于细胞倍增时间 即细胞生长的速度有多快来选择涉及增殖和细胞计数的孵育。下表提 供了各种细胞类型和分析的孵育时间。
[0542][0543]
实施例20
‑
coq10预治疗然后化疗剂治疗在体内对各种肿瘤的影响
[0544]
使用在水中4:3:1.5比率的coq10(4重量/体积%):dmpc(3 重量/体积%):泊洛沙姆188(1.5重量/体积%)的coq10浓缩水性 纳米分散体;该纳米分散体浓缩物含有40mg/ml粒度为30
‑
50nm的 coq10。单一媒介对照组接受以最高耐受剂量(1000mg api当量) 给药的3重量/体积%dmpc和1.5重量/体积%泊洛沙姆188的无菌 溶液。单一阴性对照组接受无菌缓冲生理盐水。coq10纳米分散体在 研究开始的2周内制备并在整个研究中贮存于4
‑
25℃下。在研究的开 始和结束时分析试验样品的coq10活性和粒度分布。
[0545]
纳米分散体中使用的赋形剂dmpc和泊洛沙姆188用于配制 coq10水性纳米分散体。在使用时,将浓缩纳米分散体用无菌缓冲生 理盐水(pbs)稀释。媒介含有pbs作为稀释剂并且pbs不经稀释 用作盐水对照。使用来自jackson实验室和harlan实验室的免疫低下 小鼠。免疫低下小鼠缺乏先天和适应性免疫系统。这提供了适于人肿 瘤体内生长的生物环境。这些动物特别适于移植不同的人类癌症。
[0546]
4周龄小鼠抵达机构并于48小时后进行实验。将小鼠安置单一识 别号的每笼5只的窝中。动物在抵达时及整个实验过程中称重以得到 响应于不同配方的另一个参数。采用的饮食为pmi nutritioninternational,llc生产的配方lab 5001啮齿动物饮食。该生产 商为iso 9001:2000认证的机构。该饮食每6个月购买一次,且批号 可追溯到每个房间并将由技术员记录。施用于nsg小鼠的食物在放 置于动物笼中之前必须经过高压灭
菌。全部小鼠都自由进食。水得自 佛罗里达水利部并由动物技术员在干净的瓶中分发到每个笼。每天检 查水中是否存在碎屑并用干净的水替换。施用于nsg小鼠的水在施 用于小鼠之前必须是无菌的。到20日龄时通过co2吸入处死小鼠。 为确保死亡,对每只动物施以颈椎脱臼法并刺破隔膜。
[0547]
静脉内施用无菌coq10制剂和适合的无菌对照。基于不断发展 的结果施用coq10剂量。在以至多50mg/kg每周三次施用coq10时, 先前的实验未显示出毒性迹象,而以250mg/kg每周三次给药4周建 立大鼠中的mtd。将coq10的作用与其它特别针对每种癌系的化疗 方案相比较。该研究的另一分支评价coq10与其它化疗剂之间的协 同作用。
[0548]
评价以下癌细胞:
[0549][0550][0551]
所有细胞在5%co2、100%湿度的孵育箱中于37℃下培养。基础 培养基随每种细胞而异。为制备完全生长培养基,向基础培养基中添 加以下组分:胎牛血清至10%的最终浓度。在向动物中注射细胞之前, 让细胞生长至50%汇合,其后根据细胞实验方案粘附或离心。采集以 下器官:肾、胰、肺、心脏和肝脏。对器官称重并记录。进行常规瑞 氏染色或苏木精/伊红染色的病理报告。腹膜内或静脉内施用coq10 制剂和化疗剂。
[0552]
观察缺乳、嗜睡和体重减轻的存在。该类濒死迹象为早期处死的 基础并在动物中进行尸检(即,器官重量、病理切片)。
[0553]
在无菌条件下,如上所述向动物进行注射。将窝根据笼卡号识别 符随机化并记录每只动物的重量。然后让小鼠返回到它们的笼子。其 后,每天向小鼠进行腹膜内注射直至它们因肿瘤负荷或其存活而被处 死。
[0554]
如所示出的,对各种癌细胞测试以下化疗方案:
[0555]
乳腺癌(非转移性)
[0556][0557]
肺癌(小细胞)
[0558][0559]
肺癌(非小细胞)
[0560][0561]
卵巢癌
[0562][0563]
肝细胞癌
[0564][0565]
前列腺癌
[0566][0567]
急性白血病
[0568][0569]
结肠癌
[0570][0571][0572]
胶质母细胞瘤
[0573][0574]
实施例21
‑
用coq10和化疗剂处理的各种癌细胞系的体外分析
[0575]
如上面实施例14中所述,用coq10和各种化疗剂共处理或预处 理各种癌细胞系。显著减少活细胞数的细胞/化疗剂组合示于下表2 中。
[0576]
表2:coq10和各种化疗剂处理的各种癌细胞系的体外研究汇总。co: 共处理;pre:预处理。
[0577][0578]
表3:化疗剂的标准剂量。标准剂量得自化疗剂生产商的产品说明书。
[0579]
[0580]
[0581]
[0582]
[0583]
[0584]
[0585]
[0586]
[0587]
[0588]
[0589]
[0590]
[0591]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。