用于治疗关节疼痛和炎症的可注射缓释制剂
1.相关申请的交叉引用本技术根据35 u.s.c.
§
119(e)要求2019年5月6日提交的美国临时申请第62/843,875号的优先权;其公开内容通过引用全文并入本文。
发明领域
2.本公开内容涉及用于治疗关节疼痛和炎症、尤其是类风湿性关节炎和骨关节炎的缓释微球制剂。
3.发明背景关节炎是一种引起关节疼痛的炎症性疾病。通常,存在两种主要类型的关节炎:类风湿性关节炎(ra)和相关疾病,一种免疫介导的全身炎症性关节病;以及骨关节炎(oa),一种退行性关节病,其发作通常由以下因素介导:以前的关节损伤或其他因素。对于所有这些关节炎病症,常见症状是关节和肌肉骨骼疼痛。炎症和疼痛会妨碍关节的正常使用和功能。关节炎、关节退化和手术引起的疼痛和缺陷通常通过口服药物、肌肉和关节内注射甾体化合物的组合来治疗,旨在减少炎症。
4.局部抗炎药物注射的一个明显的好处在于,与传统的抗炎口服药物相比,特定身体区域的炎症缓解更快、更有效。局部注射还可以避免伴随多剂量口服抗炎药物引起的全身副作用,特别是对胃的刺激。此外,施用口服皮质类固醇可能抑制下丘脑
‑
垂体
‑
肾上腺(hpa)轴,从而导致多种不良副作用。
5.因此,需要局部施用能够持续释放的抗炎剂以治疗疼痛和炎症,例如关节痛,同时减少与口服施用相关的全身副作用。此外,在医学上需要减缓、阻止、逆转或以其他方式抑制由炎性疾病引起的组织结构损伤,例如由骨关节炎或类风湿性关节炎引起的关节组织损伤。
技术实现要素:
6.本发明通过提供载有甾体抗炎药和非甾体抗炎药的微球和包含微球的可注射制剂满足上述需要,所述微球悬浮在稀释剂中,优选存在透明质酸。
7.一方面,本发明提供了一种可注射的缓释制剂,包括:(a)包封在聚乳酸
‑
乙醇酸共聚物(plga)微球中的甾体抗炎药和非甾体抗炎药(nsaid),其中甾体药物能够在注射给药的第一周从微球中初始释放出来以立即缓解疼痛,然后在几个月内甾体和非甾体药物被控制释放出来以持续缓解疼痛;和(b)其中悬浮有药物微球的稀释液。
8.plga共聚物可以具有90:10至40:60的乳酸:乙醇酸摩尔比。plga共聚物可具有10kd至130kd范围内的分子量。plga也可以是具有不同乳酸:乙醇酸比例和/或不同平均分子量和/或不同链端基团的plga共聚物的共混物。
9.在一些实施方案中,皮质类固醇抗炎药优选为醋酸甲泼尼龙(mpa)或曲安奈德(tca)并且占微球重量的10%至40%;nsaid优选为塞来昔布(cxb)并且占微球重量的10%
至40%。
10.本发明的另一方面涉及一种制备如上所述的可注射缓释制剂的方法,包括通过包括乳化、溶剂萃取和蒸发、颗粒洗涤和颗粒干燥等步骤的水包油包固体(s/o/w)乳剂工艺制备载药微球;其中所述有机相液体是通过将plga共聚物或plga共聚物与可溶性非甾体抗炎药的混合物溶解在溶剂或溶剂混合物中,然后将不溶性皮质类固醇抗炎药的微粒化固体颗粒悬浮于有机相液体中;并且其中利用包含聚乙烯醇的连续水相来乳化所述有机相液体。
11.本发明的另一方面涉及治疗疼痛和/或炎症,尤其是类风湿性关节炎或骨关节炎的方法,包括将治疗有效量的本文公开的可注射缓释制剂局部注射到有此需要的患者的关节中。其中,这种注射可有效控制疼痛和/或炎症至少约三个月。
12.另一方面,本发明提供了一种载药微球,其包括包封在聚乳酸
‑
乙醇酸共聚物(plga)微球中的甾体抗炎药和非甾体抗炎药(nsaid),其中甾体药物能够在注射给药的第一周从微球中释放出来以立即缓解疼痛,然后在几个月内甾体和非甾体药物被控制释放以持续缓解疼痛。
13.在另一方面,本发明提供了一种治疗试剂盒,包括容器、所述容器中的多个载药微球,其中所述载药微球悬浮在或能够悬浮在稀释液中,以便向有需要的对象给药治疗。
14.以下详细描述、附图、实施例和权利要求,将会更好地理解本发明的其他方面或优点。
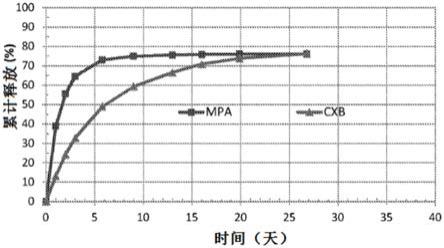
15.附图简要说明图1示出实施例2中给出的制剂#1的醋酸甲泼尼龙(mpa)和塞来昔布(cxb)在37℃、恒温水浴摇床(shaking water bath)上ph7.4的pbs缓冲液/0.5%sds中的体外释放曲线。
16.图2示出实施例2中给出的制剂#2的醋酸甲泼尼龙和塞来昔布在37℃、恒温水浴摇床上在ph7.4的pbs缓冲液/0.5%sds中的体外释放曲线。
17.图3示出实施例3中给出的制剂#3的曲安奈德(tca)和塞来昔布(cxb)在37℃、恒温水浴摇床上在ph7.4的pbs缓冲液/0.5%sds中的体外释放曲线。
18.图4示出实施例3中给出的制剂#4的曲安奈德和塞来昔布在37℃、恒温水浴摇床上在ph7.4的pbs缓冲液/0.5%sds中的体外释放曲线。
19.图5示出实施例3中给出的制剂#5的曲安奈德和塞来昔布在37℃、恒温水浴摇床上在ph7.4的pbs缓冲液/0.5%sds中的体外释放曲线。
20.图6示出实施例3中给出的制剂#6的曲安奈德和塞来昔布在37℃、恒温水浴摇床上在ph7.4的pbs缓冲液/0.5%sds中的体外释放曲线。
21.图7示出实施例3中给出的制剂#7的曲安奈德和塞来昔布在37℃、恒温水浴摇床上在ph7.4的pbs缓冲液/0.5%sds中的体外释放曲线。
22.图8示出实施例3中给出的制剂#8的曲安奈德和塞来昔布在37℃、恒温水浴摇床上在ph7.4的pbs缓冲液/0.5%sds中的体外释放曲线。
23.图9示出实施例2中提供的制剂#2的微球的粒度分布。
24.图10示出实施例3中提供的制剂#5的微球的粒度分布。
具体实施方式
25.皮质类固醇是常用于治疗关节炎和相关疾病的药物。这些药物被广泛使用,原因
是它们在减少炎症(导致关节炎和相关疾病的关节疼痛和肿胀的过程)方面具有整体有效性。非甾体抗炎药(nsaid)也常用于治疗类风湿性关节炎。它们有助于控制与ra相关的慢性疼痛、炎症和肿胀。
26.透明质酸注射是另一种缓解骨关节炎疼痛的治疗选择。在膝盖中注射透明质酸通常可以为一些患者带来显著的缓解。此外,实验室和临床研究表明,透明质酸的作用可能远不止简单地重新润滑活动困难的关节。
27.现在,已经出乎意料地发现,将这三种药物——皮质类固醇、非甾体抗炎药(nsaid)和透明质酸——结合在具有多种释放机制的持续药物释放系统中可以改善类风湿性关节炎和骨关节炎的整体控制。
28.在一方面,本发明提供了一种可注射的缓释制剂,包括:(a)包封在聚乳酸
‑
乙醇酸共聚物(plga)微球中的甾体抗炎药和非甾体抗炎药(nsaid),其中甾体药物能钩在注射给药的第一周从微球中初始释放出来以立即缓解疼痛,然后在几个月内甾体和非甾体药被控制释放出来以持续缓解疼痛;和(b)其中悬浮有药物微球的稀释液。
29.在一些实施方案中,本发明提供了一种可注射的缓释制剂,其包含:(a)包封在聚(乳酸
‑
乙醇酸共聚物)微球中共聚物(plga)微球中的甾体抗炎药和非甾体抗炎药(nsaid),其中皮质类固醇药物具有较高的初始释放速率,其在给药的第一周内可释放高至其总含量的60%,并且甾体和非甾体药物两者在注射给药之后均具有长达90天的缓控释放;和(b)含有透明质酸(ha)的稀释液,其中悬浮有药物微球悬浮。
30.在一些实施方案中,可注射缓释制剂的载药微球的平均直径优选为20μm至90μm。
31.这些药物的控释可以持续约一到三个月;而第一种抗炎药以较高的初始释放速率释放,以达到即时抗炎作用。透明质酸还起关节润滑剂和止痛剂的作用。
32.在一些实施方案中,皮质类固醇药物的初始快速释放在给药的第一周内累积达到总量的约30%、35%、40%、45%、50%、55%、或60%左右。
33.在一些优选的实施方案中,皮质类固醇药物的初始快速释放在给药的第一周累积达到约50%至约60%。
34.在一些实施方案中,这些药物的控释可以持续约三个月,其中第一种抗炎药的初始快速释放用于即时抗炎作用。
35.在一些实施方案中,缓释持续约一个月或约两个月,有时优选约三个月。在此期间,透明质酸还起关节润滑剂和止痛剂的作用。
36.在一些实施方案中,甾体药物选自可的松、倍他米松、醋酸倍他米松、倍他米松二丙酸酯、倍他米松戊酸酯、可替伐唑、地塞米松、醋酸地塞米松、地塞米松磷酸钠、醋酸氢化可的松、氢化可的松磷酸钠、氢化可的松琥珀酸钠、氢化可的松戊酸酯、氢化可的松乙丙酸酯、氢化可的松丁酸酯、氢化可的松环戊丙酸酯、氢化可的松丙丁酸酯、甲基泼尼松龙、甲基泼尼松龙乙丙酸酯、甲基泼尼松龙醋酸酯、甲基泼尼松龙磷酸钠、甲基泼尼松龙琥珀酸钠、泼尼松龙、泼尼松龙醋酸酯、泼尼松龙间磺基苯甲酸酯、泼尼松龙磷酸钠、泼尼松龙硬脂酰乙醇酸酯、泼尼松龙叔丁基乙酸酯、曲安西龙、曲安奈德、曲安奈德21
‑
棕榈酸酯、曲安西龙苯内酰胺、曲安西龙二乙酸酯、曲安西龙六丙酮、阿氯米松、阿氯米松二丙酸酯、安西奈德、阿美米松、倍氯米松、二丙酸倍氯米松一水合物、布地奈德、布可可、布可可丙酸酯、环索奈
德、环丙奈德、氯贝他索、丙酸氯贝他索、氯可托龙、氯倍他索、氯倍他索丁酸酯、氯倍他索新戊酸酯、氯泼尼醇、可的松、醋酸可的松、地夫可特、地普酮、丙酸地普酮、地奈德、去羟米松、去氧皮质酮、醋酸去氧皮质酮、二氯松、双醋二氟松、二氟可龙、二氟泼尼酯、氟氯龙、丙酮氟氯龙、氟氢可的松、醋酸氟氢可的松、氟羟皮质、氟米松、新戊酸氟米松、氟尼缩松、氟轻松、醋酸氟轻松、氟皮质素、氟可龙、氟米龙、氟替卡松、糠酸氟替卡松、丙酸氟替卡松、醋酸氟米龙、氟甲睾酮、氟哌龙、氟泼尼烯、醋酸氟泼烯、氟泼尼松龙、福莫皮质酮、哈西奈德、丙酸卤倍他索、卤米松、醋酸氟哌啶酮、氢化可的酯、异氟泼尼酮、异氟泼尼酮醋酸酯、伊曲康奈德、依碳酸氯替泼诺、马齐普利酮、甲氯松、二丁酸甲氯利松、甲羟松、甲泼尼龙、莫米松、糠酸莫米松、糠酸莫米松一水和物、醋酸甲米酮、帕拉米松、醋酸帕拉米松、泼那唑啉、泼尼卡酯、普鲁西奈德、罗非奈德、利美舒酮、噻莫贝松、替瑞丹、替考多醇、新戊酸托索皮质醇和曲洛奈德、或类似物及其立体异构体,包括外消旋体或对映体。
37.在一些实施方案中,nsaid选自塞来昔布(cxb)、甲芬那酸、托芬那酸、氟芬那酸、双氯芬酸、舒林酸、芬布芬、吲哚美辛、醋美辛、氨芬酸、依托度酸、联苯乙酸、布洛芬、氟比洛芬、酮洛芬、萘普生、普拉洛芬、非诺洛芬、噻洛芬酸、奥沙普秦、洛索洛芬、氨洛芬、扎托洛芬、吡罗昔康、替诺昔康、氯诺昔康、美洛昔康、噻拉米特、托美汀、二氟尼柳、夫洛非宁、替诺立定或类似物及其立体异构体,包括外消旋体或对映体。
38.在一些实施方案中,皮质类固醇抗炎药优选自醋酸甲泼尼龙(mpa)、曲安奈德(tca)、地塞米松、氢化可的松、泼尼松龙和泼尼松等,以及它们的组合。
39.在一些实施方案中,nsaid优选自塞来昔布(cxb)、双氯芬酸、吲哚美辛、布洛芬、萘普生、美洛昔康、甲芬那酸和恶丙嗪等以及它们的组合。
40.在一些实施方案中,plga共聚物具有约90:10至约40:60的乳酸:乙醇酸单体单元摩尔比(l/g比)。
41.在一些实施方案中,plga共聚物的l/g摩尔比为约80:20至约40:60、或约70:30至约40:60、或约60:40至约40:60、或约50:50至约40:60。
42.在一些优选实施方案中,plga共聚物的l/g摩尔比为约50:50、约75:25或约50:50至约75:25。
43.在一些实施方案中,plga共聚物的分子量在约10kd和约130kd之间的范围内。
44.在一些实施方案中,plga共聚物的分子量在约10kd至约125kd、或约20kd至约120kd、或约30kd至约110kd、或约40kd至约100kd、或约50kd至约90kd、或约60kd至约80kd、或其任何组合如约10kd至约50kd、约20kd至约40kd、约40kd至约60kd、约50kd至约70kd等范围内。
45.在一些实施方案中,plga共聚物是具有不同乳酸:乙醇酸比率、和/或不同平均分子量、和/或不同链端基团的plga共聚物的混合物。
46.合适的链端基团包括但不限于游离酸(即羧基)和酯端基团。
47.在一些实施方案中,有时优选地,皮质类固醇抗炎药是mpa或tca或其组合。
48.在一些实施方案中,皮质类固醇抗炎药如mpa、tca或其组合占微球重量的约10%至约40%、或约15%至约35%、或约20%至约30%。
49.在一些实施方案中,皮质类固醇抗炎药如mpa、tca或其组合占微球重量的约10%、或约15%、或约20%、或约25%、或约30%、或约35%、或约40%。
50.在一些实施方案中,有时优选地,nsaid优选的是cxb等。
51.在一些实施方案中,nsaid如cxb等占微球重量的约10%至约40%、或约15%至约35%,或约20%至约30%。
52.在一些实施方案中,有时优选地,nsaid如cxb等占微球重量的约10%、或约15%、或约20%、或约25%、或约30%、或约35%、或约40%。
53.在一些实施方案中,有时优选地,可注射缓释制剂的载药微球的平均直径为约20微米至约90微米,优选约25微米至约85微米,或约30微米至约80微米,或约35微米至约75微米、或约40微米至约70微米、或约45微米至约65微米、或约50微米至约60微米。
54.本发明的另一方面涉及一种制备如上所述的可注射缓释制剂的方法,包括通过水包油包固体(s/o/w)乳化工艺制备载药微球的步骤,所述乳化工艺包括乳化、溶剂萃取和蒸发、颗粒洗涤和颗粒干燥;其中有机相液体是通过将plga共聚物或plga共聚物与可溶性非甾体抗炎药的混合物溶解在溶剂或溶剂混合物中和随后将不溶性皮质类固醇抗炎药的微粒化固体颗粒悬浮于有机相液体中制备的,其中溶剂可选自二氯甲烷、乙酸乙酯、苯甲醇、甲醇、乙醇、异丙醇、1
‑
丁醇、异丁醇、1
‑
戊醇、异戊醇和1
‑
己醇;并且其中利用连续水相使所述有机相液体乳化,所述连续水相包含聚乙烯醇、明胶、聚山梨醇酯20、聚山梨醇酯80和其他表面活性剂和分散剂。
55.在一个实施方案中,制备如上所述的可注射缓释制剂的方法包括通过水包油(o/w)乳化工艺制备载药微球的步骤,其中利用包含含水聚乙烯醇(pva)溶液的连续水相来乳化分散的有机相,所述分散的有机相包含与甾体药物和非甾体药物混合于合适的溶剂或溶剂混合物中的plga共聚物。
56.在一些实施方案中,有时优选地,水相包含水中约1%的pva。
57.在一些实施方案中,有时优选地,溶剂选自二氯甲烷(dcm)、乙酸乙酯(etoac)、苯甲醇(ba)、甲醇、乙醇、异丙醇(ipa)、1
‑
丁醇、异
‑
丁醇、1
‑
戊醇、异戊醇、1
‑
己醇及其两种或更多种的混合物。
58.在一些实施方案中,有时优选地,有机溶剂是dcm或dcm和etoac的混合物。在一些实施方案中,dcm和etoac的体积比为约10:0至约3:7。
59.在另一方面,在本文所述的任意实施方案中,本发明提供了一种载药微球,其包含包封在聚乳酸
‑
乙醇酸共聚物(plga)微球中的甾体抗炎药和非甾体抗炎药(nsaid)。载药微球可以悬浮在稀释液中,即时用于向患有需要治疗的疼痛或炎症的对象给药。
60.在一些实施方案中,有时优选地,在以合适的制剂施用于对象之后,微球中的甾体药物具有在给药的第一周释放微球中总含量60%的高初始释放速率,并且甾体和非甾体药物两者均在注射给药后具有长达约90天的持续控释。
61.另一方面,本发明提供了一种载药微球,其包括包封在聚乳酸
‑
乙醇酸共聚物(plga)微球中的甾体抗炎药和非甾体抗炎药(nsaid),其中甾体药物能够在注射给药的第一周从微球中初始释放出来以立即缓解疼痛,然后在几个月内甾体和非甾体药物被控制释放以持续缓解疼痛。
62.在另一方面,本发明提供了在本文公开的任意实施方案中的载药微球在制备用于治疗疼痛和/或炎症的药物中的用途,所述疼痛和/或炎症优选由关节炎引起,其中所述关节炎任选(有时优选)为类风湿性关节炎或骨关节炎。
63.在另一方面,本发明提供了一种治疗试剂盒,其包括容器、容器中的多个载药微球,其中所述载药微球悬浮在或能够悬浮在稀释液中,即时用于向患有治疗需要的关节炎的对象给药。
64.在本文公开的任何方面的任何实施方案中、用于载药微球的合适甾体药物包括但不限于可的松、倍他米松、醋酸倍他米松、倍他米松二丙酸酯、倍他米松戊酸酯、可替伐唑、地塞米松、醋酸地塞米松、地塞米松磷酸钠、醋酸氢化可的松、氢化可的松磷酸钠、氢化可的松琥珀酸钠、氢化可的松戊酸酯、氢化可的松乙丙酸酯、氢化可的松丁酸酯、氢化可的松环戊丙酸酯、氢化可的松丙丁酸酯、甲基泼尼松龙、甲基泼尼松龙乙丙酸酯、甲基泼尼松龙醋酸酯、甲基泼尼松龙磷酸钠、甲基泼尼松龙琥珀酸钠、泼尼松龙、泼尼松龙醋酸酯、泼尼松龙间磺基苯甲酸酯、泼尼松龙磷酸钠、泼尼松龙硬脂酰乙醇酸酯、泼尼松龙叔丁基乙酸酯、曲安西龙、曲安奈德、曲安奈德21
‑
棕榈酸酯、曲安西龙苯内酰胺、曲安西龙二乙酸酯、曲安西龙六丙酮、阿氯米松、阿氯米松二丙酸酯、安西奈德、阿美米松、倍氯米松、二丙酸倍氯米松一水合物、布地奈德、布可可、布可可丙酸酯、环索奈德、环丙奈德、氯贝他索、丙酸氯贝他索、氯可托龙、氯倍他索、氯倍他索丁酸酯、氯倍他索新戊酸酯、氯泼尼醇、可的松、醋酸可的松、地夫可特、地普酮、丙酸地普酮、地奈德、去羟米松、去氧皮质酮、醋酸去氧皮质酮、二氯松、双醋二氟松、二氟可龙、二氟泼尼酯、氟氯龙、丙酮氟氯龙、氟氢可的松、醋酸氟氢可的松、氟羟皮质、氟米松、新戊酸氟米松、氟尼缩松、氟轻松、醋酸氟轻松、氟皮质素、氟可龙、氟米龙、氟替卡松、糠酸氟替卡松、丙酸氟替卡松、醋酸氟米龙、氟甲睾酮、氟哌龙、氟泼尼烯、醋酸氟泼烯、氟泼尼松龙、福莫皮质酮、哈西奈德、丙酸卤倍他索、卤米松、醋酸氟哌啶酮、氢化可的酯、异氟泼尼酮、异氟泼尼酮醋酸酯、伊曲康奈德、依碳酸氯替泼诺、马齐普利酮、甲氯松、二丁酸甲氯利松、甲羟松、甲泼尼龙、莫米松、糠酸莫米松、糠酸莫米松一水和物、醋酸甲米酮、帕拉米松、醋酸帕拉米松、泼那唑啉、泼尼卡酯、普鲁西奈德、罗非奈德、利美舒酮、噻莫贝松、替瑞丹、替考多醇、新戊酸托索皮质醇和曲洛奈德或类似物及其立体异构体,包括外消旋体或对映体。
65.在本文公开的任意方面的任意实施方案中,用于载药微球的合适nsaid包括但不限于塞来昔布(cxb)、甲芬那酸、托芬那酸、氟芬那酸、双氯芬酸、舒林酸、芬布芬、吲哚美辛、醋美辛、氨芬酸、依托度酸、联苯乙酸、布洛芬、氟比洛芬、酮洛芬、萘普生、普拉洛芬、非诺洛芬、噻洛芬酸、奥沙普秦、洛索洛芬、氨洛芬、扎托洛芬、吡罗昔康、替诺昔康、氯诺昔康、美洛昔康、噻拉米特、托美汀、二氟尼柳、夫洛非宁、替诺立定或类似物及其立体异构体,包括外消旋体或对映体。
66.本领域技术人员将理解,在本文公开的任何方面,本发明包括本文公开的任何实施例,包括不同组分和/或参数的任何合理组合。
67.稀释液可以是任何类型的适合于悬浮载药微球的稀释液,其通常在无菌条件下制备和储存。在一些实施方案中,有时优选地,稀释液包含透明质酸等作为关节润滑剂和/或镇痛剂。
68.以下是用于分散本发明载药微球的含有透明质酸(ha)的悬浮稀释剂制剂的实施例:稀释剂配方1:成分浓度
透明质酸1.0重量%聚山梨醇酯800.05重量%磷酸氢二钠二水合物,5
‑
10mm98.9%ph6
‑
7稀释剂配方2:成分浓度透明质酸1.0重量%聚山梨醇酯800.04重量%柠檬酸,10
‑
20mm98.9%ph6
‑
7稀释剂配方3:成分浓度透明质酸1.0重量%羧甲基纤维素钠0.5重量%聚山梨醇酯800.04重量%磷酸氢二钠二水合物,5
‑
10mm98.5%ph6
‑
7稀释剂配方4:成分浓度透明质酸1.0重量%羧甲基纤维素钠0.5重量%聚山梨醇酯800.04重量%柠檬酸,10
‑
20mm98.5%ph6
‑
7本发明的另一方面涉及治疗类风湿性关节炎或骨关节炎的方法,包括将治疗有效量的上述可注射缓释制剂局部注射到有此需要的患者的关节中。优选地,所述患者是人。这样的注射可有效控制疼痛和/或炎症至少约一个月或约两个月,优选至少约三个月。本文所述组合物的一些优选注射途径包括:关节内、肌肉内和脊柱内。
69.本发明还可以应用于其他药物产品,例如口服混悬液。例如,可以将载有tca/cxb的微球粉末悬浮在适当的载体中,然后将口服混悬液给药至不能服用口服片剂或胶囊的患者。tca/cxb微球粉末也可以包封在胶囊中或配制成口服给药的片剂。与传统片剂和胶囊相比,以这种方式配制的载有tca/cxb的微球胶囊或片剂将以缓释方式释放药物并减少给药频率。
70.在本发明的另一方面,本发明提供了一种方便给药的包含本文公开的药物组合物的装置或试剂盒的组合,例如包含单剂量微球的注射器,所述微球包含用于治疗可通过缓释形式的微球治疗的症状的活性孕激素化合物。这样的注射器可任选附接至即时用于注射的针头。这样的针头应该具有适合于微球的孔径尺寸,并且可以选用针罩罩住。所有此类装置或试剂盒应处于无菌条件下,并且优选在此类条件下储存和易于运输。
71.本发明制备的微球制剂可被制成具有适于通过其他肠胃外和非肠胃外途径如口
服、口腔、鞘内、鼻、肺、经皮、经粘膜等途径递送的特性。
72.在其他方面,微球制剂可以单独给药,或者作为药物制剂的一部分与其他活性剂或药物疗法适当组合给药。这样的药物制剂可以包括与本领域已知的任何标准生理学和/或药学可接受载体组合的微球。制剂的组成优选是无菌的并且以适合施用于患者的重量或体积单位包含治疗有效量的微球。
73.除非有明确定义,本技术中使用的任何术语均采用本领域技术人员将理解的普通含义。
74.如本文所公开,提供了多种数值范围。可以理解,除非上下文另有明确规定,每个中间值,到下限单位的十分之一,在该范围的上限和下限之间,也具体公开。在规定范围内的每个较小范围数值区间以及任何规定值或中间值都包含在本发明内。这些较小范围的上限和下限可以独立地包括在该范围内或排除在该范围内,并且其中每个小范围,不管包括或不包括上下限,也包括在本发明内。所述任何范围,包括或不包括一个或两个限度的情况下,也包括在本发明中。
75.术语“约”通常是指指定数字的正负10%,有时优选5%,有时优选2%。例如,“约10%”可表示9%至11%的范围,有时优选9.5%至10.5%;“约20”可表示18至22,有时优选19至21。“约”的其他含义可从上下文显而易见,例如四舍五入,因此,例如“约1”也可表示0.5到1.4。类似地,“约0.2”可以包含值0.22。
76.如本文所用,单数形式“一个”和“该”包括复数形式,反之亦然,任何复数形式均包括单数形式,除非上下文另有明确规定。
77.除非另有说明,否则术语“包括”、“具有”、“包括”和“包含”等应被解释为开放式术语(即,意为“包括但不限于”)。
78.如本文所用的,术语“微球”等是指直径在以下范围内的球形或基本球形的小颗粒:约1μm至约1000μm,例如,在一些实施方案中,约10μm至约500m,在一些实施方案中,约20μm至约150μm,并且在一些实施方案中,更具体地,约50μm至约100μm,其由天然或合成聚合物制成,可包封多种药物。
79.术语“持续释放”或类似术语是指药物递送系统,例如微球,其在从数天到数月的限定或延长的时间段内释放所需量的药物分子(或活性药物成分,api),例如,在一些实施方案中,在5至15天内释放约80%至90%的药物分子,而在另一些实施方案中,在约30天内释放约30%的药物分子,等等。来自本发明微球的分子可以采用连续、不连续、线性或非线性方式、优选连续和线性方式进行释放。
80.术语“控释”等是指一种递送系统,例如微球,其有助于以受控速率方式释放预定量的药物。在本发明中,术语“缓释”和“受控释放”有时可互换使用。
81.如本领域普通技术人员所理解的,本文所用的术语“基本上”是指“大部分”或“实质地”。
82.术语“药学上可接受的”描述了在生物学上或其他方面合乎需要的材料,即不会引起不可接受水平的不合需要的生物学效应或以有害方式相互作用。
83.术语“治疗有效量”是指有效递送治疗有效量的活性剂,以延迟所治疗的特定疾病、病症或病症的发作、抑制其进展或完全停止所治疗的特定疾病或病症,或者对待治疗的对象提供所需的效果。如本领域普通技术人员所理解的,治疗有效量随着患者的年龄、状况
和性别,以及患者的疾病、病症或状况的性质和程度而变化,并且可以由个别医生(或兽医)调整剂量。
84.术语“治疗”和“处理”是指逆转、减轻、抑制或减缓适用的疾病或病症的进展,或此类疾病或病症的一种或多种症状。
85.本文使用的术语“对象”或“患者”是指人类患者或哺乳动物,例如猫、狗、牛、马、猴等。
86.以下非限制性实施例将进一步说明本发明的某些方面。实施例
87.实施例1.制剂1
‑
8中使用的原料药和plga原料列表a.原料药1)mpa:醋酸甲泼尼龙(methylprednisolone acetate),微粉,美国药典纯度,spectrum chemical mfg corp.2)tca:曲安奈德(triamcinolone acetonide)(9α
‑
氟
‑
11β,21
‑
二羟基
‑
16α,17α
‑
异亚丙基二氧孕烷
‑
1,4
‑
二烯,3,20
‑
二酮),微粉,美国药典纯度,spectrumchemicalmfgcorp.3)cxb:塞来昔布(5
‑
(4
‑
甲基苯基)
‑
l
‑
(4
‑
氨磺酰苯基)
‑3‑
(三氟甲基)吡唑),粉末晶体,tci america。
88.b.不同丙交酯/乙交酯比例、分子量和链端基团的plga聚合物列于表1。
89.表1.用于制备配方1
‑
8的plga聚合物列表。
90.*25℃,0.1%三氯甲烷溶液实施例2:醋酸甲泼尼龙(mpa)和塞来昔布(cxb)的plga载药微球(制剂1和制剂2)的制备制剂采用水包油包固体(s/o/w)乳液法制备。载药微球通过包括乳化步骤和随后的溶剂萃取/蒸发、洗涤和干燥步骤的方法步骤形成。首先,将450mg列于表1中的一种plga聚合物或混合物和150mg cxb(参见实施例1)溶解在3.0ml二氯甲烷(dcm)或3.0ml的二氯甲烷和乙酸乙酯(etoac)的1:1混合溶剂中来制备有机相。在形成澄清溶液之后,将150mg微粒化mpa粉末(参见实施例1)加入溶液中并使用强烈搅拌以均匀分散mpa颗粒。随后,将有机相液体注入40ml 1%pva(聚乙烯醇8
‑
88,exp ph eur,usp,jpe)的水溶液中,并立即用polytron pt
‑
3100均质器乳化该溶液,混合速度约为800至1000rpm。在大约1.5分钟
的总混合时间后,立即将乳液转移到300ml水中。以中速搅拌乳液约4小时以除去溶剂。将固化微球的最终悬浮液通过150微米的筛网过筛分去任何大块的凝聚物,然后再用25微米的筛网脱水并收集产物。将微球进一步用去离子水洗涤,并在2
‑
8℃空气中干燥过夜,然后在真空(低于0.5torr)中干燥6小时。表2提供了配方1和配方2的一些详细信息,包括原料组成和测得的配方载药量和粒径分布,其中粒径分布d10、d50和d90为其下方的体积百分比分别为10%、50%和90%的粒径,跨度值由(d90
‑
d10)/d50计算。
91.表2:mpa/cxb载药微球制剂#1和制剂#2的详细信息制剂#1和#2的mpa和cxb的体外累积释放曲线示于图1和图2。两种配方均使用l/g比为50:50的中高分子量酯封端plga(rg505)。使用二氯甲烷作为分散有机相的溶剂,配方#1提供了快速的mpa初始释放速率,而cxb的释放相对较慢(图1)。然而,在配方#2中,当使用二氯甲烷和乙酸乙酯(1:1)的混合物作为分散有机相的溶剂时,mpa和cxb的释放速度都慢得多,并且两种药物的释放都可以持续更长的时间(图2)。
92.实施例3:曲安奈德(tca)和塞来昔布(cxb)的plga载药微球的制备(制剂3至8)。
93.制剂由水包油包固体(s/o/w)乳液法制备。载药微球通过包括乳化步骤和随后的溶剂萃取/蒸发、洗涤和干燥步骤的方法形成。首先,将450mg列于表1中的一种plga聚合物或混合物和150mgcxb(参见实施例1)溶解在3.0ml二氯甲烷(dcm)或3.0ml的dcm和乙酸乙酯(etoac)1:1混合物中来制备有机相。在形成澄清溶液之后,将150mg微粒化tca粉末(参见实施例1)加入溶液中并使用强烈搅拌以均匀分散tca颗粒。随后,将有机相液体注入40ml1%pva(聚乙烯醇8
‑
88,exppheur,usp,jpe)的水溶液中,并立即用polytronpt
‑
3100均质机在混合速度约为800至1000rpm下乳化。在大约1.5分钟的总混合时间后,立即将乳液转移到较大容器中的300ml水中。以中速搅拌乳液约4小时以除去溶剂。将固化微球的最终悬浮液通过150微米的筛网过筛以分去任何大块的凝聚物,然后在用25微米的筛网脱水并收集产物。微球进一步用去离子水洗涤并在2
‑
8℃空气中干燥过夜,然后在真空(低于0.5torr)中干燥6小时。
94.表3提供了配方3至8的一些详细信息,包括原料组成和测得的配方载药量和粒度分布,其中粒径分布d10、d50和d90为其下方的体积百分比分别为10%、50%和90%的粒径,跨度值由(d90
‑
d10)/d50计算。
表3:tca/cxb载药微球制剂的详细信息,制剂#3至#8制剂#3至#8的tca和cxb的体外累积释放曲线示于图3至图8。
95.在配方#3和#4中,使用了l/g比为50:50的中高分子量酯封端plga(rg505)。使用二氯甲烷作为分散的有机相溶剂时,配方#3提供了非常快的tca初始释放和较慢的cxb释放(图3),而当使用二氯甲烷和乙酸乙酯的(1:1)混合物作为溶剂时有机相溶剂,两种药物的释放速度都减慢(图4)。
96.在配方#5和#6中,使用l/g比为75:25的中高分子量、羧基封端的plga。使用二氯甲烷作为分散的有机相溶剂时,配方#5中的tca初始释放快速而cxb的释放慢得多(图5),而当
使用二氯甲烷和乙酸乙酯的(1:1)混合物作为有机相时相溶剂时,tca的初始释放速率减慢(图6)。
97.在配方#7中,使用了l/g比为75:25的中高分子量、酯封端的plga。在体外累积释放曲线中,tca在前3至4天内几乎完全释放,而cxb以缓释模式释放很长时间。
98.在配方#8中,使用了低分子量、羧基封端的plga和中高分子量、酯封端的plga的混合物,两者的l/g比均为50:50。在体外累积释放曲线中,在最初几天内,cxb的初始释放比tca更快,随后减慢(图8)。
99.实施例4:用hplc方法测定微球配方的药物载药百分比色谱参数:色谱柱:phenomenex luna cl8(2),5pm,4.6mmx250mm柱温:40℃流动相:乙腈/甲醇/水53:15.7:31.3(v/v/v)流速:1.0ml/分钟进样量:20μl检测器:uv245nm标准溶液制备:称取约30mgapi参考标准品至100ml容量瓶中,加入约80ml甲醇,混合并超声溶解,并用甲醇定容。将上述储备标准溶液进一步用甲醇/水(3:1)稀释1/10,制成api浓度约30μg/ml的工作标准液。
100.样品溶液制备:称取约20mg载药微球置于100ml容量瓶中,加入约30ml乙腈,混匀,超声使微球溶解,再加入60ml水,最后加入甲醇定容。在hplc注射之前,样品溶液通过0.45μmpvdf过滤器过滤。载药百分比由下式计算:载药量(%)=微球样品中api的重量/微球总重量x100%实施例5:载药微球制剂的体外释放测试和用于分析体外释放样品中药物物质的hplc方法载药微球的体外释放测试是通过将大约10毫克微球样品悬浮在21毫升释放介质中来实现的。释放介质包括加入0.5%sds和0.02%叠氮化钠的pbs缓冲液,并将ph调节至约7.40。样品悬浮液容纳在60ml圆柱形玻璃瓶(盖上盖子)中,于37℃水浴中以90rpm的速度摇动。在每个预定的采样时间点,通过5微米不锈钢网过滤器抽取20毫升释放介质,然后重新加入20毫升新鲜释放介质重新悬浮微球颗粒。在hplc注射之前,样品溶液通过0.45pm pvdf过滤器过滤。
101.所用的色谱参数与实施例4中的相同。
102.药物释放的累积百分比是基于释放到总介质中的药物量除以初始微球中的药物总量来计算的。
103.实施例6:微球样品的粒度分布测定微球样品的平均粒径和粒径分布用horibala
‑
920激光衍射粒度分析仪来测量,其中使用di水作为分散剂,使用约1ml的1%pva水溶液预润湿颗粒。图9为制剂#2(见实施例2)的mpa/cxb载药微球制剂的粒度分布,图10为制剂#5(见实施例3)的tca/cxb载药微球制剂的粒度分布。粒度分布值(dio、d50、d90和跨度值)在表2和表3中已给出。
104.上述实施方案的实施例和描述应被视为对本发明的说明而非限定范围。在不脱离
本发明的情况下,可以使用上述特征的多种变化和组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。