一种pcl/col/mc梯度三层人工骨膜及其制备方法与应用
技术领域
1.本发明属于生物医学材料技术领域,具体涉及一种pcl/col/mc梯度三层人工骨膜及其制备方法,采用静电纺丝法制备的骨膜材料。本方法属于生物医药材料领域,所制备的材料可广泛应用于骨膜和骨组织的修复。
背景技术:
2.骨缺损是骨科临床的常见疾病,可由创伤、感染及肿瘤等多种因素引起,大段骨缺损是骨科治疗临床中的挑战之一。当前,骨移植是临床最常使用的治疗方法,即通过植入支架填充骨缺损,来诱导骨再生。然而,这些方法在没有骨膜帮助的情况下有一定的局限性,骨膜在自体移植物植入的初始愈合过程中对骨形成贡献了约70%[2
‑
4]。骨膜的再生能力已被用于治愈临界尺寸的骨骼[6
‑
8]。因此,保留骨膜或植入人工骨膜可以改善成骨和骨传导性[7]。
[0003]
目前,还没有成熟的“人工骨膜”产品在临床中应用,现有研究中的人工骨膜有:
①
经电喷技术制备的负载bmp、vegf等生物活性因子的可降解高分子多孔膜(王身国,王宏鹤,刘浩,任红文.生物可吸收人工骨膜及其制备方法.2008
‑
02
‑
27.);
②
使用纳米钙磷盐与胶原纤维经压制、冷冻干燥等过程制备的矿化胶原人工骨膜(陶春生,仇志烨,宋天喜,张自强,崔福斋.一种矿化胶原人工骨膜及其制备方法.2014
‑
10
‑
15.)等,尚未见具有缓释sdf
‑
1α和cgrp功能的人工骨膜的研究及相关产品。因此,有必要开发一种能够缓释sdf
‑
1α和cgrp因子的人工骨膜,以改善大段骨缺损修复临床治疗的难题。
[0004]
静电纺丝技术可以生产出直径为纳米级聚合物纤维,所制备纤维形貌可控、柔性好,具有高比表面积和孔隙率,且纤维形貌类似细胞外基质,因此在生物医学工程领域得到广泛的关注j.xue,j.xie,w.liu,y.xia,electrospunnanofibers:newconcepts,materials,andapplications,accchem res,50(2017)1976
‑
1987。
[0005]
通过仿生矿化过程制备的矿化胶原(mineralized collagen,mc),模拟了天然骨组织的组成和分级自组装结构,众多研究显示mc在刺激干细胞的成骨分化、骨重建和脊柱融合方面有良好的效果[22
‑
25]。一型胶原是骨基质中的主要有机成分,在骨形成和重塑过程中起着重要作用。骨膜主要由胶原纤维组成,它赋予骨膜韧性和内部细胞有利的微环境[26]。因此,在骨膜中整合入mc和col将提高pcl纤维膜的生物相容性和骨整合能力。
[0006]
除了生物材料的选择,结构设计对于理想的人造骨膜也至关重要。本专利受骨膜层状结构和每层具有特定功能的启发[28],通过静电纺丝构建了pcl、col和mc在各层呈现梯度变化的膜。由于成纤维细胞或上皮细胞具有更快的增殖速度,将致密且疏水的pcl层作为外层,以阻止周围结缔组织长入缺损区域,pcl/col作为中间层,为人工骨膜整体提供力学支持,pcl/col/mc作为内层,具有良好的骨诱导活性和生物相容性,可以为所募集细胞提供有利的微环境。
技术实现要素:
[0007]
本发明目的在于针对现有人工骨膜的不足,发明一种pcl/col/mc梯度三层人工骨膜及其制备方法,以改善大段骨缺损修复的临床治疗。
[0008]
为了达到上述目的,本发明采用以下技术方案予以实现:
[0009]
一种pcl/col/mc梯度三层人工骨膜的制备方法,包括如下方法:
[0010]
1)采用体外仿生矿化方法制备矿化胶原材料;
[0011]
首先,将一型胶原溶解在酸性溶液中,不断搅拌;
[0012]
然后,将cacl2和nah2po4溶液以钙磷摩尔比为1.67的比例逐滴加入胶原的酸性溶液中,制得含有胶原、钙离子和磷酸根离子的混合溶液;
[0013]
向混合溶液中缓慢滴加氢氧化钠溶液,升高溶液的ph值至7.2
‑
7.5,搅拌24
‑
48小时,获得矿化胶原絮状沉淀;
[0014]
最后,将矿化胶原沉淀用超纯水离心洗涤3
‑
5次,冷冻干燥48
‑
72小时,研磨至粒径为10
‑
100μm的颗粒;
[0015]
2)静电纺丝溶液的制备
[0016]
向溶剂六氟异丙醇(hfip)中分别加入聚己内酯(pcl)、聚己内酯/胶原(pcl/col)、聚己内酯/胶原/矿化胶原(pcl/col/mc)以制备三层所需纺丝溶液,浓度分别为:外层为10%w/w的pcl溶液,中间层为pcl/col溶液,其中pcl溶液的浓度为7.5%w/w pcl,col溶液的浓度为2.5%w/w,内层为pcl/col/mc溶液,其中pcl溶液浓度为3.3%~5%w/w,col溶液浓度为2.5%~4%w/w,mc溶液的浓度为2.5%~4%w/w,室温磁力搅拌12小时;
[0017]
3)骨膜材料的制备
[0018]
采用双喷头静电纺丝装置,采用19号静电纺丝针头,调节接收距离为10cm,加正高压12kv,负高压1kv;调节液体流速0.5ml/h的速度,接收滚筒转速600r/min,5ml注射器内装入纺丝液,在注射泵的控制下两个喷头依次纺丝pcl、pcl/col、pcl/col/mc溶液,为更好地保证层间结合力,在停止纺丝前一个溶液之前,使用另一相同的针头开始同时纺丝下个溶液,得到厚度为600μm的纤维膜。
[0019]
进一步地,步骤2)中,所述内层pcl/col/mc溶液中pcl溶液浓度为3.3%w/w,col溶液浓度为3.3%w/w,mc溶液的浓度为3.3%w/w。
[0020]
进一步地,步骤2)中,所述内层pcl/col/mc溶液中pcl溶液浓度为4.0%w/w,col溶液浓度为4.0%w/w,mc溶液的浓度为4.0%w/w。
[0021]
进一步地,步骤2)中,所述内层pcl/col/mc溶液中pcl溶液浓度为5.0%w/w,col溶液浓度为2.5%w/w,mc溶液的浓度为2.5%w/w。
[0022]
进一步地,所述mc材料为弱结晶纳米羟基磷灰石,所述羟基磷灰石占人工骨膜质量的2.5%
‑
4%。
[0023]
进一步地,步骤2)中,所述的有机溶液为六氟异丙醇hfip。
[0024]
进一步地,所述一型胶原材料占人工骨膜质量的5%
‑
6.5%。
[0025]
进一步地,所述聚己内酯(pcl)为可降解天然高分子材料或可降解合成高分子材料。
[0026]
一种pcl/col/mc梯度三层可吸收人工骨膜,所述pcl/col/mc梯度三层人工骨膜的纤维具有无规则排列或定向排列的纳米纤维结构。
[0027]
一种具有pcl/col/mc梯度三层结构的人工骨膜材料在制备骨膜组织修复材料中的应用。
[0028]
本发明中,所述具有pcl/col/mc梯度三层结构的人工骨膜材料,利用各层纤维的特点实现响应功能,且各层连续性良好。
[0029]
本发明中,具有pcl/col/mc梯度三层结构的人工骨膜材料,三层纤维层间结合良好。
[0030]
本发明提供一种pcl/col/mc梯度三层人工骨膜材料,优点在于:
[0031]
(1)本发明所有采用原料均是已批准在用的医用材料,通过特殊的工艺步骤使得其具有特定的功能,良好的生物相容性,不易发生免疫排斥安全性高;
[0032]
(2)本发明人工骨膜内层添加mc颗粒,为所募集细胞提供有利的微环境,对干细胞的成骨分化有促进作用;
[0033]
(3)本发明人工骨外层为致密且疏水的pcl层,有阻止周围结缔组织长入缺损区域的功能;
[0034]
(4)本发明人工骨中间层为pcl/col,为人工骨膜整体提供力学支持;
[0035]
(5)本发明使用静电纺丝技术,具备静电纺丝纤维膜的优点,包括:大比表面积(有利于细胞粘附)、高孔隙率(有利于营养和代谢产物交换、细胞信号交流)、小于组织细胞尺寸的孔(防止感染与异位骨化)、可降解性(植入后无需二次手术取出)、
[0036]
(5)本发明采用工艺简单,易于转化。
附图说明
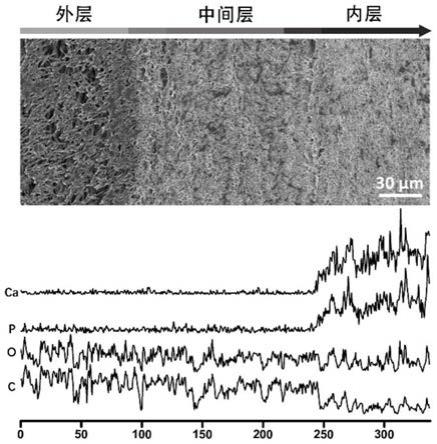
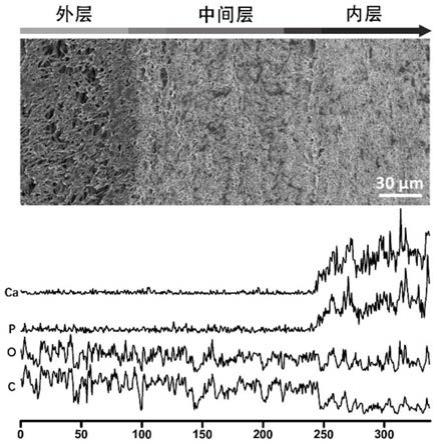
[0037]
图1为本发明制得人工骨膜的截面形貌和元素分布;
[0038]
图2为本发明制得人工骨膜的实物照片;
[0039]
图3a为本发明制得人工骨膜pcl外层的扫描电镜图像;
[0040]
图3b为本发明制得人工骨膜pcl/col/mc内层的扫描电镜图像;
[0041]
图4为本发明制得人工骨膜对细胞增殖的影响;
[0042]
图5为本发明制得人工骨膜对细胞成骨标志物之一碱性磷酸酶(alp)活性的影响;
[0043]
图6a为本发明制得人工骨膜对细胞其他成骨标志物表达活性的影响;
[0044]
图6b为本发明制得人工骨膜对细胞其他成骨标志物表达活性的影响;
[0045]
图7为本发明制得人工骨膜对大鼠颅骨临界缺损修复的影响。
具体实施方式
[0046]
为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
[0047]
此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它
步骤或单元。
[0048]
一、具体实施例
[0049]
实施例1
[0050]
制备pcl/col/mc梯度三层人工骨膜;
[0051]
1.采用体外仿生矿化方法制备矿化胶原材料。
[0052]
步骤1,将一型胶原溶解在酸性溶液中,不断搅拌;
[0053]
步骤2,将cacl2和nah2po4溶液以钙磷比为1.67的比例逐滴加入胶原的酸性溶液中,制得含有胶原、钙离子和磷酸根离子的混合溶液;
[0054]
步骤3,向混合溶液中缓慢滴加氢氧化钠溶液,升高溶液的ph值至7.4,搅拌48小时,获得矿化胶原絮状沉淀;
[0055]
步骤4,最后,将矿化胶原沉淀用超纯水离心洗涤3次,冷冻干燥48小时,研磨至粒径为10
‑
100μm的颗粒;
[0056]
2.静电纺丝溶液的制备。
[0057]
步骤1,向溶剂六氟异丙醇(hfip)中分别加入聚己内酯(pcl)、聚己内酯和胶原(pcl/col)、聚己内酯、胶原和矿化胶原(pcl/col/mc)来制备三层所需纺丝溶液,浓度分别为:外层pcl溶液(10%w/w),中间层pcl/col溶液(7.5%pcl,2.5%col,w/w),内层pcl/col/mc溶液(5%pcl,2.5%col,2.5%mc,w/w);
[0058]
步骤2,室温磁力搅拌12小时备用;
[0059]
3.骨膜材料的制备
[0060]
步骤1,采用双喷头静电纺丝装置,采用19号静电纺丝针头,调节接收距离为10cm,加正高压12kv,负高压1kv;调节液体流速0.5ml/h的速度,接收滚筒转速600r/min;
[0061]
步骤2,将5ml注射器内装入纺丝液,在注射泵的控制下两个喷头依次纺丝pcl、pcl/col、pcl/col/mc溶液;
[0062]
步骤3,为更好地保证层间结合力,在停止纺丝pcl溶液之前,使用另一针头开始同时纺丝pcl/col溶液,重合纺丝时间约占pcl溶液量的10%,在停止纺丝pcl/col溶液之前,使用另一针头开始同时纺丝pcl/col/mc溶液,重合纺丝时间约占pcl溶液量的10%,最终得到厚度为600μm的纤维膜;
[0063]
图3a显示了实施例1制备的pcl/col/mc梯度三层人工骨膜pcl外层的扫描电镜图像,从图中可以看到,纤维连续,纤维直径较统一,分布在1200
‑
1600nm,图3b显示了实施例1制备的pcl/col/mc梯度三层人工骨膜pcl内层的扫描电镜图像,从图中可以看到,纤维连续,直径较统一,分布在100
‑
300nm,纤维直径较外层纯pcl纤维较细,纤维间分布有矿化胶原颗粒。内层和外层纤维为无规则排列或非定向排列的纳米纤维结构。
[0064]
二、本发明制得pcl/col/mc梯度三层人工骨膜的性能检测。
[0065]
1.人工骨膜对细胞增殖的影响。
[0066]
将pcl/col/mc梯度三层人工骨膜圆片浸于将人工骨膜裁剪成24孔板孔大小的圆片,将hbmscs按105个/ml的细胞密度种在纳米纤维膜样品表面,使用人源骨髓间充质干细胞专用培养基进行培养,包括dmem,10%fbs,1%双抗(青霉素
‑
链霉素)和1%谷氨酰胺。置于37℃、95%湿度、5%二氧化碳的培养箱中培养1、4、7天后,采用cck
‑
8方法检测细胞增殖活性。p<0.05和p<0.01定义为具有统计学差异。
[0067]
结果如图4所示,所有材料表面细胞从第1天至第7天均处于细胞数量增加的状态。在第1天各组间细胞数量无显著性差异,在第4天和第7天,pcl/col/mc材料表面细胞活性显著高于pcl组和对照组,这些结果表明pcl/col/mc膜有利于hbmscs细胞的粘附和增殖。
[0068]
2.人工骨膜对细胞成骨标志物之一碱性磷酸酶(alp)活性的影响
[0069]
alp测定,将hbmscs细胞以1x106/ml接种到24孔板中,1ml/孔,置于5%二氧化碳培养箱过夜,次日,更换培养基为上述成骨诱导培养基,隔日更换,于成骨诱导第7、14d取出细胞培养板,吸弃培养基,pbs清洗2遍,然后每孔加入0.2%triton x
‑
100裂解液4℃过夜。使用碱性磷酸酶试剂盒(p0321m,碧云天)对hbmscs细胞alp表达量进行检测。首先提取细胞中的总蛋白,然后使用bca蛋白浓度试剂盒(p0009,碧云天)测定蛋白浓度,最后使用碱性磷酸酶试剂盒检测alp含量,先将试剂盒缓冲液基质液按说明书混合为工作液,再于96孔板中加入4μl待测样品,后加入200μl工作液,在37℃下反应15min,最后置于酶标仪中进行检测。通过alp含量和蛋白含量的比值确定alp活性。p<0.05和p<0.01定义为具有统计学差异。
[0070]
结果如图5所示,在所有时间点,pcl/col/mc人工骨膜组的alp活性均高于细胞培养板对照组和pcl组,所以结果证明在没有可溶性成骨生长因子刺激的情况下,pcl/col/mc人工骨膜能够支持细胞成骨分化。
[0071]
3.人工骨膜对细胞其他成骨标志物表达活性的影响。
[0072]
骨髓间充质干细胞成骨分化相关蛋白的表达利用western blot方法检测,检测对象包括alp,ocn,opn,col
‑
i和gapdh,以2
×
105/孔的细胞浓度将细胞接种在放置材料的24孔板内,使用完全培养基培养14天和21天,首先,提取蛋白,吸弃培养基,用预冷的pbs将材料细胞复合体洗3次,加入含蛋白酶抑制剂pmsf的蛋白裂解液,于冰上裂解30分钟,反复吹打,将裂解的细胞悬液转移到1.5mlep管中,4℃,12000rpm离心5min,取上清液用于蛋白浓度测定和western blot测试。按照说明书用bca法测定蛋白浓度。
[0073]
用以上提取的蛋白进行western blot测试,首先,将一抗和二抗按照1:500和1:2500比例用tbst稀释,置于4℃冰箱待用。然后清洗并晾干玻璃板,并保证其整体漏液,其次,将10%的分离胶注入玻璃板中,需避免气泡产生,加入无水乙醇来检验分离胶是否凝固,除去无水乙醇,在玻璃板中加入5%浓缩胶,将10孔梳子插入浓缩胶中,待其凝固,取出梳子,将预染蛋白marker、待测样品和loading buffer依次加入孔中。其次,在80v恒压电泳浓缩胶30min,在100v恒压下电泳分离胶1.5h直至marker蛋白分离。待电泳结束后,裁剪同凝胶尺寸相同的pvdf膜,将膜、滤纸、凝胶三层固定在转移槽内,于300ma电流条件下转膜2h。此时,蛋白已经被转移到pvdf膜上,用5%的bsa溶液将膜封闭2h。最后,将膜与一抗和二抗在4℃下孵育过夜,完成后在膜的蛋白面低价ecl化学发光液,通过化学显影来检测蛋白表达情况。p<0.05和p<0.01定义为具有统计学差异。
[0074]
结果如图6a和图6b所示,pcl/col/mc人工骨膜表现出明显地促hbmscs细胞成骨分化的作用。
[0075]
4.人工骨膜大鼠颅骨临界缺损修复的影响。
[0076]
本动物实验遵照动物护理和使用委员会(iacuc)指南进行。实验选取体重在250g至300g的7周大的成年雄性sd大鼠。将人工骨膜材料制备成直径为5mm,厚度1mm的圆片,并进行辐照灭菌。
[0077]
大鼠颅骨临界缺损制造步骤为:首先用含有10%水合氯醛的生理盐水按照动物体
重每100g注射0.3ml的剂量对大鼠进行腹腔注射麻醉。待大鼠被麻醉后,备皮手术部位,固定在手术台上,用碘伏将手术部位消毒,沿颅骨中线切开一条2.5cm左右的切口,将头皮和皮下组织用钝器拉倒一侧。使用直径为5mm的环形钻头(bernal dental,britain)在大鼠颅骨左右两边各制造一个缺损,过程中不断用生理盐水冲洗和降温,同时注意不要伤及颅骨下面的脑膜。待缺损制造完毕,放入各组支架材料,逐层缝合伤口。术后每天每只注射20万单位青霉素,持续3天。
[0078]
术后4、8、12周,将大鼠注射过量水合氯醛麻醉剂处死,取出颅骨,用生理盐水轻轻润洗,使用4%多聚甲醛固定24小时后,用微计算机断层扫描仪(micro
‑
ct)对缺损处扫描,工作电流为313μa,电压为80kv,图像像素为17.4μm。收集的数据用于重建3d断层图像,并基于micro
‑
ct图像分析骨体积/组织体积(bv/tv)和骨矿物质密度(bmd)。
[0079]
micro
‑
ct扫结束后,使用10%edta脱钙液对骨组织进行6周的脱钙,脱钙液每周更换三次,对已脱钙组织进行脱水、石蜡包埋、组织切片以及h&e染色和masson染色,具体操作与2.2.6.2和2.2.6.3相同。最后在切片扫描仪下进行观察记录。p<0.05和p<0.01定义为具有统计学差异。
[0080]
结果如图7所示,12周后,pcl/col/mc人工骨膜各组之间无显著性差异,新生骨量和骨密度均显著高于空白组和pcl组,证明pcl/col/mc人工骨膜具有良好的体内原位骨再生作用。
[0081]
实施例2
[0082]
制备pcl/col/mc梯度三层人工骨膜。
[0083]
1.采用体外仿生矿化方法制备矿化胶原材料
[0084]
步骤1,将一型胶原溶解在酸性溶液中,不断搅拌;
[0085]
步骤2,将cacl2和nah2po4溶液以钙磷比为1.67的比例逐滴加入胶原的酸性溶液中,制得含有胶原、钙离子和磷酸根离子的混合溶液;
[0086]
步骤3,向混合溶液中缓慢滴加氢氧化钠溶液,升高溶液的ph值至7.4,搅拌48小时,获得矿化胶原絮状沉淀;
[0087]
步骤4,最后,将矿化胶原沉淀用超纯水离心洗涤3次,冷冻干燥48小时,研磨至粒径为10
‑
100μm的颗粒;
[0088]
2.静电纺丝溶液的制备
[0089]
步骤1,向溶剂六氟异丙醇(hfip)中分别加入聚己内酯(pcl)、聚己内酯/胶原(pcl/col)、聚己内酯/胶原/矿化胶原(pcl/col/mc)来制备三层所需纺丝溶液,浓度分别为:外层pcl溶液(10%w/w),中间层pcl/col溶液(7.5%pcl,2.5%col,w/w),内层pcl/col/mc溶液(每个组分3.3%w/w);
[0090]
步骤2,室温磁力搅拌12小时备用;
[0091]
3.骨膜材料的制备
[0092]
步骤1,采用双喷头静电纺丝装置,采用19号静电纺丝针头,调节接收距离为10cm,加正高压12kv,负高压1kv;调节液体流速0.5ml/h的速度,接收滚筒转速600r/min;
[0093]
步骤2,将5ml注射器内装入纺丝液,在注射泵的控制下两个喷头依次纺丝pcl、pcl/col、pcl/col/mc溶液;
[0094]
步骤3,为更好地保证层间结合力,在停止纺丝pcl溶液之前,使用另一针头开始同
时纺丝pcl/col溶液,重合纺丝时间约占pcl溶液量的10%,在停止纺丝pcl/col溶液之前,使用另一针头开始同时纺丝pcl/col/mc溶液,重合纺丝时间约占pcl溶液量的10%,最终得到厚度为600μm的纤维膜;
[0095]
该pcl/col/mc梯度三层人工骨膜的纤维具有无规则排列或定向排列的纳米纤维结构。
[0096]
实施例3
[0097]
制备pcl/col/mc梯度三层人工骨膜
[0098]
1.采用体外仿生矿化方法制备矿化胶原材料
[0099]
步骤1,将一型胶原溶解在酸性溶液中,不断搅拌;
[0100]
步骤2,将cacl2和nah2po4溶液以钙磷比为1.67的比例逐滴加入胶原的酸性溶液中,制得含有胶原、钙离子和磷酸根离子的混合溶液;
[0101]
步骤3,向混合溶液中缓慢滴加氢氧化钠溶液,升高溶液的ph值至7.4,搅拌48小时,获得矿化胶原絮状沉淀;
[0102]
步骤4,最后,将矿化胶原沉淀用超纯水离心洗涤3次,冷冻干燥48小时,研磨至粒径为10
‑
100μm的颗粒;
[0103]
2.静电纺丝溶液的制备
[0104]
步骤1,向溶剂六氟异丙醇(hfip)中分别加入聚己内酯(pcl)、聚己内酯/胶原(pcl/col)、聚己内酯/胶原/矿化胶原(pcl/col/mc)来制备三层所需纺丝溶液,浓度分别为:外层pcl溶液(10%w/w),中间层pcl/col溶液(7.5%pcl,2.5%col,w/w),内层pcl/col/mc溶液(每个组分4%w/w);
[0105]
步骤2,室温磁力搅拌12小时备用;
[0106]
3.骨膜材料的制备。
[0107]
步骤1,采用双喷头静电纺丝装置,采用19号静电纺丝针头,调节接收距离为10cm,加正高压12kv,负高压1kv;调节液体流速0.5ml/h的速度,接收滚筒转速600r/min;
[0108]
步骤2,将5ml注射器内装入纺丝液,在注射泵的控制下两个喷头依次纺丝pcl、pcl/col、pcl/col/mc溶液;
[0109]
步骤3,为更好地保证层间结合力,在停止纺丝pcl溶液之前,使用另一针头开始同时纺丝pcl/col溶液,重合纺丝时间约占pcl溶液量的10%,在停止纺丝pcl/col溶液之前,使用另一针头开始同时纺丝pcl/col/mc溶液,重合纺丝时间约占pcl溶液量的10%,最终得到厚度为600μm的纤维膜;
[0110]
该pcl/col/mc梯度三层人工骨膜的纤维具有无规则排列或定向排列的纳米纤维结构。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。