用于治疗b细胞恶性肿瘤的联合疗法
1.相关申请的交叉引用
2.本技术要求2019年2月15日提交的美国临时申请号62/806,148的优先权,该申请的公开内容据此全文以引用方式并入。
技术领域
3.本文提供了治疗b细胞恶性肿瘤的方法,以及可以用于鉴定将对用依鲁替尼和抗pd
‑
1抗体的组合治疗b细胞恶性肿瘤作出反应的受试者的基因突变。
背景技术:
4.新型靶向疗法和免疫肿瘤学药剂已经彻底变革了血液学b细胞恶性肿瘤的治疗,特别是用于患有复发性/难治性(r/r)疾病的难以治疗的患者的治疗。然而,许多患有滤泡性淋巴瘤(fl)、弥漫性大b细胞淋巴瘤(dlbcl)和richter转化(rt)的患者复发或对于标准疗法变得难治,并且对于不能对挽救疗法有充分反应或不适合干细胞移植的那些患者预后不佳。体细胞突变不仅导致b细胞恶性肿瘤的形成,而且还可以导致那些癌症变得复发/难治。在重度预治疗的患者中缺乏替代性的选择。
技术实现要素:
5.本文公开了治疗受试者的b细胞恶性肿瘤的方法,该方法包括向受试者施用治疗有效量的依鲁替尼和抗pd
‑
1抗体的组合,从而治疗b细胞恶性肿瘤,其中:
6.a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
7.b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自rnf213、nbpf1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表16中;
8.c)所述b细胞恶性肿瘤为fl并且所述受试者在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
9.d)所述b细胞恶性肿瘤为rt并且所述受试者在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
10.本文还提供了治疗受试者的b细胞恶性肿瘤的方法,该方法包括向受试者施用治疗有效量的依鲁替尼和抗pd
‑
1抗体的组合,从而治疗b细胞恶性肿瘤,其中:
11.a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
12.b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自kmt2d、bcl2、csmd3、
crebbp、ebf1、sgk1或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表16中;
13.c)所述b细胞恶性肿瘤为fl并且所述受试者在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
14.d)所述b细胞恶性肿瘤为rt并且所述受试者在选自ros1、igll5、pask或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
15.还提供了预测患有b细胞恶性肿瘤的受试者对依鲁替尼和抗pd
‑
1抗体的组合的反应性的可能性的方法,其中:
16.a)所述b细胞恶性肿瘤为dlbcl并且所述方法包括分析来自所述受试者的样品的在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表4或表6中;
17.b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述方法包括分析来自所述受试者的样品的在选自rnf213、nbpf1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表16中;
18.c)所述b细胞恶性肿瘤为fl并且所述方法包括分析来自所述受试者的样品的在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
19.d)所述b细胞恶性肿瘤为rt并且所述方法包括分析来自所述受试者的样品的在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表12或表14中;
20.其中所述基因中的所述一个或多个突变指示对所述组合的反应性。
21.本发明还公开了预测患有b细胞恶性肿瘤的受试者对依鲁替尼和抗pd
‑
1抗体的组合的无反应性的可能性的方法,其中:
22.a)所述b细胞恶性肿瘤为dlbcl并且所述方法包括分析来自所述受试者的样品的在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表4或表6中;
23.b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述方法包括分析来自所述受试者的样品的在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表16中;
24.c)所述b细胞恶性肿瘤为fl并且所述方法包括分析来自所述受试者的样品的在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
25.d)所述b细胞恶性肿瘤为rt并且所述方法包括分析来自所述受试者的样品的在选自ros1、igll5、pask或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表12或表14中;
26.其中所述基因中的所述一个或多个突变指示对所述组合的无反应性。
附图说明
27.当结合附图阅读时,进一步理解发明内容以及下文的具体实施方式。出于示出本发明所公开方法的目的,附图中所示的是本发明方法的示例性实施方案;然而,所述方法不限于所公开的具体实施方案。在附图中:
28.图1展示了本文所公开的lym1002研究的给药计划表。
29.图2展示了dlbcl患者(n=26)中在基于ihc的pd
‑
l1表达的作用下的无进展生存期(pfs)的图线。
30.图3展示了生发中心b细胞(gcb)dlbcl患者(n=17)中在基于ihc的pd
‑
l1表达的作用下的无进展生存期(pfs)的图线。
31.图4a、图4b、图4c、图4d和图4e展示了dlbcl受试者和richter综合征受试者中无进展存活百分比(pfs)随时间推移的变化。图4a:具有突变tp53(tp53 m)的dlbcl受试者中的pfs对比具有tp53野生型(tp53 wt)的dlbcl受试者中的pfs(p=0.002);图4b:在2个疗程的依鲁替尼加纳武单抗后(分子缓解,mr )的dlbcl受试者中的pfs对比无分子缓解(mr
‑
)的dlbcl受试者中的pfs;图4c:在具有tp53 wt mr 、tp53 wt mr
‑
、tp53 m mr 和tp53 m mr
‑
的复发性/难治性dlbcl受试者中的pfs;图4d:在具有tp53 wt的richter综合征受试者中的pfs对比在具有tp53 m的richter综合征受试者中的pfs;以及图4e:在具有mr 的richter综合征受试者中的pfs对比在具有mr
‑
的richter综合征受试者中的pfs。
具体实施方式
32.结合形成本公开一部分的附图,并参考以下具体实施方式,可更容易地理解本发明所公开的方法。应当理解,本发明所公开的方法不限于本文所描述和/或示出的具体方法,并且本文所用的术语仅用于以举例方式描述具体实施方案,并不旨在限制受权利要求书保护的方法。
33.除非另外特别说明,否则关于可能的机制或作用模式或改善原因的任何描述仅旨在出于示例性目的,并且本发明所公开的方法不受任何此类建议的机制或作用模式或改善原因的正确或错误的约束。
34.应当理解,本发明所公开的方法的某些特征为清楚起见在本文各单独实施方案的上下文中进行描述,但也可以组合形式提供在单个实施方案中。相反地,本文所公开的方法的各种特征为简明起见在单个实施方案的上下文中进行描述,也可分开地或以任何子组合形式提供。
35.如本文所用,单数形式“一个”、“一种”和“该”包括复数形式。
36.与说明书的各方面相关的各种术语在说明书和权利要求书中通篇使用。除非另外指明,否则此类术语被赋予本领域的普通含义。其他具体定义的术语应按照与本文所提供的定义相符的方式理解。
37.术语“包含”旨在包括由术语“基本上由
……
组成”和“由
……
组成”涵盖的示例;类似地,术语“基本上由
……
组成”旨在包括由术语“由
……
组成”所涵盖的示例。
38.美国和其他国家批准用于多种b细胞恶性肿瘤的布鲁顿酪氨酸激酶(btk)的第一类口服共价抑制剂依鲁替尼破坏恶性b细胞的粘附、增殖、归巢和生存所必需的信号传导途径。
[0039]“治疗(treat、treatment)”及类似的术语是指治疗性处理和预防性或预防措施,并且包括降低症状的严重性和/或频率、消除症状和/或症状的根本原因、降低症状的频率或可能性和/或其根本原因,以及改善或补救由b细胞恶性肿瘤直接或间接造成的损害。治疗包括对所述组合(依鲁替尼和抗pd
‑
1抗体)的完全反应和部分反应。治疗也包括与未接受治疗的受试者的预期生存期相比延长生存期。要治疗的受试者包括患有病症或障碍的受试者以及易患病症或障碍的受试者或者要预防病症或障碍的受试者。
[0040]
如本文所用,短语“治疗有效量”是指如本文所述的能有效地实现特定生物学或治疗结果(诸如但不限于本文所公开、描述或例示的生物学或治疗结果)的依鲁替尼和抗pd
‑
1抗体的组合的量。治疗有效量可根据以下因素而变化:诸如个体的疾病状态、年龄、性别和体重,以及组合物在受试者中引发期望的反应的能力。治疗有效量的示例性指标包括例如患者健康状况改善、肿瘤负荷减少、b细胞恶性肿瘤生长被遏止或减慢,以及/或者b细胞恶性肿瘤细胞没有向身体其他部位转移。
[0041]
如本文所用,术语“受试者”旨在表示任何动物,特别是哺乳动物。因此,本发明所公开的方法适用于人和非人动物,但最优选地适用于人。“受试者”和“患者”在本文中可互换使用。
[0042]
如本文所用,“依鲁替尼和抗pd
‑
1抗体的组合”是指其中依鲁替尼和抗pd
‑
1抗体基本上同时、并行或相继施用的治疗方案。因此,可以将依鲁替尼和抗pd
‑
1抗体包含在待施用于受试者的单独组合物中。
[0043]
本文使用以下缩写:复发性或难治性(r/r);总反应率(orr);总生存期(os);无进展生存期(pfs);滤泡性淋巴瘤(fl);弥漫性大b细胞淋巴瘤(dlbcl);richter转化(rt);慢性淋巴细胞性白血病/小淋巴细胞性淋巴瘤(cll/sll);基因表达谱分析(gep);完全反应(cr);部分反应(pr);活化b细胞(abc);生发中心b细胞(gcb);部分反应伴随淋巴球增多(pr
‑
l);疾病进展(pd);以及疾病稳定(sd)。
[0044]
治疗b细胞恶性肿瘤的方法
[0045]
本文提供了治疗受试者的b细胞恶性肿瘤的方法,其中所述b细胞恶性肿瘤为弥漫性大b细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤(fl)或richter转化(rt)。所述方法包括向所述受试者施用治疗有效量的依鲁替尼和抗pd
‑
1抗体的组合,从而治疗所述b细胞恶性肿瘤,其中所述受试者在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr、irf2bp2、klhl6、setx、sf3b1或它们的组合的基因中具有一个或多个突变。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的依鲁替尼和抗pd
‑
1抗体的组合,从而治疗所述b细胞恶性肿瘤,其中:
[0046]
a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0047]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自rnf213、nbpf1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表16中;
[0048]
c)所述b细胞恶性肿瘤为fl并且所述受试者在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0049]
d)所述b细胞恶性肿瘤为rt并且所述受试者在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0050]
本文还提供了治疗在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr、irf2bp2、klhl6、setx、sf3b1或它们的组合的基因中具有一个或多个突变的受试者的b细胞恶性肿瘤的方法,所述方法包括向所述受试者施用治疗有效量的依鲁替尼和抗pd
‑
1抗体的组合,从而治疗所述b细胞恶性肿瘤,其中:
[0051]
a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0052]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自rnf213、nbpf1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表16中;
[0053]
c)所述b细胞恶性肿瘤为fl并且所述受试者在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0054]
d)所述b细胞恶性肿瘤为rt并且所述受试者在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0055]
在一些实施方案中,所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表4或表6中。在一些方面,所述受试者在klhl14、rnf213或它们的组合中具有一个或多个突变,其中所述一个或多个突变列于表4或表6中。所述方法可以针对在klhl14、rnf213、csmd3、bcl2、nbpf1和lrp1b中的1者、2者、3者、4者、5者或全部6者中以及它们的各种组合中具有表4或表6中所列出的一个或多个突变的受试者进行。
[0056]
在一些实施方案中,所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自rnf213、nbpf1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表16中。所述方法可以针对在rnf213和nbpf1中的任一者或两者中具有表16中所列出的一个或多个突变的受试者进行。
[0057]
在一些实施方案中,所述b细胞恶性肿瘤为fl并且所述受试者在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表8或表10中。在一些方面,所述受试者在bcl2中具有一个或多个突变,其中所述一个或多个突变列于表8或表10中。所述方法可以针对在bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2或tpr中的1者、2者、3者、4者、5者、6者、7者或全部8者中以及它们的各种组合中具有表8或表10中所列出的一个或多个突变的受试者进行。
[0058]
在一些实施方案中,所述b细胞恶性肿瘤为rt并且所述受试者在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。所述方法可以针对在irf2bp2、nbpf1、klhl6、setx或sf3b1中的1者、2者、3者、4者或全部5者中以及它们的各种组合中具有表12或表14中所列出的一个或多个突变的受试者进行。
[0059]
本发明还公开了治疗受试者的b细胞恶性肿瘤的方法,所述方法包括向所述受试者施用治疗有效量的依鲁替尼和抗pd
‑
1抗体的组合,从而治疗所述b细胞恶性肿瘤,其中所述受试者在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b、kmt2d、bcl2、csmd3、crebbp、sgk1、stat6、nbpf1、ezh2、ros1、igll5、pask或它们的组合的基因中不具有一个或多个突变。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的依鲁替尼和抗pd
‑
1抗体的组合,从而治疗所述b细胞恶性肿瘤,其中:
[0060]
a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0061]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表16中;
[0062]
c)所述b细胞恶性肿瘤为fl并且所述受试者在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0063]
d)所述b细胞恶性肿瘤为rt并且所述受试者在选自ros1、igll5、pask或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0064]
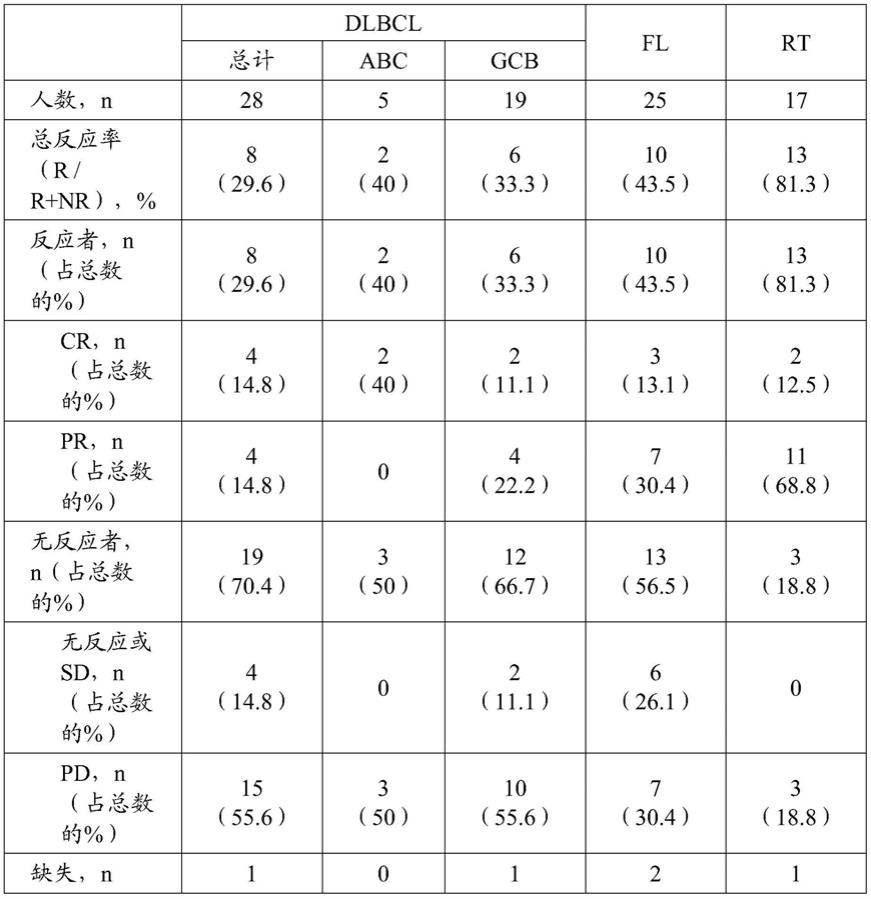
本发明公开了治疗在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b、kmt2d、bcl2、csmd3、crebbp、sgk1、stat6、nbpf1、ezh2、ros1、igll5、pask或它们的组合的基因中不具有一个或多个突变的受试者的b细胞恶性肿瘤的方法,所述方法包括向所述受试者施用治疗有效量的依鲁替尼和抗pd
‑
1抗体的组合,从而治疗所述b细胞恶性肿瘤,其中:
[0065]
a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0066]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表16中;
[0067]
c)所述b细胞恶性肿瘤为fl并且所述受试者在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0068]
d)所述b细胞恶性肿瘤为rt并且所述受试者在选自ros1、igll5、pask或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0069]
在一些实施方案中,所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表4或表6中。所述方法可以针对在tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88或nfkb1b中的1者、2者、3者、4者、5者、6者、7者或全部8者中以及它们的各种组合中不具有表4或表6中所列出的一个或多个突变的受试者进行。
[0070]
在一些实施方案中,所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表16中。所述方法可以针对在kmt2d、bcl2、csmd3、crebbp、ebf1或sgk1中的1者、2者、3者、4者、5者或全部6者中以及它们的各种组合中不具有表16中所列出的一个或多个突变的受试者进行。
[0071]
在一些实施方案中,所述b细胞恶性肿瘤为fl并且所述受试者在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表8或表10中。所述方法可以针对在crebbp、kmt2d、bcl2、stat6、nbpf1或ezh2中的1者、2者、3者、4者、5者或全部6者中以及它们的各种组合中不具有表8或表10中所列出的一个或多个突变的受试者进行。
[0072]
在一些实施方案中,所述b细胞恶性肿瘤为rt并且所述受试者在选自ros1、igll5、pask或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。在一些方面,所述受试者在ros1中不具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。所述方法可以针对在ros1、igll5或pask中的1者、2者或全部3者中以及它们的各种组合中不具有表12或表14中所列出的一个或多个突变的受试者进行。
[0073]
所述方法可以还包括在治疗之前分析来自所述受试者的样品是否存在表4、表6、表8、表10、表12、表14或表16中所列出的一个或多个突变。所述方法可以还包括在分析和治疗之前从所述受试者分离样品。在一些实施方案中,例如,所述方法包括:从受试者分离样品,分析来自所述受试者的样品是否存在表4、表6、表8、表10、表12、表14或表16中所列出的一个或多个突变,以及治疗所述受试者。
[0074]
来自所述受试者的合适样品包括例如血液样品或肿瘤样品。在一些方面,所述方法可以包括在治疗之前,从所述受试者分离血液样品以及/或者分析来自所述受试者的血液样品是否存在表4、表6、表8、表10、表12、表14或表16中所列出的一个或多个突变。在一些方面,所述方法可以包括在治疗之前,从所述受试者分离肿瘤样品以及/或者分析来自所述受试者的肿瘤样品是否存在表4、表6、表8、表10、表12、表14或表16中所列出的一个或多个突变。
[0075]
在一些实施方案中,抗pd
‑
1抗体包括纳武单抗(品牌名)。
[0076]
在本发明所公开的方法中使用的合适的依鲁替尼量包括约140mg至约840mg。在一些实施方案中,依鲁替尼量包括140mg、190mg、240mg、290mg、340mg、390mg、420mg、440mg、490mg、540mg、590mg、640mg、690mg、740mg、790mg或840mg。
[0077]
抗pd
‑
1抗体的合适量包括约1mg/kg至约5mg/kg。在一些实施方案中,抗pd
‑
1抗体的量包括1mg/kg、1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg或5mg/kg。在一些方面,依鲁替尼和抗pd
‑
1抗体的组合的治疗有效量包括560mg的依鲁替尼和3mg/kg的抗pd
‑
1抗体。
[0078]
抗pd
‑
1抗体可以静脉内施用,并且依鲁替尼可以口服施用。示例性给药计划表包括例如以14天为周期施用抗pd
‑
1抗体和每天施用一次依鲁替尼。
[0079]
在一些实施方案中,所述治疗导致所述受试者的完全反应(cr)或部分反应(pr)。
[0080]
用本发明所公开的方法治疗的合适受试者包括以下那些:
[0081]
a)患有dlbcl、fl或rt(仅从cll/sll转化);
[0082]
b)接受过≥1种在先疗法(对于fl,≥2种在先疗法),但在先治疗线不超过4条;
[0083]
c)具有≤2的东部肿瘤协作组(ecog)体能状态得分;
[0084]
d)患有可测量的疾病;以及
[0085]
e)先前没有接受过依鲁替尼疗法或抗pd
‑
1疗法。
[0086]
本文还提供了在治疗受试者的b细胞恶性肿瘤中使用的依鲁替尼和抗pd
‑
1抗体的组合,其中:
[0087]
a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0088]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自rnf213、nbpf1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表16中;
[0089]
c)所述b细胞恶性肿瘤为fl并且所述受试者在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0090]
d)所述b细胞恶性肿瘤为rt并且所述受试者在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0091]
还提供了依鲁替尼在制造用于与抗pd
‑
1抗体组合治疗受试者的b细胞恶性肿瘤的药物中的用途,其中:
[0092]
a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0093]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自rnf213、nbpf1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表16中;
[0094]
c)所述b细胞恶性肿瘤为fl并且所述受试者在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0095]
d)所述b细胞恶性肿瘤为rt并且所述受试者在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0096]
本发明公开了在治疗受试者的b细胞恶性肿瘤中使用的依鲁替尼和抗pd
‑
1抗体的组合,其中:
[0097]
a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0098]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表16中;
[0099]
c)所述b细胞恶性肿瘤为fl并且所述受试者在选自crebbp、kmt2d、bcl2、stat6、
nbpf1、ezh2或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0100]
d)所述b细胞恶性肿瘤为rt并且所述受试者在选自ros1、igll5、pask或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0101]
本发明还公开了依鲁替尼在制造用于与抗pd
‑
1抗体组合治疗受试者的b细胞恶性肿瘤的药物中的用途,其中:
[0102]
a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0103]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表16中;
[0104]
c)所述b细胞恶性肿瘤为fl并且所述受试者在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0105]
d)所述b细胞恶性肿瘤为rt并且所述受试者在选自ros1、igll5、pask或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0106]
预测患有b细胞恶性肿瘤的受试者对依鲁替尼和抗pd
‑
1抗体的组合的反应性或无反应性的可能性的方法
[0107]
还提供了预测患有b细胞恶性肿瘤的受试者对依鲁替尼和抗pd
‑
1抗体的组合的反应性的可能性的方法,所述方法包括分析来自所述受试者的样品的在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr、irf2bp2、klhl6、setx或sf3b1的基因中的一个或多个突变,其中所述一个或多个基因中的突变指示对所述组合的反应性。在一些实施方案中:
[0108]
a)所述b细胞恶性肿瘤为dlbcl并且所述方法包括分析来自所述受试者的样品的在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0109]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述方法包括分析来自所述受试者的样品的在选自rnf213、nbpf1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表16中;
[0110]
c)所述b细胞恶性肿瘤为fl并且所述方法包括分析来自所述受试者的样品的在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0111]
d)所述b细胞恶性肿瘤为rt并且所述方法包括分析来自所述受试者的样品的在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表12或表14中;
[0112]
其中所述基因中的所述一个或多个突变指示对所述组合的反应性。
[0113]
在一些实施方案中,所述b细胞恶性肿瘤为dlbcl并且所述方法包括分析来自所述受试者的样品的在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中
的一个或多个突变,其中所述一个或多个突变列于表4或表6中,并且所述基因中的所述一个或多个突变指示对所述组合的反应性。在一些方面,所述b细胞恶性肿瘤为dlbcl并且所述方法包括分析来自所述受试者的样品的在选自klhl14、rnf213或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表4或表6中,并且所述基因中的所述一个或多个突变指示对所述组合的反应性。表4或表6中所列出的在klhl14、rnf213、csmd3、bcl2、nbpf1和lrp1b中的1者、2者、3者、4者、5者或全部6者中以及它们的各种组合中的一个或多个突变可以指示对所述组合的反应性。
[0114]
在一些实施方案中,所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述方法包括分析来自所述受试者的样品的在选自rnf213、nbpf1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表16中,并且所述基因中的所述一个或多个突变指示对所述组合的反应性。表16中所列出的在rnf213和nbpf1中的任一者或两者中的一个或多个突变可以指示对所述组合的反应性。
[0115]
在一些实施方案中,所述b细胞恶性肿瘤为fl并且所述方法包括分析来自所述受试者的样品的在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表8或表10中,并且所述基因中的所述一个或多个突变指示对所述组合的反应性。在一些方面,所述方法包括分析来自所述受试者的样品的在bcl2中的一个或多个突变,其中所述一个或多个突变列于表8或表10中。表8或表10中所列出的在bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2或tpr中的1者、2者、3者、4者、5者、6者、7者或全部8者中以及它们的各种组合中的一个或多个突变可以指示对所述组合的反应性。
[0116]
在一些实施方案中,所述b细胞恶性肿瘤为rt并且所述方法包括分析来自所述受试者的样品的在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表12或表14中。在irf2bp2、nbpf1、klhl6、setx或sf3b1中的1者、2者、3者、4者或全部5者中以及它们的各种组合中的一个或多个突变可以指示对所述组合的反应性。
[0117]
还提供了预测患有b细胞恶性肿瘤的受试者对依鲁替尼和抗pd
‑
1抗体的组合的无反应性的可能性的方法,其中:
[0118]
a)所述b细胞恶性肿瘤为dlbcl并且所述方法包括分析来自所述受试者的样品的在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0119]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述方法包括分析来自所述受试者的样品的在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表16中;
[0120]
c)所述b细胞恶性肿瘤为fl并且所述方法包括分析来自所述受试者的样品的在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0121]
d)所述b细胞恶性肿瘤为rt并且所述方法包括分析来自所述受试者的样品的在选自ros1、igll5、pask或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表12或表14中;
[0122]
其中所述基因中的所述一个或多个突变指示对所述组合的无反应性。
[0123]
在一些实施方案中,所述b细胞恶性肿瘤为dlbcl并且所述方法包括分析来自所述受试者的样品的在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表4或表6中,并且所述基因中的所述一个或多个突变指示对所述组合的无反应性。表4或表6中所列出的在tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88或nfkb1b中的1者、2者、3者、4者、5者、6者、7者或全部8者中以及它们的各种组合中的一个或多个突变可以指示对所述组合的无反应性。
[0124]
在一些实施方案中,所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述方法包括分析来自所述受试者的样品的在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表16中,并且所述基因中的所述一个或多个突变指示对所述组合的无反应性。表16中所列出的在kmt2d、bcl2、csmd3、crebbp、ebf1或sgk1中的1者、2者、3者、4者、5者或全部6者中以及它们的各种组合中的一个或多个突变可以指示对所述组合的无反应性。
[0125]
在一些实施方案中,所述b细胞恶性肿瘤为fl并且所述方法包括分析来自所述受试者的样品的在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表8或表10中,并且所述基因中的所述一个或多个突变指示对所述组合的无反应性。表8或表10中所列出的在crebbp、kmt2d、bcl2、stat6、nbpf1或ezh2中的1者、2者、3者、4者、5者或全部6者中以及它们的各种组合中的一个或多个突变可以指示对所述组合的无反应性。
[0126]
在一些实施方案中,所述b细胞恶性肿瘤为rt并且所述方法包括分析来自所述受试者的样品的在选自ros1、igll5、pask或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表12或表14中,并且所述基因中的所述一个或多个突变指示对所述组合的无反应性。在一些方面,所述b细胞恶性肿瘤为rt并且所述方法包括分析来自所述受试者的样品的在ros1中的一个或多个突变,其中所述一个或多个突变列于表12或表14中。表12或表14中所列出的在ros1、igll5或pask中的1者、2者或全部3者中以及它们的各种组合中的一个或多个突变可以指示对所述组合的无反应性。
[0127]
来自所述受试者的合适样品包括例如血液样品或肿瘤样品。
[0128]
本发明所公开的方法可以用于预测以下受试者对所述组合的反应性或无反应性的可能性,所述受试者:
[0129]
a)患有dlbcl、fl或rt(仅从cll/sll转化);
[0130]
b)接受过≥1种在先疗法(对于fl,≥2种在先疗法),但在先治疗线不超过4条;
[0131]
c)具有≤2的东部肿瘤协作组(ecog)体能状态得分;
[0132]
d)患有可测量的疾病;以及
[0133]
e)先前没有接受过依鲁替尼疗法或抗pd
‑
1疗法。
[0134]
在一些实施方案中,预测对依鲁替尼和抗pd
‑
1抗体的组合的反应性或无反应性的可能性的方法还包括向所述受试者施用治疗有效量的依鲁替尼和抗pd
‑
1抗体的所述组合,从而治疗所述b细胞恶性肿瘤,条件是所述受试者在基因中具有指示对所述组合的反应性的一个或多个突变,以及/或者在基因中缺少指示对所述组合的无反应性的一个或多个突
变,所述一个或多个突变在表4、表6、表8、表10、表12、表14和表16中列出。在一些方面,抗pd
‑
1抗体包括纳武单抗(品牌名)。
[0135]
依鲁替尼的合适量、抗pd
‑
1抗体的量以及给药计划表包括上文针对治疗方法所公开的那些。
[0136]
实施例
[0137]
提供以下实施例以进一步描述本文所公开的实施方案中的一些。这些实施例旨在说明而非限制本发明所公开的实施方案。
[0138]
用依鲁替尼 纳武单抗治疗的患有复发性弥漫性大b细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤(fl)或richter转化(rt)的受试者的遗传分析
[0139]
进行了1/2a期研究(称为lym1002)以调查依鲁替尼与抗pd
‑
1药剂纳武单抗组合在患有复发性或难治性(r/r)b细胞恶性肿瘤的患者中的用途,并且鉴定与反应相关联的预测基因和机制基因。
[0140]
方法
[0141]
患者和研究设计
[0142]
该非随机化的开放标签试验入选了患有非霍奇金氏淋巴瘤(nhl)的患者,其以14天为周期接受静脉内(iv)纳武单抗(3mg/kg),并结合每天口服一次依鲁替尼(560mg)(图1)。关键的合格标准为:
[0143]
·
患有dlbcl、fl或rt(仅从cll/sll转化);
[0144]
·
接受过≥1种在先全身疗法(对于fl,≥2种),但在先治疗线不超过4条;
[0145]
·
具有≤2的东部肿瘤协作组(ecog)体能状态得分;
[0146]
·
患有可测量的疾病;以及
[0147]
·
先前没有接受过依鲁替尼疗法或抗pd
‑
1疗法。
[0148]
排除以下患者:在第一剂依鲁替尼的4周内进行过大手术,被诊断为患有除了正在研究的适应症以外的恶性肿瘤或在治疗除了正在研究的适应症以外的恶性肿瘤,或者需要用华法林或等效维生素k拮抗剂或强效cyp3a抑制剂治疗。在患有dlbcl、fl和rt的患者中进行生物标志物分析。
[0149]
评定
[0150]
dlbcl亚型分析
‑
在治疗前使用affymetrix hg
‑
u133 2阵列(thermo fisher scientific,carlsbad,ca)和来自存档活检样品的rna进行基因表达谱分析(gep)。dlbcl亚型分析通过使用wright g,tan b,rosenwald a,hurt eh,wiestner a,staudt lm.a gene expression
‑
based method to diagnose clinically distinct subgroups of diffuse large b cell lymphoma.proc natl acad sci u s a 2003;100(17):9991
‑
6中所述的分类算法来分析mas5标准化的gep数据或通过htg系统(htg molecular diagnostics,inc.,tucson,az)而进行。
[0151]
治疗反应和生存结果
‑
通过在前15个月每五个周期(14天周期)和其后每12个周期直到疾病进展、在治疗结束时,以及在随访期期间每六个月进行一次放射学评定,来评估对治疗的初步活性和临床反应。为了计算总反应率(orr),通过研究者评定将反应者定义为实现了完全反应(cr)或部分反应(pr)的患者。使用kaplan
‑
meier方法和对数秩检验估计了无进展生存期(pfs)和总生存期(os)。
[0152]
通过生物标志物进行的临床结果分析
[0153]
pd
‑
l1表达
‑
评估了作为临床结果的预测性生物标志物的pd
‑
l1表达。pd
‑
l1水平使用gep鉴定,并且还作为肿瘤细胞的百分比,证明使用dako pd
‑
l1 ihc 28
‑
8pharmdx测定(agilent technologies,glostrup,denmark)在最少100个可评估的肿瘤细胞中具有任何强度的质膜pd
‑
l1染色。在治疗前使用affymetrix hg
‑
u133 2阵列和来自存档活检样品的rna进行gep。
[0154]
使用肿瘤细胞中的pd
‑
l1表达≥5%(升高的对比未升高的)的免疫组织化学(ihc)hc阈值,计算pd
‑
l1升高或未升高的dlbcl、fl和rt亚组患者的具有反应终点或生存终点的kaplan
‑
meier生存概率。使用fisher精确检验评定了pd
‑
l1与临床反应的关联。dlbcl亚型分析通过使用感测方法分析mas5标准化的gep数据或通过使用htg edgeseq系统来进行。使用dako 28
‑
8抗体,通过ihc染色来测量pd
‑
l1水平(pd
‑
l1升高=在≥5%的肿瘤细胞中表达)。
[0155]
将反应者定义为实现了完全反应(cr)或部分反应(pr)的患者。使用kaplan
‑
meier方法和对数秩检验评估了无进展生存期(pfs)和总生存期(os)。
[0156]
外显子组分析
‑
由72个淋巴瘤样品(各自来自不同的患者)的福尔马林固定石蜡包埋样本生成外显子组数据。在dnanexus上使用原始fastq序列数据文件运行内部外显子组分析流水线。基于用snpeff和gemini软件作出的注释来定义可能的体细胞变体。将多个变体过滤器放置就位,以降低将测序人工痕迹和种系变体结合到关联分析中的可能性。
[0157]
评定感兴趣的特定基因的突变发生率,所述特定基因包括来自下列各项的那些:personalis ace extended cancer panel的dlbcl相关基因(即,abc/gcb区分基因,用于区分四个新定义的亚型的基因,在dlbcl中预测为超突变的基因),以及janssen特异性97基因组套。
[0158]
研究了治疗反应者(cr pr pr
‑
l)与无反应者(无反应或sd sd pd)之间,以及有持续反应的患者(pfs>24个月)对比没有持续反应的患者之间关于突变变体、基因表达模式和体细胞突变负荷的任何差异。单变量基因分析检查了反应者对比无反应者的变体频率显著性,并且使用fisher精确检验检查了pfs大于24个月对比pfs不大于24个月的变体频率显著性。使用“limma”r软件包进行了反应者对比无反应者以及pfs大于24个月对比pfs不大于24个月的差异基因表达分析。使用wilcoxon符号秩检验评定了反应者对比无反应者以及pfs大于24个月的患者对比pfs不大于24个月的患者的体细胞突变计数的总体差异。
[0159]
患者和临床反应
[0160]
在144名入选的受试者中,141名接受了治疗。对于这些患者,中位数年龄为65岁(范围为20岁至89岁),87名(61.7%)为男性,130名(92.2%)具有0
‑
1的ecog体能状态得分,在先治疗线的中位数为3,并且68名(48.2%)具有巨大肿块(≥5cm)。
[0161]
总而言之,入选了45名dlbcl患者(9名患有转化dlbcl,36名患有原发dlbcl)、40名fl患者和20名rt患者。其中,28名dlbcl患者(4名转化)、25名fl患者和17名rt患者可通过gep分析评估基因。
[0162]
数据库锁定时的总体中位数随访时间为19.4个月(范围为0.4个月至28.8个月)。
[0163]
在具有gep数据的患者中,针对dlbcl的总反应率为29.6%,针对fl的总反应率为43.5%,并且针对rt的总反应率为81.3%(表1)。
[0164]
表1.使用gep数据研究对dlbcl患者、fl患者和rt患者的反应
[0165][0166]
abc=活化b细胞;gcb=生发中心b细胞
[0167]
亚型分析
[0168]
通过gep微阵列和htg edgeseq dlbcl起源细胞(coo)测定(htg)方法评估患者亚型。28名dlbcl患者可使用gep微阵列方法评估亚型分析:5名患者具有活化b细胞(abc)亚型,19名具有生发中心b细胞(gcb)亚型,并且4名未归类(表1)。13名dlbcl患者可使用htg方法评估亚型分析:6名患者具有abc亚型,6名具有gcb亚型,并且1名未归类。gep方法和htg方法之间的一致性很高
‑
只有1名被gep归类为gcb的dlbcl患者被htg归类为abc亚型。
[0169]
pd
‑
l1分析
[0170]
dlbcl患者中的pd
‑
l1表达和临床结果
[0171]
pd
‑
l1升高(≥5%肿瘤细胞)发生在8名(30.8%)dlbcl患者(3名cr,2名pr)、1名(4.0%)fl患者和3名(20.0%)rt患者(全部pr)中(表2)。在pd
‑
l1 ihc和gep均可用的dlbcl患者中,4/17gcb患者(1名cr,2名pr,1名sd)、1/3abc患者(pd)和1/3居间患者(pd)具有pd
‑
l1升高。
[0172]
在dlbcl中,在反应者中对比在无反应者中,更频繁地观察到升高的pd
‑
l1,但这在总体上不具有统计学显著性(62.5%对比18.8%,p=0.06);升高的pd
‑
l1还与cr显著相关(37.5%对比0;p=0.03[fisher精确检验])。
[0173]
在dlbcl患者(n=26)(图2)中,以及在具有升高的pd
‑
l1的gcb
‑
dlbcl亚型(n=17)患者(图3)中,与不具有升高的那些患者相比,存在pfs改善的趋势。
[0174]
表2.通过ihc和肿瘤类型评估的pd
‑
l1表达*
[0175][0176]
*基于所考虑的测定,患者数量在不同结果之间略有不同。
[0177]
fl患者和rt患者中的pd
‑
l1反应和生存期
[0178]
在fl患者中不能评估pfs改善的趋势,因为通过ihc,只有1名fl患者对pd
‑
l1呈阳性。在rt中,13/16的可评估患者作出反应,但仅3/15的具有ihc数据的患者具有升高的pd
‑
l1水平;pd
‑
l1升高的所有患者均实现了pr。这些患者中的所有3名均具有持久的pfs和os,并且在临床截止时依然存活,但由于数量少,因此不可能存在显著的相关性。
[0179]
结论
[0180]
在该研究中,pd
‑
l1表达升高的dlbcl患者表现出对用依鲁替尼和纳武单抗治疗作出更好的反应以及出现更长的生存期的趋势,但患者数量少并且仅对cr实现了显著性。
[0181]
依鲁替尼和纳武单抗治疗的安全性与单一药剂依鲁替尼相当,并且滤泡性淋巴瘤(fl)的总反应率(orr)为32.5%,弥漫性大b细胞淋巴瘤(dlbcl)的总反应率为35.6%,并且richter转化(rt)的总反应率为65.0%。
[0182]
在27名具有可评估的gep数据和反应者/无反应者状态的dlbcl患者中,orr为29.6%,但这些患者中的大多数为gcb亚型(orr 33.3%),其中先前仅报道了使用单一药剂依鲁替尼的orr为5%。abc亚型患者太少,因而不能进行稳健分析。
[0183]
rt中的临床反应(历史上用单一药剂依鲁替尼或化学疗法的结果很差)超过预期:在经过筛选和接受治疗的患者中orr为65.0%,并且在具有gep数据的患者中orr为81.3%;虽然通过ihc仅有3名患者具有升高的pd
‑
l1,但所有这3名患者均具有持久的pr。
[0184]
pd
‑
1通常通过限制tfh细胞上的cxcr3表达,来有助于将tfh细胞浓缩在gc中。本文的结果表明,可能存在其疾病主要受到tfh细胞活性驱使的gcb
‑
dlbcl患者的不同亚组;在这些患者中,抗pd
‑
1疗法有可能通过抑制tfh细胞与b细胞之间的pd
‑
l1/pd
‑
1相互作用来减少gc中的恶性b细胞的增殖和成熟。
[0185]
外显子组和序列分析
[0186]
使用来自接受依鲁替尼和纳武单抗的组合的受试者的存档活检样品进行遗传分析。由72个福尔马林固定石蜡包埋样本生成外显子组数据,并且使用测序分析鉴定了感兴趣的基因中的突变并评定了体细胞突变负荷。通过每种组织类型中由研究者评定的反应并且通过dlbcl患者中的持续反应(无进展生存期[pfs]大于24个月的n=7对比pfs不大于24个月的n=20)来评估免疫细胞比例与基因变体的相关性。评估总反应率(orr)。
[0187]
反应者对比无反应者
[0188]
对于26名dlbcl患者(10名反应者(5名cr,5名pr)、16名无反应者)、16名gcb dlbcl患者(6名反应者(2名cr,4名pr)、10名无反应者)、26名fl患者(12名反应者(3名cr,9名pr)、14名无反应者)和17名rt患者(13名反应者(2名cr,11名pr)、4名无反应者),有基因变体和反应数据可用。结果在表3至表16中提供。
[0189]
下面的表3和表4提供了在患有dlbcl的反应者或无反应者中突变更频繁的基因的突变频率和特定基因突变,其中使用fisher精确检验评估了显著性。
[0190]
表3.dlbcl患者中针对基于fisher精确检验结果所选择的基因的反应数据
[0191][0192]
*fisher精确检验结果
[0193]
表4.dlbcl患者中针对基于fisher精确检验结果所选择的基因的基因变体
[0194]
基因转录物id等位基因密码子变化aa变化反应组camta1enst00000303635c/tgcg/gtga385v反应者camta1enst00000303635g/agac/aacd486n反应者dido1enst00000266070c/acag/catq1539h反应者dido1enst00000266070g/acga/tgar1835*反应者ebf1enst00000313708g/acgc/tgcr163c无反应者ebf1enst00000313708t/cgaa/ggae17g无反应者ebf1enst00000313708a/gtgt/cgtc164r无反应者ebf1enst00000313708a/tatg/aagm232k无反应者gigyf2enst00000421778a/gatg/gtgm1v反应者gigyf2enst00000452341a/gaga/ggar851g反应者klhl14enst00000583263g/acca/tcap20s反应者klhl14enst00000359358c/agag/gate140d反应者klhl14enst00000359358t/caac/gacn124d反应者
klhl14enst00000359358c/aaag/aatk187n反应者klhl14enst00000359358c/tcgc/cacr452h反应者nacaenst00000454682g/ccag/gagq55e反应者nacaenst00000454682c/aagg/atgr502m反应者rnf213enst00000508628g/cgaa/caae4942q反应者rnf213enst00000508628c/tgcc/gtca2744v反应者rnf213enst00000508628c/actc/atcl4751i反应者rnf213enst00000508628g/acgt/catr4252h反应者selpenst00000263686c/agtg/ttgv758l反应者selpenst00000263686g/atcg/ttgs385l反应者zmym4enst00000314607g/agac/aacd1541n反应者zmym4enst00000314607a/gact/gctt313a反应者
[0195]
*获得的终止密码子。
[0196]
下面的表5和表6提供了在患有dlbcl的反应者或无反应者中突变最频繁的基因的突变频率和特定基因突变。
[0197]
表5.dlbcl患者中针对基于在反应者或无反应者中具有高频率变体所选择的基因的反应数据
[0198][0199]
表6.dlbcl患者中针对基于在反应者或无反应者中具有高频率变体所选择的基因的基因变体
[0200][0201]
[0202]
*获得的终止密码子;**丢失的起始密码子。
[0203]
反应者对比无反应者
‑
在dlbcl中,在反应者中观察到的最常见基因变体包括klhl14(n=3)、rnf213(n=4)、csmd3(n=3)、bcl2(n=3)、nbpf1(n=3)和lrp1b(n=3)。相反地,在无反应者中观察到的最常见基因变体包括tp53(n=3)、ebf1(n=4)、adamts20(n=3)、akap9(n=3)和socs1(n=3),以及bcr途径中的基因,诸如tnfrsf14(n=3)、myd88(n=2)和nfkb1b(n=2)。观察到反应者与无反应者之间基因变体频率的最大差异在于klhl14突变(3/10(30.0%)对比0/16;比值比(or)(95%置信区间(ci))inf[0.730
–
inf];p=0.046),以及rnf213突变(4/10(40.0%)对比1/16(6.2%);or(95%ci)9.053(0.711
–
522.371);p=0.055)。因此,在dlbcl患者中,具有rnf213突变和klhl14突变的那些更可能对依鲁替尼 纳武单抗作出反应。
[0204]
下面的表7和表8提供了在患有fl的反应者或无反应者中突变更频繁的基因的突变频率和特定基因突变,其中使用fisher精确检验评估了显著性。
[0205]
表7.fl患者中针对基于fisher精确检验结果所选择的基因的反应数据
[0206][0207]
*fisher精确检验结果
[0208]
表8.fl患者中针对基于fisher精确检验结果所选择的基因的基因变体
[0209]
[0210][0211]
下面的表9和表10提供了在患有fl的反应者或无反应者中突变最频繁的基因的突变频率和特定基因突变。
[0212]
表9.fl患者中针对基于在反应者或无反应者中具有高频率变体所选择的基因的反应数据
[0213]
[0214][0215]
表10.fl患者中针对基于在反应者或无反应者中具有高频率变体所选择的基因的基因变体
[0216]
[0217]
[0218][0219]
*获得的终止密码子。
[0220]
反应者对比无反应者
‑
在fl患者中,在反应者中观察到的最常见基因变体为bcl2(n=9)、crebbp(n=7)、kmt2d(n=6)、muc17(n=4)、ciita(n=3)、fes(n=3)、ncoa2(n=3)和tpr(n=3)。在无反应者中观察到的最常见基因变体为crebbp(n=9)、kmt2d(n=5)、bcl2(n=4)、stat6(n=4)、nbpf1(n=4)和ezh2(n=4)。反应者与无反应者之间基因变体频率的差异对于bcl2是显著的(9/12(75%)对比4/14(28.6%);or(95%ci)6.847(1.019
–
62.695);p=0.047)。
[0221]
下面的表11和表12提供了在患有rt的反应者或无反应者中突变更频繁的基因的突变频率和特定基因突变,其中使用fisher精确检验评估了显著性。
[0222]
表11.rt患者中针对基于fisher精确检验结果所选择的基因的反应数据
[0223][0224]
*fisher精确检验结果
[0225]
表12.rt患者中针对基于fisher精确检验结果所选择的基因的基因变体
[0226][0227][0228]
*获得的终止密码子。
[0229]
下面的表13和表14提供了在患有rt的反应者或无反应者中突变最频繁的基因的突变频率和特定基因突变。
[0230]
表13.rt患者中针对基于在反应者或无反应者中具有高频率变体所选择的基因的反应数据
[0231][0232]
表14.rt患者中针对基于在反应者或无反应者中具有高频率变体所选择的基因的基因变体
[0233][0234][0235]
反应者对比无反应者
–
在rt中,在反应者中观察到的最常见基因变体包括irf2bp2、nbpf1、klhl6、setx和sf3b1(全部n=3),而在无反应者中观察到的最常见基因变体为ros1、igll5和pask(全部n=2)。反应者与无反应者之间基因变体频率的差异对于ros1是显著的(0/13对比2/4(50%);or(95%ci)0.000(0.000
–
1.431);p=0.044)。
[0236]
下面的表15和表16提供了在患有gcb
‑
dlbcl的反应者或无反应者中突变最频繁的基因的突变频率和特定基因突变。
[0237]
表15.gcb
‑
dlbcl患者中针对基于在反应者或无反应者中具有高频率变体所选择
的基因的反应数据
[0238]
基因反应者无反应者csmd30/6(0.0%)5/10(50.0%)bcl21/6(16.7%)6/10(60.0%)kmt2d1/6(16.7%)6/10(60.0%)crebbp0/6(0.0%)4/10(40.0%)ebf10/6(0.0%)4/10(40.0%)sgk10/6(0.0%)4/10(40.0%)rnf2132/6(33.3%)1/10(10.0%)nbpf12/6(33.3%)1/10(10.0%)
[0239]
表16.gcb
‑
dlbcl患者中针对基于在反应者或无反应者中具有高频率变体所选择的基因的基因变体
[0240]
[0241][0242]
反应者对比无反应者
–
在gcb
‑
dlbcl中,在反应者(n=6)中观察到的最常见基因突变包括rnf213(n=2)和nbpf1(n=2)。在无反应者(n=10)中,最常见基因突变为kmt2d(n=6)、bcl2(n=6)、csmd3(n=5)、crebbp(n=4)、ebf1(n=4)和sgk1(n=4)。在具有gcb亚型的反应者与无反应者之间没有基因变体频率的显著差异(数据未示出)。
[0243]
体细胞突变负荷
‑
在患有dlbcl、fl或rt的反应者与无反应者之间未观察到总体细胞突变计数的显著差异,但是在gcb dlbcl中,反应者中的该计数显著低于无反应者中的该计数(p=0.003)(数据未示出)。体细胞突变变体的数量在pfs大于24个月的dlbcl患者中对
比pfs不大于24个月的dlbcl患者显著较低(p=0.0288)(数据未示出)。
[0244]
无进展生存期(pfs)持续时间大于(>)24个月(ongoing24)
[0245]
分析了dlbcl患者中大于24个月对比不大于24个月的pfs持续时间。结果在下面的表17和表18中提供。
[0246]
表17.dlbcl患者中针对基于在具有大于24个月的pfs持续时间的患者组或具有较短pfs的患者组中具有高频率变体所选择的基因的pfs24突变频率数据
[0247][0248]
表18.dlbcl患者中针对基于在具有大于24个月的pfs持续时间的患者组或具有较短pfs的患者组中具有高频率变体所选择的基因的基因变体
[0249]
[0250]
[0251][0252]
*获得的终止密码子;**丢失的起始密码子。
[0253]
在dlbcl中pfs持续时间大于24个月对比pfs持续时间不大于24个月
‑
在dlbcl中,pfs大于24个月的患者中的最常见基因突变为rnf213、nbpf1和bcl2(各自为3/7[42.9%]),并且pfs不大于24个月的患者中的最常见基因突变为kmt2d(8/20[40.0%])和csmd3(8/20[40.0%])。在反应者中对比在无反应者中,体细胞突变负荷较低,尤其是在生发中心b细胞dlbcl中,以及在pfs大于24个月的dlbcl患者中(对比在pfs不大于24个月的dlbcl患者中)。
[0254]
上述分析鉴定了dlbcl患者、fl患者和rt患者之中与使用依鲁替尼和纳武单抗的组合时的反应或持久的pfs相关联的基因变异。虽然依鲁替尼抑制布鲁顿酪氨酸激酶依赖性途径,但鉴定了可能影响治疗结果的替代性基因途径变体。免疫细胞浸润到微环境中涉及用该免疫组合进行的差异治疗反应,并且是组织学依赖性的。
[0255]
基线tp53突变和分子缓解是在复发性/难治性dlbcl中受益于依鲁替尼治疗的预后生物标志物
[0256]
基线tp53突变和2个疗程的化学免疫疗法后ctdna载量的2
‑
log
10
下降(分子缓解,mr)均是未治疗的弥漫性大b细胞淋巴瘤(dlbcl)中的预后生物标志物。它们在用靶向药剂治疗复发性dlbcl的情况下的预后价值仍然知之甚少。lym1002试验是预期的1/2a期研究,旨在测试依鲁替尼加纳武单抗的组合在复发性/难治性b细胞恶性肿瘤中的安全性和活性。这里,通过使用ctdna测试了在lym1002试验中用依鲁替尼加纳武单抗治疗的dlbcl中的基线突变和mr的预后影响。
[0257]
方法
[0258]
该辅助生物学研究的纳入标准是在基线和c3d1处采集的血液的可用性。在可用的情况下,在疾病进展/疗法结束时采集的血液也包括在该分析中。使用capp
‑
seq来进行ctdna基因分型和ctdna定量。测定灵敏度为0.3%。
[0259]
结果
[0260]
在lym1002试验中招募的37名复发性/难治性dlbcl患者中,27名符合纳入标准。与研究队列中gcb dlbcl的相对富集(gcb 78%对比abc 5%对比居间17%)一致,在大于10%的患者中反复地受到非同义体细胞突变影响的基因包括hist1h1e、kmt2d、mef2b tp53、bcl2、btg1、ep300、znf292、mga、hist1h1c、xpo1、btg1、card11、crebbp、ezh2、pim1、ciita、ddx3x、myc、tnfrsf14。考虑到在大于10%的病例中突变的基因之后,仅tp53突变状态与较差的无进展生存期显著相关(在tp53突变病例中的0%具有12个月的pfs,对比在tp53野生型病例中的53.6%具有12个月的pfs;p=0.002)(图4a)。在2个疗程的依鲁替尼加纳武单抗后ctdna的2
‑
log
10
下降(mr)与较长的pfs相关联(66.7%对比21.4%具有12个月的pfs;p=0.05)(图4b)。特征在于基线时的野生型tp53和2个疗程的依鲁替尼加纳武单抗(19%的病
例)后mr的复发性/难治性dlbcl亚组示出颇有前途的持久缓解(12个月的pfs:80%;p=0.06)(图4c)。在进展时采集了ctdna的10名患者中,b细胞受体信号传导基因中的有限比例(2个病例;20%)获得突变,包括一名患者中的btk和plcg2,以及第二名患者中的foxo1。在来自患有dlbcl的受试者的ctdna样品中观察到的tp53突变提供于表19中。
[0261]
在lym1002试验中招募的20名从慢性淋巴细胞性白血病(cll)转化的dlbcl(也称为richter综合征)患者中,14名符合纳入标准。在大于10%的患者中反复地受到非同义体细胞突变影响的基因为tp53、notch1、hist1h1e、egr2、sf3b1、atm、asxl1、chek2、mga、nras。与原发dlbcl不同,基线tp53突变并不显著影响用依鲁替尼加纳武单抗治疗的richter综合征中的pfs(图4d),这与依鲁替尼至少部分地克服了cll中tp53异常的负面影响的观念一致。此外,与依鲁替尼不根除cll中的微小残留病变的观念一致,仅一名richter综合征患者在2个疗程后达到mr(图4e)。
[0262]
结论
[0263]
基线tp53突变状态和2个疗程后的mr是在复发性/难治性dlbcl而非richter综合征中受益于依鲁替尼治疗的预后生物标志物。
[0264][0265]
本领域的技术人员将会知道,可以对本发明的优选实施方案作出许多改变和修改,而且此类改变和修改可以在不脱离本发明实质的情况下进行。因此,所附权利要求书旨在覆盖落入本发明的真实实质和范围内的所有此类等同变化。
[0266]
本文档所引用或描述的每项专利、专利申请和公布的公开内容均据此全文以引用方式并入本文。
[0267]
实施方案
[0268]
实施方案的以下列表旨在补充而不是替换或取代先前的描述。
[0269]
实施方案1.一种治疗受试者的b细胞恶性肿瘤的方法,所述方法包括:
[0270]
向所述受试者施用治疗有效量的依鲁替尼和抗pd
‑
1抗体的组合,从而治疗所述b细胞恶性肿瘤,其中:
[0271]
a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0272]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自rnf213、nbpf1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表16中;
[0273]
c)所述b细胞恶性肿瘤为fl并且所述受试者在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0274]
d)所述b细胞恶性肿瘤为rt并且所述受试者在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0275]
实施方案2.根据实施方案1所述的方法,其中所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表4或表6中。
[0276]
实施方案3.根据实施方案2所述的方法,其中所述受试者在klhl14、rnf213或它们的组合中具有一个或多个突变,其中所述一个或多个突变列于表4或表6中。
[0277]
实施方案4.根据实施方案1所述的方法,其中所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自rnf213、nbpf1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表16中。
[0278]
实施方案5.根据实施方案1所述的方法,其中所述b细胞恶性肿瘤为fl并且所述受试者在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表8或表10中。
[0279]
实施方案6.根据实施方案5所述的方法,其中所述受试者在bcl2中具有一个或多个突变,其中所述一个或多个突变列于表8或表10中。
[0280]
实施方案7.根据实施方案1所述的方法,其中所述b细胞恶性肿瘤为rt并且所述受试者在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0281]
实施方案8.一种治疗受试者的b细胞恶性肿瘤的方法,所述方法包括:
[0282]
向所述受试者施用治疗有效量的依鲁替尼和抗pd
‑
1抗体的组合,从而治疗所述b细胞恶性肿瘤,其中:
[0283]
a)所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0284]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突
变列于表16中;
[0285]
c)所述b细胞恶性肿瘤为fl并且所述受试者在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0286]
d)所述b细胞恶性肿瘤为rt并且所述受试者在选自ros1、igll5、pask或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0287]
实施方案9.根据实施方案8所述的方法,其中所述b细胞恶性肿瘤为dlbcl并且所述受试者在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表4或表6中。
[0288]
实施方案10.根据实施方案8所述的方法,其中所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述受试者在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表16中。
[0289]
实施方案11.根据实施方案8所述的方法,其中所述b细胞恶性肿瘤为fl并且所述受试者在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表8或表10中。
[0290]
实施方案12.根据实施方案8所述的方法,其中所述b细胞恶性肿瘤为rt并且所述受试者在选自ros1、igll5、pask或它们的组合的基因中不具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0291]
实施方案13.根据实施方案12所述的方法,其中所述受试者在ros1中不具有一个或多个突变,其中所述一个或多个突变列于表12或表14中。
[0292]
实施方案14.根据前述实施方案中任一项所述的方法,其中依鲁替尼和所述抗pd
‑
1抗体的所述组合的所述治疗有效量包括560mg的所述依鲁替尼和3mg/kg的所述抗pd
‑
1抗体。
[0293]
实施方案15.根据前述实施方案中任一项所述的方法,其中所述抗pd
‑
1抗体静脉内施用,并且所述依鲁替尼口服施用。
[0294]
实施方案16.根据实施方案15所述的方法,其中所述抗pd
‑
1抗体以14天为周期施用并且所述依鲁替尼每天施用一次。
[0295]
实施方案17.根据前述实施方案中任一项所述的方法,其中所述抗pd
‑
1抗体是纳武单抗。
[0296]
实施方案18.根据前述实施方案中任一项所述的方法,其中所述治疗导致所述受试者的完全反应(cr)或部分反应(pr)。
[0297]
实施方案19.根据前述实施方案中任一项所述的方法,其中所述受试者:
[0298]
a)患有dlbcl、fl或rt(仅从cll/sll转化);
[0299]
b)接受过≥1种在先疗法(对于fl,≥2种在先疗法),但在先治疗线不超过4条;
[0300]
c)具有≤2的东部肿瘤协作组(ecog)体能状态得分;
[0301]
d)患有可测量的疾病;以及
[0302]
e)先前没有接受过依鲁替尼疗法或抗pd
‑
1疗法。
[0303]
实施方案20.一种预测患有b细胞恶性肿瘤的受试者对依鲁替尼和抗pd
‑
1抗体的组合的反应性的可能性的方法,其中:
[0304]
a)所述b细胞恶性肿瘤为dlbcl并且所述方法包括分析来自所述受试者的样品的在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0305]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述方法包括分析来自所述受试者的样品的在选自rnf213、nbpf1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表16中;
[0306]
c)所述b细胞恶性肿瘤为fl并且所述方法包括分析来自所述受试者的样品的在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0307]
d)所述b细胞恶性肿瘤为rt并且所述方法包括分析来自所述受试者的样品的在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表12或表14中;
[0308]
其中所述基因中的所述一个或多个突变指示对所述组合的反应性。
[0309]
实施方案21.根据实施方案20所述的方法,其中所述b细胞恶性肿瘤为dlbcl并且所述方法包括分析来自所述受试者的样品的在选自klhl14、rnf213、csmd3、bcl2、nbpf1、lrp1b或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表4或表6中,并且所述基因中的所述一个或多个突变指示对所述组合的反应性。
[0310]
实施方案22.根据实施方案21所述的方法,其中所述方法包括分析来自所述受试者的样品的在选自klhl14、rnf213或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表4或表6中,并且所述基因中的所述一个或多个突变指示对所述组合的反应性。
[0311]
实施方案23.根据实施方案20所述的方法,其中所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述方法包括分析来自所述受试者的样品的在选自rnf213、nbpf1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表16中,并且所述基因中的所述一个或多个突变指示对所述组合的反应性。
[0312]
实施方案24.根据实施方案20所述的方法,其中所述b细胞恶性肿瘤为fl并且所述方法包括分析来自所述受试者的样品的在选自bcl2、crebbp、kmt2d、muc17、ciita、fes、ncoa2、tpr或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表8或表10中,并且所述基因中的所述一个或多个突变指示对所述组合的反应性。
[0313]
实施方案25.根据实施方案24所述的方法,其中所述方法包括分析来自所述受试者的样品的在bcl2中的一个或多个突变,其中所述一个或多个突变列于表8或表10中,并且所述基因中的所述一个或多个突变指示对所述组合的反应性。
[0314]
实施方案26.根据实施方案20所述的方法,其中所述b细胞恶性肿瘤为rt并且所述方法包括分析来自所述受试者的样品的在选自irf2bp2、nbpf1、klhl6、setx、sf3b1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表12或表14中,并且所述基因中的所述一个或多个突变指示对所述组合的反应性。
[0315]
实施方案27.一种预测患有b细胞恶性肿瘤的受试者对依鲁替尼和抗pd
‑
1抗体的组合的无反应性的可能性的方法,其中:
[0316]
a)所述b细胞恶性肿瘤为dlbcl并且所述方法包括分析来自所述受试者的样品的
在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表4或表6中;
[0317]
b)所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述方法包括分析来自所述受试者的样品的在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表16中;
[0318]
c)所述b细胞恶性肿瘤为fl并且所述方法包括分析来自所述受试者的样品的在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表8或表10中;或者
[0319]
d)所述b细胞恶性肿瘤为rt并且所述方法包括分析来自所述受试者的样品的在选自ros1、igll5、pask或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表12或表14中;
[0320]
其中所述基因中的所述一个或多个突变指示对所述组合的无反应性。
[0321]
实施方案28.根据实施方案27所述的方法,其中所述b细胞恶性肿瘤为dlbcl并且所述方法包括分析来自所述受试者的样品的在选自tp53、ebf1、adamts20、akap9、socs1、tnfrsf14、myd88、nfkb1b或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表4或表6中,并且所述基因中的所述一个或多个突变指示对所述组合的无反应性。
[0322]
实施方案29.根据实施方案27所述的方法,其中所述b细胞恶性肿瘤为gcb
‑
dlbcl并且所述方法包括分析来自所述受试者的样品的在选自kmt2d、bcl2、csmd3、crebbp、ebf1、sgk1或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表16中,并且所述基因中的所述一个或多个突变指示对所述组合的无反应性。
[0323]
实施方案30.根据实施方案27所述的方法,其中所述b细胞恶性肿瘤为fl并且所述方法包括分析来自所述受试者的样品的在选自crebbp、kmt2d、bcl2、stat6、nbpf1、ezh2或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表8或表10中,并且所述基因中的所述一个或多个突变指示对所述组合的无反应性。
[0324]
实施方案31.根据实施方案27所述的方法,其中所述b细胞恶性肿瘤为rt并且所述方法包括分析来自所述受试者的样品的在选自ros1、igll5、pask或它们的组合的基因中的一个或多个突变,其中所述一个或多个突变列于表12或表14中,并且所述基因中的所述一个或多个突变指示对所述组合的无反应性。
[0325]
实施方案32.根据实施方案31所述的方法,其中所述方法包括分析来自所述受试者的样品的在ros1中的一个或多个突变,其中所述一个或多个突变列于表12或表14中,并且所述一个或多个突变指示对所述组合的无反应性。
[0326]
实施方案33.根据实施方案20至32中任一项所述的方法,其中所述受试者:
[0327]
a)患有dlbcl、fl或rt(仅从cll/sll转化);
[0328]
b)接受过≥1种在先疗法(对于fl,≥2种在先疗法),但在先治疗线不超过4条;
[0329]
c)具有≤2的东部肿瘤协作组(ecog)体能状态得分;
[0330]
d)患有可测量的疾病;以及
[0331]
e)先前没有接受过依鲁替尼疗法或抗pd
‑
1疗法。
[0332]
实施方案34.根据实施方案20至33中任一项所述的方法,还包括向所述受试者施
用治疗有效量的依鲁替尼和抗pd
‑
1抗体的所述组合,从而治疗所述b细胞恶性肿瘤,条件是所述受试者在基因中具有指示对所述组合的反应性的所述一个或多个突变,以及/或者在基因中缺少指示对所述组合的无反应性的所述一个或多个突变。
[0333]
实施方案35.根据实施方案34所述的方法,其中依鲁替尼和所述抗pd
‑
1抗体的所述组合的所述治疗有效量包括560mg的所述依鲁替尼和3mg/kg的所述抗pd
‑
1抗体。
[0334]
实施方案36.根据实施方案34或35所述的方法,其中所述抗pd
‑
1抗体静脉内施用,并且所述依鲁替尼口服施用。
[0335]
实施方案37.根据实施方案36所述的方法,其中所述抗pd
‑
1抗体以14天为周期施用并且所述依鲁替尼每天施用一次。
[0336]
实施方案38.根据实施方案34至37中任一项所述的方法,其中所述抗pd
‑
1抗体是纳武单抗。
[0337]
实施方案39.根据实施方案34至38中任一项所述的方法,其中所述治疗导致所述受试者的完全反应(cr)或部分反应(pr)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。