1.本技术属于生物医药技术领域,具体涉及用于消化道肿瘤药物筛选的腹水肿瘤模型、构建方法、应用。
背景技术:
2.恶性腹水为进展期恶性肿瘤侵袭和转移的一个突出临床表现,严重影响患者的生存质量,危及患者的生命,一旦形成,预后很差。尤其是消化道肿瘤合并恶性腹水,中位生存期大约数周至数月,其治疗也成为临床医生棘手为题。近年来,对于腹水的形成机制以及诊断治疗倍受关注。随着新证据、新理念的发展,对消化道肿瘤患者预后的判断标准等也有了新的认识。
3.消化道肿瘤患者的治疗依然是生物医药领域面临的亟待解决的问题之一。
技术实现要素:
4.有鉴于此,一方面,一些实施例公开了用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法,该构建方法包括:
5.收集消化道肿瘤患者的腹水;
6.用磁珠法纯化腹水获得非免疫细胞;
7.将获得的非免疫细胞接种至高度免疫缺陷动物体内;
8.饲养接种有非免疫细胞的动物,在动物体内形成瘤体,并对具有瘤体的动物进行筛选,获得具有消化道肿瘤特性的动物模型。
9.进一步,一些实施例公开的用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法,非免疫细胞为磁珠阴性筛选得到的人cd45细胞。
10.一些实施例公开的用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法,动物为npi小鼠。
11.一些实施例公开的用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法,瘤体的体积控制在600~800mm3之间。
12.一些实施例公开的用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法,通过双色流式分析对具有瘤体的动物进行筛选。
13.一些实施例公开的用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法,对动物的筛选进一步包括str检测。
14.一些实施例公开的用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法,动物的饲养周期控制在60~120天。
15.一些实施例公开的用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法,将获得的非免疫细胞接种至高度免疫缺陷动物皮下。
16.另一方面,一些实施例公开了用于消化道肿瘤药物筛选的腹水肿瘤模型,该肿瘤模型为用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法得到的具有消化道肿瘤特性的
动物模型。
17.再一方面,一些实施例公开了腹水肿瘤模型的应用,腹水肿瘤模型用于筛选消化道肿瘤药物,具体包括:
18.获得消化道肿瘤特性的动物模型;
19.剥离瘤体,将瘤体切割为符合接种要求的瘤体样本;
20.将瘤体样本接种到动物体内,针对消化道肿瘤药物进行药效学测试,筛选药效符合要求的消化道肿瘤药物。
21.本技术实施例公开的用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法,得到了具有消化道肿瘤特性的人源异体移植动物模型,能够用于对多种药物和联合用药进行测试,并对消化道肿瘤药物进行有效筛选。
附图说明
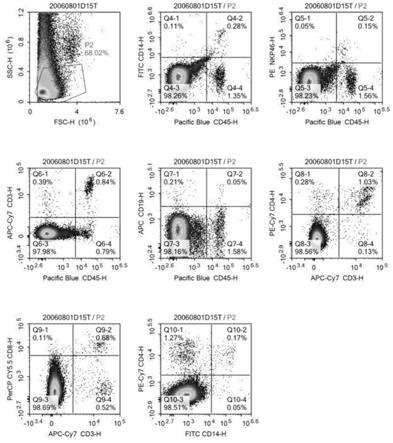
22.图1实施例1腹水流式分析图;
23.图2实施例1瘤体生长曲线;
24.图3实施例1确定瘤体cd19/cd45双色流式分析图;
25.图4实施例1确定瘤体的病理诊断he染色图;
26.图5实施例2利用消化道肿瘤动物模型筛选药物第一轮结果图;
27.图6实施例2利用消化道肿瘤动物模型筛选药物第二轮结果图。
具体实施方式
28.在这里专用的词“实施例”,作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。本技术实施例中性能指标测试,除非特别说明,采用本领域常规试验方法。应理解,本技术中所述的术语仅仅是为描述特别的实施方式,并非用于限制本技术公开的内容。
29.除非另有说明,否则本文使用的技术和科学术语具有本技术所属技术领域的普通技术人员通常理解的相同含义;作为本技术中其它未特别注明的试验方法和技术手段均指本领域内普通技术人员通常采用的实验方法和技术手段。
30.本文所用的术语“基本”和“大约”用于描述小的波动。例如,它们可以是指小于或等于
±
5%,如小于或等于
±
2%,如小于或等于
±
1%,如小于或等于
±
0.5%,如小于或等于
±
0.2%,如小于或等于
±
0.1%,如小于或等于
±
0.05%。在本文中以范围格式表示或呈现的数值数据,仅为方便和简要起见使用,因此应灵活解释为不仅包括作为该范围的界限明确列举的数值,还包括该范围内包含的所有独立的数值或子范围。例如,“1~5%”的数值范围应被解释为不仅包括1%至5%的明确列举的值,还包括在所示范围内的独立值和子范围。因此,在这一数值范围中包括独立值,如2%、3.5%和4%,和子范围,如1%~3%、2%~4%和3%~5%等。这一原理同样适用于仅列举一个数值的范围。此外,无论该范围的宽度或所述特征如何,这样的解释都适用。
31.在本文中,包括权利要求书中,连接词,如“包含”、“包括”、“带有”、“具有”、“含有”、“涉及”、“容纳”等被理解为是开放性的,即是指“包括但不限于”。连接词“由
……
构成”和“由
……
组成”是封闭连接词。
32.为了更好的说明本技术内容,在下文的具体实施例中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本技术同样可以实施。在实施例中,对于本领域技术人员熟知的一些方法、手段、仪器、设备等未作详细描述,以便凸显本技术的主旨。
33.在不冲突的前提下,本技术实施例公开的技术特征可以任意组合,得到的技术方案属于本技术实施例公开的内容。
34.在一些实施方式中,用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法,包括:
35.收集消化道肿瘤患者的腹水;
36.用磁珠法纯化腹水获得非免疫细胞;
37.将获得的非免疫细胞接种至高度免疫缺陷动物体内;
38.饲养接种有非免疫细胞的小鼠,在动物体内形成瘤体,并对具有瘤体的动物进行筛选,获得具有消化道肿瘤特性的小鼠模型。
39.发明人研究发现,将从腹水中纯化获得的非免疫细胞接种到免疫缺陷小鼠体内,能够在小鼠体内生长具有消化道肿瘤特性的人源异体移植肿瘤模型,在保留了肿瘤模型的生物学特征和对药物的反应特征基础上,筛选具有消化道肿瘤特性的小鼠个体,获得具有消化道肿瘤特性的小鼠模型,能够利用该小鼠模型对多种药物和联合用药方法进行测试,找到准确的个体用药方案,以获得最好的临床疗效,进而可以有效引导消化道肿瘤患者的个体化癌症治疗,增加患者的生存期。
40.小鼠作为接种动物,生长周期短,瘤体成长速度快,能够有效缩短模型构建时间,提高模型构建的成功率。进一步作为可选实施例,选用npi小鼠,其具有高度免疫缺陷,背景单一,对于异种移植的排异性较低,异种移植成活率高、寿命长,有利于模型构建的成功率,更加有利于后期进行药物评价试验。
41.作为可选实施例,腹水肿瘤模型构建过程中,小鼠体内生长的瘤体体积控制在600~800mm3之间,有利于对瘤体进行准确的判断,瘤体体积过小,则瘤体的病例辨识度不高,难以对瘤体的类别进行准确判断,瘤体体积过大,则肿瘤缺血坏死。
42.发明人发现,腹水肿瘤模型构建过程中,小鼠的饲养周期控制在60~120天可以有效控制瘤体体积在600~800mm3之间。
43.作为可选实施例,非免疫细胞为磁珠阴性筛选得到的人cd45细胞。
44.发明人发现,利用磁珠从腹水中纯化获得非免疫细胞,有利于非免疫细胞在被接种动物体内快速生长,提高模型构建的成功率和构建速率。
45.发明人进一步发现,通过双色流式分析对具有瘤体的小鼠进行筛选,例如通过cd19/cd45双色流式染色分析,cd19/cd45双色流式分析结果可提供免疫细胞浸润信息,可从免疫细胞浸润角度判断瘤体是否来源于非免疫细胞,准确度高,进而获得具有消化道肿瘤小鼠模型的成功率高,后续小鼠模型用于筛选药物,筛药结果的可信度进一步提高。
46.发明人进一步发现,对小鼠的筛选进一步通过str检测进行,str检测可从基因的角度判定瘤体样本的来源以及样本的基因表达信息,进而从细胞形态、生化信息以及基因表达信息同时判断,对瘤体样本的种类的判定更将准确,避免消化道肿瘤动物模型误建,而导致更为严重的筛药实验的失败。通过str检测可以从基因的角度判定瘤体与腹水纯化获得的非免疫细胞是否来源于相同个体,进而进一步提高模型构建的成功率。后续将构建的小鼠模型用于药物筛选,可以进一步提高筛选结果的可信度。
47.作为可选实施例,将获得的非免疫细胞接种至高度免疫缺陷小鼠皮下。皮下接种有利于接种细胞在被接种动物体内的存活和生长,有利于进一步提高模型构建的成功率。
48.一些实施例公开的用于消化道肿瘤药物筛选的腹水肿瘤模型,由用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法得到,该肿瘤模型为具有消化道肿瘤特性的人源异体移植小鼠模型。
49.一些实施例公开了腹水肿瘤模型的应用,将腹水肿瘤模型用于筛选消化道肿瘤药物,具体包括:
50.获得消化道肿瘤特性的小鼠模型;
51.剥离瘤体,将瘤体切割为符合接种要求的瘤体样本;
52.将瘤体样本接种到小鼠体内,针对消化道肿瘤药物进行药效学测试,筛选药效符合要求的消化道肿瘤药物。
53.发明人发现,作为腹水肿瘤模型的小鼠模型,能够用于对西药、中药、组合药物、联合药物的有效筛选。
54.发明人发现,作为可选实施例,利用腹水肿瘤模型构建方法获得的小鼠模型可以有效地对多种药物和联合用药方案进行测试,找出准确的个体用药方案以获得最好的胃淋巴瘤治疗效果,可以有效地引导消化道肿瘤患者的个体化癌症治疗,减少了临床用药的盲目性和降低临床用药的错误率。
55.本文公开实施例中,发明人通过把患者术中获得的新鲜腹水纯化获得的非免疫细胞接种到免疫缺陷小鼠体内,待成瘤后,对成瘤小鼠进行筛选,获得的消化道肿瘤小鼠模型可以用于进行药物筛选实验,找出准确的个体用药方案以获得最好临床疗效。将患者手术中获得的新鲜的腹水纯化获得的非免疫细胞接种到免疫缺陷小鼠身上,在小鼠体内重建了患者自身的肿瘤模型,能最好地保留肿瘤组织的生物学特征和对药物的反应特征,因此可以更准确地预测药物疗效,并可以避免无效化学治疗和可能的毒副作用。
56.需要说明的是,本文述及的“接种”操作,不受特别限制,本领域技术人员即可轻松完成,不需特别的专业培训。
57.本文公开的腹水肿瘤模型,一方面用于治疗消化道肿瘤药物或药物联合的筛选,另一方面,用于消化道肿瘤静脉血肿瘤模型的构建方法也间接用于消化道肿瘤患者的预后判定。
58.另外,需要说明的是,在利用本文公开的方法所获得的消化道肿瘤小鼠模型进行抗肿瘤治疗方案筛选时,所采用的抗肿瘤治疗方案筛选包括消化道肿瘤药物的筛选、给药剂量的筛选、化疗方案的筛选、放疗的筛选、给药期间的管理等。其中,本领域技术人员可以采用任何本领域中常规使用的疗法或者正在研发中的药物作为候选疗法,另外,本领域技术人员也可以采用不同剂量的现有药物进行不同给药周期和剂量的研究。抗肿瘤药物包括西药、中药,其类型并不受特别限制,例如适于化疗、分子靶向治疗、免疫治疗等的药物都包括在本文公开的抗肿瘤药物之内。按照临床制定的治疗方案,可以根据不同药物的给药途径确定实验动物的给药方式,包括口服、皮下注射、静脉注射等,给药频率按照患者临床用药方式进行。
59.以下结合实施例对技术细节做进一步示例性说明。
60.实施例1
61.用于消化道肿瘤药物筛选的腹水肿瘤模型构建
62.本实施例1中,用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法包括:
63.实验材料
64.临床提供新鲜腹水,4℃运输。
65.实验动物
66.·
品种:npi小鼠
67.·
年龄:6~8周龄
68.·
供应商:北京艾德摩生物技术有限公司
69.·
饲养环境:北京艾德摩生物技术有限公司spf实验动物房
70.·
实验室温度:22~25℃
71.·
相对湿度:40~70%
72.·
相对空气压力:10~20pa
73.·
空气交换频率:10~15次/小时
74.·
光照循环:12小时光照(8:00
‑
20:00),12小时黑暗(20:00~8:00)
75.·
动物饲养:5只小鼠/笼,备有中央空调和空气过滤机械设备,动物笼具、饮水、垫料等均经高压蒸汽消毒,饲以spf级专用颗粒饲料,自由饮水。
76.试剂
77.抗凝剂、组织培养液、抗菌素等。
78.实验内容
79.取材:
80.·
消化道肿瘤恶性腹水患者,取得腹水;
81.·
取材后立刻置于抗凝管中,4℃运输,24小时内送达。
82.纯化:
83.·
降幅水转移至50ml离心管中,1000rpm离心5min;
84.·
吸走上清液,下次细胞用pbs(pbs 2%pen strep)重悬后离心,清洗细胞2次;
85.·
弃上清液,重悬细胞后细胞计数,取1
×
105细胞做流式检测;
86.·
根据流式结果判断进行cd45
‑
细胞的纯化;
87.·
淋巴层细胞用release human cd45 positive selection kit分离cd45 细胞和cd45
‑
细胞;
88.接种:
89.·
cd45
‑
(非免疫)细胞完成接种工作;
90.·
按5e6/只标准接种于小鼠皮下;一般地接种小鼠数量3~6只,具体数量根据细胞量决定;
91.·
cd45阳性细胞,全部用于冻存。
92.观察和测量:
93.·
接种后至实验结束前,每天观察动物状态,若发现动物生病或异常死亡,则由兽医进行处理或解剖;
94.·
肿瘤生长情况的测量:每周一次用游标卡尺测量肿瘤体积大小并进行荷瘤小鼠体重称量;
95.·
肿瘤体积计算公式:v(mm3)=(a
×
b2)/2,a:肿瘤长径,b:肿瘤短径;
96.结束实验及取材:
97.·
若接种后的第一代动物p0有肿瘤长出,则选取生长最快、体积达到600~800mm3的瘤体,剥离瘤体组织一块固定保存,剩余缓冻液氮保存;
98.·
若接种后120天,p0代肿瘤仍没有生长迹象,则处死该批小鼠,结束该模型。
99.样品检测:
100.·
将固定的瘤体组织p0和p1做cd19/cd45双色流式分析染色,he染色分析及str检测。
101.结果分析:
102.·
参照原始肿瘤组织的he染色结果,对比p0和p1的he染色及str检测报告,确定瘤体的类型。如图1腹水流式分析图、图2瘤体生长曲线、图3确定瘤体cd19/cd45双色流式分析图、图4确定瘤体的病理诊断he染色图所示,瘤体组织表现为肿瘤细胞弥漫分布,且无b淋巴细胞异常增殖情况。
103.实施例2
104.药物筛选
105.在本实施例2中,利用构建成功的消化道肿瘤小鼠模型进行治疗药物筛选,实验过程包括:
106.p1代成瘤动物,待瘤体达到600~800mm3,剥离瘤体,瘤体切成3*3*3mm3大小;
107.按1块/只的标准接种,接种40只小鼠;
108.当瘤体达到150mm3后随机分组进行药效学测试,通过肿瘤体积和体重变化的数据收集,筛选出最优的治疗消化道肿瘤方案供临床治疗参考。
109.在本实施例中,待筛选药物包括:吉西他滨单药,白蛋白紫杉醇单药,伊利替康单药,雷替曲塞单药,吉西他滨,奥沙利铂和雷替曲塞联用方案,曲美替尼,多西他赛和卡培他滨联用;
110.筛选结果如表1和图5、图6所示,在所筛选的药物中,在所筛选的药物中,曲美替尼,多西他赛和卡培他滨联用方案对消化道肿瘤恶性腹水模型的抑制效果最佳。
111.表1利用消化道肿瘤动物模型筛选药物的结果列表
[0112][0113]
本技术实施例公开的用于消化道肿瘤药物筛选的腹水肿瘤模型构建方法,得到了具有消化道肿瘤特性的人源异体移植动物模型,能够用于对多种药物和联合用药进行测
试,并对消化道肿瘤药物进行筛选。
[0114]
本技术公开的技术方案和实施例中公开的技术细节,仅是示例性说明本技术的发明构思,并不构成对本技术技术方案的限定,凡是对本技术公开的技术细节所做的常规改变、替换或组合等,都与本技术具有相同的发明构思,都在本技术权利要求的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。