一种sars-cov-2疫苗
技术领域
1.本发明涉及疫苗技术领域,具体涉及一种sars-cov-2疫苗,其以sars-cov-2的s蛋白为抗原,疫苗的形式包括不限于腺病毒载体疫苗,该疫苗经黏膜免疫后可产生较佳的保护性免疫反应,从而可预防sars-cov-2的感染。
背景技术:
2.冠状病毒为不分节段的单股正链rna病毒,属于巢病毒(nidovirales)冠状病毒(coronaviridae)正冠状病毒亚科(orthocoronavirinae),根据血清型和基因组特点,冠状病毒亚科被分为α、β、γ和δ四个属。迄今为止,共有7种冠状病毒可感染人类:包括α属的229e和nl63,β属的oc43和hku1、中东呼吸综合征相关冠状病毒(mersr-cov)、严重急性呼吸综合征相关冠状病毒(sarsr-cov)和新型冠状病毒(sars-cov-2)。
3.新型冠状病毒(sars-cov-2)可导致急性呼吸窘迫综合征、脓毒症休克、出凝血功能障碍,引起新型冠状病毒相关疾病(covid-19)。
4.冠状病毒属的病毒是具外套膜的正链单股rna病毒,直径约80~120nm,基因组为27~32kb,其遗传物质是所有rna病毒中最大的;冠状病毒属正链rna的结构特征是:rna链5’端有甲基化“帽子”,3’端有polya“尾巴”结构。这一结构与真核mrna非常相似,这是冠状病毒的基因组rna自身可以发挥翻译模板作用的重要结构基础,冠状病毒感染宿主细胞后,可以直接合成蛋白质,而省去了rna-dna-rna的转录过程,该特点促使冠状病毒容易变异或者容易发生基因重组。
5.冠状病毒可感染人、鼠、猪、猫、犬、禽类等脊椎动物。冠状病毒有包膜,包膜上存在棘突,整个病毒像日冕,不同的冠状病毒的棘突有明显的差异。在冠状病毒感染细胞内有时可以见到管状的包涵体。
6.s蛋白是冠状病毒最重要的表面蛋白,与病毒的传染能力相关。s蛋白含有两个亚基:s1和s2,其中s1主要包含受体结合区域(rbd),负责识别细胞受体;s2含有膜融合过程所需的基本元件。s蛋白承担病毒与宿主细胞膜受体结合及膜融合功能;s蛋白决定了病毒的宿主范围和特异性;s蛋白通过受体结合区(rbd)的基因重组或突变可以实现不同宿主间传播,并导致较高致死率;s蛋白可产生中和抗体,因此,s蛋白是疫苗设计的重要候选抗原。
7.s蛋白是冠状病毒疫苗开发的首选抗原,综合分析sars、mers以及sars-cov-2疫苗研究的相关报道,基本上都是围绕s抗原来设计的。国内布局了5条不同的技术路线来开发sars-cov-2疫苗,包括核酸疫苗,重组蛋白疫苗,灭活疫苗,载体疫苗以及流感病毒载体疫苗。这些疫苗都以肌肉注射为免疫途径。新型冠状病毒为呼吸道感染病毒,目前的研究结果表明,新型冠状病毒在下呼吸道以及肺部有大量的聚集;因此,有效地清除呼吸道系统,以及肺部的病毒是开发新型冠状病毒疫苗必须考虑的策略。
技术实现要素:
8.本发明提供一种sars-cov-2疫苗,该疫苗采用黏膜给药制剂,为重组腺病毒载体
疫苗,该重组腺病毒中插入sars-cov-2的s蛋白基因。
9.具体地,上述黏膜给药制剂选自:滴鼻剂、气雾剂、喷雾剂、粉雾剂、粉末剂、凝胶剂、微球剂、脂质体、膜剂、混悬剂等。
10.具体地,按照物质形态分类,上述黏膜给药制剂可以为液体剂型(如混悬剂,其可经特定装置在施用时形成气雾剂或喷雾剂)、固体剂型(如粉末剂,其可特定装置在施用时形成粉雾剂)、半固体剂型(如凝胶剂、膜剂)、气体剂型(如气雾剂、喷雾剂)。
11.在本发明的一个实施方式中,上述黏膜给药制剂为气体剂型,如气雾剂、喷雾剂等。
12.具体地,上述重组腺病毒还可包含sars-cov-2的其他结构蛋白(如m蛋白、e蛋白、n蛋白)基因(全长或部分序列)。
13.在本发明的一个实施方式中,上述重组腺病毒包含sars-cov-2的s蛋白基因和m蛋白基因。
14.在本发明的一个实施方式中,上述重组腺病毒包含sars-cov-2的s蛋白基因和e蛋白基因。
15.在本发明的一个实施方式中,上述重组腺病毒包含sars-cov-2的s蛋白基因、m蛋白基因和e蛋白基因。
16.具体地,上述腺病毒可以为人腺病毒(如adhu2型、adhu5型等)、动物腺病毒载体如黑猩猩腺病毒载体(如adc6型、adc7型、adc36型、adc68型等);在本发明的一个实施例中,上述腺病毒为adhu5型。
17.具体地,上述疫苗中,重组腺病毒的含量为1*109~5*10
11
vp/ml(具体如2*109、4*109、6*109、8*109、1*10
10
、2*10
10
、4*10
10
、6*10
10
、8*10
10
、1*10
11
、2*10
11
、3*10
11
、4*10
11
、5*10
11
vp/ml);在本发明的一个实施例中,重组腺病毒的含量为1*10
11
vp/ml。
18.具体地,上述疫苗还包含药学上可接受的辅料。
19.具体地,上述药学上可接受的辅料可选自:缓冲剂、保护剂、稳定剂、表面活性剂、渗透压调节剂等中的一种或多种。
20.在本发明的一个实施方式中,上述疫苗为液体剂型。
21.具体地,在上述液体剂型中,缓冲剂的含量可以为0-10mm(具体如1mm,2mm,3mm,4mm,5mm,6mm,7mm,8mm,9mm),特别是0-5mm。
22.在本发明的一个实施方式中,上述缓冲剂可以包括hepes、his、tris、琥珀酸、柠檬酸中的一种或多种;在本发明的一个实施例中,上述缓冲为hepes,具体地,hepes在黏膜给药液体剂型中的含量可以为0-10mm,特别是1-5mm。
23.在本发明的一个实施方式中,上述缓冲剂可以包括his;具体地,his在液体剂型中的含量可以为0-10mm,特别是3-7mm。
24.具体地,上述保护剂可包括冻干保护剂、抗原保护剂等。
25.具体地,上述抗原保护剂可以为明胶和/或人血白蛋白。在本发明的一个实施方式中,上述抗原保护剂包括明胶;具体地,明胶在液体剂型中含量为0-20mg/ml(具体如1mg/ml,2mg/ml,3mg/ml,4mg/ml,5mg/ml,6mg/ml,7mg/ml,8mg/ml,9mg/ml,10mg/ml,11mg/ml,12mg/ml,13mg/ml,14mg/ml,15mg/ml,16mg/ml,17mg/ml,18mg/ml,19mg/ml),特别是5-15mg/ml。
26.在本发明的一个实施方式中,上述抗原保护剂可以包括人重组白蛋白(hsa);具体地,hsa在液体剂型中含量0-10%(重量百分比)(具体如0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、2%、4%、6%、8%、10%),特别是0.1%-1%。
27.具体地,在上述液体剂型中,稳定剂的含量可以为0-100mg/ml(具体如5mg/ml,10mg/ml,15mg/ml,20mg/ml,25mg/ml,30mg/ml,35mg/ml,40mg/ml,45mg/ml,50mg/ml,55mg/ml,60mg/ml,65mg/ml,70mg/ml,75mg/ml,80mg/ml,85mg/ml,90mg/ml,95mg/ml)。
28.具体地,在上述液体剂型中,稳定剂可以为蔗糖、甘露醇、岩藻糖、麦芽糖中的一种或多种;稳定剂的主要作用是液体制剂在冻融或者冻存或者冻干过程中,维持病毒的活性不改变。
29.在本发明的一个实施方式中,上述稳定剂可以包括蔗糖;具体地,蔗糖在液体剂型中的含量可以为0-100mg/ml,特别是10-50mg/ml。
30.在本发明的一个实施方式中,上述稳定剂可以包括甘露醇;具体地,甘露醇在液体剂型中的含量可以为0-100mg/ml,特别是15-75mg/ml。
31.具体地,在上述疫苗中,表面活性剂的含量可以为0-10mg/ml(具体如0.01mg/ml,0.05mg/ml,0.1mg/ml,0.2mg/ml,0.3mg/ml,0.4mg/ml,0.5mg/ml,1mg/ml,1.5mg/ml,2mg/ml,2.5mg/ml,3mg/ml,3.5mg/ml,4mg/ml,4.5mg/ml,5mg/ml,6mg/ml,7mg/ml,8mg/ml,9mg/ml)。
32.在本发明的一个实施方式中,上述表面活性剂可以包括吐温(如吐温80);具体地,吐温在液体剂型中的含量为0-10mg/ml,特别是0.05-0.5mg/ml。
33.在本发明的一个实施方式中,上述表面活性剂可以包括甘油;具体地,甘油在液体剂型中的含量为0-10mg/ml,特别是0.5-5mg/ml。
34.具体地,上述液体剂型中,渗透压调节剂的含量可以为0-100mm(具体如1mm,10mm,15mm,20mm,25mm,30mm,35mm,40mm,45mm,50mm,55mm,60mm,65mm,70mm,75mm,80mm,85mm,90mm,95mm),特别是40-60mm。
35.在本发明的一个实施方式中,上述渗透压调节剂包括氯化钠。
36.具体地,上述液体剂型中,抗原保护剂的含量可以为0-10mm(具体如0.01mm,0.05mm,0.1mm,0.2mm,0.3mm,0.4mm,0.5mm,1mm,2mm,3mm,4mm,5mm,6mm,7mm,8mm,9mm,10mm)。
37.在本发明的一个实施方式中,上述病毒活性保护剂可包括氯化镁;具体地,氯化镁在液体剂型中的含量为0-10mm,特别是1-5mm。
38.在本发明的一个实施方式中,上述病毒活性保护剂可包括edta;具体地,edta在液体剂型中的含量为0-10mm,特别是0.05-0.5mm。
39.在本发明的一个实施方式中,上述疫苗包含:重组腺病毒、蔗糖、甘露醇、氯化钠、hepes、氯化镁、吐温80、明胶。
40.在本发明的一个实施方式中,上述疫苗包含:重组腺病毒、蔗糖、甘露醇、氯化钠、甘油、hepes、氯化镁、吐温80、his、edta、hsa、明胶。
41.在本发明的一个实施方式中,上述疫苗为液体剂型,其包含:重组腺病毒1*109~5*10
11
vp/ml、蔗糖10-50mg/ml、甘露醇15-75mg/ml、氯化钠40-60mm、hepes 1-5mm、氯化镁1-5mm、吐温80 0.05-0.5mg/ml、明胶5-15mg/ml。
42.在本发明的一个实施方式中,上述疫苗为液体剂型,其包含:重组腺病毒1*109~5*10
11
vp/ml、蔗糖10-50mg/ml、甘露醇15-75mg/ml、氯化钠40-60mm、甘油0.5-5mg/ml、hepes 1-5mm、氯化镁1-5mm、吐温80 0.05-0.5mg/ml、his 3-7mm、edta 0.05-0.5mm、hsa 0.1%-1%、明胶5-15mg/ml。
43.在本发明的一个实施例中,上述疫苗为液体剂型,其包含:重组腺病毒1*10
11
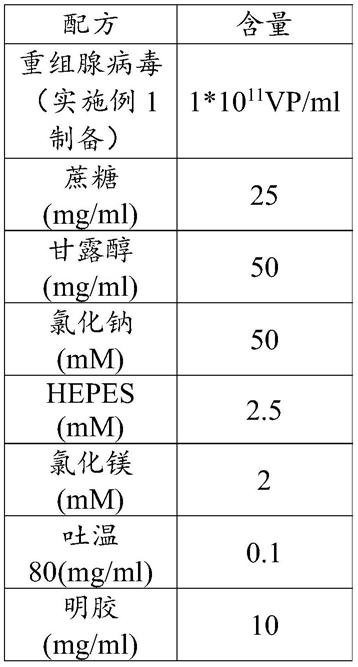
vp/ml,蔗糖25mg/ml,甘露醇50mg/ml,氯化钠50mm,hepes 2.5mm,氯化镁2mm,吐温80 0.1mg/ml,明胶10mg/ml。
44.在本发明的一个实施例中,上述疫苗为液体剂型,其包含:重组腺病毒1*10
11
vp/ml,蔗糖25mg/ml,甘露醇50mg/ml,氯化钠50mm,甘油1.5mg/ml,hepes 2.5mm,氯化镁2mm,吐温80 0.1mg/ml,his 5mm,edta 0.1mm,hsa 0.60%,明胶10mg/ml。
45.在本发明的一个实施方式中,本发明上述疫苗为固体剂型,其可由本发明上述液体剂型经过处理(例如冻干)得到。
46.在本发明的一个实施方式中,本发明上述疫苗为气体剂型,其可由本发明上述液体剂型或固体剂型经过处理(例如雾化)得到。
47.具体地,在上述疫苗中,本领域技术人员还可根据实际需求加入其它辅料,例如抛射剂、吸收促进剂、防腐剂、稀释剂、赋形剂、助溶剂等等中的一种或多种。
48.本发明还提供一种上述疫苗的制备方法,其包括上述重组腺病毒的制备方法步骤。
49.具体地,上述重组腺病毒的制备方法可采用现有技术中已知的任何合适的重组腺病毒的制备方法,例如利用现有技术中任何合适的可用腺病毒包装系统和服务(例如,但不限于,武汉维诺赛生物技术有限公司、武汉巴菲尔生物技术服务有限公司等可提供的腺病毒包装系统、腺病毒包装服务)。
50.具体地,上述制备方法可包括如下步骤:
51.(1)将sars-cov-2的s蛋白基因与腺病毒的穿梭质粒连接,得到重组腺病毒穿梭质粒;
52.(2)将步骤(1)所得重组腺病毒穿梭质粒与携带腺病毒大部分基因组的骨架质粒共转染包装细胞,得到携带sars-cov-2的s蛋白基因的重组腺病毒。
53.在本发明的一个实施例中,上述包装细胞为293细胞。
54.本发明还提供一种sars-cov-2的s蛋白基因在制备预防sars-cov-2感染的疫苗中的应用,特别是,该疫苗为黏膜给药制剂。
55.本发明还提供一种重组腺病毒在制备预防sars-cov-2感染的疫苗中的应用,其中该重组腺病毒包含sars-cov-2的s蛋白基因,特别是该疫苗为黏膜给药制剂。
56.具体地,上述腺病毒可以为人腺病毒(如adhu2型、adhu5型等)、黑猩猩腺病毒载体(如adc6型、adc7型、adc36型、adc68型等);在本发明的一个实施例中,该腺病毒为adhu5型。
57.具体地,上述应用中,黏膜给药制剂选自:滴鼻剂、气雾剂、喷雾剂、粉雾剂、粉末剂、凝胶剂、微球剂、脂质体、膜剂、混悬剂等。
58.具体地,按照物质形态分类,上述黏膜给药制剂可以为液体剂型(如混悬剂,其可经特定装置在施用时形成气雾剂或喷雾剂)、固体剂型(如粉末剂,其可特定装置在施用时形成粉雾剂)、半固体剂型(如凝胶剂、膜剂)、气体剂型(如气雾剂、喷雾剂)。
59.在本发明的一个实施方式中,上述黏膜给药制剂为气体剂型,如气雾剂、喷雾剂、粉雾剂等。
60.本发明还提供一种预防covid-19的方法,其包括对受试者施用(特别是通过黏膜给药)有效量的本发明上述疫苗的步骤。
61.在本发明的一个实施方式中,上述黏膜给药为雾化吸入给药。
62.在本发明另一个实施方式中,上述黏膜给药为滴鼻给药。
63.具体地,上述方法中,可采用多种黏膜给药方式,例如对受试者进行滴鼻给药和雾化吸入给药;还可结合其他给药方式(例如注射,具体如肌肉注射)对受试者施用本发明上述疫苗,以增强免疫效果,例如对受试者进行雾化吸入给药和肌肉注射,或,滴鼻给药和肌肉注射,或对受试者进行肌肉注射、滴鼻给药和雾化吸入给药。
64.具体地,上述方法中,所述粘膜免疫制剂经雾化后形成10μm以下的颗粒,优先的,颗粒分布于3-10μm,经口腔或者鼻腔吸入后,可以均匀地分布到整个呼吸道,包括肺部。
65.本发明还提供一种给药装置,其包含本发明上述疫苗。
66.具体地,上述给药装置可以包括雾化器、喷雾器等,本发明上述疫苗为液体剂型或固体剂型,其经该给药装置可形成气体剂型,如气雾剂、喷雾剂、粉雾剂等。
67.具体地,上述方法中,所述装置可以将疫苗雾化后形成10μm以下的颗粒,优先的,颗粒分布于3-10μm,经口腔或者鼻腔吸入后,可以均匀的分布到整个呼吸道,包括肺部。
68.本发明提供一种粘膜免疫的sars-cov-2疫苗,其以sars-cov-2的s蛋白为抗原,经黏膜免疫特别是经雾化吸入后可产生较佳的保护性免疫反应,从而可预防sars-cov-2的感染。该疫苗经适宜的设备雾化后,可产生3-10μm之间,均一度较佳的颗粒,其经鼻腔或者口腔吸入可到达肺部,从而产生对整个呼吸道,以及肺部的保护性免疫反应,增强疫苗的有效利用率,提高疫苗的效果。该疫苗可在2-8℃下稳定保存,反复冻融也不会引起病毒活性的变化。
附图说明
69.图1所示为重组sars-cov-2腺病毒载体的电镜图。
70.图2所示为重组sars-cov-2腺病毒载体疫苗肌肉和雾化给药后血清中的抗体滴度结果。
71.图3所示为重组sars-cov-2腺病毒载体疫苗肌肉和雾化给药后肺泡灌洗液中的抗体滴度结果。
72.图4所示为重组sars-cov-2腺病毒载体疫苗肌肉和雾化给药后血清中的细胞免疫。
73.图5所示为重组sars-cov-2腺病毒载体疫苗肌肉和雾化给药后肺泡灌洗中的细胞免疫。
具体实施方式
74.除非另有定义,本发明中所使用的所有科学和技术术语具有与本发明涉及技术领域的技术人员通常理解的相同的含义。
[0075]“腺病毒载体疫苗”是指以腺病毒作为载体,将目的抗原基因(在本发明中,例如
sars-cov-2的s蛋白基因)重组到腺病毒基因组中,使用能表达该抗原基因的重组腺病毒制成的疫苗。具体地,sars-cov-2的基因及其各结构蛋白可通过本领域公知技术检索得到,例如,sars-cov-2的基因可以如genbank:mt419849.1所示,其各结构蛋白:s蛋白、e蛋白、m蛋白基因可以为genbank:mt419849.1的21387-25208、26069-26296、26347-27015所示。
[0076]
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0077]
人5型腺病毒载体和黑猩猩病毒载体同属病毒载体疫苗,两个不同的载体所开发的粘膜给药的制剂类型,免疫动物的作用效果都类似,本实施例中,以人5型腺病毒载体为例进行说明。
[0078]
实施例1:重组新型冠状病毒(sars-cov-2)腺病毒载体疫苗的包装
[0079]
将sars-cov-2的s抗原基因连接到腺病毒的穿梭质粒,然后与携带腺病毒大部分基因组的骨架质粒共转染293细胞,穿梭质粒和骨架质粒共转染细胞后,利用cre/loxp系统的作用实现重组,从而产生重组腺病毒。
[0080]
包装成功的重组腺病毒,连续挑单斑三次,选择感染能力强,表达量高,以及装配速度快的作为原始种子,进行生产工艺和制剂工艺的开发。所得重组腺病毒用电镜观察,结果见图1。如图1所示,电镜下观察到典型的腺病毒结构。
[0081]
实施例2:重组sars-cov-2腺病毒载体疫苗的制剂研究
[0082]
重组sars-cov-2腺病毒载体疫苗液体制剂配方如表1和2所示:
[0083]
表1重组sars-cov-2的腺病毒载体疫苗液体制剂配方
[0084]
[0085]
表2重组sars-cov-2的腺病毒载体疫苗液体制剂配方
[0086][0087][0088]
测定了上述表2重组sars-cov-2腺病毒载体疫苗的液体制剂雾化多次给药后vp和ifu的变化,结果见表3。结果表明,该重组sars-cov-2腺病毒载体疫苗的稳定性很好,持续多次雾化后,其比活变化不明显。
[0089]
表3重组sars-cov-2腺病毒载体疫苗雾化给药比活变化
[0090][0091]
测定了上述表2配方的重组sars-cov-2腺病毒载体疫苗雾化后的喷雾剂的粒径范围,结果表明,粒径为1-6μm,平均为4μm。
[0092]
测定了重组sars-cov-2腺病毒载体疫苗不同给药体积的雾化时间,连续测定三次,结果见表4。结果表明,重组sars-cov-2腺病毒载体疫苗液体制剂适合雾化,多次雾化时间cv变异不大于10%。
[0093]
表4不同体积重组sars-cov-2腺病毒载体疫苗的雾化速率
[0094][0095]
实施例3:重组sars-cov-2腺病毒载体疫苗免疫原性的研究
[0096]
根据表2,采用相同制剂配方的重组sars-cov-2腺病毒载体疫苗,每ml含有1*10
11
vp,以肌肉和雾化吸入两种方式免疫食蟹猴,测定血清中的lgg和肺泡灌洗液中的lga。
[0097]
实验动物:食蟹猴,每组2只;
[0098]
免疫剂量:1剂,每剂为0.5ml,含有5*10
10
vp病毒颗粒;
[0099]
免疫方式:肌肉注射和雾化吸入,免疫剂量相同;
[0100]
单针免疫,免后4周采血,收集肺泡灌洗液,通过elisa测定血清中的lgg和肺泡灌
洗液中的lga。
[0101]
血清中的lgg检测结果如图2所示。结果表明,上述重组sars-cov-2腺病毒载体疫苗,以肌肉和雾化两种方式免疫食蟹猴,在剂量相同时,血清中产生的lgg抗体滴度基本相当。
[0102]
肺泡灌洗液中的lga检测结果如图3所示。结果表明,上述重组sars-cov-2腺病毒载体疫苗,以肌肉和雾化两种方式免疫食蟹猴,肌肉免疫的方式未能有效产生lga,但是雾化给药的黏膜免疫则在肺泡灌洗中检测到很高滴度的lga。
[0103]
实施例4:重组sars-cov-2腺病毒载体疫苗细胞免疫的研究
[0104]
根据表2,采用相同制剂配方的重组sars-cov-2腺病毒载体疫苗,每ml含有1*10
11
vp,以肌肉和雾化吸入两种方式免疫食蟹猴,测定血清和肺泡灌洗液中的细胞免疫水平。
[0105]
实验动物:食蟹猴,每组2只;
[0106]
免疫剂量:1剂,每剂为0.5ml,含有5*10
10
vp病毒颗粒;
[0107]
免疫方式:肌肉注射和雾化吸入;
[0108]
单针免疫,免后4周采血,测定细胞免疫。
[0109]
血清中的lgg检测结果如图4所示。结果表明,雾化吸入免疫重组新冠疫苗激发的细胞免疫水平和肌肉注射的相当。
[0110]
测定肺泡灌洗液中细胞免疫,结果如图5所示。结果表明,雾化吸入免疫重组新冠疫苗可有效激发肺泡灌洗液的细胞免疫水平,肌肉注射的肺泡灌洗液中检测不到细胞免疫。
[0111]
实施例5:重组sars-cov-2腺病毒载体疫苗保护力的研究
[0112]
根据表2,采用相同制剂配方的重组sars-cov-2腺病毒载体疫苗,每ml含有1*10
11
vp,以肌肉和雾化吸入两种方式免疫食蟹猴,测定中和抗体滴度。
[0113]
实验动物:食蟹猴,每组2只;
[0114]
免疫剂量:1剂,每剂为0.5ml,含有5*10
10
vp病毒颗粒;
[0115]
免疫方式:肌肉注射和雾化吸入;
[0116]
单针免疫,免后4周采血,测定中和抗体滴度,结果如下表所示:
[0117]
表5重组sars-cov-2腺病毒载体疫苗在肌肉和雾化给药后血清中的中和抗体
[0118][0119]
结果表明,上述重组sars-cov-2腺病毒载体疫苗以肌肉和雾化吸入两种方式免疫食蟹猴,均可产生中和抗体水平,两种给药途径产生的中和抗体水平相当。
[0120]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精
神和原则之内,所作的任何修改、等同替换等,均应包含在本发明的保护范围之内。
[0121]
本发明中描述的前述实施例和方法可以基于本领域技术人员的能力、经验和偏好而有所不同。
[0122]
本发明中仅按一定顺序列出方法的步骤并不构成对方法步骤顺序的任何限制。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。