1.本发明属于生物制药技术领域,涉及体外培育牛黄抗惊厥的制药应用以及基于其的药物组合物和制备方法。
背景技术:
2.热性惊厥(febrile seizures,fs)是儿科常见的惊厥性疾病,在儿科急诊中,60%的抽搐是由fs引起的,fs的复发率较高,5岁以下儿童有50%的复发率,部分呈反复复发趋势,且远期癫痫发生率高达2%~8%,远高于一般人群(0.3%~0.5)。目前fs预防用药主要有以下两种方案:间断应用安定(dzp)和长期口服丙戊酸钠(vpa)或苯巴比妥(pb),有效率为70%~80%。但长期服用此类西药会引起诸多不良反应,如嗜睡、肥胖、激素水平紊乱、过敏反应,甚至个别患者会出现急性肝坏死等严重不良反应。这就大大降低了患者的依从性,影响了总体有效率,限制了其临床应用。另有研究显示有上呼吸道感染引发的fs占到了总数的60%~80%,所以,近年来大量学者开始探索更既能治疗上呼吸道感染,又能安全有效的预防fs的治疗手段或药物。
3.小儿咽扁颗粒源于首都儿科研究所的临床验方,原名“咽扁合剂”,属清热解毒类药物,方中包括金银花、射干、金果榄、桔梗、玄参、麦冬、人工牛黄、冰片,具有清热利咽,解毒止痛之功效,用于“肺实热”引起的咽喉肿痛,咳嗽痰盛,咽炎等,但由该方剂的适应症与临床应用可知该小儿咽扁颗粒不具备抗惊厥效果。这是因为原处方中所含的牛黄为人工牛黄,由牛胆粉、胆酸、猪去氧胆酸、牛磺酸、胆红素、胆固醇、微量元素等加工制成,其中胆红素含量低,不足1%,药典中规定不少于0.63%。
4.而体外培育牛黄是由新鲜胆汁作母液,加入去氧胆酸、胆酸、复合胆红素钙等制成,体外培育牛黄的胆红素含量药典中规定不得少于35%,与人工牛黄相比,体外培育牛黄的胆红素含量更高,研究表明体外培育牛黄的性状、结构、成分及其含量、药理、临床疗效与天然牛黄基本一致,无毒副作用,已被载入2005年版药典,并于2005年7月1日起开始执行。但是,当前还未有研究能够将体外培育的牛黄用于抗惊厥药物的研发中。
技术实现要素:
5.为了克服上述现有技术的缺点,本发明的目的在于提供体外培育牛黄抗惊厥的制药应用以及基于其的药物组合物和制备方法。
6.为了达到上述目的,本发明采用以下技术方案予以实现:
7.本发明公开了一种用于抗惊厥的体外培育牛黄药物组合物,以质量份数计,包括:体外培育牛黄0.2
‑
0.4份、金银花100份
‑
120份、射干50份
‑
70份、金果榄70
‑
90份、桔梗70
‑
90份、玄参70
‑
90份、麦冬70
‑
90份和冰片0.1
‑
0.2份。
8.优选地,所述体外培育牛黄药物组合物中还包括甜味剂8
‑
10份,赋形剂200
‑
250份。
9.进一步优选地,所述甜味剂为甜菊素、乳糖或木糖醇。
10.进一步优选地,所述赋形剂为α
‑
环糊精、β
‑
环糊精或变性淀粉。
11.本发明还公开了上述的用于抗惊厥的体外培育牛黄药物组合物的制备方法,包括:取金银花、射干、金果榄、桔梗、玄参和麦冬,加水煎煮二次,滤过,滤液合并,减压浓缩至相对密度为1.20
‑
1.25;加入体外培育牛黄,混匀,制成颗粒,干燥后加入冰片,混匀,即得。
12.优选地,加水煎煮两次,第一次2
‑
3小时,第二次1
‑
2小时。
13.优选地,减压浓缩是在50℃下浓缩至相对密度为1.20
‑
1.25。
14.优选地,在加入体外培育牛黄的同时加入甜味剂与赋形剂混匀后制粒。
15.本发明还公开了体外培育牛黄在制备抗惊厥药物中的应用。
16.优选地,所述的药物为通过抑制海马细胞凋亡而抑制惊厥后神经损伤的药物。
17.与现有技术相比,本发明具有以下有益效果:
18.本发明公开的体外培育牛黄药物组合物,配方中采用体外培育牛黄,其中的胆红素含量约为人工牛黄的50倍,同时价格便宜。本发明所得的体外培育牛黄药物组合物具有价格便宜,疗效显著的特点。经实验证明,本发明所得的体外培育牛黄药物组合物具有良好抗惊厥的功效。本发明所述体外培育牛黄药物组合物主要通过抑制惊厥大鼠模型脑部海马部位的内质网应激
‑
chop
‑
caspas相关通路抑制海马细胞凋亡进而保护脑细胞,抑制惊厥后的损伤,对热惊厥脑细胞和神经元具有保护作用。
19.优选地,本发明采用甜菊素或乳糖或木糖醇代替蔗糖,使得该组合物也适用于糖尿病患儿使用。
20.本发明采用了干式制粒工艺,相比传统工艺含糖量小,节约成本,且用甜菊素或乳糖或木糖醇代替蔗糖,使得该组合物也适用于糖尿病患儿使用。
附图说明
21.图1为大鼠惊厥情况图;其中,a为惊厥发生时间情况图;b为惊厥持续时间情况图;c为惊厥等级结果图;
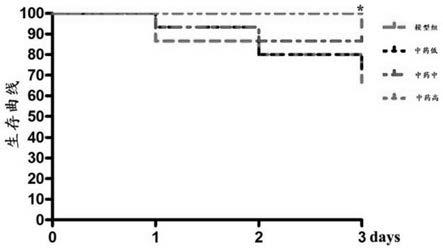
22.图2为生存曲线图;
23.图3为水迷宫实验结果图;
24.图4为空间探索实验结果图;
25.图5为热性惊厥后大鼠血液、脑组织中各项因子表达水平;其中,a为tnf
‑
a促炎症因子表达变化结果;b为il
‑
6促炎症因子表达变化结果;c为mmp
‑
9促炎症因子表达变化结果;d为il
‑
10抑炎因子表达变化结果;e为bdnf保护性因子表达变化结果;f为sod抗氧化因子表达变化结果;g为cat保护性因子表达变化结果;
26.图6为大鼠海马体e染色病理和尼氏小体染色图;
27.图7为海马部位凋亡荧光结果图;其中,a图中红色代表凋亡,蓝色代表神经元细胞核;b图为凋亡小体个数柱状统计结果图;
28.图8为western blot法检测海马部位:内质网应激状态;其中,a图为atf6、磷酸化
‑
ire1α、磷酸化perk及chop的表达变化结果;b图为统计结果柱状图;
29.图9为线粒体(应激)导致的凋亡结果图;其中,a图:bcl
‑
2,bax,cleaved
‑
cas
‑
3,caspase
‑
9表达变化;b图为统计结果柱状图;
30.图10为nrf
‑
2,ho
‑
1促凋亡因子表达变化结果图;其中,a图为表达结果图;b为统计结果柱状图。
具体实施方式
31.为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
32.需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
33.下面结合附图对本发明做进一步详细描述:
34.一、实施例与对比例
35.实施例1
36.按质量配比,称取体外培育牛黄0.2g、金银花100g、射干50g、金果榄70g、桔梗70g、玄参70g、麦冬70g和冰片0.1g,除体外培育牛黄、冰片外,金银花等其余六味加水煎煮二次,第一次2小时,第二次1小时,滤过,滤液合并,减压浓缩至相对密度为1.20
‑
1.25(50℃),加入甜菊素8g、β
‑
环糊精200g及体外培育牛黄,混匀,干式制粒法制成颗粒,干燥,加入冰片,混匀,即得抗惊厥的体外培育牛黄药物组合物颗粒501.31g。
37.实施例2
38.按质量配比,称取体外培育牛黄0.31g、金银花109.4g、射干62.5g、金果榄78.1g、桔梗78.1g、玄参78.1g、麦冬78.1g和冰片0.16g,除体外培育牛黄、冰片外,其余金银花等六味加水煎煮二次,第一次3小时,第二次1小时,滤过,滤液合并,减压浓缩至相对密度为1.20
‑
1.25(50℃),加入甜菊素9g、β
‑
环糊精225g及体外培育牛黄,混匀,干式制粒法制成颗粒,干燥,加入冰片,混匀,即得抗惊厥的体外培育牛黄药物组合物颗粒563.69g。
39.实施例3
40.按质量配比,称取体外培育牛黄0.4、金银花120g、射干70g、金果榄90g、桔梗90g、玄参90g、麦冬90g和冰片0.2g,除体外培育牛黄、冰片外,其余金银花等六味加水煎煮二次,第一次3小时,第二次2小时,滤过,滤液合并,减压浓缩至相对密度为1.20
‑
1.25(50℃),加入甜菊素10g、β
‑
环糊精250g及体外培育牛黄,混匀,干式制粒法制成颗粒,干燥,加入冰片,混匀,即得抗惊厥的体外培育牛黄药物组合物颗粒640.92g。
41.本发明实施例所用的体外培育牛黄按照2010版药典中提供的方法制备得到。
42.对照例1
43.按质量配比,称人工牛黄0.31g、金银花109.4g、射干62.5g、金果榄78.1g、桔梗
78.1g、玄参78.1g、麦冬78.1g和冰片0.16g,除人工牛黄、冰片外,其余金银花等六味加水煎煮二次,第一次3小时,第二次1小时,滤过,滤液合并,减压浓缩至相对密度为1.20
‑
1.25(50℃),加入蔗糖230g及体外培育牛黄,混匀,干式制粒法制成颗粒,干燥,加入冰片,混匀,即得抗惊厥的体外培育牛黄药物组合物颗粒537.62g。
44.对照例2
45.按质量配比,称取人工牛黄0.31g、金银花109.4g、射干62.5g、金果榄78.1g、桔梗78.1g、玄参78.1g、麦冬78.1g和冰片0.16g,除人工牛黄、冰片外,其余金银花等六味加水煎煮二次,第一次3小时,第二次1小时,滤过,滤液合并,减压浓缩至相对密度为1.20
‑
1.25(50℃),加入木糖醇230g及体外培育牛黄,混匀,干式制粒法制成颗粒,干燥,加入冰片,混匀,即得抗惊厥的体外培育牛黄药物组合物颗粒559.17g。
46.对照例3
47.按质量配比,称取人工牛黄0.31g、金银花109.4g、射干62.5g、金果榄78.1g、桔梗78.1g、玄参78.1g、麦冬78.1g和冰片0.16g,除人工牛黄、冰片外,其余金银花等六味加水煎煮二次,第一次3小时,第二次1小时,滤过,滤液合并,减压浓缩至相对密度为1.20
‑
1.25(50℃),加入甜菊素9g、α
‑
环糊精225g及体外培育牛黄,混匀,干式制粒法制成颗粒,干燥,加入冰片,混匀,即得抗惊厥的体外培育牛黄药物组合物颗粒561.27g。
48.对照例4
49.按质量配比,称取人工牛黄0.31g、金银花109.4g、射干62.5g、金果榄78.1g、桔梗78.1g、玄参78.1g、麦冬78.1g和冰片0.16g,除人工牛黄、冰片外,其余金银花等六味加水煎煮二次,第一次3小时,第二次1小时,滤过,滤液合并,减压浓缩至相对密度为1.20
‑
1.25(50℃),加入甜菊素9g、变性淀粉225g及人工牛黄,混匀,干式制粒法制成颗粒,干燥,加入冰片,混匀,即得抗惊厥的体外培育牛黄药物组合物颗粒553.62g。
50.二、体外培育牛黄药物组合物颗粒的质量评价
51.1、形状
52.取上述实施例及对比例制备的颗粒剂样品,通过观察法对其性状进行评价。
53.表1颗粒外观
[0054][0055]
2、粒度
[0056]
取上述实施例及对比例制备的颗粒剂样品约8g,精密称定,置药筛内过筛。过筛
时,将筛保待水平状态,左右往返轻轻筛动3分钟。不能通过1筛和能通过5筛的颗粒和粉末总和。
[0057]
表2颗粒粒度
[0058][0059][0060]
3、水分
[0061]
取上述实施例及对比例制备的颗粒样品,按照《中国药典》2020版附录中的水分测定法(通则0832)进行测定。取颗粒约5g,平铺于干燥至恒重的扁形称量瓶(质量m1)中,精密称定其质量为m2,开启瓶盖在100~105℃干燥5小时,将瓶盖盖好,移置干燥器中,放冷30分钟,精密称定,再在上述温度干燥1小时,放冷,称重,至连续两次称重的差异不超过5mg为止,记录质量m3。做三次平行实验,计算颗粒水分含量。
[0062]
颗粒水分含量=(m2‑
m3)/(m2‑
m1)
×
100%
[0063]
表3颗粒水分含量
[0064][0065]
4、溶化性
[0066]
取上述实施例及对比例制备的颗粒样品作为供试品(颗粒约10g),加热水200ml,搅拌5分钟,观察颗粒溶解情况。
[0067]
表4溶化性
[0068][0069][0070]
体外培育牛黄药物组合物颗粒的性状、粒度、水分和溶化性检查结果表明:实施例1,2,3制备得到的颗粒剂较对照例1,2,3,4均有成型率高,流动性好,溶化率大,吸湿性小,色泽好,口感好的特点。
[0071]
三、体外培育牛黄药物组合物颗粒的抗惊厥药效评价
[0072]
1、实验方法
[0073]
1.1实验动物选取
[0074]
取健康sd幼年大鼠若干只,体重在40~50g,雌雄各半,进行热水浴试验,温度为47℃,在5min内大鼠发生惊厥即选为试验大鼠,选出的60只合适的大鼠,随机分为模型组及中药组(体外培育牛黄药物组合物颗粒实施例3)低、中、高剂量组。
[0075]
1.2热性惊厥模型
[0076]
于热性惊厥试验前1h分别用注射用水、组合物颗粒8g/kg
·
d、组合物颗粒12g/kg
·
d和组合物颗粒16g/kg
·
d灌胃(中药低、中、高剂量组均选取实施例3制备的颗粒),然后进行47℃热水浴试验,每天惊厥1次,共惊厥3d。观察每组大鼠惊厥潜伏期、惊厥持续时间、惊厥级别。惊厥潜伏期指大鼠放入热水中即刻至发生惊厥的时间,记录单位为秒(s)。惊厥持续时间指大鼠由刚开始发生惊厥至惊厥停止的时间,记录单位为秒(s)。本项实验以幼年大鼠5级惊厥为惊厥发作。大鼠惊厥判断标准:0级:无惊厥;1级:面部抽动;2级:点头;3级:前肢阵挛抽搐;4级:全身强直;5级:全身强直阵挛。
[0077]
1.3水迷宫实验
[0078]
于正式实验的第2天至第4天,每天进行两次获得性训练,记录大鼠找到水平台的时间;在正式实验第4天进行空间探索实验,早晚各进行1次,记录总泳程时间、通过目的象限的频率,取平均值。
[0079]
1.4热性惊厥后大鼠脑组织检测
[0080]
1.4.1、厥构建后24小时处死大鼠取血、取脑组织,留取海马标本,用酶联免疫吸附法(elisa法)检测血清及海马组织中tnf
‑
α、il
‑
6、il
‑
10的水平,脑组织脑源性神经营养因子水平(bdnf),以及脑组织基金金属蛋白酶(mmp9)水平。酶标仪法脑组织超氧化物歧化酶(sod)、过氧化氢酶(cat)。
[0081]
1.4.2、大鼠海马体e染色病理和尼式染色。
[0082]
1.4.3、tunel检测海马部位凋亡荧光。
[0083]
1.4.4、解剖大鼠后western blot法检测海马部位:内质网应激状态:磷酸化
‑
ire1α,磷酸化perk,atf6,atf4;
[0084]
1.4.5、测炎症反应状态:nrf
‑
2,ho
‑
1和凋亡相关通路蛋白表达情况:bcl
‑
2,bax,cleaved
‑
caspase
‑
3,caspase
‑
9及内质网应激相关凋亡因子chop。
[0085]
2、实验结果
[0086]
2.1热性惊厥实验结果
[0087]
成功建立了大鼠热惊厥动物模型(见表5)。由图1可知,中药组(体外培育牛黄药物组合物颗粒实施例3)出现惊厥的时间晚于模型组,且用药剂量越大组,出现惊厥的时间越晚,惊厥持续时间越短,惊厥等级越低。由图2可知,与模型组相比,中药组随着用药量的增加,在热性惊厥实验中大鼠的存活率也逐渐增大。说明体外培育牛黄药物组合物颗粒实施例3能延后大鼠热性惊厥出现的时间,减小热性惊厥的时间,降低热性惊厥的等级,进而提高了大鼠在热性惊厥试验后的存活率。
[0088]
表5大鼠惊厥评分表
[0089]
[0090]
[0091][0092]
2.2水迷宫及空间探索实验结果
[0093]
水迷宫实验结果显示,大鼠在惊厥期内随着训练天数的增加,大鼠找到水平台的潜伏期呈倍数减小,且在训练的第2、3天,中药高剂量组的大鼠找到平台的潜伏期均比低、中剂量组和模型组的大鼠小(见表6)。
[0094]
表6水迷宫实验各组大鼠惊厥情况比较
[0095][0096]
空间探索实验结果显示,与模型组相比,低、中、高剂量组大鼠游泳时间和穿越平台的次数均大于模型组,穿越次数依次为低剂量组<中剂量组<高剂量组(见表7)。
[0097]
表7四组大鼠水平台区域游泳时间及水平台面积穿越次数比较
[0098]
[0099]
2.3热性惊厥实验后大鼠生理变化
[0100]
2.3.1、热性惊厥后大鼠血液、脑组织中各项因子表达情况
[0101]
参见图5,其中,a为tnf
‑
a促炎症因子表达变化结果(逐渐降低);b为il
‑
6促炎症因子表达变化结果(逐渐降低);c为mmp
‑
9促炎症因子表达变化结果(逐渐降低);d为il
‑
10抑炎因子表达变化结果(逐渐升高);e为bdnf保护性因子表达变化结果(逐渐升高);f为sod抗氧化因子表达变化结果(逐渐升高);g为cat保护性因子表达变化结果(逐渐升高);由图5可知,各组大鼠在惊厥试验后,与模型组相比,脑组织中促炎症因子均高于实施例3低、中、高剂量组,且随用药剂量的增加,促炎症因子的水平越低。反之,大鼠脑组织中抑炎性因子(il
‑
10)、保护因子(cat、bdnf)和抗氧化因子(sod)均低于中药低、中、高剂量组,中药剂量越大的组,促炎症因子的水平越高。通过该实验可知,体外培育牛黄药物组合物能有效降低大鼠脑组织中促炎症因子的表达,增加了抑炎症因子和保护因子的表达,从而保护大鼠脑组织不受损伤。
[0102]
2.3.2、e染色病理和尼氏小体染色检查体惊厥大鼠的海马神经元损伤
[0103]
由图6可知,各组大鼠在惊觉试验后,通过普通病理染色,发现模型组神经元细胞数大量破裂且数量减少,中药组的神经元细胞被破坏程度均比模型组小。
[0104]
表8尼氏小体面积和光密度(od值)
[0105][0106][0107]
由表8可知,尼式染色后中药组的尼式小体面积和光密度均高于模型组,且随用药量的增加尼式小体面积和光密度值均增加。通过该实验可知,体外培育牛黄药物组合物能有效减小热性惊厥对大鼠海马体的损伤。
[0108]
2.3.3 tunel荧光检测海马部位凋亡情况
[0109]
模型组和中药组大鼠在惊觉试验后,tunel荧光检测海马体细胞凋亡情况,与模型组相比,中药组大鼠海马体细胞凋亡数量要小于模型组,且海马体细胞凋亡数量依次为模型组>中药低>中药中>中药高。
[0110]
2.3.4、western blot检测内质网应激状态
[0111]
模型组和中药高剂量组大鼠在惊觉试验后,通过western blot检测海马体中atf
‑
6、p
‑
ire1α、p
‑
perk和chop的表达。由图7可知,中药高剂量组的大鼠atf
‑
6、p
‑
ire1α、p
‑
perk及chop均低于模型组,且表达量均低于模型组的1/4。
[0112]
2.3.5、检测炎症反应状态结果
[0113]
模型组和中药高剂量组大鼠在惊觉试验后,通过western blot检测线粒体中bcl
‑
2、bax、cleaved
‑
cas
‑
3、caspase
‑
9、nrf
‑
2和ho
‑
1表达。由图8可知模型组的cleaved
‑
cas
‑
3,caspase
‑
9和bax表达量高于中药高剂量组,bcl
‑
2的表达低于中药高剂量组。说明体外培育
牛黄药物组合物能阻碍cleaved
‑
cas
‑
3和caspase
‑
9通路,从而是诱导凋亡因子bax表达降低,抗凋亡因子bcl
‑
2的表达增加。
[0114]
由图9可知,中药高剂量组的nrf
‑
2和ho
‑
1的表达量均低于模型组,说明体外培育牛黄药物组合物能有效阻碍促凋亡因子nrf
‑
2和ho
‑
1的表达。
[0115]
通过western blot检测线粒体中bcl
‑
2、bax、cleaved
‑
cas
‑
3、caspase
‑
9、nrf
‑
2和ho
‑
1表达,进一步证实体外培育牛黄药物组合物能够减小大鼠在热性惊觉对神经元细胞损伤。
[0116]
2.4结论:
[0117]
1、体外培育牛黄药物组合物对大鼠热性惊厥具有抑制作用;其中高剂量组抗惊厥等级评分明显高于中低剂量组和模型组。
[0118]
2、体外培育牛黄药物组合物对热性惊厥大鼠脑细胞和神经元具有一定的保护作用;
[0119]
3、内质网应激作为机体的一种应对外界刺激的方式,在惊厥发病过程中脑部尤以海马部位的细胞受到的刺激最大,最容易对该刺激产生反应,故药效实验将海马部位研究中心。内质网应激主要通过atf
‑
6/ire1α和perk三条分支发挥传导信号的作用,其中perk和ire1α可以激活促凋亡因子chop直接导致凋亡;另外内质网应激释放内质网内的钙离子,然后经由perk介导内质网和线粒体形成mam结构直接将内质网的钙离子“经过mam注射”至线粒体中,钙离子扰乱线粒体呼吸链和atp代谢过程进而产生氧化应激以应对此种刺激,持续的钙离子进入线粒体导致激活caspase
‑
3和caspase
‑
9通路进而诱导促凋亡因子bax和降低抗凋亡因子bcl
‑
2,最终的结果是导致收刺激细胞(海马细胞)凋亡。大量的海马细胞凋亡坏死会加重惊厥后遗症。
[0120]
本研究的结果表明:体外培育牛黄药物组合物可以主要通过抑制惊厥大鼠模型脑部海马部位的内质网应激
‑
chop
‑
caspas相关通路抑制海马细胞凋亡进而保护脑细胞,抑制惊厥后的损伤。
[0121]
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。