一种非洲猪瘟病毒p30阻断elisa抗体检测试剂盒及其应用
技术领域
1.本发明属于生物检测技术领域,更具体地,本发明涉及一种非洲猪瘟p30阻断elisa抗体检测试剂盒及其应用,适用于非洲猪瘟抗体的特异、快速、准确检测。
背景技术:
2.非洲猪瘟(african swine fever,asf)是由非洲猪瘟病毒(african swine fever virus,asfv)引起的猪的一种急性、烈性、高度接触传染性疾病。非洲猪瘟在临床症状上与猪瘟极为相似,以高热、高死亡率、全身广泛性出血、呼吸障碍以及神经功能紊乱为主要特征,病死率高达100%。我国将其列为一类动物传染病。非洲猪瘟1921年于肯尼亚发现,2007年传入高加索地区和俄罗斯,2014年已传入东欧大部分国家,流行趋势扩大,2018年,我国首例非洲猪瘟在沈阳确诊并迅速蔓延,给我国养猪业造成巨大经济损失。
3.非洲猪瘟病毒是一种由囊膜包裹的双股线性dna病毒。不同毒株基因组大小存在些许差异,长度介于170
‑
190kb之间,有150多个主要开放阅读框,可编码150~200种蛋白质,其中结构蛋白为54种。其中p30蛋白是asfv的主要结构蛋白,由cp204l基因编码,也被称为p32蛋白,该蛋白有很强的抗原性,能诱导机体产生中和抗体,通常被用做诊断抗原。非洲猪瘟病毒p30蛋白是病毒感染早期产生的蛋白,以此为基础的抗体检测方法可在病毒感染早期就实现有效检测。
4.由于对asfv的生物学特性研究不充分,目前还没有研发出针对非洲猪瘟特别有效的疫苗,对非洲猪瘟的防控主要依赖于动物检疫,但非洲猪瘟与猪瘟临床症状极为相似且作为我国的新发病,国内相应的检测产品尚属于空白状态,因此研发出一款简便、快捷、高效的检测试剂变得尤为重要。
5.酶联免疫吸附试验(enzyme
‑
linked immunosorbentassays,elisa)是市场上主流的免疫测定技术,已广泛应用于临床检测,快速便捷且灵敏度高,且不需要特殊的仪器设备,可用于非洲猪瘟病毒的抗体检测。
技术实现要素:
6.本发明获得了具有较好反应原性及免疫原性的可溶性p30蛋白,以该蛋白免疫balb/c小鼠,通过细胞融合和亚克隆筛选,获得了一株特异性单抗;分析抗体序列,构建并表达p30特异性单抗,以避免抗体生产过程中,杂交瘤细胞抗体分泌不稳定以及腹水制备批次间存在差异的问题,能够保证抗体供应高效、稳定;研发出基于抗非洲猪瘟病毒p30蛋白特异性单克隆抗体的阻断elisa抗体检测方法,解决了间接elisa方法特异性较差的问题,使得该试剂盒具有很好的敏感性和特异性。
7.基于此,本发明的目的在于提供一种敏感性高、特异性强、能够快速、简便地检测非洲猪瘟病毒p30抗体的阻断elisa试剂盒。
8.该试剂盒的优点之一是使用了辣根过氧化物酶(hrp)标记的抗非洲猪瘟病毒p30蛋白的单克隆抗体,提高了检测的敏感性和特异性。
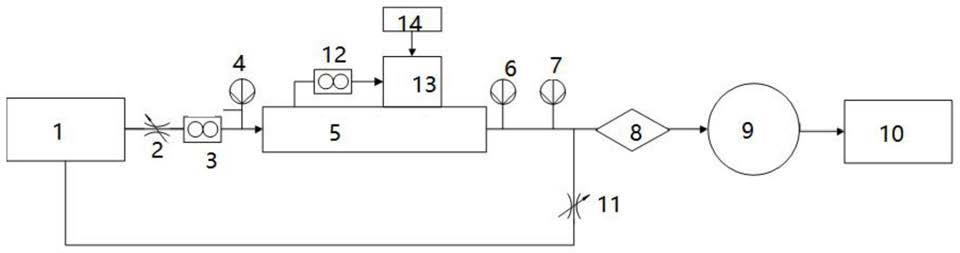
9.基于上述目的,本发明的非洲猪瘟病毒p30阻断elisa抗体检测试剂盒,包括以非洲猪瘟病毒p30蛋白为包被抗原的的酶联反应板和酶标抗体;所述酶标抗体为与非洲猪瘟病毒p30蛋白特异性结合的单克隆抗体(6g10)制成的酶标抗体。所述酶标抗体优选为经辣根化物酶标记抗体,所述辣根过氧化物酶可通过戊二醛法或过碘酸法交联在抗体上。
10.优选的,所述非洲猪瘟p30蛋白的序列为序列表中seq id no.5序列,为密码子优化后序列,构建入原核表达载体pet
‑
28a,该蛋白为利用大肠杆菌原核表达系统获得的可溶性p30纯化蛋白,具有良好的特异性、敏感性及免疫原性。
11.优选的,与非洲猪瘟病毒p30蛋白特异性结合的单克隆抗体含有重链可变区6g10
‑
v
h
和轻链可变区6g10
‑
v
l
;所述重链可变区6g10
‑
v
h
和轻链可变区6g10
‑
v
l
均由决定簇互补区和框架区组成;所述6g10
‑
v
h
和所述6g10
‑
v
l
的决定簇互补区均由cdr1、cdr2和cdr3组成;所述6g10
‑
v
h
的cdr1的氨基酸序列如seq id no.1的第26~30位氨基酸所示;所述6g10
‑
v
h
的cdr2的氨基酸序列如seq id no.1的第48~63位氨基酸所示;所述6g10
‑
v
h
的cdr3的氨基酸序列如seq id no.1的第102~111位氨基酸所示;所述6g10
‑
v
l
的cdr1的氨基酸序列如seq id no.2的第24~40位氨基酸所示;所述6g10
‑
v
l
的cdr2的氨基酸序列如seq id no.2的第56~62位氨基酸所示;所述6g10
‑
v
l
的cdr3的氨基酸序列如seq id no.2的第95~102位氨基酸所示。
12.优选的,所述6g10
‑
v
h
的氨基酸序列如序列表中seq id no.1的第1~119位所示;其6g10
‑
v
l
的氨基酸序列如序列表中seq id no.2的第1~113位所示。
13.所述酶联反应板的最佳包被制备方法及条件是将所述非洲猪瘟病毒p30蛋白溶于100μl的ph 9.6的碳酸盐溶液,然后加到96孔聚苯乙烯酶联反应板,每孔0.1μg~1μg非洲猪瘟病毒p30蛋白,2~8℃下放置8~12小时,使包被抗原与酶联反应板充分结合,然后按照300μl/孔加入含有10mg/ml牛血清白蛋白ph7.4的pbs缓冲液,37℃封闭处理2~3小时,甩干后,待酶联反应板干燥后4℃密封保存。
14.优选的,所述试剂盒还包括阳性对照血清和阴性对照血清,所述阳性对照血清为用p30重组蛋白免疫后的猪血清;所述阴性对照血清为无特定病原体且无疫苗接种的猪血清。
15.更进一步的,所述试剂盒还包括样品稀释液、20倍浓缩洗涤液、底物液a、底物液b、终止液。所述酶联反应板为可拆卸96孔酶标板。所述样品稀释液为含有5mg/ml酪蛋白的0.01m、ph值为7.4的磷酸盐缓冲液。所述20倍浓缩洗涤液为含有浓度为0.8%~1.2%(ml/ml)的tween
‑
20的0.01m,ph值为7.4的磷酸盐缓冲液。所述底物液a为含0.6mg/ml过氧化氢尿素的柠檬酸磷酸盐缓冲液,所述底物液b为0.2mg/ml的四甲基联苯胺溶液,使用时两者以1:1的比例混合。所述终止液为2mol/l的硫酸溶液。
16.本发明还要求保护单克隆抗体,其可与非洲猪瘟病毒特异性结合,是下述任意一项所述的单克隆抗体:
17.1)含有重链可变区6g10
‑
v
h
和轻链可变区6g10
‑
v
l
;所述重链可变区6g10
‑
v
h
和轻链可变区6g10
‑
v
l
均由决定簇互补区和框架区组成;所述6g10
‑
v
h
和所述6g10
‑
v
l
的决定簇互补区均由cdr1、cdr2和cdr3组成;所述6g10
‑
v
h
的cdr1的氨基酸序列如seq id no.1的第26~30位氨基酸所示;所述6g10
‑
v
h
的cdr2的氨基酸序列如seq id no.1的第48~63位氨基酸所示;所述6g10
‑
v
h
的cdr3的氨基酸序列如seq id no.1的第102~111位氨基酸所示;所述
6g10
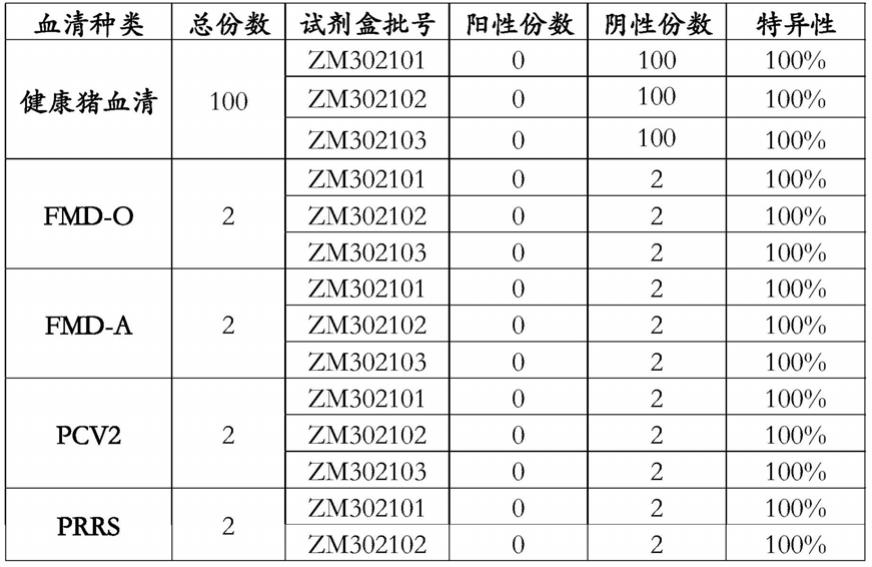
‑
v
l
的cdr1的氨基酸序列如seq id no.2的第24~40位氨基酸所示;所述6g10
‑
v
l
的cdr2的氨基酸序列如seq id no.2的第56~62位氨基酸所示;所述6g10
‑
v
l
的cdr3的氨基酸序列如seq id no.2的第95~102位氨基酸所示。
18.2)含有重链可变区6g10
‑
v
h
和轻链可变区6g10
‑
v
l
;所述6g10
‑
v
h
的氨基酸序列如序列表中seq id no.1的第1~119位所示;其6g10
‑
v
l
的氨基酸序列如序列表中seq id no.2的第1~113位所示。
19.通过上述重链可变区和轻链可变区序列,可以与动物源恒定区(如鼠抗体重链和轻链恒定区)连接,制备得到可与非洲猪瘟病毒特异性结合的单克隆抗体。
20.上述酶联免疫试剂盒在非洲猪瘟病毒p30阻断抗体检测中的应用也属于本发明的保护范围。
21.上述可以与非洲猪瘟毒特异性结合的单克隆抗体在制备检测非洲猪瘟病毒的试剂盒中的应用也是本发明的保护范围。特别是在制备检测非洲猪瘟病毒抗体的试剂盒中的应用。
22.上述非洲猪瘟病毒p30蛋白为利用大肠杆菌原核表达系统表达获得的非洲猪瘟病毒p30可溶性纯化蛋白,可包括下述步骤:
23.1)基因序列的合成、表达载体的构建:根据genbank报道(mk238347.1)毒株的p30基因序列,加入his标签,并在p30基因的5’和3’分别插入nde
ꢀⅰ
和xho
ꢀⅰ
两个酶切位点,经大肠杆菌密码子优化后合成,合成基因构建在pet
‑
28a( )载体中,对插入质粒的目的片段进行测序鉴定。
24.2)质粒转化及阳性菌株筛选:将构建好的质粒转化bl21(de3)感受态,将1μl质粒加入100μl感受态,轻轻震荡混匀,冰浴30min,45℃热激45s,冰浴3min,加入700μl无抗lb培养基,37℃,200rpm培养1h,取部分培养基涂布于卡纳抗性的lb平板,37℃培养过夜。挑取菌落进行培养,送往测序公司对插入的目的片段进行测序,比对后筛选出测序无误菌株。
25.3)蛋白的诱导表达:接种阳性菌株于卡纳抗性lb培养基,37℃,200rpm过夜培养作为种子液,第二天以1:100的比例加入卡纳抗性lb培养基,当培养基od600达到0.6~0.8时,加入终浓度为0.5mm的iptg,37℃诱导表达4h。
26.4)菌体收集及破碎:菌液4000rpm离心30min,弃上清,用pbs按照1:10的比例重悬菌体。超声破碎菌体,超声破碎仪参数设置为:功率190w,工作5s,关闭10s,超声15min。离心后收集破碎上清。
27.5)蛋白纯化:用0.22μm滤膜过滤细菌破碎上清后备用。20mmol/l tris 150mmol/l nacl ph8.0溶液平衡his柱,然后细菌破碎上清挂柱,以不同浓度的咪唑溶液洗脱,进行亲和层析纯化并鉴定,进而获得纯化的非洲猪瘟病毒p30蛋白。
28.上述的可以与非洲猪瘟病毒p30蛋白及非洲猪瘟病毒特异性结合的单克隆抗体的获得方法如下:按照本领域已知的常规方法筛选本发明非洲猪瘟病毒特异性单克隆细胞株,再采用基因测序的方法测定特异性单克隆细胞株的基因序列,利用基因合成,构建重组表达载体的方法制备稳定表达的单克隆抗体作为本发明的酶标单克隆抗体。具体来讲,本发明非洲猪瘟病毒的特异性单克隆抗体的获得方法,可包括下述步骤:
29.1)以大肠杆菌原核表达系统表达并纯化的p30蛋白为免疫原;
30.2连续免疫4次,每次间隔14天,前3次采用多点皮下免疫方式,第4次采取腹腔注射
的免疫方式,每次10μg/只动物;
31.3)分离免疫动物的脾细胞,将其与骨髓瘤细胞进行融合,用hat选择性培养基筛选杂交瘤细胞,对杂交瘤细胞上清用间接elisa方法进行筛选特异性阳性克隆。当被免疫动物的血清抗体水平用间接elisa进行检测效价超过1:50000时,可分离动物的脾细胞并制备成单细胞悬液,并在适当的融合剂(如聚乙二醇)的诱导下与骨髓瘤细胞(优选为小鼠骨髓瘤细胞sp2/0)融合以形成杂交瘤;经检测,优选单克隆细胞株分泌的6g10能够特异性与非洲猪瘟病毒p30蛋白反应。
32.4)特异性阳性克隆杂交瘤细胞株总rna提取:取杂交瘤细胞悬液250μl,加入750μl的trizol,上下颠倒混匀,加入200μl的氯仿,混匀,4℃12000rpm离心15min。吸取上清至新的1.5ml ep管中,加入600μl的异丙醇,混匀离心10min。将异丙醇弃去,用75%的depc乙醇洗涤,离心。将乙醇弃去,烘干,用20μl无rna酶水溶解rna。
33.5)反转录、pcr扩增及基因测序:利用invitrogen反转录试剂盒按说明书进行反转录,获得杂交瘤细胞的cdna。针对重链(vh
‑
1:5
’‑
gtgaattcatgcaggtgcagctgttggagtctgg
‑3’
;vh
‑
2:5
’‑
atgtcgactgaggagacggtgaccagggtgcc
‑3’
)和轻链(vl
‑
1:5
’‑
gtgaattcatggacattgtgatgacccagtctcc
‑3’
;vl
‑
2:5
’‑
cagtcgacttacgtttgatctccagcttggtccc
‑3’
)可变区设计通用引物,利用扩增引物对目的片段进行扩增,扩增完后胶回收片段,然后连接载体进行序列测定,获取单克隆抗体重链和轻链可变区序列信息。
34.6)特异性单克隆抗体的基因序列的合成、穿梭载体的构建、重组bacmid的筛选与提取、重组杆状病毒的拯救:
①
基因序列的合成:根据已测得单抗6g10的重链和轻链可变区的序列,将鼠抗体重链和轻链恒定区的序列补充在可变区部分,然后进行基因序列的合成,并进行昆虫细胞密码子优化。
②
穿梭载体的构建:根据重链和轻链的序列信息以及pfastbacdual载体序列信息,构建穿梭载体,pfastbacdual载体含有两个启动子,即ph启动子和p10启动子,连入载体后进行序列测定确保序列的准确性。
③
重组bacmid的筛选与提取:将构建好的穿梭载体转化dh10bac感受态,然后涂布三抗平板(卡那霉素、庆大霉素、四环霉素),37℃培养箱培养48h后挑取白斑,进行鉴定,阳性克隆目的片段大小为4600bp,阴性克隆为300bp,选取完全无300bp条带的克隆菌摇菌,12h后采用异丙醇沉淀法进行bacmid的提取,然后利用nanodrop进行浓度测定。
④
重组杆状病毒的拯救:转染前将密度为2
×
106的sf9细胞铺六孔板,重组bacmid按5μg和2.5μg的量进行转染,转染试剂用量为8μl,转染后4~6h进行换液,28℃培养,72h后收获扩增p2代病毒,采用同样方法进行p3代病毒扩增。p4代病毒的扩增采取摇瓶扩增,病毒接种比例为1:100。
35.7)特异性单克隆抗体的表达与纯化:将p4代病毒按1:5的比例接种密度为2
×
106的hi5细胞,28℃培养,48h后收获细胞,8000r/min离心1h取上清,然后用0.22μm滤膜过滤备用。用na3po
4 ph值为7.0溶液平衡proteina预装柱,平衡3~5个柱体积,然后将细胞上清结合proteina预装柱,样品结合完后用glycine
‑
hcl ph值为3.0洗脱液进行洗脱,即获得纯化的抗非洲猪瘟病毒p30蛋白特异性单克隆抗体6g10。
36.本发明试剂盒的检测程序为:
37.1)平衡:将试剂盒从冷藏环境中取出,置室温平衡30min备用;液体试剂用前混匀。
38.2)配液:将浓缩洗涤液用蒸馏水或去离子水20倍稀释得到洗涤缓冲液;
39.3)样品稀释:在血清稀释板中将待检血清用样品稀释液进行2倍稀释,阴、阳性对
照血清已稀释,可直接使用。
40.4)加样:取出所需板条,剩余板条装入铝箔袋中封好,置于2~8℃保存备用。将稀释好的待检血清、阴性对照血清和阳性对照血清加入到抗原包被板中,100μl/孔。每份待检血清设1孔,阴性对照和阳性对照各设2孔,加样过程时间跨度应尽量短。如图1所示加样:n:表示加阴性对照血清;p:表示加阳性对照血清;s1、s2、s3、s4等表示加各待检血清。
41.5)温育:震荡混匀,置37℃温箱中,反应60min。
42.6)洗板:弃去反应液,每孔加300μl稀释后的洗涤缓冲液,浸泡15s,甩弃洗液,连续洗板4次后拍干。
43.7)加酶:各孔加入辣根过氧化物酶标记的单克隆抗体100μl(浓度为0.5ug/ml)。
44.8)温育:置37℃温箱,反应30min。
45.9)洗板:弃去反应液,每孔加入稀释后的洗涤缓冲液300μl,浸泡15s,甩弃洗涤液,连续洗板4次后拍干。
46.10)显色:每孔加入100μl底物工作液(将底物液a和底物液b等量混合即为底物工作液,现用现配),震荡混匀,置37℃温箱中,避光反应15min。
47.11)每孔加入显色终止液50μl,振荡混匀终止反应,15分钟内测定结果。
48.12)试验成立条件:阴性对照od
450nm
值均应≥1.0。阳性对照孔s/n值应≤0.5。
49.13)判定:在酶标仪上测各孔od
450nm
值。s/n=样本od
450nm
值/阴性对照od
450nm
值。通过计算每个样品的s/n值,判定其抗体的有无。阴性:s/n≥0.7;可疑0.6<s/n<0.7;阳性s/n≤0.6。
50.本发明的积极效果在于:本发明提供了非洲猪瘟病毒抗体检测的酶联免疫检测试剂盒。该试剂盒是采用非洲猪瘟病毒p30纯化蛋白和抗非洲猪瘟病毒p30蛋白特异性单克隆抗体制备的阻断法酶联免疫抗体检测试剂盒,可通过检测酶催化底物产生的信号变化来测定样品中非洲猪瘟病毒特异性抗体的含量,且与目前其他病原如猪口蹄疫病毒o型、猪口蹄疫病毒a型、猪圆环病毒、猪繁殖与呼吸综合征病毒阳性血清均不发生交叉反应。
51.综上所述,本试剂盒采用非洲猪瘟病毒p30纯化蛋白和抗非洲猪瘟病毒p30蛋白特异性单克隆抗体制备的阻断法酶联免疫抗体检测试剂盒,灵敏度高、特异性强,可以有效地检测样品中非洲猪瘟病毒抗体的含量,与进口试剂盒符合率达95%以上,具有广阔的市场前景和良好的经济、社会效益。
附图说明
52.图1为本发明试剂盒酶联免疫板加样示意图。
具体实施方式
53.下述实施例中的方法,如无特别说明,均为常规方法。
54.实施例中描述到的各种生物材料的取得途径仅是提供一种实验获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和伦理道德可获取的生物材料都可按照实施例中的提示替换使用。
55.实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的
操作过程,实施例将有助于理解本发明,但是本发明的保护范围不限于下述的实施例。
56.实施例1、制备非洲猪瘟病毒p30纯化蛋白
57.包括下述步骤:
58.上述非洲猪瘟病毒p30蛋白为利用大肠杆菌原核表达系统表达获得的非洲猪瘟病毒p30可溶性纯化蛋白,可包括下述步骤:
59.1)根据genbank报道(mk238347.1)的p30基因序列,加入his标签,并在p30基因的5’和3’分别插入ndeⅰ和xhoⅰ两个酶切位点,经大肠杆菌密码子优化后合成,合成基因构建在pet
‑
28a( )载体中,对插入质粒的目的片段进行测序鉴定。
60.2)将构建好的质粒转化bl21(de3)感受态,将1μl质粒加入100μl感受态,轻轻震荡混匀,冰浴30min,45℃热激45s,冰浴3min,加入700μl无抗lb培养基,37℃,200rpm培养1h,取部分培养基涂布于卡纳抗性的lb平板,37℃培养过夜。挑取菌落进行培养,送往测序公司对插入的目的片段进行测序,比对后筛选出测序无误菌株。
61.3)接种阳性菌株于卡纳抗性lb培养基,37℃,200rpm过夜培养作为种子液,第二天以1:100的比例加入卡纳抗性lb培养基,当培养基od600达到0.6~0.8时,加入终浓度为0.5mm的iptg,37℃诱导表达4h。
62.4)菌液4000rpm离心30min,弃上清,用pbs按照1:10的比例重悬菌体。超声破碎菌体,超声破碎仪参数设置为:功率190w,工作5s,关闭10s,超声15min。离心后收集破碎上清。
63.5)用0.22μm滤膜过滤细菌破碎上清后备用。20mmol/l tris 150mmol/lnacl ph8.0溶液平衡his柱,然后细菌破碎上清挂柱,以不同浓度的咪唑溶液洗脱,进行亲和层析纯化并鉴定;通过分子筛对蛋白进行凝胶过滤层析纯化并鉴定,进而获得纯化的非洲猪瘟病毒p30蛋白(序列5)。
64.实施例2、非洲猪瘟病毒p30蛋白特异性杂交瘤细胞株的筛选
65.非洲猪瘟病毒p30蛋白特异性杂交瘤细胞株的筛选,包括以下步骤:
66.1)以实施例1获得的p30蛋白为免疫原,免疫动物为balb/c小鼠(购自北京维通利华实验动物技术有限公司),连续免疫4次,每次间隔14天,前3次采用多点皮下免疫方式,第4次采取腹腔注射的免疫方式,每次每只小鼠注射p30蛋白10μg;
67.2)末次免疫后7天,取小鼠尾血分离血清后,用间接elisa进行检测,效价>1:50000后,分离免疫动物的脾细胞,将其与生长状态良好的骨髓瘤细胞sp2/0进行融合,用hat选择性培养基筛选获得杂交瘤细胞;
68.3)对杂交瘤细胞上清用间接elisa方法进行筛选特异性阳性克隆,经检测,最终获得分泌6g10的单克隆细胞株能够特异性与非洲猪瘟病毒p30蛋白反应。具体操作步骤:非洲猪瘟病毒p30蛋白溶于100μl的ph 9.6的碳酸盐溶液稀释浓度至2μg/ml,然后加到96孔聚苯乙烯酶联反应板,每孔100μl,2~8℃下放置8~12小时,使特异性单克隆抗体与酶联反应板充分结合,然后按照300μl/孔加入含有10mg/ml牛血清白蛋白ph7.4的pbs缓冲液,37℃封闭处理2~3小时,甩干后,待酶联反应板干燥后用铝箔纸进行封袋,置2~8℃保存备用。
69.取细胞培养上清加入包被有p30纯化蛋白的酶标板中,37℃反应30分钟,用洗涤液(含有浓度为0.8%~1.2%(ml/ml)的tween
‑
20的0.01m,ph值为7.4的磷酸盐缓冲液,使用时用双蒸水稀释20倍。)洗板4次,拍干后,向每孔加入1:5000稀释的兔抗鼠igg
‑
hrp标记物(购自美国sigma公司),37℃反应30分钟,用洗涤液4次,拍干后,向每孔加入底物液a(为含
0.6mg/ml过氧化氢尿素的柠檬酸磷酸盐缓冲液)和底物液b(为0.2mg/ml的四甲基联苯胺溶液)各50μl底物工作液,37℃避光反应15分钟。向每孔加入50μl终止液(2mol/l的硫酸溶液),振荡混匀终止反应。15分钟内测定每孔的od
450nm
值。以吸光度值>阴性对照(即洗板培养液)
×
2.1倍为阳性判定标准,测定细胞培养上清中特异性单克隆抗体效价,最后获得1株特异性细胞克隆,与非洲猪瘟病毒p30蛋白有强烈信号反应,将这株编号为6g10。
70.实施例3、抗非洲猪瘟病毒p30蛋白特异性单克隆抗体重组表达系统的建立及单克隆抗体的纯化
71.非洲猪瘟病毒p30蛋白的特异性杂交瘤细胞株的基因测序、单克隆抗体重组表达系统的建立及单克隆抗体的纯化,包括以下步骤:
72.1)特异性阳性克隆杂交瘤细胞株总rna提取、反转录、pcr及序列测定:
73.①
总rna提取:取杂交瘤细胞悬液250μl,加入750μl的trizol,上下颠倒混匀,加入200μl的氯仿,混匀,4℃12000rpm离心15min。吸取上清至新的1.5ml ep管中,加入600μl的异丙醇,混匀离心10min。将异丙醇弃去,用75%的depc乙醇洗涤,离心。将乙醇弃去,烘干,用20μl无rna酶水溶解rna。
74.②
反转录:利用invitrogen反转录试剂盒按说明书进行反转录,获得杂交瘤细胞的cdna。
75.③
pcr反应及其产物的克隆测序:针对重链和轻链可变区设计通用引物,序列信息如下:
76.表1重链及轻链可变区通用引物
77.名称序列(5
’‑3’
)v
h
‑
1(正向)gtgaattcatgcaggtgcagctgttggagtctggv
h
‑
2(反向)atgtcgactgaggagacggtgaccagggtgccv
l
‑
1(正向)gtgaattcatggacattgtgatgacccagtctccv
l
‑
2(反向)cagtcgacttacgtttgatctccagcttggtccc
78.利用扩增引物对目的片段进行扩增,扩增完后胶回收片段,然后连接载体进行序列测定,获取单克隆抗体重链和轻链可变区序列信息。
79.单克隆抗体6g10含有重链可变区6g10
‑
v
h
、轻链可变区6g10
‑
v
l
,其6g10
‑
v
h
的氨基酸序列如序列表中seq id no.1的第1~119位所示;其6g10
‑
v
l
的氨基酸序列如序列表中seq id no.2的第1~113位所示。
80.所述重链可变区6g10
‑
v
h
和轻链可变区6g10
‑
v
l
均由决定簇互补区和框架区组成;所述6g10
‑
v
h
和所述6g10
‑
v
l
的决定簇互补区均由cdr1、cdr2和cdr3组成;所述6g10
‑
v
h
的cdr1的氨基酸序列如seq id no.1的第26~30位氨基酸所示;所述6g10
‑
v
h
的cdr2的氨基酸序列如seq id no.1的第48~63位氨基酸所示;所述6g10
‑
v
h
的cdr3的氨基酸序列如seq id no.1的第102~111位氨基酸所示;所述6g10
‑
v
l
的cdr1的氨基酸序列如seq id no.2的第24~40位氨基酸所示;所述6g10
‑
v
l
的cdr2的氨基酸序列如seq id no.2的第56~62位氨基酸所示;所述6g10
‑
v
l
的cdr3的氨基酸序列如seq id no.2的第95~102位氨基酸所示。
81.2)特异性单克隆抗体的基因序列的合成及重组表达系统的建立
82.①
基因序列的合成:根据已测得单抗6g10的重链和轻链可变区的序列,将鼠抗体重链和轻链恒定区的序列补充在可变区部分,然后进行基因序列的合成,并进行昆虫细胞
密码子优化,6g10重链可变区编码的核苷酸序列如序列表中seq id no.3所示,轻链可变区编码的核苷酸序列如序列表中seq id no.4所示。
83.②
穿梭载体的构建:根据重链和轻链的序列信息以及pfastbacdual(购自thermo fisher公司,货号10712024)载体序列信息,构建穿梭载体。
84.③
重组bacmid的筛选与提取:将构建好的穿梭载体转化dh10bac感受态,然后涂布三抗平板(卡那霉素、庆大霉素、四环霉素),37℃培养箱培养48h后挑取白斑,利用m13引物进行鉴定,阳性克隆目的片段大小为4600bp,阴性克隆为300bp,选取完全无300bp条带的克隆菌摇菌,12h后采用异丙醇沉淀法进行bacmid的提取,然后利用nanodrop进行浓度测定。
85.④
重组杆状病毒的拯救:转染前将密度为2
×
106的sf9细胞铺六孔板,重组bacmid按5μg和2.5μg的量进行转染,转染试剂用量为8μl,转染后4~6h进行换液,28℃培养,72h后收获扩增p2代病毒,采用同样方法进行p3代病毒扩增。p4代病毒的扩增采取摇瓶扩增,病毒接种比例为1:100。
86.3)特异性单克隆抗体的表达与纯化:将p4代病毒按1:5的比例接种密度为2
×
106的hi5细胞,28℃培养,48h后收获细胞,8000r/min离心1h取上清,然后用0.22μm滤膜过滤备用。用na3po
4 ph值为7.0溶液平衡proteina预装柱,平衡3~5个柱体积,然后将细胞上清结合proteina预装柱,样品结合完后用glycine
‑
hcl ph值为3.0洗脱液进行洗脱,即获得纯化的抗非洲猪瘟病毒p30蛋白特异性单克隆抗体6g10。
87.实施例4、制备非洲猪瘟病毒p30阻断elisa抗体检测试剂盒
88.1)用非洲猪瘟病毒p30蛋白制备抗原包被板:将p30蛋白用ph 9.6的碳酸盐溶液稀释成1μg/ml的包被工作液,然后加到96孔聚苯乙烯酶联反应板,100μl/孔,2~8℃下放置8~12小时,使包被抗原与酶联反应板充分结合,然后按照300μl/孔加入含有10mg/ml牛血清白蛋白ph7.4的pbs缓冲液,37℃封闭处理2~3小时,甩干后,待酶联反应板干燥后2~8℃密封保存。
89.2)制备辣根过氧化物酶标记的抗非洲猪瘟病毒p30蛋白特异性单克隆抗体
90.将抗非洲猪瘟病毒p30蛋白特异性单克隆抗体用戊二醛氧化法与辣根过氧化物酶(hrp)进行偶联,用ph7.4的pbs缓冲液充分透析,加等量的优质丙三醇,
‑
20℃以下保存。具体步骤如下:
91.①
将5mg hrp溶于0.2ml含有1.25%戊二醛的0.1mol/l ph值6.8的pbs缓冲液中,置室温偶联18个小时,充分透析出去多余戊二醛;
92.②
加生理盐水至1ml,然后加入2.5mg纯化的抗非洲猪瘟病毒p30蛋白特异性单克隆抗体及0.1mlph值9.6的1mol/l碳酸盐缓冲液,置于2~8℃放置24小时;
93.③
加入0.1ml 0.3mol/l的赖氨酸溶液,室温放置2小时;
94.④
用ph7.4的pbs缓冲液充分透析,通过离心除去沉淀,上清即为酶结合物。用酶标记物稀释液按一定比例稀释后即为酶标记物的工作液(0.5ug/ml)。
95.3)阳性对照血清:是以非洲猪瘟p30重组蛋白免疫后猪血清,作为试剂盒的阳性对照血清(1管,1.5ml/管)。
96.4)阴性对照血清:是无特定病原体(spf)猪血清,作为试剂盒的阴性对照血清(1管,1.5ml/管)。
97.5)样品稀释液的制备:为含有5mg/ml酪蛋白的0.01m、ph值为7.4的磷酸盐缓冲液,
1瓶(24ml/瓶)。
98.6)底物液a的制备为含0.6mg/ml过氧化氢尿素的柠檬酸磷酸盐缓冲液(1瓶,12ml/瓶)
99.7)底物液b的制备为0.2mg/ml的四甲基联苯胺(tmb)溶液(1瓶,12ml/瓶)。
100.8)20倍浓缩洗涤液的制备为含有浓度为1.0%(ml/ml)的tween
‑
20的0.01m,ph值为7.4的磷酸盐缓冲液(50ml/瓶,2瓶)。
101.9)终止液的制备2mol/l的硫酸溶液(1瓶,12ml/瓶)。
102.10)根据需要,试剂盒中还可以有样品稀释板(2块,96孔/块),用于样品的稀释。
103.实施例5、非洲猪瘟病毒p30阻断elisa抗体检测试剂盒的使用方法
104.1)平衡:将试剂盒从冷藏环境中取出,置室温平衡30min备用;液体试剂用前混匀。
105.2)配液:将浓缩洗涤液用蒸馏水或去离子水20倍稀释得到洗涤缓冲液;
106.3)样品稀释:在血清稀释板中将待检血清用样品稀释液进行2倍稀释,阴、阳性对照血清已稀释,可直接使用。
107.4)加样:取出所需板条,剩余板条装入铝箔袋中封好,置于2~8℃保存备用。将稀释好的待检血清、阴性对照血清和阳性对照血清加入到抗原包被板中,100μl/孔。每份待检血清设1孔,阴性对照和阳性对照各设2孔,加样过程时间跨度应尽量短。如图1所示加样:n:表示加阴性对照血清;p:表示加阳性对照血清;s1、s2、s3、s4等表示加各待检血清。
108.5)温育:震荡混匀,置37℃温箱中,反应60min。
109.6)洗板:弃去反应液,每孔加300μl稀释后的洗涤缓冲液,浸泡15s,甩弃洗液,连续洗板4次后拍干。
110.7)加酶:各孔加入实施例4中制备的酶标记物的工作液100μl。
111.8)温育:置37℃温箱,反应30min。
112.9)洗板:弃去反应液,每孔加入稀释后的洗涤缓冲液300μl,浸泡15s,甩弃洗涤液,连续洗板4次后拍干。
113.10)显色每孔加入100μl底物工作液(将底物液a和底物液b等量混合即为底物工作液,现用现配),震荡混匀,置37℃温箱中,避光反应15min。
114.11)每孔加入显色终止液50μl,振荡混匀终止反应,15分钟内测定结果。
115.12)试验成立条件:阴性对照od
450nm
值均应≥1.0。阳性对照孔s/n值应≤0.5。
116.13)判定:在酶标仪上测各孔od
450nm
值。s/n=样本od
450nm
值/阴性对照od
450nm
值。通过计算每个样品的s/n值,判定其抗体的有无。阴性:s/n≥0.7;可疑0.6<s/n<0.7;阳性s/n≤0.6。
117.实施例6、敏感性试验
118.使用按照实施例4的方法制备的3批非洲猪瘟病毒p30阻断elisa抗体检测试剂盒(批次zm302101、zm302102、zm302103),按照实施例5的使用方法对非洲猪瘟病毒感染猪血清62份进行检测,实验结果见表2,本发明的试剂盒共检测出62份,结果表明本试剂盒对62份已知阳性血清的敏感性为100.0%。
119.表2敏感性检测结果
120.试剂盒批号检出率敏感性zm30210162/62100.0%
zm30210262/62100.0%zm30210362/62100.0%
121.实施例7、特异性试验
122.使用按照实施例4的方法制备的3批非洲猪瘟病毒p30阻断elisa抗体检测试剂盒(批次zm302101、zm302102、zm302103),按照实施例5的使用方法对100份健康猪血清、2份猪口蹄疫病毒o型(fmd
‑
o)阳性血清、2份猪口蹄疫病毒a型(fmd
‑
a)阳性血清、2份猪圆环病毒阳性血清(pcv2)、2份猪繁殖与呼吸综合征阳性血清(prrs),分别进行检测。
123.试剂盒的特异性检测结果如下表(表3)显示,对100份健康猪血清的检测结果显示,3批试剂盒的特异性均为100.0%。对2份猪口蹄疫病毒o型(fmd
‑
o)阳性血清、2份猪口蹄疫病毒a型(fmd
‑
a)阳性血清、2份猪圆环病毒阳性血清(pcv2)、2份猪繁殖与呼吸综合征阳性血清(prrs)的检测结果均显示为阴性,因此3批试剂盒对这8份相关病原阳性血清检测的特异性均为100%。
124.表3非洲猪瘟病毒阻断elisa抗体检测试剂盒特异性检测结果
[0125][0126][0127]
实施例8、符合率试验
[0128]
采用西班牙ingenasa试剂盒和本发明的试剂盒同时对50份健康猪血清、25份病毒感染血清同时进行检测,比较2种试剂盒检测结果的符合率。
[0129]
美国进口试剂盒操作方法:
[0130]
(1)每孔加入50μl稀释液,任选两孔加入50μl的阳性对照血清,任选两孔加入50μl的阴性对照血清,其余每孔加入50μl的待测血清样品,36℃
±
1℃孵育1h或20~25℃过夜孵育(16~20h);
[0131]
(2)倾去孔内液体,洗板4次;
[0132]
(3)每孔加入100μl的结合物(用稀释液进行1:100倍稀释),36℃
±
1℃孵育30min;
[0133]
(4)倾去孔内液体,洗板5次,每孔加100μl的底物溶液,室温20~25℃避光放置15min;
[0134]
(5)每孔加入100μl终止液,5min内读取od450nm值。判定标准:
①
有效性:阴性对照od值/阳性对照od值≥4;
②
血清阻断率计算%=(nc
‑
样品od值)/(nc
‑
pc)
×
100;
③
阳性cut
‑
off值=nc
‑
[(nc
‑
pc)
×
0.5],阴性cut
‑
off值=nc
‑
[(nc
‑
pc)
×
0.4];
④
阻断率≥50%,判为阳性,阻断率≤40%,判为阴性,两者之间为可疑,可疑样品重新检测。
[0135]
本发明试剂盒和西班牙ingenasa试剂盒对50份健康猪血清、30份病毒感染血清的检测结果见表4,本发明试剂盒和西班牙ingenasa试剂盒检测为阳性的血清份数均为26份,检测为阴性的血清份数均为52份。80份待检血清中,两种试剂盒检测结果一致的血清份数是78份,符合率为97.5%。
[0136]
表4符合率试验结果
[0137]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。