1.本发明属生物医药技术领域,涉及检测肝肿瘤组织豪猪音配体(shh)的方 法,具体涉及基于适配体生物传感技术检测肝肿瘤组织豪猪音配体的方法,本方 法具有高灵敏性和特异性。
背景技术:
2.研究公开了豪猪(hedgehog,hh)信号通路是控制胚胎发育的保守途径, 已被证实介导慢性炎症、组织修复、癌症发生和恶性进展1。音豪猪配体(sonichedgehog,(shh)是豪猪信号通路的配体之一,该分泌性蛋白以自分泌和旁分 泌形式作用于ptch1受体,启动金典hh信号通路,促进肿瘤生长、间质改变、 转移和耐药2,因此,肿瘤组织或体液中的shh水平能反映肿瘤的进展、转移或 药物敏感性或治疗反应
3,4,5
。有研究显示hedgehog信号通路的关键分子在60-70% 的hcc病理标本中呈阳性5,与肝细胞肝癌(hcc)中类胰岛素生长因子(igf) 和成纤维细胞生长因子(fgf)受体抑制剂治疗应答差、高转移和耐药性呈正相 关
6,7
。另有研究证实hh信号是调控低分化肝细胞癌(hcc)分化状态、药物反 应和转移的关键机制,并根据表面分子谱建立了独特的亚群8,其中的一种是高 转移(huh-7-trans),其受hh信号调控,其受体ptch1和转录因子gli-1/2 高表达,下游分子如基质金属蛋白酶-1,2,9(mmp-1,2,9)以及上皮-间充质 转化转录因子如snail,twist等高表达9;研究显示,建立了的高耐药肝癌亚群 (huh-7-dn),与hh转录因子gli-1/2和atp结合复合物(abc)中耐药组分 tap-1、abcc1的高表达呈正相关
8,10
;因此,hh信号分子,如配体(sonic hh)、 受体(ptch1)或转录因子(gli-1/2)等hh信号通路的关键分子对反映肝肿瘤 高转移和耐药具有参考价值。
3.目前,利用手术切除标本研究肝癌转移或药物敏感性的方法,包括分离肿 瘤细胞的体外培养及免疫缺陷小鼠建立患者来源的异种移植(pdx)模型,前者 需要从肿瘤组织中分离细胞进行培养,然而,肿瘤细胞在适应体外培养后会失去 其特定的表型,所述pdx模型需要形成异种移植瘤,从移植到形成移植瘤,并多 次接种,整个过程耗时长,体内药敏试验费用高,结果不及时,对原发肿瘤药物 敏感性和转移特性的预测价值较低
11
;因此,研究实践需要快速、准确和高通量 的检测方法,既能反映肿瘤细胞的转移或耐药性,又能预测晚期肝癌患者对现有 药物(如regorafenib、lenvatinib、ramucirumab、cabozantinib)以及免疫 检查点抑制剂(如nivolumab pembrolizumab)的敏感性
12
。
4.研究公开了核酸适配体是一种单链dna(ssdna)或rna,长度为20-80 个碱基
13,14,15
,多种多样的二级和三级空间结构使得适配体对分子靶标具有高度 的特异性,研究显示,适配体的分子靶标在性质、大小和复杂性上可涵盖从离子 到全细胞,包括小分子(如氨基酸、核苷酸、抗生素)、肽、蛋白质、核酸、病 毒、细菌和细胞
16,17,18
,业内称适配体为“化学抗体”,具有类似于抗体的高度 特异性和结合亲和力
19
;配体指数富集的系统进化(selex)技术为高效适配体 筛选技术,用于富集与配体高亲和特异结合的ssdna或rna片段
20,21,22
。基于适 配体作为生物识别元件的生物传感器称为适配体生物传感技术
(aptasensor), 它通过传感技术检测样品中目标的存在及浓度。
5.目前,与抗体相关的医疗诊断测试方法的开发、生产、加工、运输和储存 以及基于抗体的治疗和诊断均呈现价格昂贵,适配体传感作为抗体传感的有力竞 争者,在生物医学领域的应用将极为广泛
23
。
6.基于现有技术的现状,本技术的发明人拟提供一种检测肝肿瘤组织豪猪音配 体(shh)的方法,尤其涉及基于适配体生物传感技术检测肝肿瘤组织豪猪音配 体的方法,本方法具有高灵敏性和特异性。并进一步制备基于适配体传感微流控 芯片携便式设备。
7.与本发明相关的参考文献有:
8.1.fattahi s,pilehchian langroudi m,akhavan-niaki h.hedgehog signaling pathway: epigenetic regulation and role in disease and cancer development.jcell physiol 233,5726-5735(2018).
9.2.wang y,han c,lu l,magliato s,wu t.hedgehog signaling pathway regulates autophagy in human hepatocellular carcinoma cells.hepatology 58,995-1010 (2013).
10.3.noman as,et al.serum sonic hedgehog(shh)and interleukin-(il-6)as dual prognostic biomarkers in progressive metastatic breast cancer.sci rep 7,1796 (2017).
11.4.lim s,lim sm,kim mj,park sy,kim jh.sonic hedgehog pathway as the prognostic marker in patients with extensive stage small cell lung cancer.yonsei med j 60,898-904(2019).
12.5.huang s,et al.activation of the hedgehog pathway in human hepatocellular carcinomas.carcinogenesis 27,1334-1340(2006).
13.6.katoh m,nakagama h.fgf receptors:cancer biology and therapeutics.med res rev 34,280-300(2014).
14.7.dey a,et al.yb-1 is elevated in medulloblastoma and drives proliferation in sonic hedgehog-dependent cerebellar granule neuron progenitor cells and medulloblastoma cells.oncogene 35,4256-4268(2016).
15.8.chen x,lingala s,khoobyari s,nolta j,zern ma,wu j.epithelial mesenchymal transition and hedgehog signaling activation are associated with chemoresistance and invasion of hepatoma subpopulations.j hepatol 55,838-845 (2011).
16.9.fan yh,et al.aberrant hedgehog signaling is responsible for the highly invasive behavior of a subpopulation of hepatoma cells.oncogene 35,116-124(2016).
17.10.ding j,zhou xt,zou hy,wu j.hedgehog signaling pathway affects the sensitivity of hepatoma cells to drug therapy through the abcc1 transporter.lab invest 97, 819-832(2017).
18.11.tentler jj,et al.patient-derived tumour xenografts as models for oncology drug development.nat rev clin oncol 9,338-350(2012).
electrostatic potential (resp)model perform in calculating conformational energies of organic and biological molecules?journal of computational chemistry 21,1049-1074(2000).
36.29.case d,cheatham 3rd t,darden t,gohlke h,luo r,merz jr k.onufriev a, simmerling c,wang b,woods rj.the amber biomolecular simulation programs.j comput chem 26,1668-1688(2005).
37.30.y y,d z,p z,b l,sy h.hdock:a web server for protein-protein and protein-dna/rna docking based on a hybrid strategy.nucleic acids research45, w365-w373(2017).
38.31.inc ccg.molecular operating environment(moe).1010 sherbooke st west,suite #910,montreal,qc,canada,h3a 2r7,(2014).
39.32.concepcion j,et al.label-free detection of biomolecular interactions using biolayer interferometry for kinetic characterization.comb chem high throughput screen 12,791-800(2009).
40.33.hindupur sk,et al.the protein histidine phosphatase lhpp is a tumour suppressor. nature 555,678-682(2018).
41.34.zhou xtd,j.;li,h.y.;zuo,j.l.;ge,s.y.;jia,h.l.;wu,j.hedgehog signaling mediates drug resistance through targeting tap1 in hepatocellular carcinoma.journal of cellular and molecular medicine,doi:10.1111/jcmm.15090 (2020).
42.35.hindupur sk,etal.the protein histidine phosphatase lhpp is a tumour suppressor. nature 555,678-682(2018).。
技术实现要素:
43.本发明的目的在于,基于现有技术的现状,提供一种检测肝肿瘤组织豪猪音 配体(shh)的方法,尤其是基于适配体生物传感技术检测肝肿瘤组织豪猪音配 体的方法,本方法具有高灵敏性和特异性。
44.本发明提供了一种基于适配体生物传感技术检测肝肿瘤组织豪猪音配体的 方法,本方法包括豪猪音配体的dna适配体的筛选,建立基于适配体高灵敏特异 方法以及微芯片技术检测豪猪音配体。本发明为监测药物敏感性和进展、预测包 括hcc在内的恶性肿瘤的预后提供了手段。
45.本发明从随机寡核苷酸库中筛选得到了与shh高亲和、特异性结合的dna 适配体,并基于shh适配体传感器(ap32-aptasensor)建立了一种特异、灵敏 shh检测方法,用于检测肝癌组织中的shh水平;该适配体传感法通过流式细胞 仪监测组织体液中shh信号水平,检测shh的线性范围为0.06~62.5nm,最低 检测下限为69.02pm,在血清中的回收率为104.63
±
3.87%;用酶联免疫吸附 试验(elisa)对适配体传感法检测的人肝癌组织、细胞系中shh的实际值进行 了验证,其检测特异性和阳性率分别为100%和57.14%;与elisa相比,生物传 感法制备方法简单、耗时缩短、操作简便、批次重复性好。
46.本发明中,经筛选得到dna适配体与shh的平衡解离常数(k
d
值)为25.7
±ꢀ
4.1nm。
47.具体的,本发明的基于适配体生物传感技术检测肝肿瘤组织豪猪音配体的方 法,其包括步骤:
48.(1)使用selex技术筛选并富集dna适配体;
49.(2)ssdna的克隆与测序;
50.(3)适配体三级结构预测及与shh n末端蛋白模拟对接;
51.(4)dot blot检测适配体与shh结合特异性;
52.(5)生物层干涉法(bli)测定结合亲和力;
53.(6)适配体传感器与微珠的结合;
54.(7)共聚焦显微镜分析微珠荧光;
55.(8)肝癌细胞和肝癌组织裂解物中shh的检测;
56.(9)western blot分析肝癌/癌旁组织中shh蛋白水平;
57.(10)人血清样本的检测;
58.结果以均值
±
标准差(sd)报告,两组间的统计学差异采用t检验。多组 间比较采用方差分析(anova),p值<0.05被认为具有统计学显着性。
59.本方法测定肝癌组织中shh的阳性率与特异性与用酶联免疫吸附试验 (elisa)检测结果相当,与癌旁组织的差异显著,其检测特异性和阳性率高, 与elisa相比,方法简单、耗时缩短、操作简便、批次重复性好。
60.本发明进一步制备基于适配体传感微流控芯片携便式设备,其中包括:微芯 片的设计与制备。
61.本发明结合微流控装置可建成实时检测装置,其中可以安置多个检测靶分 子,形成多通道高通量(multiplex)检测手段;其中的微芯片可集成到化学和 生物领域微流控器元件中,如样品制备、反应、分离和检测,形成具有微通道的 网络。该检测装置具有携带方便、能耗低、易制作、易掌握、灵敏度高、样品分 离精度高、分析速度快等特点,对临床诊断具有重要意义。
附图说明
62.图1,其中,
63.图-1a.磁珠selex技术体外筛选shh特异性dna适配体的过程示意图;
64.图-1b.selex筛选周期中fam标记的shh特异性ssdna的富集,使用实时荧 光成像系统对筛选进程可视化监测;
65.图-1c.荧光定量fam标记的shh特异性ssdna的富集。
66.图2.通过m-fold软件预测了ap72的三种可能的二级结构:ap72-1(a)、ap72-2 (b)、ap72-3(c),以及去掉潜在无用的ap72序列的ap32的二级结构(d)。
67.图3,其中,
68.图-3a.预测得到适配体ap32的三级结构;
69.图-3b.ap32与shh n末端蛋白的互作状态(视角:前、右和左);
70.图-3c.ap32与shh n末端蛋白的结合位点,参与结合的碱基根据ap32的茎 环结构分为a、b和c三个位点;
71.图-3d.使用bli技术检测ap32突变a位点后与shh结合亲和力,显示无结合, 纵坐
标表示分子结合的信号值;
72.图-3e.使用bli技术检测ap32突变b位点后与shh结合亲和力,测得k
d
值为 120nm,纵坐标表示分子结合的信号值;
73.图-3f.使用bli技术检测ap32突变c位点后与shh结合亲和力,测得k
d
值为 88nm,纵坐标表示分子结合的信号值。
74.图-3g.检测ap32、ap32-30nt(截断ap32一对互补碱基)、ap32-28nt(截 断ap32的两对互补碱基)、ap32-26nt(截短ap32的三对互补碱基)、ap32-34nt (在ap32上增加一对互补碱基)、ap32-36nt(在ap32上增加两对互补碱基) 和ap32-38nt(在ap32上增加三对互补碱基)与shh蛋白的亲和力,测得的k
d
值标注在各图中。纵坐标表示分子结合的信号值。
75.图4,其中,
76.图-4a.斑点印迹法检测ap72和ap32与shh和其它肝特异性蛋白的结合特异 性,shh的浓度和三个肝脏特异性蛋白的名称被标记在相应的点上方;
77.图-4b.免疫印迹斑点颜色强度的量化。
78.图-5.检测ap72(a)和ap32(b)与shh的结合亲和力,k
d
值相近。
79.图6,其中,
80.图-6a.用于shh检测的适配体传感技术示工作原理意图;
81.图-6b.裸微珠、ap32-texasred改性微珠(bs ap)、ap32-texasred-qs改性 微珠(bs ap qs)、50nm shh存在下的ap32-texasred-qs改性微珠 (bs ap qs shh)的荧光图像;
82.图-6c.bs ap、bs ap qs shh、bs ap qs和裸微珠的荧光响应;
83.图-6d.对应于图6c的荧光强度的定量分析。
84.图7,其中,
85.图-7a.使用细胞流式仪检测ap qs修饰的微珠对不同纳摩尔水平的shh蛋白 (0,7.80,15.6,31.25,62.51,125和250nm)的荧光响应;
86.图-7b.荧光强度与shh浓度(nm水平)的关系图。插图:线性拟合曲线;
87.图-7c.使用细胞流式仪检测ap qs修饰的微珠对不同纳摩尔水平的shh蛋白 (0、31.25、62.5、125、250、500、1000pm)的荧光响应;
88.图-7d.荧光强度与shh浓度(pm水平)的关系图;
89.图-7e.适配体传感法检测特异性验证。检测平台对肝其它特异性蛋白:α1
-ꢀ
抗胰蛋白酶(α1-at)、甲胎蛋白(α-fetoprotein)和人血清白蛋白(hsa) 的选择性,每种蛋白的实际添加浓度为125nm。
90.图8,其中,
91.图-8a.通过基于适配体传感技术的分析或elisa(参见表-2)直观绘制每个 样本的实际值,通过基于适配体传感法检测或elisa检测样品的实际值,95%ul: 参考值在95%置信区间的上限;99%ul:参考值在99%置信区间的上限,半空圆形: 适配体传感法检测shh浓度在95%置信区间(4.79nm)内高于参考上限的样品; 半空三角形:elisa检测shh浓度在95%置信区间(6.29nm)内高于参考上限的 样品;
92.图-8b.肝癌标本中刺猬信号分子的western blot分析,除shh外,用westernblot分析其他hh信号分子,如ptch1和gli-1,shh在癌旁组织中的表达在 western blots中几乎检测不到,calnexin被用作参考蛋白。箭头:目标条带, c:癌组织;p:癌旁组织。
93.图-9,基于适配体传感技术的微芯片设计图。
94.图-10,罗丹明标记的液态阻隔peg-da水凝胶加入通道5分钟后的荧光成像。
95.图-11,信号蛋白通过阻隔水凝胶的扩散。将fitc标记的豪猪音蛋白注入一个 培养室,并评估随着时间的推移其向相邻培养室的扩散。
具体实施方式
96.实施例1本发明的基于适配体生物传感技术检测肝肿瘤组织豪猪音配体的 方法包括:
97.(1)使用selex技术筛选并富集dna适配体
98.合成共有72个碱基的ssdna文库:5
’-
agtcctgcactacgct(n
40
) agatcgcagctgagtc-3’。其中n为碱基a:t:c:g=1:1:1:1的随机组合,为 了通过selex循环筛选特异性dna适配体,将随机ssdna文库溶解在结合缓冲液 (8mm na2hpo4、136mm nacl、2mm kh2po4、5mm mgcl2、0.01%鲑鱼精dna) 中,加热到95℃,维持5分钟,在冰浴中冷却5分钟,再在室温下保持5分钟, 使ssdna形成最佳结构构象,将shh蛋白偶联的磁珠(shh-mb)与ssdna文库结 合缓冲液中在室温孵育一定时间,随着筛选压力逐渐升高,筛选轮次增加,孵育 时间减少(1~5轮:30分钟,5~10轮:15分钟,10轮后:10分钟),对于负筛 选,在筛选过程中加入空白磁珠,以减少由于物理吸附引起的非特异性结合,通 过磁分离,用含有0.05%的吐温20和0.1%的牛血清白蛋白的pbs缓冲液反复洗 涤shh-mb,去除未与shh结合的游离ssdna,然后,将8m尿素溶液加入到与 ssdna结合的shh-mb复合物中,加热至80℃,通过磁分离将结合的ssdna从磁 珠表面分离出,用mastercyclernexusx2热循环仪(eppendorf,德国)pcr扩 增洗脱液中的ssdna,并用12%尿素变性聚丙烯酰胺凝胶电泳(page)分离下一 轮筛选的ssdna池,洗脱后的ssdna通过凝胶提取纯化,并重新溶解在结合缓冲 液中进行下一轮筛选,16轮后,最终筛选产物经pcr扩增、凝胶电泳纯化,然 后克隆、测序、鉴定;pcr引物包括正向引物:5
’-
fam-agtcctgcactacgct-3’, 和反向引物:5
’-
aaaaaaaaaa/spcer9/gactcagctgcgatct-3’,扩增条件为:95 ℃,2分钟,95℃、46℃,30秒和68℃,15秒共25个循环,最后一个 循环68℃,5分钟;
99.(2)ssdna的克隆与测序
100.最后一轮富集的ssdna池用未经修饰的引物和selex过程中相同的pcr条件 进行pcr扩增,pcr产物与pmd18-t载体连接,转化bl21大肠杆菌,约30个克 隆被随机挑选、培养、测序,。用m-fold软件对获得的序列进行二级结构分析;
101.(3)适配体三级结构预测及与shh n末端蛋白模拟对接
102.将ap32序列提交于mc-fold/mc-sym
26
预测二级结构和三级结构,使用 tinker
27
分子建模程序包进一步优化生成的三维模型,使用mc-sym软件中的 relieve与refine模块对获得的三维结构继续进行能量优化,能量优化使用最 陡下降法,力场采用amber99力场参数
28
,并用amber16
29
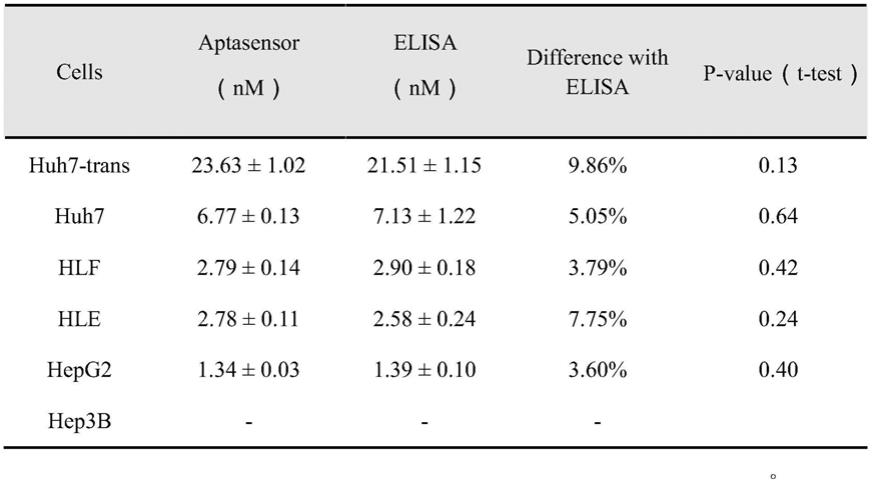
对所生成的3d模型进 行分析动力学模拟,优化得最终ap32的3d模型;
103.使用hdock
30
服务器预测ap32和shh n末端蛋白分子之间的对接,过程中, shh n作为受体,ap32作为配体,在分子操作环境(moe)
31
中分析配体和受体 的相互作用,并用pymol(www.pymol.org)可视化;
104.通过分子动力学模拟优化ap32与shh n末端蛋白对接后的复合物,使用 cpptraj
对轨迹进行进一步分析,用mm-pbsa方法计算了配合物的结合自由能, 以确保预测结果的可靠性;
105.预测结合位点对结合能力的影响及验证预测的可靠性,根据ap32的二级茎 环结构,将ap32与shhn互作的碱基分为划分为3个位点:位于环部的a位点、 位于环茎连接处的b位点以及位于茎部的c位点,分别对三个位点的碱基做突变, 并使用bli技术测试三个位点分别突变后的ap32与shh n的结合亲和力;
106.(4)dot blot检测适配体与shh结合特异性
107.将1μl蛋白溶液小心滴在硝酸纤维素滤膜(nc)条上,待膜条干燥后,放入 5%的牛血清白蛋白溶液中,室温孵育15分钟,以封闭其他未结合蛋白的区域, 然后与100nm的cy5标记适配体溶液在室温下孵育30分钟,去除适配体溶液 后,在洗涤缓冲液(pbs 0.02%吐温20 5mm mgcl2 1%bsa)中洗涤3 次后,立即用多功能生物分子激光成像系统typhoon9500进行荧光成像;
108.(5)生物层干涉法(bli)测定结合亲和力
109.适配体的亲和力通过bli使用octerred 96系统测定,将生物素化的适配体 固定在链霉亲和素标记的传感器上,随后的结合反应在含有不同浓度shh蛋白的 溶液中进行,所有数据均在fortebio data acquisition 6.4软件中获取和分析, 通过减去参考传感器信号(仅限分析缓冲液)、应用savitzky-golay滤波和使 用1:1模型进行全局曲线拟合来执行数据处理
32
;
110.(6)适配体传感器与微珠的结合
111.筛选并截短适配体后,在tris-hcl缓冲液(20mm tris-hcl、100mm nacl、 5mm mgcl2、ph 7.4)中,在适配体的3’端延长10个a碱基并用生物素修饰, 5’端用texasred修饰。链霉亲和素包被的聚苯乙烯微珠和生物化适配体在50 μl tris-hcl缓冲液中室温孵育30分钟,通过离心去除未结合的适配体,并用 tris-hcl缓冲液洗涤珠子两次。ap-32-texasred探针通过加入长度为13nt、 经bhq2修饰的与ap32的5’端互补的ssdna(命名为qs13)来猝灭探针 (ap-32-texasred)的荧光,并在室温下避光孵育1小时,然后,将修饰后的微 珠离心两次,重新分布在50μl的tris-hcl缓冲液中,然后加入目的蛋白shh, 摇匀,室温避光孵育1小时,加入0.45ml的tris-hcl缓冲液后,立即用流式 细胞仪检测微珠的荧光;
112.(7)共聚焦显微镜分析微珠荧光
113.使用leica tcs sp8 x共聚焦显微镜对微珠进行成像,实验分组包括:裸链 霉亲和素标记微珠(bs)、ap32-texasred-qs改性微珠(bs ap)、 ap32-texasred-qs改性微珠(bs ap qs)和ap32-texasred-qs改性微珠 (bs ap qs shh),texasred在560nm处激发,接收610nm处的发射光;
114.(8)肝癌细胞和肝癌组织裂解物中shh的检测
115.用非变性裂解液完全裂解6个肝癌细胞系,包括hle、hlf、huh7、hep3b、 hepg2、反式huh7细胞和14对肝癌组织。用10kd超滤管收集裂解液上清液, 用bca试剂盒测定裂解液中总蛋白浓度,人音豪猪配体(shh,购于美国明尼阿 波利斯r&d公司)末端定量elisa试剂盒检测裂解液中shh的浓度,并将结果与 适配体传感法的结果进行比较;
116.核酸适配体传感检测方法为:将texasred标记的ap32偶联的微珠重悬到 40μl tris-hcl缓冲液中,然后将来自不同样品的10μl的裂解液加入到微 珠悬浮液中,在室温避
光孵育1小时后,加入0.45ml的tris-hcl缓冲液,用 流式细胞仪分析微珠的荧光强度;
117.(9)western blot分析肝癌/癌旁组织中shh蛋白水平
118.采用minutetm总蛋白提取试剂盒提取人肝癌/癌旁标本的总蛋白,上样等量 蛋白质(30μg),用4%~12%的梯度胶分离,然后将蛋白转移到pvdf膜上,用 5%脱脂牛奶封闭后,与抗shh、gli1、ptch1或calnexin的一抗在4℃孵育过 夜,将印迹膜与辣根过氧化物酶(hrp)偶联的抗鼠或兔igg抗体在室温下孵育 1h。calnexin被用作对照管家基因
33
,蛋白条带由高信号增强化学发光系统 (tanon 5200)成像,如先前报道
34
;
119.(10)人血清样本的检测
120.在正常人血清中加入不同浓度的shh蛋白,将2μl的适配体传感微珠重悬 在40μl的tris-hcl结合缓冲液中,然后各取10μl不同浓度的血清样本加入 微珠悬浮液中,室温避光振荡孵育1小时后,加入0.45ml tris-hcl缓冲液, 立即使用流式细胞仪分析微珠的荧光;
121.结果以均值
±
标准差(sd)报告。两组间的统计学差异采用t检验,多组 间比较采用方差分析(anova),p值<0.05为具有统计学显着性。
122.实施例2制备基于适配体传感微流控芯片携便式设备
123.包括微芯片的设计与制备:
124.可培养细胞的检测微芯片平台由10μm高的凹槽组成,将peg室与细胞培养 室隔开,顶层由两个相邻的微腔组成(尺寸为8
×
1.8
×
0.075mm(长
×
宽
ꢀ×
高)),由一条窄的阻隔凝胶通道(宽100μm)隔开,pdms模具采用双层 制造工艺制造;
125.优选的,首先su82010在硅片上形成了一个10μm高的矩形板,然后对su8 2050进行旋涂,形成75μm高的腔室和通道的模具,将pdms基料与固化剂按10: 1的比例混合,倒入培养皿中的模具上,将培养皿脱气1小时,然后在80℃ 孵育2小时固化,固化的pdms层从模具上剥离后,使用锋利的金属冲床为入口 和出口打孔,随后,将pdms材料放在印有传感水凝胶的玻璃片上,以完成装置, 4个圆柱体作为培养基储液池连接到芯片上,然后微芯片装置在紫外线照射下在 组织培养罩中灭菌1-2小时,准备培养细胞;
126.将玻璃基板在氧等离子体室(yes-r3,san jose,ca)中300w清洗15分钟, 然后在氮气吹扫下,玻璃基板在无水甲苯中加入0.1%(v/v)三氯硅烷(3-丙烯 酰氧丙基)孵育1小时,然后,用新鲜的甲苯漂洗,在氮气下干燥,然后在100 ℃下固化2小时,然后立即对玻璃基板使用丙烯酰硅烷改性基质或将其放置在干 燥器中;
127.使用uv交联peg-da(聚乙二醇二丙烯酸酯)和acryl-peg-mal(丙烯酸树 脂)制备传感水凝胶(直径200μm),具体方法如下:将20%(v/v)peg-da (mw 700)、40%(v/v)peg(mw 200)、10%(v/v)的20mm丙烯酸聚乙二醇 和1%irgacure 2959溶于pbs中制备得到功能性水凝胶单体溶液,将单体溶液 加载到硅烷化玻璃上,然后用盖玻片(24
×
30
×
0.13mm)覆盖,形成均匀 的单体溶液层,玻片通过365nm紫外光源通过光掩模照射1.5秒,用去离子水 洗涤,并用氮气干燥;
128.阻隔水凝胶的制备方法:将5%w/v的6kda聚乙二醇-二丙烯酸酯和1%w/v 的光引发剂溶液在pbs中稀释,充分旋转,制成凝胶阻隔,再暴露于365nm, 18w/cm2紫外光之前,将溶液注入中心室,并将微流控装置放入氮气袋中。
129.实施例3使用磁珠selex筛选适配体并成功监测到适配体信号的募集
敏度和特异性。
136.实施例6 dot blot鉴定两个候选适配体(ap72和ap32)的结合特异性
137.不同浓度的靶蛋白shh和其他三种肝脏特异性蛋白,包括α1-抗胰蛋白酶 (α1-at)、甲胎蛋白(afp)和人血清白蛋白和(hsa),所述蛋白与fam标记 的适配体探针在牛血清白蛋白封闭的硝酸纤维素滤膜(nc)上进行印迹,研究适 配体探针的结合特异性,来自nc膜的荧光信号的强度直接反映适配体与靶蛋白 的结合能力,图4a显示,随着shh浓度的降低,nc膜上斑点的颜色变浅,表明 适配体探针能够与shh蛋白结合,图4b表示斑点颜色强度的量化,结果显示, 虽然α1-at、afp和hsa这3种蛋白的浓度已与shh最高浓度一致(20μm), 但在nc膜上依然没有产生任何颜色,说明所述的ap72和ap32适配体只能与shh 有效结合,完全不能与其它3种肝脏特异性蛋白结合,表明ap72和ap32两种适 配体与shh具有很好的结合特异性。
138.实施例7用bli技术进一步分析ap72和ap32与shh的结合亲和力
139.如图-5所示,ap72和ap32对shh的亲和力相似,均具有非常低的k
d
值(< 30nm),结果表明,本发明获得了高亲和力与shh特异性结合的适配体ap72, 而截短的适配体ap32与其原始ap72保持了相同的亲和力,表明ap72两端的线 性片段不参与shh的结合,因此,使用截短适配体ap32作为适配体探针检测不 同类型样品中的shh。
140.实施例8建立基于适配体传感器的液相shh测定方法
141.本发明建立的用于shh检测的适配体传感技术工作原理如图-6a所示,为了 证明该基于适配体传感技术检测shh的可行性,将荧光基团texasred标记的 ap32标记到聚苯乙烯微珠上,用共聚焦显微镜(图-6b)成功可视化shh的检测 可行性,同时通过流式细胞仪(图-6c,d)对shh的检测可行性进行监测和定量, 结果显示,未标记的微珠在610nm处没有texasred的自发荧光,微珠与texasred 标记的ap32偶联后,发出强烈的texasred红色荧光,加入5μm的qs13后, 荧光猝灭,来自微珠的荧光变得暗淡,只有当加入shh时,由于shh将qs13替 换,微珠的荧光才得以恢复,因此,该适配体传感技术用于检测shh水平可行。
142.实施例9适配体检测shh特异性和敏感性的验证
143.随着shh浓度的增加,微珠的荧光强度逐渐增强;由于流式细胞仪性能的限 制,将标准曲线分为两个水平:纳摩尔水平和皮摩尔水平,适配体传感技术检测 法检测shh,在0.03-62.50nm的动态范围内呈线性增加,当shh浓度在纳摩尔 水平时,其线性方程为y=227.1x 3468(r2=0.9706)(图-7a,b),当shh 浓度在皮摩尔水平时,线性方程为y=15.21x 35203(r2=0.9786)(图-7c,d), shh的检测下限为69.02pm(s/n=3),噪声水平低于空白样品多次测量的标准 差,由于适配体传感反应混合物的体积只有50微升,因此,该基于适配体传感 法可以检测到低至3.1fmol的shh;特异性验证实验结果显示(图-7e),与shh 蛋白相对比,α1-抗胰蛋白酶(α1-at)、甲胎蛋白(α-fetoprotein)和人血 清白蛋白(hsa)等其它肝特异性蛋白只能检测到微弱的信号,证实了其检测特 异性,表明基于适配体生物传感检测法可以高灵敏度特异性地检测溶液中的 shh。
144.实施例10细胞和组织裂解物中shh的检测
145.为了验证基于ap32适配体传感技术检测的有效性,本实施例检测了6个肝 癌细胞系的裂解液中shh的水平,并用商品化的elisa试剂盒对结果进行了验证, 如表-1所示,基于ap32适配体传感技术的细胞裂解物检测结果与elisa检测结 果一致,变异<10%,检测范
围为1.34
±
0.03~23.63
±
1.02nm;
146.检测了14例hcc患者肝癌和癌旁组织裂解物中shh的含量,并与elisa法 结果进行了比较,表-2显示了每对样本的各个值,图-8a中重新绘制了正常shh 值的上限;同时,通过western blot对14对组织样本中shh蛋白的表达进行了 直观地验证(图-8b),结果表明,用western blot分析、elisa和基于适配体 传感技术检测到的shh蛋白水平总体上是一致的,western blots结果显示,shh、 gli-1和ptch1在14例hcc组织中的阳性表达率分别为64.29%、85.71%和57.14%,明显高于配对的癌旁组织;在western blot分析中,由于gapdh(甘 油醛-3-磷酸脱氢酶)经常受到肝细胞癌代谢紊乱的影响,所以在western blot 分析中使用了calnexin作为管家基因对照,适配体传感法和elisa法检测的癌 旁组织中shh蛋白浓度均为正态分布,癌旁组织中基于适配体传感技术检测方法 的95%置信区间上限为4.79nm,99%置信区间上限为5.90nm,根据上述上限, 在95%的置信区间内,基于适配体传感法检测在肝癌标本中的检测特异性为 88.99%(11.11%假阳性),检测阳性率为57.14%,99%置信区间的值比95%置信 区间的值更可靠,当上限提高到99%置信区间时,特异性为100%(0%假阳性), 阳性率仍然为57.14%。elisa检测结果在95%和99%可信区间内一致,并与基于 适配体传感法的检测结果一致,特异性为100%,阳性率为57.14%,两种方法检 测肝细胞癌组织与癌旁组织的shh水平均有显著性差异(p<0.05)。
147.表-1 elisa和适配体传感技术检测6种肝癌细胞裂解物中的shh
[0148][0149]
表-2 elisa和适配体传感技术检测14对种肝癌组织裂解物中的shh
[0150]
[0151][0152]
实施例11基于适配体传感技术检测人血清中shh的回收率
[0153]
将shh蛋白加入健康人血清中,取10μl样品加入至检测系统,溶液总体 积为50μl,血清中shh的最终浓度分别为10,20,40nm,并用预先设定的校 正曲线进行分析,如表3所示,回收率为100.48
±
4.15%~108.13
±
3.91%, 表明临床血清对ap32适配体传感技术检测无明显干扰,结果证实基于ap32适配 体传感技术检测法将适用于临床样品的研究和分析。
[0154]
表-3适配体传感技术测定人血清中shh的回收率(n=3)
[0155][0156]
实施例12设计与制备微芯片
[0157]
微芯片设计有两个细胞培养室,细胞静止培养,中间的peg水凝胶可以将两 个细胞培养室阻隔开来,并允许细胞间的分子信息交换,每个细胞培养室有4 个peg-aptamer传感水凝胶,通过检测传感水凝胶的荧光强度建立检测工作曲 线,实时监控细胞分泌的shh水平(图-10)。
[0158]
实施例13制备微芯片中阻隔水凝胶
[0159]
为确保阻隔水凝胶在微芯片内交联之前不会冲破两个培养室之间的互通微 阀(10μm),在液态阻隔peg-da胶中混入罗丹明染料,随后将液态阻隔胶加 入进样孔,5分钟后在荧光显微镜下观测水凝胶的状态,确认液态胶不会冲破两 侧微阀进入细胞培养室(如图-11所示);
[0160]
阻隔peg-da水凝胶允许两个培养室之间分子信息交换:将荧光(fitc)标 记的豪猪音蛋白质的溶液注入微芯片装置的一个细胞室,观测其通过阻隔水凝胶 的扩散,如图-12所示,荧光蛋白逐渐通过凝胶屏障扩散,3h后荧光强度无明显 差异,表明分隔细胞培养室的阻隔凝胶通道允许与旁分泌信号大小相似的蛋白质 分子扩散。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。