1.本发明涉及癌症治疗领域。具体而言,涉及评估癌症治疗中由放射治疗产生的对免疫的影响。
背景技术:
2.据报道,当对癌症进行了放射治疗时,对照射视野之外存在的癌症也具有使其消退的效果,称为远端效应(abscopal effect)。远端效应被认为是通过某些免疫激活而产生的现象,但关于其详细的机制还有很多不清楚的部分,并且还未发现用于对所产生的远端效应进行定量或评估的生物标志物。
技术实现要素:
3.用于解决技术问题的手段
4.本发明提供一种方法,其将从受试者获得的样品中的细胞亚群的组成用作受试者中的由放射治疗引起的免疫激活的指标。通过将本说明书中记载的特定的细胞亚群的量与基准进行比较,可确定受试者中产生的由放射治疗引起的免疫激活的有无和/或程度。
5.在本发明中,作为可用作指标的细胞亚群,没有限制,但可列举与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群、与抗肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群或与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8
t细胞亚群。与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群例如为包含在cd62l
low
cd4
t细胞群中的细胞亚群(例如,cd62llowcd4
t细胞亚群本身、或icos cd62l
low
cd4
t细胞亚群等)。与抗肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群例如为hla
‑
dr
cd141
cd11c
细胞亚群等。与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8
t细胞亚群例如为cd137 cd62llowcd8 t细胞亚群等。
6.在本发明的另一实施方式中,通过表示出在受试者中产生的由放射治疗引起的免疫激活,可表示出是否应该对该受试者施用癌症免疫疗法或应该何时施用癌症免疫疗法。认为在产生由放射治疗引起的免疫激活的时间点、使用癌症免疫疗法(利用对癌症的免疫反应)是有利的,但至今为止,还不存在用于判断是否由放射治疗引起免疫激活的生物标志物。
7.作为癌症免疫疗法,优选列举包括给予免疫检查点抑制剂的癌症免疫疗法。免疫检查点抑制剂的给予可与其他形式的治疗组合使用,也可与不同的药剂(例如,不同的免疫检查点抑制剂)组合使用。
8.本发明的实施方式的示例示于以下项目中。
9.(项目1)
10.一种方法,其将从接受过放射治疗的受试者获得的样品中的细胞亚群的组成用作所述受试者中的由放射治疗引起的免疫激活的指标,
11.所述方法包括分析从所述受试者获得的所述样品中的细胞亚群的组成的工序,
12.通过所述样品中的与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群的量与基准之间的比较,示出在所述受试者中有无免疫激活。
13.(项目2)
14.一种方法,其将从接受过放射治疗的受试者获得的样品中的细胞亚群的组成用作所述受试者中的由放射治疗引起的免疫激活的指标,
15.所述方法包括分析从所述受试者获得的所述样品中的细胞亚群的组成的工序,
16.通过所述样品中的与抗肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群的量与基准之间的比较,示出在所述受试者中有无免疫激活。
17.(项目3)
18.一种方法,其将从接受过放射治疗的受试者获得的样品中的细胞亚群的组成用作所述受试者中的由放射治疗引起的免疫激活的指标,
19.所述方法包括分析从所述受试者获得的所述样品中的细胞亚群的组成的工序,
20.通过所述样品中的与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8
t细胞亚群的量与基准之间的比较,示出在所述受试者中有无免疫激活。
21.(项目4)
22.根据上述的项目中任一项所述的方法,其中,通过选自由所述样品中的与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群的量、与抗肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群的量及与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8
t细胞亚群的量组成的组中的至少两个量与基准之间的比较,示出在所述受试者中有无免疫激活。
23.(项目5)
24.根据上述的项目中任一项所述的方法,其中,所述与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群为包含在cd62llowcd4 t细胞群中的细胞亚群。
25.(项目6)
26.根据上述的项目中任一项所述的方法,其中,所述与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群为cd62l
low
cd4
t细胞亚群或ccr7
cd45ra
‑
cd62l
low
cd4
t细胞亚群。
27.(项目7)
28.根据上述的项目中任一项所述的方法,其中,所述与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群为icos
cd62l
low
cd4
t细胞亚群、lag3
cd62l
low
cd4
t细胞亚群、pd
‑1
cd62l
low
cd4
t细胞亚群或cd28
cd62l
low
cd4
t细胞亚群。
29.(项目8)
30.根据上述的项目中任一项所述的方法,其中,所述与抗肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群为hla
‑
dr
cd141
cd11c
细胞亚群。
31.(项目9)
32.根据上述的项目中任一项所述的方法,其中,所述与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8
t细胞亚群为包含在cd62l
low
cd8
t细胞群中的细胞亚群。
33.(项目10)
34.根据上述的项目中任一项所述的方法,其中,所述与抗肿瘤免疫应答中的树突状
细胞刺激相关的cd8
t细胞亚群为cd137
cd62l
low
cd8
t细胞亚群。
35.(项目11)
36.根据上述的项目中任一项所述的方法,其中,所述样品为外周血样品。
37.(项目12)
38.根据上述的项目中任一项所述的方法,其中,所述基准为所述放射治疗前的所述受试者的样品中的所述细胞亚群的量。
39.(项目13)
40.根据上述的项目中任一项所述的方法,其中,所述样品中的所述细胞亚群的量与所述基准相比增加表示在所述受试者中产生由放射治疗引起的免疫激活。
41.(项目14)
42.根据上述的项目中任一项所述的方法,其中,所述样品中的所述细胞亚群的量与所述基准相比未增加表示在所述受试者中未产生由放射治疗引起的免疫激活。
43.(项目15)
44.根据上述的项目中任一项所述的方法,其中,所述放射治疗适在包括肿瘤在内的照射范围进行。
45.(项目16)
46.根据上述的项目中任一项所述的方法,其中,根据在所述受试者中产生由放射治疗引起的免疫激活,进一步示出在该时间点上应给所述受试者实施包含免疫检查点抑制剂的癌症免疫疗法。
47.(项目17)
48.根据上述的项目中任一项所述的方法,其中,根据在所述受试者中未产生由放射治疗引起的免疫激活,进一步示出应对所述受试者再次实施放射治疗。
49.(项目18)
50.一种方法,其是上述的项目中任一项所述的方法,该方法进一步规定将在多个时间点从受试者获得的样品中的细胞亚群的组成设定为用于监测所述受试者中由放射治疗引起的免疫激活的指标,所述方法包括分析在多个时间点从所述受试者获得的样品中的细胞亚群的组成的工序。
51.(项目19)
52.一种组合物,其包含用于治疗受试者的癌症的免疫检查点抑制剂,
53.所述组合物被给予至受试者,所述受试者接受过放射治疗,且通过上述的项目中任一项所述的方法在所述受试者中产生免疫激活。
54.(项目20)
55.根据上述的项目所述的组合物,其中,所述免疫检查点抑制剂为pd
‑
1抑制剂和/或pd
‑
l1抑制剂。
56.(项目21)
57.根据上述的项目所述的组合物,其特征在于,与一种或多种另外药剂组合给药。
58.(项目22)
59.根据上述的项目中任一项所述的组合物,其中,所述另外药剂包含第二免疫检查点抑制剂。
60.(项目23)
61.一种产品,其包含上述项目中任一项所述的组合物和随附文件,所述随附文件记载了所述组合物与放射治疗组合使用。
62.(项目24)
63.一种试剂盒,其用于判定受试者中是否产生由放射治疗引起的免疫激活,所述试剂盒包含针对以下物质的检测剂:
64.(a)cd4及cd62l;
65.(b)(i)选自icos、pd
‑
1、lag
‑
3及cd28中的标志物、(ii)cd4以及(iii)cd62l;
66.(c)cd11c、cd141及hla
‑
dr;
67.(d)cd11c、cd123及hla
‑
dr;或者
68.(e)cd8、cd62l及cd137。
69.(项目25)
70.一种组合物,其包含用于治疗癌症的免疫检查点抑制剂,所述组合物被给予至接受过放射治疗的受试者,所述受试者在接受放射治疗之前具有对癌症免疫疗法无应答的免疫细胞组成。
71.(项目26)
72.根据上述的项目所述的组合物,其中,所述对癌症免疫疗法无应答的免疫细胞组成是低于阈值的cd4
cd62l
low
细胞亚群的量或比例。
73.(项目27)
74.根据上述的项目中的任一项所述的组合物,其中,所述免疫检查点抑制剂包含抗pd
‑
1抗体和/或抗pd
‑
l1抗体。
75.发明效果
76.根据本发明,可定量或评估由放射治疗引起的免疫激活。由此,能够经时地监测因放射治疗产生的引发相激活及效应t细胞增加效果。并且,通过本发明,可判断放射治疗之后应该在什么时间进行免疫检查点(例如,pd
‑
1)抑制治疗。并且,本发明的生物标志物是用于评估治疗效果(即,通过以t细胞引发效应为目标的放射线假疫苗疗法将免疫检查点抑制剂从无效型转化为有效型)的生物标志物、并且是用于选择需要进行此类转化治疗的患者的指标。
附图说明
77.图1为示出胸部放射治疗前与胸部放射治疗结束时的外周血t细胞组成的变化的图。其中,左图示出cd4
t细胞群中的cd62l
low
cd4
t细胞亚群的比例。中间的图示出cd4
t细胞群中的foxp3
cd25
cd4
t细胞亚群的比例。右图示出t细胞群中的cd8
t细胞亚群的比例。可以理解的是,cd4
细胞群中的d62l
low
cd4
细胞亚群的比例显著增加。
78.图2为示出胸部放射治疗前后的外周血cd4
t细胞组成的变化的图。左上图示出t细胞群中的cd4
t细胞亚群的比例。右上图示出cd4
t细胞群中的cd62l
low
cd4
t细胞亚群的比例。左下图示出cd62l
low
cd4
t细胞群中的icos
cd62l
low
cd4
t细胞亚群的比例。右下图示出cd4
t细胞群中的foxp3
cd25
cd4
t细胞亚群的比例。可以理解的是,cd4
细胞群中的cd62l
low
cd4
细胞亚群的比例、及cd62l
low
cd4
细胞亚群中的icos
cd62l
low
cd4
细胞亚群的
比例显著增加。
79.图3为示出对于几种治疗类型中的每一种、cd4
细胞群中的cd62l
low
cd4
细胞亚群的比例的变化的图。可以理解的是,在所有治疗类型中,通过放射治疗,cd4
细胞群中的cd62l
low
cd4
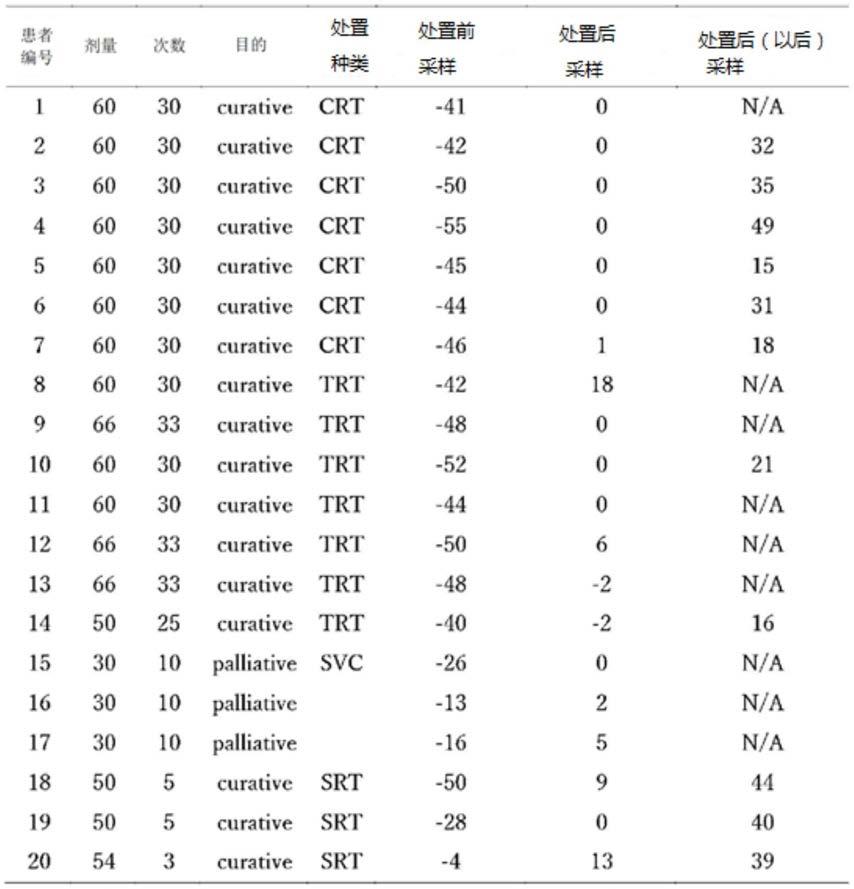
细胞亚群的比例呈现增加倾向。curative trt:以治疗为目的的胸部放射治疗;curative crt:以治疗为目的的化学疗法并用放射治疗;palliative trt:以缓解为目的的胸部放射治疗。
80.图4为示出胸部放射治疗前后的外周血髓系(myeloid系)dc细胞组成的变化的图。左图示出cd141
cd11c
细胞群中的hla
‑
dr
cd141
cd11c
细胞亚群的比例。右图示出人外周血单核细胞(pbmc)细胞群中的cd141
cd11c
细胞亚群的比例。可以理解的是,cd141
cd11c
细胞群中的hla
‑
dr
cd141
cd11c
细胞亚群的比例显著增加。
81.图5为包括cd4
细胞群中的cd62l
low
cd4
细胞亚群的比例及cd141
cd11c
细胞群中的hla
‑
dr
cd141
cd11c
细胞亚群的比例直至放射治疗后一个月左右的时间点的变化的图。暂时增加的cd62l
low
cd4
细胞亚群的比例及hla
‑
dr
cd141
cd11c
细胞亚群的比例趋于恢复到放射治疗前的水平。
82.图6为示出cd4
t细胞中的cd62l
low
cd4
t细胞的比例与cd4
t细胞中的效应记忆细胞(ccr7
‑
cd45ra
‑
)cd4
t细胞的比例之间的关系的图。可以理解的是,这些细胞亚群的量存在很强的相关关系。
83.图7为示出放射治疗前和放射治疗结束时的外周血t细胞组成的变化的图。图7的a示出cd4
t细胞群中的cd62l
low
cd4
t细胞亚群的比例的变化(p<0.0001,配对t检验)。图7的b示出hla
‑
dr
high
cd11c
cd123
‑
mdc亚群的比例的变化(p=0.0008,配对t检验)。图7的c示出未接受德瓦鲁单抗(durvalumab)联合疗法的患者中的治疗前的%cd62l
low
cd4
t细胞与trt或crt之后的pfs之间的相关性(n=34)。
84.图8为示出放射治疗前和放射治疗结束时的cd62l
low
cd4
t细胞上的免疫检查点分子的表达的变化的图(配对t检验)。
85.图9为示出在放射治疗前和放射治疗结束时的、基于用ccr7及cd45ra门控(gating)的cd4
t细胞的t细胞亚群的变化的图。naive:ccr7
cd45ra
;cm:ccr7
cd45ra
‑
;em:ccr7
‑
cd45ra
‑
(配对t检验)。
86.图10为示出在放射治疗前、放射治疗结束时及放射治疗后一个月左右的、%mdc、%cd62l
low
cd4
t细胞及免疫检查点分子表达的动态的图(伴随tukey post
‑
hoc分析的单向方差分析(anova))。
87.图11为示出在放射治疗前和放射治疗结束时的、基于用ccr7及cd45ra门控的cd8 t细胞的t细胞亚群的变化的图。naive:ccr7
cd45ra
、cm:ccr7
cd45ra
‑
、em:ccr7
‑
cd45ra
‑
、emra:ccr7
‑
cd45ra
(配对t检验)。
具体实施方式
88.以下,在示出最佳方式的同时描述本发明。应理解,在本说明书全文中,除非另有说明,单数形式的表示还包括其复数形式。因此,应理解,除非另有说明,单数形式的冠词(例如英语中的“a”、“an”、“the”等)还包括其复数形式的概念。还应理解,除非另有说明,本说明书中使用的术语均以本领域通常使用的含义使用。因此,除非另有定义,本说明书中使
用的所有专业术语及科技术语与本发明所属领域的普通技术人员通常理解的含义相同。如有冲突,以本说明书(包括定义)为准。
89.以下将适当描述本说明书中特别使用的术语的定义和/或基本的技术内容。
90.定义
91.在本说明书中,“生物标志物”是指作为对通常的生物学过程、病理学过程或治疗介入的药理学应答的指标而被客观测量并评估的特性。
92.在本说明书中,“癌症”或“癌”可被互换使用,是指高度非典型性、比正常细胞增殖快、可破坏性地浸润至周围组织或者转移的恶性肿瘤或这种恶性肿瘤存在的状态。在本发明中,癌症包括但不限于实体瘤及造血肿瘤。
93.在本说明书中,“癌症免疫疗法”是指使用生物防御机制、例如生物所具有的免疫系统来治疗癌症的方法。
94.在本说明书中,“抗肿瘤免疫应答”是指生体内对肿瘤的任何免疫应答。
95.在本说明书中,“抗肿瘤免疫应答中的树突状细胞刺激”是指在对生物体内肿瘤的免疫应答的过程中发生的、激活树突状细胞的任何刺激。该刺激可成为直接或间接产生抗肿瘤免疫应答的因素之一。没有特别限定,典型地,抗肿瘤免疫应答中的树突状细胞刺激可以为由cd4
t细胞(例如,效应t细胞)引起的树突状细胞的激活,由此,被激活的树突状细胞刺激cd8
t细胞,受刺激的cd8
t细胞发挥抗肿瘤效果。
96.在本说明书中,“相关”是指两个事件具有统计学上显著的相关性关系。例如,“与a相关的b的相对量”是指当发生事件a时,b的相对量在统计学上受到显著影响(例如,增加或减少)。
97.在本说明书中,“流式细胞术”是指用于测量悬浮在液体中的细胞、个体及其他生物颗粒的颗粒数量、各自的物理、化学、生物学特性的技术。
98.在本说明书中,“免疫激活”是指免疫功能的消除体内异物的功能增大,可通过在免疫功能中积极作用的任何因素(例如,免疫细胞或细胞因子)的量的增大来表示。
99.在本说明书中,“细胞亚群”是指包括多种特性的细胞的细胞群中的、具有一些共同特征的任意一个细胞的集合。在本技术领域中已知的特定名称的情况下,也可利用该术语来指代特定细胞亚群,还可描述任何特性(例如,细胞表面标志物的表达)来指代特定细胞亚群。
100.在本说明书中,某细胞亚群的“量”是指包括某细胞的绝对数量和细胞群中的比例的相对量。例如,在本说明书中,“cd62l
low
cd4
t细胞亚群的量”可以是指相对于cd4
细胞的量的相对量。并且,在本说明书中,“细胞比例”是指其细胞亚群的量,例如“cd62l
low
cd4
t细胞比例”是指cd62l
low
cd4
t细胞亚群的量。
101.在本说明书中,涉及细胞的术语“相对量”可与“比例”互换使用。典型地,术语“相对量”及“比例”是指,相对于形成特定细胞群(例如,cd4
t细胞群)的细胞的数量的、形成所需的细胞亚群(例如,cd62l
low
cd4
t细胞亚群)的细胞数量。
102.在本说明书中,“基准”是指用于确定本说明书中记载的标志物的量的增减的、比较对象的量。当确定在某治疗(例如,放射治疗)前后的某量的增减时,例如,作为“基准”,可列举治疗之前的该量或本技术领域中通常用作基准的值。
103.在本说明书中,当修饰数值来使用时,“约”用于表示包括直至所记载的数值的
±
10%的范围。
104.在本说明书中,“放射线”是指以波形或颗粒进行的空间或物质中的能量传播。
105.在本说明书中,“放射治疗”是指使用放射线照射的任意治疗方法。
106.(标志物)
107.在本发明的实施方式中,提供一种方法,其将接受过放射治疗的受试者中的细胞亚群的组成用作受试者中的由放射治疗引起的免疫激活的指标。方法可包括分析样品中的细胞亚群的组成的工序。细胞亚群的组成的分析可通过本说明书中所描述的或本领域技术人员已知的任意方法进行。方法可以为体外或计算机模拟(in silico)的方法。在本发明一实施方式中,通过细胞亚群的量与适当的基准之间的比较,来示出受试者中有无免疫激活。尤其,细胞亚群可使用与抗肿瘤免疫应答中的树突状细胞刺激相关的细胞亚群。
108.在一个实施方式中,作为指标的细胞亚群为与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群。例如,在本说明书的实施例中,在放射治疗前后观察到cd62l
low
cd4
t细胞亚群量的增大。cd62l
low
cd4
t细胞在抗肿瘤免疫中负责树突状细胞的激活。对于与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群,同样被认为可用作放射治疗引起的免疫激活的指标。
109.作为与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群,例如,可以举出对次级淋巴器官的归巢分子的表达减少的cd4
t细胞亚群、被效应型t细胞引发的cd4
t细胞亚群、接受到由抗原识别产生的启动的cd4
t细胞亚群及调节性t细胞亚群,但不限于此。
110.作为与树突状细胞刺激相关的cd4
t细胞亚群的示例,例如可以举出cd62l
low
cd4
t细胞亚群、ccr7
‑
cd4
t细胞亚群、lag
‑3
cd62l
low
cd4
t细胞亚群、icos
cd62l
low
cd4
t细胞亚群、ccr4
cd25
cd4
t细胞亚群、cd45ra
‑
cd4
t细胞亚群、cd45ro
cd4
t细胞亚群、cd28
cd62l
low
cd4
t细胞亚群、cd62l
high
cd25
cd4
t细胞亚群、cd127
cd25
cd4
t细胞亚群、cd45ra
‑
foxp3
cd4
t细胞亚群及foxp3
cd25
cd4
t细胞亚群等,但不限于此。
111.与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群可以为例如包含在cd62l
low
cd4
t细胞群中的细胞亚群。作为与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群,可以举出cd62l
low
cd4
t细胞亚群(即,cd62l
low
cd4
t细胞群本身)、icos
cd4
t细胞亚群、icos
cd62l
low
cd4
t细胞亚群、pd
‑1
cd4
t细胞亚群、pd
‑1
cd62l
low
cd4
t细胞亚群、lag
‑3
cd4
t细胞亚群、lag
‑3
cd62l
low
cd4
t细胞亚群、cd28
cd4
t细胞亚群及cd28
cd62l
low
cd4
t细胞亚群等,但不限于此。
112.在一实施方式中,与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群(优选地,包含在cd62l
low
cd4
t细胞群中的细胞亚群)可以成为无进展存活(progression free survival,pfs)的指标。
113.就上述的细胞亚群而言,代替将细胞亚群的量用作指标或除了将细胞亚群的量用作指标之外,可以将合适细胞中的合适表面标志物分子的表达量用作指标。例如,可将在cd4
t细胞中表达的icos、pd
‑
1、lag
‑
3及cd28等的表达量用作指标。更优选地,可将在cd62l
low
cd4
t细胞中表达的icos、pd
‑
1、lag
‑
3及cd28等的表达量用作指标。
114.在一实施方式中,成为指标的细胞亚群为与抗肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群。例如,在本说明书的实施例中,在放射治疗前后观察到hla
‑
dr
cd141
cd11c
细胞亚群的增大。hla
‑
dr介导cd4
t细胞引起的树突状细胞的激活。与抗肿瘤
免疫应答中的树突状细胞刺激相关的树突状细胞亚群也同样被认为可用作由放射治疗引起的免疫激活的指标。cd11c
cd141
cd123
‑
的细胞群通常被认为在功能上具有高th1诱导性的骨髓性树突状细胞(mdc,对抗肿瘤免疫重要的dc),但由于cd141和cd123一般是专门表达的,因此,应注意的是,在本说明书中,无论作为cd141
cd11c
,还是作为cd123
‑
cd11c
都特定相同的细胞群。
115.作为与抗肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群,例如可以举出:因cd4
t细胞群中的归巢分子的表达减少的细胞亚群的增加而增加的树突状细胞亚群;因由cd4
t细胞群中的效应型t细胞引发的cd4
t细胞亚群的增加而增加的树突状细胞亚群;以及因cd4
t细胞群中的受到由抗原识别引起的启动的cd4
t细胞亚群的增加而增加的树突状细胞亚群,但不限于此。并且,作为树突状细胞亚群,例如可以举出hla
‑
dr
树突状细胞亚群、cd80
树突状细胞亚群、cd86
树突状细胞亚群以及pd
‑
l1
树突状细胞亚群,但不限于此。作为树突状细胞,例如可以举出骨髓树突状细胞(mdc、cd141
cd11c
树突状细胞)及浆细胞样树突状细胞(pdc、cd123
cd11c
树突状细胞),但不限于此。
116.作为与抗肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群,可以举出hla
‑
dr
cd141
cd11c
细胞亚群。对于上述的细胞亚群,代替将细胞亚群的量用作指标或者除了将细胞亚群的量用作指标之外,还可将合适的细胞中的合适的表面标志物分子的表达量用作指标。例如,还可将cd141
cd11c
细胞中表达的hla
‑
dr等的表达量用作指标。
117.在一实施方式中,作为指标的细胞亚群为与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8
t细胞亚群。例如,对于cd62l
low
cd8
t细胞上表达的cd137,在放射治疗前后发生着具有显著差异的变化(表4)。受到由cd4
t细胞引起的激活的树突状细胞,刺激cd8
t细胞,最终,受到刺激的cd8 t细胞发挥抗肿瘤活性。cd8
t细胞上的cd137介导因树突状细胞引起的cd8
t细胞的刺激。与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8
t细胞亚群也同样被认为可用作由放射治疗引起的免疫激活的指标。
118.作为与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8
t细胞亚群,例如可以举出:因cd4
t细胞群中的归巢分子的表达减少的细胞亚群的增加而增加的cd8
t细胞亚群、因cd4
t细胞群中的由效应型t细胞引发的cd4
t细胞亚群的增加而增加的cd8
t细胞亚群、因cd4
t细胞群中的受到由抗原识别引起的启动的cd4
t细胞亚群的增加而增加的cd8
t细胞亚群、因树突状细胞群中的hla
‑
dr
树突状细胞亚群的增加而增加的cd8
t细胞亚群、因树突状细胞群中的cd80
树突状细胞亚群的增加而增加的cd8
t细胞亚群、因树突状细胞群中的pd
‑
l1
树突状细胞亚群的增加而增加的cd8
t细胞亚群,但不限于此。并且,作为与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8
t细胞亚群,例如可以举出cd62l
low
cd8
t细胞亚群、cd137
cd8
t细胞亚群以及cd28
cd62l
low
cd8
t细胞亚群,但不限于此。
119.作为与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8
t细胞亚群,包括cd137
cd62l
low
cd8
t细胞亚群。对于上述的细胞亚群,代替将细胞亚群的量用作指标或者除了将细胞亚群的量用作指标之外,还可将合适的细胞中的合适的表面标志物分子的表达量用作指标。例如,还可将cd62l
low
cd8
t细胞中表达的cd137、pd
‑
1或cd28等表达量用作指标。
120.骨髓由来免疫抑制细胞(mdsc,cd33
cd14
hla
‑
dr
‑
细胞群)在放射治疗前后观察到显著变化,这种细胞群的比例也可以作为指标。
121.本说明书中记载的细胞亚群的量可组合多个量用作指标。组合指标可以使应答性
的预测更加准确。在一实施方式中,将选自由样品中的与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群的量、与抗肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群的量及与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8 t细胞亚群的量组成的组中的至少两个量,与基准进行比较,由此来示出在受试者中有无免疫激活。例如,在一实施方式中,可使用下述指数,即,将样品中的cd4
t细胞中的cd62l
low
细胞的比例(x)和cd4
t细胞中的cd25
foxp3
的比例(y)组合而成的x2/y。本领域技术人员应理解的是,代替这些指标或除了这些指标之外,还可使用能够示出由放射治疗引起的免疫激活的其他指标。此外,在本发明中,代替所需的细胞亚群的量或者除了所需的细胞亚群的量之外,还可使用包含在其所需的细胞亚群中的细胞亚群的量。
122.例如,根据本说明书的实施例中所示的结果,以下因子可用作标志物。此外,在本说明书中,当以%
○○
/
○○
的形式表示细胞亚群的比例时,例如,cd62l
low
/cd4
t细胞是指cd62l
low
cd4 t细胞相对于cd4
t细胞的比例,分子中所描述的细胞具有分母中所描述的细胞的特征。当未指定针对细胞亚群的分母时,可包含相对于cd4 t细胞群、cd8 t细胞群等包含该细胞亚群的任何细胞群的比例。
123.在因放射治疗(rt)而发生显著变化且被认为与t细胞免疫增强相关的因子之中,作为rt刚刚结束后即增加的因子,可以举出:
124.·
%cd62l
low
/cd4
t细胞(cd62l
low
cd4
t细胞相对于cd4
t细胞的比例);
125.·
%lag3
/cd62l
low
cd4
t细胞(也可以为lag3
/效应记忆(ccr7
‑
cd45ra
‑
)cd4
t细胞);
126.·
%icos
/cd62l
low
cd4
t细胞(也可以为%icos
/效应记忆(ccr7
‑
cd45ra
‑
)cd4
t细胞);
127.·
%cd28
/cd62l
low
cd4
t细胞(也可以为%cd28
/效应记忆(ccr7
‑
cd45ra
‑
)cd4
t细胞);及
128.·
%hla
‑
dr
/cd11c
cd141
细胞(也可以为hla
‑
dr
high
cd11c
cd123
‑
mdc、%mdc/cd3
‑
cd14
‑
cd19
‑
细胞)
129.·
%pd
‑1
/cd62l
low
cd4
t细胞
130.·
%cd62l
low
ccr7
cd45ra
‑
/cd4
t细胞(也可以为ccr7
cd45ra
‑
cd4
细胞)
131.·
%ccr7
‑
cd45ra
‑
cd4
t细胞
132.·
%ccr7
‑
cd45ra
‑
cd8
t细胞(em cd8
t细胞)
133.·
%ccr7
cd45ra
‑
cd8
t细胞(cm cd8
t细胞)。
134.作为rt刚刚结束后即减少的因子,可以举出:
135.·
%ccr7
cd45ra
cd4
细胞(初始cd4
t细胞)
136.·
%ccr7
‑
cd45ra
cd8
t细胞(emra cd8
t细胞)。
137.另外,作为rt结束后直至一个月后增加的因子,可以举出:
138.·
%pd
‑1
/cd62l
low
cd4
t细胞(也可以为%pd
‑1
/效应记忆(ccr7
‑
cd45ra
‑
)cd4
t细胞);
139.·
%cd137
/cd62l
low
cd4
t细胞(也可以为%cd137
/效应记忆(ccr7
‑
cd45ra
‑
)cd4
t细胞);
140.·
%pd
‑1
/cd62l
low
cd8
t细胞(也可以为%pd
‑1
/效应(ccr7
cd45ra
‑
)cd8
t细
胞、%pd
‑1
/效应记忆(ccr7
‑
cd45ra
‑
)cd8
t细胞);及
141.·
%cd137
/cd62l
low
cd8
t细胞(也可以为%cd137
/效应(ccr7
cd45ra
‑
)cd8
t细胞、%cd137
/效应记忆(ccr7
‑
cd45ra
‑
)cd8
t细胞)。
142.进而,作为因放射治疗而显著增加且被认为与t细胞免疫抑制相关的因子,可以举出:
143.%cd25
foxp3
/cd4
t细胞(调节性t细胞);及
144.%cd33
cd14
hla
‑
dr
low
细胞(myeloid
‑
derived suppressor(mdsc))。
145.尽管不受理论束缚,但这些被认为是对激活的细胞性免疫进行抑制的负反馈。认为作为评估放射治疗后的免疫状态的因子有用。
146.在本发明中,将细胞亚群量与适当的基准进行比较,通过比较,可以确定受试者中有无免疫激活。样品中的细胞亚群的量与基准相比增加可表示受试者中产生由放射治疗引起的免疫激活。或者,样品中的细胞亚群的量与基准相比未增加可表示受试者中未产生由放射治疗引起的免疫激活。
147.作为基准,例如可以举出放射治疗前的受试者的样品中的相应细胞亚群的量,但不限于此。此外,作为基准,还可使用基于未接受放射治疗的受试者的样品通过实验计算的值。作为基准,例如还可使用基于从多例受试者样品获得的数据并通过回归分析等统计计算的值。还可根据从受试者获得的数据,通过机器学习或人工智能等计算出基准。
148.与基准相比增加可通过如下方式示出,即,放射治疗后的细胞亚群量为超过基准量,或者增加超过基准的1%、2%、3%、4%、5%、10%、15%、20%、30%,或者增加超过基准的1.5倍、2倍、3倍、5倍。典型地,若超过基准值,则被认为是与基准相比增加。当通过实验计算基准时,在观察到从基准值看有超过适当误差的增加的情况下,为与基准相比增加。作为适当的误差,例如可以举出1标准偏差、2标准偏差、3标准偏差或超过其等。
149.细胞的分级/分离
150.可通过常规方法从受试者适当地收集用于t细胞的分级/分离的样品。例如,可以从受试者的外周血、骨髓、肿瘤组织、造血组织、脾脏、正常组织、淋巴液等进行。从外周血的样品收集因是非侵入性且方便,因此可以是有利的。
151.本领域普通技术人员可通过常规方法测量受试者的样品中的t细胞的组成。通常,对于规定样品中的靶细胞亚群的标志物(例如,cd4),可使用流式细胞术等来测量作为阳性的细胞数量。细胞群的组成的测定通常使用流式细胞术,但除此之外,还可使用对含有细胞的样品的免疫染色、使用抗体阵列的方法、含有细胞的样品中的蛋白质表达分析(例如,蛋白质印迹(western blot)、质量分析、hplc等)、含有细胞的样品中的mrna表达分析(例如,微阵列、下一代测序等)等。
152.为了测量cd62l
low
cd4
t细胞亚群等的每个细胞亚群的细胞数,可以从总细胞中实验性地排除每个细胞的亚群以外的细胞而求出。有一种试剂盒可以实现它。例如,当使用cd4 effector memory t cell分离试剂盒、人(德国美天旎(militenyi biotech)公司)时,可在不使用cd4抗体和cd62l抗体的情况下,从外周血分离出对应于cd4 cd62llow t细胞亚群的细胞。对全体的活细胞数进行计数和记录,并且可对使用该试剂盒获得的细胞数量进行计数和记录。
153.另外,也可以不使用抗体。抗体可特异性识别并结合在单个细胞中表达的分子,以
当抗体与细胞表面上或细胞内部中表达的分子结合时进一步显色的方式进行检测,并对显色的细胞数量进行计数。其中,这些细胞表面上或细胞内部表达的分子为蛋白质,因此,当表达该蛋白质时,编码该蛋白质的mrna也在细胞内部形成。即,可检查单个细胞内部的mrna以检查编码目标蛋白质分子的mrna的有无。这通过单细胞基因表达分析,即单细胞水平的mrna分析实现的。作为单细胞的基因表达分析,例如可以举出:1)使用quartz
‑
seq进行下一代测序的方法;2)使用fluidigm c1 system或icell8 single
‑
cell system分离细胞、使用smart
‑
seq v4制备基因库的方法;3)使用细胞分选仪分离细胞、使用ambion single cell
‑
to
‑
ct试剂盒用定量pcr测量的方法;4)cytof system(helios公司)等。
154.获得血液,对活细胞数进行计数,使用细胞分选仪等分离细胞,针对所分离的各个细胞,可使用例如ambion single cell
‑
to
‑
ct试剂盒,通过定量pcr法的装置测量针对特定基因的表达量。基于该结果,调查各个细胞对应于cd62l
low
cd4
t细胞亚群等的哪个亚群,并对对应于每个亚群的细胞数量进行计数。作为调查表达的基因的候选,包括αβtcr、cd3、cd4、cd25、ctla4、gitr、foxp3、stat5、foxo1、foxo3、il
‑
10、tgfbeta、il
‑
35、smad2、smad3、smad4、cd62llow、cd44、il
‑
7r(cd127)、il
‑
15r、ccr7low、blimp1等。
155.例如,在cd62l
low
cd4
t细胞中,作为与cd62l
high
cd4
t细胞相比表达更亢进的基因,可以举出auraka、ccl17、cd101、cd24、foxf1、gzma、gzmh、il18rap、il21、il5ra、nd2、smad5、smad7及vegfa(wo2018147291,出于所有目的,该申请通过引用全文并入本说明书中)。通过调查这种基因表达,可判定所取得的t细胞属于哪个t细胞亚群,并可测量细胞亚群的量和/或比例。
156.另外,在cd62l
high
cd4
t细胞中,作为与cd62l
low
cd4
t细胞相比表达更亢进的基因,可以举出bach2、ccl28、ccr7、cd27、cd28、cd62l、csnk1d、foxp1、foxp3、igf1r、il16、il27ra、il6r、lef1、mal及tcf7(wo2018147291)。通过调查这种基因的表达,可判定所取得的t细胞属于哪个t细胞亚群,并可测量细胞亚群的量和/或比例。
157.本发明中,可使用具有规定信号的标准样品进行细胞亚群的比例的测量或与阈值的比较。比较为了产生与规定的细胞亚群对应的荧光信号而配制的标准(例如,附着有荧光色素的颗粒)与包含细胞群的样品之间的信号,通过与标准比较,来测量样品中的细胞亚群的量或比例。另外,比较为了产生与规定的阈值对应的荧光信号而配制的标准(例如,附着有荧光色素的颗粒)与包含细胞群的样品之间的信号,通过与标准比较,来判定样品中的t细胞组成的本发明的标志物的有无或量。
158.在本发明中,就特定的标志物而言,当判定high(高表达)或low(低表达)时,本领域普通技术人员可使用本技术领域常规使用的表达强度的分类基准来进行。例如,就cd62l而言,将与使用pe标记抗人cd62l抗体时的10e2的信号对应的信号强度作为边界,可清楚地划分cd62l
low
和cd62l
high
(wo2018147291)。
159.(放射治疗)
160.在本发明的实施方式中,提供由放射治疗引起的免疫激活的指标。在放射治疗中,通过照射放射线,破坏癌症细胞的dna或rna并抑制细胞分裂,和/或通过诱导细胞凋亡(细胞死亡)以使癌症细胞减少。通常,将达到正常细胞的允许剂量的界限(约50~60gy)的剂量进行分割(1日约2gy)并照射组织。正常细胞修复被破坏的基因并存活下来,但自我修复作用慢于正常细胞的癌症细胞在修复被破坏的基因之前被再次照射而无法修复基因,故而导
致细胞死亡。由此,在照射视野中实现肿瘤消退。
161.据报道,在放射治疗中,除了照射视野中的肿瘤消退之外,还产生在照射野外的肿瘤消退,这被称为远端(abscopal)效应。对于照射视野外的肿瘤消退,无法通过上述的由放射线引起的癌症细胞的增殖抑制/细胞死亡来说明,被认为是通过某种免疫系统的激活的作用,但对于详细的机制还有许多不清楚的部分。虽然认为通过放射治疗引起的免疫系统的激活可提高使用抗肿瘤免疫的癌症免疫疗法的有效性,但在接受过放射治疗的受试者中尚未发现用于确认是否产生远端效应的生物标志物。在本说明书中提供一种生物标志物,其示出对接受过放射治疗的受试者中的照射视野外产生影响的免疫激活(远端效应)。
162.放射线大致分为电磁波和粒子束两种类型。电磁波中包括x射线、γ射线等。粒子束为具有高动能流动的物质粒子,可以举出α射线、β射线、中子射线、质子射线、重离子射线、介子射线等。
163.作为放射治疗中的放射线的照射方法,分为从体外照射放射线的“外部照射”和从体内对癌症或其周围照射将放射线的“内部照射”。还可组合外部照射和内部照射。
164.在外部照射中,从体外通过皮肤照射放射线。最常规的方法为照射高能x射线的方法。作为外部照射,可以举出各种类型,例如可以举出通过直线加速器(linac)进行的x射线照射、三维适形照射(3d
‑
crt)、调强放射疗法(imrt)、立体定向放射疗法(srt)、粒子束治疗(质子束疗法/重粒子束疗法)、图像引导放射治疗(igrt)等。
165.作为内部照射类型,例如可以举出密封近距离放射治疗(组织内照射、腔内照射)、或使用未密封放射线同位素的疗法(内用疗法)等,但不限于此。
166.本发明中可作为对象的放射治疗,只要是以可产生免疫激活的方式进行的照射即可,其方式没有限定。例如,放射治疗中的照射视野可以为包括肿瘤组织的照射范围。尽管不受理论束缚,但认为接受了放射治疗的肿瘤细胞产生免疫原性细胞死亡对于抗肿瘤效应t细胞增加是重要的。放射治疗可以举出胸部放射线照射、对骨转移部位的放射线照射、对淋巴结转移的放射线照射、对肾上腺转移的放射线照射、对肝转移的放射线照射、对脑转移的放射线照射等。
167.本发明的生物标志物可用于研究旨在产生免疫激活的放射治疗的计划。例如,通过受试者中未产生由放射治疗引起的免疫激活,可示出受试者应再次施用放射治疗。或者,通过受试者中产生由放射治疗引起的免疫激活,可示出应结束放射治疗。
168.放射治疗可以将约1~3gy/次的剂量的照射以约1~2次/日进行,持续3周~8周。然而,在考虑到与癌症免疫疗法组合使用的情况下,小剂量的多次照射还可影响免疫细胞(例如,t细胞),因此,优选寡分割照射法(例如,在1~2周内照射大剂量少次数)。
169.为了降低放射治疗中产生副作用的可能性,可在呈现产生免疫激活的时间点不进行另外的放射治疗。尤其是,当增加每次的剂量时,不进行多余的照射而产生免疫激活是有利的。以往,无法检测何时产生了免疫激活,而根据预先根据经验确定的计划来进行放射治疗,但是根据本发明的生物标志物,可确定结束放射治疗的适当的时机。
170.(癌症免疫疗法)
171.癌症免疫疗法是指使用生物所具有的生物防御机制来治疗癌症的方法。癌症免疫疗法中大致分为:通过增强对癌症的免疫功能而进行的癌症免疫疗法和通过抑制癌症的免疫回避功能而进行的癌症免疫疗法。并且,癌症免疫疗法中,包括在体内激活免疫功能的主
动免疫疗法和通过将在体外激活免疫功能的或增殖的免疫细胞返回体内而进行的被动免疫疗法。通过本发明的生物标志物,可根据示出由放射治疗引起的免疫激活,可知道使用免疫功能进行癌症免疫疗法的最佳时机。
172.作为癌症免疫疗法的示例,包括非特异性免疫活化剂、细胞因子疗法、癌症疫苗疗法、树突状细胞疗法、过继免疫疗法、非特异性淋巴细胞疗法、癌症抗原特异性t细胞疗法、抗体疗法、免疫检查点抑制疗法等。
173.免疫检查点抑制剂的典型示例为pd
‑
1抑制剂。作为pd
‑
1抑制剂,可以举出为抗pd
‑
1抗体的纳武单抗(nivolumab,以opdivo
tm
出售)、派姆单抗(pembrolizumab)、斯巴达珠单抗(spartalizumab)及西米普利单抗(cemiplimab),但不限于此。在一优选实施方式中,可选择纳武单抗作为对象。
174.在本发明中,pd
‑
l1抑制剂也可与pd
‑
1抑制剂相同方式使用。抗pd
‑
1抗体被认为通过将由pd
‑
1信号引起的t细胞激活的抑制进行消除而发挥抗癌症效果。另外,抗pd
‑
l1抗体也被认为通过将由pd
‑
1信号引起的t细胞激活的抑制进行消除而发挥抗癌症效果。虽然pd
‑
1抑制t细胞功能的机制尚未完全明确,但认为在pd
‑
1(程序性死亡,programmed death 1)与pd
‑
l1或者pd
‑
l2相互作用时,shp
‑
1,2(为酪氨酸脱磷酸酶的一种)被募集到pd
‑
1的胞质域中,通过使作为t细胞受容体信号转导蛋白质的zap70不活化,而抑制t细胞的激活(okazaki,t.,chikuma,s.,iwai,y.et al.:a rheostat for immune responses:the unique properties of pd
‑
1and their advantages for clinical application.nat.immunol.,14,1212
‑
1218(2013))。认为这是因为shp
‑
1,2被募集到称为itsm基序的部分中,并使附近的t细胞受体的近端信号激酶(proximal signaling kinase)去磷酸化,换言之,也可以说,从受到抗原刺激的t细胞中抹去该“受到抗原刺激”的记忆。
175.pd
‑
1在浸润至癌症组织的杀伤性t细胞和自然杀伤性细胞中以高水平表达。另外,认为通过肿瘤上的pd
‑
l1,减弱了经由由pd
‑
1产生的pd
‑
1信号的免疫应答。通过pd
‑
l1,经由该pd
‑
1信号的免疫应答减弱,但是通过抗pd
‑
1抗体来抑制pd
‑
1与pd
‑
l1之间的相互作用和/或因相互作用产生的信号转导时,可获得抗肿瘤免疫应答的增强效果。
176.作为免疫检查点抑制剂的其他示例,可以举出pd
‑
l1抑制剂(例如,作为抗pd
‑
l1抗体的阿维鲁单抗(avelumab)、德瓦鲁单抗或阿替利珠单抗(atezolizumab))。
177.pd
‑
l1抑制剂将上述pd
‑
1通路结合在pd
‑
l1侧并进行抑制,并且抑制通过pd
‑
1与pd
‑
l1之间的相互作用和/或通过相互作用而产生的信号转导,以产生抗肿瘤免疫应答。
178.作为免疫检查点抑制剂的其他示例,可以举出ctla
‑
4抑制剂(例如,作为抗ctla
‑
4抗体的伊匹单抗(ipilimumab)或曲美木单抗(tremelimumab))。ctla
‑
4抑制剂激活t细胞,产生抗肿瘤免疫应答。t细胞通过表面的cd28与cd80或cd86相互作用而被激活。然而,即使为暂时激活的t细胞,表面表达的ctla
‑
4(细胞毒性t淋巴细胞相关抗原4(cytotoxic t
‑
lymphocyte
‑
associated antigen 4))以与cd20相比更高的亲和力优先与cd80或cd86相互作用,由此激活被抑制。ctla
‑
4抑制剂通过抑制ctla
‑
4而阻止cd20与cd80或cd86之间的相互作用,从而产生抗肿瘤免疫应答。
179.在另一实施方式中,免疫检查点抑制剂可以靶向tim
‑
3(t
‑
cell immunoglobulin and mucin containing protein
‑
3、lag
‑
3(lymphocyte activation gene
‑
3、b7
‑
h3、b7
‑
h4、b7
‑
h5(vista)、或tigit(t cell immunoreceptor with ig and itim domain)等免疫
检查点蛋白质。
180.虽然认为如上所述的免疫检查点抑制对自身组织的免疫应答,但在病毒等抗原长期存在于生物体内的情况下,t细胞中免疫检查点也会增加。对于肿瘤组织也是长期存在于生物体内的抗原,因此认为通过上述免疫检查点来避免抗肿瘤免疫应答,上述的免疫检查点抑制剂使这种回避功能失效,从而具有抗肿瘤效果。
181.在本发明中,免疫检查点抑制剂可适当与其他癌症治疗组合使用。作为其他癌症治疗,除了放射治疗之外,可以举出其他的癌症免疫疗法(例如,过继细胞转移)、化学疗法、温热疗法、外科程序等,但不限于此。免疫检查点抑制剂可与一种或多种的另外药剂组合给药。一种或多种的另外药剂可以为任意的化学治疗药物,或者可包含第二免疫检查点抑制剂。
182.在本发明一实施方式中,提供包含免疫检查点抑制剂的组合物。本发明的包含免疫检查点抑制剂的组合物通常以口服或肠胃外形式全身或局部给药。本发明的包含免疫检查点抑制剂的组合物,通过本说明书中描述的方法对呈现出产生了由放射治疗引起的免疫激活的受试者进行给药,具有显著的治疗效果。
183.给药量根据年龄、体重、症状、治疗效果、给药方法、治疗时间等而不同,但通常例如,每位成人在一次以0.1mg至100mg的范围内一天口服给药1次至多次,或者每位成人在一次以0.01mg至30mg的范围内一天肠胃外给药(优选地,静脉给药)1次至多次,或者一天在1小时至24小时的范围静脉内持续给药。当然,给药量根据各种条件而有变动,因此,存在以少于上述给药量即充分的情况,也存需要超过上述范围的情况。
184.在给药时,包含免疫检查点抑制剂的组合物可采用用于口服给药的内服用固体制剂、内服用液体制剂及用于肠胃外给药的注射剂、外用制剂、栓剂等剂型。对于用于口服给药的内服用固体制剂,包含片剂、丸剂、胶囊剂、散剂、颗粒剂等。胶囊剂包含硬胶囊和软胶囊。
185.根据需要,本发明的组合物可直接使用一种或多种活性成分(例如,针对免疫检查点蛋白质的抗体)、或与赋形剂(乳糖、甘露醇、葡萄糖、微晶纤维素、淀粉等)、粘合剂(羟丙基纤维素、聚乙烯吡咯烷酮、偏硅酸铝酸镁等)、崩解剂(纤维素乙醇酸钙等)、润滑剂(硬脂酸镁等)、稳定剂、增溶剂(谷氨酸、天冬氨酸等)等混合以常规方法制剂化使用。另外,根据需要,可用包衣剂(蔗糖、明胶、羟丙基纤维素、邻苯二甲酸羟丙基甲基纤维素等)包覆,另外也可包覆两层以上。并且,还可包含明胶这样的可吸收物质的胶囊。
186.本发明的组合物在配制成内服用液体制剂以用于口服给药时,包括药学上可接受的水性剂、悬浮剂、乳剂、糖浆剂、酏剂等。在这种液体制剂中,一种或多种活性物质溶解、悬浮或乳化在常用的稀释剂(纯净水、乙醇或其混合物等)中。另外,该液体制剂也可包含润湿剂、悬浮剂、乳化剂、甜味剂、调味剂、香味剂、防腐剂、缓冲剂等。
187.作为用于肠胃外给药的注射剂,包含在溶液、悬浮液、乳液及使用时溶剂中溶解或悬浮进行使用的固体注射剂。注射剂通过将一种或多种活性物质溶解、悬浮或乳化在溶剂来使用。作为溶剂,可使用例如注射用蒸馏水、生理盐水、植物油、诸如丙二醇、聚乙二醇、乙醇等醇类以及它们的组合。并且,上述注射剂可包含稳定剂、增溶剂(谷氨酸、天冬氨酸、聚山梨醇酯80(注册商标)等)、悬浮剂、乳化剂、镇痛剂、缓冲剂、防腐剂等。这些在最后工序中通过灭菌或无菌操作来进行配制。另外,无菌的固体制剂可以例如制备冻干制品,在使用前
溶解于无菌化或无菌的注射用蒸馏水或其他溶剂中进行使用。
188.本发明的组合物可与随附文件(其记载有可与放射治疗并用)一同装入盒子等中进行产品化。随附文件中可记载本发明的组合物优选在放射治疗后在规定期间内给药。随附文件可明确示出可与放射治疗并用,也可以仅提及并用的可能性。
189.(癌症)
190.作为本发明中成为对象的癌症,可举出黑色素瘤(恶性黑色素瘤)、非小细胞肺癌、肾细胞癌、恶性淋巴瘤(霍奇金淋巴瘤或非霍奇金淋巴瘤)、头颈癌、泌尿系统癌症(膀胱癌、尿路上皮癌、前列腺癌)、小细胞肺癌、胸腺癌、胃癌、食道癌、胃食管交界处癌、肝癌(肝细胞癌、肝内胆管细胞癌)、原发性脑肿瘤(胶质母细胞瘤、中枢神经系统原发性淋巴瘤)、恶性胸膜间皮瘤、妇科癌症(卵巢癌、宫颈癌、子宫体癌)、软肉瘤、胆道癌、多发性骨髓瘤、乳腺癌、结肠癌等,但不限于此。
191.(放射治疗和免疫疗法组合使用的治疗方法)
192.可对受试者进行放射治疗,可以从接受过放射治疗的受试者采集样品。通过分析该样品中的细胞亚群的组成,如上所述可确定受试者中有无由放射治疗引起的免疫激活。根据需要,也可以从接受放射治疗前的受试者采集样品。该样品中的细胞亚群的组成可用作基准以用于比较。
193.样品的采集的时间点无特别限定。是否产生由放射治疗引起的免疫激活以及持续到何时均根据受试者而不同,可以在任意的时间点进行样品采集以检查该时间点上的免疫激活。细胞亚群中的变化,例如,树突状细胞(cd11c
cd141
细胞)的hla
‑
dr阳性率及cd62l
low
cd4
t细胞的icos阳性率的变化有可能会持续2~3个月。根据受试者的不同,有些会持续1年以上高cd62l
low
cd4
t细胞比例。适用保险的化学放射治疗后德瓦鲁单抗(durvalumab,抗pd
‑
l1抗体)的可给药期间可以设置为从化学放射治疗结束后的第一天到病情没有恶化的期间,若是这种时间段内,则认为可以检测免疫激活状态的放射治疗后的变化,判断是否进行癌症免疫疗法。
194.树突状细胞或t细胞亚群中的变化在放射治疗刚刚结束后达到峰值,之后cd62l
low
cd4
t细胞比例等细胞亚群比例呈现恢复原始水平的倾向。因此,虽然不是必需的,但通过从放射治疗的时间点到经过一定期间后的期间内获得样品,可能会增加用于癌症免疫疗法的免疫激活的检测可能性。例如,样品可以在放射治疗的时间点到约1年后的期间、到约6个月后的期间、到约3个月后的期间、到约2个月后的期间、到约4周后的期间、或到约14天之后的期间、或在放射治疗刚刚结束后等的时间点上获得,但不限于此。
195.当经过一定期间进行放射治疗时,可以在多个时间点从受试者获得样品,并监测受试者中的由放射治疗引起的免疫激活。例如,当未产生由放射治疗引起的免疫激活时,可再次向受试者施用放射治疗。当产生了由放射治疗引起的免疫激活时,结束放射治疗,并可施用癌症免疫疗法。作为多个时间点,可以为放射线的每次照射后,也可以是放射线照射的多次(例如,2次、3次、4次或5次或者更多次)中1次照射后,也可以独立于照射在多天(例如,2天、3天、4天、5天、1周或2周或者更长时间)中1次的时间点。
196.当本发明的生物标志物示出产生免疫激活时,可向受试者施用癌症免疫疗法,但就施用癌症免疫疗法的时间点而言,只要是保持免疫激活状态就无特别限定。从放射治疗的时间点随着时间推移,免疫激活状态有可能恢复到原始状态,因此虽然不是必需的但当
示出产生免疫激活时,可在从放射治疗的时间点到一定期间、例如从放射治疗的时间点到约4周之后、或者从放射治疗的时间点到约14天后的期间,向受试者施用癌症免疫疗法。由此,可提高享受远端效应的好处的可能性。在一实施方式中,受试者中产生由放射治疗引起的免疫激活,由此可在该时间点向受试者施用包含免疫检查点抑制剂的癌症免疫疗法。
197.在一实施方式中,可进一步施用作用于免疫抑制的因子来确定施用癌症免疫疗法的时刻。例如,大致在放射治疗后一个月左右时调节性t细胞或mdsc可能会增加,可在此类细胞亚群的增加之前(即,当此类细胞亚群的比例为一定以下时)向受试者施用包含免疫检查点抑制剂的癌症免疫疗法。
198.本发明人发现,通过放射治疗,受试者的免疫细胞中所包含的特定细胞亚群(例如,与抗肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群、与抗肿瘤免疫应答中的树突状细胞刺激相关的cd8
t细胞亚群或与抗肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群)的量或比例发生了变化。由此,在本发明一方面,提供通过向受试者施用放射治疗而引起的受试者中的细胞亚群的比例的调节。特别地,通过放射治疗,可使包含在cd4
cd62l
low
细胞群中的细胞亚群(例如,cd4
cd62l
low
细胞亚群)的量或比例增加。认为受试者中的特定细胞亚群(例如,cd4
cd62l
low
细胞亚群)负责受试者中的抗肿瘤免疫,另外,由于通过放射治疗可改变这种负责抗肿瘤免疫的特定细胞亚群的量或比例,因此认为通过放射治疗可使受试者改变为对癌症免疫疗法(例如,免疫检查点抑制剂)应答性的状态。
199.在本发明一实施方式中,提供一种方法,该方法在具有对癌症免疫疗法无应答的免疫细胞组成(例如,具有低cd4
cd62l
low
细胞亚群的量或比例)的受试者中治疗癌症,该方法包括向受试者施用放射治疗的工序。根据需要,该方法包括向受试者施用癌症免疫疗法的工序。另外,该方法可包括测量受试者中的免疫细胞组成的工序。由此,可确认通过放射治疗受试者对癌症免疫疗法应答性地变化,可使用癌症免疫疗法。本发明还提供一种组合物,其特征在于,该组合物包含用于治疗癌症的免疫检查点抑制剂,可以给与至接受过放射治疗的受试者,所述受试者具有对癌症免疫疗法无应答的免疫细胞组成(例如,具有低cd4
cd62l
low
细胞亚群的量或比例)。例如,免疫细胞组成可以为外周血中的免疫细胞组成。
200.本领域普通技术人员可参考wo2018/147291等来确定对癌症免疫疗法无应答(或有应答)的免疫细胞组成。例如,当cd4
t细胞中的cd62l
low
t细胞的比例低于阈值(无效组阈值)时,免疫细胞组成被认为对癌症免疫疗法无应答。阈值可由本领域普通技术人员考虑到敏感性/特异性来适当确定。作为阈值的示例,对于cd62l
low
cd4
比例而言可以为19.4%。另外,免疫细胞组成可使用cd62l
low
cd4
比例与调节性t细胞(例如,cd25
foxp3
cd4
细胞比例)之间的相对值来判定。例如,可以使用x/y或x2/y,其中,x为cd62l
low
cd4
比例,y为cd25
foxp3
cd4
细胞比例。在这种情况下,作为一例,对于比例(x/y)可以将7.35作为阈值,另外对于x2/y可以将192作为阈值。
201.(试剂盒)
202.在本发明一实施方式中,提供一种试剂盒,用于判定受试者中是否产生由放射治疗引起的免疫激活。试剂盒可包含针对适当分子的一种或多种检测剂以检测本说明书中描述的细胞亚群。可将这种检测剂的组合用于受试者的t细胞组成的确定。这种试剂盒可用于测量受试者中作为本说明书记载的新型生物标志物的特定细胞亚群的比例。
203.在本发明一实施方式中,试剂盒可包含针对以下物质的检测剂:
204.(a)cd4及cd62l;
205.(b)(i)选自icos、pd
‑
1、lag
‑
3及cd28中的标志物、(ii)cd4以及(iii)cd62l;
206.(c)cd11c、cd141及hla
‑
dr;
207.(d)cd11c、cd123及hla
‑
dr;或者
208.(e)cd8、cd62l及cd137。
209.在一实施方式中,检测剂为抗体。优选地,抗体被适当地标记,易于标志物的检测。
210.实施例
211.(实施例1:由放射治疗引起的免疫激活的指标)
212.(概述)
213.在本实施例中证实,受试者中的特定细胞亚群的组成是在放射治疗前后受试者中显著变化的参数(即,生物标志物)。
214.(材料及方法)
215.[受试者]
[0216]
在本实施例中,对以下受试者(20名)在放射治疗前后(适用的情况下也可以在以后)回收外周血,以检查外周血内的细胞群的组成。
[0217]
表1
[0218][0219]
采样时间点:对于处置前,表示从放射线治疗开始时间点至哪天前,对于处置后,表示从处置结束时间点至哪天后
[0220]
crt:化学放射线疗法;trt:胸部放射线治疗(thoracic radiotherapy);svc:上大动脉;srt:定位放射线治疗;curative:治疗目的;palliative:缓解目的
[0221]
[pbmc分析]
[0222]
如下进行各时间点的采样和pbmc分析。pbmc分析中使用了单核细胞分离用的bd真空cpttm采血管。对pbmc进行了fcm分析。
[0223]
表2
[0224]
[0225][0226]
分析时
[0227]
1.髓系(myeloid)细胞分析
[0228]
解冻后,进行cd11c、cd141、hla
‑
dr、cd33、cd14等抗体染色,进行了流式细胞术分析。
[0229]
2.t细胞分析
[0230]
1)悬浮于rpmi1640 10%fcs中,在5%co2培养箱中于37℃静置36小时左右(32
‑
48小时)。
[0231]
2)进行t细胞表面标志物用抗体染色,进行了流式细胞术分析。
[0232]
(结果)
[0233]
针对20名受试者中的放射治疗前后的各细胞群的比例,基于配对学生双边t检验计算t统计量。结果示于下述表3中。t统计量为0.05以下的以粗体/下划线表示。
[0234]
表3
[0235][0236]
※
x为cd4
t细胞中的cd62l
low
细胞的比例,y为cd4
t细胞中的cd25
foxp3
的比例
[0237]
对于一部分细胞亚群,在图中示出放射治疗前后的变化。在放射治疗前后,cd4
细胞群中的cd62l
low
cd4
细胞亚群的比例、及cd62l
low
cd4
细胞亚群中的icos
cd62l
low
cd4
细胞亚群的比例显著增加(图1及图2)。cd4
细胞群中的cd62l
low
cd4
细胞亚群的比例的增加在每个放射治疗类型(curative trt:治疗目的胸部放射治疗;curative crt:治疗目的化学疗法并用放射治疗;palliative trt:缓解目的胸部放射治疗)中同样地观察到(图3)。另外,在放射治疗前后,cd141
cd11c
细胞群中的hla
‑
dr
cd141
cd11c
细胞亚群的比例显著增加(图4)。
[0238]
对于进行了3次采样的受试者(n=11)的在放射治疗前、放射治疗结束时及放射治
疗后的各个时间点上的各细胞群比例之差,基于配对学生双边t检验计算出t统计量。结果示于表4中。t统计量为0.05以下的以粗体/下划线表示。
[0239]
表4
[0240][0241]
※
x为cd4
t细胞中的cd62l
low
细胞的比例,y为cd4
t细胞中的cd25
foxp3
的比例
[0242]
1:放射线治疗前;2:放射线治疗结束时;3:放射线治疗后
[0243]
对于一部分细胞亚群,在图中示出放射治疗前后的变化。在放射治疗的约30天后,暂时增加的cd62l
low
cd4
细胞亚群的比例和hla
‑
dr
cd141
cd11c
细胞亚群的比例存在恢复到放射治疗前的水平的倾向(图5)。
[0244]
(讨论)
[0245]
cd62l
low
cd4
细胞亚群具有强的正相关的t细胞亚群为1型辅助cd4
t细胞(th1)、效应记忆cd4
t细胞、cd8
t细胞、效应cd8
t细胞。它们是在细胞性免疫中对细胞杀伤功能很重要的细胞亚群。另一方面,具有负相关的是2型辅助cd4
t细胞(th2)、调节性t细胞。这些是公知的抑制细胞性免疫的细胞亚群。因此,认为cd62l
low
cd4
细胞亚群的增加表示抗肿瘤细胞性免疫的激活。另外,hla
‑
dr
cd141
cd11c
树突状细胞亚群和cd62l
low
cd4
细胞亚群具有正相关关系。认为通过被激活的树突状细胞表达mhc classii限制性抗原,从而导致识别mhc classii限制性抗原的cd62l
low
cd4
细胞亚群的增加,cd62l
low
cd4
细胞亚群被认为是与肿瘤免疫应答中的树突状细胞刺激相关的cd4
t细胞亚群。hla
‑
dr
cd141
cd11c
树突状细胞亚群被认为是与肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群。并且,lag3
cd62l
low
cd4
t细胞亚群、icos
cd62l
low
cd4
t细胞亚群、cd28
cd62l
low
cd4
t细胞亚群、pd
‑1
cd62l
low
cd4
t细胞亚群、cd137
cd62l
low
cd4
t细胞亚群、pd
‑1
cd62l
low
cd8
t细胞亚群、cd137
cd62l
low
cd8
t细胞亚群也被认为是与肿瘤免疫应答中的树突状细胞刺激相关的t细胞亚群(wo2018/147291)。
[0246]
此外,在放射治疗结束一个月后的外周血细胞分级的分析结果中,显示hla
‑
dr
cd141
cd11c
树突状细胞亚群的减少和cd62l
low
cd4
t细胞亚群、cd28
cd62l
low
cd4
t细胞亚群的减少。可以理解为,通过消除了由放射治疗引起的免疫原性癌细胞死亡,从而树突状细胞的激活减弱,对于与此相关而增加的cd62l
low
cd4
t细胞亚群及树突状细胞的相互作用而言所必需的cd28表达转为减少。但是,放射治疗中受到来自树突状细胞的癌症抗原刺激的cd62l
low
cd4
t细胞亚群表达cd137、icos,保持并残存有激活状态。另一方面,在放射治疗结束一个月后,观察到cd25
foxp3
cd4
调节性t细胞亚群及cd33
cd14
hla
‑
dr
‑
mdsc细胞亚群的增加。众所周知,调节性t细胞和mdsc是抑制t细胞免疫的细胞,可以理解其是用于控制所激活的t细胞亚群的负反馈。最初,作为显示pd
‑
1抑制剂效果的t细胞免疫状态的指标,将cd62l
low
cd4
t细胞亚群用作分子,将调节性t细胞亚群用作分母。
[0247]
从上述结果可以看出,通过使用与抗肿瘤免疫应答中的树突状细胞刺激相关的t细胞亚群和/或与抗肿瘤免疫应答中的树突状细胞刺激相关的树突状细胞亚群,可评估由放射治疗引起的免疫激活。
[0248]
(实施例2:由放射治疗引起的免疫激活的应用)
[0249]
向外周血中的cd4
cd62l
low
t细胞亚群比例为一定以上的受试者给药免疫检查点抑制剂。在奏效群中,有时在给药免疫检查点抑制剂之后cd4
cd62l
low
t细胞亚群比例降低。通过监测受试者中的cd4
cd62l
low
t细胞亚群比例,以监测受试者对免疫检查点抑制剂的应答性。当cd4
cd62l
low
t细胞亚群的比例降低时,向受试者施用放射治疗。通过放射治疗,cd4
cd62l
low
t细胞亚群的比例增加,恢复受试者对免疫检查点抑制剂的应答性。
[0250]
基于wo2018/147291中所描述的步骤,对外周血中的cd62l
low
cd4
t细胞亚群比例低于无效群阈值、被判定为对癌症免疫疗法无应答的受试者施用放射治疗。接着,向受试者给药免疫检查点抑制剂。通过放射治疗,所述受试者的外周血中的cd62l
low
cd4 t细胞亚群比例增加,对免疫检查点抑制剂具有应答性。
[0251]
(实施例3:cd62l
low
cd4
t细胞与效应记忆细胞之间的相关性)
[0252]
对从42名i期(stage i)~iv期的肺癌患者获得的84份样本(其中,20名的手术前后,22名的egfr
‑
tki前后)进行fortessa分析,分析了cd4
t细胞中的cd62l
low
cd4
t细胞的比
例与cd4
t细胞中的效应记忆细胞(ccr7
‑
cd45ra
‑
)cd4
t细胞的比例之间的关系。
[0253]
结果示于图6。可理解为cd62l
low
cd4
t细胞与ccr7
‑
cd45ra
‑
cd4
t细胞具有强相关关系。从该结果可知,可使用效应记忆细胞(ccr7
‑
cd45ra
‑
)cd4 t细胞的量来代替cd62l
low
cd4 t细胞的量。
[0254]
(实施例4:不同患者群中由放射治疗引起的免疫激活的指标的研究)
[0255]
(概述)
[0256]
除了实施例1的研究之外,还研究了不同患者群中的特定细胞亚群的组成是否为放射治疗前后在受试者中具有显著变化的参数(即,生物标志物)。
[0257]
(材料及方法)
[0258]
[受试者]
[0259]
本实施例在埼玉医科大学国际医疗中心进行,以56名接受了治疗目的化学放射疗法(crt)或胸部放射疗法的持续局部进行性nsclc患者作为对象。22名患者在crt后接受了德瓦鲁单抗的联合疗法。在放射治疗前后、以及根据情况在放射治疗的约1个月后采集外周血样品。用lsr fortessa
tm
分析了pbmc。在各时间点的采样遵循了与实施例1相同的步骤。
[0260]
作为对象的患者及被实施的处置的内容如下所示。
[0261]
表5
[0262]
患者特性
[0263][0264]
表6
[0265]
处置的详细内容
[0266][0267]
(结果)
[0268]
结果示于图7~图11中。图7~图11中的“rt之前”对应于图1~图6中的“pre
‑
trt”,表示临近放射治疗(rt)之前。图7~图11中的“rt后”、图1~图6的“trt后”、“trt完成时”、“trt完成”均在放射治疗(rt)刚结束之后。
[0269]
与实施例1的结果一致,胸部放射治疗后,观察到在外周血中cd62l
low
cd4
t细胞和hla
‑
dr
骨髓树突状细胞的比例的显著增加(图7的a、b)。另外,在放射治疗前的%cd62l
low
cd4 t细胞与无进展存活(pfs)之间观察到显著相关性(图7的c)。此外,图7中的hla
‑
dr
high
cd11c cd123
‑
mdc为与实施例1中的表3及4以及图5的hla
‑
dr
high
cd11c cd141 mdc对应的细胞群。
[0270]
图8示出放射治疗前和放射治疗结束时的cd62l
low
cd4 t细胞上的免疫检查点分子的表达的变化(配对t检验)。与实施例1的结果(表3)一致,cd62l
low
cd4 t细胞上的lag
‑
3及icos的表达显著增加(图8的b及c)。除此之外,在本实施例中,cd62l
low
cd4 t细胞上的pd
‑
1表达的增加也观察到显著差异(图8的a)。这被认为是因样品数的增加而引起的。
[0271]
图9示出放射治疗前和放射治疗结束时的、基于用ccr7及cd45ra门控的cd4
t细胞所产生的t细胞亚群的变化。通常,ccr7和cd45ra是细胞表面标志物,用于分级初始t细胞(ccr7
cd45ra
)、中央记忆(cm)t细胞(ccr7
cd45ra
‑
)、效应记忆t细胞(ccr7
‑
cd45ra
‑
)。
[0272]
如图9中的a所示,发现初始cd4细胞在放射治疗前后减少。如图9的b所示,观察到作为中枢记忆细胞(cm)的ccr7
cd45ra
‑
cd4
t细胞的显著增加。中枢记忆细胞一旦发挥功能之后,攻击对象消失,成为处于休止状态的细胞,所以中枢记忆细胞在放射治疗后增加是不符合本发明的逻辑的。因此,实际上将中枢记忆细胞群进一步分为cd62l
low
和cd62l
high
进行研究,结果发现,不是作为本来的中枢记忆细胞的细胞表面标志物的特征的cd62l
high
的细胞群,而是作为效应记忆细胞(em)的特征的cd62l
low
的细胞群增加(图9的d及e)。即,cd62l
low
ccr7
(图9的e)群一时性表达ccr7,故而在外形上似乎是cm,实际增加的细胞群为em,从图9的c和图9的e可知,通过放射治疗,em增加。该结果还与上述实施例3一致。
[0273]
图10示出放射治疗前、放射治疗结束时及直至放射治疗约一个月后的、%mdc、%cd62l
low
cd4
t细胞及免疫检查点分子表达的动态(伴随tukey post
‑
hoc分析的单向方差分析(anova))。各图的最上侧的p值为anova分析的结果。另外,通过post
‑
hoc分析,示出呈现显著差异的2点间的p值和条形图。一半的患者中cd62l
low
cd4
t细胞在直至放射疗法后4周开始减少。在放射治疗结束时与放射治疗约一个月后的期间没有出现统计上的显著差异,但大约半数的患者中随着时间的推移减少,与实施例1中的表4的结果相同地,放射治疗后增加的mdc、cd62l
low
cd4
t细胞、cd62l
low
cd4
t细胞的icos表达及pd
‑
1表达是在接下来的一个月的期间内趋于减少。这表明,暂时被激活的针对肿瘤的免疫功能随后减弱,认为最好在这些细胞减少之前开始给药免疫检查点抑制剂等。
[0274]
图11示出在放射治疗前和放射治疗结束时的、基于用ccr7及cd45ra门控的cd8
t细胞所产生的t细胞亚群的变化。
[0275]
在图1中显示放射治疗前后的cd8
细胞群的量没有发生显著变化,但认为实际上对癌症细胞具有杀伤能力的细胞为cd8
细胞,因此,在放射治疗中,通过用ccr7及cd45ra设门控来分析cd8
t细胞群中的特定亚群中是否存在变化。如上所述,通常ccr7及cd45ra为细胞表面标志物,该细胞表面标志物可用于分级初始t细胞(ccr7
cd45ra
)、中央记忆(cm)t细胞(ccr7
cd45ra
‑
)、效应记忆t细胞(ccr7
‑
cd45ra
‑
),ccr7
‑
cd45ra
的细胞相当于em老化的细胞(terminally differentiated)(emra)。
[0276]
em(图11c)和cm(图11d)增加、emra(图11a)减少表明:年轻的em增加,老化的em减少,从这些结果可以理解cd8阳性细胞也被rt激活。
[0277]
(讨论)
[0278]
在放射治疗时,放射治疗中免疫被激活,成为免疫检查点抑制易于起效的状态,随着时间的推移恢复到原始状态。免疫被激活的状态中,分化为特定细胞群(cd62l
low
cd4
等)的细胞增加,未分化(初始)的细胞减少,被刺激、激活的树突状细胞(hla
‑
dr
high
cd11c
cd123
‑
mdc等)增加,cd8阳性的细胞群中的年轻的em增加。观察这些任意的细胞群的变化时,可以判定放射治疗后是否为免疫检查点抑制易于起效的状态。除此之外,该易于起效的状态随着时间的推移而自然而然地恢复到原始状态,由此可以判定是否需要再次进行放射治疗以再次成为免疫检查点抑制易于起效的状态。
[0279]
此外,不用放射治疗而仅使用化学疗法进行分析的结果(n=60,数据未显示),cd4及cd8阳性的任意者中效应记忆型(ccr7
‑
cd45ra
‑
)的比例均显著减少。ccr7
‑
cd45ra
cd8
(emra)细胞分级略有增加,但没有显著差异。cd62l
low
的比例没有变化,但有微微减少趋势。树突状细胞没有变化。由上可知,仅使用化学疗法的情况下,在t细胞分级上,倾向于以与放射治疗后相反的模式变化(仅使用抗癌药物治疗时,发现年轻的em减少,作为比例,老效应的emra分级增加)。
[0280]
用仅进行放射治疗的患者群进行分析时,得到了与化学放射治疗(化学疗法 放射治疗)群相同的结果,因此,本实施例中的放射治疗前后的免疫细胞组成的变化认为是由放射治疗所致。
[0281]
针对本实施例的结果的解释,预测存在如下机制:
[0282]
在放射治疗中,因放射线而引起局部的免疫原性癌细胞死亡,树突状细胞被激活,效应t细胞增殖。在使用化学治疗药物的抗癌药物治疗中,产生因化学治疗药物引起的免疫
原性癌细胞死亡,树突状细胞激活,但同时作为化学治疗药物及止吐剂的类固醇产生树突状细胞减少效果,因树突状细胞激活而使效应t细胞增殖,但进入细胞周期的t细胞因化学治疗药物受到细胞损伤而死亡(em分级减少效果),已经失去增殖能力的emra群即使受到抗原呈递也不会进入细胞周期、不受到细胞损伤,并获得通过抗原刺激产生的延长存活时间的效果(emra分级的临时增加效果)。
[0283]
因此,据预计,重复化学治疗药物的治疗时,由于年轻的em的减少效果,作为终末分化(terminally differentiated)效应细胞的emra最终枯竭,抗肿瘤t细胞免疫消失。例如,在作为胃癌临床试验的keynote062中表明,当并用抗pd
‑
1抗体和化学治疗药物以进行长期治疗时,则由抗pd
‑
1抗体单剂获得的治疗效果降低。对此,认为放射治疗可通过使年轻的em增加的效果来增强抗肿瘤t细胞免疫。另外,认为该增强效果可通过观察与上述机制相关的任何细胞群(例如,mdc或cd62l
low
t细胞分级等)来数值化。
[0284]
工业上的可用性
[0285]
本发明可用于癌症治疗。根据本发明,可评估由放射治疗引起的免疫激活,并可用于与放射治疗并用的癌症免疫疗法(例如,免疫检查点抑制剂)。
[0286]
注释
[0287]
如上所述,使用本发明的优选实施方式举例说明本发明,但本发明不应被解释为限于该实施方式。应理解的是,本发明应当仅由发明要求保护范围来解释。本领域普通技术人员应理解,可根据本发明的具体的优选实施方式的描述,基于本发明的描述及技术常识来实现等效范围。应理解的是,本说明书中所引用的专利、专利申请及文献的内容应以与本说明书具体描述内容本身相同的方式通过引用并入本说明书。本技术主张日本专利申请第2019
‑
028502号(2019年2月20日申请)及同第2019
‑
175852号(2019年9月26日申请)的优先权,其全部内容通过引用结合在此。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。