1.本发明属于药品研究和分子生物学方法学技术领域,具体涉及脂滴作为神经退行性疾病药物靶点的用途。
背景技术:
2.小胶质细胞(microglia)是中枢神经系统内固有的免疫效应细胞,其中一种富含脂滴的小胶质细胞与其他亚型的小胶质细胞存在不同的转录组学特征,被称之为脂质液滴积聚小胶质细胞(lipid
‑
droplet
‑
accumulatingmicroglia,ldam),其下调的基因部分与dam、mgnd这两种小胶质细胞亚型存在重合,但是也存在axl、cd74、clec7a和cybb等基因在富含脂滴的小胶质细胞下调,在dam、mgnd中却上调的现象。
3.现有研究表明,小胶质细胞参与一系列神经退行性疾病的发生,小胶质细胞活化和神经炎症为神经病理学的主要特征。阿尔茨海默病(alzheimer's disease,ad)是一种以aβ聚集导致的神经外淀粉样蛋白沉淀,tau蛋白过度磷酸化导致的神经纤维缠结为主要病理特征的神经退行性疾病,其临床表现以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆为特点,病因迄今未明,ad发病过程中是否也存在小胶质细胞ldam表型活化的现象也尚不清楚。
4.目前,针对ad发病机制和治疗手段的研究十分有限。多年来,胆碱酯酶抑制剂和兴奋性天冬氨酸受体拮抗剂等药物一直被临床诊疗指南推荐作为首要治疗方式。然而,这些药物也仅只在一定程度上改善部分患者的临床症状及认知功能水平,长期使用还会造成药物依耐性和严重的不良反应(adrs)。同时近年来一系列以aβ和tau蛋白为靶点开发的药物研发均在不断开展,但最终均以临床试验失败而告终,提示aβ和tau蛋白不是最佳治疗靶点。因此,探索ad的发病机制,寻找安全、有效的药物作用靶点,并针对其靶点开展分子机理研究,为完善和阐释ad发病机制及加速研制和开发新的抗ad药物进程提供理论和实验依据,具有重要意义。
技术实现要素:
5.本发明发现(i)尿石素b或其药学上可接受的盐或(ii)长脂肪酸酰基辅酶a合成酶抑制剂(triacsin c,trc)能抑制小胶质细胞内脂滴的生成,从而抑制小胶质细胞向ldam表型转化,还发现ldam比例降低后可以显著改善ad小鼠的记忆障碍、提高神经元突触相关蛋白psd95、syn的表达水平以及神经元活力,因而确定了脂滴可以成为神经退行性疾病药物的靶点,通过抑制脂滴生成来抑制小胶质细胞ldam表型转化可以成为治疗ad的新手段。
6.基于以上发现,本发明提供如下技术方案:
7.第一方面,本发明提供脂质液滴积聚小胶质细胞表型转化抑制剂在制备用于治疗或预防与神经炎症相关的神经退行性疾病的药物中的应用,该类药物以脂质液滴积聚小胶质细胞表型转化抑制剂作为有效成分,以小胶质细胞为与神经炎症相关的神经退行性疾病的治疗靶点,通过抑制小胶质细胞转化为脂质液滴积聚小胶质细胞表型,来延缓、预防和治
疗神经炎症相关的神经退行性疾病。
8.第二方面,本发明提供脂滴生成抑制剂在制备用于治疗或预防与神经炎症相关的神经退行性疾病的药物中的应用,该类药物以脂滴生成抑制剂作为有效成分,通过抑制小胶质细胞内脂滴的生成来抑制小胶质细胞转化为脂质液滴积聚小胶质细胞,从而延缓、预防和治疗神经炎症相关的神经退行性疾病。
9.第三方面,本发明提供(i)尿石素b或其药学上可接受的盐或(ii)长脂肪酸酰基辅酶a合成酶抑制剂在制备用于治疗或预防与神经炎症相关的神经退行性疾病的药物中的应用,该类药物采用(i)尿石素b或其药学上可接受的盐或(ii)长脂肪酸酰基辅酶a合成酶抑制剂作为抑制小胶质细胞内脂滴生成的有效成分,通过抑制脂滴生成来抑制小胶质细胞转化为脂质液滴积聚小胶质细胞,进而延缓、预防和治疗神经炎症相关的神经退行性疾病。
10.第四方面,本发明提供(i)尿石素b或其药学上可接受的盐或(ii)长脂肪酸酰基辅酶a合成酶抑制剂在制备脂滴生成抑制剂中的应用,该脂滴生成抑制剂包含(i)尿石素b或其药学上可接受的盐或(ii)长脂肪酸酰基辅酶a合成酶抑制剂作为有效成分,对β淀粉样多肽1‑
42
诱导原代小胶质细胞生成脂滴具有抑制作用。
11.第五方面,本发明提供(i)尿石素b或其药学上可接受的盐或(ii)长脂肪酸酰基辅酶a合成酶抑制剂在制备脂质液滴积聚小胶质细胞表型转化抑制剂中的应用,该脂质液滴积聚小胶质细胞表型转化抑制剂包含(i)尿石素b或其药学上可接受的盐或(ii)长脂肪酸酰基辅酶a合成酶抑制剂作为有效成分,通过抑制脂滴生成来抑制小胶质细胞转化为脂质液滴积聚小胶质细胞。
12.第六方面,本发明提供一种药物筛选方法,该药物为脂滴生成抑制剂、脂质液滴积聚小胶质细胞表型转化抑制剂或用于治疗或预防与神经炎症相关的神经退行性疾病的药物,包括以下步骤:
13.向原代小胶质细胞体外培养体系中加入β淀粉样多肽1
‑
42(aβ1‑
42
)进行共培养,作为空白组;
14.向原代小胶质细胞体外培养体系中加入β淀粉样多肽1
‑
42和待测药物或待测药物组合进行共培养,作为干预组;
15.统计各组中脂质液滴积聚小胶质细胞的比例;
16.选取能相对空白组有效降低脂质液滴积聚小胶质细胞比例的干预组。
17.在上述技术方案的基础上,统计各组中脂质液滴积聚小胶质细胞的比例的步骤为:通过在激光共聚焦荧光显微镜下观察脂滴的数量来确定脂质液滴积聚小胶质细胞的比例。
18.具体地,与神经炎症相关的神经退行性疾病为治疗帕金森病、阿尔茨海默病、多发性硬化症中的一种或多种。
19.本发明检测脂质液滴积聚小胶质细胞比例的方式至少包括如下方式中的一种:(i)采用激光共聚焦透射电镜检测细胞内脂滴的数量;(ii)免疫荧光法检测bodipy和perilipin2脂质液滴积聚小胶质细胞相关标志物;(iii)qpcr法检测脂质液滴积聚小胶质细胞的特征基因转录水平;(iv)wb检测脂质液滴积聚小胶质细胞特征蛋白数量。
20.本发明具有如下优点和有益效果:
21.(1)本发明首次以(i)尿石素b或其药学上可接受的盐或(ii)长脂肪酸酰基辅酶a
合成酶抑制剂作为脂滴生成抑制剂、脂质液滴积聚小胶质细胞表型转化抑制剂的有效成分。
22.(2)本发明首次以脂滴作为神经退行性疾病药物的靶点,也首次以抑制小胶质细胞ldam表型转化作为治疗ad的手段,将脂滴生成抑制剂、脂质液滴积聚小胶质细胞表型转化抑制剂作为用于治疗或预防与神经炎症相关的神经退行性疾病的药物的有效成分。
23.(3)本发明提供的药物筛选方法首次以脂质液滴积聚小胶质细胞的比例作为药物筛选的指标,该方法能简单、快速、准确地筛选出用于治疗或预防与神经炎症相关的神经退行性疾病的药物。
附图说明
24.图1为12月龄wt衰老小鼠与12月龄app/ps1/tau三转基因ad小鼠脑组织免疫荧光双标实验结果;其中,图1a展示了ldam特异性标志物perilipin2(简称plin 2)的表达情况,图1b展示了小胶质细胞标志物iba1的表达情况。
25.图2为ad小鼠的动物行为学实验结果;其中,图2a展示了ad小鼠模型构建、给药、行为学实验的流程图;图2b展示了老化度评分实验结果;图2c展示了各组小鼠的体重变化情况;图2d为智力筑巢实验结果;图2e展示了morris水迷宫训练阶段四组小鼠找到隐藏平台的潜伏期;图2f展示了morris水迷宫训练阶段aβ1‑
42
trc组(a)和aβ1‑
42
组(b)的运动轨迹;图2g展示了条件恐惧记忆实验中四组小鼠的基础僵直水平。
26.图3展示了ad小鼠脑组织iba1免疫组化染色结果。
27.图4为图3的统计结果。
28.图5展示了ad小鼠脑组织cd68、iba1蛋白质印迹实验电泳图谱(见图5a)及其光密度分析结果(见图5b)。
29.图6展示了ad小鼠脑组织tip47、perilipin 2、perilipin1的蛋白质印迹实验电泳图谱(见图6a)及其光密度分析结果(见图6b)。
30.图7展示了透射电镜观察到的小鼠海马组织内小胶质细胞超微结构。
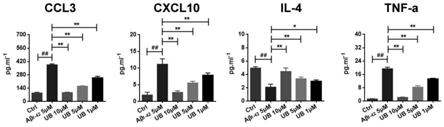
31.图8和图9展示了ad小鼠脑组织免疫荧光双标结果;其中,图8展示了ldam特异性标志物perilipin2在体外ad细胞中的表达情况,图9展示了小胶质细胞标志物iba1在体外ad细胞中的表达情况。
32.图10展示了体外ad细胞bodipy493/503(绿色)激光共聚焦荧光实验结果。
33.图11为图10的统计结果。
34.图12展示了体外ad细胞通过流式单标半定量分析实验获得的脂滴定量分析结果;其中,图12a展示了体外ad细胞中bodipy
阳性细胞数量,图12b展示了体外ad细胞中脂滴平均数量,图12c展示了体外ad细胞中脂滴平均粒径,a代表ctrl组;b代表trc组;c代表aβ1‑
42
组;d代表aβ1‑
42
trc组。
35.图13展示了体外ad细胞bodipy493/503流式单标半定量分析实验图谱(见图13a)及其统计结果(见图13b)。
36.图14展示了体外ad细胞的tip47、perilipin 2、perilipin1的蛋白质印迹实验电泳图谱(见图14a)及其光密度分析结果(见图14b)。
37.图15通过激光共聚焦荧光显微展示了ub抑制ad体外小胶质细胞生成脂滴的情况。
38.图16展示了ub干预下ad小鼠的动物行为学实验结果;其中,图16a为老化度评分实验结果;图16b
‑
f展示了在连续5天的morris水迷宫训练阶段,记录四组小鼠找到隐藏平台的潜伏期与三组小鼠的运动轨迹;图16b展示morris水迷宫训练阶段五组小鼠的逃避潜伏期;图16c展示了morris水迷宫实验中小鼠训练第5天的逃逸潜伏期;图16d展示了morris水迷宫实验中小鼠穿越平台的次数;图16e展示了morris水迷宫实验中小鼠在目标象限逗留时间;图16f展示了各组小鼠的运动轨迹图,其中,a代表ctrl组;b代表aβ1‑
42
5μm组;c代表ub150mg/kg组;d代表ub100mg/kg组;e代表ub50mg/kg组;图16g展示了在条件恐惧检测期三组小鼠的基础僵直水平。
39.图17展示了ub干预下5组小鼠海马dg区的h&e染色(he)、尼氏染色(niss)、iba1免疫组化染色结果;其中,a代表ctrl组;b代表aβ1‑
42
5μm组;c代表ub150mg/kg组;d代表ub100mg/kg组;e代表ub50mg/kg组。
40.图18展示了ub干预下ad小鼠脑组织内psd95和synapsinⅰ的蛋白质印迹实验电泳图谱(见图18a)及其光密度分析结果(见图18b);其中,a代表ctrl组;b代表aβ1‑
42
5μm组;c代表ub150mg/kg组;d代表ub100mg/kg组;e代表ub50mg/kg组。
41.图19展示了ub干预下5组ad小鼠脑组织海马区的透射电镜图。
42.图20和图21展示了ub干预下ad小鼠脑组织海马区免疫荧光双标实验结果;其中,图20展示了ldam特异性标志物perilipin2的表达情况,图21展示了小胶质细胞标志物iba1的表达情况。
43.图22展示了通过流式单标半定量分析实验获得的ad小鼠脑组织内小胶质细胞的脂滴定量分析结果,主要指标包括脂滴的平均数量(见图22a);bodipy 阳性细胞数量(见图22b);脂滴的平均直径大小(见图22c)。
44.图23展示了ad小鼠海马区tip47、perilipin1及perilipin2的蛋白质印迹电泳图谱(见图23a)及其光密度分析结果(见图23b);其中,a代表ctrl组;b代表aβ1‑
42
5μm组;c代表ub150mg/kg组;d代表ub100mg/kg组;e代表ub50mg/kg组。
45.图24为ub干预下体外小胶质细胞免疫荧光图像。
46.图25展示了通过流式单标半定量分析实验获得的ub干预下体外小胶质细胞中bodipy
阳性细胞数量(见图25a)与脂滴平均数量(见图25b)。
47.图26展示了原代小胶质细胞的流式单标半定量分析实验图谱(见图26a)及其统计结果(见图26b)。
48.图27展示了原代小胶质细胞tip47、pin1及perilipin2的蛋白质印迹实验电泳图谱(见图27a)及其光密度分析结果(见图27b);其中,a代表ctrl组;b代表aβ1‑
42
5μm组;c代表ub 10μm组;d代表ub 5μm组;e代表ub1μm组。
49.图28展示了原代小胶质细胞绿色荧光粒子微球吞噬实验结果。
50.图29展示了dcfh
‑
da法检测小胶质细胞活性氧释放结果。
51.图30展示了elisa法检测小胶质细胞ccl3、cxcl10、il
‑
4、tnf
‑
α表达结果。
52.图31是原代小胶质细胞和neuron
‑
2a神经元细胞共培养的实验流程图。
53.图32展示了pi荧光染色法检测到的共培养体系中neuron
‑
2a细胞的死亡情况。
54.图33展示了map
‑
2、psd95及synapsinⅰ的蛋白质印迹实验电泳图谱(见图33a)及其光密度分析结果(见图33b);其中,a代表ctrl组;b代表aβ1‑
42
5μm组;c代表ub 10μm组;d代表
ub 5μm组;e代表ub1μm组。
具体实施方式
55.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
56.实施例1
57.本实施例对比了12月龄wt衰老小鼠与12月龄app/ps1/tau三转基因ad小鼠脑组织内小胶质细胞激活及ldam表型转化情况,选用2组小鼠脑组织样本(12月龄wt组、12月龄app/ps1/tau组),进行iba1(小胶质细胞标志物)和plin2(围脂滴蛋白2,作为ldam特异性标志物)免疫荧光双标实验,从图1展示的免疫荧光双标实验结果观察到12月龄app/ps1/tau组ad小鼠海马dg区中iba1和plin2具有明显共定位,且共定位百分比明显高于12月龄wt衰老小鼠。此外,同样观察到,与12月龄wt衰老小鼠相比,12月龄app/ps1/tau三转基因ad小鼠海马dg区中iba1和perilipin 2的表达水平明显升高。
58.实施例2
59.选用spf级7~8周龄雄性c57bl/6j小鼠,按随机数表法等量分为5组,分组情况如下,并按图2a所示的流程图构建ad小鼠模型、给药:
60.aβ1‑
42
组:利用aβ1‑
42
(30μm)对小鼠进行侧脑室注射,诱导其成为ad小鼠,每天按照20μg/kg体重给予双蒸水,第21天时停止给药。
61.ctrl组:每天按照20μg/kg体重小鼠给予双蒸水,第21天时停止给药。
62.trc组:在ctrl组的基础上,每天以8mg/kg/d的剂量腹腔注射trc,第21天时停止给药。
63.aβ1‑
42
trc组:利用aβ1‑
42
(30μm)对小鼠进行侧脑室注射,诱导其成为ad小鼠,每天以8mg/kg/d的剂量腹腔注射trc,第21天时停止给药。
64.如图2a所示,停止给药后的一周内进行老化度评分实验、智力筑巢实验、morris水迷宫实验、条件恐惧实验等动物行为学实验,包括并记录各组小鼠体重和进食量。
65.图2b所示的老化度评分实验结果显示,aβ1‑
42
组较ctrl组老化度评分在第7天、14天、21天均显著性提高,aβ1‑
42
trc组老化度评分明显下降。
66.从图2c展示的各组小鼠的体重变化情况可以看出,体重增长速率从低到高依次为aβ1‑
42
组、aβ1‑
42
trc组、trc组、ctrl组。
67.从图2d展示的智力筑巢实验结果可以看出,aβ1‑
42
组打分最低,aβ1‑
42
trc组、trc组与ctrl组的打分结果基本无差别。
68.从图2e所示的morris水迷宫实验结果可以看出,在持续5天的训练阶段,aβ1‑
42
组寻找隐藏平台的潜伏期与ctrl组相比明显延长,aβ1‑
42
trc组寻找隐藏平台的潜伏期与aβ1‑
42
组相比明显缩短,证明了腹腔注射trc可以显著降低ad小鼠寻找隐藏平台的潜伏期。
69.从图2f展示的morris水迷宫实验中小鼠的运动轨迹可以看出,aβ1‑
42
trc组(a)较aβ1‑
42
组(b)的轨迹简单。
70.为了进一步验证四组小鼠的认知功能水平,本实施例进行了条件恐惧记忆实验,
结果如图2g所示,在条件恐惧的训练期,四组小鼠的基础僵直水平表现相似,没有明显差异,在条件恐惧的记忆检测期,aβ1‑
42
组小鼠的基础僵直水平与ctrl组相比明显降低,aβ1‑
42
trc组小鼠的基础僵直水平与aβ1‑
42
组小鼠相比明显提高,说明了腹腔注射trc可以显著改善ad小鼠的记忆障碍。
71.以上结果说明,通过aβ1‑
42
诱导构建的ad小鼠模型是成功的,给予trc干预可以改善ad小鼠的记忆障碍。
72.实施例3
73.本实施例在实施例2的基础上进一步验证ad小鼠脑组织内是否存在ldam。
74.首先,通过图3和图4展示iba1(小胶质细胞标志物)免疫组化结果和图5所示的cd68(小胶质细胞激活标志物)免疫印迹实验结果可以看出,aβ1‑
42
组小鼠海马区的小胶质细胞与ctrl组相比,明显异常激活。
75.图6展示的蛋白质免疫印迹实验结果显示,在aβ1‑
42
刺激下,aβ1‑
42
组小鼠的ldam标志物围脂滴蛋白tip47、perilipin 2、perilipin 1较ctrl组明显升高。
76.图7展示的透射电镜结果显示,aβ1‑
42
组小鼠的小胶质细胞中有脂滴存在;图8和图9所示ad小鼠脑组织免疫荧光双标结果显示,aβ1‑
42
组小鼠的ldam标志物围脂滴蛋白perilipin 2表达水平较ctrl组显著上调。
77.以上结果说明aβ1‑
42
侧脑室注射构建的ad小鼠脑组织内存在ldam。更为有趣的是,通过给予trc可以有效降低ad小鼠脑组织内小胶质细胞的活化与胞内脂滴的表达与生成,抑制了ldam表型转化,从而缓解了ad小鼠的认知功能障碍。
78.实施例4
79.为了进一步明确体外ad细胞中的ldam表型,本实施例利用浓度为5μm的aβ1‑
42
对bv2小胶质细胞进行了体外时间点刺激实验,以探讨体外小胶质细胞中脂滴的生成规律。
80.本实施例中利用激光共聚焦、流式、wb等三种方法共同表征了bv2小胶质细胞,从图10和图11展示的激光共聚焦荧光实验结果和图12和图13展示的bodipy493/503流式单标半定量分析实验结果可以发现,在浓度为5μm的aβ1‑
42
刺激时间达24h时,bv2小胶质细胞中脂滴的数量及脂质含量最多,图14展示的蛋白质免疫印迹实验结果也表明此时ldam的标志物围脂滴蛋白tip47、perilipin2、perilipin1的表达水平是最高的;而随着时间的推移,如aβ1‑
42
刺激达到48h时,bv2小胶质细胞内的脂滴数量和脂质含量均有所下降,推测在ldam生成的动态过程中,直径较大的脂滴会不断融合成脂质或形成小的脂滴。综上所述,aβ1‑
42
刺激作用下体外ad细胞中同样也存在ldam表型。
81.实施例5
82.实施例3和实施例4证实了ad小鼠脑组织及体外ad细胞中均存在ldam,本实施例在实施例4的基础上,使用不同浓度的ub干预体外ad细胞,来验证ub是否对ldam中脂滴的生成具有调控作用。
83.表1
84.组别刺激造模干预ctrl组pbspbsaβ1‑
42
组aβ1‑
42
(5μm)pbsub10μm组aβ1‑
42
(5μm)ub(10μm)
ub5μm组aβ1‑
42
(5μm)ub(5μm)ub1μm组aβ1‑
42
(5μm)ub(1μm)
85.采用4',6
‑
二脒基
‑2‑
苯基吲哚(dapi)和激发波长为493nm、发射波长为503nm的bodipy绿色染料对细胞进行染色,在激光共聚焦荧光显微镜下拍照,图15显示,浓度为1
‑
10μm的ub均能有效抑制体外bv2小胶质细胞受到aβ1‑
42
诱导时生成脂滴的数量,初步提示ub能调控ldam的表型转换。
86.实施例6
87.本实施例验证ub能否成为脂滴生成抑制剂、脂质液滴积聚小胶质细胞表型转化抑制剂或用于治疗或预防与神经炎症相关的神经退行性疾病的药物的有效成分,步骤如下:
88.(1)选用spf级7~8周龄雄性c57bl/6j小鼠,按随机数表法等量分为5组,分组情况如表2所示:
89.表2
[0090][0091]
所有小鼠在注射生理盐水2h后,aβ1‑
42
组和治疗组小鼠给予侧脑室注射aβ1‑
42
(10umol/l)诱导ad模型,ctrl组给予等量生理盐水替代aβ1‑
42
注射。
[0092]
在造模给药21天后,观察ad小鼠相关认知与记忆行为变化情况,如采用老化度评分实验、水迷宫实验、条件恐惧行记忆等实验完成相应指标的检测,结果如图16所示。完成以上实验后处死小鼠,进行心脏灌注,取材。he染色法和niss检测法观察小鼠海马组织神经元细胞的存活情况(标记和半定量),高尔基体染色观察小鼠脑组织神经元树突棘变化,免疫组化检测iba1
观测小胶质细胞活化情况,结果如图17所示;蛋白质印迹实验检测突触相关蛋白psd95、syn的表达水平,结果如图18所示。
[0093]
(2)在步骤(1)基础上,运用透射电镜以及流式单标半定量分析实验检测ad小鼠脑组织内小胶质细胞脂滴表达变化情况,结果如图19和图22所示;通过免疫荧光双标实验检测bodipy493/503和perilipin2确定ad小鼠脑组织内ldam特异性标志物perilipin2和小胶质细胞标志物iba1的表达情况,结果如图20和21所示;qpcr检测dam特征基因转录水平变化,蛋白质印迹实验验证qpcr对于ldam转录组特征蛋白tip47、perilipin1及perilipin2的调控,结果如图23所示。
[0094]
(3)以原代小胶质细胞为培养体系,建立炎症刺激体外细胞模型,分组如表3所示:
[0095]
表3
[0096]
组别刺激造模治疗ctrl组pbspbsaβ1‑
42
组aβ1‑
42
(5μm)pbs
ub10μm组aβ1‑
42
(5μm)ub(10μm)ub5μm组aβ1‑
42
(5μm)ub(5μm)ub1μm组aβ1‑
42
(5μm)ub(1μm)
[0097]
免疫荧光检测bodipy和perilipin2确定体外ldam表型相关标志物,结果如图24所示;通过流式单标半定量分析实验验证ub对ad小鼠脑组织内小胶质细胞脂滴表达的抑制情况,结果如图25和图26所示;qpcr检测ldam特征基因转录水平变化,wb验证qpcr对于ldam特征蛋白的调控,结果如图27所示。
[0098]
荧光乳胶微粒吞噬实验检测原代小胶质细胞吞噬绿色荧光粒子微球的能力,结果如图28所示;dcfh
‑
da法检测小胶质细胞内ros水平,结果如图29所示;qpcr及elisa法检测ccl3、cxcl10、il
‑
4、tnf
‑
α等炎症相关指标的变化,结果如图30所示。
[0099]
(4)如图31所示,以原代小胶质细胞为培养体系,构建原代小胶质细胞和neuron
‑
2a神经元细胞体外共培养体系,分组如表4所示:
[0100]
表4
[0101]
组别刺激造模治疗ctrl组pbspbsaβ1‑
42
组aβ1‑
42
(5μmol/l)pbsub10μm组aβ1‑
42
(5μmol/l)ub(10μm)ub5μm组aβ1‑
42
(5μmol/l)ub(5μm)ub1μm组aβ1‑
42
(5μmol/l)ub(1μm)
[0102]
将小胶质细胞培养基上清加入neuron
‑
2a神经元培养体系中,ctrl组则使用pbs或生理盐水代替aβ1‑
42
刺激条件下的小胶质细胞培养基上清,使用pi荧光探针检测神经元细胞死亡情况,结果如图32所示;利用wb检测神经元突触相关蛋白psd95、syn的表达情况,结果如图33所示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。