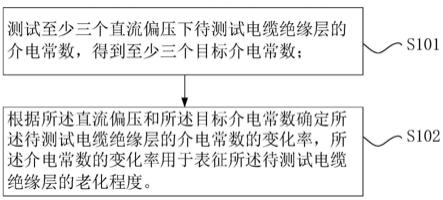
1.本发明涉及中药的质量评价方法技术领域,特别是涉及一种三叶青药材的质量评价方法。
背景技术:
2.三叶青(tetrastigma hemsleyanum diels et gilg)为葡萄科崖爬藤属植物,又名蛇附子、石抱子、金线吊葫芦,是我国特有濒危珍稀药用植物,主产于我国浙江、江西、福建和广西等地(范适,胡春梅,李有清,等.三叶青的研究进展[j].湖南生态科学学报,2018,5(02):46
‑
51.)。三叶青为新“浙八味”道地药材之一,是浙江省近年来重点发展的中药材品种之一。三叶青药用部位为其块根,味微苦、性平,具有清热解毒、消肿止痛、化痰散结等功效,在浙江、福建和江西等地区有悠久的药用历史,在抗肿瘤和抗炎方面的临床应用广泛,疗效确切,被誉为“天然植物抗生素”。
[0003]
随着三叶青人工种植面积和产量逐年增加,其在产品销售和质量评价等方面的问题日益严峻。三叶青在浙江、广西、云南、贵州、福建和四川等省份均有分布,不同产地的三叶青质量和销售价格参差不齐,缺乏有效的评价和鉴别方法。
[0004]
三叶青中的黄酮类化合物是其主要的有效成分,研究发现,三叶青总黄酮具有广谱的抗肿瘤作用,对肝癌、肺癌、胃癌、乳腺癌等具有显著的抑制生长和诱导细胞凋亡与自噬的作用,显示了良好的抗肿瘤药物开发前景,提示其可作为潜在评价三叶青质量的活性化合物(hu w,zheng y,xia p,et al.the research progresses and futureprospects of tetrastigma hemsleyanum diels et gilg:a valuable chinese herbal medicine.jethnopharmacol.2021 may 10;271:113836.)。但现有的三叶青质量评价方法以分析黄酮类化学成分的含量和指纹图谱的特征性物质为主,与临床治疗效果之间缺乏关联性,其评价结果与实际效果之间有一定的差距,不利于三叶青产业的健康发展。因此,迫切需要开发一种基于合理的三叶青质量评价方法,对不同产地的三叶青质量进行科学合理的评价,规范三叶青药材市场,促进三叶青产业快速发展。
技术实现要素:
[0005]
为了更加科学地评价和鉴定药材质量,本发明通过指纹图谱结合化学模式识别技术联合抗胰腺癌活性评价对全国8个不同产区三叶青药材进行鉴别和评价分析,以期建立一种科学合理的三叶青质量评价方法,为三叶青药材的种质鉴别和质量控制提供依据。
[0006]
一种三叶青药材的质量评价方法,构建三叶青药材品质评价的主成分综合评价模型进行质量评价,所述主成分综合评价模型使用5项指标进行三叶青质量综合评分,5 项指标分别用a~e表示,
[0007]
a:三叶青中总黄酮的含量;
[0008]
b:芦丁、槲皮素和山奈酚在总黄酮中的相对含量;
[0009]
c:三叶青总黄酮指纹图谱中的特征峰进行主成分综合评分;
[0010]
d:三叶青总黄酮对胰腺癌细胞的增殖抑制率;
[0011]
e:三叶青总黄酮对胰腺癌细胞的凋亡率,
[0012]
三叶青质量综合评分公式为:y=0.337a 0.220b 0.358c 0.131d 0.117e,
[0013]
三叶青质量综合评分y值越大表示该三叶青药材品质越好。
[0014]
优选的,a~e这5项指标的数据均进行归一化处理。归一化处理时可直接标准样品的数据进行归一化,或者使用本技术中提供的数据,进行归一化即可。
[0015]
优选的,三叶青总黄酮a~e项指标进行归一化处理的公式为: wxi=(axi
‑
aimin)/(aimax
‑
aimin),其中wxi为第x个样品第i个指标(a~e)的原始数据经归一化处理后的标准值,axi为第x个样品第i个指标的原始数据,aiman和 aimin分别为所有品种中第i个指标(a~e)的最大值和最小值。
[0016]
优选的,a项指标中的最大数值和最小数值分别为51.75和17.82,单位为mg/g; b项指标中的最大数值和最小数值分别为17.85和6.92,单位为百分率;c项指标中的最大数值和最小数值分别为0.460和0.037;d项指标中的最大数值和最小数值分别为68和34.55,单位为百分率;e项指标中的最大数值和最小数值分别为19.8和2.9,单位为百分率。
[0017]
优选的,三叶青中总黄酮的含量测定方法:取三叶青样品,粉碎后真空干燥至恒重,取干燥后粉末,加入体积浓度为50%~70%的乙醇溶液,料液比为1∶20~40g
·
ml
‑1,在70~90℃恒温水浴锅中冷凝回流提取30~90min,抽滤获得滤液即为三叶青总黄酮提取液。
[0018]
更优选的,三叶青中总黄酮的含量测定方法:取三叶青样品,粉碎后真空干燥至恒重,取干燥后粉末,加入体积浓度为60%的乙醇溶液,料液比为1∶30g
·
ml
‑1,在 80℃恒温水浴锅中冷凝回流提取60min,抽滤获得滤液即为三叶青总黄酮提取液。
[0019]
更优选的,三叶青中总黄酮的含量测定方法:取三叶青样品,粉碎后真空干燥至恒重,取干燥后粉末,加入体积浓度为60%的乙醇溶液,料液比为1∶30g
·
ml
‑1,在 83℃恒温水浴锅中冷凝回流提取65min,抽滤获得滤液即为三叶青总黄酮提取液。
[0020]
优选的,三叶青总黄酮指纹图谱中的特征峰进行主成分综合评分的方法如下:
[0021]
(1)建立三叶青总黄酮指纹图谱
[0022]
将若干已知产区的不同产区来源的三叶青标准样品分别提取三叶青总黄酮,并分别经hplc分析获得相应的色谱图数据,分析确定共有峰,共标定11个共有峰,其中 5号峰为芦丁,10号峰为槲皮素,11号峰为山柰酚;
[0023]
(2)不同产区三叶青标准样品中三叶青总黄酮指纹图谱主成分分析
[0024]
以各产区三叶青11个共有峰的面积为变量,计算主成分特征值和方差贡献率,以特征值>1为标准,得到3个主成分,其中主成分1、2、3的方差贡献率分别为51.05%、 19.93%和14.68%;
[0025]
(3)待评价三叶青药材的主成分综合评分
[0026]
按上述步骤(1)中相同方法进行hplc分析获得色谱图数据,分析获得3个主成分得分情况,以各主成分对应的方差贡献率为权重,以f表示综合得分,f1、f2、f3 分别表示主成分1、2、3的得分情况,按照公式f=0.5105f1 0.1993f2 0.1468f3,计算综合得分。
[0027]
更优选的,分析确定共有峰时,将各色谱图数据导入“中药色谱指纹图谱相似度评价系统”进行分析。
[0028]
更优选的,主成分f1、f2和f3回归方程如下:
[0029]
f1=
‑
0.405x1‑
0.413x2‑
0.322x3 0.130x4 0.278x5 0.323x6 0.348x7 0.273x8 0.350x9 0.161x
10
0.141x
11
,
[0030]
f2=
‑
0.093x1‑
0.080x2‑
0.003x3 0.225x4‑
0.331x5‑
0.178x6 0.091x7‑
0.233x8‑
0.267x9 0.583x
10
0.565x
11
,
[0031]
f3=
‑
0.057x1 0.362x2 0.261x3‑
0.612x4 0.288x5‑
0.263x6‑
0.206x7 0.430x8 0.086x9 0.250x
10
0.320x
11
,
[0032]
其中x1‑
x
11
为三叶青总黄酮指纹图谱中11个共有峰峰面积的相对比例。
[0033]
更优选的,hplc分析时,色谱条件:
[0034]
色谱柱为waters sunfire c
18
柱,4.6
×
250mm,5μm;
[0035]
流动相为0.2%磷酸水
‑
乙腈;
[0036]
梯度洗脱:0
‑
30min,15%
‑
20%乙腈;30
‑
35min,20%
‑
33%乙腈;35
‑
50min,33%乙腈;50
‑
60min,33%
‑
60%乙腈;
[0037]
流速为1.0ml/min;
[0038]
检测波长为360nm;
[0039]
柱温为40℃;
[0040]
进样量为10μl。
[0041]
优选的,三叶青总黄酮对胰腺癌细胞的增殖抑制率为对胰腺癌细胞株bxpc
‑
3和 panc
‑
1细胞增殖抑制率的平均值;三叶青总黄酮对胰腺癌细胞的凋亡率为对胰腺癌细胞株bxpc
‑
3和panc
‑
1细胞凋亡率的平均值,
[0042]
增殖抑制率和凋亡率检测时三叶青总黄酮的使用浓度为10μg/ml;处理时间48h。
[0043]
本发明的有益效果如下:
[0044]
(1)本发明以三叶青为原料,采用响应面法优化总黄酮的提取工艺,所得总黄酮得率较高,相比朱良辉(朱良辉,刘慧,汪军.三叶青总黄酮提取工艺研究[j].南方林业科学,2018,46(06):59
‑
62.)在正交工艺优化下的总黄酮得率26.04mg
·
g
‑1,有较大的提升,可为进一步研究、开发三叶青药用资源开发利用提供参考。
[0045]
(2)本发明通过8个不同产区三叶青药材样品的指纹图谱确定了11个共有峰,并指认出其中3个共有峰。同时各产地三叶青样品共有峰相对保留时间的rsd值差异较小,但相对峰面积的rsd值差异较大,表明不同产区三叶青样品其化学成分近似,但同一化学成分含量因产区不同而差异较大。
[0046]
(3)本发明采用指纹图谱结合化学模式识别对不同产地三叶青进行了较为系统、整体和全面的评价分析,可以反映各产地三叶青的整体性、差异性,可为三叶青药材的种质鉴别和质量控制提供依据。
附图说明
[0047]
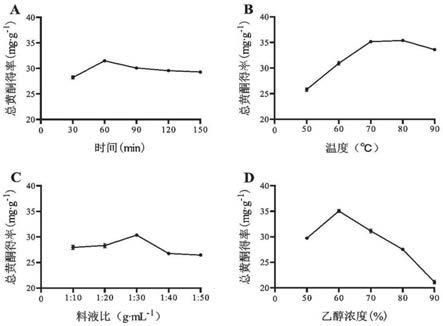
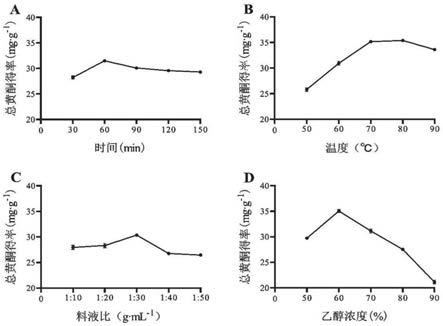
图1不同单因素对三叶青总黄酮得率的影响,其中a为不同提取时间对三叶青总黄酮得率的影响;b为不同提取温度对三叶青总黄酮得率的影响;c为不同的料液比对三叶青总黄酮得率的影响;d为不同的乙醇浓度对三叶青总黄酮得率的影响。
[0048]
图2为不同因素对三叶青总黄酮得率的3d响应面图,其中,a为温度与时间对三叶青总黄酮得率的响应面图;b为料液比与时间对三叶青总黄酮得率的响应面图;c为乙醇浓
度与时间对三叶青总黄酮得率的响应面图;d为料液比与温度对三叶青总黄酮得率的响应面图;e为乙醇浓度与温度对三叶青总黄酮得率的响应面图;f为乙醇浓度与料液比对三叶青总黄酮得率的响应面图。
[0049]
图3为不同产区三叶青总黄酮样品的hplc指纹图谱。其中三叶青样品来源分别分浙江、江西、湖南、云南、福建、贵州、广东和广西。
[0050]
图4为不同产区三叶青总黄酮样品的指纹图谱聚类分析图。
[0051]
图5为不同产区三叶青总黄酮指纹图谱中的特征峰进行主成分分析图。
具体实施方式
[0052]
实施例1:三叶青总黄酮的提取工艺的单因素优化实验
[0053]
选取浙江台州的三叶青样品为供试品,将其粉碎后过50目筛,真空干燥至恒重,得到样品粉末。精密称取粉末1.0g,在一定提取时间、提取温度、液料比、乙醇浓度下于恒温水浴锅中进行冷凝回流提取,将滤液抽滤,转移至50ml量瓶中定容,备用。
[0054]
以芦丁为对照品,采用分光光度计的方法检测不同提取条件下三叶青总黄酮的得率。精密称取芦丁对照品10.0mg,用60%乙醇定容至10ml,摇匀,即得1mg
·
ml
‑1对照品溶液。精密吸取0.2、0.4、0.6、0.8、1.0ml的芦丁1.0mg
·
ml
‑1对照品储备液于25ml容量瓶中,加入1ml 5%亚硝酸钠溶液,摇匀,静置6min。再加入1ml 10%硝酸铝溶液,摇匀,静置6min。最后加入10ml 4%氢氧化钠溶液,加水定容至25ml,摇匀,静置15min。以加纯水的试剂作为空白,测定样品在510nm处的吸光度a,以芦丁质量浓度x为横坐标,吸光度a为纵坐标进行回归,得到回归方程: a=0.4705x
‑
0.0035(r2=0.9999)。
[0055]
准确吸取三叶青样品溶液2.0ml于25ml容量瓶中,按照上述方法进行操作并计算三叶青总黄酮得率,计算公式如下:
[0056][0057]
式中,y为三叶青总黄酮得率(mg
·
g
‑1),c为总黄酮的质量浓度(mg
·
ml
‑1),v为测量总黄酮提取液体积(ml),n为稀释倍数,m为称量的三叶青品质量(mg)。
[0058]
以三叶青总黄酮得率为指标,固定提取时间90min、提取温度70℃、料液比1∶30 g
·
ml
‑1、乙醇体积浓度70%时,分别考察不同提取时间(30、60、90、120、150min)、提取温度(50、60、70、80、90℃)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50g
·
ml
‑1)、乙醇浓度(50%、60%、70%、80%、90%)对三叶青总黄酮得率的影响,各实验均平行重复3次。
[0059]
研究结果表明,提取时间、温度、料液比、乙醇浓度各单因素对三叶青总黄酮得率影响如图1所示。由图1a可知,三叶青总黄酮得率随着时间的增加先升后下降,并在提取时间60min时得率达到最大值。提取时间较短时,黄酮类成分尚未完全溶出,而提取时间过长时,可能会使三叶青黄酮中热不稳定成分在长时间提取中遭到破坏降解,使得总黄酮得率下降。
[0060]
由图1b可知,总黄酮的得率随着温度的升高先上升再下降,在80℃时得率达到最大值。当温度升高,分子运动加剧,黄酮类物质溶出增加,故总黄酮得率上升。而当温度过高时,可能导致黄酮类化合物氧化变性,使得总黄酮得率下降。
[0061]
由图1c可知,当料液比从1∶10g
·
ml
‑1增加到1∶30g
·
ml
‑1的过程中,总黄酮得率显
著增加,并在料液比1∶30g
·
ml
‑1时得率达到最大值;但当继续提高料液比时,得率显著下降,可能是高料液比时溶出的黄酮类物质被稀释,伴随着非黄酮类杂质增多,使得得率下降。
[0062]
由图1d可知,当乙醇浓度为60%时,总黄酮得率达到最大值。当乙醇浓度继续增大时,总黄酮得率显著下降,推测当乙醇浓度高于60%时,溶剂的极性相对降低,导致其他非黄酮类物质溶出,使得总黄酮得率下降。
[0063]
综合上述因素,确定响应面分析的各因素考察水平分别为时间30、60、90min,温度70、80、90℃,料液比1∶20、1∶30、1∶40g
·
ml
‑1,乙醇浓度50%、60%、70%。经单因素实验优选的三叶青总黄酮的最佳提取条件为时间60min,料液比1∶30g
·
ml
‑1,乙醇浓度60%,温度80℃,该条件下总黄酮得率为37.27mg
·
g
‑1。
[0064]
实施例2:box
‑
behnken响应面优化三叶青总黄酮的提取工艺实验
[0065]
根据单因素实验结果,以提取时间(a)、提取温度(b)、料液比(c)、乙醇浓度(d) 作为影响因素,总黄酮得率为评价指标(y),应用box
‑
behnken中心组合进行4因素 3水平的实验设计。因素水平如表1所示。
[0066]
表1因素水平
[0067][0068]
在单因素实验基础上,以提取时间(a)、提取温度(b)、料液比(c)、乙醇浓度(d) 为自变量,以总黄酮得率为响应值,采用design
‑
expert 8.0.6软件设计4因素3水平共29个实验,如表2所示。得到总黄酮得率关于以提取时间(a)、提取温度(b)、料液比(c)、乙醇浓度(d)的回归方程:
[0069]
y=37.73 0.30a 1.86b 0.079c
‑
0.44d 1.18ab
‑
0.80ac 0.43ad
‑
0.059bc 104bd 0.24 cd
‑
1.96a2‑
3.8382‑
3.41c2‑
4.70d2。
[0070]
表2响应面实验设计及结果
[0071]
实验编号a时间b温度c料液比d乙醇浓度总黄酮得率(mg
·
g
‑1)1100131.562
‑1‑
10031.3731
‑
10029.224110035.175010
‑
130.716100
‑
131.56700
‑1‑
129.86810
‑
1033.479
‑
110032.6210001
‑
129.86
11
‑
100
‑
130.9112
‑
10
‑
1031.7713000037.94140
‑
10125.8215101031.5616001130.2017010131.14180
‑
11028.1619
‑
101033.05200
‑
10
‑
129.572100
‑
1129.2222000037.3023
‑
100129.2024000038.022501
‑
1032.2026011032.62270
‑1‑
1027.9728000037.3029000038.10
[0072]
由表3anova方差分析可知,实验所选模型的决定系数r2=0.9672,调整决定系数r
2adj
=0.9343,模型f=59.77,p<0.0001,表明该模型具有极显著性意义;失拟项p >0.05,没有显著差异,表明该模型与实验数据拟合程度良好。b、d、ab、ac、bd、 a2、b2、c2、d2的p值均小于0.05,表明其对总黄酮得率具有显著性影响。变异系数cv值为1.84%,说明模型的重现性很好,该模型可用于三叶青总黄酮的提取工艺优化。各因素的影响程度通过f值反映,f值越大代表该因素的影响程度越大,故各因素对总黄酮得率的影响次序为:温度>乙醇浓度>时间>料液比。
[0073]
表3 anova方差分析
[0074]
[0075][0076]
注:p<0.01,差异极显著;p<0.05,差异显著。
[0077]
由回归方程绘制不同因子的响应面图,以评价两两交互作用对总黄酮得率的影响并确定各因素的最佳水平范围,如图2所示。在响应面图中,曲面越陡峭,则该因素对响应值的影响越显著。在保持两个自变量之外的因素固定的前提下,两个交互的自变量对响应值的影响也可以从响应面图的曲面反映。由图2可知,提取时间和提取温度(图2a),提取温度和料液比(图2d)以及提取温度和乙醇浓度(图2e)两者交互作用显著,其表现为响应面曲线走势陡峭。
[0078]
通过软件design
‑
expert 10.0软件分析得三叶青总黄酮的最佳提取条件:当提取时间为64.69min,温度为82.65℃,料液比为1∶29.9g
·
ml
‑1,乙醇浓度为59.90%时,预测可达三叶青总黄酮得率38.01mg
·
g
‑1。考虑到实际操作,最终确定最佳提取工艺为提取时间65min,温度83℃,料液比1∶30g
·
ml
‑1,乙醇浓度60%。此条件下对建立的模型进行验证实验,重复3次,三叶青总黄酮得率为37.89
±
0.07mg
·
g
‑1,预测值为 38.01mg
·
g
‑1,误差为0.32%,小于3%,表明该响应面法得到的预测值准确可靠。该提取工艺总黄酮得率较高,相比朱良辉(朱良辉,刘慧,汪军.三叶青总黄酮提取工艺研究[j]. 南方林业科学,2018,46(06):59
‑
62.)在正交工艺优化下的总黄酮得率26.04mg
·
g
‑1,有较大的提升,可为进一步研究、开发三叶青药用资源开发利用提供参考。
[0079]
实施例3:不同产区三叶青药材样品中总黄酮含量分析
[0080]
采集不同产区的三叶青干燥块根样品,其具体来源信息详见表4,其中广西南宁、云南楚雄产三叶青为原产地采集,其他产地三叶青样品分别购于磐安、毫州、安国和荷花池等药材市场。
[0081]
表4不同产区三叶青样品信息表
[0082]
样本编号产地样本编号产地s1浙江台州s2浙江台州
s3江西上饶s4江西上饶s5湖南永州s6湖南永州s7云南楚雄s8云南楚雄s9福建福州s10福建福州s11贵州黔西南s12贵州黔西南s13广东清远s14广东清远s15广西南宁s16广西南宁
[0083]
以box
‑
behnken响应面优化的最佳提取工艺对不同产区三叶青样品进行总黄酮提取,平行3次,测得各产地三叶青总黄酮得率,如表5所示。其中以云南楚雄、福建福州、贵州黔西南产三叶青的总黄酮得率量较高,分别为51.19、51.75和49.84mg
·
g
‑1;湖南永州、广东清远产三叶青的总黄酮得率较低,均低于25mg
·
g
‑1。各产地三叶青中总黄酮得率差异较大,其原因可能是由于品种差异、地域气候和采收时间等因素影响而产生的结果。
[0084]
表5不同产地三叶青样品中总黄酮含量的比较
[0085]
产地样本编号总黄酮含量(mg/g)标准化数据(a)浙江台州s1、s237.800.59江西上饶s3、s440.210.66湖南永州s5、s623.840.18云南楚雄s7、s851.190.98福建福州s9、s1051.751贵州黔西南s11、s1249.840.94广东清远s13、s1417.820广西南宁s15、s1632.270.43
[0086]
利用公式wxi=(axi
‑
aimin)/(aimax
‑
aimin)对原始数据进行归一化处理,其中wxi 为第x个样品第i个指标的原始数据经归一化处理后的转化值,axi为第x个样品第i 个指标的原始数据,aiman和aimin分别为所有品种中第i个指标的最大值和最小值。其中不同产地三叶青中总黄酮的含量的标准化数据为a。
[0087]
实施例4:不同产地三叶青总黄酮样品的hplc指纹图谱研究
[0088]
精密称取各产地三叶青粉末1.0g,以最佳提取工艺进行提取,抽滤,滤液转移至 50ml量瓶中,定容至刻度。后置于蒸发皿中,蒸干,残渣加甲醇超声溶解,转移至 5ml容量瓶中,定容至刻度,用0.22μm微孔滤膜滤过,得到供试品溶液,备用。标准品的样品制备方法如下,取芦丁、槲皮素、山柰酚对照品,加甲醇制成每1ml含芦丁10.1μg、槲皮素9.7μg、山柰酚8.8μg的混合对照品溶液,备用。
[0089]
hplc的色谱条件如下,色谱柱为waters sunfire c
18
柱(4.6
×
250mm,5μm),流动相为0.2%磷酸水
‑
乙腈,梯度洗脱(0
‑
30min,15%
‑
20%乙腈;30
‑
35min,20%
‑
33%乙腈;35
‑
50min,33%乙腈;50
‑
60min,33%
‑
60%乙腈);流速为1.0ml/min;检测波长为360nm;柱温为40℃;进样量为10μl。
[0090]
将16批各产地三叶青液相色谱图数据导入“中药色谱指纹图谱相似度评价系统 (2012版)”进行分析,共标定11个共有峰,如图3所示。其中3号峰、7号峰在湖南和广东两地产三叶青样品中有缺失;同时通过与对照品指纹图谱进行比对,成功指认其中3个成分,确
认5号峰为芦丁,10号峰为槲皮素,11号峰为山柰酚。其中5 号峰在江西产三叶青中占比最高,于湖南和广东两地产三叶青中占比较低;10(槲皮素)、11(山柰酚)号峰在云南产三叶青中占比较高,在江西产三叶青中占比较少。表明该结果显示的指纹图谱中11个共有峰,可作为三叶青hplc指纹图谱特征鉴定指标。各样品色谱图中均存在5(芦丁)号峰,其与邻峰的分离度较好,峰形较佳,且峰面积较大,故选择该峰作为参考峰(s)。如表6所示,经计算得出8个不同产区的16 批三叶青共有峰相对保留时间的rsd为0%
‑
0.21%,但相对峰面积的rsd为 23.89%
‑
194.54%。
[0091]
表6三叶青样品共有峰相对保留时间及相对峰面积
[0092][0093]
将16批各产地三叶青液相色谱图数据导入“中药色谱指纹图谱相似度评价系统 (2012版)”进行分析,以s1样品色谱图为参照图谱,采用中位数法生成对照图谱,时间窗宽度设置为0.1min,进行多点校正和自动峰匹配,生成指纹叠加图谱,确定共有峰。以对照图谱为参照,进行相似度评价。各产地三叶青相似度评价如表7所示, 16批三叶青样品与对照指纹图谱相似度为0.770
‑
0.961。
[0094]
表7三叶青样品相似度评价表
[0095]
编号相似度编号相似度s10.868s20.869s30.938s40.937s50.819s60.823s70.941s80.942s90.960s100.956s110.778s120.784s130.803s140.767s150.949s160.949
[0096]
实施例5:不同产地三叶青总黄酮样品中芦丁、槲皮素和山奈酚在总黄酮中的相对含量分析
[0097]
根据三叶青总黄酮指纹图谱中芦丁(5号峰),槲皮素(10号峰),山柰酚(11号峰为)的相对峰面积,计算不同产地三叶青总黄酮中三种活性化合物的相对含量。其结果如表8所示。三种化合物相对含量较高的三叶青样品分别为云南、湖南、福建和浙江地区,三种化合
物的平均相对含量分别为17.85%、16.25%、14.01%和12.08%。
[0098]
表8不同产地三叶青总黄酮中芦丁、槲皮素和山奈酚的相对含量
[0099][0100]
利用公式wxi=(axi
‑
aimin)/(aimax
‑
aimin)对原始数据进行归一化处理,其中wxi 为第x个样品第i个指标的原始数据经归一化处理后的转化值,axi为第x个样品第i 个指标的原始数据,aiman和aimin分别为所有品种中第i个指标的最大值和最小值。其中芦丁、槲皮素和山奈酚在总黄酮中的相对含量标准化数据为b。
[0101]
实施例6:不同产地三叶青总黄酮样品的指纹图谱聚类分析
[0102]
采用spss 20.0软件以16批三叶青样品的共有峰面积为变量,采用组间连接聚类方法,以平方euclidean距离为度量标准进行系统聚类分析.结果如图4所示。当欧氏距离>10时,同产地三叶青可分为4类,浙江(s1,s2)、贵州(s11,s12)样品聚为第1类,云南(s7,s8)、福建(s9,s10)、广西(s15,s16)样品聚为第2类,湖南(s5,s6)、广东(s13,s14)样品聚为第3类,江西(s3,s4)单独聚为第4 类。
[0103]
实施例7:不同产地三叶青总黄酮样品hplc指纹图谱中的特征峰进行主成分综合评分
[0104]
采用spss 20.0软件对16批三叶青样品的指纹图谱数据进行主成分分析,采用降维、因子分析,计算相关系数矩阵,主成分特征值、累积贡献率及主成分综合得分。以各产地三叶青11个共有峰的面积为变量,导入spss 20.0软件,计算主成分特征值和方差贡献率。
[0105]
主成分特征值和方差贡献率是选择主成分的依据,载荷矩阵反映了各变量对主成分的重要程度。以各产区三叶青11个共有峰的峰面积相对比例为变量(x1
‑
x11),计算主成分特征值和方差贡献率,以特征值>1为标准,得到3个主成分(f1
‑
f3),其中主成分f1、f2、f3的方差贡献率分别为51.05%、19.93%和14.68%,,累计贡献率为85.67%,表明可以反映样品大部分的信息,可作为各产地三叶青成分的评价指标。
[0106]
主成分f1、f2和f3回归方程如下:
[0107]
f1=
‑
0.405x1‑
0.413x2‑
0.322x3 0.130x4 0.278x5 0.323x6 0.348x7 0.273x8 0.350x9 0.161x
10
0.141x
11
,
[0108]
f2=
‑
0.093x1‑
0.080x2‑
0.003x3 0.225x4‑
0.331x5‑
0.178x6 0.091x7‑
0.233x8‑
0.267x9 0.583x
10
0.565x
11
,
[0109]
f3=
‑
0.057x1 0.362x2 0.261x3‑
0.612x4 0.288x5‑
0.263x6‑
0.206x7 0.430x8 0.086x9 0.250x
10
0.320x
11
,
[0110]
其中x1
‑
x11为三叶青总黄酮指纹图谱中11个共有峰峰面积的相对比例。
[0111]
主成分因子荷载矩阵如表9所示,峰1、2、3、5(芦丁)、6、7、8、9在主成分 1上有较高载荷,说明主成分1主要反映这8个成分指标信息;同理,主成分2主要反映峰10(槲皮素)、11(山柰酚)这2个成分指标的信息;主成分3主要反映峰4、 8这2个成分指标的信息。综上所述,以3个主要成分建立坐标系,绘制16批三叶青样品的得分图,如图5所示,表明不同产地三叶青的质量存在一定的差异,可将16 批三叶青样品分为4类,其分析结果与聚类分析结果一致。
[0112]
表9不同产地三叶青总黄酮hplc指纹图谱中特征峰主成分因子荷载矩阵
[0113]
峰号成分1成分2成分31
‑
0.961
‑
0.137
‑
0.0722
‑
0.978
‑
0.1190.463
‑
0.763
‑
0.0050.33240.3090.333
‑
0.77850.659
‑
0.4900.36660.765
‑
0.263
‑
0.33470.8250.135
‑
0.26280.646
‑
0.3450.54790.829
‑
0.3960.109100.3820.8630.318110.3330.8370.407
[0114]
采用3个主成分得分情况,以各主成分对应的方差贡献率为权重,以f表示综合得分,f1、f2、f3分别表示主成分1、主成分2、主成分3的得分情况,按照公式 f=0.5105f1 0.1993f2 0.1468f3,计算三叶青总黄酮指纹图谱中的特征峰的综合得分并排名,如表10所示。结果表明,浙江样品中6、8、10(槲皮素)、11(山柰酚)等的含量较高,在各产地样品综合得分为0.460,位居第1位,表明浙江产三叶青成分含量较好。而湖南及广东样品不仅各成分含量低,且综合得分垫底。
[0115]
表10不同产地三叶青总黄酮hplc指纹图谱中特征峰主成分分析
[0116][0117]
利用公式wxi=(axi
‑
aimin)/(aimax
‑
aimin)对原始数据进行归一化处理,其中wxi 为第x个样品第i个指标的原始数据经归一化处理后的转化值,axi为第x个样品第i 个指标的原始数据,aiman和aimin分别为所有品种中第i个指标的最大值和最小值。其中指纹
图谱中的特征峰进行主成分综合评分标准化数据为c。
[0118]
实施例8:不同产地三叶青总黄酮对胰腺癌细胞增殖的影响
[0119]
利用胰腺癌细胞株bxpc
‑
3和panc
‑
1细胞,检测不同产地的三叶青总黄酮对胰腺癌细胞增殖的影响。
[0120]
细胞培养bxpc
‑
3和panc
‑
1细胞用含10%胎牛血清和青霉素100u/ml、链霉素 100μg/ml的rpim 1640培养液中于37℃、5%的co2的细胞培养箱中培养。细胞贴壁生长近80%后,弃培养瓶中的培养液,用pbs清洗后加入适量的胰酶消化,待贴壁细胞变圆,即加培养液中止并离心,取适量比例的单颗细胞传代培养。每次传代培养与实验用细胞皆为处于对数生长期的细胞。
[0121]
三叶青总黄酮的药物制备:不同产地的三叶青总黄酮给药组中药物的母液浓度为 10mg/ml,利用dmso充分容易溶解后,利用0.45μm的滤膜过滤除杂,作为母液放置
‑
20摄氏度备用。使用时取配置好的三叶青总黄酮工作母液,利用rpim 1640培养液稀释至的工作浓度,吹打混匀后,加入96孔培养板中。
[0122]
细胞增殖活性实验:收集对数生长期bxpc
‑
3和panc
‑
1的细胞,调整细胞密度至 1
×
105/ml,每孔100μl接种量接种于96孔板,培养过夜后加入10μg/ml的三叶青总黄酮进行处理。实验设空白对照组和不同产区的三叶青总黄酮药物处理组,培养终体积为200μl,每组设5个平行孔。置37℃的培养箱中继续培养48h后,加入20μl的mtt(浓度为5mg/ml),培养4h后,弃去培养液,加入150μl dmso室温振荡15min溶解结晶,用酶标仪于波长570nm测吸光度值(a值),以a值表示细胞增殖能力。细胞增殖抑制率按照空白对照组吸收值减去药物处理组吸收值后除以空白组吸收值的百分率表示,反映的是各孔中细胞的存活率,据此可算出各孔细胞在药物作用下的增殖抑制情况。
[0123]
由表11结果可知,不同产地的三叶青总黄酮对胰腺癌细胞的增殖抑制作用差异较大,在10μg/ml的浓度下处理做48h,其中湖南、浙江和江西的三叶青总黄酮样品对两种胰腺癌细胞的增殖抑制作用最明显,其平均的增殖抑制率分别为68%、62.6%和 57.55%。而广东、广西和贵州的三叶青总黄酮样品,对两种胰腺癌细胞的增殖抑制作用较差,作用48h的增殖抑制率仅为34.55%、41.1%和41.1%。
[0124]
表11不同产地三叶青总黄酮对胰腺癌株bxpc
‑
3和panc
‑
1增殖的影响
[0125][0126][0127]
利用公式wxi=(axi
‑
aimin)/(aimax
‑
aimin)对原始数据进行归一化处理,其中
wxi 为第x个样品第i个指标的原始数据经归一化处理后的转化值,axi为第x个样品第i 个指标的原始数据,aiman和aimin分别为所有品种中第i个指标的最大值和最小值。其中三叶青总黄酮对胰腺癌细胞株增殖抑制率的标准化数据为d。
[0128]
实施例9:不同产地三叶青总黄酮对胰腺癌细胞凋亡的影响
[0129]
为进一步评价不同产地三叶青总黄酮抗胰腺癌的效果,本发明检测了不同产地三叶青总黄酮对胰腺癌细胞株bxpc
‑
3和panc
‑
1细胞的细胞凋亡率的影响。
[0130]
细胞凋亡率的实验采用annexin v
‑
fitc/pi双染法检测细胞凋亡率。取对数生长期bxpc
‑
3和panc
‑
1细胞,调整细胞悬液密度至调整细胞密度至5
×
105/ml后,以5 ml接种于直径60mm培养皿内,分别加入加入不同产地的三叶青总黄酮提取物,浓度均为10μg/ml,处理时间为48h,空白对照组不加入药物处理。处理完毕后,加入胰酶消化后,离心收集上述各组细胞,用预冷pbs洗1次,用稀释好的结合缓冲液重悬细胞,调整细胞密度为5
×
105‑1×
106/ml。取100μl细胞悬液于5ml流式管中,加入annexinv
‑
fitc 5μl和10mg/l碘化丙啶(pi)溶液10μl,混匀后室温避光孵育15min,加入400μl稀释好的结合缓冲液,流式细胞仪检测各组细胞的凋亡率,观察药物对细胞凋亡的诱导作用。
[0131]
由表12中结果可知,不同产地的三叶青总黄酮对胰腺癌细胞的凋亡诱导作用差异较大,在10μg/ml的浓度下处理做48h,其中湖南、浙江和江西的三叶青总黄酮样品对两种胰腺癌细胞的凋亡诱导作用最明显,其平均的凋亡诱导率分别为19.8%、15.75%和13.9%。而广东、广西和贵州的三叶青总黄酮样品,对两种胰腺癌细胞的凋亡诱导作用较差,作用48h的增殖凋亡诱导率仅为2.9%、5.6%和6.05%。
[0132]
表12不同产地三叶青总黄酮对胰腺癌株bxpc
‑
3和panc
‑
1细胞凋亡率的影响
[0133][0134][0135]
利用公式wxi=(axi
‑
aimin)/(aimax
‑
aimin)对原始数据进行归一化处理,其中wxi 为第x个样品第i个指标的原始数据经归一化处理后的转化值,axi为第x个样品第i 个指标的原始数据,aiman和aimin分别为所有品种中第i个指标的最大值和最小值。其中三叶青总黄酮对胰腺癌细胞株凋亡率的标准化数据为e。
[0136]
实施例10:三叶青不同特征性指标的主成分分析与质量综合评价
[0137]
基于三叶青总黄酮5个不同的特征性指标进行主成分分析,建立三叶青质量的综合评价模型。如表13所示,采用spss软件对5个特征性指标进行提取,共获得主成分1和主成分2两个主成分,其方差贡献率分别为45.810%、33.304%,累积方差贡献率79.113%。
[0138]
表13三叶青总黄酮特征性指标的主成分因子荷载矩阵
[0139]
特征性指标主成分1主成分2a0.4590.767b0.5780.174c0.5630.725d0.854
‑
0.493e0.836
‑
0.527
[0140]
以主成分的各个特征性指标除以对应主成分特征性指标的算术平方根为系数,得到各主成分的线性方程。
[0141]
主成分1:y1=0.303a 0.382b 0.372c 0.564d 0.553e
[0142]
主成分2:y2=0.595a 0.135b 0.562c
‑
0.382d
‑
0.409e
[0143]
再以两个主成分的方差贡献占比为权重,构建主成分综合模型。
[0144]
y=0.4581f1 0.3330f2=0.337a 0.220b 0.358c 0.131d 0.117e
[0145]
其中a到e分别代表三叶青中总黄酮的含量,芦丁、槲皮素和山奈酚在总黄酮中的相对含量,三叶青总黄酮指纹图谱中的特征峰进行主成分综合评分,三叶青总黄酮对胰腺癌细胞株增殖抑制率和三叶青总黄酮对细胞凋亡率的归一化处理数值。
[0146]
表14不同产地三叶青特征性指标的主成分分析综合得分表
[0147][0148][0149]
按照公式计算不同地区三叶青样品的综合得分及排名,如表14所示。结果表明不同地区的三叶青样品综合得分差异较大,其中云南、福建和浙江地区的综合得分较高。其中浙江地区样品在主成分1的综合得分最高,云南地区和福建地区样品在主成分2 的综合得分最高,其中主成分1与在d、e指标上有较高的载荷,提示与抗胰腺癌的活性密切相关,主成分2在a、c指标上有较高的载荷,提示与黄酮类化合物的含量和构成密切相关。三叶青总黄酮的5个特征性指标的主成分分析表明,不同产地的三叶青品种之间存在显著的差异,本发明采用三叶青总黄酮的化学成分分析结合三叶青总黄酮的抗胰腺癌活性的分析方法,可以较为全面系统的评价三叶青药材的质量,为三叶青药材的种质鉴别和质量控制提供技术保障。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。