1.本发明涉及生物医药技术领域,具体为巨噬素1在制备治疗肺动脉高压的药物及其应用。
背景技术:
2.肺动脉高压(pulmonary hypertension,ph)是一种严重的进行性肺血管疾病,其特征是远端肺小动脉重塑致肺血管阻力增加,最终导致右心衰竭和死亡。其基本的病理特点是肺血管重塑,包括内皮功能失调,肺动脉内皮细胞和平滑肌细胞增殖和抗凋亡耐性增加,细胞外基质产生和蓄积,以及血管外周促炎细胞因子和趋化因子表达增加并浸润。在缺氧引起的肺动脉高压中,肺泡毛细血管床破坏或慢性缺氧性血管收缩可导致肺动脉压升高。临床上主要表现为,持续升高的肺动脉压会使壁薄的右心室产生压力的增大。右心室适应于低压肺循环,而无法承受增大的压力,最终引起右心衰竭,这也是肺动脉高压患者最常见的死亡原因。这些病理基础的机制仍然知之甚少,目前可用的治疗方法对病理性血管重塑的疗效有限,研究参与肺血管重塑的新途径为肺动脉高压提供新的治疗靶点。
3.特殊促消退介质(specialized pro
‑
resolving mediators,spms)是机体在炎症过程中,由多不饱和脂肪酸产生的一系列具有抑制中性粒细胞募集,减少炎症介质的释放,促进吞噬细胞对凋亡细胞的清除,促进炎症的消退的脂质介质。maresin1(巨噬素1)是由二十碳六烯酸(docosahexaenoic acid,dha)源性的一种重要的内源性促消退介质。
4.现有的巨噬素1在治疗作用中普遍作为抗炎药物应用,巨噬素1在肺动脉高压治疗中并没有相关研究。
技术实现要素:
5.针对现有技术存在的不足,本发明的目的在于提供一种巨噬素1在制备治疗肺动脉高压的药物及其应用,能够提供一种新的肺动脉高压治疗方案。
6.为实现上述目的,本发明提供了如下技术方案:巨噬素1在制备治疗肺动脉高压药物中的应用。
7.进一步的,巨噬素1抑制内皮细胞向间质细胞转化,减少肺血管平滑肌细胞的来源。
8.进一步的,巨噬素1促进肺血管平滑肌细胞凋亡抑制其增殖,且改善肺血管重塑。
9.一种治疗肺动脉高压的药物,包括有效剂量的巨噬素1、用于承载巨噬素1的载体。
10.进一步的,该药物的给药方式为腹腔/静脉注射。
11.本发明的有益效果,巨噬素1可逆转肺动脉高压,改善右心功能障碍,通过抑制内皮细胞向间质细胞转化和促进肺动脉平滑肌细胞的凋亡而改善血管重塑来实现。
附图说明
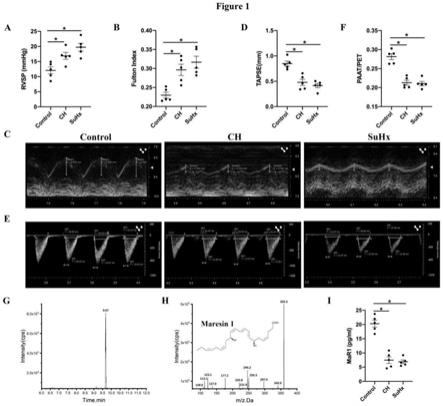
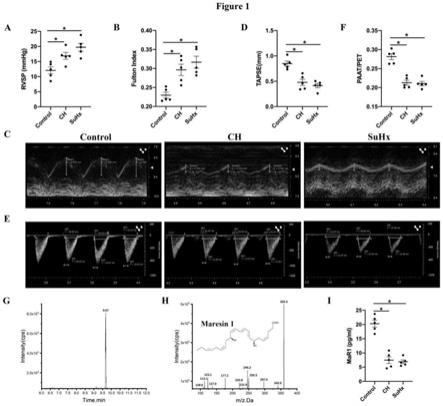
12.图1为本发明肺动脉高压小鼠模型已经成功建立指标示意图,(a)有创血流动力学
监测rvsp。(b)评估右心肥厚(fulton index(rv/lv s))。(c
‑
f)小动物超声仪评估右心功能相关指标,包括:tapse、patt/pet。(g)高效液相色谱串联质谱图显示了mar1保留时间(m/z359/177)。q1,m
‑
h(母离子)和q3,串联质谱(ms/ms)中的诊断离子(子离子)。(h)maresin1的ms/ms谱图和分子结构式。(i)各组小鼠血清中maresin1的浓度。
13.图2为本发明maresin1对小鼠肺动脉压力和右心功能的影响示意图,(a)实验造模方案。(b)血流动力学监测rvsp。(c)右心肥厚(fulton index(rv/lv s))。(d
‑
g)小动物超声仪检测右心功能相关的指标,包括tapse、paat/pet。
14.图3为本发明的maresin1对肺动脉高压小鼠肺血管重塑的影响示意图,(a)远端肺小血管he染色观察血管形态学变化。(b)血管壁面积/血管总面积(wa/ta)。(c)血管壁厚度/血管总厚度(wt/tt)。(d)masson染色观察血管外周胶原沉积。(e)免疫组化α
‑
sma观察肺动脉血管中层平滑肌细胞的变化。(f)免疫组化cd31观察肺动脉血管内层内皮细胞的变化。(g)定量分析血管壁α
‑
sma阳性的细胞。
15.图4为本发明maresin1对肺血管内皮向间质转化的影响示意图,(a)激光共聚焦观察α
‑
sma和vwf共定位染色。(b)在α
‑
sma 的细胞中vwf α
‑
sma 阳性细胞的定量分析。
16.图5为本发明maresin1对小鼠肺动脉高压肺动脉平滑肌细胞凋亡的影响示意图,(a)tunel染色评估小鼠肺动脉平滑肌细胞凋亡的情况定位的小动脉内凋亡细胞的分布。(b)α
‑
sma 细胞中tunel阳性的细胞统计分析图。
17.图6为本发明maresin1对小鼠肺动脉高压肺组织中凋亡蛋白的影响示意图,(a)小鼠肺组织中均浆中,抗凋亡蛋白bcl
‑
2和促凋亡蛋白bax的表达。(b)数据统计图bax/bcl
‑
2。(c)促凋亡蛋白cleaved
‑
caspase3表达。(d)数据统计图相关的cleaved
‑
caspase3表达。
具体实施方式
18.下面将结合附图所给出的实施例对本发明做进一步的详述。
19.肺动脉高压(pulmonary hypertension,ph)是一种进行性致命性的肺血管疾病,其特征是远端肺小动脉重塑,导致肺血管阻力逐渐增加,最终导致右心衰竭和死亡。其基本的病理特点是肺血管重塑,包括内皮功能失调,肺动脉内皮细胞(pulmonary arterial endothelial cells,paecs)和肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,pasmcs)的增殖和抗凋亡耐性增加,细胞外基质产生增加和蓄积,以及局部促炎细胞因子和趋化因子表达增加,随后白细胞浸润到肺血管周围区域。尽管目前的治疗方法提高了生存质量和预后,但病理基础的机制仍然不清楚,目前可用的治疗药物对病理性血管重塑的疗效有限。
20.肺动脉分三层,包括最内层的单层内皮细胞,中间层的平滑肌细胞,外层的成纤维细胞。在肺动脉高压的病理发展过程中,三层细胞都表现的异常活跃。越来越多的研究报道,在肺动脉高压中,早期血管内皮细胞凋亡在肺动脉高压的形成中至关重要。各种环境因素比如低氧可导致肺血管内皮细胞损伤,内皮凋亡增加,最后导致内皮功能障碍。内皮细胞功能障碍,会产生大量的生长因子。如pdgfb,fgf2,tgfβ在肺高压患者的肺组织中高表达,药理性抑制或敲除这些因子,可以有效抑制肺动脉高压的发展。另外,增加的内皮粘附分子、促炎细胞因子和趋化因子的表达,以及白细胞募集,也是促进肺动脉高压发展的。内皮细胞释放的生长因子和促炎因子,能够刺激肺动脉平滑肌细胞和成纤维细胞的增殖,同时
还会进一步激活异常的内皮细胞,导致管壁变厚,管腔狭窄,严重可导致管腔闭塞。内皮细胞凋亡后,随着病情加重,还可以诱导产生抗凋亡的间充样表型的内皮细胞过度增殖,这一过程称为内皮间质转化(endothelial
‑
to
‑
mesenchymal transition,endmt),造成丛样病变和血管闭塞,导致严重的肺动脉高压。
21.因此,设计的对照方案如下:
22.选取6
‑
8周龄c57bl/6,建立肺高压经典动物模型,随机分为5组,记录造模当天为第0天:
23.实施例1
24.常氧对照组(ctr):小鼠暴露在正常氧环境下6周。
25.实施例2
26.慢性低氧组(ch):小鼠放于低氧仓中持续低氧6周。
27.实施例3
28.低氧 sugen5416(suhx)组:小鼠持续低氧6周,在第0,7,14皮下注射的2.5mg/kg的sugen5416。
29.实施例4
30.低氧 maresin1组(ch mar1):小鼠持续低氧6周,在慢性低氧的第21天,给予maresin1治疗,腹腔注射1μg/mouse,随后隔天追加100ng/mouse直至第42天。
31.实施例5
32.低氧 sugen5416 maresin1组(suhx mar1):小鼠持续低氧6周,在第0,7,14皮下注射的2.5mg/kg的sugen5416,maresin1治疗于慢性低氧的第21天,腹腔注射1μg/mouse,随后隔天追加100ng/mouse直至第42天。
33.实施例6
34.针对实施例1~5的实验组,每天记录小鼠体重。造模21天后,超声高效液相色谱
‑
串联质谱(uplc
‑
ms/ms)检测血浆中maresin1的浓度。小动物超声仪和有创血流动力学监测评估右心室收缩压(right ventricular systolic pressure,rvsp)和右心功能指标三尖瓣环收缩期位移(tricuspid annulus plain systolic excursion,taspe),肺动脉加速时间(pulmonary artery acceleration time,paat),肺动脉射血时间(pulmonary artery ejection time,pet),右心肥厚指标包括右心室/(左心室 室间隔)(right ventricle/left ventricle septum,rv/(lv s))。
35.he和masson染色评估肺组织肺小动脉管形态和胶原沉积。α
‑
sma和cd31免疫组化评估肺动脉平滑肌细胞及内皮细胞的增殖程度。vwf和α
‑
sma免疫荧光共定位,评估肺小血管中血管内皮细胞向间质细胞转化。tunel染色(tdt
‑
mediated dutp nick end labeling,tunel)检测pasmcs的凋亡程度。wb检测肺组织中凋亡相关蛋白bax、bcl
‑
2、cleaved
‑
caspase3的表达。
36.1.小鼠暴露在慢性低氧和sugen5416结合低氧环境下3周,肺动脉高压模型建立后,高效液相色谱质谱和有创血流动力学结果显示,与对照组相比,ch组小鼠和suhx组小鼠血浆中maresin1浓度降低,rvsp明显升高,tapse、paat/pet明显降低。
37.2.小鼠经42天造模完成后,无创血流动力学和小动物超声结果显示,ch组小鼠和suhx组小鼠,体重降低,rvsp明显升高,rv/(lv s)升高,tapse、paat/pet明显降低,在给予
maresin1干预治疗以后,恢复了小鼠体重,同时降低了rvsp和rv/(lv s),升高了tapse和paat/pet。表明maresin1能够逆转肺动脉高压,改善右心肥厚和右心功能障碍。
38.3.he和masson染色结果显示,对照组小鼠肺动脉形态正常,管壁薄,血管及其周围胶原蓄积少。ch组小鼠和suhx组小鼠肺远端小动脉壁明显增厚,管腔变窄,血管及其周围大量胶原产生并蓄积。给予maresin1治疗后,可改善以上异常的肺血管重塑。
39.4.免疫组化结果表明,肺动脉高压模型组α
‑
sma和cd31表达量明显增加,血管内层和中层异常增殖,管壁变厚,管腔狭窄。在给予maresin1治疗后α
‑
sma和cd31表达量明显减少,管壁变薄,管腔大小恢复到对照组水平。maresin1干预治疗,可抑制远端肺血管平滑肌细胞和内皮细胞的增殖,改善肺血管重塑。
40.5.激光共聚焦结果表明,对照组小鼠vwf表达在肺动脉的单层内层,不与α
‑
sma共表达,且α
‑
sma表达在小动脉的外缘。肺动脉高压模型组,vwf和α
‑
sma共表达且表达量明显增加。maresin1治疗组vwf和α
‑
sma共表达明显减少且表达量减少。
41.6.tunel染色结果显示,与对照组相比,肺动脉高压模型组血管平滑肌标记物α
‑
sma表达增多,同时tunel染色阳性的肺动脉平滑肌细胞几乎没有表达。给予maresin1治疗之后,可使α
‑
sma阳性细胞凋亡恢复至正常水平,并降低α
‑
sma总表达。
42.7.wb结果显示,肺动脉高压模型组肺组织中,bcl
‑
2表达增高同时伴随bax表达水平变化不大,bax/bcl
‑
2比值降低,同时cleaved
‑
caspase3蛋白表达明显降低。给予maresin1治疗后,逆转了bax/bcl
‑
2比值和cleaved
‑
caspase3的表达。
43.实施例7
44.基于实施例6的结论,以下还提供一种药物,能够用于治疗肺动脉高压,该药物具有有效剂量的巨噬素1,即maresin1。通过载体承载maresin1,并且利用腹腔或静脉注射的方式进行给药。
45.综上所述,本方案通过利用巨噬素maresin1抑制远端肺血管平滑肌细胞α
‑
sma、内皮细胞cd31的增值和表达,且改善肺血管重塑,并且明显减少vwf和α
‑
sma共表达及其表达量。巨噬素maresin1调节提高bax/bcl
‑
2比值、提高cleaved
‑
caspase3蛋白表,来促进α
‑
sma阳性细胞凋亡,降低α
‑
sma总表达,能够让α
‑
sma阳性细胞凋亡恢复至正常水平。maresin1可逆转肺动脉高压,改善右心功能障碍,通过抑制内皮细胞向间质细胞转化和促进肺动脉平滑肌细胞的凋亡而改善血管重塑来实现。因此针对肺动脉高压症状的治疗具有明显作用。
46.以下,对上述试验过程的细化描述:
47.评估肺动脉高压模型是否成功建立
48.将小鼠放于低氧仓(氧气浓度:10%二氧化碳浓度:5%)持续3周,诱导慢性低氧肺动脉高压模型。另外一组小鼠放于低氧仓持续低氧3周,并且在第0,7,14天皮下注射sugen5416(2.5mg/kg),诱导低氧 sugen5416肺动脉高压模型。对照组小鼠置于正常氧环境下饲养。为了评估模型是否成功建立,将小鼠随机分为3组:(1)常氧对照组(ctr):正常氧环境下3周;(2)低氧组(ch):持续低氧3周;(3)低氧 sugen5416(suhx):持续低氧3周,同时在第0,7,14天皮下注射2.5mg/kg的sugen5416。21天造模完成后,小动物超声仪和血流动力学检测评估右心室收缩压和右心功能相关指标。随后眼球取血,收集上清液,随后处死小鼠,收集肺组织并储存于
‑
80℃冰箱。
49.评估maresin1对肺动脉高压的治疗作用
50.将小鼠放于低氧仓(氧气浓度:10%二氧化碳浓度:5%)持续6周,诱导慢性低氧肺动脉高压模型。另外一组小鼠放于低氧仓持续低氧6周,并且在第0,7,14天皮下注射sugen5416(2.5mg/kg),诱导低氧 sugen5416肺动脉高压模型。对照组小鼠放置于正常氧环境下饲养。maresin1购买于美国cayman chemical公司。购买的maresin1溶解在乙醇中,且储存于
‑
80℃。在使用前,首先用氮吹仪将乙醇吹走,然后将maresin1迅速溶解在无菌生理盐水中。为了评估maresin1对两种小鼠肺动脉高压模型的影响,将小鼠随机分为5组:(1)常氧对照组(ctr):正常氧环境下6周;(2)低氧组(ch):持续低氧6周;(3)低氧 sugen5416(suhx):持续低氧6周,同时在第0,7,14天皮下注射2.5mg/kg的sugen5416;(4)低氧 maresin1(ch mar1):持续低氧6周,在第21天腹腔注射给予maresin1(1μg/mouse)治疗,随后隔天追加100ng/mouse直至第6周;(5)低氧 sugen5416 maresin1(ch mar1):持续低氧6周,同时在第0,7,14天皮下注射2.5mg/kg的sugen5416,在第21天腹腔注射给予maresin1(1μg/mouse)治疗,随后隔天追加100ng/mouse直至第6周。42天造模完成后,小动物超声仪评估右心功能相关指标,随后有创血流动力学监测右心室收缩压。眼球取血,收集上清液,随后处死小鼠,收集肺组织置于多聚甲醛固定或存储于
‑
80℃进行下一步实验。
51.高效液相色谱串联质谱(uplc
‑
ms/ms)
52.小鼠造模21天后,从低氧仓中取出,处死前采集小鼠眼眶后神经丛的全血,然后对全血进行离心收集血清,
‑
80℃保存待用。通过超高效液相色谱串联质谱来检测小鼠血清中maresin1的浓度。将血清样本(1ml)放入冰甲醇(4ml)中,每个样本中含有氚标记的maresin1。然后将样本放置在
‑
20℃下45分钟,使蛋白质沉淀,然后离心并收集上清液。采用美国waters公司的c18固相色谱柱提取血清中的总的脂质介质,用超高效液相色谱串联质谱分析血清中maresin1的含量。实验选择含有0.01%醋酸的水作为流动相a,使用含0.01%乙酸的甲醇作为流动相b。使用超高效液相色谱系统配备ab sciex instruments 6500q
‑
trap质谱仪(schex,美国)和analyst 1.6软件(美国应用生物系统公司)进行数据采集和分析。maresin1的定量是基于多反应监测跃迁峰面积和各化合物的线性校正曲线。
53.小动物超声心动图
54.42天造模完成后,将小鼠从低氧仓中取出,放在常氧环境下适应数个小时。用异氟烷(1.2
‑
1.6%异氟烷,中国深圳瑞沃德生命科技公司)诱导小鼠麻醉,持续吸入异氟烷(1.5
‑
3%)来维持麻醉。随后将小鼠四肢和头部固定于操作台上,用脱毛膏去除其胸部毛发,使用vevo3100小型动物超声仪(fujifilm visual sonics)经胸超声检测小鼠右心功能相关指标。用脉冲多普勒方式在小鼠胸骨旁长轴测量肺动脉加速时间(paat)和肺动脉射血时间(pet)。采用m超在小鼠胸骨旁短轴测量三尖瓣环收缩期位移(tapse)。
55.有创血流动力学监测
56.小鼠造模42天完成后,将小鼠从低氧仓中取出,放在常氧环境下适应数个小时。称量体重并记录。腹腔注射2%戊巴比妥钠(60mg/kg)麻醉,随后将小鼠四肢和头部固定于操作板上,暴露颈部正中切口,颈外静脉游离0.8
‑
1cm,上端手术线结扎,下端穿线备用,pe导管通过压力传感器与powerlab生理信号记录系统相连,肝素润洗导管后,插入右侧颈外静脉到达右心室监测右心室波形和压力并记录,评估右心室收缩压。同样的方法插入左侧颈动脉,监测颈动脉的波形和压力并记录,评估小鼠体循环的稳定性。
57.右心室肥厚评估
58.有创血流动力学监测完成后,打开小鼠胸腔并取出心脏和肺。心脏在pbs里清洗后,解剖并去除心房,沿心脏室间隔边缘分离右心室(rv)和左心室 室间隔(lv s),称重并记录,计算rv/(lv s)。
59.小鼠肺组织苏木精
‑
伊红染色(hematoxylin
‑
eosin staining,he染色)
60.(1)左肺远端固定和包埋:小鼠经有创血流动力学监测完成后,迅速打开胸腔。用pbs沿肺动脉灌洗肺后,取左肺远端部分置入4%多聚甲醛中固定48小时。固定完成后,适当修剪后置入包埋盒中,流水冲洗组织30分钟。梯度酒精脱水以及二甲苯透明,然后将石蜡倒入到包埋盒中。等待石蜡凝固为固态,石蜡切片机进行切片(5μm)。
61.(2)脱蜡:将肺组织切片置65℃烘箱2小时,然后将切片于二甲苯20分钟,更换二甲苯10分钟。肉眼观察蜡是否脱干净
62.(3)水化:将切片按浓度依次放入100%、95%、85%、75%乙醇中各5分钟。
63.(4)染色:切片水化后,pbs中浸泡清洗,每次5分钟,总共3次。滴加苏木素染色(20ul,10分钟)。染色完成后使用蒸馏水洗去多余的染色液。放入1%的盐酸乙醇中3
‑
5秒进行分化,分化完后,将片子立即放入蒸馏水槽中,蒸馏水槽放入盛有自来水的烧杯,缓慢流水冲洗20分钟。
64.(5)切片伊红染色与脱水:在切片中加入伊红染液,反应5分钟,然后将片子依次放入75%、85%、95%、100%酒精槽中各2分钟。
65.(6)封片,观察:将脱水后的肺组织切片放入二甲苯中透明,然后样本上滴加中性树胶,盖上盖玻片封片。最后在显微镜下观察拍片。
66.免疫组化
67.材料:二甲苯、梯度酒精、蒸馏水、枸橼酸钠、h2o2、磷酸盐缓冲液、驴血清、dab液、苏木精、盐酸乙醇、中性树脂、烧杯、玻璃缸、盖玻片。
68.步骤:
69.(1)脱蜡:小鼠肺组织石蜡切片置于65℃烘箱2小时,然后将切片于二甲苯20分钟,更换二甲苯10分钟。肉眼观察蜡是否脱干净。
70.(2)水化:将切片按浓度依次放入100%、95%、85%、75%乙醇各5分钟,蒸馏水中浸泡5分钟,滤纸吸除多余液体。
71.(3)去除内源性过氧化物酶:滴加3%h2o2各样20ul,孵育5
‑
10分钟,用于去除过氧化物酶(内源性),pbs洗3次。
72.(4)抗原修复:将切片放入切片架中,将切片架放入1000ml烧杯中,倒入枸橼酸盐缓冲液400ml,微波炉中加热至有小气泡产生,此时关闭微波炉,冷却5分钟。5分钟后,微波炉中继续加热,当小气泡融合成大气泡,关闭微波炉,随后冷却40分钟。
73.(5)封闭:pbs清洗3次,每次5分钟,滤纸吸去多余的液体。滴加10%驴血清,每样20ul,室温下封闭1小时。
74.(6)孵育一抗:吸除封闭液后,滴加α
‑
sma抗体或cd31抗体,每样20ul,浓度为1:100,4℃环境下孵育过夜。
75.(7)敷育二抗:第二天,将一抗回收与ep管中,pbs清洗3次,每次5分钟。随后滴加二抗(山羊抗兔或山羊抗鼠)浓度为1:100,室温下孵育1小时。
76.(8)吸除二抗,pbs清洗3次,每次5分钟。随后滴加dab液,反应5
‑
10分钟,待组织变
黄即可。
77.(9)核复染:苏木精20
‑
30ul每样,反应10分钟。随后放入盐酸乙醇中3
‑
5s分化。
78.(10)脱水:75%、85%、95%、100%酒精梯度各5分钟。
79.(11)封片,观察:二甲苯中透明,中性树脂封片,光学显微镜下拍照。
80.组织免疫荧光
81.组织免疫荧光可以观察蛋白在组织中的定位。在进行肺组织石蜡切片免疫荧光时,需要先对组织脱蜡,抗原修复,进而进行组织的免疫荧光。
82.材料:二甲苯、梯度酒精、蒸馏水、枸橼酸钠、h2o2、磷酸盐缓冲液、驴血清、dab液、苏木精、盐酸乙醇、中性树脂、烧杯、玻璃缸、盖玻片。
83.步骤:
84.(1)脱蜡:小鼠肺组织石蜡切片置于65℃烘箱2小时,二甲苯20分钟,更换二甲苯10分钟。肉眼观察蜡是否脱干净。
85.(2)水化:将切片按浓度依次放入100%、95%、85%、75%乙醇各5分钟,蒸馏水中浸泡5分钟,滤纸擦干。
86.(3)加入0.5%triton
‑
100在室温下通透10分钟,pbs洗涤3次。
87.(4)抗原修复:将切片放入切片架中,将切片架放入1000ml烧杯中,倒入枸橼酸盐缓冲液400ml,微波炉中加热至有小气泡产生,随后冷却40分钟。
88.(5)封闭:pbs清洗3次,每次5分钟,滤纸吸去多余的液体。滴加10%驴血清,每样20ul,室温下封闭1小时。
89.(6)孵育一抗:吸去封闭液,每样滴加足够量适宜浓度的一抗(1%驴血清稀释一抗),4℃湿盒内孵育过夜。组织免疫荧光所用一抗如下:α
‑
sma,vwf(1:100)。
90.(7)孵育二抗:第二天,将一抗回收与ep管中,pbs清洗3次,每次5分钟。滴加足够适宜浓度的二抗(1:200),室温避光孵育1小时。
91.(8)核复染:吸去二抗,pbs浸洗3次,每次5分钟。向玻璃片上滴加dapi复染细胞核,避光孵育3
‑
5分钟。
92.(9)封片、观察:pbs浸洗3次,每次5分钟。用含抗荧光猝灭剂的封片液封片,然后在荧光显微镜或共聚焦显微镜下观察并采集图像。
93.tunel(tdt
‑
mediateddutpnickendlabeling)细胞凋亡检测
94.tunel细胞凋亡检测试剂盒,是用来检测组织细胞在凋亡早期过程中细胞核dna的断裂情况。由于正常的或正在增殖的细胞几乎没有dna断裂因而没有3
‑
oh的形成,很少能够被染色。此方法特异准确的定位在正在凋亡的细胞。
95.步骤:
96.(1)脱蜡:小鼠肺组织石蜡切片置于65℃烘箱2小时,二甲苯20分钟,更换二甲苯10分钟。肉眼观察蜡是否脱干净。
97.(2)水化:将切片按浓度依次放入100%、95%、85%、75%乙醇各5分钟,蒸馏水中浸泡5分钟,滤纸擦干。
98.(3)加入0.5%triton
‑
100在室温下通透10分钟,pbs洗涤3次。
99.(4)制备tunel反应混合液。
100.(5)滴加50ultunel反应混合液于标本上,37℃,暗湿盒中反应1小时。(6)吸去混合
液,pbs浸洗3次,每次5分钟。
101.(7)向玻璃片上滴加dapi复染细胞核,避光孵育3
‑
5分钟。
102.(8)pbs浸洗3次,每次5分钟。
103.(9)用含抗荧光猝灭剂的封片液封片,然后在荧光显微镜或共聚焦显微镜下观察并采集图像。
104.masson染色
105.masson染色是用来观察病变胶原沉积及先纤维化程度的。原理是masson染色使胶原纤维呈蓝色(苯胺蓝所染),肌纤维呈红色(酸性品红所染),这与阴离子染料分子的大小和组织渗透性有关。
106.步骤:
107.(1)脱蜡:小鼠肺组织石蜡切片置于65℃烘箱2小时,二甲苯20分钟,更换
108.二甲苯10分钟。肉眼观察蜡是否脱干净。
109.(2)水化:将切片按浓度依次放入100%、95%、85%、75%乙醇各5分钟,蒸
110.馏水中浸泡5分钟,滤纸擦干。
111.(3)滴加苏木素染液反应5
‑
10分钟,缓慢流水冲洗,1%盐酸分化。(4)流水冲洗数分钟,masson复合染色液5分钟。
112.(5)蒸馏水稍冲洗,1%磷钨酸液处理约5分钟。
113.(6)苯胺蓝液复染5分钟。
114.(7)1%冰醋酸水处理1分钟。
115.(8)脱水:75%、85%、95%、100%酒精梯度各5分钟。
116.(9)封片,观察:二甲苯中透明,中性树脂封片,光学显微镜下拍照。
117.western bloting检测
118.(1)制作肺组织蛋白匀浆液:肺组织经pbs漂洗并擦干后,用剪刀将其剪碎,置入裂解液中。裂解液包含:pmsf和ripa裂解液,磷酸酶抑制剂。肺组织样本经组织研磨仪器制作成蛋白匀浆,样本经超声处理后,在12000xg,4℃下离心20min,取上清液。
119.(2)测量蛋白浓度:用bca蛋白测定试剂盒测定蛋白浓度,随后将每样本蛋白浓度配置一致。
120.(3)电泳:蛋白经变性后,加入10%的sds
‑
page电泳胶中,根据不同的目标蛋白调节压力。
121.(4)转膜:将电泳胶上的蛋白转移到pvdf膜上,转膜时间根据蛋白分子量大小调节。
122.(5)封闭:用10%脱脂牛奶在室温下封闭pvdf膜2h。
123.(6)抗体孵育:将pvdf膜置于一抗液中4℃敷育过夜。一抗浓度为1:1000
‑
1:2000。第二天将pvdf膜用tbst漂洗3次,每次10分钟,pvdf膜置于二抗液(山羊抗兔或山羊抗鼠)中室温孵育2小时,浓度为1:3000。
124.(7)曝光:pvdf膜漂洗后,滴加曝光液,使用quant las 4000mini曝光。使用alphaeasefc软件分析曝光图片。
125.上述试验过程还获得以下结论:
126.1.在两种肺动脉高压小鼠模型中血浆中maresin1浓度降低
127.许多研究已经表明,慢性低氧或sugen5416结合慢性低氧都能成功诱导小鼠发生肺动脉高压。之前的研究也确定了小鼠暴露在低氧环境下3周,可以诱导肺动脉高压和远端肺小动脉重塑。在目前的实验中,用了两种pah高压模型:慢性低氧或sugen5416(第0,7,14天皮下注射,2.5mg/kg)结合慢性低氧诱导的小鼠肺动脉高压,造模时间为21天。用有创血流动力学监测了rvsp和fultonindex验证模型是否成功建立。进一步,小动脉超声结果发现,两种pah高压小鼠模型的右心功能明显受损,表现为缩短的tapse和paat/pet。最后,高效液相色谱质谱检测了血浆中maresin1浓度,结果显示,与对照组相比,肺动脉高压小鼠血浆中maresin1浓度明显降低。以上实验数据显示:肺动脉高压模型组小鼠,rvsp显著升高和右心肥厚,右心功能障碍,同时伴有血浆中maresin1浓度明显降低(图1)。这些结果表明,21天,模型已成功建立,且在两种肺动脉高压模型中,血浆中maresin1浓度是降低的。
128.2.maresin1可改善小鼠肺动脉压力和右心功能障碍
129.为了确定maresin1对肺动脉高压的作用,小鼠低氧和sugen5416结合慢性低氧环境下暴露3周后,也就是肺动脉高压模型成功建立后,治疗性给予maresin1治疗3周,治疗的期间继续持续低氧,总的造模时间为6周(图2a)。6周后,监测rvsp以评估pah的发生和进展。实验数据显示,肺动脉高压组rvsp明显升高,给予maresin1治疗后能够明显降低ch和suhx,诱导的肺动脉压力的升高(图2b)。进一步fultonindex结果显示maresin1可降低rv/(lv s),改善右心肥大(图2c)。最后,进一步鉴定了maresin1对pah诱导的右心功能障碍的影响,小动物超声仪评估了肺动脉高压小鼠的右心功能相关的指标,发现maresin1可以增加tapse和paat/pet(图2d
‑
e),改善右心功能障碍。以上实验数据显示:在小鼠肺动脉高压中,右心室收缩压明显升高,右心肥大,右心功能障碍,maresin1可明显降低右心室收缩压和右心肥大,同时能够改善右心功能障碍。这些结果确定了maresin1对肺动脉高压的保护作用。
130.3.maresin1改善异常的肺动脉血管重塑
131.在前面的实验中发现maresin1可改善肺动脉压力和右心功能障碍。为了进一步确定maresin1对肺动脉高压的保护作用,假设maresin1通过改善异常的肺血管重塑对肺动脉高压起保护作用。用组织学染色评估了肺血管重塑的相关指标。he染色结果发现,肺动脉高压组小鼠,肺远端小动脉壁明显增厚,管腔狭窄。给予maresin1治疗后,血管壁变薄,管腔形态与对照组相似(图3a
‑
c)。masson染色结果显示,ch组和suhx组小鼠,血管周围伴胶原产生增加并蓄积,而maresin1治疗组,胶原蓄积减少(图3d)。肺动脉主要是由肺动脉内皮细胞和肺动脉平滑肌细胞组成,肺动脉内皮细胞和平滑肌细胞的异常增殖是pah肺血管重塑的主要病理特点。为确定maresin1对pah内皮细胞和平滑肌细胞异常的增殖的影响,使用免疫组化对两层血管定位分析,结果发现,在ch组和suhx组,小鼠肺血管中α
‑
sma和cd31的表达均增加,表明肺动脉高压组平滑肌细胞和内皮细胞异常增殖,maresin1干预后降低了肺小动脉中α
‑
sma和cd31的表达,可抑制平滑肌细胞和内皮细胞的增殖,管腔变薄(图3e
‑
g)。以上实验结果表明:在两种小鼠肺动脉高压模型中,maresin1可改善异常的肺小血管重塑。
132.4.maresin1抑制内皮向间质转化
133.肺动脉高压的主要病理特点是肺血管重塑,在肺血管重塑的过程中,内皮细胞向间质细胞(endmt)是其中的一个主要的病理特点,其中内皮细胞向间转化质细胞转化使得肺血管壁变厚,管腔狭窄,严重可导致管腔闭塞。评估血管内皮细胞在慢性低氧和suhx诱导的肺动脉高压模型中的表达情况以及是否经历了endmt,并观察maresin1对这一过程的影
响。采用激光共聚焦检测了内皮细胞标记物vwf和平滑肌细胞标记物α
‑
sma在肺小动脉中的共表达。在对照组小鼠的肺动脉中,vwf表达与内层单层,且不与α
‑
sma共定位,α
‑
sma表达在小动脉的外缘。在低氧和suhx组小鼠的肺动脉中,观察到vwf和α
‑
sma共表达且表达量明显增多。maresin1治疗后,可显著降低vwf
‑
α
‑
sma的共表达(图4ab)。以上结果表明:在小鼠肺动脉高压模型中,治疗性给予maresin1可抑制内皮细胞向间质细胞转化,抑制内皮和平滑肌增殖,使肺血管壁变薄,明显改善肺血管重塑。
134.5.maresin1促进肺动脉高压小鼠肺动脉α
‑
sma阳性细胞凋亡
135.凋亡耐受的α
‑
sma阳性的细胞过度增殖,导致远端肺动脉血管壁变厚,管腔变窄,这是肺动脉高压肺动脉闭塞的重要原因。为了探讨maresin1是否是通过促进于凋亡耐受的α
‑
sma阳性细胞的凋亡而改善血管重塑,观察了α
‑
sma定位的小动脉内凋亡细胞的分布。与以上结果相一致,慢性低氧和sugen5416结合低氧诱导的两种小鼠肺动脉高压模型中,平滑肌标记物α
‑
sma表同时tunel染色阳性的细胞几乎没有表达。给予maresin1治疗后,达明显增加,可使α
‑
sma阳性细胞恢复至正常水平,并降低了α
‑
sma总表达(图5ab)。与此同时,进一步检测了小鼠肺组织中凋亡相关的蛋白表达。蛋白免疫印迹结果显示在肺动脉高压小鼠肺组织中,抗凋亡蛋白bcl
‑
2表达明显增加,促凋亡蛋白bax表达水平变化不大,导致bax/bcl
‑
2比值降低(图6ab)。bax/bcl
‑
2信号通路下游的caspase
‑
3表达也降低。给予maresin1治疗后,可以下调抗凋亡蛋白bcl
‑
2的表达,上调bax/bcl
‑
2比值,同时上调促凋亡蛋白cleaved
‑
caspase3的表达(图6cd)。以上结果表明,在两种小鼠肺动脉高压模型中,maresin1可降低小鼠肺动脉α
‑
sma表达,且促进α
‑
sma阳性细胞凋亡凋亡,从而抑制肺动脉平滑肌过度增殖,改善肺血管重塑。
136.以上所述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。