将腺病毒和化学治疗剂组合用于治疗癌症
1.本技术是申请日为2017年1月11日、发明名称为“将腺病毒和化学治疗剂组合用于治疗癌症”的中国发明专利申请no.201780006703.7的分案申请。
发明领域
2.本发明涉及医学领域。具体地,本发明涉及使用oncos
‑
102腺病毒与两种化学治疗剂联合治疗人癌症的新策略。还公开了使用病毒和化学治疗剂的这种联合治疗恶性间皮瘤的方法。除了病毒和两种化学治疗剂以外,其他药物也可以包括在所述治疗方案中。
3.发明背景
4.恶性间皮瘤(malignant mesothelioma,mm)是一种从间皮发展而来的侵袭性和罕见的癌症形式。mm主要是由于暴露于石棉造成的,表现出较长的潜伏期,通常>30年。间皮瘤患者诊断后的中位存活时间通常仅为9
‑
12个月。mm在85.5%的mm病例中影响胸膜(肺和内胸壁的外衬层),在13.2%的mm病例中影响腹膜(腹腔内衬层),在0.5%的mm病例中影响心包(包围心脏的囊),以及在0.8%的mm病例中影响鞘膜(包围睾丸的囊)。mm肿瘤通常对标准疗法反应不佳,并且发病率在世界范围内不断增加。mm的低发病率长期以来限制了新药的发现,因此非常需要新的治疗方式。
5.通常,癌症用常规治疗方案诸如例如手术、激素疗法、化学疗法、放射疗法和/或其他疗法进行治疗。然而,在许多情况下,通常以晚期为特征的癌症不能用现有疗法治愈。
6.病毒疗法是一种相对新颖的治疗方法,其利用了一些病毒杀伤它们在其中增殖的细胞的天然能力和扩散到相邻细胞(从而放大初始输入剂量的治疗效果)的能力。在病毒疗法中,通过病毒基因组的基因工程小心控制癌细胞转导和病毒复制,以获得有效和安全的肿瘤根除。安全的肿瘤根除需要将各种遗传修饰引入腺病毒基因组,从而将复制仅限制在肿瘤细胞中,并最终获得肿瘤的选择性根除,而对健康组织没有副作用。
7.腺病毒关键调控基因的特定缺失可用于产生功能失调的蛋白质或其表达的缺乏,这导致对靶细胞中存在的特定遗传特征的依赖。e1a的部分缺失导致在正常细胞中的复制受限,但允许在靶细胞诸如癌细胞中复制。已经产生了特征在于cr2(恒定区2)中的24个碱基对缺失的条件性复制病毒,显示其在治疗神经胶质瘤和乳腺癌异种移植物方面是有效的和选择性的(fueyo等,2000;heise等2000)。其癌症特异性源于功能失调的e1a不能释放e2f1转录因子,这导致对游离e2f1的需要。e2f1在癌细胞中很丰富,其中prb途径最常被破坏(hanahan和weinberg 2000)。
8.临床和临床前结果表明,利用非武装性溶瘤病毒的治疗的免疫刺激性不足以导致持续的抗肿瘤治疗性免疫反应。在这一点上,溶瘤病毒已被武装成更具免疫刺激性。可将病毒工程化以表达高度免疫原性的蛋白质,诸如粒细胞
‑
巨噬细胞集落刺激因子(gm
‑
csf)。当免疫原性蛋白在肿瘤微环境内表达时,它们是特异性和长效的抗肿瘤免疫力的强效刺激剂。将免疫治疗性基因引入肿瘤细胞中并进一步将其翻译成蛋白质导致了免疫反应的激活和对肿瘤细胞的更高效破坏。在这一点上,最相关的免疫细胞是天然杀伤细胞(nk)和细胞毒性cd8 t细胞。
9.oncos
‑
102(ad5/3
‑
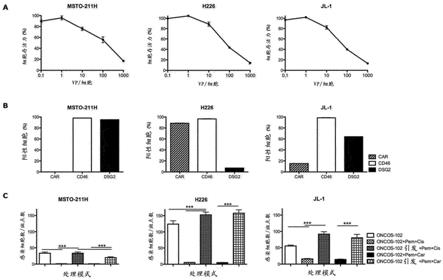
d24
‑
gm
‑
csf;在wo2010/072900中公开的)是血清型5腺病毒,其包含用于增强向癌细胞递送基因的嵌合衣壳和用于癌细胞局限性复制的e1a区域的rb结合部位中的24bp缺失。oncos
‑
102装备有粒细胞
‑
巨噬细胞集落刺激因子(gm
‑
csf)以增强免疫刺激作用。oncos
‑
102的安全性和免疫学活性已在i期临床研究(nct01598129)中得到证明。在该i期研究中,用oncos
‑
102局部治疗胸膜间皮瘤诱导了全身性抗肿瘤cd8 t细胞反应,并且cd8 t细胞浸润到最后一线难治性恶性胸膜间皮瘤患者的肿瘤中。
10.koski等(2010)公开了用oncos
‑
102治疗总共21名患有标准疗法难治的晚期实体瘤的患者。根据这些研究,oncos
‑
102在治疗癌症患者中似乎是安全的。还看到了令人期待的功效迹象。
11.公开文本wo 99/59604公开了一种治疗鳞状细胞癌的方法,该方法由将腺病毒直接注射到癌中并施用两种化学治疗剂顺铂和5
‑
氟尿嘧啶组成。
12.siurala等(2015)公开了衣壳经修饰的溶瘤腺病毒cgtg
‑
102(与oncos
‑
102相同)与多柔比星(含有或不含异环磷酰胺)的组合。当在具有完全免疫能力的叙利亚仓鼠体内对建立的软组织肉瘤肿瘤进行体内测试时,发现该组合是有效的。
13.公开文本us 7393478 b2公开了用于抑制受试者中肿瘤生长的方法,其包括向受试者施用有效量的包含顺铂和治疗剂的胶束。该方法中的治疗剂可以是例如gm
‑
csf。
14.在实践中,恶性间皮瘤(mm)的治疗自2003年以来保持不变。最常用的mm一线化学疗法是用化学治疗剂培美曲塞(pemetrexed disosium,alimta)、顺铂(platinol)、卡铂(paraplatin)及其组合进行的。尽管在常规癌症治疗方案中取得了进展,但人间皮瘤仍然无法治愈,迫切需要新的治疗方案。
15.发明概述
16.本发明的目的是提供溶瘤腺病毒和化学治疗剂的新组合,使用溶瘤腺病毒和化学治疗剂治疗患者癌症的新型联合疗法,并且还解决与常规癌症疗法相关的问题。
17.本发明的一个方面是用于治疗人癌症,优选用于治疗人恶性间皮瘤的oncos
‑
102腺病毒,其中将向有此需要的人患者施用该病毒与施用两种化学治疗剂相组合来进行。
18.本发明的另一方面是用于在患者中治疗人癌症,优选人恶性间皮瘤的方法,其包括向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤。
19.本发明的又一方面是oncos
‑
102腺病毒在治疗人恶性间皮瘤中的用途,其中将所述病毒与两种化学治疗剂组合向患者施用。
20.附图简述
21.包括以下附图来进一步说明本发明的某些方面和特征。参照这些附图中的一个或多个并结合具体实施方案(包括实施例)的详细描述,可以更好地理解本发明。
22.图1.在体外功效研究中利用培美曲塞和顺铂或培美曲塞和卡铂单独地或与oncos
‑
102(10vp/细胞)组合地,或利用oncos
‑
102单独地进行人间皮瘤细胞jl
‑
1、msto
‑
211h和h226的治疗。a)通过mts细胞活力测定法测量抗肿瘤功效。治疗后72小时相对于未治疗的细胞(模拟)测定细胞活力。通过流式细胞术分析处理后48小时的b)坏死细胞(pi)和c)早期凋亡细胞(fitc标记的膜联蛋白
‑
v)的量。误差棒,平均值
±
sem:*p<0.05,**p<0.01,***p<0.001。
23.图2.利用培美曲塞和顺铂或培美曲塞和卡铂单独地或与oncos
‑
102(10vp/细胞)
组合地进行人间皮瘤细胞jl
‑
1、msto
‑
211h和h226的联合治疗,或利用oncos
‑
102单独地进行治疗
‑
体外免疫原性肿瘤细胞死亡。a)使用atp测定试剂盒处理后48小时(j1
‑
1,msto
‑
211h)和72小时(h226)从上清液测量细胞外atp。b)使用elisa测定处理后3天测量细胞外hmgb1向上清液中的分泌。c)在通过流式细胞术处理后24小时(h226,j1
‑
1)和48小时(msto
‑
211h)测量经测试的人间皮瘤细胞的外细胞表面上的钙网蛋白暴露。误差棒,平均值
±
sem:*p<0.05,**p<0.01,***p<0.001。
24.图3.在三种间皮瘤细胞系(j1
‑
1、msto
‑
211h,h226)中测量的oncos
‑
102的溶瘤功效、受体表达谱和病毒感染性测定。a)在治疗开始后3天通过mts细胞活力测定法测量oncos
‑
102(0.1vp、1vp、10vp、100vp和1000vp/细胞)的溶瘤功效。相对于未治疗的细胞(模拟)测定细胞活力曲线。b)在特异性抗体染色后通过流式细胞术测量car、dsg2和cd46在间皮瘤细胞系上的表达。c)对五个治疗组进行oncos
‑
102感染性测定。oncos
‑
102感染性的测定基于的是病毒六邻体蛋白染色后感染细胞的目测定量和最终检测到的斑点的计算。对于每5次重复,使用amg evo xl显微镜获得5个非重叠视野的图像。对于感染性比较,数据表示为5个孔中的平均斑点数。误差棒,平均值
±
sem:*p<0.05,**p<0.01,***p<0.001。
25.图4.分析oncos
‑
102(1e 8vp/小鼠,肿瘤内(i.t.))与培美曲塞(10mg/kg于100μl中,腹膜内(ip))、顺铂(1.5mg/kg于100μl中,ip)或卡铂(8mg/kg于100μl中,ip)的组合在balb/c裸鼠的人间皮瘤异种移植物模型(每组7只小鼠,每组14个肿瘤)中的功效,并将其与模拟或单独的每种治疗进行比较。a)按照治疗方案(表1),用oncos
‑
102(i.t.)和化学疗法(ip)分8组治疗携带皮下h226肿瘤(6x106个细胞/肿瘤)的babl/c裸鼠。在整个2个月中每3天处理动物一次。b)通过kaplan
‑
meier测试计算存活状况。c)利用elisa技术在无痛处死动物后从肿瘤、肝脏和血清中分析由oncos
‑
102产生的人gm
‑
csf。d)通过qpcr从无痛致死的动物的肿瘤、肝脏和血清中测量腺病毒拷贝(e4基因)。误差棒,平均值
±
sem:*p<0.05,**p<0.01,***p<0.001。
26.图5.oncos
‑
102(1e 8vp/小鼠,i.t.)、培美曲塞(10mg/kg于100μl中,ip)和顺铂(1.5mg/kg于100μl中,ip)、所有三种所述化学治疗剂的组合或所述化学治疗剂的组合在balb/c裸鼠的人间皮瘤异种移植模型(每组2只小鼠,每只小鼠2个肿瘤)中的抗肿瘤功效。a)用oncos
‑
102(i.t.)和化学疗法(ip)分4组治疗携带皮下h226肿瘤(7x106个细胞/肿瘤)的babl/c裸鼠。在整个54天中每3天处理动物一次。b)在整个实验过程中监测和测量体重。将体重(g)换算为体重的百分比值,其中第0天的体重设定为100%。c)通过kaplan
‑
meier检验计算存活状况。误差棒,平均值
±
sem:*p<0.05,**p<0.01,***p<0.001。
27.图6.oncos
‑
102(2e 8vp/小鼠,i.t.)、培美曲塞(6.7mg/kg于100μl中,ip)和卡铂(5.4mg/kg于100μl中,ip)、所有三种化学治疗剂的组合或所述化学治疗剂的组合在balb/c裸鼠的人间皮瘤异种移植模型(每组2只小鼠,每只小鼠2个肿瘤)中的抗肿瘤功效。a)用oncos
‑
102(i.t.)和化学疗法(ip)分4组治疗携带皮下h226肿瘤(7x106个细胞/肿瘤)的balb/c裸鼠。动物在整个30天内每3天处理一次。b)在整个实验过程中监测和测量体重。将体重(g)换算为体重的百分比值,其中第0天的体重设定为100%。c)通过kaplan
‑
meier检验计算存活状况。误差棒,平均值
±
sem:*p<0.05,**p<0.01,***p<0.001。
28.发明详述
29.除非另外定义,否则本技术中使用的所有技术和科学术语具有与本发明所属领域
的普通技术人员通常理解的含义相同的含义。
30.间皮瘤是对标准疗法表现为治疗
‑
耐药的癌症,在世界范围内致死病例数量不断增加。胸部的肺以及腹部器官诸如胃、肠、肝脏以及心脏分别包裹在膜诸如胸膜、腹膜和心包膜中。覆盖此类膜表面的部分称为间皮。从此类间皮发展而来的肿瘤被称为间皮瘤。恶性间皮瘤有三种主要的组织学亚型:上皮样、肉瘤性和双相性亚型。本文所用的“恶性间皮瘤”(mm)是指影响胸膜、腹膜、心包或鞘膜的间皮瘤。迄今为止,针对mm的最有效的标准治疗是培美曲塞和顺铂的组合,其导致41%的响应率(rr)。与单药化学疗法相比,顺铂和培美曲塞的组合提高了间皮瘤患者的存活率。然而,mm仍然是一种致命疾病,中位pfs/os的预后为从治疗开始至12个月,因此需要新的治疗方式。
31.如本文中所用,术语“抗病毒反应”是指细胞对病毒感染的反应,包括例如干扰素的产生、细胞因子释放、趋化因子的产生、淋巴因子的产生或其任何组合。
32.如本文中所用,表述“正常宿主细胞”和“正常组织”是指具有完整抗病毒反应的非癌性、未感染的细胞或组织。
33.如本文中所用,术语“溶瘤剂”是指能够抑制肿瘤细胞生长和/或杀死肿瘤细胞的药剂。
34.如本文中所用,术语“受试者”是指任何活的生物体,包括人和动物、人和动物组织,以及人和动物细胞。
35.如本文中所用,术语“患者”是指患有疾病诸如mm的任何受试者(优选人),其可能受益于利用如本文所述的联合疗法的治疗。
36.腺病毒是具有二十面体衣壳的直径为70
‑
90nm的无包膜病毒。它们的基因组是线性的双链dna,其大小在25
‑
45千碱基之间,两端都有反向末端重复序列(itr),并在5'末端附接有末端蛋白质。
37.该二十面体衣壳由三种主要蛋白质形成,其中六邻体三聚体最丰富。衣壳的12个顶点中的每一个还包含五聚体蛋白质,即共价附接至纤维的五邻体基底(penton base)。所述纤维是三聚体蛋白质,其从五邻体基底突出,是有圆头的棒状结构。其他病毒蛋白iiia、iva2、vi、viii和ix也与病毒衣壳缔合。蛋白质vii、小肽mu和末端蛋白(tp)与dna缔合。蛋白v通过蛋白vi提供与衣壳的结构连接。
38.如本文中所用,术语“衣壳”是指病毒的蛋白质壳,其包括六邻体蛋白、纤维蛋白和五邻体基底蛋白。
39.所有人腺病毒在其纤维结构上具有相似性。各自都有n末端尾、具有重复序列的柄,以及具有球状结构的c末端圆头结构域。圆头结构域主要负责结合靶细胞受体,并且其球状结构呈现出用于侧向和顶端结合的大表面。来自不同亚组的腺病毒的纤维蛋白在长度和弯曲能力方面差异最明显。
40.纤维参与病毒至靶细胞的附着。首先,纤维蛋白的圆头结构域与靶细胞的受体结合,其次,病毒与整联蛋白分子相互作用,第三,病毒被内吞至靶细胞中。随后,病毒基因组从内体转运到细胞核中,病毒基因组的复制可以开始。
41.如本文中所用,衣壳的“ad5/3嵌合体”是指这样的嵌合体,其中纤维的圆头部分来自ad血清型3,并且纤维的其余部分来自ad血清型5。
42.腺病毒依靠细胞机制来复制病毒基因组。它们可以感染静止细胞并诱导它们进入
细胞周期s期样状态,从而使得能够进行病毒dna复制。腺病毒基因组可分为立即早期(e1a)、早期(e1b、e2、e3、e4)、中期(ix、iva)和晚期(l1
‑
l5)基因。
43.e3基因产物对于体外病毒复制不是必需的,但专用于控制各种宿主免疫反应。e3
‑
gp19k抑制i类主要组织相容性复合体(mhc)从内质网(er)向质膜的转运,从而阻止mhc向t淋巴细胞呈递肽。
44.腺病毒e1a蛋白最初被描述为能够在静止的正常细胞中诱导dna复制的prb结合蛋白。e1a蛋白的关键功能之一是破坏prb
‑
e2f相互作用,从而释放e2f转录因子以激活e2f应答启动子和它们控制的基因诸如腺病毒e2a的转录。e1a蛋白中的保守区域2(cr2)与prb的口袋结合结构域形成强相互作用,并且cr1介导prb的e2f结合的实际破坏。已产生了特征在于cr2中的24个碱基对缺失的条件性复制病毒,显示其在治疗神经胶质瘤和乳腺癌异种移植物方面是有效的并且具有选择性。它们的癌症特异性源于功能失调的e1a不能释放e2f1转录因子,这导致需要游离e2f1。
45.oncos
‑
102腺病毒早已公开在公开文本wo2010/072900中。oncos
‑
102是血清型5腺病毒(ad5),显示出与ad5基因组不同的以下修饰:
46.1.e1a基因恒定区2(cr2)中的24个碱基对(bp)的缺失。功能失调的e1a蛋白不能结合e2f1转录因子并将其从视网膜母细胞瘤蛋白(rb)上释放,导致需要游离的e2f1用于腺病毒基因转录。游离e2f1在癌细胞中很丰富,其中prb途径最常被破坏。因此,在e1a中具有该24bp缺失的病毒能够在癌细胞中高效复制。e1a基因转录成mrna受内源性e1a启动子控制。
47.2.在编码6.7k和gp19k蛋白的早期3(e3)区域引入了965bp的缺失。这些蛋白质与腺病毒逃避宿主免疫控制机制的能力相关,它们的功能对于腺病毒复制是消耗性的。
48.3.编码人粒细胞巨噬细胞集落刺激因子(gm
‑
csf)蛋白的转基因已被插入e3区域,取代6.7k和gp19k。gm
‑
csf基因转录成mrna受内源性e3启动子控制。换句话说,在oncos
‑
102腺病毒中,已从e3区域中缺失了编码病毒基因gp19k和6.7k的965个碱基对,并且已引入了转基因gm
‑
csf来替代它们。
49.4.血清型5纤维圆头被血清型3纤维替代,从而允许病毒通过血清型3受体而不是血清型5受体car进入细胞。
50.在oncos
‑
102腺病毒中,存在天然e1a启动子,即其未被另一种启动子替代。
51.简言之,在oncos
‑
102腺病毒中,gm
‑
csf处于内源性病毒e3控制元件之下,其导致在感染后约8小时开始复制相关的转基因表达。病毒以肿瘤选择性方式复制,从而导致gm
‑
csf的肿瘤局限性产生。通过24
‑
bp缺失实现了肿瘤特异性,这消除了e1a的rb
‑
结合部位,并且如先前报道中所证实的,病毒选择性地在具有p16
‑
rb途径缺陷的细胞(包括大多数(如果不是全部的话)人癌症)中复制。oncos
‑
102腺病毒的溶瘤效力显示比野生型对照病毒更有效。
52.表达gm
‑
csf的溶瘤腺病毒在通过溶瘤作用直接作用于癌细胞的同时诱导抗癌免疫力。gm
‑
csf是与抗原呈递细胞(apc)(主要是树突状细胞)的募集和成熟以及先天免疫力武装的细胞的募集相关的全身性抗肿瘤免疫力的强效诱导剂。然而,系统性升高的细胞因子水平代表毒性副作用的风险。除了由gm
‑
csf的高血清浓度介导的副作用的直接风险以外,还存在由骨髓来源的抑制性细胞(mdsc)的募集引起的间接风险。虽然mdsc的免疫抑制作用通常对癌症患者有潜在危害,但在癌症免疫疗法的情况下,其可能特别适得其反。因
此,将gm
‑
csf表达局限于肿瘤部位是至关重要的。
53.oncos
‑
102腺病毒已在体外显示出良好的溶瘤潜力和具有功能活性的人gm
‑
csf的产生(koski等,2010)。在具有免疫能力的仓鼠中显示该病毒有效地阻止侵袭性同基因胰腺肿瘤的生长。通过测量病毒拷贝数显示了病毒在肿瘤中复制的证据。复制的选择性也得到证实,因为在直接注射的肝组织中病毒拷贝数没有增加。证实了gm
‑
csf在肿瘤中的局部复制相关的产生,而gm
‑
csf几乎没有渗漏到血清或肝脏中。还显示了将低剂量环磷酰胺与oncos
‑
102腺病毒组合可以增强抗肿瘤作用,而单独的环磷酰胺治疗不导致肿瘤生长的显著减少。
54.总体而言,用oncos
‑
102腺病毒治疗晚期癌症患者似乎是安全的,并且已经观察到可能有效的令人期待的迹象。虽然在单次剂量后病毒长期存在于血清中,但多次注射有可能改善肿瘤转导并增强抗肿瘤免疫力。
55.如本文所用的“化学疗法”是指化合物或药物在疾病治疗中的用途,尽管术语化学疗法最通常地与癌症治疗相关。癌症化学治疗性化合物包括近100种单独的药物。
56.化疗药物最常见的副作用是恶心和呕吐。大部分个体也患有骨髓抑制,或骨髓的抑制,所述骨髓产生红细胞、白细胞和血小板。这些和其他副作用也因免疫系统受到抑制而伴随着白细胞的破坏和缺乏产生以及机会性感染的相关风险而加剧。
57.广泛的化学治疗剂常见的其他副作用包括:脱发(秃发);食欲不振;体重减轻;口味变化;口腔炎和食道炎(炎症和疮);便秘;腹泻;疲劳;心脏损伤;神经系统变化;肺损伤;生殖组织损伤;肝损害;肾脏和泌尿系统损害。
58.已经显示癌细胞死亡可以是免疫原性的或非免疫原性的。免疫原性细胞死亡(icd)包括细胞表面结构的变化,导致促免疫原性因子的释放。随后,其吸引apc摄取肿瘤抗原,加工它们,最后引发抗肿瘤免疫反应(特异性抗肿瘤t细胞)。癌症治疗的成功,无论是使用化学疗法、溶瘤病毒还是两者的组合,均依赖于免疫原性肿瘤细胞死亡的诱导和抗肿瘤免疫反应的诱导。已知一些化学治疗剂和溶瘤腺病毒充当icd的强效诱导剂,因此对抗癌免疫反应具有有益影响,从而促成抗肿瘤活性。可通过icd生物标志物诸如钙网蛋白(crt)在外层质膜中的存在,然后高迁移率组匣1蛋白(hmgb1)和三磷酸腺苷(atp)的细胞外释放来评估icd。
59.如较早公开的,使用oncos
‑
102腺病毒的癌症治疗以及利用化学治疗剂的疗法在单独使用时已显示出一定功效。本发明人想要研究腺病毒基因疗法与其他疗法(诸如常规疗法)的组合在mm的治疗方面是否可以比单独任一种更加有效。
60.如本文所用的“联合疗法”是指向有此需要的患者施用oncos
‑
102与化学治疗剂,优选或者培美曲塞和顺铂或者培美曲塞和卡铂。在联合疗法中,病毒以及化学治疗剂可以在几天内以若干次剂量施用。可在开始病毒施用之前开始化学治疗剂的施用,并且还可在施用病毒剂量期间进一步施用化学治疗剂的剂量。治疗方案还可包括首先用病毒引发,随后施用化学治疗剂,然后继续施用病毒与化学治疗剂两者。在另一个实施方案中,联合疗法首先包含化学治疗剂培美曲塞和顺铂,但在联合治疗期间,将顺铂换成卡铂。这可能是必需的,例如因为当在疗法中使用顺铂时出现过度的副作用。其他药物也可与该联合疗法同时施用。
61.如本文所用,“同时”是指已在如本文所述的联合疗法之前、之后或与之同时施用
的药物或疗法。同时疗法的时间可从几分钟到数周不等。通常,与本文所述的联合疗法同时进行的疗法持续数天或数周。
62.如本文中所用,术语“引发”是指具有常规细胞毒性化学疗法能力的诱导凋亡的预处理的使用。用溶瘤病毒进行的肿瘤引发导致免疫原性癌细胞死亡,其与细胞表面上钙网蛋白的呈递和天然佐剂(特别是高迁移率组蛋白b1(hmgb1))和atp从死亡细胞内的释放相关,最终导致dc刺激并随后激活适应性免疫反应。这种病毒诱导的肿瘤环境变化在引发有意义的抗肿瘤免疫反应中是必需的。抗原呈递细胞从垂死的肿瘤细胞中捕获肿瘤抗原并加工它们以用于mhc i类和ii类呈递,迁移到引流淋巴结并刺激抗原特异性b和t细胞。例如,oncos
‑
102腺病毒可导致细胞毒性肿瘤特异性cd8 t细胞的诱导。如本文中所用,术语“引发”还指化学治疗剂在施用病毒之前施用时,引起这种免疫原性癌细胞死亡的能力。另一方面,用化学治疗剂引发肿瘤也意味着使用诱导细胞凋亡的预治疗扩大间隙空间。
63.如本文中所用,术语“有效量”是指能够实现预期结果的化合物、治疗剂、病毒或药物的量。例如,化学治疗剂和/或腺病毒的有效量是足以实现有益的或期望的临床结果(包括临床结果)的量。有效量可以在一次或多次给药中施用。如本文中所述,有效量是足以改善、稳定、逆转、减缓和/或延迟恶性间皮瘤的进展或治愈恶性间皮瘤的量。在本发明中,化学治疗剂和oncos
‑
102腺病毒的效果可以例如通过监测肿瘤对所述治疗的反应来进行监测。可用本领域已知的任何合适方法进行肿瘤反应的监测。其可以例如用测量细胞免疫状态的方法诸如ranki等(2014)列出的那些方法来进行。例如,可通过测量肿瘤中肿瘤浸润性淋巴细胞的存在来进行监测,也可用微阵列监测th1型反应,以及还可在监测中使用ifnγ酶联免疫斑点测定(elispot)。
64.有效量因此是能够在肿瘤中引起所需的作用或反应或者所需要的量。如本领域所理解的,有效量可以变化,取决于患者病史以及其他因素,诸如所用化学治疗剂的类型和/或剂量等。
65.如本文中所用,术语“毒性”是指与化学治疗剂的施用相关的毒性事件。此类事件包括但不限于嗜中性白细胞减少症、血小板减少症、中毒死亡、疲劳、厌食、恶心、皮疹、感染、腹泻、粘膜炎和贫血。可用本领域已知的任何常规方法监测毒性作用。
66.如本文所用,术语“治疗期”是指进行联合治疗时的时间段。治疗期可由oncos
‑
102和化学治疗剂的数次施用组成,其中可在多个周期中进行施用。治疗期可持续数周或数月。治疗期可持续长达一年。
67.如本文中所用,术语“施用期”是指向患者施用腺病毒、化学治疗剂或其他药物的时间段。在施用期期间,可施用单次剂量或数次剂量的所述药剂。施用期可以是数分钟、数小时、数天、数周或数月。施用期可由周期组成。例如,可在化学治疗剂的施用中使用三周(21天)的周期。
68.基于铂的抗肿瘤药物(非正式地称为铂类(platins))是治疗癌症的化学治疗剂。它们是铂的配位络合物(coordination complex)。卡铂和顺铂是基于铂的抗肿瘤药。
69.培美曲塞在化学上与叶酸类似,属于称为叶酸抗代谢物的化疗药物类别。培美曲塞通过抑制嘌呤和嘧啶合成中使用的三种酶
‑
胸苷酸合酶(ts)、二氢叶酸还原酶(dhfr)和甘氨酰胺核糖核苷酸甲酰基转移酶(garft)起作用。通过抑制前体嘌呤和嘧啶核苷酸的形成,培美曲塞防止dna和rna的形成,而这是分裂的正常细胞和癌细胞的生长和存活所必需
的。
70.培美曲塞已被fda批准用于与顺铂联合治疗不可切除的mpm(分别为500mg/m2和75mg/m2)。大型iii期emphacis试验显示,使用顺铂和培美曲塞治疗的患者与单独使用顺铂相比,结果有改善。还显示组合组中患者的中位存活期为12个月,相比之下,仅使用顺铂的中位存活期为9个月(p=0.02)。由于顺铂在许多mm患者中存在高毒性,卡铂已被作为替代品进行了测试。然而,这些一线化学治疗剂均显示对mm的疗效很低。
71.通常针对具体的施用途径来配制治疗性组合物。在本文所述的联合疗法中,培美曲塞以其有效浓度使用。例如,对于mm的治疗,培美曲塞可以以高达500mg/m2的总日剂量进行施用。当使用21天的周期时,培美曲塞可以例如在每个21天周期的第1天以10分钟静脉内(i.v.)输注进行施用。例如,在副作用的情况下,剂量可以更低,诸如200mg/m2至450mg/m2,更优选250mg/m2至375mg/m2。适当时还可腹膜内施用培美曲塞。
72.在本文所述的联合疗法中,顺铂以其有效浓度使用。在mm的治疗中,顺铂的典型剂量是在培美曲塞输注结束后约30分钟开始后,经2小时的75mg/m2静脉内输注。施用的顺铂的量可在30mg/m2至75mg/m2之间变化。例如在副作用的情况下,剂量可以较低,诸如30mg/m2至70mg/m2,更优选35mg/m2至60mg/m2,最优选37.5mg/m2至56.25mg/m2。适当时也可腹膜内施用顺铂。
73.在利用oncos
‑
102腺病毒的联合疗法中,顺铂和培美曲塞可以以0.75:10至3:10的摩尔比施用。最优选地比例为1.5:10。
74.在本文所述的联合疗法中,卡铂以其有效浓度使用。在mm的联合治疗中,对于肾功能正常的患者,卡铂的典型剂量为400mg/m2。可从已在约10分钟的时间内输注的培美曲塞输注结束后约30分钟开始,经30
‑
60分钟静脉内输注卡铂。然而,卡铂的剂量通常根据calvert公式(以mg而不是以mg/m2计算的)计算:总剂量(mg)=(目标auc)x(gfr 25),该公式考虑患者的肾小球滤过率(gfr)和浓度对比时间曲线下的目标面积(以mg/ml x min计的auc)。因此可以例如因副作用,尤其因肾功能降低而调节和降低卡铂剂量。
75.在利用oncos
‑
102腺病毒的联合疗法中,施用剂量通常为约500mg/m2的培美曲塞和约auc 5的卡铂。在一个优选实施方案中,并且在患者肾功能正常的情况下,可以施用约500mg/m2的培美曲塞和约400mg/m2的卡铂。然而,施用量可以在250mg/m2与500mg/m2的培美曲塞之间和200mg/m2与400mg/m2的卡铂之间变动。在某些情况下,特别是当化学治疗剂显示毒性作用时,可施用约375mg/m2的培美曲塞和约300mg/m2的卡铂。因此,培美曲塞和卡铂可以5:4的摩尔比施用。然而,该比例可在5:8与5:2之间变化。
76.本发明的一个目的是oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中向有此需要的患者联合施用所述病毒与两种化学治疗剂。
77.在本文所述的联合疗法中,可以以数个剂量并在与化学治疗剂不同的时间施用oncos
‑
102腺病毒,化疗剂也可以以数个剂量施用。
78.本发明的另一个目的是oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中向患者联合施用所述病毒与两种化学治疗剂,并且其中所述两种化学治疗剂是培美曲塞和顺铂或培美曲塞和卡铂。
79.本发明的另一个目的是oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中向有此需要的患者联合施用所述病毒与与培美曲塞和顺铂,并且其中培美曲塞与顺铂之间的摩尔比
为10:0.75至10:3。
80.本发明的另一个目的是oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中向有此需要的患者联合施用所述病毒与培美曲塞和顺铂,并且其中培美曲塞与顺铂之间的摩尔比为10:1.5。
81.本发明的另一个目的是oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中向患者联合施用所述病毒与培美曲塞和卡铂,其中培美曲塞与卡铂的摩尔比为5:8至5:2。
82.本发明的另一个目的是oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中向有此需要的患者联合施用所述病毒与培美曲塞和卡铂,其中培美曲塞与卡铂之间的摩尔比为5:4。
83.在本发明的优选实施方案中,除了oncos
‑
102与培美曲塞和顺铂或培美曲塞和卡铂以外,还可使用环己酰胺、氰钴胺(cyanocobolamine)、叶酸和地塞米松的各种组合。更具体地,从由环己酰胺、氰钴胺、叶酸和地塞米松组成的药剂列表中,可将一种、两种、三种或四种及其任何组合与包含oncos
‑
102和培美曲塞和顺铂或oncos
‑
102和培美曲塞和卡铂的联合疗法同时使用。作为一个实例,可在施用所述联合疗法的化学治疗剂之前、期间和之后施用一种或多种减少或消除超敏反应的辅助剂,诸如在施用化学治疗剂之前、期间和之后施用地塞米松、叶酸和维生素b12来治疗受试者。在某些实施方案中,通过以下方式治疗受试者:在化学治疗剂施用前一天、当天和一天后口服2
‑
25mg地塞米松;在从施用化学治疗剂之前7天开始,在至少一个治疗期内,以及在最后一次施用化学治疗剂后持续21天的时期内,每天口服400
‑
1000μg叶酸;以及在治疗期间首次施用化学治疗剂之前1周肌内注射1000μg维生素b12。
84.可使用任何常规方法向有此需要的患者施用oncos
‑
102。施用途径取决于组合物的配方或形式、疾病、肿瘤的位置、患者、并发症和其他因素。在本发明的一个优选实施方案中,通过肿瘤内、肌内、动脉内、胸膜内、膀胱内、腔内或腹膜内注射或口服施用进行施用。优选地,施用以肿瘤内注射或腹膜内注射进行。
85.可以根据肿瘤的位置和大小为每个患者进行个性化注射。例如,可以以0.5ml至10ml的体积注射(i.t.)病毒。可以对数个,优选多达五个不同的肿瘤部位进行注射。腹膜内剂量的体积可在200ml与800ml之间变化。优选地,施用体积为500ml。
86.载体的有效剂量至少取决于需要治疗的受试者、肿瘤类型、肿瘤的位置和肿瘤的阶段。剂量可以例如从约108个病毒颗粒(vp)变化至约10
14
个vp,优选约5x109个vp至约10
13
个vp,更优选约8x109个vp至约10
12
个vp。在本发明的一个具体实施方案中,剂量在约5x10
10
‑
5x10
11
个vp的范围内。因此,待施用的oncos
‑
102腺病毒的量可以在5x10
10
‑
5x10
11
个vp的范围内。优选地,oncos 102以3x10
11
个vp/5ml施用。另一方面,在以噬斑形成单位表示的情况下,可通过直接注射至所述患者的恶性间皮瘤肿瘤中或腹膜内而以约108‑
10
12
个噬斑形成单位的剂量施用oncos
‑
102。
87.本发明的一个目的是用于治疗人恶性间皮瘤的oncos
‑
102腺病毒,其中向有此需要的患者联合施用所述病毒与两种化学治疗剂,并且其中所述病毒的量为5x10
10
至5x10
11
个vp。
88.本发明的另一个目的是用于治疗人恶性间皮瘤的oncos
‑
102腺病毒,其中向患者联合施用所述病毒与两种化学治疗剂,并且其中以3x10
11
个vp/5ml的量施用病毒。
89.本发明的另一方面是用于治疗人恶性间皮瘤的oncos
‑
102腺病毒,其中向患者联
合施用病毒与两种化学治疗剂,并且其中化学治疗剂和病毒以有效量施用。
90.本发明的另一个目的是用于治疗人恶性间皮瘤的oncos
‑
102腺病毒,其中向有此需要的患者联合施用病毒与两种化学治疗剂,并且其中病毒通过腹膜内施用或通过直接注射到肿瘤内来施用,两种化学治疗剂通过静脉内或腹膜内途径施用。
91.根据本发明的一个方面,oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中向有此需要的患者联合施用病毒与两种化学治疗剂,并且其中在施用两种化学治疗剂之前,以及在所述化学治疗剂施用期期间施用病毒。
92.根据本发明的另一方面,oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中在施用病毒之前以及在所述病毒的施用期期间施用所述两种化学治疗剂。
93.根据一个优选实施方案,可将联合疗法的药剂与第一次引发一起施用,其中在1个月至10个月的时期内施用病毒1至10次,然后例如在开始病毒施用后1至4周施用化学治疗剂。施用可以例如按以下顺序进行:通过在4个月的时期中向需要的受试者施用病毒6次来进行利用病毒的引发。通常,在治疗期开始时,各剂量之间的时间短于治疗进行时的时间。在开始施用病毒三周后,可以开始施用化学治疗剂,优选培美曲塞和顺铂或培美曲塞和卡铂。可以继续施用化学治疗剂,使得例如在约三周的周期中进行总共六次施用。施用次数可从一次到六次不等。
94.本发明的溶瘤腺病毒载体诱导病毒体介导的肿瘤细胞的溶瘤作用并激活针对肿瘤细胞的人免疫反应。在本发明的一个优选实施方案中,该方法或用途还包括施用能够下调受试者中的调节性t细胞的物质。“能够下调调节性t细胞的物质”是指减少被鉴定为t抑制者或调节性t细胞的细胞量的试剂。这些细胞已被鉴定为由以下免疫表型标记中的一种或多种组成:cd4 、cd25 、foxp3 、cd127
‑
和gitr 。减少t抑制者或调节性t细胞的此类药剂可选自抗cd25抗体或化学治疗剂。
95.转基因gm
‑
csf的免疫调节功能是武装的溶瘤腺病毒的中心作用机制,此外,腺病毒本身是免疫系统的强激活剂,这显著促成了病毒的整体抗肿瘤功效。
96.如本文所用的“病毒敏化剂”是指可提高溶瘤病毒功效的试剂。适用于此类联合疗法或可用作病毒致敏剂的药剂包括但不限于全反式维甲酸、阿扎胞苷、硫唑嘌呤、博来霉素、卡铂、卡培他滨、顺铂、苯丁酸氮芥、环磷酰胺、阿糖胞苷、柔红霉素、多西他赛、多西氟尿苷、多柔比星、表柔比星、埃博霉素、厄洛替尼、依托泊苷、氟尿嘧啶、吉西他滨、羟基脲、伊达比星、伊马替尼、盐酸氮芥、巯基嘌呤、甲氨蝶呤、米托蒽醌、奥沙利铂、紫杉醇、培美曲塞、替莫唑胺、替尼泊苷、硫鸟嘌呤、戊柔比星、长春碱、长春新碱、长春地辛和长春瑞滨。优选地,待使用的病毒敏化剂是环磷酰胺。
97.检查点抑制剂,诸如抗pd
‑
1/pd
‑
l1或抗
‑
ctla4抗体(诸如pembrolizumab、nivolumab或伊匹木单抗)也适合与联合疗法一起使用。
98.本发明的一个方面是用于治疗患者的恶性间皮瘤的方法,其包括向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤。以有效量施用vegf
‑
102腺病毒和两种化学治疗剂。
99.本发明的另一方面是治疗患者的恶性间皮瘤的方法,其包括以足以杀死恶性间皮瘤细胞或防止恶性间皮瘤细胞生长的量和时间向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤。
100.本发明的一个优选方面是用于治疗患者的恶性间皮瘤的方法,其包括向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤,其中所述化学治疗剂是培美曲塞和顺铂或培美曲塞和卡铂。
101.本发明的另一个优选方面是用于治疗患者的恶性间皮瘤的方法,其包括向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤,其中首先施用所述化学治疗剂,然后开始病毒的施用期,并且可在病毒的施用期期间施用所述化学治疗剂。
102.本发明的另一个优选方面是用于治疗患者的恶性间皮瘤的方法,其包括向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤,其中首先施用病毒,然后开始化学治疗剂日的施用期,并且也可在所述化学治疗剂的施用期期间施用病毒。
103.本发明的另一个优选方面是用于治疗患者的恶性间皮瘤的方法,其包括向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤,其中向所述患者施用oncos
‑
102腺病毒1至10次,并且向患者施用化学治疗剂1至6次。
104.本发明的另一个优选方面是用于治疗患者的恶性间皮瘤的方法,其包括向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤,其中通过直接注射至所述患者的恶性间皮瘤肿瘤内或以108‑
10
12
个噬斑形成单位的剂量进行腹膜内注射来进行所述oncos
‑
102的施用。
105.本发明的另一个优选方面是用于治疗患者的恶性间皮瘤的方法,其包括向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤,其中待施用的oncos
‑
102腺病毒的量在5x10
10
‑
5x10
11 vp的范围内。
106.本发明的另一个优选方面是用于治疗患者的恶性间皮瘤的方法,其包括向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤,其中以250mg/m2至500mg/m2的培美曲塞和30mg/m2至75mg/m2的顺铂的剂量,或以250mg/m2至500mg/m2的培美曲塞和200mg/m2至400mg/m2的卡铂的剂量施用所述化学治疗剂。
107.本发明的另一方面是oncos
‑
102腺病毒在治疗人恶性间皮瘤中的用途,其中向患者联合施用所述病毒和两种化学治疗剂。
108.可以在联合治疗的时期期间向患者同时施用环磷酰胺(cpo)。环磷酰胺是一种常见的化学治疗剂,其也已用于某些自身免疫性病症。已显示环磷酰胺通过几种机制提高溶瘤病毒的功效。其抑制先天性抗病毒反应,减缓抗溶瘤病毒中和抗体的产生,可靶向t
‑
regs并且可影响肿瘤血管系统,增强溶瘤病毒外渗。数项临床前研究表明,环磷酰胺可以延缓溶瘤病毒的免疫清除,增强病毒感染的持久性并延长治疗效果。在本发明中,环磷酰胺可用作病毒敏化剂以增强病毒复制和gm
‑
csf诱导的对nk和细胞毒性t细胞的刺激(以增强抗肿瘤的免疫反应)的作用。其可以以静脉推注剂量或低剂量口服节律性施用方式进行施用。可用于本发明的实施方案的其他合适的病毒敏化剂包括替莫唑胺和厄洛替尼。
109.为了减少调节性t细胞,患者将在每次注射oncos 102之前1至3天接受低剂量cpo。cpo将例如以300mg/m2的静脉推注方式施用。推注可在100和600mg/m2之间变化。cpo的施用途径也可以是例如口服给药。也可使用节律性化学疗法。
110.此外,还可在开始联合疗法之前以及在联合治疗期间向患者施用叶酸。可在施用第一剂联合疗法的化学治疗剂之前至少五天开始叶酸的施用。例如,可以在开始施用联合疗法的化学治疗剂之前1
‑
2周开始施用。可以每日施用叶酸(口服施用;po),并且在联合治
疗期间也可以继续施用。施用可持续至最后一剂化学治疗剂后约三周。叶酸的典型剂量为4mg(po)。本发明的一个优选方面是用于治疗有此需要的患者的间皮瘤的方法,其包括(a)向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤,以及向所述患者施用叶酸的步骤。
111.可以在开始联合疗法之前以及在联合疗法期间向患者施用氰钴胺(维生素b12)。通常在开始施用联合疗法的化学治疗剂之前1
‑
2周开始氰钴胺的施用。可以例如以9周的间隔以及也可在联合疗法期间通过肌内注射(i.m.)施用氰钴胺。施用可持续至最后一剂化学治疗剂后约三周。氰钴胺的典型量是1000mcg(μg)。本发明的一个优选方面是用于治疗有此需要的患者的间皮瘤的方法,其包括(a)向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤以及向所述患者施用氰钴胺的步骤。
112.叶酸和氰钴胺通常用于减少与治疗相关的血液学和胃肠道毒性。这些副作用可能与例如培美曲塞的施用相关。
113.还可向经历联合疗法的患者施用地塞米松。通常,在施用联合疗法的化学治疗剂的前一天、当天和一天后施用地塞米松。可以以4mg bd(即一天两次)施用地塞米松5天,以及以每三周一次的频率施用多达六个周期。本发明的一个目的是用于治疗有此需要的患者的间皮瘤的方法,其包括(a)向所述患者oncos
‑
102腺病毒和两种化学治疗剂和(b)向患者施用地塞米松的步骤。
114.本文所述的联合疗法还可包括向患者施用环磷酰胺。本发明的一个目的是用于治疗有此需要的患者的间皮瘤的方法,其包括(a)向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤,并且还包括在步骤(a)之前向患者施用环磷酰胺。
115.本发明的另一方面是用于减少患者的肿瘤生长的方法,其中所述方法包括在其中所述患者中的肿瘤生长被减小的条件下向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂。
116.所述方法可包括在施用联合疗法之前将患者鉴定为患有肿瘤。肿瘤诊断可用任何常规方法进行。可以例如使用诊断成像技术将患者鉴定为患有肿瘤。该方法还可包括在向患者施用联合疗法后测量肿瘤生长的减少。可以通过任何常规方法研究肿瘤的减少。可以例如使用诊断成像技术测量肿瘤生长减少。
117.本发明的另一方面是使用联合疗法来抑制肿瘤的生长。肿瘤生长的抑制的标志可以例如是肿瘤重量的减少和肿瘤体积的减少。此外,联合疗法可用于抑制肿瘤的扩散。
118.还应注意,对应于与治疗相关的病变大小增加的肿瘤假性进展可影响旨在揭示当前联合疗法对肿瘤大小的效果的成像追踪的结果。在约30%的患者中,在联合化疗和放射疗法后观察到这种效应。因此,当使用如本文所述的联合疗法时,假性进展可存在于患者的某些部位中。对于那些患者,肿瘤尺寸的减小不是疗法有效性的合适指标。
119.还公开了减少癌细胞生长的方法,其包括向需要治疗的受试者施用有效量的oncos
‑
102腺病毒和两种化学治疗剂。
120.还公开了抑制或杀死人患者中的肿瘤或癌细胞的方法,其包括用oncos
‑
102腺病毒和两种化学治疗剂治疗患者,其中所述化学治疗剂是培美曲塞和顺铂或培美曲塞和卡铂。
121.此外,公开了杀死肿瘤或癌细胞的方法,其包括使肿瘤或癌细胞与oncos
‑
102腺病
毒和两种化学治疗剂接触,其中所述化学治疗剂是培美曲塞和顺铂或培美曲塞和卡铂。
122.此外,还公开了用于治疗恶性间皮瘤的方法,其包括向有此需要的受试者施用有效量的oncos
‑
102腺病毒和有效量的两种化学治疗剂,以提供与单独施用oncos腺病毒的效果或不与所述病毒一起施用所述两种化学治疗剂的效果相比具有增强的治疗效果的联合疗法。
123.在本发明的一个实施方案中,oncos
‑
102作为原位癌症疫苗发挥作用。如本文所用,“原位癌症疫苗”是指这样的癌症疫苗,其既杀死肿瘤细胞又增加针对肿瘤细胞的免疫反应。病毒复制是向免疫系统发出强烈的危险信号(=th1型反应所需的),因此可以充当对gm
‑
csf介导的apc成熟和活化以及nk细胞募集的强大共刺激现象。肿瘤细胞裂解还有助于向apc呈递肿瘤片段和表位,此外,通过炎症产生共刺激。因此,在每个肿瘤的背景下产生不依赖于表位(即非hla局限性的)的反应,该反应因此原位发生。当肿瘤细胞裂解后从垂死细胞释放特异性肿瘤抗原时,肿瘤特异性免疫反应在肿瘤环境中被激活。
124.在本发明的一个优选实施方案中,该方法或用途还包括向受试者施用同时放射疗法。
125.在本发明的一个优选实施方案中,该方法或用途还包括向受试者施用自噬诱导剂。自噬是指牵涉通过溶酶体机制降解细胞自身组分的分解代谢过程。“自噬诱导剂”是指能够诱导自噬的药剂,并且可以选自但不限于mtor抑制剂、pi3k抑制剂、锂、他莫昔芬、氯喹、巴弗洛霉素、替西罗莫司、西罗莫司和替莫唑胺。在本发明的一个具体实施方案中,该方法还包括向受试者施用替莫唑胺。替莫唑胺可以是口服或静脉内替莫唑胺。
126.本发明的一个目的是开发oncos
‑
102溶瘤腺病毒和化学治疗剂的新型治疗上有效的用途,其与单独使用病毒疗法或仅使用化学疗法相比,具有改善的安全性和提高的癌症疗效。
127.目前的实验结果表明,oncos
‑
102作为单一疗法在体外杀死人间皮瘤细胞系,并在治疗难治性h226恶性胸膜间皮瘤异种移植物模型中显示出一定的抗肿瘤活性。相反,恶性间皮瘤的目前的护理标准(soc)化学治疗方案(培美曲塞 顺铂或培美曲塞 卡铂)在该间皮瘤异种移植模型中没有显示出抗肿瘤功效。然而,令人惊讶的是,当oncos
‑
102与soc化疗方案组合时,观察到协同的抗肿瘤作用。该数据为将oncos
‑
102与soc化疗联合用于治疗恶性间皮瘤提供了强有力的理论依据。
128.化学疗法
‑
当与oncos
‑
102一起施用时
‑
增加了目前的异种移植模型中icd标志物的表达。早先已经显示,oncos
‑
102在仓鼠中产生功能性人gm
‑
csf,诱导肿瘤特异性免疫力,表明gmc
‑
sf可能也参与当前异种移植模型中树突状细胞(dc)的募集和激活,导致t细胞的刺激,和最后抗肿瘤免疫力的产生。在实施例中详细描述的人间皮瘤癌症模型中,gm
‑
csf的功能因免疫缺陷型鼠的免疫系统而丧失。然而,gm
‑
csf对针对间皮瘤的免疫系统调节的效用已经在临床研究中得到证实(ranki等,2014)。
129.先前的临床数据已经证明,oncos
‑
102能够在化学疗法难治性的恶性胸膜间皮瘤患者中引发肿瘤特异性免疫应答,意指细胞毒性肿瘤特异性cd8 t细胞的诱导(ranki等,2014)。然而,在目前的免疫缺陷型动物模型中,在开始化学疗法之前用oncos
‑
102引发并未显示出任何额外的益处。这并不奇怪,因为免疫系统在免疫缺陷型小鼠模型中几乎不起作用。
130.目前的数据强有力地表明,oncos
‑
102联合一线化学疗法可用作针对mm的有效治疗。由于其安全性特征,oncos
‑
102仅在肿瘤局部复制并且对间皮瘤细胞表现出高度趋向性。在动物研究期间未报告有主要副作用。联合治疗显示出协同作用,是对间皮瘤的最有效疗法,因此也比标准的一线化学疗法更有效。另外,oncos
‑
102与化学疗法的组合是一种有力的工具,其因免疫原性肿瘤细胞死亡的诱导增强和最终抗癌免疫反应的诱导而克服了肿瘤微环境中的免疫抑制微环境的主要障碍。本发明人已显示,联合治疗导致icd增加,表明肿瘤免疫原性细胞死亡的活性增强。另外,根据本发明的联合治疗改善了间皮瘤细胞中oncos
‑
102的感染性。该动物模型中的gm
‑
csf功能丧失,但从先前的研究中已知,该细胞因子通过直接募集apc和天然杀伤细胞以及通过在肿瘤部位激活apc和使其成熟而发挥重要作用。
131.除了使得能够将载体转运到目标部位以外,本发明的腺病毒载体还确保了转基因的表达和持久性。此外,针对载体以及转基因的免疫反应也被最小化。
132.本发明解决了与常规治疗的治疗抗性相关的问题。此外,本发明还提供了用于选择性治疗的工具和方法,其在健康组织中具有较低的毒性或损害。与其他治疗剂相比,本发明的有利方面还包括不同的和减少的副作用。重要的是,该方法与包括放射疗法在内的许多其他形式的疗法具有协同作用,因此适合用于组合方案。
133.本发明实现了癌症治疗,其中肿瘤细胞被病毒体引起的溶瘤作用破坏。另外,募集激活人免疫应答的各种不同机制,包括自然杀伤细胞(nk)和树突状细胞(dc)的激活,用于本发明的治疗用途。
134.因此,本技术描述了策略并提供了有效地招募宿主的免疫系统抵抗恶性细胞并在恶性细胞中同时提供直接溶瘤和化学治疗活性,同时保持极好的安全记录的方法和手段。
135.本发明的方面涉及用于在癌症疗法中实现高效和准确的基因转移以及增加的特异性和足够的肿瘤杀伤能力的新型方法和手段。
136.利用与化学治疗剂的使用组合的溶瘤腺病毒的创造性疗法的意外功效提供了治疗功效的显著提高(与恶性间皮瘤的目前护理标准(soc)化学治疗方案(培美曲塞 顺铂或培美曲塞 卡铂)相比),如在体内研究中所证明的。
137.总之,所提供的数据为将oncos
‑
102与一线化学疗法联合用于治疗恶性间皮瘤提供了强有力的理论依据。
实施例
138.给出以下实施例仅用于举例说明本发明的各种实施方案的目的,它们不意味着限制本发明。本领域技术人员将容易理解,本发明非常适合于实现该目的并获得上述目的和有利方面,以及本文固有的那些目的、目标和有利方面。本领域技术人员将想到其中的变化和包含在由权利要求的范围限定的本发明的精神内的其他用途。
139.oncos
‑
102的构建
140.先前(wo2010/072900和koski等)已经描述了编码人gm
‑
csf(oncos
‑
102)的嵌合溶瘤腺病毒的构建和表征。简言之,使用标准腺病毒制备技术产生和扩增ad5/3
‑
d24
‑
gmcsf。通过在大肠杆菌(escherichia coli)中同源重组ad5/3luc1病毒基因组与padeasy
‑
1的bstxi消化的8.9kb片段,产生含有嵌合5/3纤维、padeasy5/3的padeasy
‑
1衍生质粒。随后,
用pmei将含有e1a中的24bp缺失的穿梭载体(pshuttled24)线性化,并与padeasy5/3重组,得到pad5/3
‑
d24。为了将人gmcsf基因插入e3区,通过将来自ad5基因组的spei至ndei片段插入到pgem5zf
(promega,madison,wi)的多克隆位点,产生了e3克隆性载体pthsn。用suni/muni进一步消化pthsn,在e3区域产生965bp的缺失(6.7k和gp19k被缺失)。编码人gm
‑
csf的432bp互补dna(invitrogen,carlsbad,ca)用该基因侧翼的特异性限制性位点suni/muni的特征性引物扩增,然后将其插入到经suni/muni消化的pthsn中。通过在大肠杆菌中在fspi线性化的pthsn
‑
gmcsf与srfi线性化的pad5/3
‑
d24之间的同源重组,产生pad5/3
‑
d24
‑
gmcsf。通过paci消化释放ad5/3
‑
d24
‑
gmcsf病毒基因组,并将其转染至a549细胞中以用于扩增和拯救。克隆的所有阶段均通过pcr和多重限制性消化进行确认。对穿梭质粒pthsn
‑
gm
‑
csf进行测序。利用pcr确认不存在野生型e1。通过测序和pcr检查最终病毒中的e1区、转基因和纤维。根据oncos therapeutics(helsinki,finland)的cgmp原理,在a549细胞上进行病毒生产,以避免野生型重组的风险。病毒原液缓冲液配方为10mmol/l trizma碱,75mmol/l nacl,5%(wt/vol)蔗糖,1mmol/l mgcl,10mmol/l l( )组氨酸,0.5%(vol/vol)etoh,0.02%tween,100μmol/l edta;使用0.9%(wt/vol)nacl溶液(b.braun,melsungen,germany)作为稀释剂。oncos
‑
102由biovian(turku,finland)在glp中生产并于
‑
80℃下储存直至使用。对于使用,在即将施用前解冻oncos
‑
102,并储存在冰上直至使用。解冻后,将oncos
‑
102在层流箱中稀释以获得所需浓度,制备注射器并储存在冰上直至使用。
141.细胞系
142.将人上皮样间皮瘤细胞系jl
‑
1(acc 596,购自dsmz)培养在达克伯克改良伊格尔培养基(dmem,10567
‑
014,gibco)中,所述培养基补充有20%热灭活的胎牛血清(fbs,16000
‑
044,gibco)、2mm l
‑
谷氨酰胺、1%青霉素和链霉素(15140
‑
122,gibco)。将人恶性双相间皮瘤msto
‑
211h(acc390,购自dsmz)和人上皮间皮瘤nci
‑
h226(h226,crl
‑
5826,购自atcc)培养在补充有10%热灭活的fbs(16000
‑
044,gibco)、2mm l
‑
谷氨酰胺、1%青霉素和链霉素(15140
‑
122,gibco)的rpmi 1640(a10491
‑
01,gibco)中。将所有细胞系在37℃和5%co2下进行孵育。
143.化学治疗剂
144.培美曲塞二钠(sc
‑
219564)、顺铂(sc
‑
200896)和卡铂(sc
‑
202093)均购自santa cruz biotechnology,并在使用前将其于无菌水中重构。
145.将10mg培美曲塞(pem)悬浮于1ml无菌水中,得到10mg/ml的溶液。将该溶液用作原液并在室温下储存。加入溶液后,将物质摇动1分钟至5分钟,得到均匀的溶液。将原液在0.9%nacl中进一步稀释,使用10mg/kg/小鼠(于100μl中)。
146.将150mg顺铂(cis)悬浮于150ml无菌水中,得到1mg/ml的溶液。将该溶液用作原液并在室温下储存。加入该溶液后,将物质摇动1分钟至5分钟,得到均匀的溶液。将原液在0.9%nacl中进一步稀释,并使用1.5mg/kg/小鼠(于100μl中)。
147.将25mg卡铂(car)悬浮于10ml 0.9%的nacl中,得到2.5mg/ml溶液。将该溶液用作原液并在室温下储存。加入溶液后,将物质摇动1分钟至5分钟,得到均匀的溶液。将原液进一步稀释,并使用8mg/kg/小鼠(于100μl中)。
148.细胞活力
‑
体外肿瘤细胞杀伤试验
149.将间皮瘤细胞以每孔1.0x104个细胞接种在96孔板上。孵育过夜后,用oncos
‑
102感染细胞,其中病毒颗粒/细胞比率为10(vp/细胞)。将病毒和化学治疗剂在含有5%fbs的培养基中稀释。分别以下列次优的先前选择的浓度测试培美曲塞、顺铂和卡铂:0.625mg/ml、0.0026mg/ml、0.0625mg/ml(h226细胞);0.625mg/ml、0.0006mg/ml、0.00196mg/ml(jl
‑
1细胞);0.083mg/ml、0.0026mg/ml、0.0625mg/ml(msto
‑
211h细胞)。评估了八种不同的治疗组合:单独的oncos
‑
102、培美曲塞 顺铂、培美曲塞 卡铂、oncos
‑
102 培美曲塞 顺铂、oncos
‑
102 培美曲塞 卡铂、oncos
‑
102 培美曲塞 顺铂(引发:首先施用病毒,感染后24小时加入化学疗法)、oncos
‑
102 培美曲塞 卡铂(引发:首先施用病毒,感染后24小时加入化学疗法)和模拟(仅生长培养基)。3天后,通过mts根据制造商的说明书(g3582,promega)测定细胞活力。
150.体外凋亡和坏死细胞的分析
151.将间皮瘤细胞以5x105个细胞/孔接种到6孔板上。根据上述治疗方案,用补充有化学治疗剂的10vp/细胞的oncos
‑
102感染细胞。48小时后,根据制造商的说明书,通过流式细胞仪(4830
‑
01
‑
k,trevigen inc.),用tacs annexin v
‑
fitc试剂盒测量凋亡和坏死细胞的量。
152.体外肿瘤细胞死亡的免疫原性
153.crt暴露。将细胞系以5x105个细胞/孔一式两份接种到6孔板上。根据上述处理组合,用10vp/细胞的oncos
‑
102和/或化学治疗剂感染细胞。24小时(h226,j1
‑
1)和48小时(msto
‑
211h)后,收获细胞并用1:1000稀释的兔多克隆抗
‑
钙网蛋白抗体(ab2907,abcam)在4℃下染色40分钟,随后用1:100稀释的alexa
‑
fluor 488二抗(a21206,invitrogen)染色,并通过流式细胞术进行分析。
154.hmgb
‑
1释放。将细胞系一式三份接种到细胞培养板上,并根据上述治疗组合用10vp/细胞的oncos
‑
102和/或化学治疗剂进行感染。72小时后,收集上清液,并根据制造商的说明(st51011,ibl international)用elisa试剂盒测量hmgb
‑
1。
155.atp释放。将细胞系一式三份接种到细胞培养板上,并如上所述进行处理。在48小时(jl
‑
1、msto
‑
211h)和72小时(h226)后收集上清液,并根据制造商的方案(a22066,invitrogen)用atp测定试剂盒分析以用于发光分析。
156.体外病毒感染性
‑
免疫细胞化学分析(icc)
157.将间皮瘤细胞系以5个重复以6x105个细胞/孔接种在24孔板上,并用上述8种不同的处理组合进行处理。24小时后,吸出上清液,通过将细胞与冰冷的甲醇一起孵育15分钟(322415
‑
100ml,sigma
‑
aldrich)来固定细胞。oncos
‑
102感染性的测定基于感染细胞中病毒六邻体蛋白的目测定量。简言之,将细胞用1:2000稀释的小鼠抗
‑
六邻体抗体(nb600
‑
413,novus biologicals)在室温下于黑暗中染色1小时,随后用1:500稀释的缀合有生物素
‑
sp的二抗(115
‑
065
‑
062,jackson immuno research)在室温下于黑暗中染色1小时。随后以1:200加入extravidin
‑
过氧化物酶,并在室温下于黑暗中孵育30分钟(e2886
‑
1ml,sigma
‑
aldrich)。最后,通过添加染色剂dab进行长达5分钟(d3939
‑
1set,sigma
‑
aldrich)使感染的细胞可视化。对于每5个重复(孔),使用amg evo xl显微镜获取非重叠视野的5个图像。感染性数据表示为5个孔中的平均斑点数。
158.间皮瘤细胞系中的car、cd46和dsg2的表达
159.人腺病毒在附着于柯萨奇病毒b和ad受体(car)、cd46或桥粒芯糖蛋白2(dsg
‑
2)后感染细胞。间皮瘤细胞用小鼠单克隆抗
‑
car抗体(1μg/1x106个细胞)(sc
‑
56892fitc,santa cruz biotech)在4℃下标记40分钟,或用小鼠单克隆抗
‑
cd46抗体(1μg/1x106个细胞)(ab789,abcam)或小鼠单克隆抗
‑
dsg2抗体(1μg/1x106个细胞)(ab14415,abcam)在4℃下标记40分钟,随后用1:2000稀释的alexa
‑
fluor 488二抗(a21206,abcam)进行流式细胞术测量。
160.剂量水平和途径的论证
161.转基因gm
‑
csf的免疫调节功能是oncos
‑
102作用的中心机制。另外,腺病毒本身是先天免疫系统的强激活剂。balb/c裸鼠是免疫缺陷的,因此只能研究病毒的复制依赖性溶瘤功能,从而丧失了主要作用机制(免疫介导的作用)。剂量5e 7vp/肿瘤i.t.(1e 8vp/小鼠)是基于两个试验性研究的结果选择的,其中测试了剂量2e 8/小鼠和1e 8/小鼠(图5和6)。选择次优病毒剂量(=非治愈性)以允许评估oncos
‑
102和化学疗法的潜在累加和/协同组合效应。基于临床试验中使用的途径(即肿瘤内)选择注射途径。
162.基于技术可行性选择化学治疗剂的施用剂量和途径。
163.动物选择、随机化、小组分配、圈养、进食和水以及环境适应
164.将动物随机分成各组。将动物组保持在分开的笼子中,并将研究卡片附在笼子上。这些卡片上标有研究编号、处理组、个体动物id以及它们的来源和到达日期。用耳朵刺穿标记每个笼子中的动物个体以进行识别。一次只处理一个笼子以避免混淆笼子之间的动物。
165.将动物在湿度和温度受监测的环境中饲养在生物安全水平为2(bsl2)的设施中。将动物圈养在具有过滤盖(greenline,scanbur)的单独通风的塑料笼中。
166.给动物饲喂随意提供的标准颗粒饲料。在适应和研究期间随意供应水。
167.在开始实验部分之前使动物适应7天。在整个适应期间,所有动物都保持良好的健康状态。
168.临床观察
169.在适应和施用期期间每天观察所有动物的临床体征、发病率或死亡率,并且在每次处理后再另外观察60分钟。在实验过程中,由于肿瘤尺寸达到允许的最大值(任何直径为1.5cm),杀死小鼠。每天跟踪动物的健康状况,没有看到由于肿瘤引起的不适的迹象。在第63天用二氧化碳杀死小鼠,这是实验的终点。另外,还实施了颈椎脱臼。
170.在整个实验中跟踪动物的体重,并且在以下组中观察到轻微的体重减轻:pem cis(在第48天减少10%,在第60天减少11%)、oncos
‑
102引发 pem cis(在第48天减少9%,第60天减少12%)(图5b)、pem car(在第60天减少6%)(图6b)。在单独的oncos
‑
102或oncos
‑
102与培美曲塞和顺铂联合治疗(单个病例)的组中,很少有动物由于健康问题(>30%的体重减轻和皮肤问题(=皮疹))而被处死。这些不良事件可能与处理无关,因为两只模拟治疗的动物也患有皮肤问题(皮疹)。兽医被告知这些问题以进一步调查,但这些事件的原因仍不清楚。另外,尸检显示少数动物(pem cis;pem car)的肠(空肠和回肠)和胃的形态发生了一定变化。
171.肿瘤尺寸进展的分析
172.在细胞注射后8天开始测量并记录肿瘤尺寸。在图4a中,治疗的第一天和肿瘤尺寸测量的第一天标示为第0天。每三天测量一次肿瘤。
173.记录最长和最短的直径,并使用0.52x长度x(宽度)2的公式计算肿瘤体积。肿瘤尺寸的进展表示为第0天的第一测量点(任意地设置为100%)的百分比。
174.数据汇编和统计分析
175.在整个实验过程中每3天测量一次体重。计算每只动物的相对于基线的百分比体重变化。
176.肿瘤体积(表2):绝对肿瘤体积是肿瘤体积分析的终点。分别在第21天和第48天评估绝对肿瘤体积。重复测量的方差分析用作肿瘤体积的分析方法,因为对于每只小鼠测量了两个肿瘤。该模型包含组效应和基线值作为协变量(作为固定效应)。使用tukey法调整组间的成对比较。通过使用ftv(分数肿瘤体积)法进行协同作用计算。
177.时间点选择的理由:第21天是所有动物仍然存活的最后一天,并且在第48天,每组不超过一只动物死亡。
178.人间皮瘤异种移植模型
179.动物实验由university of helsinki实验动物委员会和southern finland的省政府批准。从scanbur(karlslunde,dk)获得6
‑
8周龄小鼠并在实验开始前隔离1周。用异氟烷呋喃(baxter)麻醉小鼠,将50μl中的nci
‑
h226细胞注射到两个侧腹(6e 06/侧腹)中。在治疗前让肿瘤生长8天。每6天施用一次病毒。一组仅接受oncos
‑
102,两组每6天接受一次oncos
‑
102和化学疗法(培美曲塞 顺铂或培美曲塞 卡铂),而另外两组在3天的周期中交替接受oncos
‑
102引发,然后化学疗法(培美曲塞 顺铂或培美曲塞 卡铂)和oncos
‑
102的联合治疗。用0.9%的盐水处理模拟动物。将oncos
‑
102稀释到0.9%盐水中,并以每个肿瘤5x107vp的剂量进行瘤内注射(每只动物两个肿瘤)。注射以扇形图案进行,以确保在整个肿瘤中均匀分布。将培美曲塞、顺铂和卡铂在0.9%的nacl中稀释,并分别以10mg/kg、1.5mg/kg和8mg/kg的剂量腹膜内施用。每种化学治疗剂的注射体积为100μl。
180.从第一个治疗日开始,每3天用卡尺在两个维度上测量肿瘤尺寸。记录最长和最短直径,并使用0.52x长度
×
(宽度)2的公式计算肿瘤体积。肿瘤尺寸的进展表示为第0天的第一测量点(任意地设置为100%)的百分比(图4a)。在适应和施用期间每天观察所有动物的临床体征、发病率或死亡率,并在每次治疗后另外观察30分钟。在实验期间,当肿瘤尺度达到允许的最大直径(1.5cm)时,小鼠被杀死。
181.人gm
‑
csf elisa
182.根据制造商的说明,使用补充有蛋白酶抑制剂混合物(p
‑
2714,sigma
‑
aldrich)的组织提取试剂i(fnn0071,invitrogen)提取来自收获的balb/c裸鼠组织样品(肿瘤和肝脏)的总蛋白质。根据制造商的说明,使用elisa(ab100529,abcam)分析蛋白质提取物和先前收集的血清中的人gm
‑
csf浓度。
183.定量实时pcr
184.根据先前描述的方案进行腺病毒e4拷贝数的qpcr(引物fw:5
′‑
gga gtg cgc cga gac aac
‑3′
,引物rv:5
′‑
act acg tcc ggc gtt cca t
‑3′
,探针e4:5
′‑
(6fam)
‑
tgg cat gac act acg acc aac acg atc t
‑
(tamra)
‑3′
)(koski等2010)。根据制造商的方案,使用qiaamp dna blood mini试剂盒(51106,qiagen)从balb/c裸鼠样品(肿瘤、肝脏、血液)中提取总dna。随后,对分离的dna分析腺病毒e4拷贝数,将其分别针对鼠β
‑
肌动蛋白(肝脏、血液)和人β
‑
肌动蛋白(肿瘤)进行标准化(引物fw:5
′‑
cga gcg gtt ccg atg c
‑3′
,引物rv:
5
′‑
tgg atg cca cag gat tcc at
‑3′
,探针鼠β
‑
肌动蛋白:5
′‑
(6fam)
‑
agg ctc ttt tcc agc ctt cct tct tgg
‑
(tamra)
‑3′
;(引物fw:5
′‑
cag cag atg tgg atc agc aag
‑3′
,引物rv:5
′‑
cta gaa gca ttt gcg gtg gac
‑3′
,探针人β
‑
肌动蛋白:5
′‑
(6fam)
‑
agg agt atg acg ccg gcc cct c
‑
(tamra)
‑3′
)。使用lighcyclerqpcr仪(lighcycler 480,roche)分析样品。
185.统计分析
186.使用单因素方差分析和tukey多重比较检验和非参数化mann
‑
whitney检验分析统计学显著性。使用kaplan
‑
meier检验进行存活曲线和统计分析。使用graphpad prism 5(graphpad software,san diego,usa)进行所有统计分析,计算和检验。结果表示为平均值
±
sem。所有p值均为双侧或单侧,当≤0.05时,被认为具有统计学意义。
187.实施例1.oncos
‑
102与一线化学疗法的组合对间皮瘤的体外抗肿瘤活性提高
188.在体外于三种间皮瘤细胞系中测试了oncos
‑
102的溶瘤效力(图1a)。jl
‑
1(上皮样间皮瘤)、msto
‑
211h(恶性双相)和h226(上皮形态)细胞似乎对溶瘤作用具有相对抗性,因为10vp/细胞(亚最佳剂量)在3天中分别杀死了18%、24%和11%的细胞。与msto
‑
211h细胞(培美曲塞 顺铂或培美曲塞 卡铂)相比,jl
‑
1和h226细胞系对化学疗法介导的细胞毒性更具抗性。与化学治疗剂一起孵育在3天内仅杀死10%的jl
‑
1和11
‑
12%的h226细胞。相反,在与培美曲塞 顺铂和培美曲塞 卡铂共培养的第3天,分别杀死63%和73%的msto
‑
211h细胞。与在单一治疗(病毒或化学疗法)中观察到的结果相比,oncos
‑
102与化学治疗剂的组合在h226和jl
‑
1细胞中显著增加了细胞毒性。然而,当将化学疗法与oncos
‑
102组合时,在msto
‑
211h细胞中未观察到增加的细胞毒性。总的来说,相较于对化学疗法特别敏感的msto
‑
211h细胞,h226和jl
‑
1细胞对溶瘤作用(单独oncos
‑
102)和化学治疗剂的细胞毒性作用更具抗性。
189.与细胞活力结果一致,在所有处理组中凋亡h226和jl
‑
1细胞的数量通常较低,但与单一疗法相比,联合治疗略微增加凋亡细胞的数量。与h226和jl
‑
1细胞相反,在单独的化学疗法和化学疗法 oncos
‑
102治疗的细胞中凋亡的msto
‑
211h细胞的数量显著更高(图1b)。
190.实施例2.oncos
‑
102和化学疗法的组合增强了间皮瘤细胞系的免疫原性细胞死亡和病毒复制
191.在暴露于oncos
‑
102、化学治疗剂或两者的组合后,从间皮瘤细胞培养物测量免疫原性细胞死亡标志物,诸如钙网蛋白a对细胞表面的暴露以及atp和hmgb1的细胞外释放(图2)。通过利用oncos
‑
102 化学疗法的治疗诱导了jl
‑
1和h226间皮瘤中最具免疫原性的肿瘤细胞死亡,因为在这些组中测量到最高量的crt暴露和hmgb1和atp的细胞外释放。反过来,在msto
‑
211h细胞中,oncos
‑
102和化学疗法的同时施用与单独的化学疗法具有相同的免疫原性,这与来自细胞活力测定的观察一致,证实了这些细胞对化学疗法的高度敏感性。
192.还评估了化学疗法对oncos
‑
102体外复制的影响。用oncos
‑
102感染并用化学治疗剂(培美曲塞 顺铂或培美曲塞 卡铂)预处理(引发)的h226和jl
‑
1细胞显示相对于对照细胞(p<0.001对比oncos
‑
102)在感染细胞数量方面显著增加(图3c)。另一方面,用化学疗法预处理msto
‑
211h细胞没有增加感染细胞的数量。相反,化学疗法与oncos
‑
102同时施用于三种间皮瘤细胞系导致体外病毒复制的抑制或限制。
193.实施例3.oncos
‑
102显示出对间皮瘤细胞的高度趋向性
194.oncos
‑
102是嵌合的溶瘤腺病毒,其中纤维圆头5被血清型圆头3结构域替代。筛选cd46、dsg2(ad3)和car(ad5)受体的阳性细胞(图3b)。msto
‑
211h、h226和jl
‑
1在其表面上表达高水平的cd46(分别为98%、96%和98%)、dsg2(分别为95%、7%和64%)。car受体由三种间皮瘤中的两种h226(88%)和j11(15%)表达。
195.实施例4.oncos
‑
102与培美曲塞和顺铂或培美曲塞和卡铂组合在人异种移植物间皮瘤模型中显示出提高的针对mm的抗肿瘤效力
196.鉴于观察到oncos
‑
102与培美曲塞和顺铂或培美曲塞和卡铂在体外的协同作用,接下来评估在体内动物模型中是否也存在增强的抗肿瘤活性。因此,将人间皮瘤h226细胞系皮下植入balb/c裸鼠中,并根据表1中所示的治疗方案治疗肿瘤。
197.在指定的时间点计算肿瘤生长(体积)并报告为时间的函数(图4a)。h226间皮瘤异种移植肿瘤似乎是标准化学治疗剂(培美曲塞 顺铂、培美曲塞 卡铂)难以治疗的,因为没有一种治疗显著减少了肿瘤生长。单独的化学疗法是针对间皮瘤的最低效的治疗方式,部分原因是所使用的次优剂量。用oncos
‑
102 培美曲塞 顺铂治疗的一只动物到第21天显示完全肿瘤消退(两种肿瘤)。另外,用oncos
‑
102引发 培美曲塞 顺铂治疗的一只动物到第45天显示两种肿瘤完全消退。单独的oncos
‑
102能够在一定程度上控制肿瘤生长(在第48天,p=0.074模拟对比oncos
‑
102)。针对胸膜间皮瘤的最有效的治疗方式是利用oncos
‑
102引发加上培美曲塞和顺铂(这种治疗在第60天显示97%的初始肿瘤尺寸对比473%(模拟)、563%(培美曲塞 顺铂)和672%(培美曲塞和卡铂))。另外,在所有联合方案(oncos
‑
102 化学疗法)中,我们观察到最显著的抗肿瘤活性,特别是与单独的化学疗法、单独病毒和模拟相比(初始肿瘤尺寸:97%(病毒引发 培美曲塞 顺铂)、138%(病毒 培美曲塞 顺铂)、151%(病毒引发 培美曲塞 卡铂)和163%(病毒 培美曲塞 卡铂)对比第60天的206%(单独的病毒)、473%(模拟)、563%(培美曲塞 顺铂)和672%(培美曲塞 顺铂)。在所有测试的组合中,oncos
‑
102和化学治疗剂在第48天显示出强烈的协同抗肿瘤作用(r=2.19oncos
‑
102 培美曲塞 顺铂;r=1.7oncos
‑
102 培美曲塞 卡铂;r=2.5oncos
‑
102引发 培美曲塞 顺铂;r=1.41oncos
‑
102引发 培美曲塞 卡铂)。在第21天,oncos
‑
102与培美曲塞 顺铂的组合在两种方案(r=1.8oncos
‑
102 培美曲塞 顺铂;r=1.32oncos
‑
102引发 培美曲塞 顺铂)上都显示出协同效应,而与培美曲塞 卡铂的组合显示出累加效应(组合组的r=1.0和0.93)。
198.表1.在八个组(a
‑
h)中评价oncos
‑
102与化学治疗剂(培美曲塞和顺铂或培美曲塞和卡铂)的组合在间皮瘤中的抗肿瘤活性。在2个月期间在balb/c裸鼠的人间皮瘤异种移植模型中测试了不同的治疗方案、化学疗法和病毒浓度。
199.200.[0201][0202]
表2公开了利用oncos
‑
102与培美曲塞 顺铂或培美曲塞 卡铂对balb/c裸鼠进行的间皮瘤联合治疗。
[0203]
表2.在balb/c裸鼠中利用oncos
‑
102与培美曲塞 顺铂或培美曲塞 卡铂对间皮瘤进行的联合治疗。用ftv计算方法评估治疗协同作用。ftv(平均肿瘤体积(%)实验)/(平均肿瘤体积对照(%))。*(化学疗法的平均ftv(%))x(oncos
‑
102的平均ftv(%))。**(预期的ftv除以观察到的ftv)。>1的比率(r)表示协同效应,<1的比率表示小于累加效应。
[0204][0205][0206]
实施例5.oncos
‑
102在肿瘤组织中局部复制并产生人gm
‑
csf
[0207]
通过qpcr和elisa对鼠器官(肿瘤,肝脏)和血清中的腺病毒e4拷贝数和gm
‑
csf水平进行定量。oncos
‑
102仅存在于肿瘤(局部)中,而在所有测试组中均未在血清或肝脏中检测到病毒颗粒(图4d)。oncos
‑
102正在产生gm
‑
csf蛋白,在5个测试组中在肿瘤中检测到其最高浓度(参见图4c)。
[0208]
本发明涉及以下实施方式:
[0209]
1.oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中向患者联合施用所述病毒与两种化学治疗剂。
[0210]
2.根据实施方式1所述的oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中所述两种化学治疗剂是培美曲塞和顺铂或培美曲塞和卡铂。
[0211]
3.根据实施方式2所述的oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中培美曲塞与顺铂之间的摩尔比为10:0.75至10:3。
[0212]
4.根据实施方式3所述的oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中培美曲塞与顺铂之间的摩尔比为10:1.5。
[0213]
5.根据实施方式2所述的oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中培美曲塞与卡铂之间的摩尔比为5:8至5:2。
[0214]
6.根据实施方式5所述的oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中培美曲塞与卡铂之间的摩尔比为5:4。
[0215]
7.根据实施方式1至6中任一项所述的oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中所述病毒的量为5x10
10
至5x10
11 vp。
[0216]
8.根据实施方式7所述的oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中所述病毒以3x10
11
vp/5ml的量施用。
[0217]
9.根据实施方式1
‑
8中任一项所述的oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中所述化学治疗剂和所述病毒以有效量施用。
[0218]
10.根据实施方式1
‑
9中任一项所述的oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中所述病毒通过腹膜内施用或通过直接注射入肿瘤施用,并且所述两种化学治疗剂通过静脉内或腹膜内施用。
[0219]
11.根据实施方式1至10中任一项所述的oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中在施用所述两种化学治疗剂之前并且还在所述化学治疗剂的施用期期间施用所述病毒。
[0220]
12.根据实施方式1至10中任一项所述的oncos
‑
102腺病毒用于治疗人恶性间皮瘤,其中在施用病毒之前并且还在所述病毒的施用期期间施用两种化学治疗剂。
[0221]
13.一种用于治疗患者的恶性间皮瘤的方法,其包括向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤。
[0222]
14.根据实施方式13所述的方法,其中所述病毒和化学治疗剂以有效量施用。
[0223]
15.根据实施方式13或14所述的方法,其中所述化学治疗剂是培美曲塞和顺铂或培美曲塞和卡铂。
[0224]
16.根据实施方式13
‑
15中任一项所述的方法,其中在开始所述病毒的施用期之前首先施用所述化学治疗剂,并且也在所述病毒的施用期期间施用所述化学治疗剂。
[0225]
17.根据实施方式13
‑
15中任一项所述的方法,其中在开始所述化学治疗剂的施用
期之前首先施用所述病毒,并且也在所述化学治疗剂的施用期期间施用所述病毒。
[0226]
18.根据实施方式13
‑
17中任一项的方法,其中向所述受试者施用oncos
‑
102腺病毒1至10次,并且施用所述化学治疗剂1至6次。
[0227]
19.根据实施方式13
‑
18中任一项所述的方法,其中所述oncos
‑
102的施用以108‑
10
12
个噬斑形成单位的剂量进行,这是或者通过直接注射到所述患者的恶性间皮瘤肿瘤中或以腹膜内注射方式进行的。
[0228]
20.根据实施方式13
‑
19中任一项所述的方法,其中待施用的oncos
‑
102腺病毒的量在5x10
10
‑
5x10
11 vp的范围内。
[0229]
21.根据实施方式13
‑
20中任一项所述的方法,其还包括在向所述患者施用oncos
‑
102腺病毒和两种化学治疗剂的步骤之前施用环磷酰胺。
[0230]
22.根据实施方式13
‑
21中任一项所述的方法,其还包括向所述患者施用叶酸。
[0231]
23.根据实施方式13
‑
22中任一项所述的方法,其还包括向所述患者施用氰钴胺。
[0232]
24.根据实施方式13
‑
23中任一项所述的方法,其还包括向所述患者施用地塞米松。
[0233]
25.oncos
‑
102腺病毒在治疗人恶性间皮瘤中的用途,其中向患者联合施用所述病毒和两种化学治疗剂。
[0234]
参考文献
[0235]
fueyo j.,gomez
‑
manzano c.,alemany r.,lee p.,mcdonnell tj.,mitlianga p.shi y
‑
x.,levin va.,yung wka和kyritsis ap.a mutant oncolytic adenovirus targeting the rb pathway produces anti
‑
glioma effect in vivo.oncogene(2000)19:2
‑
12.
[0236]
heisec.,hermiston t.,johnson l.,brooksg.,sampson
‑
johannes a.,williamsa.,hawkins l.&kirn d.an adenovirus e1a mutant that demonstrates potent and selective systemic anti
‑
tumoral efficacy.nat med(2000)6:1134
‑
9.
[0237]
hanahan d,weinberg ra.(2000).the hallmarks of cancer.cell(2000)100:57
–
70.
[0238]
koski a,kangasniemi l,escutenaire s,pesonen s,cerullo v,diaconu i,nokisalmi p,raki m,rajecki m,guse k,ranki t,oksanen m,等人.treatment of cancer patients with a serotype 5/3chimeric oncolytic adenovirus expressing gmcsf.mol ther(2010)18:1874
‑
84.
[0239]
ranki t,joensuu t,e,karbach j,wahle c,kairemo k,alanko t,partanen k,turkki r,linder n,lundin j,a,等人.local treatment of a pleural mesothelioma tumor with oncos
‑
102induces a systemic antitumor cd8 t
‑
cell response,prominent infiltrationof cd8 lymphocytes and th1 type polarization.oncoimmunology(2014)3:e958937.
[0240]
siurala m,bramante s,vassilev l,hirvinen m,parviainen s,tahtinen s,guse k,cerullo v,kanerva a,kipar a,vaha
‑
koskela m,hemminki a.oncolytic adenovirus and doxorubicin
‑
based chemotherapy results in synergistic antitumor activity against soft
‑
tissue sarcoma.int j cancer(2015)136:945
‑
54.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。