1.本发明属于高分子材料技术领域,尤其涉及一种双组分蛋白粘合剂及其制备方法和应用。
背景技术:
2.在临床上,外科手术的伤口缝合问题已经引起了越来越多的关注。临床上常用方法,比如缝合线、缝合钉等的全球市场价值预计到2024年将超过150亿美元每年。然而,这些方法常常面临渗漏、伤口感染、渗液结痂、产生疤痕以及愈合后拆线拆钉等问题。因此,在最近的几十年里,作为手术缝合替代物的组织粘合剂因其具有易于使用、应用时间短、组织损伤小的优点而受到了广泛的关注和研究。
3.蛋白质是广泛存在于生物体内的一种重要物质,具有良好的生物相容性和可降解性。此外,蛋白质的结构多样,具有丰富的官能团,使其具有良好的功能性。作为最早的组织粘合剂之一,纤维蛋白胶由人凝血酶和病毒灭活的人纤维蛋白原双组分组成,其主要成分为蛋白质。纤维蛋白胶具有良好的生物可降解性以及弱的免疫原性,不会引起机体排斥反应,因此已被广泛应用于临床。然而,纤维蛋白胶的机械强度较差,不能应用于高载荷的修复。其他的蛋白粘合剂,比如bioglue组织粘合剂是一种由纯化的牛血清白蛋白和戊二醛组成的双组分粘合剂也已被临床应用。因此,开发新的、具有高强度及高黏附性的组织粘合剂是非常必要的。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种高强度、高黏附性、无生物毒性的蛋白粘合剂,以应用于伤口修复、组织工程及药物缓释载体领域。
5.本发明提供了一种双组分蛋白粘合剂,包括组分一和组分二;
6.所述组分一中包含具有式(i)结构的重复单元和具有式(ii)结构的端基:
[0007][0008][0009]
所述组分二选自牛血清白蛋白、人血清白蛋白或明胶。
[0010]
在本发明中,所述双组分蛋白粘合剂中组分一和组分二的质量比为1:0.95~1.05,优选为1:1。
[0011]
在本发明中,还包括溶剂;
[0012]
所述溶剂选自水、生理盐水、缓冲溶液、组织培养液或体液;优选为缓冲溶液。在本
发明具体实施例中,所述溶剂选自pbs缓冲溶液。
[0013]
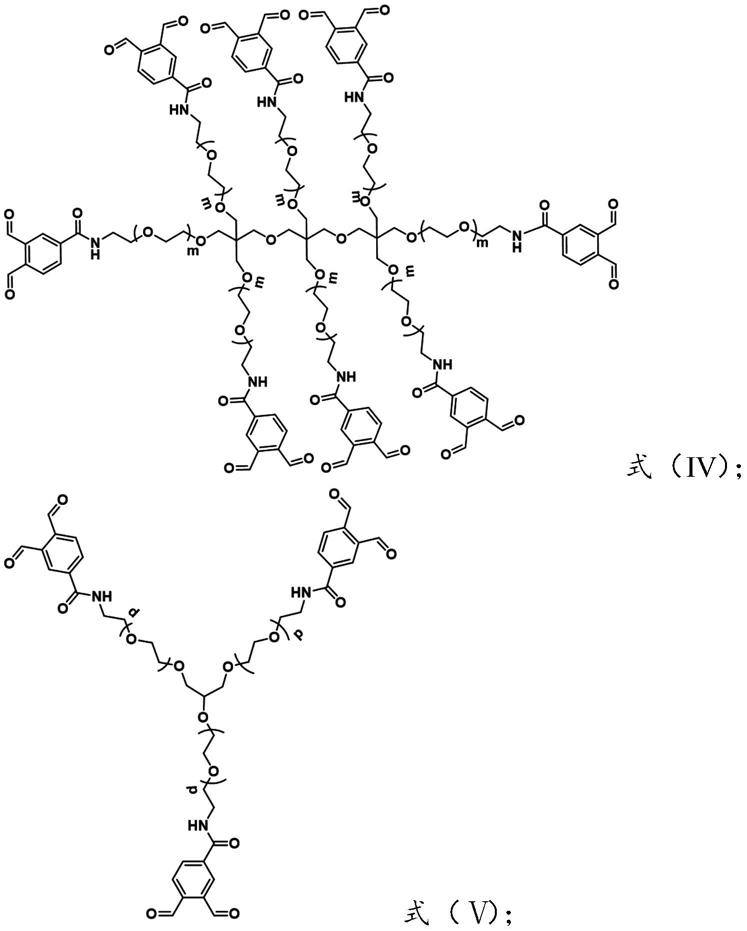
在本发明中,所述组分一具体选自式(ⅲ)~式(v)结构的化合物中的一种或多种:
[0014][0015]
[0016]
其中,m、n和p均为聚合度;50≤n≤100;25≤m≤50;67≤p≤133。
[0017]
本发明提供了一种上述技术方案所述双组分蛋白粘合剂的制备方法,包括以下步骤:
[0018]
将组分一溶液和组分二溶液混合,得到双组分蛋白粘合剂。
[0019]
在本发明中,所述组分一溶液中组分一的质量体积浓度为(1~50)g/ml;优选为(10~30)g/ml;
[0020]
所述组分二溶液中组分二的质量体积浓度为(1~50)g/ml,优选为(10~30)g/ml。
[0021]
在本发明中,所述混合的温度为25~45℃。
[0022]
本发明提供了一种上述技术方案所述双组分蛋白粘合剂或上述技术方案所述制备方法制备的双组分蛋白粘合剂在伤口修复、组织工程及药物缓释载体中的应用。
[0023]
本发明提供了一种双组分蛋白粘合剂,包括组分一和组分二;所述组分一中包含具有式(i)结构的重复单元和具有式(ii)结构的端基;所述组分二选自牛血清白蛋白、人血清白蛋白或明胶。本发明提供的粘合剂采用组分一和组分二,使得粘合剂具有高强度、高黏附性、无生物毒性;其能够应用于伤口修复、组织工程及药物缓释载体领域。
附图说明
[0024]
图1为本发明实施例1所制备的3,4
‑
二(二溴甲基)苯甲酸的核磁共振氢谱图;
[0025]
图2为本发明实施例2所制备的1,3
‑
二甲氧基
‑
1,3
‑
二氢异苯并呋喃
‑5‑
羧酸琥珀酰亚胺酯的核磁共振氢谱图;
[0026]
图3为本发明实施例3所制备的端基被保护的四臂聚乙二醇衍生物的核磁共振氢谱图;
[0027]
图4为本发明实施例4所制备的4apeg
‑
opa的核磁共振氢谱图;
[0028]
图5为质量体积浓度为4g/ml的牛血清白蛋白粘合剂的机械强度测试结果;
[0029]
图6为质量体积浓度为8g/ml的牛血清白蛋白粘合剂的机械强度测试结果;
[0030]
图7为质量体积浓度为1.5g/ml的明胶粘合剂的机械强度测试结果;
[0031]
图8为质量体积浓度为2g/ml的明胶粘合剂的机械强度测试结果;
[0032]
图9为质量体积浓度为4g/ml的明胶粘合剂的机械强度测试结果;
[0033]
图10为本发明实施例10制备的牛血清白蛋白粘合剂的体外降解实验结果;
[0034]
图11为本发明实施例11制备的牛血清白蛋白粘合剂的体外降解实验结果;
[0035]
图12为质量体积浓度为10g/ml的人血清白蛋白粘合剂对pmma的黏附力测试结果;
[0036]
图13为质量体积浓度为15g/ml的人血清白蛋白粘合剂对pmma的黏附力测试结果;
[0037]
图14为质量体积浓度为20g/ml的人血清白蛋白粘合剂对pmma的黏附力测试结果;
[0038]
图15为质量体积浓度为10g/ml的人血清白蛋白粘合剂对玻璃的黏附力测试结果;
[0039]
图16为质量体积浓度为15g/ml的人血清白蛋白粘合剂对玻璃的黏附力测试结果;
[0040]
图17为质量体积浓度为20g/ml的人血清白蛋白粘合剂对玻璃的黏附力测试结果;
[0041]
图18为质量体积浓度为10g/ml的人血清白蛋白粘合剂对猪肠衣的黏附力测试结果;
[0042]
图19为质量体积浓度为15g/ml的人血清白蛋白粘合剂对猪肠衣的黏附力测试结果;
[0043]
图20为质量体积浓度为20g/ml的人血清白蛋白粘合剂对猪肠衣的黏附力测试结果;
[0044]
图21为不同浓度本发明实施例4所制备的4apeg
‑
opa对l929细胞的细胞毒性结果;
[0045]
图22为质量体积浓度为15g/ml的人血清白蛋白粘合剂用于大鼠皮肤伤口闭合。
具体实施方式
[0046]
为了进一步说明本发明,下面结合实施例对本发明提供的一种双组分蛋白粘合剂及其制备方法和应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
[0047]
实施例1
[0048]
将12g 3,4
‑
二甲基苯甲酸和57g n
‑
溴代琥珀酰亚胺溶解于200ml四氯化碳中。将1.62g过氧化苯甲酰加入到反应混合物中,在81℃下加热回流15h。将得到的白色沉淀趁热过滤,分别用苯和乙醚洗涤三次。滤液合并浓缩,将剩余物溶解于300ml10%的碳酸钠溶液中。二氯甲烷洗涤,调ph值至1,然后用乙酸乙酯萃取。有机相用饱和食盐水洗涤,并用硫酸钠干燥、过滤,然后真空浓缩。在乙腈中结晶纯化获得3,4
‑
二(二溴甲基)苯甲酸。
[0049]
本发明对得到的3,4
‑
二(二溴甲基)苯甲酸进行核磁共振分析,图1为本发明实施例1所制备的3,4
‑
二(二溴甲基)苯甲酸的核磁共振氢谱图。
[0050]
实施例2
[0051]
将由实施例1所制备的3,4
‑
二(二溴甲基)苯甲酸溶解在180ml10%的碳酸钠溶液中,并在70℃下反应4h。将反应混合物在冰水浴中用浓盐酸酸化至ph为1,并用乙酸乙酯萃取。有机相用饱和食盐水洗涤,并用硫酸钠干燥、过滤,然后真空浓缩。将得到的固体溶解于100ml无水甲醇中,并在室温下用750mg三氟甲磺酸钪处理过夜。蒸发甲醇,混合物溶解于100ml无水乙腈中,并加入4.8g nhs和8.1g edc
·
hcl。将混合物在室温下搅拌过夜,然后真空浓缩。将剩余物溶解在二氯甲烷中,饱和食盐水洗涤后用硫酸镁干燥。通过硅胶色谱法在正己烷/乙酸乙酯中纯化粗产物,得到1,3
‑
二甲氧基
‑
1,3
‑
二氢异苯并呋喃
‑5‑
羧酸琥珀酰亚胺酯。
[0052]
本发明对得到的1,3
‑
二甲氧基
‑
1,3
‑
二氢异苯并呋喃
‑5‑
羧酸琥珀酰亚胺酯进行核磁共振分析,图2为本发明实施例2所制备的1,3
‑
二甲氧基
‑
1,3
‑
二氢异苯并呋喃
‑5‑
羧酸琥珀酰亚胺酯的核磁共振氢谱图。
[0053]
实施例3
[0054]
将2g末端为氨基的四臂聚乙二醇与514mg由实施例2所制备的1,3
‑
二甲氧基
‑
1,3
‑
二氢异苯并呋喃
‑5‑
羧酸琥珀酰亚胺酯溶解于25ml无水二氯甲烷中,并加入0.5ml吡啶。混合物在室温下搅拌2天后在冰乙醚中沉淀,得到端基被保护的四臂聚乙二醇衍生物。
[0055]
本发明对得到的端基被保护的四臂聚乙二醇衍生物进行核磁共振分析,图3为本发明实施例3所制备的端基被保护的四臂聚乙二醇衍生物的核磁共振氢谱图。
[0056]
实施例4
[0057]
将由实施例3所制备的端基被保护的四臂聚乙二醇衍生物溶解于5ml去离子水中,加入5ml三氟乙酸,室温避光搅拌1h后稀释至50ml。将混合物透析2天并冻干,得到具有式ⅲ所示结构的四臂聚乙二醇衍生物(4apeg
‑
opa)。
[0058]
本发明对得到的4apeg
‑
opa进行核磁共振分析,图4为本发明实施例4所制备的
4apeg
‑
opa的核磁共振氢谱图。
[0059]
实施例5
[0060]
将通过实施例4所制得的组分一与牛血清白蛋白分别用ph为7.4的pbs缓冲溶液配置成质量体积浓度为4g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后迅速转移至旋转流变仪测定其机械强度,结果参见图5,质量体积浓度为4g/ml的牛血清白蛋白粘合剂的机械强度为600pa。
[0061]
实施例6
[0062]
将通过实施例4所制得的组分一与牛血清白蛋白分别用ph为7.4的pbs缓冲溶液配置成质量体积浓度为8g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后迅速转移至旋转流变仪测定其机械强度,结果参见图6,质量体积浓度为8g/ml的牛血清白蛋白粘合剂的机械强度为13000pa。
[0063]
实施例7
[0064]
将通过实施例4所制得的组分一与明胶分别用ph为7.4的pbs缓冲溶液配置成质量体积浓度为1.5g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后迅速转移至旋转流变仪测定其机械强度,结果参见图7,质量体积浓度为1.5g/ml的明胶粘合剂的机械强度为60pa。
[0065]
实施例8
[0066]
将通过实施例4所制得的组分一与明胶分别用ph为7.4的pbs缓冲溶液配置成质量体积浓度为2g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后迅速转移至旋转流变仪测定其机械强度,结果参见图8,质量体积浓度为2g/ml的明胶粘合剂的机械强度为400pa。
[0067]
实施例9
[0068]
将通过实施例4所制得的组分一与明胶分别用ph为7.4的pbs缓冲溶液配置成质量体积浓度为4g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后迅速转移至旋转流变仪测定其机械强度,结果参见图9,质量体积浓度为4g/ml的明胶粘合剂的机械强度为4000pa。
[0069]
实施例10
[0070]
将通过实施例4所制得的组分一与牛血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为4g/ml(组分二浓度)和6g/ml(牛血清白蛋白浓度)的溶液,二者等体积混合,使用涡旋仪混合均匀后放置37℃下固化。待稳定后,向其中分别加入ph为7.4的pbs缓冲溶液和浓度为5u/ml的蛋白酶k的pbs缓冲溶液,置于37℃下培养。在特定的时间点吸干液体,称取质量。而后再分别加入ph为7.4的pbs缓冲溶液和浓度为5u/ml的蛋白酶k的pbs缓冲溶液,继续37℃下培养。降解曲线参见图10,体外降解实验结果表明所得双组分蛋白粘合剂的可降解性,有利于其生物医学应用。
[0071]
实施例11
[0072]
将通过实施例4所制得的组分一与牛血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为4g/ml(组分二浓度)和8g/ml(牛血清白蛋白浓度)的溶液,二者等体积混合,使用涡旋仪混合均匀后放置37℃下固化。待稳定后,向其中分别加入ph为7.4的pbs缓冲溶液和浓度为5u/ml的蛋白酶k的pbs缓冲溶液,置于37℃下培养。在特定的时间点吸干液体,称取质量。而后再分别加入ph为7.4的pbs缓冲溶液和浓度为5u/ml的蛋白酶k的pbs缓冲溶液,继续37℃下培养。降解曲线参见图11,体外降解实验结果表明所得双组分蛋白粘合剂
的可降解性,有利于其生物医学应用。
[0073]
实施例12
[0074]
将通过实施例4所制得的组分一与人血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为10g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后涂至pmma板上,将另一pmma板放置其上,接触面积为26mm
×
10mm,37℃固化24h。用万能试验机测试其黏附力,重复3次,结果参见图12。
[0075]
实施例13
[0076]
将通过实施例4所制得的组分一与人血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为15g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后涂至pmma板上,将另一pmma板放置其上,接触面积为26mm
×
10mm,37℃固化24h。用万能试验机测试其黏附力,重复3次,结果参见图13。
[0077]
实施例14
[0078]
将通过实施例4所制得的组分一与人血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为20g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后涂至pmma板上,将另一pmma板放置其上,接触面积为26mm
×
10mm,37℃固化24h。用万能试验机测试其黏附力,重复3次,结果参见图14。
[0079]
实施例15
[0080]
将通过实施例4所制得的组分一与人血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为10g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后涂至玻璃板上,将另一玻璃板放置其上,接触面积为26mm
×
10mm,37℃固化24h。用万能试验机测试其黏附力,重复3次,结果参见图15。
[0081]
实施例16
[0082]
将通过实施例4所制得的组分一与人血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为15g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后涂至玻璃板上,将另一玻璃板放置其上,接触面积为26mm
×
10mm,37℃固化24h。用万能试验机测试其黏附力,重复3次,结果参见图16。
[0083]
实施例17
[0084]
将通过实施例4所制得的组分一与人血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为20g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后涂至玻璃板上,将另一玻璃板放置其上,接触面积为26mm
×
10mm,37℃固化24h。用万能试验机测试其黏附力,重复3次,结果参见图17。
[0085]
实施例18
[0086]
将通过实施例4所制得的组分一与人血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为10g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后涂至贴有猪肠衣的pmma板上,将另一贴有猪肠衣的pmma板放置其上,接触面积为26mm
×
10mm,37℃固化24h。用万能试验机测试其黏附力,重复3次,结果参见图18。
[0087]
实施例19
[0088]
将通过实施例4所制得的组分一与人血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为15g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后涂至贴有猪
肠衣的pmma板上,将另一贴有猪肠衣的pmma板放置其上,接触面积为26mm
×
10mm,37℃固化24h。用万能试验机测试其黏附力,重复3次,结果参见图19。
[0089]
实施例20
[0090]
将通过实施例4所制得的组分一与人血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为20g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后涂至贴有猪肠衣的pmma板上,将另一贴有猪肠衣的pmma板放置其上,接触面积为26mm
×
10mm,37℃固化24h。用万能试验机测试其黏附力,重复3次,结果参见图20。
[0091]
实施例21
[0092]
将小鼠成纤维细胞l929以8000细胞/孔的密度种植于96孔板中,每孔加200μl完全培养基(90%dmem培养基 10%新生牛血清),置于培养箱中孵育24h。24h后取出培养板,培养板中分别加入20μlph为7.4的pbs缓冲溶液以及浓度为10~0.625mg/ml的通过实施例4所制备的组分一以达到终浓度为1~0.0625mg/ml(具体为1mg/ml、0.5mg/ml、0.2 5mg/ml、0.125mg/ml和0.0625mg/ml),置于培养箱中孵育24h。24h取出培养板,吸走培养基,用pbs洗2~3遍,避光加入10%的cck
‑
8溶液,置于培养箱中孵育1h,用酶标仪测试其450nm和630nm处的吸光度。不同浓度的粘合剂材料对l929细胞的细胞毒性参见图21,实验结果表明粘合剂材料无生物毒性,可应用于临床。
[0093]
实施例22
[0094]
将sd大鼠用戊巴比妥钠麻醉后在其背部造2cm左右伤口,将通过实施例4所制得的组分一与人血清白蛋白用ph为7.4的pbs缓冲溶液分别配置成质量体积浓度为15g/ml的溶液,二者等体积混合,使用涡旋仪混合均匀后涂至伤口处,发现其能有效闭合伤口。观察14天,并于第1天、4天、7天、10天、14天拍照,结果参见图22。结果表明,本发明所制备的双组分蛋白粘合剂具有优秀的伤口愈合促进能力。
[0095]
由以上实施例可知,本发明提供了一种双组分蛋白粘合剂,包括组分一和组分二;所述组分一中包含具有式(i)结构的重复单元和具有式(ii)结构的端基;所述组分二选自牛血清白蛋白、人血清白蛋白或明胶。本发明提供的粘合剂采用组分一和组分二,使得粘合剂具有高强度、高黏附性、无生物毒性;其能够应用于伤口修复、组织工程及药物缓释载体领域。
[0096]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。