一种蛋白酶k的冷冻干燥保护剂及制备方法
技术领域
1.本发明涉及一种蛋白酶k的冷冻干燥保护剂及制备方法,属于生物技术领域。
背景技术:
2.蛋白酶k是一种与枯草杆菌蛋白酶相关的丝氨酸蛋白酶,是林伯氏白色链球菌(tritirachium album limber)产生的一类主要蛋白酶。因能合成该种蛋白酶的微生物能在以角蛋白(kerantin)为唯一碳氮源的环境中生长,故被称作蛋白酶k。
3.蛋白酶k具有高效的酶活性和广泛的底物特异性,能优先分解与疏水性氨基酸、含硫氨基酸、芳香族氨基酸c末端邻接的酯键和肽键,常被用于降解蛋白生产短肽。它具有丝氨酸蛋白酶类所特有的典型催化三联体asp39
‑
his69
‑
ser224特征并且活性中心周围有两个ca
2
结合位点增加其稳定性,使其在更广泛的条件下保持较高的酶活力。
4.蛋白酶k除含有两个ca
2
结合位点有助于稳定蛋白构象外,内部结构还存在两对二硫键,因此蛋白酶k比其他枯草杆菌蛋白在极端ph和高温环境下有更高的稳定性。利用这个特性,蛋白酶k在核酸纯化、丝绸、医药、食品和酿造等领域都有着重要的应用。
5.冷冻干燥技术是把含有水分的物料预先进行降温,冻结成冰点以下的固体,在真空条件下使冰直接升华,以水蒸气形式除去,从而得到干燥产品的一种技术。
6.冷冻干燥是在低温及真空状态下完成对制品的脱水干燥,有着其他干燥方式不具有的优点,逐渐成为生物制品中首选的干燥储存方法。主要体现在以下几个方面:制剂在预冻前完成分装,保证剂量的精确性;制品不易发生氧化和热变性,最大限度了保证原有理化性质和生物特性;固态的冰晶升华成为水蒸气后形成的疏松多孔结构,冻干制品具有良好的速溶性和复水性;易进行无菌操作,最大程度的减小微生物污染;脱水彻底,重量轻,方便储存和运输。
7.由于冻干过程是一个复杂的相变过程,蛋白酶k作为一种蛋白质,在冷冻干燥过程中极易受到冻干过程的低温效应、冻结效应和脱水效应的影响,最终导致其酶活性的降低甚至失活。因此为了减少蛋白酶k酶活性在冻干过程中的损伤,筛选合适的冻干保护剂尤为重要。
8.申请人检索的背景文献情况如下:
9.公开号为cn10717757a的专利文献中公开了一种蛋白酶k的冻干工艺,该专利的目的是采用新的冻干程序对蛋白酶k进行冻干,并未提及使用何种保护剂及添加量;公开号为cn102839165b的专利文献中公开了一种基因突变型重组蛋白酶k的工业化生产方法,该专利利用毕赤酵母生产制备蛋白酶k发酵液,经纯化冻干制成干粉制剂,但该专利也未提及使用何种保护剂及添加量。现有技术中公开的一些酶的冻干保护剂通常需要10余种配方才能够达到较为稳定的保护效果,调配过程繁琐。因此,筛选配方简单,有助于延长酶的储存时间并保持酶制剂良好外观的冻干保护剂配方尤为重要。
技术实现要素:
10.本发明提供了一种蛋白酶k的冷冻干燥保护剂及制备方法,通过配方筛选和优化,所得到的蛋白酶k酶粉具有酶活力高、热稳定性好、储存时间长、外观良好的特性。
11.本发明提供了蛋白酶k的冻干保护剂,含有蔗糖、海藻糖、麦芽糖、肌醇、甘氨酸、l
‑
丝氨酸、α
‑
丙氨酸、peg6000、peg8000、bsa、甘油中的一种或多种;所述蔗糖、海藻糖、麦芽糖、肌醇、甘氨酸、l
‑
丝氨酸、α
‑
丙氨酸、peg6000、peg8000或bsa的终浓度分别为3~30g/l;所述甘油的终浓度为3~30%。
12.在一种实施方式中,所述冻干保护剂还含有终浓度为0.2~200mm的ca
2
;所述ca
2
以盐的形式加入,包括但不限于氯化钙、乙酸钙、葡萄糖酸钙、磷酸二氢钙、硝酸钙、碳酸氢钙、硫酸氢钙、亚硫酸氢钙、次氯酸钙中的一种和几种复配添加到配方中。
13.在一种实施方式中,所述冻干保护剂含有(a)~(j)中的任一种:
14.(a)15g/l蔗糖,15g/l海藻糖;5mm ca
2
;
15.(b)15g/l蔗糖,15g/l甘氨酸;5mm ca
2
;
16.(c)15g/l蔗糖,15g/l丝氨酸;5mm ca
2
;
17.(d)15g/l蔗糖,15g/l丙氨酸;5mm ca
2
;
18.(e)15g/l海藻糖,15g/l甘氨酸;5mm ca
2
;
19.(f)15g/l海藻糖,15g/l丝氨酸;5mm ca
2
;
20.(g)15g/l海藻糖,15g/l丙氨酸;5mm ca
2
;
21.(h)15g/l甘氨酸,15g/l丝氨酸;5mm ca
2
;
22.(i)15g/l甘氨酸,15g/l丙氨酸;5mm ca
2
;
23.(j)15g/l丝氨酸,15g/l丙氨酸;5mm ca
2
。
24.在一种实施方式中,所述冻干保护剂的添加量为蛋白质量的1%~100%,所述冻干保护剂用以减少蛋白酶k在冻干过程中活力的损失及增加蛋白质活力稳定性。
25.在一种实施方式中,所述冻干保护剂还含有酸碱调节剂。
26.在一种实施方式中,所述酸碱调节剂的浓度为2~100mm,缓冲能力在ph 4.0~8.0之间,所述酸碱调节剂包括但不限于乙酸
‑
乙酸钠缓冲液、柠檬酸
‑
柠檬酸钠缓冲液、柠檬酸
‑
氢氧化钠
‑
盐酸缓冲液、tris
‑
盐酸缓冲液、pipes缓冲液、hepes缓冲液。所述缓冲液用以维持蛋白酶k在其最适ph条件从而保证其最大催化活性。
27.本发明还提供了所述冻干保护剂在制备蛋白酶k冻干粉中的应用。
28.在一种实施方式中,所述蛋白酶k冻干粉按如下方法制备:
29.(1)配制蛋白酶k和冻干保护剂的混合物,使溶液体系中蛋白酶k浓度为1~80mg/ml,冻干保护剂的添加量为蛋白质量的1%~100%;
30.(2)将步骤(1)配制的混合物冻干。
31.在一种实施方式中,所述步骤(1)的混合物是在50mm hepes缓冲液中,含有蔗糖、海藻糖、麦芽糖、肌醇、甘氨酸、l
‑
丝氨酸、α
‑
丙氨酸、peg6000、peg8000、bsa、甘油中的一种或多种;所述蔗糖、海藻糖、麦芽糖、肌醇、甘氨酸、l
‑
丝氨酸、α
‑
丙氨酸、peg6000、peg8000或bsa的终浓度分别为3~30g/l;所述甘油的终浓度为3~30%。
32.在一种实施方式中,所述步骤(1)的混合物还含有终浓度0.2~200mm的ca
2
。
33.在一种实施方式中,所述步骤(1)的混合物是在50mm hepes缓冲液中,含有终浓度
5mm的ca
2
,终浓度为3~30%的甘油。
34.在一种实施方式中,所述步骤(1)的混合物是在50mm hepes缓冲液中,含有终浓度0.2~50mm的ca
2
,终浓度为15g/l的丝氨酸,终浓度为1.5g/l丙氨酸。
35.在一种实施方式中,所述步骤(1)的混合物中是在50mm hepes缓冲液中,含有(a)~(j)所示的保护剂成分:
36.(a)15g/l蔗糖,15g/l海藻糖;5mm ca
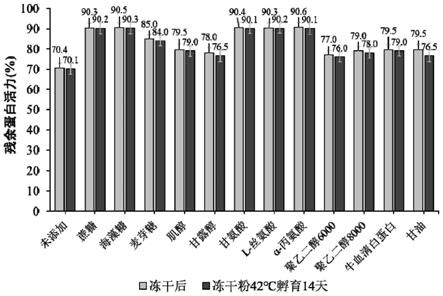
2
;
37.(b)15g/l蔗糖,15g/l甘氨酸;5mm ca
2
;
38.(c)15g/l蔗糖,15g/l丝氨酸;5mm ca
2
;
39.(d)15g/l蔗糖,15g/l丙氨酸;5mm ca
2
;
40.(e)15g/l海藻糖,15g/l甘氨酸;5mm ca
2
;
41.(f)15g/l海藻糖,15g/l丝氨酸;5mm ca
2
;
42.(g)15g/l海藻糖,15g/l丙氨酸;5mm ca
2
;
43.(h)15g/l甘氨酸,15g/l丝氨酸;5mm ca
2
;
44.(i)15g/l甘氨酸,15g/l丙氨酸;5mm ca
2
;
45.(j)15g/l丝氨酸,15g/l丙氨酸;5mm ca
2
。
46.在一种实施方式中,所述步骤(2)的冻干采用真空冷冻干燥。
47.在一种实施方式中,所述蛋白酶k是来源于林伯氏白色链球菌(tritirachium album limber)或布氏白僵菌(beauveria brongniartii)的蛋白酶k。
48.在一种实施方式中,所述蛋白酶k是利用基因工程手段表达获得或者是从野生菌中分离提取获得的。
49.在一种实施方式中,所述外源表达系统包括但不限于大肠杆菌表达系统、枯草芽孢杆菌表达系统、昆虫细胞表达系统、哺乳动物细胞表达系统或酵母表达系统。
50.在一种实施方式中,所述蛋白酶k是通过粗分离、柱层析等方式获得。
51.在一种实施方式中,所述粗分离包括但不限于盐析法、等电点沉淀法、有机溶剂沉淀法;所述柱层析包括但不限于分子筛层析、离子交换层析、疏水吸附层析、亲和层析。
52.本发明还提供应用所述方法制备的蛋白酶k冻干粉。
53.本发明还提供蔗糖、海藻糖、麦芽糖、肌醇、甘氨酸、l
‑
丝氨酸、α
‑
丙氨酸、peg6000、peg8000、bsa、甘油中的一种或多种在单独或与ca
2
共同提高蛋白酶k冻干存活率、储存稳定性方面的应用。
54.有益效果:
55.1、本发明的蛋白酶k冻干保护剂具有良好的冻干保护效果,使蛋白酶k经过冻干处理后的存活率维持在90%甚至95%以上。
56.2、本发明的冻干保护剂有助于提高蛋白酶k的储藏稳定性,获得的蛋白酶k冻干粉在42℃加速孵育14天残余活力能够维持在90%以上;在
‑
20℃冰箱存放1年,其酶活性维持在90%以上,酶粉稳定性好同时便于储存和运输。
57.3、应用本发明的冻干保护剂制备的蛋白酶k冻干粉,外观良好,呈无定形白色粉末,无冒泡,皱缩等现象,酶粉以水复溶时间不超过10秒,蛋白比活力>40u/mg。
58.4、本发明获得的蛋白酶k冻干粉在60mg/ml浓度下依然能够保证良好的溶解性,在10秒内充分溶解。
附图说明
59.图1不同成分冻干保护剂对蛋白酶k冻干过程及热稳定性的影响。
60.图2冻干保护剂的浓度对蛋白酶k冻干过程的影响。
61.图3冻干保护剂的浓度对蛋白酶k热稳定性的影响。
62.图4不同配方对蛋白酶k冻干过程及热稳定性的影响。
63.图5ca
2
浓度对蛋白酶k冻干过程及热稳定性的影响。
具体实施方式
64.(一)技术术语:
65.蛋白酶k:本发明所提及的“蛋白酶k(proteinase k)”是指如酶命名法所定义的ec 3.4.21.14类中的酶。出于本发明的目的,根据具体实施方式中提及的方法确定蛋白酶k活性。在本发明的上下文中,蛋白酶k是利用基因工程手段在动物细胞或微生物细胞中表达获得的,或是从野生型微生物的细胞培养液中分离提取获得的。采用基因工程手段表达蛋白酶k的外源表达系统包括但不限于大肠杆菌表达系统、枯草芽孢杆菌表达系统、昆虫细胞表达系统、哺乳动物细胞表达系统或酵母表达系统。
66.细胞培养液:本发明所提及的细胞培养液是指由动物细胞或微生物在培养基中生长所产生的、未经回收或经过回收和/或纯化的制剂。例如,当微生物培养物在允许蛋白质合成(例如,由宿主细胞表达酶)并且将蛋白质分泌到细胞培养基中的碳限制条件下孵育生长到饱和时,产生发酵液。所述细胞培养液可以含有细胞、目的产物、细胞破碎后释放的内容物及细胞碎片。例如,微生物细胞培养液包含被微生物利用后的培养基成分以及可通过离心去除微生物细胞后存在的细胞碎片。
67.冻干保护剂:本发明所提及的冻干保护剂是指在酶(例如蛋白酶k)的冷冻干燥和/或储藏过程中,影响酶的活性的制剂或组分。在本发明上下文中,冻干保护剂的成分可选自:蔗糖、海藻糖、麦芽糖、肌醇、甘氨酸、l
‑
丝氨酸、α
‑
丙氨酸、peg6000、peg8000、bsa、甘油,由其中的一种或多种复配。可选地,冻干保护剂还可含有ca
2
及酸碱调节剂。
68.酸碱调节剂:本发明所提及的酸碱调节剂是指能被用来控制常温常压下或低温高压下,气体或液体逸度的固体或液态组合通常为强酸弱碱或弱酸强碱盐类,可在反应或保存中逐渐释出盐中的酸或碱以保持稳定的酸碱值。在本发明上下文中,酸碱调节剂用以维持蛋白酶k在其最适ph条件从而保证其最大催化活性。
69.分离:本发明所提及的分离是指从天然产生组分的环境中移出的该组分。
70.纯化:本发明所提及的纯化是指从含目标组分的样品中去除杂质或污染物,以获得具有更高的绝对或相对浓度的目标组分。
71.热稳定性:是指酶在一定温度下保持一段时间后,仍能够保持一定活性的能力。本技术的实施例中提及的热稳定性是指酶在42℃、50%湿度孵育14天后的残余活力。
72.残余活力(%):残余酶活性的百分比,也即,将酶经过一定条件下的处理,再于25℃下测得的处理后的酶活力与处理前的酶活力的比值。在本发明上下文中,冻干后的残余活力是指蛋白酶k经过真空冷冻干燥处理后的酶活与真空冷冻干燥处理前的酶活的百分比;升温孵育一段时间后的残余活力是指孵育结束时的蛋白酶k的酶活与孵育前蛋白酶k的酶活的百分比。
73.(二)检测方法
74.蛋白酶k酶活活力检测原理:
75.血红蛋白(hemoglobin)加入蛋白酶k后溶于三氯乙酸的肽和氨基酸。蛋白酶k可将血红蛋白水解为带酚基的氨基酸,在偏碱条件下酚基氨基酸可将福林酚试剂还原生成钼蓝和钨蓝,其颜色的深浅与酚基氨基酸含量成正比。在750nm处测定血红蛋白被蛋白酶k水解后的吸光度,结合标准曲线可计算得到水解产生的酚基氨基酸的量,进而计算得到蛋白酶k的活力。
76.蛋白酶k酶活检测方法:
77.酶活定义:单位酶活定义为在下述条件下,每分钟水解血红蛋白生成1μmol酪氨酸所需的酶量。具体检测方法如下:
78.反应底物:称取1.0g血红蛋白,溶于20ml水中,37℃恒温搅拌30min。添加4ml 1m naoh溶液,37℃恒温搅拌20min。添加18g尿素,37℃恒温搅拌60min。添加5ml 1m kh2po4溶液,37℃条件下用1m hcl调节至ph 7.5,用水定容至50ml,混匀,即为2.0%血红蛋白溶液。
79.酪氨酸标准品:称取0.01g l
‑
酪氨酸,用水定容至50ml,70~80℃加热直至l
‑
酪氨酸完全溶解,用0.22μm滤膜过滤,即为1.1mm l
‑
酪氨酸标准品。
80.305mm tca溶液:取6.1m tca溶液2ml,用水定容至40ml,混匀。
81.0.5m福林酚溶液:取1m福林酚溶液20ml,用水定容至40ml,混匀。
82.20mm cacl2溶液:称取7.351g cacl2·
2h2o,用水定容至50ml,混匀,即为1m cacl2溶液。取10ml 1m cacl2溶液,用水定容至500ml,混匀,用0.22μm滤膜过滤,4℃存放。
83.标准曲线的制作:按照如下活性测定方法检测不同标准品酪氨酸溶液在显色体系中750nm处的吸光值,再根据不同浓度和对应的吸光值拟合得到酪氨酸浓度和吸光度的曲线,用于计算蛋白酶k的活力。
84.酶活测定方法:向15ml离心管中加入2.5ml的2%血红蛋白溶液,分为空白组和实验组,均置于37℃水浴锅中恒温10min,然后,空白组加入5ml 305mm tca溶液,实验组加入0.5ml稀释至合适倍数的蛋白酶k溶液,震荡混匀后在37℃下恒温反应10min,再向反应组中加入5ml 305mm tca溶液,空白组加入0.5ml稀释同样倍数后的酶液。室温静置20后,0.22μm滤膜过滤澄清反应液置于冰盒待用。
85.再取新的15ml离心管,将上述空白和实验组的反应液各取2.5ml加到15ml管中,标曲样品分别加入0、0.05、0.1、0.3、0.5、0.7ml标准酪氨酸溶液,2.5、2.45、2.4、2.2、2.0、1.8ml 200mm hcl,再向所有管中加入5ml 500mm naoh,所有样品震荡混匀后每管加入1.5ml 0.5m的福林酚溶液,室温静置30min,如有沉淀则过滤后立即在750nm分光光度计下读数。
86.根据检测出来的od值,绘制δa750nm标准与酪氨酸含量(μm)的标准曲线,从而计算得到蛋白酶k溶液的比活力。蛋白酶k溶液的浓度检测采用bicinchoninic acid(bca)法进行检测。
87.实施例1蛋白酶k的分离和纯化
88.提取蛋白酶k:利用酵母分泌表达或其他表达体系制备蛋白酶k,发酵下罐的蛋白酶k上清液(离心去除微生物细胞后的含蛋白酶k的发酵产物上清液)可通过以下几种方式,获得纯化后的酶液。
89.1.粗分离:
90.(a)盐析法:利用硫酸铵分级沉淀蛋白质。首先配制饱和硫酸铵溶液(通常饱和度为33%~50%),边搅拌边慢慢加入等体积的饱和硫酸铵溶液至蛋白浓度为20mg/ml的蛋白上清液中,将溶液置于4℃,磁力搅拌器搅拌6小时或搅拌过夜,使蛋白质充分沉淀;将蛋白质溶液于12000g 4℃离心20min,弃上清保留沉淀,沉淀用20mm ph7.0 hepes充分溶解后,进行超滤置换步骤,置换液为20mm ph7.0 hepes,以彻底除去硫酸铵。
91.(b)有机溶剂沉淀法:采用无水乙醇纯化,具体步骤为:在蛋白浓度为20mg/ml的蛋白上清液中加入无水乙醇至体系中乙醇终浓度为30%(v/v),4℃静置过夜,12000g 4℃离心20min;取上清,再加入无水乙醇至体系中乙醇终浓度为60%,4℃静置过夜,12000g 4℃离心20min,将得到的沉淀用20mm ph7.0 hepes充分溶解,即为纯化后的酶液。
92.(c)超滤置换法:采用截留分子量不大于30kda的透析膜,透析处理,收集留在透析膜内的组分;或者采用截留分子量不小于30kda的超滤膜,收集透过膜的组分;或者采用上述两种方式相结合的超滤手段,获取的目的蛋白所在组分的分离方式。
93.2.柱层析:对于步骤1粗分离后的酶液进行(e)或(f)的处理:
94.(e)离子交换层析:采用阳离子交换方式纯化,阳离子包含但不限定于弱阳离子层析、强阳离子层析、包含阳离子交换功能的复合层析方式。
95.(f)阳离子交换层析:采用sp
‑
琼脂糖凝胶ff(sp
‑
sepharose ff)层析,具体方法为:将经过步骤1粗分离后的溶液以20mg总蛋白/ml填料的上样量上样sp
‑
琼脂糖凝胶ff,样品溶液和sp
‑
琼脂糖凝胶ff柱层析的缓冲体系均为20mm naac,ph4.0,通过增加盐浓度的方式进行线性洗脱(0
‑
1m nacl,10cv),根据活性检测结果,收集目的蛋白所在的组分。
96.实施例2冻干粉的制备方法:
97.将实施例1制备纯化后的酶液单独或与保护剂混合,倒入干净无菌的玻底直径14cm的玻璃平皿中,保证液面高度不超过1cm,以保证最好的升华效果(液面过高、液体体积过多会影响升华效率),后置于冷冻干燥机的板层上冻干。
98.冻干机程序设置如下;
99.a.预冻阶段:设置板层温度为
‑
45℃,时长2.5h;退火温度
‑
25℃,时长2h;随后再降温至
‑
45℃,时长3h;回温速率为1℃/min;
100.b.一次升华:设置真空值在20pa以下,由步骤a的
‑
45℃升至
‑
18℃,时长22h;第二阶段板层温度升至
‑
15℃,时长12h;第三阶段板层温度升至
‑
12℃,时长3h;第四阶段板层温度升至
‑
10℃,时长3h;回温速率为0.5℃/min;
101.c.解析干燥:设置真空值在10pa以下,第一阶段板层温度升至15℃,时长1h;第二阶段板层温度升至30℃,时长1h;回温速率为1℃/min;
102.d.冻干程序结束,最终获得白色粉末酶粉,
‑
20℃保存。
103.实施例3冻干保护剂成分的筛选及冻干酶粉的制备
104.在50mm ph7.0 hepes缓冲液中,分别以蔗糖、海藻糖、麦芽糖、肌醇、甘氨酸、l
‑
丝氨酸、α
‑
丙氨酸、peg6000、peg8000、bsa和甘油作为冻干保护剂,将比活为48u/mg、浓度为60mg/ml的蛋白酶k分别与等体积的浓度为30mg/ml蔗糖、30mg/ml海藻糖、30mg/ml麦芽糖、30mg/ml肌醇、30mg/ml甘氨酸、30mg/ml l
‑
丝氨酸、30mg/mlα
‑
丙氨酸、3mg/ml peg6000、3mg/ml peg8000、30mg/ml bsa、20%甘油混合,并分别添加1
‰
体积的1m cacl2溶液,使蛋
白酶k在溶液中的终浓度为30mg/ml,缓冲液hepes(ph 7.0)终浓度为50mm,ca
2
浓度为5mm。按照实施例2的步骤制备冻干酶粉,分别测定冻干后酶粉的酶活,及酶在42℃、50%湿度孵育14天后的蛋白酶活力。用50mm ph7.0 hepes缓冲液配制终浓度为30mg/ml的蛋白酶k
‑
hepes溶液作为对照,按照上述相同方法处理。
105.结果如图1所示,蛋白酶k在不添加保护剂的情况下,冻干后残余活力为冻干前活力的70.4%,在42℃、50%湿度孵育14天后残余活力为70.1%,在单独添加蔗糖、海藻糖、甘氨酸、丙氨酸及丝氨酸后,冻干后残余活力可保持为冻干前活力的90%以上,相比于不添加保护剂的对照组提高了20%,同时42℃、50%湿度孵育14天后蛋白残余活力继续保持在90%以上;麦芽糖作为保护剂冻干后,残余活力为冻干前的85%,42℃、50%湿度孵育14天后蛋白残余活力为84%;其余类型的保护剂如甘露醇、肌醇、聚乙二醇、甘油等冻干后残余活力相比于冻干前下降20%以上,对比不添加保护剂的对照组并无明显区别。表明糖类特别是非还原性二糖及氨基酸在蛋白酶k冻干过程中发挥重要的保护作用。
106.实施例4冻干保护剂浓度的筛选及冻干酶粉的制备
107.在50mm ph7.0 hepes缓冲液中分别配制如下冻干保护剂体系,使体系中蔗糖、海藻糖、麦芽糖、甘氨酸、l
‑
丝氨酸、α
‑
丙氨酸的终浓度分别为3g/l,15g/l和30g/l,ca
2
终浓度为5mm,蛋白酶k的终浓度为30mg/ml,按照实施例2的步骤制备冻干酶粉,分别测定冻干酶粉在冻干后的残余活力及在42℃、50%湿度孵育14天后的残余活力。ca
2
以盐的形式加入,可以为氯化钙、乙酸钙、葡萄糖酸钙、磷酸二氢钙、硝酸钙、碳酸氢钙、硫酸氢钙、亚硫酸氢钙或次氯酸钙,本实施例以氯化钙为例。
108.冻干后的蛋白比活力结果如图2所示,蔗糖、海藻糖、甘氨酸、丝氨酸及丙氨酸三种比例的添加量都能保证蛋白酶k冻干后90%以上的活力,三组差距较小,但在1.5%浓度下保护作用相对更优,麦芽糖作为保护剂冻干后蛋白活力保持在85%左右;热稳定性结果如图3所示,蔗糖、海藻糖、甘氨酸、丝氨酸及丙氨酸三种添加比例都能保证蛋白酶k维持90%的残余活力,1.5%浓度下残余活力最高。
109.实施例5不同配方的冻干保护剂及冻干酶粉的制备
110.在50mm ph7.0 hepes缓冲液中,按如下配方配制冻干保护剂(浓度为与蛋白酶k混合后的终浓度):
111.配方1:1.5%蔗糖,1.5%海藻糖;5mm ca
2
112.配方2:1.5%蔗糖,1.5%甘氨酸;5mm ca
2
113.配方3:1.5%蔗糖,1.5%丝氨酸;5mm ca
2
114.配方4:1.5%蔗糖,1.5%丙氨酸;5mm ca
2
115.配方5:1.5%海藻糖,1.5%甘氨酸;5mm ca
2
116.配方6:1.5%海藻糖,1.5%丝氨酸;5mm ca
2
117.配方7:1.5%海藻糖,1.5%丙氨酸;5mm ca
2
118.配方8:1.5%甘氨酸,1.5%丝氨酸;5mm ca
2
119.配方9:1.5%甘氨酸,1.5%丙氨酸;5mm ca
2
120.配方10:1.5%丝氨酸,1.5%丙氨酸;5mm ca
2
121.向上述配方中加入实施例1制备的蛋白酶k,使蛋白质终浓度为30mg/ml。按照实施例2的步骤制备冻干酶粉,分别测定冻干后酶粉及酶粉在42℃、50%湿度孵育14天后的蛋白
残余活力。
122.冻干后及热稳定性检测结果如图4所示,上述配方1~配方10均能保证蛋白酶k冻干后保持冻干前的95%以上的活性,42℃、50%湿度孵育14天后蛋白残余活力也在95%以上。对冻干粉的溶解性进行测试,结果显示,获得的蛋白酶k冻干粉在60mg/ml浓度下依然能够保证良好的溶解性,在10秒内充分溶解。
123.由此结果,蔗糖、海藻糖、甘氨酸、丝氨酸、丙氨酸无论是单独配方还是复合调配,对蛋白酶k冻干及冻干粉热稳定性都具有极佳的保护作用。
124.实施例6不同ca
2
浓度下制备冻干酶粉
125.在50mm ph7.0 hepes缓冲液中,加入终浓度15g/l丝氨酸,15g/l丙氨酸和实施例1制备的蛋白酶k,使蛋白酶k的终浓度为30mg/ml,并加入cacl2溶液,使ca
2
在缓冲液中的终浓度分别为0.2、0.5、1、5、10、20、50、200mm,按照实施例2的步骤制备冻干酶粉,所获得的蛋白酶k冻干粉,外观良好为无定形白色粉末,无冒泡,皱缩等现象,酶粉以水复溶时间不超过10秒,蛋白比活力≥40u/mg。
126.分别测定冻干后的酶粉相比于冻干前的残余活力,及酶粉在42℃、50%湿度孵育14天后的蛋白残余活力。结果如图5所示,不加入ca
2
,蛋白酶k冻干后残留酶活仅为50%,说明ca
2
为蛋白酶k冻干过程和发挥活性所必须,0.2mm~50mm的ca
2
能够有效减少蛋白酶k冻干过程中活性的损失,ca
2
浓度高于50mm后,蛋白酶k活力及稳定性明显下降,低于90%。
127.本发明还尝试将氯化钙替换为乙酸钙、葡萄糖酸钙、磷酸二氢钙、硝酸钙、碳酸氢钙、硫酸氢钙、亚硫酸氢钙、次氯酸钙或上述钙盐的复配混合物,结果显示,在ca
2
浓度一致的情况下,使用不同钙盐对蛋白酶k活力或稳定性的影响差别不显著。
128.实施例7蛋白酶k冻干粉在
‑
20℃条件下储存的稳定性
129.分别检测实施例3的对照组和实施例5制备的蛋白酶k冻干粉在
‑
20℃下的储存稳定性。每两个月对
‑
20℃条件下储存的蛋白酶k冻干粉进行残余活力监测,结果如表1所示,无保护剂的条件下,冻干粉在
‑
20℃冰箱储存一年,其残余活力降低至50.5%;配方1~10能够显著提高蛋白酶k的酶活力稳定性,
‑
20℃冰箱储存一年,残余活力分别为95.9%、95.5%、95.7%、95.3%、95.3%、95.8%、95.2%、95.1%、95.3%、95.7%。
130.表1不同配方对蛋白酶k在
‑
20℃储存12个月稳定性的影响
[0131] 0天60天120天180天240天300天360天未添加100%90.0%83.5%72.0%62.5%55.0%50.5%配方1100%98.0%97.7%97.1%96.9%96.5%95.9%配方2100%98.9%98.2%97.6%97.0%96.5%95.5%配方3100%98.7%98.3%97.8%97.0%96.4%95.7%配方4100%98.8%97.9%97.4%96.8%95.9%95.3%配方5100%98.9%97.9%97.3%96.8%95.8%95.3%配方6100%99.5%98.5%97.4%96.7%96.2%95.8%配方7100%99.1%98.6%97.5%96.9%95.9%95.2%配方8100%98.8%97.9%97.2%96.6%95.8%95.1%配方9100%98.2%97.7%97.0%96.3%95.7%95.3%配方10100%99.2%98.6%97.8%96.9%96.2%95.7%
[0132]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。