improves age-related decline of insulin signaling in mice[j].nutrients,2015,7(4),3038-3053.]研究了人参果提取物对老年小鼠胰岛素敏感性及相关分子机制的影响。将15月龄c57bl/6小鼠维持在常规饮食(con组)或添加0.05%人参浆果提取物(gbd组)的常规饮食中24和32周,发现补充人参果提取物可减少胰岛肥大,foxo1和pparγ的表达也增加,证明人参果提取物喂养能抑制foxo1和pparγ的表达下降,增加胰岛素信号传导,有助于改善老年小鼠胰岛素敏感性,因此人参果提取物可能具有改善糖尿病等老年代谢紊乱的潜力。choi[choi hanseok,kim sunmi,kim min jung,et al.efficacy and safety of panax ginseng berry extract on glycemic control: a 12-wk randomized, double-blind, and placebo-controlled clinical trial[j].journal of ginseng research,2018,42(1): 90-97.]评估了空腹血糖水平在100 mg/dl到140 mg/dl之间的受试者服用人参果提取物12周的治疗有效性和安全性,采用随机、双盲、安慰剂对照的临床实验模式,将72名受试者被随机分为两组:人参果提取物组和安慰剂组,检测了葡萄糖代谢的相关参数。发现人参果提取物能显著降低空腹血糖以及餐后口服葡萄糖耐量,安慰剂组无下降。两组患者的安全状况无差异,表明人参果提取物具有改善人体葡萄糖代谢的潜力,尤其对于空腹血糖水平大于等于110 mg/dl的人。kim[kim myung-sunny,kim soon-hee,park su-jin,et al.ginseng berry improves hyperglycemia by downregulating hepatic gluconeogenesis and steatosis in mice with diet-induced type 2 diabetes[j].journal of functional foods,2017,35:295-302.]探讨了人参果对ii型糖尿病小鼠的作用机制,治疗12周后,发现人参果显著改善了小鼠的高血糖、胰岛素抵抗和糖耐量,下调了pepck和g6pase等糖异生基因的表达,显著降低了参与糖异生途径的肝代谢产物,如葡萄糖-6-磷酸和二羟基丙酮磷酸,脂肪肝也有明显改善,降低了fas、acc and srebp1等转录因子,降低了tg含量,以及脂肪合成酶的表达,使脂肪肝和脂质堆积的hepg2细胞ampk磷酸化增加,证明人参果具有降低血糖的作用。
[0005]
本专利将新鲜人参果去除种子后,通过水煎煮提取结合d101大孔吸附树脂洗脱得到人参果提取物(gbe),采用有机试剂萃取法将人参果提取物分为7个不同极性的分离部位。采用人体hepg2细胞建立胰岛素抵抗模型,对人参果7个不同极性部位进行体外降糖活性筛选,最终确定最优降糖活性部位,该部位降糖活性优于其他各组。
技术实现要素:
[0006]
本发明目的是制备一种具有降糖活性作用的人参果提取物最佳降糖活性部位,用于治疗ii型糖尿病。
[0007]
1. 5年生新鲜人参果(ginseng berry)除去种子后,加入3倍量蒸馏水煎煮提取2次,每次3小时,合并提取液,上柱d101型大孔吸附树脂,水洗脱3个柱体积后,使用60%乙醇洗脱,洗脱液抽滤后浓缩、冻干,得到人参果提取物(gbe),置于干燥器中保存。
[0008]
2. 称取30g人参果提取物,加入400ml蒸馏水,60℃水浴溶解,使用不同有机试剂依次对水溶液进行萃取,每种试剂萃取3次,3次体积分别为400ml、300ml、200ml,合并萃取液,减压浓缩,最终得到6个萃取部位和1个水溶部位共7个不同极性部位。将各部位冻干,置于干燥器中保存。
[0009]
3. 7个不同极性部位分别为:gbe-1部位(石油醚萃取部位)、gbe-2部位(乙醚萃取
部位)、gbe-3部位(乙酸乙酯:乙醚=5:3萃取部位)、gbe-4部位(乙酸乙酯:正丁醇=4:1萃取部位)、gbe-5部位(乙酸乙酯:正丁醇=1:1萃取部位)、gbe-6部位(正丁醇萃取部位)、gbe-7部位(水溶解部位)。
[0010]
4. 使用棕榈酸(palmitic acid, pa)造模hepg2胰岛素抵抗模型,先用无水乙醇配制100mm的pa溶液,用超纯水配制0.1n的naoh溶液以及10%的牛血清白蛋白(bovine serum albumin, bsa)溶液,将pa溶液与naoh溶液1:1混合,70℃水浴30min制成混合液,混合液与10% bsa溶液按1:19比例混合,涡旋30秒,55℃水浴15min,制成pa工作液,浓度为2.5 mm。使用该方法配制的pa工作液稀释为不同浓度后,可用于hepg2细胞胰岛素抵抗模型的建立。
[0011]
5. 使用萃取法对人参果提取物按极性大小进行分段后,对不同极性部位进行hepg2细胞胰岛素抵抗模型降糖活性筛选,最终获得人参果提取物gbe-5部位(乙酸乙酯:正丁醇=1:1萃取部位)相较于其他部位具有更好的降糖活性。
具体实施方式
[0012]
实施例1:1. 人参果提取物不同极性部位制备取5年生新鲜人参果(ginseng berry)除去种子后,加入3倍量蒸馏水煎煮提取2次,每次3小时,合并提取液,上柱d101型大孔吸附树脂,使用60%乙醇洗脱,洗脱液抽滤后浓缩、冻干,得到人参果提取物。称取30g人参果提取物,加入400ml蒸馏水,60℃水浴溶解,使用不同有机试剂依次对水溶液进行萃取,每种试剂萃取3次,3次体积分别为400ml、300ml、200ml,合并萃取液,减压浓缩,得到6个萃取部位以及一个水溶部位,分别为:gbe-1部位(石油醚萃取部位)、gbe-2部位(乙醚萃取部位)、gbe-3部位(乙酸乙酯:乙醚=5:3萃取部位)、gbe-4部位(乙酸乙酯:正丁醇=4:1萃取部位)、gbe-5部位(乙酸乙酯:正丁醇=1:1萃取部位)、gbe-6部位(正丁醇萃取部位)、gbe-7部位(水溶解部位)。将各冻干部位,置于干燥器中备用。
[0013]
2. hepg2细胞的培养取冻存的hepg2细胞,37℃水浴复苏,用含有10%灭活胎牛血清、1%青霉素-链霉素的rpmi 1640培养基,于5%的co2孵育箱中,37℃进行培养,观察细胞生长状态,按每3天1:3比例传代,取对数生长期的细胞用于实验。
[0014]
3. 人参果提取物不同极性部位对正常hepg2细胞给药后增殖的影响实验设为空白组、对照组、实验组,其中实验组加入不同浓度(1000、500、250、125、62.5、36.25 μg/ml)的人参果提取物不同极性部位(人参果提取物、gbe-3部位、gbe-4部位、gbe-5部位、gbe-6部位、gbe-7部位),对照组为正常培养的细胞不加药物,空白组为不含细胞和药物的培养基。取对数生长期的细胞,用细胞计数板制成密度为5
×
104/ml细胞悬液,接种在96孔板中,每孔100μl,不断摇晃防止细胞沉降,37℃,5% co2细胞培养箱中培养24小时,待90%细胞贴壁后,吸出培养基,实验组加入含有不同浓度人参果提取物各萃取部位的含药培养基(培养基含有0.1% dmso),每个浓度设6个复孔,每孔100μl;对照组及空白组加入100μl培养基(培养基含有0.1% dmso),每组6个复孔。在37℃、5%的co2培养箱中继续培养 24 小时后吸出培养基,重新加入培养基,每孔100μl,并向每孔加入 10μl的cck-8溶液,将96孔板在37℃恒温培养箱内孵育2个小时,用酶标仪测定450nm处的吸光度值。
[0015]
4. hepg2细胞胰岛素抵抗模型的建立使用棕榈酸(palmitic acid, pa)造模hepg2胰岛素抵抗模型,先用无水乙醇配制100mm的pa溶液,用超纯水配制0.1n的naoh溶液以及10%的牛血清白蛋白(bovine serum albumin, bsa)溶液,将pa溶液与naoh溶液1:1混合,70℃水浴30min制成混合液,混合液与10% bsa溶液按1:19比例混合,涡旋30秒,55℃水浴15min,制成pa工作液,浓度为2.5 mm。使用完全培养基将pa工作液稀释为1 mm,0.75 mm,0.5 mm,0.25 mm浓度,过滤备用。取对数生长期的细胞,用细胞计数板制成密度为5
×
104/ml细胞悬液,不断摇晃防止细胞沉降,接种在96孔板中,每孔100μl,在5%的co2培养箱中,37 ℃孵育24 h,待90%细胞贴壁后,吸出培养基。设空白组、正常组、模型组,模型组每孔加入100μl的各浓度pa工作液,各组设5个副孔,继续培育24h后,吸出pa工作液,pbs洗涤3次,加入100μl的无血清培养基,24小时后检测培养基上清液中葡萄糖含量,计算各组细胞的葡萄糖消耗量。
[0016]
5. 人参果提取物不同极性部位对胰岛素抵抗hepg2细胞葡萄糖消耗的影响实验设空白组、正常组、模型组、阳性组、实验组,空白组无细胞,正常组、模型组不加任何药物,阳性组加盐酸二甲双胍阳性药,实验组加不同浓度(200、100、50、25、12.5、6.25 μg/ml)的人参果提取物不同极性部位(gbe-3部位、gbe-4部位、gbe-5部位、gbe-6部位、gbe-7部位),每组设6个副孔。将传代后处于对数生长期的hepg2细胞,用培养基调整细胞密度为5
×
10
4 /ml的细胞悬液,不断摇晃接种在96孔培养板上,每孔100μl,于37℃,5%的co2培养箱中培养24小时,待90%细胞贴壁后,弃去原培养基,以“2.4”中介绍的造模方法,配制0.25mm浓度的pa工作液,分别加入模型组、阳性组、实验组中,每孔100 μl,于5%的co2培养箱中,37 ℃孵育24 h,建立hepg2细胞胰岛素抵抗模型。
[0017]
造模后,吸出培养基,pbs洗涤3次,正常组、模型组加不含药物的完全培养基,阳性组加入含有165 μg/ml盐酸二甲双胍的完全培养基,实验组加入含药的完全培养基(以上培养基均含有0.1% dmso),于5%的co2培养箱中,37 ℃孵育24 h,弃去培养基,空白组、正常组、模型组、阳性组、实验组分别加入100 μl的无血清培养基,于5%的co2培养箱中,37 ℃孵育24 h,检测培养基上清液中葡萄糖含量,细胞葡萄糖消耗量(glucose consumption, gc)=空白组葡萄糖含量-对应组葡萄糖的含量。
[0018]
6. 细胞存活率实验在检测完葡萄糖含量的96孔板中,每孔加入10μl的cck-8试剂,于37℃恒温培养箱中培养2小时后测定450nm处吸光度值,计算细胞存活率,细胞存活率=[(a-c)/(b-c)]
×
100%,a:实验组吸光值(含有培养基、细胞、待测药物和cck-8的吸光值),b:对照组吸光值(含有培养基、细胞、cck-8的吸光值),c:空白组吸光值(含有培养基、cck-8的吸光值)。
[0019]
7. 统计学分析结果均以`x
±
s表示,数据处理使用excel统计软件进行t-test组间分析,p<0.05认为有统计学差异,p<0.01认为有极显著差异。
[0020]
8. 结果8.1 人参果提取物不同极性部位对正常hepg2细胞增殖的影响将各浓度实验组吸光值与正常组和对照组吸光值进行比较,以“2.6”方法计算细胞存活率。结果表明,当药物浓度≥250μmol/l时,实验组细胞存活率普遍<50%,故将人参果提取物给药浓度设置为200、100、50、25、12.5、6.25 μmol/l进行实验。
[0021]
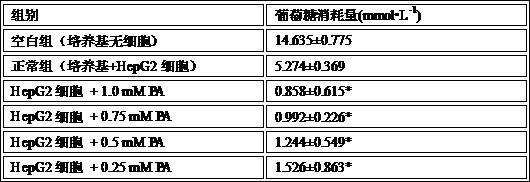
8.2 hepg2细胞胰岛素抵抗模型的建立发现pa浓度为1 mm,0.75 mm,0.5 mm,0.25 mm的模型组与正常组比较,葡萄糖消耗量极显著降低(p<0.01),表明各浓度均成功建立hepg2细胞胰岛素抵抗模型,考虑到pa浓度对细胞存活率的影响,故采用文献报道的0.25 mm pa浓度造模,测定结果如表1所示。
[0022]
表1 不同浓度pa造模对hepg2细胞糖消耗的影响(`x
±
s)与正常组比较,p<0.01用“*”表示8.3 人参果提取物不同极性部位对胰岛素抵抗hepg2细胞葡萄糖消耗的影响人参果提取物各极性部位降糖活性测定结果如表2所示,结果以均值
±
标准差表示。
[0023]
表2 实验组各部位对胰岛素抵抗hepg2细胞糖消耗的影响(`x
±
s)
与模型组比较,p<0.05用“*”表示,p<0.01用“**”表示;与人参果gbe-5部位比较,p<0.01用“▲”表示。
[0024]
实验结果表明,与正常组比较,模型组葡萄糖消耗量显著低于正常组(p<0.01),表明hepg2细胞胰岛素抵抗模型造模成功,与模型组比较,实验组人参果提取物不同极性部位葡萄糖消耗量显著高于(p<0.05)或极显著高于(p<0.01)模型组。
[0025]
空白组、模型组、阳性组、实验组各浓度细胞葡萄糖消耗量(gc)如表1所示,为消除
细胞个数对葡萄糖消耗量的影响,计算细胞葡萄糖消耗量(gc)与细胞存活率(cck-8)的比值,人参果gbe-5部位具有最优降糖活性,但降糖效果低于阳性组 (p>0.05),差异无统计学意义,结果如表2所示。
[0026]
9. 结论通过萃取法对人参果提取物按极性大小进行分段,并对不同极性部位进行细胞降糖活性筛选,最终发现人参果提取物gbe-5部位(乙酸乙酯:正丁醇=1:1萃取部位)相较于其他部位具有更好的降糖活性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。