1.本发明涉及生物检测领域,具体涉及基于虚拟分割方法的蛋白靶分子数字化定量检测方法。
背景技术:
2.体外诊断技术(in vitro diagnosis,ivd)是在人体之外,通过对人体的样品(血液、体液、组织等)进行样品处理、生化反应以及结果检测,从而获得临床诊断信息的技术。体外诊断技术的检测对象是液体,常规检测体积1~100ml。液体中的生物、化学物质主要是核酸分子(dna/rna),蛋白分子。体外诊断检测的主要人体样品是血液。由于正常人体生物、化学物质在血液中的浓度相对恒定,特定生物、化学物质的浓度变化,可以表征人体是否处于健康状态。体外诊断过程可以分为以下三个阶段。
3.(一)样品处理
4.人体样品,尤其是血液,含有多种生物、化学物质,例如dna/蛋白靶分子。需要对样品进行处理,对待检测的靶分子进行富集、纯化,从而减少人体样品中其余物质对生化反应和结果检测的干扰。
5.(二)生化反应
6.体外诊断中,经过处理和捕获的靶分子一般浓度较低。需要经过配体放大反应,增大靶分子物质量或者表征靶分子的物质量。例如,常用的dna靶分子配体放大反应是pcr反应,通过反应增大待测dna分子的物质总量;常用的蛋白靶分子配体放大反应是elisa(酶联促发反应),通过反应生成大量化学发光分子用于表征蛋白靶分子,增大蛋白靶分子的检测信号。
7.(三)结果检测
8.常规生物、化学检测技术基于光学检测。经过配体放大反应后,较高浓度的核酸、蛋白光学标记物(例如荧光基团、化学发光物质)通过光学器件检测,例如光电倍增管(pmt)或者ccd/cmos成像光学器件。
9.常规蛋白靶分子的检测方法是酶联免疫吸附实验(elisa)。elisa有多种类型,其中一种典型的elisa方法是从将目标抗原(蛋白靶分子)固定在一个固体表面开始。这通常用一块能够被动结合蛋白的96孔或384孔板完成。通过偶联某种酶来制备相应抗体。添加这种偶联物到样品中即可让抗体结合抗原。对目标抗原不具特异性的结合物质随后用洗涤步骤去除。然后,添加酶的底物,以让溶液中的底物与连接抗体的酶发生反应,最终产生颜色、荧光或化学发光变化,读取这种变化即可测定每份样品中蛋白靶分子的数量。elisa检测方法有很多,但在实验室中最普遍的方法是比色、荧光和化学发光法。
10.elisa方法可以分为三大类:定量、半定量和定性检测方法。定量elisa方法的缺陷是:
11.(1)相对定量。需要使用标准品,以解释实验样品的结果。生成标准曲线(通常借助梯度稀释且浓度已知的某种分析物或其他标准品)。将样品的读取值与标准曲线进行比较,
并确定绝对定量的分析物浓度。
12.(2)一致性差。由于待测样品与标准样品、不同待测样品之间的elisa反应效率有可能不一致,由此导致其定量分析所依赖的相对值不是恒定不变。另外,待测样品的反应体系与靶分子有竞争性作用,反应体系中的抑制物对生化反应效率也有影响。
13.这两大技术瓶颈造成了elisa技术的结果在实验室内部与实验室之间的偏差,甚至不同实验室得到的结果和结论相互矛盾。尤其在低浓度蛋白靶分子条件下,其检测的灵敏度、精确度都受到了限制。
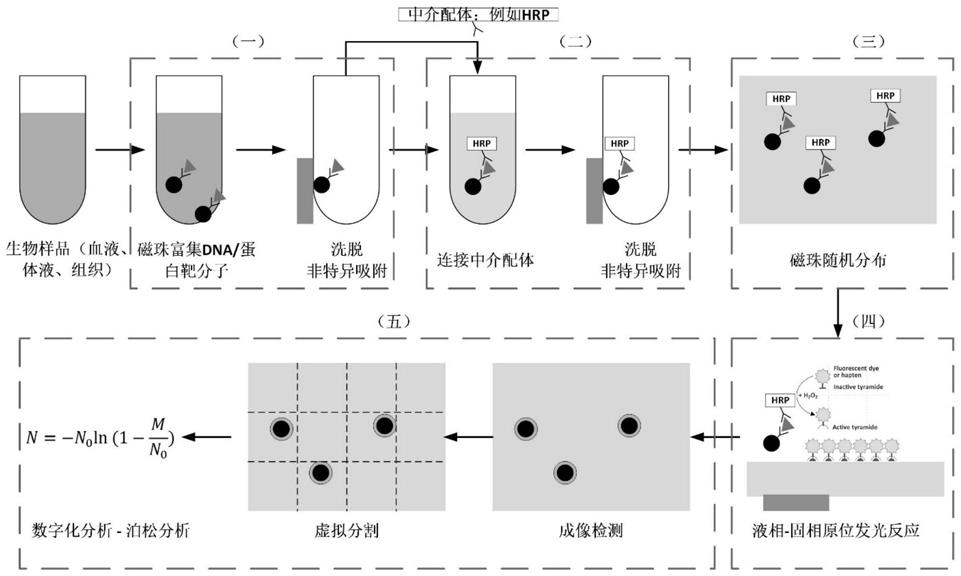
14.针对人体样品(尤其是血液)中痕量蛋白靶分子的可靠、灵敏、快速检测,是目前精准医学的重大需求。其中,数字化检测技术是目前的重点研发技术。数字化检测的核心过程是将待测样品均匀分配到大量的反应单元中,这些反应单元同时进行生化反应并进行结果检测。以针对核酸分子检测的数字pcr技术为例,策略是:将一个待测样品均匀分配到大量微小的反应单元中;然后,这些微小的反应单元同时进行pcr扩增反应,实现单拷贝或者多拷贝靶序列分子pcr扩增;扩增后,对每个反应单元检测到的荧光信号设定一个阈值,高于阈值时荧光信号的反应单元判读为1(“阳性”),低于阈值时荧光信号的反应单元判读为0(“阴性”)。理论上讲,每个反应单元中靶序列分子(dna模板)的分配存在三种可能性:零拷贝、一个拷贝或多个拷贝。当反应单元的数目足够大,大部分反应单元的内部只含有一个拷贝或者零拷贝靶序列分子(近似于泊松分布),从而实现单拷贝靶序列分子pcr扩增。最后,通过统计阳性和阴性两种信号类型的反应单元比例和数目,并进行泊松统计学分析,最终计算出原始待测样本中的靶序列拷贝数。
15.以针对蛋白检测的数字elisa技术为例,策略是:通过磁珠在样品中捕获待测蛋白靶分子。捕获到蛋白的磁珠被分配到与其尺寸接近的微坑阵列中,每个微坑只能容纳一个磁珠,每个微坑被氟化油单独隔离。然后,每个微坑进行elisa反应。反应后,对每个反应单元检测到的发光信号设定一个阈值,高于阈值时发光信号的反应单元判读为1(“阳性”),低于阈值时发光信号的反应单元判读为0(“阴性”)。理论上讲,每个磁珠捕获蛋白靶分子存在三种可能性:零分子、单分子或者多分子。当磁珠的数目足够大,大部分磁珠只捕获一个蛋白靶分子或者零蛋白靶分子;最终,大部分反应单元的内部只含有一个分子或者零分子,从而实现单分子光学信号放大。最后,通过统计阳性和阴性两种信号类型的反应单元比例和数目,并进行泊松统计学分析,最终计算出原始待测样本中的蛋白靶分子数目。
16.数字化检测的核心概念是:
17.(1)反应单元之间相互独立。每个反应单元内的生化反应不与其他反应单元的生化反应“串扰”。以针对核酸检测的数字pcr技术为例,两个反应单元内的pcr反应不能相互“串扰”;以针对蛋白检测的数字elisa技术为例,两个反应单元内的elisa反应不能相互“串扰”。
18.(2)反应单元空间尺寸均一,分布随机性。待测样品分布到每个反应单元的概率一样,为结果检测的精准分析奠定基础。
19.(3)反应单元数目远远高于待检测的dna/蛋白靶分子。从而,低浓度靶分子进入反应单元符合泊松分布,为结果检测的数据分析奠定理论基础。
20.反应单元不相互独立、反应单元空间尺寸不均一以及反应单元数目过低,都会对下游的结果检测产生误差。
21.数字化检测技术的优点是:
22.(1)绝对定量。可以直接计算靶分子的绝对数目,无需依赖于对照标准样品和标准曲线就可以进行精确的绝对定量检测。
23.(2)灵敏度高。可在物理层面实现单分子级检测。对每个反应单元的反应结果判读仅判断有/无两种状态。高于阈值时荧光信号的反应单元判读为1(“阳性”),低于阈值时荧光信号的反应单元判读为0(“阴性”)。
24.(3)准确度高。待测样品的反应体系分配过程可以极大降低与靶分子有竞争性作用的背景物质浓度,对生化反应抑制物的耐受能力也大大提高,因此数字化检测技术非常适合在复杂背景中检测痕量dna/蛋白靶分子。
25.现有数字化检测技术的不足是:
26.(1)数字化检测技术相关的微流体芯片设计、加工要求高。现有数字化检测技术需要设计、加工微米量级高精密微流体芯片,对待测dna/蛋白靶分子进行均匀物理分割。例如“油包水”数字pcr技术(伯乐、raindance),需要设计、加工几十~上百微米尺度的高精度微流道,并且利用油和水不相溶的特性,从而形成尺寸均一的独立反应单元(“微液滴”)。微坑式数字pcr芯片(赛默飞芯片),需要在硅基上加工尺度是几十微米的均匀微坑阵列,微坑上层覆盖氟化油,对样品物理隔离,形成尺寸均一的独立反应单元(“微坑”)。微坑式数字elisa芯片(quanterix公司),需要在聚合物表面加工几微米量级的高密度微坑阵列,单个磁珠被分配到微坑中,上层覆盖氟化油,实现样品物理隔离,形成尺寸均一的独立反应单元(“微坑”)。
27.(2)数字化检测技术对于检测器的要求高。物理分割后的单元经过生化反应(pcr、elisa),需要通过流式检测或者高清成像技术进行检测和分析。
28.目前体外诊断,急需可靠、灵敏、快速,并且价格低廉的数字化检测方法,实现数字化精准诊断,对疾病做到早诊、早治、早预防。
技术实现要素:
29.为了解决上述问题,本发明提供一种基于虚拟分割方法的蛋白靶分子数字化定量检测方法,其特征在于,所述方法包括:步骤1:待测蛋白靶分子溶液加入到反应位中,所述反应位具有平的底面并且所述底面固定有与所述待测蛋白靶分子产生抗原抗体反应的蛋白分子,反应时,所述待测蛋白靶分子随机分布到所述底面;步骤2:固定到所述底面的待测蛋白靶分子与中介配体结合,所述中介配体的作用是催化液相-固相原位发光反应;步骤3:将液相-固相原位发光反应液滴加到所述反应位中,在所述底面上进行所述液相-固相原位发光反应,该反应对待测蛋白靶分子进行光学放大,在所述待测蛋白靶分子周边形成固相发光区域;并且所述底面事先修饰与所述液相-固相原位发光反应生成的发光分子结合的功能基团,使得反应生成的发光分子共价连接到所述底面上;和步骤4:获得反应后所述平面底面的数字图片,然后采用虚拟分割方法,实现所述待测蛋白靶分子的数字化定量检测。
30.在一种实施方式中,所述待测蛋白靶分子溶液是来自血清、血浆、组织匀浆或细胞提取液的上清液。
31.在一种实施方式中,所述反应位是多孔酶标板的反应孔,所述多孔酶标板优选为48、96和384孔酶标板。
32.在一种实施方式中,所述待测蛋白靶分子与所述底面固定蛋白分子产生抗原抗体反应后和在所述步骤2之前,使用封闭液封闭所述底面。
33.在一种实施方式中,所述中介配体是辣根过氧化物酶,经过辣根过氧化物酶催化反应生成的发光分子与所述底面修饰的基团连接,所述底面修饰的基团为芳香基团,优选为甲苯基团或具有苯基团的bsa分子。
34.在一种实施方式中,步骤4中所述虚拟分割方法包括:将所述数字图片均匀分割划分为多个均匀虚拟反应单元,每个虚拟反应单元包括每个待测蛋白靶分子周边形成的发光分子区域,划分后,单个待测蛋白靶分子周边形成的发光分子区域不能处于两个所述反应单元内;对“虚拟反应单元”检测到的发光信号设定一个阈值,高于阈值时发光信号的反应单元判读为阳性,低于阈值时发光信号的反应单元判读为阴性;和通过数字化分析确定待测蛋白靶分子的绝对数量。
35.本发明的方法是生物数字检测领域的开拓性发明,本发明第一次提出了基于对于待测蛋白靶分子的结果数字化图像进行虚拟分割,实现待测生物靶标的数字化定量检测。本发明的优点是:(1)通过“虚拟分割”技术对检测结果图像中待测靶分子进行均匀分割,实现高精密、高准确、低成本的数字化检测。避免采用现有数字化检测技术中复杂、高精度、高成本的微流控芯片设计。(2)采用常规显微图像检测技术,实现高通量、快速、低成本的数字化检测。避免使用现有数字化检测的专用检测器。
36.本发明整个方法所要求的检测系统大大简化,检测耗材和检测系统成本大大降低,大大拓宽了数字定量技术应用。基于本发明方法,可以实现可靠、灵敏、快速,并且价格低廉的数字化检测。
附图说明
37.为了更清楚地说明本技术实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术中记载的一些实施例,对于本领域普通技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
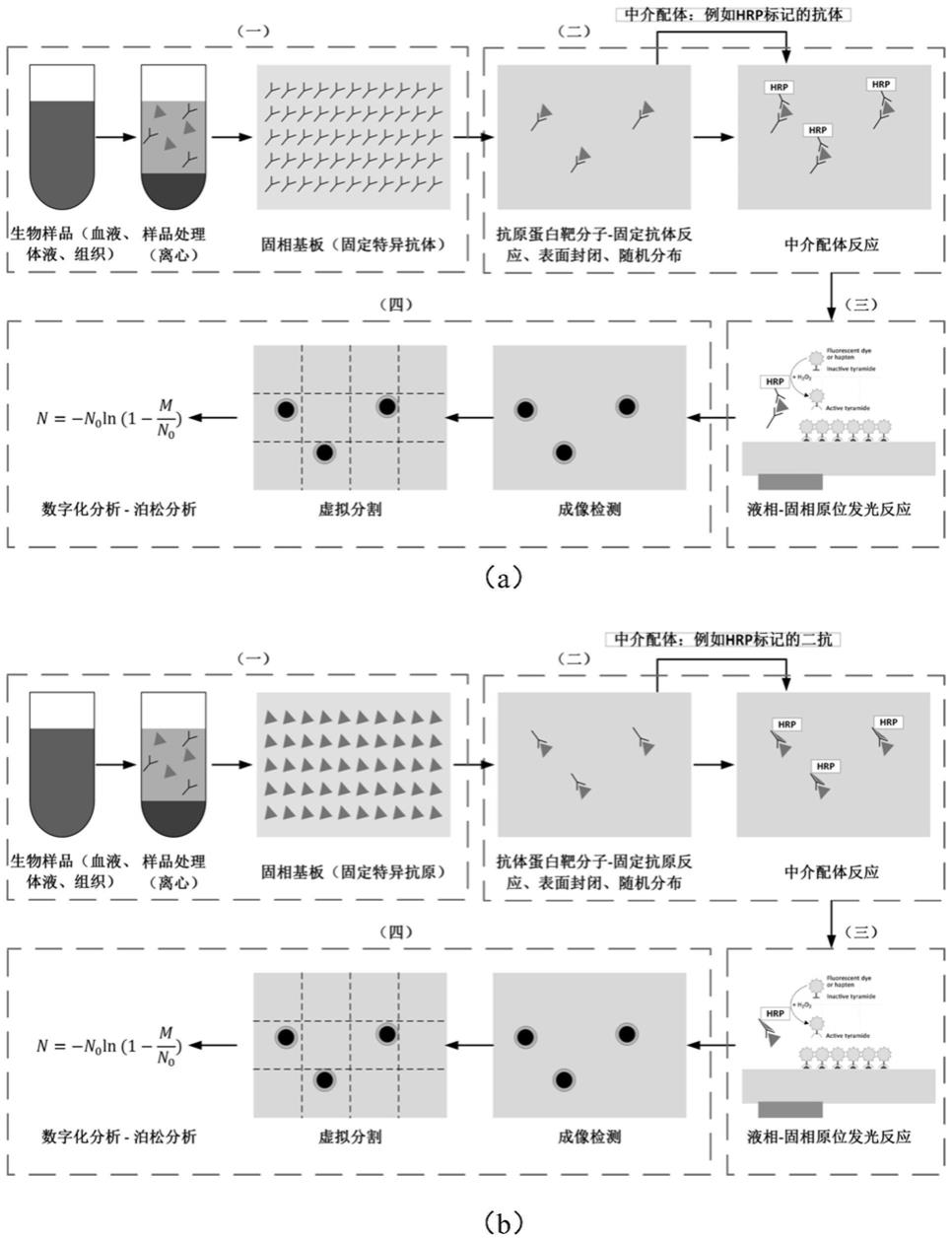
38.图1是本发明的基于虚拟分割方法的蛋白靶分子数字化定量检测方法原理示意图,其中图1a是抗原蛋白靶分子检测示意图,图1b是抗体蛋白靶分子检测示意图。
具体实施方式
39.为了使本领域技术领域人员更好地理解本技术中的技术方案,下面将结合下面结合实施例对本发明作进一步说明,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都应当属于本技术保护的范围。
40.实施例 基于虚拟分割方法的蛋白样品定量检测
41.针对人体样品,本发明提出一种基于“虚拟分割技术”的高灵敏蛋白靶分子数字化检测方法。本发明可以针对样品中的抗原蛋白靶分子进行高灵敏检测;也可以针对样品中的抗体蛋白靶分子进行高灵敏检测,得到临床诊断结果。例如:针对冠状病毒检测,有两种检测途径:一种是检测抗原蛋白靶分子。冠状病毒表面特异蛋白是抗原蛋白靶分子,抗原蛋
白靶分子浓度与冠状病毒浓度直接相关联。另一种是检测抗体蛋白靶分子。冠状病毒进入人体内,激发人体产生特异igm抗体,igm抗体是抗体蛋白靶分子。通过检测抗体蛋白靶分子浓度,可以间接表征冠状病毒浓度。
42.基于虚拟分割方法的蛋白数字化检测技术完整技术方案如图1(图1a和图1b)所示,包括以下五个步骤:
43.(一)痕量样品处理与富集
44.在此步骤,样品处理方法采用常规技术(粉碎、离心等),最终获得上清样品进行反应、检测。
45.(1)血清:全血样品于室温放置2小时或2-8℃过夜后于1000
×
g离心20分钟,取上清即可检测,收集血液的试管应为一次性的无内毒素试管。
46.(2)血浆:抗凝剂推荐使用edta钠盐,样品采集后30分钟内于1000
×
g离心15分钟,取上清即可检测,避免使用溶血,高血脂样品。
47.(3)组织匀浆:用预冷的pbs(0.01m,ph=7.4)冲洗组织,去除残留血液,称重后将组织剪碎。将剪碎的组织与对应体积的pbs(一般按1:9的重量体积比,比如1g的组织样品对应9ml的pbs,具体体积可根据实验需要适当调整,并做好记录。推荐在pbs中加入蛋白酶抑制剂)加入玻璃匀浆器中,在冰上充分研磨。为了进一步裂解组织细胞,可以对匀浆液进行超声破碎或反复冻融。最后将匀浆液5000
×
g离心5-10分钟,取上清检测。
48.(4)细胞提取液:贴壁细胞用冷的pbs轻轻清洗,然后用胰蛋白酶消化,1000
×
g离心5分钟后收集细胞;悬浮细胞可直接离心收集。收集的细胞用冷的pbs洗涤3次。每1
×
106个细胞中加入150-200μl pbs重悬并通过反复冻融使细胞破碎(若含量很低可减少pbs的体积)。将提取液于1500
×
g离心10分钟,取上清检测。
49.(5)细胞培养上清或其他生物体液:1000
×
g离心20分钟,除去杂质及细胞碎片,取上清检测。
50.与蛋白靶分子结合的特异抗体/抗原被固定在一个固相基板上(例如,96孔酶标板一个反应孔中)。
51.(二)随机分布、中介配体连接
52.在此步骤,上清样品中的蛋白靶分子与固相基板上的特异抗体/抗原结合,并且蛋白靶分子随机分布在固相基板上。这个步骤的关键是蛋白靶分子不发生团聚,随机分布在96孔酶标板一个反应孔的表面,该96孔酶标板每个孔的底面是平面。因此,蛋白靶分子与固相基板的特性抗体结合时,有必要采用超声、振动等方法,确保蛋白靶分子随机分布到反应孔的底面平面。有必要的话,需要增加一步蛋白封闭反应,利用封闭溶液中的bsa(牛血清蛋白)分子与固定在固相基板的特异抗体/抗原结合,消除以后反应的非特异性吸附。
53.然后,通过特异性配体反应,蛋白靶分子连接中介配体。中介配体的作用是催化液相-固相原位发光反应,例如辣根过氧化物酶(horseradish peroxidase,hrp)。加入中介配体反应液,将催化液相-固相原位发光反应的中介配体与待测蛋白靶分子连接。加入清洗液,洗脱基板表面非特性吸附的生物、化学物质(辣根过氧化物酶);有必要的话,多次加入清洗液清洗。每次清洗后,将清洗液去除。
54.(三)液相-固相原位发光反应
55.在此步骤,在固相基板上滴加液相-固相原位发光反应液。该反应生成的反光分子
沉积到固相基板蛋白靶分子附近区域;固相基板表面事先沉积/修饰与发光反应分子结合的功能基团,使得反应生成的发光分子共价连接到平固相基板表面。例如,固相基板表面事先修饰甲苯基团或者带有苯基团的bsa分子。经过hrp催化反应生成的发光分子与甲苯/苯基团连接。反应结束后,加入清洗液,洗脱液相-固相原位发光反应液,固相基板仅留下反应的发光分子。每个待测蛋白靶分子周边形成的固相发光分子区域在几个平方微米~几百平方微米。
56.(四)成像检测、虚拟分割、数字化分析
57.在此步骤,固相基板在常规荧光显微镜下成像,获得高清数字图片。之后,采用“虚拟分割”算法,实现数字化检测,检测灵敏度最高可以达到单分子级别。
[0058]“虚拟分割”计算方法分为几个部分:
[0059]
(1)设定单位“虚拟单元”的区域大小
[0060]
高清数字图片由像素点构成,每个待测蛋白靶分子周边形成的固相发光分子区域在几个微米~几百微米,通过算法,将高清图片均匀分割为多个均匀“虚拟反应单元”,每个“虚拟反应区域”包括每个待测蛋白靶分子周边形成的发光分子区域。一旦固定,“虚拟反应单元”的数目确定。虚拟单元的像素面积,需要根据每个待测蛋白靶分子周边形成的发光分子区域。每个待测蛋白靶分子周边形成的发光分子区域面积小于虚拟单元的面积。例如,每个待测蛋白靶分子周边形成的发光分子区域面积100平方微米,虚拟单元的面积大于100平方微米。划分后,单个待测蛋白靶分子周边形成的发光分子区域不能处于两个反应单元内。
[0061]
例如,每个待测蛋白靶分子周边形成的发光分子区域面积100平方微米,虚拟单元的面积大于100平方微米。划分后,会出现两种情形:
[0062]
a.如果两个待测蛋白靶分子周边形成的发光分子区域没有交集,“虚拟反应单元”划分时,每个待测蛋白靶分子周边形成的发光分子区域处于各自反应单元内。
[0063]
b.如果两个待测蛋白靶分子周边形成的荧光发光区域有交集,就需要扩大反应单元分割面积,使得一个反应单元内可能容纳两个以上的发光分子区域。
[0064]
这两种情形,都可以通过泊松分布进行数字化分析。
[0065]
例如,一张图片的像素是1920x1280。通过实验,每个待测蛋白靶分子周边形成的发光分子区域最大面积100平方微米。此时,对应的单个待测蛋白靶分子周边发光分子区域最大像素为4x4,因此单个“虚拟反应单元”的像素数目是16。“虚拟反应单元”的总数n0为15.36万。
[0066]
(2)确定阳性信号阈值
[0067]
对每个“虚拟反应单元”检测到的发光信号设定一个阈值,高于阈值时发光信号的反应单元判读为1(“阳性”),低于阈值时发光信号的反应单元判读为0(“阴性”)。
[0068]
(3)数字化分析
–
泊松分析
[0069]
理论上讲,虚拟反应单元存在三种可能性:零分子、单分子或者多分子。当虚拟反应单元的数目足够大,大部分虚拟反应单元只捕获一个分子或者零分子;最终,大部分“虚拟反应单元”的内部只含有一个分子或者零分子,最终只含有一个固相发光分子区域或者零个固相发光分子区域,从而实现单分子光学信号放大。即使单个“虚拟反应单元”含有两个以上固相发光分子区域,可以通过统计阳性和阴性两种信号类型的反应单元比例和数目,并进行泊松统计学分析,最终计算出原始待测样本中的dna/蛋白靶分子数目。
[0070]
例如:经过检测,阳性单元的数目m为5000,虚拟单元的总数n0为15.36万,阳性分子的绝对数目由以下公式计算:
[0071][0072]
绝对分子数量为5083。
[0073]
应该理解到披露的本发明不仅仅限于描述的特定的方法、方案和物质,因为这些均可变化。还应理解这里所用的术语仅仅是为了描述特定的实施方式方案的目的,而不是意欲限制本发明的范围,本发明的范围仅受限于所附的权利要求。
[0074]
本领域的技术人员还将认识到,或者能够确认使用不超过常规实验,在本文中所述的本发明的具体的实施方案的许多等价物。这些等价物也包含在所附的权利要求中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。